Method Article
Optimizing Isolation and Purification of Murine Glomerular Mesangial Cells
요약
이 연구는 쥐 중간막 세포(MC)와 생체 외 세포 배양을 위한 최적화된 프로토콜을 개발했습니다. 이러한 세포는 세포 성장이나 단백질 발현을 손상시키지 않고 여러 번 배양, 동결, 재생 및 배양할 수 있습니다.
초록
중간혈관 세포(mesangial cell, MC)는 사구체의 중간 공간에 위치한 기질 세포로, 사구체 항상성에서 중추적인 기능을 합니다. 사구체 MC를 분리, 정제 및 배양하는 방법은 1980년대부터 생물 의학 연구, 특히 신장학 분야에 사용하기 위해 개발 및 최적화되었습니다. 마우스는 신장 질환 연구에서 가장 많이 사용되는 실험 동물 모델입니다. 이 연구에서는 쥐 MC 분리 및 생체 외 세포 배양을 위한 최적화된 프로토콜을 개발했습니다. 이러한 세포는 세포 성장이나 단백질 발현을 손상시키지 않고 여러 번 배양, 동결, 재생 및 배양할 수 있습니다. 이 최적화된 접근 방식은 연구자의 연구 기간을 크게 단축하고 장기적인 세포 보존을 가능하게 합니다. 절차에 필요한 장비는 기본 생물 의학 실험실에서 쉽게 접근할 수 있으며 절차 단계는 간단합니다. 타겟 세포의 획득은 2-3주밖에 걸리지 않으며, 이는 기존 방법에 비해 최소 1주일 단축된 것입니다.
서문
사구체는 혈액을 걸러내 소변을 형성하는 필수 작업을 수행하는 모세혈관 네트워크입니다1. 중간혈관 세포(mesangial cell, MC)는 사구체 모세혈관 사이에 위치한 중간막 기질(mesangial matrix) 내에 내장되어 있으며, 다양한 기능을 통해 사구체 역학에 영향을 미칠 수 있는 고유한 위치에 있습니다2. MC는 사구체 발달, 사구체 모세혈관에 대한 구조적 지원, 식세포작용, 사구체 기저막 매트릭스3의 생산을 포함하여 사구체에서 중요한 역할을 합니다. 중간막 세포에 대한 연구는 신장 생리학 및 병리학에 대한 이해를 진전시키는 데 중추적인 역할을 합니다.
병리학적 상태에 대한 중간막 세포의 관여도 주목할 만합니다. 당뇨병성 신병증(diabetic nephropathy) 또는 사구체 신염(glomerulonephritis)과 같은 사구체 손상 또는 질병에 대한 반응으로 중간혈관 세포는 증식하고 과도한 세포외 기질 성분을 분비하여 사구체 경화증과 신장 기능 손상을 유발할 수 있습니다 4,5. 따라서 중간막 세포의 기능과 조절 메커니즘을 이해하는 것은 신장 질환에 대한 치료 전략을 개발하는 데 필수적입니다.
쥐 중간막 세포를 통해 연구자들은 IgA 신병증6, 당뇨병성 신병증7 및 국소 분절 사구체 경화증(FSGS)8,9과 같은 상태와 관련된 분자 및 세포 과정을 모델링하고 탐구할 수 있습니다. 신장 섬유증 및 염증에 대한 역할을 감안할 때, 쥐 사구체 MC는 치료 화합물의 효능을 평가하기 위한 임상 연구에서 자주 사용됩니다 9,10. 또한, 쥐 중간세포는 RhoA/ROCK 경로11 및 TGF-β(Transforming Growth Factor-beta) 경로12를 포함하여 다양한 신호 전달 경로가 신장 기능에 미치는 영향을 연구하는 데 중요한 도구입니다. 이러한 연구는 이러한 신호 분자가 신장 질환의 진행에 어떻게 기여하는지 밝히는 데 도움이 됩니다. 질병 모델링, 치료 개발 또는 신호 전달 연구 등 어떤 분야에 사용되든 쥐 MC는 신장 건강 및 질병에 대한 이해를 증진하는 데 중요한 자원으로 계속 사용되고 있습니다.
Mackay 등은 1988년 형질전환 마우스로부터 사구체 상피, 중간막 및 내피 세포의 생체 외 세포주를 획득하는 방법을 확립했습니다13. Wilson과 Stewart는 환자의 신장 조직에서 원발성 MC를 분리하고 정제하는 방법을 개발했는데, 여기에는 3차례의 체질과 배지를 사용한 광범위한 세척이 포함됩니다14. Menè와 Stoppacciaro는 또한 환자 또는 쥐의 신장 조직에서 원발성 MC를 분리하는 방법을 제안했습니다. 이 기술은 두 번의 체질, 두 번의 바늘 밀기, 콜라겐 분해 효소를 포함합니다. 4-8개의 쥐 신장에서 얻은 세포를 6웰 플레이트에 도금하지만 수율은 상대적으로 낮습니다15. 이러한 방법은 처리하기 전에 신장을 작은 조각으로 절개해야 합니다. 또한 이러한 접근 방식은 정제된 MC를 생성하는 데 약 3-4주가 걸립니다.
마우스는 신장 질환 연구에서 가장 자주 사용되는 실험 동물 모델입니다. 그러나 쥐 MC를 분리하는 체계적인 방법은 아직 부족합니다. 이 연구에서는 쥐 MC 분리 및 생체 외 세포 배양을 위한 최적화된 프로토콜을 개발했습니다. 이 방법은 실험 연구를 위해 1차 쥐 신장 MC를 사용할 때 사용할 수 있습니다. 이전 방법과 비교하여 이 방법은 소화 전에 조직을 절단하고 체질할 필요가 없습니다. 대신, 전체 마우스 신장을 세포 분쇄기를 사용하여 분쇄하고 콜라겐 분해 효소로 직접 소화합니다. 그런 다음 분해 용액을 두 번 체질하고 모든 세포를 두 번째 체에 모아 다시 현탁시킵니다. 이 방법을 사용하면 2개의 마우스 신장에서 10일 이내에 100mm 배양 접시 2-3개를 파종할 수 있는 충분한 세포를 생산할 수 있습니다. 정제된 MC는 D-발린을 함유한 특수 배지를 사용하여 배양 및 정제를 통해 이후에 얻어집니다. 이러한 세포는 세포 성장이나 단백질 발현을 손상시키지 않고 여러 번 배양, 동결, 재생 및 배양할 수 있습니다. 이러한 절차에 필요한 장비는 기본 생물 의학 실험실에서 쉽게 구할 수 있으며 전체 프로세스는 대상 세포를 얻는 데 2-3주 밖에 걸리지 않습니다. 이 방법은 효율적이고 시간을 절약할 수 있기 때문에 신장 관련 질환 또는 메커니즘을 조사하기 위해 쥐 MC와 관련된 연구에 적합합니다.
프로토콜
동물 실험은 ARRIVE 지침을 준수했으며 모든 동물 절차는 국내 법률 및 유럽위원회 지침(2010/63/EU)에 따라 수행되었습니다. 쥐는 쓰촨 대학교 West China Hospital의 동물 관리 및 사용 위원회의 요구 사항에 따라 병원체가 없는 조건에서 수용 및 유지되었습니다. 모든 실험 동물 연구는 쓰촨 대학교 중국 서부 병원의 동물 관리 및 사용 위원회의 승인을 받았습니다. 이 분석에서 8주 된 C57BL/6JGpt 수컷 마우스를 사용하여 중간혈관 세포를 분리했습니다. 이 연구에 사용된 시약 및 장비의 세부 정보는 재료 표에 나열되어 있습니다. 그림 1 은 쥐 사구체 중간막 세포를 분리 및 정제하는 절차를 보여줍니다.
1. 쥐 MC의 분리를 위한 시약의 제조
알림: 모든 시약과 장비가 멸균되었는지 확인하십시오.
- I형 콜라겐분해효소(750 U/mL): RPMI 1640에서 사용하기 직전에 분말의 무게를 측정하고 용해시킵니다.
- 중간혈관 세포 배양 배지 1: RPMI 1640을 2mM의 글루타민, 17% FBS, 항생제(100단위/mL 페니실린 및 10,000μg/mL 스트렙토마이신) 및 0.1U/mL 인슐린과 혼합합니다.
- 중간세포 배양 배지 2: RPMI 1640(D-발린)을 2mM의 글루타민, 10% FBS, 항생제(100단위/mL 페니실린 및 10,000μg/mL 스트렙토마이신), ITS-G(인슐린, 트랜스페린, 셀레늄 용액 100x) 및 0.1U/mL 인슐린과 결합합니다. 중간혈관 세포 배양 배지는 4°C에서 보관하고 준비 후 1개월 이내에 사용하십시오.
- 세포 동결 보존 배지: RPMI 1640 배지, 혈청 및 DMSO의 혼합물을 7:2:1 비율로 준비합니다.
2. 쥐 MC의 격리
- CO2 질식 후 경부 탈구를 통해 마우스를 인도적으로 희생합니다(기관에서 승인된 프로토콜에 따름). 살균을 위해 75% 알코올이 함유된 비커에 사체를 담근 다음 동물을 무균 작업 표면으로 옮깁니다.
- 가위와 핀셋을 사용하여 마우스의 신장을 무균 제거하고 페트리 접시에 넣고 EBSS(Earle's Balanced Salt Solution)로 헹군 다음 핀셋을 사용하여 결합 조직과 신장 캡슐을 조심스럽게 제거합니다.
- 신장을 수직으로 반으로 자르고 3-4mL의 콜라겐 분해 효소 I 용액을 넣고 플라스틱 세포 유봉으로 분쇄합니다.
- 페트리 접시의 모든 조직과 용액을 15mL 원심분리 튜브에 피펫팅합니다. 페트리 접시를 1-2mL의 콜라겐 분해 효소 I 용액으로 헹구어 모든 조직이 전달되었는지 확인합니다. 용액을 37°C의 셰이커에 넣고 120rpm으로 30분 동안 흔듭니다. 그런 다음 동일한 부피의 정지 용액(배양 배지 1)을 추가합니다.
- 15mL 원심분리 튜브에서 용액을 피펫으로 주입하고 100μm 세포 여과기에 통과시킨 다음 50mL 원심분리 튜브에 여과액을 수집합니다.
- 2.5단계의 유체를 40μm 셀 스트레이너에 통과시켜 40μm 셀 스트레이너의 세포만 유지합니다. 배양 배지 1로 스트레이너를 반복적으로 헹구어 스트레이너에 가능한 한 많은 세포가 모이도록 합니다. 스트레이너에서 수집된 세포를 새로운 50mL 원심분리 튜브로 옮깁니다.
- 현탁액을 600 x g 에서 5분(실온에서) 원심분리한 다음 세포 밀도에 따라 세포 배양 접시에 세포를 재현탁합니다. 일반적으로 2개의 신장에서 세포를 2개 또는 3개의 100mm 배양 접시(10mL 배양 배지 1/100mm 접시)에 재현탁합니다. 접시를 37% 공기/95% CO2의 5°C 세포 배양기에 넣습니다.
- 다음 날 현미경(40×)으로 세포 형태와 접착력을 검사합니다. 배양 배지에 부유 사멸 세포가 존재하는 경우 피펫을 사용하여 배양 접시 바닥에서 배지를 제거하고 부착된 세포를 방해하지 않도록 주의하십시오.
- 배양 접시의 안쪽 가장자리를 따라 1-2mL PBS를 추가하여 세포를 헹굽니다. 피펫을 사용하여 배양 접시 바닥에서 모든 PBS를 제거하고 마지막으로 배양 접시의 내부 가장자리를 따라 10mL 배양 배지 1을 추가합니다.
3. 쥐 MC의 정제
- 분리 1일 후, 2.8단계에서 설명한 대로 배양 배지를 부드럽게 세척하고 새로운 배양 배지 1로 교체하여 비부착 세포를 제거합니다. 위상차 현미경(40×)으로 사구체 세포를 관찰합니다.
참고: 밝은 구형은 사구체를 나타내고 주변 세포는 상피 세포의 특징인 조약돌과 같은 특징을 나타냅니다(그림 2A). - 1-3일 후에 세포 형태를 관찰합니다(그림 2B-C). 그림 2D와 같이 성상 모양과 방추 모양의 세포가 조약돌 세포 주위에 나타납니다.
- 세포가 80% 합류점에 도달하면(보통 7-10일 이내) 멸균 PBS로 세포를 두 번 세척한 다음 0.25% 트립신 용액(100mm 접시당 0.25% 트립신 용액 2mL)으로 세포를 트립신화합니다.
- 초기 세포 트립신화 과정은 약 20분이 소요될 수 있습니다. 트립신을 넣으면 접시를 37°C 인큐베이터에 넣습니다. 위상차 현미경(40×)에서 실시간으로 과정을 관찰하여 세포의 트립신화를 평가합니다.
- 대부분의 세포가 둥근 형태를 나타내고 접시 표면에서 분리될 때 동일한 부피의 배지 2를 추가하여 트립신화 과정을 종료합니다.
- 세포를 600 × g 에서 5분 동안(실온에서) 원심분리한 다음 배지 2에 다시 현탁시킵니다. 일반적으로 100mm 접시 1개에서 100mm 접시 2개(10mL 배양 배지 2/100mm 접시)에 세포를 재현탁합니다.
- 다음날 배양 배지 2를 변경합니다. D-valine의 배지에서 MC만이 생존하고 증식할 수 있으므로 현미경으로 수많은 부유 세포와 세포 조각을 관찰하십시오(40×16). 1-2일마다 배지를 교체하여 죽은 세포를 제거합니다. 배양액의 부착 세포는 MC입니다(그림 3A-D). 분리된 MC의 성장률을 측정합니다(그림 3E).
- 세포가 80% confluence에 도달하면 trypsinize하고 배양합니다. MC는 일반적으로 트립신화에 약 5-10분이 소요됩니다.
4. 쥐 MC의 장기 보존
참고: 일차 세포는 시간 및 여러 계대에 따라 분화하고 돌연변이를 일으킬 수 있으므로 장기 보존을 위해 세포 정제 후 MC를 동결하고 보관하십시오.
- 피펫을 사용하여 접시의 아래쪽 가장자리를 따라 상층액을 조심스럽게 제거하고 멸균 PBS로 세포를 두 번 세척한 다음 0.25% 트립신 용액(100mm 접시당 0.25% 트립신 용액 2mL)으로 트립신화합니다. 3.3-3.8단계에 설명된 대로 트립신화 단계를 따릅니다.
- 트립신화 후 동일한 부피의 매체 2를 추가하여 프로세스를 종료하고 전체 액체를 15mL 원심분리 튜브로 옮깁니다. 600 × g 에서 5분(실온에서) 세포를 원심분리하고, 상층액을 버리고, 1mL PBS에 세포를 재현탁하여 세포를 계수합니다.
- 자동 셀 카운터를 사용하여 셀 수를 계산합니다. 1mL의 재현탁 세포 용액에서 20 μL를 채취하여 전용 세포 계수 플레이트에 추가하여 총 세포 수를 측정합니다. 세포 수에 따라 세포 동결 보존 배지(세포 10개 6개당 1mL 세포 동결 보존 배지)에 재현탁합니다.
- 세포 용액을 동결 보존 튜브(2mL 동결 보존 튜브당 1mL 세포 동결 보존 매체)로 옮기고 -80°C까지 서서히 동결한 후 보존을 위해 액체 질소로 옮깁니다.
참고: 필요에 따라 증폭을 위해 세포 배양 접시에 세포를 재현탁하고 파종합니다. 세포는 완전히 특성화된 후 3계도와 8계 사이에 사용해야 한다17.
5. 쥐 MC의 식별
참고: 세포를 두 번 계대탐색한 후 다음 기술을 사용하여 쥐 MC를 식별합니다.
- 쥐 MC의 서쪽 얼룩
참고: 절차에 필요한 시약은 보충 표 1에 나와 있습니다.- 3.3-3.8 및 4.1단계와 동일한 단계에 따라 세포를 트립신화합니다.
- 세포를 채취한 후 세포를 용해하여 단백질을 추출하고 단백질 농도를 측정합니다.
- 적당량의 샘플(보통 20ng)을 취하고 로딩 버퍼를 추가한 다음 100°C에서 5분 동안 변성시킵니다.
- 10% SDS-PAGE 겔 또는 7.5% SDS-PAGE 겔로 단백질(20ng)을 분해한 다음 일정한 전압에서 셀룰로오스 멤브레인으로 옮깁니다.
- 5% 무지방 우유로 멤브레인을 막은 다음 쉐이커에서 4°C의 기본 항체와 함께 밤새 배양합니다.
- TBST(Tris Buffered Saline with Tween 20)로 3회 세척한 후 2차 항체를 실온에서 1시간 동안 배양합니다.
- 이미징 시스템으로 신호를 감지합니다.
참고: 이 연구에 사용된 1차 항체는 마우스 anti-αSMA(1:500), 토끼 anti-vimentin(1:2000), 토끼 anti-fibronectin(1:2000) 및 마우스 anti-GAPDH(1:50000)입니다. 이 연구에 사용된 2차 항체는 과산화효소 접합 염소 항토끼 IgG(H + L)(1:5000) 및 과산화효소 접합 염소 항-마우스 IgG(H + L)(1:5000)입니다.
- 쥐 MC의 면역형광 염색
참고: 시술에 필요한 시약은 보충 표 2에 나와 있습니다.- 3.3-3.8단계 및 4.1단계와 동일한 단계에 따라 세포를 트립신화합니다.
- 세포를 다시 현탁시키고 개수를 셉니다. 1 x 105 세포를 15mm 유리 바닥 세포 배양 접시(1mL 배양 배지, 15mm 유리 바닥당 2개)에 추가합니다.
- 4% 파라포름알데히드로 MC를 15분(유리 바닥 15mm당 4% 파라포름알데히드 1mL) 동안 고정한 다음 PBS로 3회 세척합니다.
- MC를 0.1% Triton X-100으로 10분 동안 처리하여 세포막을 투과시킵니다.
- PBS로 3회 더 세척한 후 3% BSA PBS 용액으로 실온에서 30분 동안 셀을 차단합니다.
- 세포를 세척하고 1차 항-마우스 αSMA 및 항-토끼 비멘틴 항체를 4°C에서 하룻밤 동안 배양합니다.
- 실온에서 빨간색 Alexa 594에 접합된 2차 당나귀 항-마우스 IgG와 녹색 FITC에 접합된 당나귀 항-토끼 IgG로 1시간 동안 배양합니다.
- 실온에서 1분 동안 핵 counterstaining에 DAPI를 사용합니다.
- 플루오로마운트 매체를 추가하고 유리 슬라이드로 덮습니다. 컨포칼 현미경을 사용하여 세포를 분석합니다.
참고: 이 연구에 사용된 1차 항체는 마우스 anti-αSMA(1:200)와 토끼 anti-vimentin(1:200)이었습니다. 이 연구에 사용된 2차 항체는 빨간색 Alexa 594에 접합된 당나귀 항-마우스 IgG(1:400), 녹색 FITC에 접합된 당나귀 항-토끼 IgG(1:400) 및 DAPI(1:1000)였습니다.
- 쥐 MC의 유세포 분석
- 3.3-3.8단계 및 4.1단계와 동일한 단계에 따라 세포를 트립신화합니다.
- 세포를 다시 현탁시키고 개수를 셉니다. 5 x 105 셀을 취하고 3mL PBS로 한 번 세척합니다.
- flow tube에 100μL의 PBS로 세포를 재현탁시킨 다음 1-2μL의 anti-mouse PDGFRB(CD140b) 항체를 추가합니다.
- 어둠 속에서 30분 동안 얼음 위에서 세포를 배양한 다음 유세포 분석으로 분석합니다.
결과
이 연구는 쥐 MC 분리 및 생체 외 세포 배양을 위한 최적화된 프로토콜을 개발했습니다. 우리가 아는 한, 생체 외에서 1차 MC를 검증하기 위한 표준 방법은 존재하지 않습니다. 이전 간행물에 따르면 MC는 αSMA, Vimentin 및 Fibronectin 3,14,15의 발현을 특징으로 합니다. MC의 발현 수준을 검출하기 위해 웨스턴 블롯 분석을 사용했습니다. 이 연구에서 분리된 MC는 αSMA, Fibronectin 및 Vimentin의 발현이 상당히 높았습니다(그림 4A). 전체 웨스턴 블롯 이미지는 보충 그림 1에 나와 있습니다.
scRNA-seq 데이터베이스 CellMarker를 기반으로 PDGFRB (CD140b) 유전자는 MCs18의 marker 유전자 역할을 합니다. cell selection 및 media 2에서 5일 동안 배양한 후, 유세포 분석으로 PDGFRB(CD140b)의 발현을 검증했습니다(그림 4F).
순도를 추가로 검증하기 위해 약 7-10일 동안 배지 2에서 세포 선택 및 배양 후 MC를 면역형광 염색으로 검증했습니다. 그림 4B-E에서 볼 수 있듯이, 배지 2에서 10일 동안 배양한 후 세포의 95% 이상이 αSMA와 비멘틴을 모두 발현했습니다. 양성 면역형광 염색 결과(그림 4B-E)는 D-발린 특이적 배지16에서 세포의 생존력과 함께 위에서 설명한 프로토콜이 마우스 사구체 MC를 성공적으로 분리했음을 나타냅니다. 이러한 데이터는 차등 접착 방법을 사용하여 얻은 MC의 고순도를 추가로 확인합니다.
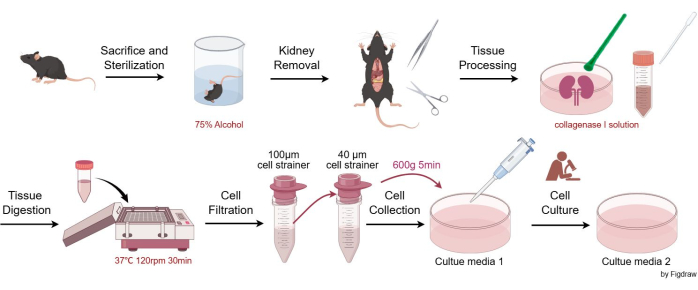
그림 1: 쥐 사구체 간막 세포를 분리 및 정제하는 절차. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 분리된 세포의 초기 배양. (A) 분리 후 1일차의 세포로, 사구체를 나타내는 밝은 구형 구조를 가지고 있습니다. (B) 분리 후 2일째의 세포로, 상피 세포의 특징인 다각형 세포를 보여줍니다. (C) 분리 후 3일째에 사구체를 둘러싼 상피와 같은 세포의 수가 증가한 세포. (D) 격리 후 6일째의 세포. 빨간색 화살표는 사구체를 가리킵니다. 각 이미지의 오른쪽 하단 모서리에 있는 빨간색 눈금 막대는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 트립신화 후 분리된 세포의 형태 및 첫 번째 계대 동안 배양 배지 2의 교체. (A) 트립신화 후 1일차의 세포로, 표면에 부착된 성상 모양의 세포를 보여줍니다. (B) 트립신화 후 4일째의 세포. (C) 트립신화 후 6일째 되는 날의 세포. (D) 트립신화 후 10일째의 세포로, 중간막 세포의 특징인 방추 모양의 다층 성장 패턴을 나타냅니다. (E) CCK-8 시약을 첨가한 후 2시간 후에 측정된 450nm에서의 흡광도로 96웰 플레이트에서 서로 다른 밀도로 시딩된 세포. 각 이미지의 오른쪽 하단 모서리에 있는 빨간색 눈금 막대는 200μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 분리된 중간막 세포의 식별.(A) GAPDH를 로딩 대조군으로 사용한 중간막 세포에서 α-SMA, Vimentin 및 Fibronectin 발현의 웨스턴 블롯 분석. (B-E) Vimentin(녹색), α-SMA(빨간색) 및 DAPI(파란색)에 대한 분리된 중간막 세포의 면역형광 염색. (F) 5일 동안 배지 2에서 배양된 중간막 세포에서 PDGFRB(CD140b) 발현의 유세포 분석 분석. 파란색 피크는 특정 염색을 나타내고 동형 대조군은 비교를 위해 표시됩니다. 각 이미지의 왼쪽 상단 모서리에 있는 빨간색 눈금 막대는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 완전한 웨스턴 블롯 이미지. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: 웨스턴 블롯 분석에 사용되는 시약. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: 면역형광 염색에 사용되는 시약. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
신장 관련 질환은 매우 흔하며, 생쥐는 인간과의 유전적 유사성과 잘 정립된 질병 모델의 가용성으로 인해 이러한 질환을 연구하기 위한 주요 동물 모델로 널리 사용됩니다. 중간막 세포는 구조적 지지를 제공하고, 사구체 여과를 조절하고, 면역 반응에 참여함으로써 사구체의 정상적인 구조와 기능을 유지하는 데 중요한 역할을 합니다. 인간, 쥐 및 닭으로부터 중간막 세포를 분리하기 위한 다양한 실험 기술이 존재하지만, 14,15,19 쥐 신장에서 이러한 세포를 분리하기 위한 표준화되고 효율적이며 재현 가능한 방법은 아직 확립되지 않았습니다. 이러한 방법이 없기 때문에 연구 진행이 제한되고 신장 질환의 마우스 모델에서 중간막 세포 기능을 조사하는 데 방해가 됩니다.
본 연구에서는 쥐 중간혈관 세포의 분리, 정제 및 생체 외 배양을 위해 시간 효율적이고 효과적인 방법을 개발했습니다. 최적화된 프로토콜은 생존 가능한 세포의 높은 수율을 보장하여 신장 연구에 유용한 도구입니다. 성공적인 세포 분리를 달성하고 높은 세포 생존율을 유지하기 위해 실험 과정에서 몇 가지 중요한 요소를 신중하게 고려해야 합니다. (1) 무균 유지: 모든 세포 채취 단계는 세포 생존력을 손상시키고 실험 결과에 영향을 미칠 수 있는 미생물 오염을 방지하기 위해 깨끗한 벤치에서 수행해야 합니다. (2) 조직 파괴: 연삭 막대를 사용하여 신장 조직을 철저히 분쇄하여 완전한 기계적 해리를 보장하고 효소 소화를 촉진해야 합니다. 부적절한 분쇄는 비효율적인 세포 방출과 낮은 세포 수율로 이어질 수 있습니다. (3) 조직 분해 최적화: 효소 분해 과정에서 조직 분해 정도를 평가하기 위해 주기적인 관찰이 필요합니다. 용액을 여러 번 부드럽게 반전시키면 효소 작용을 강화하고 세포 해리를 개선하는 동시에 세포 손상을 최소화하는 데 도움이 됩니다. (4) 세포 체질 및 수집: 선별 단계에서 세포 스트레이너를 여러 번 헹구는 것은 수집된 세포 수를 최대화하는 데 필수적입니다. 불완전한 헹굼은 세포 손실과 수율 감소를 초래하여 분리 프로세스의 전반적인 성공에 영향을 미칠 수 있습니다.
이 방법은 현재 마우스 신장에서 원발성 중간막 세포를 분리하는 데만 최적화되어 있으며 다른 동물 모델에 대한 적용 가능성은 아직 평가되지 않았습니다. 이 프로토콜을 사용하여 성공적인 분리가 이루어졌지만, 다른 종에서 사용하기 위해 이를 조정하기 위해 추가 수정이 필요할 수 있습니다. 배양된 1차 간막 세포는 7세대까지 생존 가능한 상태로 유지되었습니다. 그러나 성장률의 감소는 이후 지문에서 관찰되었습니다. 이러한 증식 능력의 감소는 세포 노화 또는 배양 환경의 변화에 기인할 수 있습니다. 따라서 최적의 기능과 실험 재현성을 보장하기 위해 1차 배양의 초기 단계에서 관련 실험에 세포를 활용하는 것이 좋습니다.
전반적으로 이 방법은 일반적으로 사용 가능한 실험실 장비 및 시약을 활용하여 1차 중간막 세포의 신속한 분리를 위한 신뢰할 수 있고 효율적이며 재현 가능한 접근 방식을 제공합니다. 이 기술은 간단하고 접근하기 쉬운 프로토콜을 제공함으로써 신장 연구를 촉진하고 질병 모델에서 중간막 세포 기능을 조사하는 연구를 지원합니다. 마우스의 일차 중간혈관 세포를 필요로 하는 연구자에게 이 방법은 다양한 실험 응용 분야를 위한 고품질 세포 배양을 확립할 수 있는 귀중한 참고 자료가 됩니다.
공개
저자는 재정적 또는 기타 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 중국 국립자연과학재단(National Natural Science Foundation of China, No. 82470196, No. 82070219, No. 81870157)과 쓰촨성 대학교 교수 창업 기금(Sichuan University Faculty Start Fund)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 µm Cell Strainer | Biosharp | BS-100-CS | |
| 100 mm Petri Dish | Sorfa | 230301 | |
| 15 mL Centrifuge Tube | Sorfa | 411000 | |
| 15 mm glass bottom cell culture dish | Sorfa | 201200 | |
| 180 kDa Plus Prestained Protein Marker | Vazyme | MP201-01 | |
| 2 mM L-glutamine | BasalMedia | S210JV | |
| 4% Paraformaldehyde | Biosharp | BL539A | |
| 40 µm Cell Strainer | Biosharp | BS-40-XBS | |
| 50 mL Centrifuge Tube | Sorfa | 41000 | |
| 60 mm Petri Dish | Sorfa | 230201 | |
| 75% Alcohol | Knowles | 64-17-5 | |
| 96 Well Cell Culture Plates, TC-treated | Servicebio | CCP-96H | |
| Antibiotics (10 μg/mL ceftriaxone plus 100 μg/mL gentamicin) | NCM | C100C5 | |
| BCA (Bicinchoninic acid) Protein Assay kit | CWBIO | CW0014S | |
| Cell Counting Kit-8 | Oriscience | CB101 | |
| Confocal Microscope | FV-3000 | Olympus | |
| DMSO | Sigma | D2650 | |
| DMSO | Sigma | D2650 | |
| Earle's Balanced Salt Solution (1x EBSS) | Beyotime | C0213 | |
| Fetal Bovine Serum (FBS) | Excell | FSP500 | |
| Fluorescence Cell Analyzer | Mira FL | Countstar | |
| Fluoromount media | Southern Biotech | 0100-01 | |
| Insulin, Transferrin, Selenium Solution 100x (ITS -G) | Gibco | 41400045 | |
| Inverted Fluorescence Microscope | Olympus | IX83 | |
| Lysis Buffer | Adilab | PP1101 | |
| One-Step PAGE Preparation Kit (10%) | Oriscience | PB102 | |
| One-Step PAGE Preparation Kit (7.5%) | Oriscience | PB101 | |
| PE anti-mouse CD140b Antibody | Biolegend | 323605 | |
| Phosphate Buffered Saline (PBS) | Servicebio | G4202 | |
| Plastic Cell Pestle | Biofil | CC-4090 | |
| Proteinase Inhibitor Cocktail | Roche | 4693159001 | |
| PVDF Membrane | Vazyme | E802-01 | |
| Recombinant Human Insulin | Solarbio | 11061-68-0 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Corning | 10-040-CV | |
| SDS-PAGE Sample Loading Buffer (5x) | Servicebio | G2013 | |
| Specially customized Roswell Park Memorial Institute (RPMI) 1640 Medium (D-valine instead of L-valine) | Procell | WH3923U222 | |
| TBS (Tris Buffered Saline) | Servicebio | G0001-2L | |
| Triton X-100 | Biosharp | BS084 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Tween 20 | Biosharp | BS100 | |
| Type I collagenase | Solarbio | CB140 |
참고문헌
- Pollak, M. R., Quaggin, S. E., Hoenig, M. P., Dworkin, L. D. The glomerulus: The sphere of influence. Clin J Am Soc Nephrol. 9 (8), 1461-1469 (2014).
- Mené, P., Simonson, M. S., Dunn, M. J. Physiology of the mesangial cell. Physiol Rev. 69 (4), 1347-1424 (1989).
- Avraham, S., Korin, B., Chung, J. J., Oxburgh, L., Shaw, A. S. The mesangial cell - the glomerular stromal cell. Nat Rev Nephrol. 17 (12), 855-864 (2021).
- Chadban, S. J., Atkins, R. C. Glomerulonephritis. Lancet. 365 (9473), 1797-1806 (2005).
- Qian, Y., Feldman, E., Pennathur, S., Kretzler, M., Brosius, F. C. From fibrosis to sclerosis: Mechanisms of glomerulosclerosis in diabetic nephropathy. Diabetes. 57 (6), 1439-1445 (2008).
- Zhu, Y., et al. Iga Gut microbiome regulates the production of hypoglycosilated iga1 via the tlr4 signaling pathway. Nephrol Dial Transplant. 39 (10), 1624-1641 (2024).
- Kong, L. -. L., et al. Advances in murine models of diabetic nephropathy. J Diabetes Res. 2013, 797548 (2013).
- Schiffer, M., et al. Inhibitory smads and tgf-beta signaling in glomerular cells. J Am Soc Nephrol. 13 (11), 2657-2666 (2002).
- Gyarmati, G., et al. Sparsentan improves glomerular hemodynamics, cell functions, and tissue repair in a mouse model of FSGS. JCI Insight. 9 (19), e177775 (2024).
- Chafin, C. B., Regna, N. L., Hammond, S. E., Reilly, C. M. Cellular and urinary microRNA alterations in NZB/W mice with hydroxychloroquine or prednisone treatment. Int Immunopharmacol. 17 (3), 894-906 (2013).
- Lucero, C. M., et al. Tnf-α plus il-1β induces opposite regulation of cx43 hemichannels and gap junctions in mesangial cells through a rhoa/rock-dependent pathway. Int J Mol Sci. 23 (17), (2022).
- Schnaper, H. W., Hayashida, T., Hubchak, S. C., Poncelet, A. C. Tgf-beta signal transduction and mesangial cell fibrogenesis. Am J Physiol Renal Physiol. 284 (2), F243-F252 (2003).
- Mackay, K., et al. Glomerular epithelial, mesangial, and endothelial cell lines from transgenic mice. Kidney Int. 33 (3), 677-684 (1988).
- Wilson, H. M., Stewart, K. N. Glomerular epithelial and mesangial cell culture and characterization. Methods Mol Med. 107, 269-282 (2005).
- Menè, P., Stoppacciaro, A. Isolation and propagation of glomerular mesangial cells. Methods Mol Biol. 466, 3-17 (2009).
- Gilbert, S. F., Migeon, B. R. D-valine as a selective agent for normal human and rodent epithelial cells in culture. Cell. 5 (1), 11-17 (1975).
- Kreisberg, J. I., Venkatachalam, M., Troyer, D. Contractile properties of cultured glomerular mesangial cells. Am J Physiol. 249 (4 Pt 2), F457-F463 (1985).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell rna-seq artifacts: A molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Sadovnic, M. J., Brand-Elnaggar, J., Bolton, W. K. Isolation and characterization of chicken mesangial cells. Nephron. 58 (1), 75-84 (1991).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유