Method Article
אופטימיזציה של בידוד וטיהור של תאים מזנגיים גלומרולרים של עכברים
In This Article
Summary
מחקר זה פיתח פרוטוקול אופטימלי לבידוד תאים מזנגיאלים של עכברים (MCs) ותרבית תאי ex vivo שלהם. ניתן להעביר תאים אלה מספר פעמים, להקפיא, להחיות ולתרבית מבלי לפגוע בצמיחת התאים או בביטוי החלבון.
Abstract
תאים מזנגיים (MCs) הם תאים סטרומליים הממוקמים בחלל האמצעי של הגלומרולוס, עם פונקציות מרכזיות בהומאוסטזיס גלומרולרי. שיטות לבידוד, טיהור וטיפוח MCs גלומרולרים פותחו ועברו אופטימיזציה מאז שנות ה-80 לשימוש במחקר ביו-רפואי, במיוחד בתחום הנפרולוגיה. עכברים הם המודלים הנפוצים ביותר של חיות ניסוי במחקר על מחלות כליות. במחקר זה, פיתחנו פרוטוקול אופטימלי לבידוד MCs של עכברים ותרבית תאים ex vivo . ניתן להעביר תאים אלה מספר פעמים, להקפיא, להחיות ולתרבית מבלי לפגוע בצמיחת התאים או בביטוי החלבון. גישה אופטימלית זו מפחיתה משמעותית את משך המחקר עבור החוקרים ומאפשרת שימור תאים לטווח ארוך. הציוד הדרוש להליכים נגיש בקלות במעבדה ביו-רפואית בסיסית, והשלבים הפרוצדורליים פשוטים. רכישת תאי מטרה דורשת 2-3 שבועות בלבד, הפחתה של שבוע לפחות בהשוואה לשיטות הקיימות.
Introduction
הגלומרולוס היא רשת של נימים המבצעת את המשימה החיונית של סינון דם ליצירת שתן1. תאים מזנגיים (MCs) משובצים בתוך המטריצה המזנגיאלית, הממוקמים בין הנימים הגלומרולריים, וממוקמים באופן ייחודי להשפיע על הדינמיקה הגלומרולרית באמצעות תפקידיהם המגוונים2. MCs ממלאים תפקידים מכריעים בגלומרולוס, כולל התפתחות גלומרולרי, תמיכה מבנית בנימים גלומרולריים, פגוציטוזיס וייצור מטריצת קרום הבסיס הגלומרולרית3. חקר תאים מזנגיאלים הוא חיוני לקידום הבנתנו את הפיזיולוגיה והפתולוגיה של הכליות.
ראויה לציון גם מעורבותם של תאים מזנגיאלים במצבים פתולוגיים. בתגובה לפגיעה או מחלה גלומרולרית, כגון נפרופתיה סוכרתית או גלומרולונפריטיס, תאים מזנגיאלים יכולים להתרבות ולהפריש רכיבי מטריצה חוץ-תאיים עודפים, מה שמוביל לגלומרולוסקלרוזיס ולפגיעה בתפקוד הכליות 4,5. הבנת הפונקציות ומנגנוני הבקרה של תאים מזנגיאלים חיונית, אם כן, לפיתוח אסטרטגיות טיפוליות למחלות כליות.
תאים מזנגיאלים של עכברים מאפשרים לחוקרים למדל ולחקור את התהליכים המולקולריים והתאיים המעורבים במצבים כגון נפרופתיה IgA6, נפרופתיה סוכרתית7 וגלומרולוסקלרוזיס מוקדית (FSGS)8,9. בהתחשב בתפקידם בפיברוזיס כלייתי ודלקת, MCs גלומרולרים של עכברים משמשים לעתים קרובות במחקרים קליניים כדי להעריך את היעילות של תרכובות טיפוליות 9,10. בנוסף, תאים מזנגיאלים של עכברים הם כלי חשוב לחקר ההשפעות של מסלולי איתות שונים על תפקוד הכליות, כולל מסלול RhoA/ROCK11 ומסלול Transforming Growth Factor-beta (TGF-β)12. מחקרים אלה עוזרים להבהיר כיצד מולקולות איתות אלו תורמות להתקדמות מחלת כליות. בין אם הם משמשים למודלים של מחלות, פיתוח טיפולי או מחקר העברת אותות, MCs של עכברים ממשיכים לשמש כמשאב מכריע לקידום ההבנה שלנו לגבי בריאות ומחלות כליות.
מקיי ועמיתיו הקימו שיטה לרכישת קווי תאים ex vivo של תאי אפיתל גלומרולרי, מזנגיל ואנדותל מעכברים טרנסגניים בשנת 198813. וילסון וסטיוארט פיתחו שיטה לבידוד וטיהור MCs ראשוניים מרקמת הכליה של המטופל, הכוללת שלושה סבבים של סינון ושטיפה נרחבת עם מדיה14. מאנה וסטופפצ'ארו הציעו גם שיטה לבידוד MCs ראשוניים מרקמת כליה של מטופל או חולדה. טכניקה זו כוללת שני סבבי סינון, שתי לחיצות מחט ועיכול קולגנאז. תאים המתקבלים מ-4-8 כליות של חולדות מצופים על צלחת של שש בארות, אם כי התשואה נמוכה יחסית15. שיטות אלו מחייבות חיתוך הכליות לחתיכות קטנות לפני העיבוד. בנוסף, לגישות אלו לוקח כ-3-4 שבועות להניב MCs מטוהרים.
עכברים הם המודלים הנפוצים ביותר של חיות ניסוי במחקר על מחלות כליות. עם זאת, עדיין חסרה שיטה שיטתית לבידוד MCs של עכברים. במחקר זה, פיתחנו פרוטוקול אופטימלי לבידוד MCs של עכברים ותרבית תאים ex vivo . ניתן להשתמש בשיטה זו בעת שימוש ב-MCs ראשוניים של כליות עכברים למחקר ניסיוני. בהשוואה לשיטות קודמות, גישה זו מבטלת את הצורך בחיתוך רקמות וסינון לפני העיכול. במקום זאת, כל כליית העכבר נטחנת באמצעות מטחנת תאים ומתעכלת ישירות עם קולגנאז. לאחר מכן מסננים את תמיסת העיכול פעמיים, כאשר כל התאים נאספים על המסננת השנייה ומושעה מחדש. שיטה זו מאפשרת לשתי כליות עכבר לייצר מספיק תאים כדי לזרוע שתיים עד שלוש מנות תרבית של 100 מ"מ תוך 10 ימים. MCs מטוהרים מתקבלים לאחר מכן באמצעות תרבית וטיהור באמצעות מדיה מיוחדת המכילה D-valine. ניתן להעביר תאים אלה מספר פעמים, להקפיא, להחיות ולתרבית מבלי לפגוע בצמיחת התאים או בביטוי החלבון. הציוד הנדרש להליכים אלה זמין בקלות למעבדות ביו-רפואיות בסיסיות, והתהליך כולו לוקח רק 2-3 שבועות כדי להשיג את תאי המטרה. שיטה זו מתאימה למחקרים הכוללים MCs של עכברים כדי לחקור מחלות או מנגנונים הקשורים לכליות, מכיוון שהיא יעילה וחוסכת זמן.
Protocol
ניסויים בבעלי חיים עמדו בהנחיות ARRIVE, וכל ההליכים בבעלי חיים נערכו בהתאם לחקיקה הלאומית ולהנחיית הנציבות האירופית (2010/63/EU). העכברים שוכנו והוחזקו בתנאים נטולי פתוגנים, בהתאם לדרישות הוועדות לטיפול ושימוש בבעלי חיים של בית החולים מערב סין, אוניברסיטת סצ'ואן. כל המחקרים הניסיוניים בבעלי חיים אושרו על ידי ועדות הטיפול והשימוש בבעלי חיים של בית החולים מערב סין, אוניברסיטת סצ'ואן. עכברים זכרים בני שמונה שבועות C57BL/6JGpt שימשו לבידוד תאים מזנגיאלים בבדיקה זו. פרטי הריאגנטים והציוד המשמשים במחקר זה מפורטים בטבלת החומרים. איור 1 ממחיש את ההליכים לבידוד וטיהור תאים מזנגיים גלומרולרים של עכברים.
1. הכנת ריאגנטים לבידוד MCs של עכברים
הערה: ודא שכל הריאגנטים והציוד סטריליים.
- קולגנאז סוג I (750 יח'/מ"ל): יש לשקול את האבקה ולהמיס זמן קצר לפני השימוש ב-RPMI 1640.
- מדיה 1 של תרבית תאים מזנגיאלית: מערבבים RPMI 1640 עם 2 מ"מ גלוטמין, 17% FBS, אנטיביוטיקה (100 יחידות/מ"ל פניצילין בתוספת 10,000 מיקרוגרם/מ"ל סטרפטומיצין) ו-0.1 U/mL אינסולין.
- מדיה של תרבית תאים מזנגיאלית 2: שלב RPMI 1640 (D-valine) עם 2 מ"מ גלוטמין, 10% FBS, אנטיביוטיקה (100 יחידות/מ"ל פניצילין בתוספת 10,000 מיקרוגרם/מ"ל סטרפטומיצין), ITS-G (אינסולין, טרנספרין, תמיסת סלניום 100x) ו-0.1 U/mL אינסולין. יש לאחסן מדיה של תרבית תאים מזנגיאלית בטמפרטורה של 4 מעלות צלזיוס ולהשתמש תוך חודש לאחר ההכנה.
- אמצעי שימור הקפאה של תאים: הכינו תערובת של מדיום RPMI 1640, סרום ו-DMSO ביחס של 7:2:1.
2. בידוד MCs עכברים
- הקרבה אנושית של עכברים באמצעות חנקCO2 ואחריו פריקת צוואר הרחם (בהתאם לפרוטוקולים שאושרו על ידי המוסד). טבלו את הפגרים בכוס המכילה 75% אלכוהול לעיקור, ואז העבירו את החיה למשטח עבודה אספטי.
- הסר באופן אספטי את כליות העכבר באמצעות מספריים ופינצטה, הנח אותן בצלחת פטרי, שטוף עם EBSS (תמיסת המלח המאוזנת של ארל), ולאחר מכן הסר בזהירות את רקמת החיבור ואת קפסולת הכליות באמצעות פינצטה.
- חוצים את הכליה אנכית, מוסיפים 3-4 מ"ל תמיסת קולגנאז I וטוחנים בעזרת עלי תאים מפלסטיק.
- פיפטה את כל הרקמות והתמיסה מצלחת הפטרי לתוך צינור צנטריפוגה של 15 מ"ל. שטפו את צלחת הפטרי עם 1-2 מ"ל תמיסת קולגנאז I כדי להבטיח שכל הרקמות מועברות. מניחים את התמיסה בשייקר בטמפרטורה של 37 מעלות צלזיוס, מנערים ב-120 סל"ד למשך 30 דקות. לאחר מכן, הוסף נפח שווה של פתרון עצירה (מדיית תרבות 1).
- פיפטו את התמיסה מצינור הצנטריפוגה של 15 מ"ל, העבירו אותה דרך מסננת תאים של 100 מיקרומטר, ואספו את המסנן בצינור צנטריפוגה של 50 מ"ל.
- העבירו את הנוזל משלב 2.5 דרך מסננת תאים של 40 מיקרומטר, תוך שמירה רק על התאים במסננת התאים של 40 מיקרומטר. שטפו את המסננת שוב ושוב עם אמצעי תרבית 1 כדי להבטיח איסוף של כמה שיותר תאים על המסננת. העבירו את התאים שנאספו מהמסננת לצינור צנטריפוגה חדש של 50 מ"ל.
- צנטריפוגה את התרחיף ב-600 x גרם למשך 5 דקות (בטמפרטורת החדר), ואז השהה מחדש את התאים בצלחת תרבית תאים בהתאם לצפיפות התאים. בדרך כלל, השעו מחדש את התאים משתי כליות בשתיים או שלוש צלחות תרבית של 100 מ"מ (צלחת תרבית 10 מ"ל 1/100 מ"מ). מניחים את הכלים באינקובטור תאים של 37 מעלות צלזיוס עם 95% אוויר/5% CO2.
- יש לבחון את המורפולוגיה וההידבקות של התא במיקרוסקופ (40×) למחרת. אם קיימים תאים מתים צפים באמצעי התרבית, השתמש בפיפטה כדי להסיר את המדיה מתחתית צלחת התרבית, והקפיד לא להפריע לתאים המחוברים.
- הוסף 1-2 מ"ל PBS לאורך הקצה הפנימי של צלחת התרבות כדי לשטוף את התאים. השתמש בפיפטה כדי להסיר את כל ה-PBS מתחתית צלחת התרבות, ולבסוף הוסף 10 מ"ל מדיית תרבית 1 לאורך הקצה הפנימי של צלחת התרבות.
3. טיהור MCs של עכברים
- יום אחד לאחר ההפרדה, הסר את התאים הלא נדבקים על ידי שטיפה עדינה והחלפת אמצעי התרבית במצע תרבית טרי 1 כמתואר בשלב 2.8. התבונן בתאי הגלומרולוס תחת מיקרוסקופ ניגודיות פאזה (40×).
הערה: הצורות הכדוריות הבהירות מייצגות את הגלומרולוס, בעוד שהתאים שמסביב מציגים מאפיינים דמויי אבן, האופייניים לתאי אפיתל (איור 2A). - התבוננו במורפולוגיה של התא אחרי 1-3 ימים (איור 2B-C). תאים בצורת כוכב וציר יופיעו סביב התאים המרוצפים, כפי שמוצג באיור 2D.
- כאשר התאים מגיעים למפגש של 80% (בדרך כלל תוך 7-10 ימים), יש לשטוף את התאים פעמיים עם PBS סטרילי, ואז לנסות את התאים בתמיסת טריפסין של 0.25% (2 מ"ל של תמיסת טריפסין של 0.25% למנה של 100 מ"מ).
- תהליך הטריפסיניזציה הראשוני של התאים עשוי להימשך כ-20 דקות. לאחר הוספת טריפסין, מניחים את המנה באינקובטור של 37 מעלות צלזיוס. התבונן בתהליך בזמן אמת תחת מיקרוסקופ ניגודיות פאזה (40×) כדי להעריך את הטריפסיניזציה של תאים.
- סיים את תהליך הטריפסיניזציה על ידי הוספת נפח שווה של מדיה 2 כאשר רוב התאים מציגים מורפולוגיה מעוגלת ומתנתקים משטח הצלחת.
- צנטריפוגה את התאים בטמפרטורה של 600 × גרם למשך 5 דקות (בטמפרטורת החדר), ואז השעו אותם מחדש במדיה 2. בדרך כלל, השעו מחדש את התאים מכלי אחד של 100 מ"מ בשתי צלחות תרבית של 100 מ"מ (צלחת תרבית של 10 מ"ל 2/100 מ"מ).
- שנה את המדיה התרבותית 2 למחרת. התבונן בתאים תלויים רבים ובשברי תאים תחת המיקרוסקופ (40×), מכיוון שרק MCs יכולים לשרוד ולהתרבות במדיה של D-valine16. החלף את המדיה כל 1-2 ימים כדי להסיר תאים מתים. התאים הדבקים בתרבית הם MCs (איור 3A-D). קבע את קצב הגדילה של MCs מבודדים (איור 3E).
- ברגע שהתאים מגיעים למפגש של 80%, יש לנסוע ולעבור אותם. MCs בדרך כלל לוקחים בערך 5-10 דקות לטריפסיניזציה.
4. שימור ארוך טווח של MCs עכברים
הערה: מכיוון שתאים ראשוניים עשויים להתמיין ולעבור מוטציות עם הזמן ומעברים מרובים, הקפיאו ואחסנו MCs לאחר טיהור התאים לשימור ארוך טווח.
- הסר בזהירות את הסופרנטנט לאורך הקצה התחתון של המנה בעזרת פיפטה, שטוף את התאים פעמיים עם PBS סטרילי, ואז נסה עם תמיסת טריפסין של 0.25% (2 מ"ל של תמיסת טריפסין של 0.25% למנה של 100 מ"מ). בצע את שלבי הטריפסיניזציה כמתואר בשלבים 3.3-3.8.
- לאחר הניסיון, הוסף נפח שווה של מדיה 2 כדי לסיים את התהליך, והעביר את הנוזל כולו לצינור צנטריפוגה של 15 מ"ל. צנטריפוגה של התאים ב-600 × גרם למשך 5 דקות (בטמפרטורת החדר), השליכו את הסופרנטנט והשעו מחדש את התאים ב-1 מ"ל PBS כדי לספור את התאים.
- השתמש במונה תאים אוטומטי כדי לספור את התאים. קח 20 מיקרוליטר מ-1 מ"ל של תמיסת תאים מושעה והוסף אותו לצלחת ספירת תאים ייעודית כדי לקבוע את מספר התאים הכולל. בהתבסס על ספירת התאים, השעו אותם מחדש באמצעי שימור הקפאה של תאים (1 מ"ל מדיה לשימור הקפאה של תאים לכל 106 תאים).
- העבירו את תמיסת התא לצינורות שימור בהקפאה (אמצעי שימור בהקפאה של תאים 1 מ"ל לכל צינור שימור בהקפאה של 2 מ"ל) ובצעו הקפאה איטית ל-80 מעלות צלזיוס לפני העברתם לחנקן נוזלי לשימור.
הערה: השעו וזרעו את התאים בכלי תרבית תאים להגברה לפי הצורך. יש להשתמש בתאים בין מעברים 3 ו-8 לאחר אפיון מלא17.
5. זיהוי MCs של עכברים
הערה: לאחר מעבר התאים פעמיים, זהה את ה-MCs של העכברים באמצעות הטכניקות הבאות.
- כתם מערבי של MCs עכברים
הערה: הריאגנטים הדרושים להליך מסופקים בטבלה משלימה 1.- נסה את התאים לפי אותם שלבים כמו ב-3.3-3.8 ובשלב 4.1.
- לאחר איסוף התאים, יש לבז את התאים כדי לחלץ חלבונים ולמדוד את ריכוז החלבון.
- קח כמות מתאימה של דגימה (בדרך כלל 20 ננוגרם), הוסף מאגר טעינה ונטורל ב-100 מעלות צלזיוס למשך 5 דקות.
- פותרים את החלבון (20 ננוגרם) עם ג'ל SDS-PAGE 10% או ג'ל SDS-PAGE 7.5%, ואז מעבירים אותו לקרום תאית במתח קבוע.
- חסמו את הממברנה עם חלב נטול שומן 5%, ולאחר מכן דגרו עם הנוגדן העיקרי בטמפרטורה של 4 מעלות צלזיוס על שייקר למשך הלילה.
- דגירה עם הנוגדן המשני בטמפרטורת החדר למשך שעה אחת לאחר שטיפה עם TBST (Tris Buffered Saline with Tween 20) שלוש פעמים.
- זיהוי אותות באמצעות מערכת ההדמיה.
הערה: הנוגדנים העיקריים ששימשו במחקר זה כללו אנטי-αSMA בעכבר (1:500), אנטי-וימנטין ארנב (1:2000), אנטי-פיברונקטין ארנב (1:2000) ואנטי-GAPDH בעכבר (1:50000). הנוגדנים המשניים ששימשו במחקר זה כללו IgG נגד ארנב מצומד פרוקסידאז (H + L) (1:5000) ו-IgG נגד עכבר עז מצומד פרוקסידאז (H + L) (1:5000).
- כתם אימונופלואורסצנטי של MCs עכברים
הערה: הריאגנטים הדרושים להליך מסופקים בטבלה משלימה 2.- נסה את התאים לפי אותם שלבים כמו בשלבים 3.3-3.8 ושלב 4.1.
- השעו מחדש את התאים וספרו אותם. קח 1 x 105 תאים והוסף אותם לצלחת תרבית תאים תחתונה מזכוכית 15 מ"מ (1 מ"ל אמצעי תרבית 2 לכל תחתית זכוכית 15 מ"מ).
- תקן את ה-MCs עם 4% פרפורמלדהיד למשך 15 דקות (1 מ"ל של 4% פרפורמלדהיד לכל תחתית זכוכית של 15 מ"מ), ולאחר מכן שטוף שלוש פעמים עם PBS.
- טפל ב-MCs עם 0.1% Triton X-100 למשך 10 דקות כדי לחלחל את קרומי התאים.
- לאחר שלוש כביסות נוספות עם PBS, חסום את התאים בטמפרטורת החדר עם תמיסת 3% BSA PBS למשך 30 דקות.
- שטפו את התאים ודגרו אותם עם נוגדנים ראשוניים נגד עכבר αSMA ונוגדני וימנטין נגד ארנב בטמפרטורה של 4 מעלות צלזיוס למשך הלילה.
- דגירה למשך שעה אחת עם IgG נגד עכבר חמור משני מצומד לאדום Alexa 594 וחמור נגד ארנב IgG מצומד ל-FITC ירוק בטמפרטורת החדר.
- השתמש ב-DAPI לצביעה גרעינית למשך דקה אחת בטמפרטורת החדר.
- הוסף מדיה פלואורו-הר וכסה בשקופית זכוכית. נתח את התאים באמצעות מיקרוסקופ קונפוקלי.
הערה: הנוגדנים העיקריים ששימשו במחקר זה כללו אנטי-αSMA של עכברים (1:200) ואנטי-וימנטין של ארנב (1:200). הנוגדנים המשניים ששימשו במחקר זה כללו IgG נגד עכבר חמור מצומד לאדום Alexa 594 (1:400), IgG נגד ארנב חמור מצומד ל-FITC ירוק (1:400) ו-DAPI (1:1000).
- ציטומטריית זרימה של MCs עכברים
- נסה את התאים לפי אותם שלבים כמו בשלבים 3.3-3.8 ושלב 4.1.
- השעו מחדש את התאים וספרו אותם. קח 5 x 105 תאים ושטוף אותם פעם אחת עם 3 מ"ל PBS.
- השעו מחדש את התאים עם 100 מיקרוליטר PBS בצינור זרימה, ולאחר מכן הוסיפו 1-2 מיקרוליטר של נוגדן PDGFRB נגד עכבר (CD140b).
- דגרו את התאים על הקרח למשך 30 דקות בחושך, ולאחר מכן נתחו על ידי ציטומטריית זרימה.
תוצאות
מחקר זה פיתח פרוטוקול אופטימלי לבידוד MCs של עכברים ותרבית תאים ex vivo. למיטב ידיעתנו, לא קיימת שיטה סטנדרטית לאימות MCs ראשוניים ex vivo. על פי פרסומים קודמים, MCs מאופיינים בביטוי של αSMA, וימנטין ופיברונקטין 3,14,15. ניתוח כתמים מערביים שימש לאיתור רמות הביטוי של MCs. ה-MCs שבודדו במחקר זה הראו ביטוי גבוה משמעותית של αSMA, פיברונקטין ווימנטין (איור 4A). התמונה המלאה של הכתם המערבי מסופקת באיור משלים 1.
בהתבסס על מסד הנתונים scRNA-seq CellMarker, הגן PDGFRB (CD140b) משמש כגן סמן של MCs18. לאחר בחירת תאים ותרבית במדיה 2 במשך 5 ימים, הביטוי של PDGFRB (CD140b) אומת על ידי זרימה ציטומטרית (איור 4F).
כדי לאמת עוד יותר את הטוהר, לאחר בחירת תאים ותרבית במדיה 2 במשך כ-7-10 ימים, ה-MCs אומתו על ידי צביעה אימונופלואורסצנטית. כפי שמוצג באיור 4B-E, לאחר 10 ימים של תרבית במדיה 2, יותר מ-95% מהתאים ביטאו גם αSMA וגם וימנטין. תוצאות הצביעה האימונופלואורסצנטיות החיוביות (איור 4B-E), יחד עם הכדאיות של התאים במדיה ספציפית ל-D-valine16, מצביעות על כך שהפרוטוקולים שתוארו לעיל בודדו בהצלחה MCs גלומרולרים של עכברים. נתונים אלה מאשרים עוד יותר את הטוהר הגבוה של ה-MCs המתקבלים בשיטת ההדבקה הדיפרנציאלית.
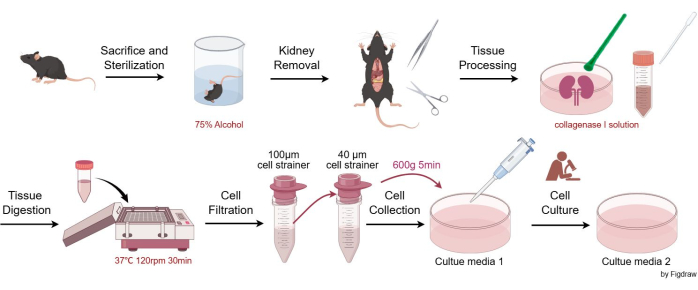
איור 1: נוהל לבידוד וטיהור תאים מזנגיים גלומרולרים של עכברים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: תרבית ראשונית של תאים מבודדים. (A) תאים ביום הראשון לאחר הבידוד, עם מבנים כדוריים בהירים המייצגים גלומרולים. (B) תאים ביום השני אחרי הבידוד, שמראים תאים מצולעים שאופייניים לתאי אפיתל. (C) תאים ביום השלישי אחרי הבידוד, עם מספר מוגבר של תאים דמויי אפיתל שמקיפים את הגלומרולוס. (D) תאים ביום ה-6 לאחר הבידוד. החצים האדומים מצביעים על הגלומרולוס. פסי קנה מידה אדומים בפינה הימנית התחתונה של כל תמונה מייצגים 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: מורפולוגיה של תאים מבודדים אחרי טריפסיניזציה והחלפת מצע תרבית 2 במהלך המעבר הראשון. (A) תאים ביום הראשון אחרי טריפסיניזציה, שמראים תאים בצורת כוכב שנדבקים לפני השטח. (B) תאים ביום הרביעי אחרי הטריפסיניזציה. (C) תאים ביום 6 אחרי הטריפסיניזציה. (D) תאים ביום ה-10 אחרי הטריפסיניזציה, שמציגים דפוס גדילה רב-שכבתי בצורת ציר שאופייני לתאים מזנגיאלים. (E) תאים שנזרעו בצפיפויות שונות בצלחות של 96 בארות, עם ספיגה ב-450 ננומטר שנמדדה שעתיים לאחר הוספת מגיב CCK-8. פסי קנה מידה אדומים בפינה הימנית התחתונה של כל תמונה מייצגים 200 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של איור זה.

איור 4: זיהוי תאים מזנגיאלים מבודדים. (A) ניתוח כתמים מערביים של ביטוי α-SMA, וימנטין ופיברונקטין בתאים מזנגיאלים, עם GAPDH כבקרת עומס. (ב-ה) צביעה אימונופלואורסצנטית של תאים מזנגיאלים מבודדים עבור וימנטין (ירוק), α-SMA (אדום) ו-DAPI (כחול). (F) ניתוח ציטומטריית זרימה של ביטוי PDGFRB (CD140b) בתאים מזנגיאלים שגודלו במדיה 2 במשך 5 ימים. השיא הכחול מייצג צביעה ספציפית, בעוד שבקרת האיזוטיפ מוצגת להשוואה. פסי קנה מידה אדומים בפינה השמאלית העליונה של כל תמונה מייצגים 100 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של איור זה.
איור משלים 1: תמונת כתם מערבית מלאה. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה 1: ריאגנטים המשמשים לניתוח כתמים מערביים. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה 2: ריאגנטים המשמשים לצביעה אימונופלואורסצנטית. אנא לחץ כאן להורדת קובץ זה.
Discussion
מחלות הקשורות לכליות נפוצות מאוד, ועכברים נמצאים בשימוש נרחב כמודל החי העיקרי לחקר מצבים אלה בשל הדמיון הגנטי שלהם לבני אדם וזמינותם של מודלים מבוססים של מחלות. תאים מזנגיים ממלאים תפקיד מכריע בשמירה על המבנה והתפקוד התקינים של הגלומרולוס על ידי מתן תמיכה מבנית, ויסות סינון גלומרולרי והשתתפות בתגובות חיסוניות. בעוד שקיימות טכניקות ניסיוניות שונות לבידוד תאים מזנגיאלים מבני אדם, חולדות ותרנגולות 14,15,19, עדיין לא הוקמה שיטה סטנדרטית, יעילה וניתנת לשחזור לבידוד תאים אלה מכליות עכברים. היעדר שיטה כזו מגביל את התקדמות המחקר ומעכב את היכולת לחקור את תפקוד התאים המזנגיאלים במודלים של עכברים של מחלת כליות.
במחקר זה פותחה שיטה יעילה ויעילה בזמן לבידוד, טיהור ותרבית ex vivo של תאים מזנגיאלים של עכברים. הפרוטוקול האופטימלי מבטיח תפוקה גבוהה של תאים ברי קיימא, מה שהופך אותו לכלי רב ערך לחקר הכליות. יש לשקול בקפידה מספר גורמים קריטיים במהלך תהליך הניסוי כדי להשיג בידוד תאים מוצלח ולשמור על כדאיות תאים גבוהה: (1) שמירה על סטריליות: כל שלבי קצירת התאים חייבים להתבצע מתחת לספסל נקי כדי למנוע זיהום מיקרוביאלי, שעלול לפגוע בכדאיות התאים ולהשפיע על תוצאות הניסוי. (2) הפרעה ברקמות: יש להשתמש במוט השחזה כדי לטחון היטב את רקמת הכליה, להבטיח דיסוציאציה מכנית מלאה ולהקל על עיכול אנזימטי. טחינה לא מספקת עלולה להוביל לשחרור תאים לא יעיל ולתפוקת תאים נמוכה יותר. (3) אופטימיזציה של עיכול רקמות: במהלך תהליך העיכול האנזימטי, יש צורך בתצפית תקופתית כדי להעריך את היקף פירוק הרקמות. היפוך עדין של התמיסה מספר פעמים עוזר לשפר את הפעולה האנזימטית ולקדם דיסוציאציה טובה יותר של התאים תוך מזעור הנזק לתאים. (4) סינון ואיסוף תאים: בשלב הסינון, שטיפת מסננת התאים מספר פעמים חיונית כדי למקסם את מספר התאים שנאספו. שטיפה לא מלאה עלולה לגרום לאובדן תאים ולהפחתת התפוקה, מה שמשפיע על ההצלחה הכוללת של תהליך הבידוד.
שיטה זו מותאמת כיום אך ורק לבידוד של תאים מזנגיאלים ראשוניים מכליות עכברים, ועדיין לא הוערכה ישימותה על מודלים אחרים של בעלי חיים. בעוד שבידוד מוצלח הושג באמצעות פרוטוקול זה, ייתכן שיידרשו שינויים נוספים כדי להתאים אותו לשימוש במינים שונים. התאים המזנגיאלים הראשוניים המתורבתים נותרו ברי קיימא עד הדור השביעי; עם זאת, ירידה בקצב הגדילה נצפתה בקטעים מאוחרים יותר. ניתן לייחס ירידה זו ביכולת ההתפשטות להזדקנות תאית או לשינויים בסביבת התרבית. לכן, מומלץ להשתמש בתאים לניסויים רלוונטיים בשלבים המוקדמים של התרבית הראשונית כדי להבטיח פונקציונליות אופטימלית ושחזור ניסוי.
בסך הכל, שיטה זו מספקת גישה אמינה, יעילה וניתנת לשחזור לבידוד מהיר של תאים מזנגיאלים ראשוניים, תוך שימוש בציוד מעבדה וריאגנטים זמינים. על ידי הצעת פרוטוקול פשוט ונגיש, טכניקה זו מקלה על מחקר הכליות ותומכת במחקרים החוקרים את תפקוד התאים המזנגיאלים במודלים של מחלות. עבור חוקרים הזקוקים לתאים מזנגיאלים ראשוניים מעכברים, שיטה זו משמשת כהתייחסות רבת ערך, המאפשרת הקמת תרביות תאים באיכות גבוהה ליישומים ניסיוניים שונים.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים, כספיים או אחרים.
Acknowledgements
עבודה זו נתמכה על ידי מענקים ל-Y.Z. מהקרן הלאומית למדעי הטבע של סין (מס' 82470196, מס' 82070219 ומס' 81870157), וקרן ההתחלה של הפקולטה של אוניברסיטת סצ'ואן.
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm Cell Strainer | Biosharp | BS-100-CS | |
| 100 mm Petri Dish | Sorfa | 230301 | |
| 15 mL Centrifuge Tube | Sorfa | 411000 | |
| 15 mm glass bottom cell culture dish | Sorfa | 201200 | |
| 180 kDa Plus Prestained Protein Marker | Vazyme | MP201-01 | |
| 2 mM L-glutamine | BasalMedia | S210JV | |
| 4% Paraformaldehyde | Biosharp | BL539A | |
| 40 µm Cell Strainer | Biosharp | BS-40-XBS | |
| 50 mL Centrifuge Tube | Sorfa | 41000 | |
| 60 mm Petri Dish | Sorfa | 230201 | |
| 75% Alcohol | Knowles | 64-17-5 | |
| 96 Well Cell Culture Plates, TC-treated | Servicebio | CCP-96H | |
| Antibiotics (10 μg/mL ceftriaxone plus 100 μg/mL gentamicin) | NCM | C100C5 | |
| BCA (Bicinchoninic acid) Protein Assay kit | CWBIO | CW0014S | |
| Cell Counting Kit-8 | Oriscience | CB101 | |
| Confocal Microscope | FV-3000 | Olympus | |
| DMSO | Sigma | D2650 | |
| DMSO | Sigma | D2650 | |
| Earle's Balanced Salt Solution (1x EBSS) | Beyotime | C0213 | |
| Fetal Bovine Serum (FBS) | Excell | FSP500 | |
| Fluorescence Cell Analyzer | Mira FL | Countstar | |
| Fluoromount media | Southern Biotech | 0100-01 | |
| Insulin, Transferrin, Selenium Solution 100x (ITS -G) | Gibco | 41400045 | |
| Inverted Fluorescence Microscope | Olympus | IX83 | |
| Lysis Buffer | Adilab | PP1101 | |
| One-Step PAGE Preparation Kit (10%) | Oriscience | PB102 | |
| One-Step PAGE Preparation Kit (7.5%) | Oriscience | PB101 | |
| PE anti-mouse CD140b Antibody | Biolegend | 323605 | |
| Phosphate Buffered Saline (PBS) | Servicebio | G4202 | |
| Plastic Cell Pestle | Biofil | CC-4090 | |
| Proteinase Inhibitor Cocktail | Roche | 4693159001 | |
| PVDF Membrane | Vazyme | E802-01 | |
| Recombinant Human Insulin | Solarbio | 11061-68-0 | |
| Roswell Park Memorial Institute (RPMI) 1640 Medium | Corning | 10-040-CV | |
| SDS-PAGE Sample Loading Buffer (5x) | Servicebio | G2013 | |
| Specially customized Roswell Park Memorial Institute (RPMI) 1640 Medium (D-valine instead of L-valine) | Procell | WH3923U222 | |
| TBS (Tris Buffered Saline) | Servicebio | G0001-2L | |
| Triton X-100 | Biosharp | BS084 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Tween 20 | Biosharp | BS100 | |
| Type I collagenase | Solarbio | CB140 |
References
- Pollak, M. R., Quaggin, S. E., Hoenig, M. P., Dworkin, L. D. The glomerulus: The sphere of influence. Clin J Am Soc Nephrol. 9 (8), 1461-1469 (2014).
- Mené, P., Simonson, M. S., Dunn, M. J. Physiology of the mesangial cell. Physiol Rev. 69 (4), 1347-1424 (1989).
- Avraham, S., Korin, B., Chung, J. J., Oxburgh, L., Shaw, A. S. The mesangial cell - the glomerular stromal cell. Nat Rev Nephrol. 17 (12), 855-864 (2021).
- Chadban, S. J., Atkins, R. C. Glomerulonephritis. Lancet. 365 (9473), 1797-1806 (2005).
- Qian, Y., Feldman, E., Pennathur, S., Kretzler, M., Brosius, F. C. From fibrosis to sclerosis: Mechanisms of glomerulosclerosis in diabetic nephropathy. Diabetes. 57 (6), 1439-1445 (2008).
- Zhu, Y., et al. Iga Gut microbiome regulates the production of hypoglycosilated iga1 via the tlr4 signaling pathway. Nephrol Dial Transplant. 39 (10), 1624-1641 (2024).
- Kong, L. -. L., et al. Advances in murine models of diabetic nephropathy. J Diabetes Res. 2013, 797548 (2013).
- Schiffer, M., et al. Inhibitory smads and tgf-beta signaling in glomerular cells. J Am Soc Nephrol. 13 (11), 2657-2666 (2002).
- Gyarmati, G., et al. Sparsentan improves glomerular hemodynamics, cell functions, and tissue repair in a mouse model of FSGS. JCI Insight. 9 (19), e177775 (2024).
- Chafin, C. B., Regna, N. L., Hammond, S. E., Reilly, C. M. Cellular and urinary microRNA alterations in NZB/W mice with hydroxychloroquine or prednisone treatment. Int Immunopharmacol. 17 (3), 894-906 (2013).
- Lucero, C. M., et al. Tnf-α plus il-1β induces opposite regulation of cx43 hemichannels and gap junctions in mesangial cells through a rhoa/rock-dependent pathway. Int J Mol Sci. 23 (17), (2022).
- Schnaper, H. W., Hayashida, T., Hubchak, S. C., Poncelet, A. C. Tgf-beta signal transduction and mesangial cell fibrogenesis. Am J Physiol Renal Physiol. 284 (2), F243-F252 (2003).
- Mackay, K., et al. Glomerular epithelial, mesangial, and endothelial cell lines from transgenic mice. Kidney Int. 33 (3), 677-684 (1988).
- Wilson, H. M., Stewart, K. N. Glomerular epithelial and mesangial cell culture and characterization. Methods Mol Med. 107, 269-282 (2005).
- Menè, P., Stoppacciaro, A. Isolation and propagation of glomerular mesangial cells. Methods Mol Biol. 466, 3-17 (2009).
- Gilbert, S. F., Migeon, B. R. D-valine as a selective agent for normal human and rodent epithelial cells in culture. Cell. 5 (1), 11-17 (1975).
- Kreisberg, J. I., Venkatachalam, M., Troyer, D. Contractile properties of cultured glomerular mesangial cells. Am J Physiol. 249 (4 Pt 2), F457-F463 (1985).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell rna-seq artifacts: A molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Sadovnic, M. J., Brand-Elnaggar, J., Bolton, W. K. Isolation and characterization of chicken mesangial cells. Nephron. 58 (1), 75-84 (1991).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved