Method Article
쥐를 위한 직접 미주신경 주사 프로토콜
요약
우리는 쥐에서 직접 미주신경 주사를 위한 프로토콜을 제시하여 주사 후 합병증 없이 신경으로 직접 약물을 전달할 수 있도록 합니다. 이 방법은 자율신경계 조작과 관련된 전임상 신경학적 연구에 적용됩니다. 필요한 수정을 통해 쥐 및 다른 종의 다른 신경에 대한 직접 신경 주입에 사용할 수 있습니다.
초록
중추신경계로의 약물 전달을 촉진하기 위한 전략과 방법론은 상대적으로 풍부합니다. 그러나 말초신경계에 약물이 직접 전달되는 경우는 그리 흔하지 않으며, 연구자를 돕기 위해 이용할 수 있는 자세한 방법 간행물도 적습니다. 여기에서는 미주신경을 모델 신경으로 사용하여 말초신경계의 약물 전달을 위한 직접 신경 주입 방법을 설명합니다. 이 방법은 좌측 미주신경을 표적으로 하여 자율신경계 장애를 치료하는 데 사용할 수 있지만, 이 일반적인 주입 방법은 경미한 변형으로 다른 신경을 주입하는 것으로 외삽할 수 있습니다. 이 방법은 해부 현미경으로 마취된 성인 쥐의 미세 수술과 관련된 절차와 관련된 모든 중요한 단계를 설명합니다. 추적 염료의 사용은 실시간으로 주입 충실도를 쉽게 모니터링할 수 있도록 설명됩니다. 성공 및 실패한 주입에 대한 그림이 제공됩니다. 적절하게 수행된다면, 직접적인 미주신경 주사는 분만 후 합병증 없이 쥐가 잘 견딜 수 있는 안전한 방식으로 수행될 수 있습니다. 예를 들어, 외과 의사가 이 방법에 대해 교육을 받은 후 6마리의 쥐 중 6마리가 아무런 합병증 없이 성공적으로 주사되었습니다. 전임상 쥐 연구를 위한 이 직접 신경 주입 방법은 말초 신경에 제제(유전자 치료를 포함하되 이에 국한되지 않음)를 전달할 수 있습니다.
서문
올바른 약물 투여 방법의 적용은 성공적인 치료 결과를 달성하는 데 중요한 요소 중 하나입니다. 중추신경계(CNS)에 치료제를 전달하는 방법은 풍부함에도 불구하고 직접 신경 주사에 의한 말초신경계(PNS) 전달에 대한 방법은 몇 가지에 불과하다고 보고되었습니다. 쥐의 배측근신경절(dorsal root ganglia, DRG)에 주사하는 것과 같은 직접 신경 주사는 통증 메커니즘, 약물 독성, 유전자 전달 1,2,3 및 일반방법 개발1,4에 대한 이해를 돕기 위해 전임상 연구에서 시도되었습니다. 직접 신경 주사에 대한 추가 보고에는 척추 신경 주사4, 좌골 신경 주사1, 쥐5 및 생쥐6의 미주신경 주사가 포함된다. 최근에는 토끼의 시신경두에 치료제를 더 잘 분배하기 위해 하수상 주사 방법이 제안되고 있다7.
DRG는 DRG2에서 세포체의 감각 기능 때문에 아데노 관련 바이러스(AAV)와 같은 전이유전자 적재 벡터의 직접 주입에 이상적인 위치로 간주됩니다. DRG 주사의 외과적 및 비수술적 방법이 모두 기술되어 있다 1,8. 그러나 DRG 주입1의 비수술적 방법과의 결과의 일관성에 대해 논란의 여지가 있는 결론이 발견되었습니다. 부분 후판 절제술과 관련된 수술 방법은 행동 결과의 변화 없이 쥐에서 DRG 주입에 대해 100% 성공하는 것으로 제안되었으며3, 생쥐에서 부분 절골술을 포함하는 방법9. 여러 연구에서 쥐와 생쥐의 전임상 유전자 치료 연구에 사용된 약물 전달의 DRG 주입 방법을 보고합니다 1,2,10. 국소 주사를 포함하는 벡터 기반 유전자 치료 연구에는 다음과 같은 이점이 있을 수 있습니다: off-target 발현 감소, 전신 독성 감소, 더 작은 바이러스 부하 및 주입량, 면역원성 합병증 위험 감소11,12.
몸에서 가장 긴 신경인 좌골신경에 직접 주사하는 방법은 쥐의 허벅지 중간 수준에서 오른쪽 좌골 신경을 노출시키는 방식으로 시도되고 있습니다. 이 방법은 마이크로 프로세싱 제어 주입 시스템이 장착된 풀드 글라스 피펫을 사용하여 1.2μL/min1의 유속으로 총 부피의 10μL 염료를 주입했습니다. 이 실험은 DRG 수준까지 염료 분포가 부족함을 보여주었으며, 분포는 대부분 주입 부위 주변에 국한되어 있었습니다. 유사하게, 척추 신경 주사와 같은 다른 직접 신경 주사 방법은 쥐에서 적절한 주입량과 염료 분포 패턴을 평가하기 위해 염료와 함께 시도되었습니다. 2 μL는 척추 신경 주입에 최적으로 제안되는 반면, DRG 주입에 의한 염료 3 μL는 쥐의 등쪽 및 복부 신경절 모두에서 분포를 보여주었습니다1. 마우스의 DRG 주입 볼륨은 변형률 및 신체 크기 2,9에 따라 1.0 μL에서 1.5 μL까지 최적으로보고되었습니다.
직접 미주신경 주사 방법은 랫트5 및 마우스6 에서 인간 α-synuclein을 전달하는 데 있어 신경 손상 또는 세포 무결성의 역할을 평가하는 데 사용되었습니다. 같은 연구자 그룹이 수행한 이 두 연구는 경추 부위의 왼쪽 미주신경에 AAV 벡터를 직접 주입하는 간단한 방법을 설명합니다. 쥐의 경우, 이 방법은 팁 직경이 60μm인 유리 모세관을 사용하여 5μL Hamilton 주사기로 0.5μL/분의 유속으로 2μL 벡터를 주입하는 것이었습니다. 마우스에서 10μL NanoFil 주사기에 장착된 36G 무딘 강철 바늘을 사용하여 총 부피 750nL 벡터 용액을 160nL/분의 유속으로 주입했습니다6. 이 실험은 전이유전자가 쥐와 생쥐의 폰스와 중뇌에 있는 축삭돌기에서 전달되고 발현된다는 것을 보여주었습니다. 마찬가지로, 좌측 미주신경의 등쪽 운동핵은 전이유전자와 함께 긍정적인 면역반응을 보였다. 이러한 증거는 직접 미주신경 주입 방법이 세포 전달이 미주신경을 통해 축삭을 투사하는 뇌의 여러 위치로 확장되는 유전자 치료에서 신뢰할 수 있는 방법일 수 있음을 보여줍니다. 그러나 이러한 방법에는 주입 충실도를 추적하기 위해 염료를 사용하는 것이 언급되어 있지 않습니다.
여기에서는 전임상 연구에서 주로 적용할 수 있는 무독성 추적 염료를 사용하여 왼쪽 미주신경에 직접 주입하는 방법을 설명합니다. 약물 전달에 어려움을 일으킬 수 있는 잠재적인 위험과 이를 극복하는 방법에 대해 논의합니다. 이러한 상황은 납품을 실패하게 만드는 원인과 납품을 성공시키는 방법을 보여주는 그림과 함께 설명되어 있습니다.
프로토콜
다음 프로토콜은 기관 윤리 지침 및 기관 동물 관리 및 사용 위원회(IACUC)의 승인에 따라 수행됩니다.
1. 주거 준비
참고: 이 프로토콜은 최소 2개월 된 성인 쥐를 위한 것입니다. 더 작은 동물 (쥐 및 어린 쥐 포함)은 가능하지만 권장되지 않으며 훨씬 더 어려울 것입니다.
- 미주신경 수술 전 48시간 동안 촉촉한 차우 또는 기타 부드러운 음식(수의학 회복 젤)을 제공하십시오. 시술 후 동물이 먹는 데 어려움을 겪을 수 있으므로 수술 전에 동물에게 이러한 품목을 소개하여 이러한 식품의 맛에 익숙해지고 먹는 동기를 유발하도록 돕습니다.
- 쥐를 수술 최소 1주일 전과 수술 후 1주일 동안 케이지에 개별적으로 가둬둡니다. 이를 통해 혼자 있는 스트레스에 적응할 수 있고 새끼 고양이의 수술 후 상처가 긁히는 것을 방지할 수 있습니다.
2. 수술 용품 및 공간 준비
- 필요한 모든 항목의 목록을 미리 만들고 모든 항목이 수술에 사용할 수 있는지 다시 확인하십시오.
- 수술 전에 적절한 소독 방법으로 모든 품목을 소독하십시오.
- 해부 현미경 아래에 멸균 수술 공간을 설정합니다. 수술 중 쥐를 따뜻하게 유지하기 위해 현미경 아래에 가열 패드를 놓습니다.
- 모든 수술 재료를 멸균 드레이프의 수술 테이블에 놓습니다. 해부 현미경 아래에 수술을 위한 충분한 공간을 확보하십시오. 현미경의 초점이 최적이고 신경을 시각화하기 위해 수술 부위를 둘러싸고 있는지 확인하십시오.
- 주사기 펌프를 수술 단계 가까이에 놓아 튜브의 길이가 주사 부위에 도달하기에 충분하도록 합니다.
- 외과 의사의 주로 사용하는 손 쪽으로 수술 도구를 놓습니다.
3. 후보 약물과 추적 염료의 혼합물 제조
- 후보 약물이 권장 희석제에서 필요한 농도를 달성하도록 희석되어 염료와 혼합된 약물 5μL가 필요한 양의 후보 약물을 전달할 수 있도록 합니다. 직접 미주신경 방법에 의한 최대 주입량은 5μL로 권장됩니다(추적 염료 포함, 3.2단계 참조).
- 호환 가능한 염료를 후보 약물과 혼합하여 실시간으로 주입 충실도를 추적할 수 있습니다. 예를 들어, 1% Luxol Fast Blue 또는 0.002% 플루오레세인의 최종 농도는 사용할 수 있는 호환 가능한 염료입니다.
주의: 염료와 후보 약물 혼합물에서 최적의 농도로 염료를 사용하십시오. 혼합물의 염료 농도가 너무 낮으면 주입을 추적하기 위해 보이지 않을 수 있습니다. 염료의 농도가 너무 높으면 혼합물이 너무 걸쭉하고 점도가 높아 주사 바늘이 막힐 수 있습니다.
4. 후보 약물 및 염료 혼합물을 튜브에 적재
- 플런저를 제거한 상태로 100μL 유리 주사기를 27G 바늘에 연결합니다.
- 약 45cm의 멸균 폴리에틸렌 튜브의 한쪽 끝을 27G 바늘에 연결합니다.
- 3mL 플라스틱 주사기를 27G 바늘로 끼웁니다. 주사기에 약 0.5mL의 0.9% 생리식염수를 로드합니다.
- 열린 끝에서 폴리에틸렌 튜브에 0.9% 일반 식염수를 채워 튜브의 전체 길이와 유리 주사기가 넘칠 때까지 배럴 전체를 채웁니다.
알림: 기포가 튜브 내부에 갇히지 않도록 하는 것이 중요합니다. - 3mL 주사기와 바늘을 제거하고 버립니다.
- 주사기 플런저를 유리 주사기의 배럴에 삽입하고 배럴 중앙까지 약간 앞으로 밉니다.
- 유리 주사기를 주사기 펌프에 놓습니다.
- 주사기 펌프를 사용하여 플런저를 약간 뒤로 당겨 튜브 길이의 열린 끝에서 약 1.5cm의 공기 공간을 만듭니다.
- 10μL 마이크로피펫으로 최소 5μL의 염료 및 후보 약물 혼합물을 피펫으로 만들고 멸균된 파라필름 조각에 떨어뜨립니다.
- 주사기 펌프를 통해 플런저를 뒤로 당겨 후보 약물 혼합물을 튜브로 빼냅니다. 0.9% 식염수와 주입 용액 사이의 기포를 유지하되, 그렇지 않으면 주입 용액 내에 기포가 갇히지 않도록 하십시오. 튜브의 주입 혼합물 수준을 마커로 표시하십시오.
참고: 후보 약물-염료 혼합물과 튜브 내의 멸균 식염수 사이의 에어 갭은 두 용액의 혼합을 방지하는 데 중요합니다. - 35G 바늘을 튜브에 끼웁니다. 바늘이 헐거워지지 않고 움직이거나 다른 것에 닿지 않고 멸균 상태를 유지하도록 수술 단계의 깨끗한 표면에 바늘을 테이프로 고정합니다.
5. 주사 바늘의 프라이밍
- 주사기 펌프 프로그램을 0.5μL/분을 분주하도록 설정합니다.
- 주사기 펌프를 약 10-15초 동안 시작하여 주사 용액이 바늘 끝에서 나오기 시작할 때까지 시작합니다. 튜브와 주사 바늘의 접합부(또는 주사기, 튜브 또는 바늘의 길이를 따라 다른 곳)에서 누출이 없는 바늘 끝의 소량의 혼합물은 설정이 올바르다는 것을 나타냅니다.
알림: 바늘 끝에 작은 물방울이 보이지 않으면 바늘이 막혔음을 나타냅니다. 후보 약물 및 염료 혼합물의 점도가 높고, 시스템 내에 과도한 공기가 갇혀 있으며, 유리 주사기가 주사기 펌프 내에 제대로 장착되지 않아 바늘이 막힐 수 있습니다. 그림 1 을 참조하십시오.amp바늘과 튜브 사이의 접합부에서 누출의 le. 프라이밍은 바늘이 막히지 않고 신경 내부의 주입이 원활하게 통과하는지 확인하는 데 도움이 되기 때문에 매우 중요합니다.
6. 수술을 위한 쥐의 준비
- 필요한 진통제 복용량을 계산하기 위해 쥐의 체중을 구하십시오. 예를 들어, 카프로펜은 쥐에서 피하 5mg/kg의 투여 속도로 사용됩니다.
참고: Carprofen은 주입 전에 4°C에서 보관하는 것이 좋습니다. - 약 2-3분 동안 마취 유도를 위해 3%-4%의 유속을 사용하여 이소플루란 기화기로 쥐를 마취합니다. 마취 유지를 위해 이소플루란 유속을 약 1.75%-2%로 줄입니다.
- 쥐를 제모 및 현장 준비를 위한 설정이 있는 별도의 테이블로 옮깁니다. 이 테이블이 수술 공간에 가까이 있는지 확인하십시오.
- 쥐의 양쪽 눈에 인공 눈물 연고를 바르면 과도한 건조를 방지할 수 있습니다.
- 쥐가 의식을 되찾았을 때 통증을 조절하기 위해 승인된 기관 동물 프로토콜에 따라 진통제를 투여합니다.
- 이발기로 목 복부 쪽, 경추 부위를 면도합니다. 턱에서 흉골까지 양쪽 정중선에서 약 2cm 수직 거리까지 면도합니다.
- 70% 에틸 알코올과 10% 베타딘으로 해당 부위를 소독하고 알코올 면봉과 포비돈 요오드로 번갈아 가며 해당 부위를 세 번 닦습니다. 해당 영역의 중앙에서 바깥쪽으로 원형으로 닦습니다.
- 쥐를 누운 자세로 현미경으로 수술 단계로 옮깁니다. 현미경의 초점을 조정하여 경추 부위의 수술 부위를 시각화합니다.
7. 후보 약물을 좌측 미주신경에 직접 주입하는 랫드 수술 시행(그림 2, 그림 3, 그림 4)
참고: 이 방법의 경우 외과의를 돕기 위해 두 번째 사람이 필요합니다.
- 장착된 조명과 관련된 해부 현미경 아래 앙와위 자세로 가열 패드에 쥐를 놓습니다.
- 비흡수성 봉합사 조각으로 쥐의 앞쪽 위턱 이빨을 걸고 봉합사의 열린 끝을 콧방울 안쪽에 고정하여 마취 내내 쥐의 콧구멍이 항상 콧구멍 안에 있도록 합니다.
- 쥐의 머리가 오른손잡이 외과 의사의 왼쪽(또는 왼손잡이 외과 의사의 오른쪽)에 놓이도록 쥐를 배치합니다. 이 위치에서 외과 의사의 앞면은 쥐의 몸에 수직입니다. 목 아래에 살균 게이지 쿠션을 놓고 쥐의 자궁 경부 각도를 조정하여 경추 부위가 직선이 되도록 합니다. 이렇게 하면 왼쪽 미주신경을 쉽게 찾고 주사를 수행할 수 있습니다.
- 쥐의 몸 전체에 살균 드레이프를 두르고 수술 공간을 열어 둡니다.
- 엘라스토머가 있는 4개의 마그네틱 고정 장치로 4개의 견인 핀을 개별적으로 고정하고 고정 장치를 수술 단계의 네 모서리에 놓습니다.
- 절개가 이루어지는 경추 부위의 정중선에 표피적으로 국소 마취제를 주입합니다. 예를 들어, 리도카인과 부피바카인의 혼합물이 일반적으로 사용됩니다.
- 턱과 흉골 사이의 정중선에서 약 2cm 길이의 세로 피부 절개를 만들고 메스 날을 사용하여 경추 부위의 목 복부 쪽에 절개합니다(그림 3A).
- 무딘 분리 멸균 된면 팁으로 피부의 절단 가장자리를 분리하십시오.
- 견인기 팁을 사용하여 절개 부위에서 반대 방향으로 피부 가장자리를 집어넣습니다.
- 더 깊이 들어가기 위해 면 팁으로 facia를 분리하십시오. 침샘을 옆으로 밉니다.
- 면봉으로 흉골 근육을 분리하고 핀으로 옆으로 집어넣습니다. 흉유근 분리가 넓게 진행됨에 따라 기관이 흉골근으로 덮인 중간에 나타납니다(그림 3B).
알림: 기관에 압력을 가하지 않도록 주의하십시오. - 왼쪽 미주신경과 함께 달리는 공통 경동맥을 포함하는 경동맥초가 나타날 때까지 쥐의 기관 왼쪽에서 조직 분리를 진행합니다.
- 현미경으로 경동맥을 손상시키지 않도록 주의하면서 미세한 집게로 경동맥에 작은 점 구멍을 조심스럽게 만듭니다. 미세한 집게로 왼쪽 미주신경과 총경동맥을 분리합니다.
참고: 수술 부위는 해부학적으로 매우 중요합니다. 경동맥 벽은 두껍고 미끄럽고 쉽게 다치지 않지만 가는 집게의 날카로운 끝이 손상되어 출혈이 발생할 수 있습니다. 동시에 신경을 다치지 않도록 주의하십시오. - 겸자에 의해 신경이 동맥에서 분리되면 해당 구멍에서 1mL 주사기에 장착된 25G 곡선 바늘을 사용하여 주로 사용하지 않는 손으로 신경을 "걸고" 신경을 잡습니다(그림 4A).
알림: 구부러진 바늘의 끝은 신경과 동맥을 손상시키지 않도록 뭉툭하게 만들어졌습니다. 바늘 끝의 곡률 각도는 지혈제를 사용하여 약 90°로 맞춤 제작됩니다(그림 2). - 주로 사용하는 손으로 후보 약물-염료 혼합물이 적재된 바늘을 잡고 신경이 흐르는 방향과 같은 방향으로 바늘의 경사가 위를 향하도록 신경을 부드럽게 찌릅니다.
- 쉽게 찌르려면 25g 후크를 사용하여 부드럽게 당겨 신경을 똑바로 유지하십시오. 바늘을 신경에 삽입하고 바늘을 미주신경과 평행하게 유지하면서 0.5cm 이상 앞으로 전진합니다. 그런 다음 바늘이 신경 내부에 약 0.4-0.5cm 남도록 약간 뒤로 당깁니다.
참고: 바늘의 각도는 반대쪽으로 가지 않고 신경 내부를 관통할 수 있을 만큼 충분히 얕아야 합니다.
- 쉽게 찌르려면 25g 후크를 사용하여 부드럽게 당겨 신경을 똑바로 유지하십시오. 바늘을 신경에 삽입하고 바늘을 미주신경과 평행하게 유지하면서 0.5cm 이상 앞으로 전진합니다. 그런 다음 바늘이 신경 내부에 약 0.4-0.5cm 남도록 약간 뒤로 당깁니다.
- 프라이밍 시 바늘이 신경 바깥쪽으로 막히지 않는 경우가 있을 수 있지만 후보 약물-염료 혼합물이 신경 내부를 원활하게 통과하지 못하는 경우가 있습니다. 이러한 상황을 피하려면 한 번의 바늘로 신경을 찌르는 횟수를 3회 이하로 제한하십시오. 바늘이 무뎌지면 막히거나 주입 불량이 발생할 가능성이 높아집니다.
- 바늘이 완전히 신경 안에 있는지 확인하십시오. 위치를 움직이지 않게 유지하고 주사기 펌프를 켭니다.
참고: 주사 부위를 주의 깊게 확인하여 후보 약물-염료 혼합물이 신경에서 역류하지 않는지 확인하십시오. - 주사가 진행되는 동안 주입이 신경 내부에 남아 원활하게 흐르고 있는지 지속적으로 확인하십시오. 주입 튜브에 있는 표시를 사용하여 시작점에서 약물-염료 혼합물의 움직임을 모니터링합니다.
- 후보 약물-염료 혼합물이 원활하게 흐르지 않으면 바늘을 당겨 빼내고 프라이밍 단계를 반복합니다(5.2단계). 그런 다음 바늘을 신경에 다시 삽입하고 주입을 재개합니다.
- 신경은 염료의 색을 발달시키기 시작합니다(그림 4B). 0.5μL/분에서 10분 동안 주입을 계속하여 후보 약물-염료 혼합물의 5μL를 모두 주입합니다.
알림: 과도한 건조와 손상을 방지하기 위해 필요에 따라 소량의 따뜻한 0.9% 멸균 식염수로 노출된 조직을 세척하는 것이 좋습니다. - 5μL를 주입하고 주사기 펌프를 멈춘 후 주사 부위에서 모든 후보 약물-염료 혼합물이 퍼질 수 있도록 바늘을 추가로 1분 동안 제자리에 유지합니다. 바늘을 제거합니다.
- 25g의 구부러진 바늘을 제거합니다. 멸균 면 팁을 사용하여 티슈를 원래 위치로 부드럽게 옮깁니다. 견인기 팁을 제거합니다.
- 비흡수성 봉합사로 상처를 봉합합니다(흡수성 봉합사도 사용할 수 있음). 상처를 완벽하게 봉합하기 위해 필요한 경우 실밥 사이에 소량의 조직 접착제를 바르십시오.
8. 쥐의 수술 후 관리
- 상처가 봉합된 후 0.9%의 따뜻한 식염수 약 3mL를 피하로 주입합니다. 이것은 쥐가 즉시 수분을 보충하는 데 도움이 됩니다.
- 쥐가 마취에서 정상 상태로 완전히 회복될 때까지 쥐를 열원에 놓습니다. 복구 과정에서 비정상적인 것으로 관찰된 모든 것에 유의하십시오.
참고: 신경 주입 절차가 오래 걸리는 경우 회복 시간이 더 길어질 수 있습니다. - 쥐를 케이지 바닥에 축축한 차우와 함께 집 케이지로 옮깁니다. 물을 항상 사용할 수 있는지 확인하십시오. 쥐가 추위를 느끼지 않는지 확인하기 위해 약 2시간 동안 수술 후 쥐를 관찰합니다.
알림: 추위로 느껴지면 쥐를 몇 시간 동안 더 열원에 두십시오. - 수술 후 12시간, 24시간, 36시간, 48시간 및 72시간에 관찰 기록을 기록하여 쥐를 모니터링합니다. 통증을 조절하기 위해 승인된 기관 동물 프로토콜에 따라 진통제를 반복합니다. 예를 들어, 카프로펜은 24시간 간격으로 5mg/kg의 비율로 2회 피하주사로 투여됩니다. 쥐에게 통증이 48 시간 이상 남아 있으면 수의사와 상담하십시오.
- 쥐의 조건에 따라 약 3mL 0.9% 따뜻한 식염수 24시간의 피하 주사를 반복합니다.
- 상처를 계속 평가하십시오. 상처가 건조하고 치유 과정에 있는지 확인하십시오.
참고: 쥐의 비활동성과 무뎌짐으로 인한 상처의 발적, 부기 및 고통스러운 상태는 상처 염증의 징후일 수 있으며 추가 수의사 상담이 필요할 수 있습니다. 통증이 있는 쥐는 구부정한 등, 주름진 털, 충혈된 눈, 비활동 상태를 보일 것입니다. 일반적으로 케이지 구석에서 발견됩니다. - 상처가 치유되면 2주 이내에 비흡수성 봉합사를 제거하십시오.
결과
본 연구에서는 6마리의 성체 쥐(수컷 3마리, 암컷 3마리)를 사용하였다. 6마리 중 1마리의 쥐를 여러 번 주입하여 주입 부위 주위에 염료의 확산을 보여주는 주입 실패 상태를 보여주었습니다( 그림 5A). 다른 모든 쥐는 그림 4B 및 그림 5B에서 볼 수 있듯이 부드러운 주입 및 신경 염색을 보여주었습니다.
그림 1은 튜브가 있는 주사 바늘의 설정이 올바르지 않을 때 바늘과 튜브 사이에 염료가 누출되는 상황을 보여줍니다. 이 실험에 사용된 1% 염료는 너무 두껍지 않지만 밀봉 누출로 인해 주입 바늘을 통한 염료 통과에 실패했습니다. 이러한 종류의 문제는 프라임 프로세스에서 쉽게 식별할 수 있습니다(5.2단계 참조). 이 상태를 해결하려면 바늘과 튜브 사이의 연결이 올바르게 이루어졌는지 확인하십시오. 튜브에 약 3mm의 바늘이 삽입되었는지 확인하고 튜브와 바늘의 크기가 올바른지 확인하십시오. 잘못된 연결을 수정한 후, 특히 기포가 유입된 경우 프라이밍을 반복합니다(5.2단계 반복).
그림 2 는 1mL 플라스틱 주사기에 장착된 25G의 구부러진 뭉툭한 바늘 설정을 보여줍니다. 바늘 끝은 무뎌지고 바늘 홀더에 의해 약 90° 각도로 구부러집니다. 사용 전에 멸균하고 수술 시 1mL 멸균 주사기에 끼웁니다. 이 주사기가 장착된 바늘은 7.14단계에서 설명한 대로 왼쪽 미주신경을 총경동맥에서 분리하고 그림 4A와 같이 주입 시 걸고 유지하는 데 사용됩니다.
그림 3은 쥐의 복부 목 부위에 메스 날을 사용하여 피부층을 절단하는 정중선 절개 절차의 설정을 보여줍니다. 쥐를 살균 된 드레이프로 덮은 후 약 2cm 길이의 수평 절개를 하여 피부층을 절단합니다 ( 그림 3A). 피부가 절단되면 절단된 피부의 두 가장자리를 엘라스토머에 연결된 핀을 사용하여 반대쪽으로 당깁니다. 절단된 모서리를 반대쪽으로 당기면 더 깊이 들어갈 수 있는 더 넓은 공간이 만들어집니다. 피부 아래의 근막층과 흉골 유방근은 그림 3B와 같이 살균된 면 팁으로 뭉툭하게 분리되어 있습니다. 7.12단계에서 설명한 것처럼 왼쪽 미주신경이 총경동맥초 내의 기관 왼쪽에 나타나면 그림 4A와 같이 미세한 집게로 분리하고 구부립니다.
그림 4는 왼쪽 미주신경이 총경동맥에서 분리되어 주사를 위해 고정되어 있는 상황을 보여줍니다. 외과의는 주로 사용하는 손(오른손)으로 주사 바늘을 잡고 있고, 다른 손(왼손)은 1mL 주사기에 장착된 구부러진 바늘로 쥐의 왼쪽 미주신경을 잡고 있습니다(그림 4A). 좌측 미주신경은 총경동맥과 잘 분리되어 있으며 주사할 수 있을 만큼 충분히 늘어나 있습니다. 신경의 오른쪽에 있는 점선 사각형은 흉골 근육으로 덮인 기관 영역을 보여줍니다. 그림 4B는 염료의 확산 없이 성공적으로 주입된 후 파란색 염료의 색으로 착색된 좌측 미주신경을 보여줍니다. 흰색 점선 사각형은 기관의 영역입니다. 그림 4B는 주입 후 신경과 그 주변의 명확한 그림을 보여주기 위해 그림 4A보다 더 늘어난 것입니다.
그림 5는 쥐의 좌측 미주신경에 주입하는 데 실패한 경우와 실패한 주사의 예를 보여줍니다. 이 주사제는 0.5μL/분의 유속으로 5μL의 1% 염료를 신경으로 사용했습니다. 그림 5A 는 염료가 신경 내부에만 국한되지 않기 때문에 주입 실패 상태를 보여줍니다(삽입 사진 참조). 오히려, 염료가 신경 주변 전체로 퍼져 나간 것입니다. 또한 신경의 실제 주입 부위는 명확하지 않습니다. 이것은 주사가 신경 내부가 아니었고 상당한 양의 주입량이 누출되어 주변 부위로 확산되었음을 시사합니다.
바늘을 신경에 다시 삽입하거나 재배치해야 하는 조건에서도 유사한 상황을 볼 수 있습니다. 이것은 바늘이 막혀 혼합물을 통과하지 못하거나 바늘이 무뎌져 신경으로 쉽게 통과할 수 없는 경우에 필요할 수 있습니다. 그림 5A에 표시된 예에서 해당 부위에 고인 소량의 혈액은 해당 부위의 작은 혈관이 우발적으로 파열되었음을 나타냅니다. 이것은 신경 분리 중에 해당 부위의 혈관이 손상되었을 때 발생합니다.
그림 5B 는 신경에 성공적으로 주입된 것을 보여줍니다. 주사 부위가 뚜렷하고 신경이 잘 염색되어 주변 부위와 구별됩니다. 신경 바깥쪽의 작은 염료 얼룩 영역은 프라이밍 후 존재하는 바늘 끝에 소량의 염료 용액 때문입니다(삽입 사진 참조). 프라이밍은 신경을 찌르기 직전에 바늘이 막혔는지 테스트하기 위해 수행됩니다.

그림 1: 바늘과 튜브 사이의 잘못된 밀봉으로 인한 염료(화살표) 누출. 이러한 유형의 오류는 튜브가 바늘 끝에 올바르게 끼워지지 않은 경우 발생합니다. 이러한 종류의 누출을 방지하기 위해 약 3mm 이상의 바늘 끝을 튜브에 삽입하고 올바른 크기의 바늘과 튜브를 사용합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 약 90° 각도로 구부러진 25G의 무딘 바늘이 1mL 플라스틱 주사기에 장착되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
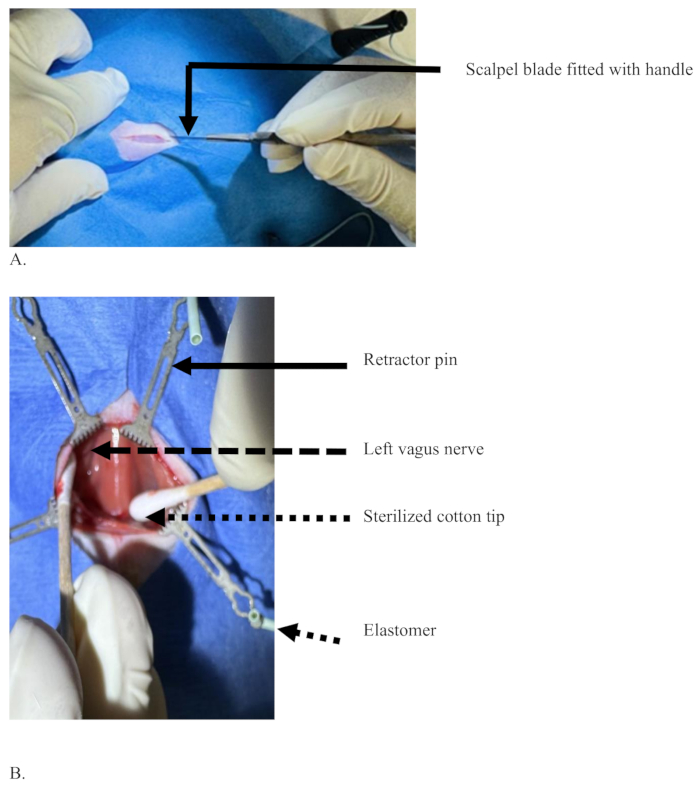
그림 3: 피부층을 절단하기 위해 쥐의 복부 목 부위에 메스 날로 정중선을 절개한 경우. (A) 피가 없는 피부만 절개한 절개부와 외과 의사의 주로 사용하는 손으로 손잡이가 달린 메스 칼날. (B) 멸균된 면 팁(점선 화살표)은 조직을 분리하여 왼쪽 미주신경(점선 화살표)을 노출시키고, 엘라스토머(짧은 점선 화살표)에 의해 지지되는 핀(실선 화살표)을 사용하여 조직을 분리하는 조직입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
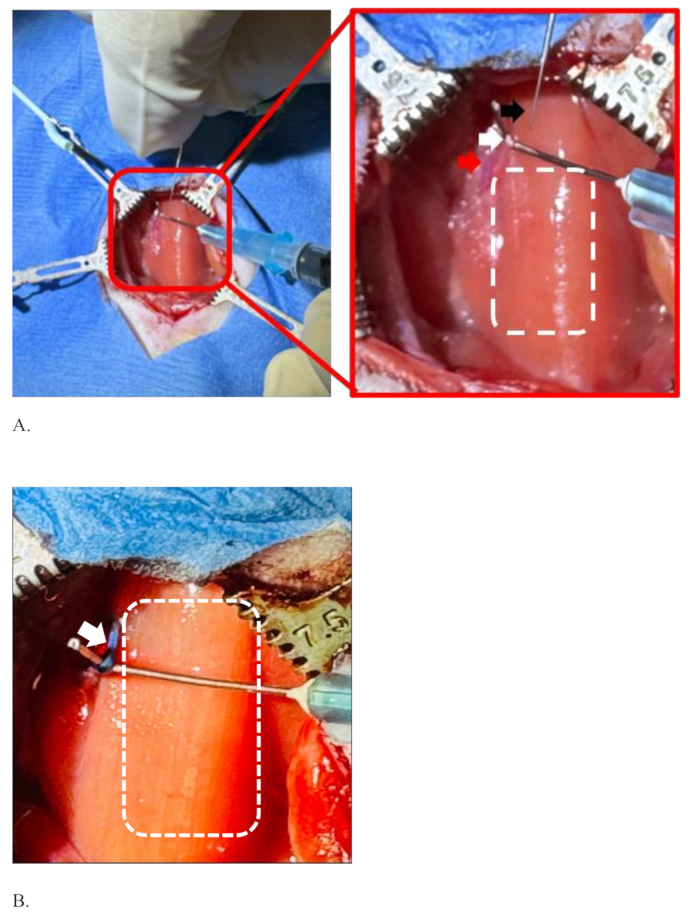
그림 4: 왼쪽 미주신경과 총경동맥을 분리하여 주사 전후에 유지하는 그림. (A) 주삿바늘(검은색 화살표), 좌측 미주신경(흰색 화살표), 총경동맥(빨간색 화살표) 및 흉골근으로 덮인 기관 영역을 보여주는 점선 직사각형. (B) 파란색의 좌측 미주신경, 염료의 확산 없이 성공적인 주입 후 염료의 색(흰색 화살표), 기관 영역(점선 직사각형). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 쥐의 좌측 미주신경에 실패한 주입 및 성공적인 주입의 예. (A,B) 1% 농도의 염료 5μL를 쥐의 좌측 미주신경에 주입했습니다. 흰색 파선 사각형은 두 패널에서 기관 영역을 보여줍니다. (A) 염료를 보여주는 고장 상태는 신경 내부에만 국한되지 않으며, 이는 시술 중 상당한 양의 염료 용액 손실을 시사합니다. 이 부위에 고인 소량의 혈액은 신경 분리 과정에서 손상된 해당 부위의 작은 혈관이 우발적으로 파열되었음을 나타냅니다. (B) 신경에 성공적으로 주입됩니다. 그것은 주위와 구별되는 단일 주입 및 잘 염색 된 신경의 명확한 지점을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
좌측 미주신경에 직접 주입하는 방법은 쥐에서 수술 후 합병증 없이 안전하게 수행할 수 있습니다. 미주신경으로의 약물 전달은 자율신경계(ANS)를 표적으로 삼는 데 사용할 수 있습니다. 여기에는 연습과 중간에서 높은 수준의 수술 기술이 필요한 특정 중요한 단계가 포함됩니다.
이 수술 절차는 쥐에서 균형 잡힌 전신 마취를 필요로 합니다. 외과 의사는 특히 늙은 쥐의 경우 더 나은 회복을 위해 마취제 노출을 제한하기 위해 더 짧은 기간 내에 수술을 끝내는 것을 목표로 합니다. 이 방법은 또한 주사 및 수술 후 회복을 성공적으로 하기 위해 일정 수준의 무균 수술 기술을 갖춘 훈련된 외과의를 가정합니다. 미주신경의 해부학적 위치는 중요한 위치에 깊숙이 자리 잡고 있습니다13. 좌측 미주신경은 좌측 총경동맥과 나란히 흐르는데, 이는 분리 및 주사 시 동맥과 신경 모두에 손상을 입힐 위험이 있습니다. 총경동맥에서 신경을 올바르게 분리하기 위해서는 높은 수준의 연습과 기술이 필요합니다. 바늘을 신경 내부에 유지하면서 시술 중에 적절한 각도로 유지해야 합니다.
같은 연구자 그룹이 쥐5 와 생쥐6 에서 직접 미주신경 시술을 시행한 사례는 단 두 건에 불과하지만, 두 연구 모두 시술을 수행하는 방법에 대한 자세한 설명이 부족합니다. 신경을 주입하기 위해 35G 바늘을 사용하는 것이 편리했으며(즉, 바늘을 준비하는 데 특별한 장비가 필요하지 않음) 다른 그룹에서 사용한 풀드 글라스 마이크로피펫을 사용한 것과 비교하여 결과가 일관되게 유지되었습니다. 좌골 신경과 같은 다른 신경에 주사하는 것과 비교했을 때, 미주신경은 상대적으로 크기가 작으며 한 번에 더 적은 양의 약물-염료 혼합물만 담을 수 있습니다. 좌골 신경에 10μL 염료 용액을 주입하는 발표된 연구에서 염료 확산은 DRG1에 도달하지 않고 주입 부위에서 신경 내 총 길이 2.3cm에 도달했습니다. 미주신경은 이 주입 프로토콜을 사용하여 최대 5μL 부피의 약물-염료 혼합물을 안전하게 흡수할 수 있습니다.
이 주입에는 해부 현미경이 필요합니다. 주입 용액에 염료를 반드시 사용해야 하는 것은 아니지만 절차 중에 주입 충실도를 실시간으로 시각화할 수 있도록 하는 것이 좋습니다. 동시에 후보 약물과 염료 혼합물에서 염료의 농도가 너무 높으면 주입 시 바늘이 막힐 수 있습니다. 단일 바늘로 주입 찌르는 횟수를 제한하는 것도 이 방법에서 중요합니다. 바늘이 무뎌지는 것을 방지하기 위해 3-5회 이상의 신경 찌르기(바늘당 쥐 3마리에 해당)에 동일한 바늘을 사용하지 않는 것이 좋습니다. 바늘(선택 사항)을 재사용하려면 70% 알코올로 세 번 닦아 동물 간에 살균해야 합니다.
직접적인 미주신경 주사를 활용한 문헌 연구의 예는 특히 설치류의 경우 극히 제한적이다 5,6. 일부 연구에서는 마우스와 쥐에게 주사하는 방법과 부피의 양에 변화를 준 직접 DRG 및 기타 신경 주사를 보고했다 1,2,9. 본 방법은 미주신경을 통해 후보 약물 또는 기타 제제를 ANS의 측면을 표적으로 삼는 접근 방식으로서 매우 중요합니다. 미주신경은 가장 긴 뇌신경이며 거의 모든 내장 기관에 신경을 공급하여 생리적 기능을 조절합니다. 따라서 이 접근 방식의 적용은 쥐를 사용한 유전자 치료를 포함하되 이에 국한되지 않는 전임상 연구에서 현재와 미래의 중요성을 갖습니다. 또한, 이 방법은 좌골 신경과 같은 다른 신경 주사로 외삽할 수 있으며, 이는 비교적 경미한 변형입니다.
요컨대, 직접 미주신경 주사 방법은 ANS 관련 쥐 모델 연구를 위한 잠재적인 약물 투여 경로입니다. 우리의 경험에 따르면 주사 후 1년 이상 유지된 동물은 장기적인 합병증이 발생하지 않았기 때문에 절차 자체는 장기적인 부작용을 일으키지 않습니다. 그러나 여기에는 몇 가지 중요한 단계가 포함되며 설치류 수술에서 관행이 필요합니다. 이러한 모든 중요한 사항은 텍스트의 이 자세한 단계별 프로토콜에 조심스럽게 포함되었습니다. 1) 총경동맥에서 미주신경을 분리하고, 2) 주사 기간 동안 미주신경 내 바늘 삽입 시 및 그 후에 신경을 안정적인 위치에 유지하고, 3) 바늘이 막히지 않고 약물-염료 혼합물을 원활하게 전달한다는 몇 가지 중요한 점에 특별한 주의를 기울입니다. 광범위한 수술 실습은 이러한 모든 수술 문제를 극복하는 가장 좋은 방법입니다.
공개
저자 NR 및 XC는 이해 상충이 없습니다. RMB와 SJG는 미주신경 주사를 통해 ANS로 유전자를 전달하는 것과 관련된 지적 재산권을 발명한 기업입니다(미국 특허 #11,753,655). SJG와 RMB는 Taysha Gene Therapies로부터 로열티 수입을 받았고, SJG는 Taysha Gene Therapies로부터 컨설팅 수입을 받았습니다.
감사의 말
쥐 수술 공간을 마련해 주신 UT Southwestern Animal Resource Center Facility에 감사드립니다. 이 연구를 위한 자금은 NIH/NINDS R01 NS087175, Hannah's Hope Fund 및 Taysha Gene Therapies를 통해 SJG에 제공되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL BD Tuberculin Syringe with Detachable 25 G x 5/8". Needle | Becton, Dickinson and Company | SKU:309626 | Used to connect with curved needle to pull the vagus nerve and hold it at the time of injection. |
| 0.5% Bupivacaine Hydrochloride Injection | Hospira | NDC 0409-1162-19 | Local anesthetics used to anesthetize local tissue. |
| 100 mL 0.9% Sodium Chloride Irrigation USP | Stericare Solutions | Item #6240 | Normal saline, used to rehydrate rat and tissue. |
| 20 Blunt, Retractor Tips, 7.5 mm | Kent Scientific Corporation | Surgi 5018 | Used to pull apart and hold tissues at the time of surgery. |
| 3 mL BD-Luer-Lok Syringe, Sterile, Single Use | Becton, Dickinson and Company | SKU # 309657 | Used to inject saline in rat and fill the saline into the Polythene tubing. |
| AK-Fluor10% | Akorn | NDC 17478-253-10 | Fluorescein dye visible within the nerve. Used to track injection fidelity. |
| Animal Weighing Scale | Kent Scientific Corporation | SCL 4000 | Used to measure body weight of rat. |
| Ansell ENCORE Perry Style 42 PF Surgical Gloves | Ansell | ASTM D3577 | Sterilie glove, it is used at the time of surgery by a surgeon. |
| Artificial Tears Ointment 3.5g | Pivetal | NDC 46066-753-55 | Used in eyses to prevent excessive dryness of eyes. |
| Baby-Myxter Hemostat | Fine Science Tools | 13013-14 | Used to stop bleeding in case of emergency. Also used to bend the 25 G x 5/8" in needle. |
| BD Intramedic PE Tubing | Becton, Dickinson and Company | 14-170-12A | Used in the injection set up system to connect with Hamilton needle and NanoFil Needles. It also holds the injection mixture. |
| BD Precison Glide Needle, 25 G x 5/8" | Becton, Dickinson and Company | REF#305122 | Used to inject saline in rat, and to make a curved needle. |
| BD Precison Glide Needle, 27 G x ½" | Becton, Dickinson and Company | REF#301629 | Used to fill sterile saline into the BD Intradermic tubing. |
| Benchmark Accuris ”NextPette” Variable Volume Pipette Micro Starter Setincludes 4 pipettes: 10/20/200/1000 μL, plus stand | MilliporeSigma | BMSP7700S1 | Used to pippette sterile solution. |
| Betadine, Povidine Iodine 10% | Honestmed | 67618015017 | Used to disinfect the surgical area. |
| Carprofen Injectable solution 50 mg/mL | Supplied by Covtrus (6451506845) | SKU 591149 | In our case, we used diluted carprofen at the dose rate of 5 mg/kg provided by the Animal Resource Center of University of Texas Southwestern Medical Center. |
| Curved needle (custom made) | Becton, Dickinson and Company | REF#305122 | BD PrecisionGlide 25 G x 5/8" in needle is curved to 90 degrees with the help of a hemostat. The tip of the needle is made blunt. It needs to be sterilized before use. It is used to hook the vagus nerve and hold it at the time of separation and injection. |
| Dissecting microscope | Motic | SMZ-171-BLED (Binocular with Lights) | Used to magnify the crifical anatomical area at the time of vagus nerve separation, injeciton, and to check injection leakage. |
| Drape sheet | Dynarex | Reorder#8122 | Used as drape after sterilization. |
| Dukal Cotton Tip Applicators, Non-Sterile | Dukal | Item 9003 | Used to blunt separation of tissue, needs to sterilize before use. |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | Used to separate the left vagus nerve from common carotid artery. It is curved so easy to use. |
| Ethicon PDS II Undyed Monofilament Suture - SUTURE, 4/0 18 PDS II CLR MONO PS | Ethicon | VA - Z682G | Used in suturing the wound. |
| Ethilon Nylon Suture Black Monofilament | Ethicon | 1856G | Used in suturing the wound if non-absorbale suture is used. Also used to hook the rat tooth to fix nose inside the nose cone. |
| Fine Forceps - Mirror Finish | Fine Science Tools | 11412-11 | Used at the time of vagus nerve separation from the common carotid artery. This is straight. |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | Ued to cut tissue. |
| Hamilton cleaning solution | Hamilton | HT18311 | Used to clean the Hamilton after use. |
| Hamilton Needle, 27G, Small Hub RN Needle, 2”, PT3, 6/PK | Hamilton | 7762-01 | Used to connect BD Intramedic™ PE Tubing. |
| Hamilton Syringe , 710RN | Hamilton | 7638-01 | Used to hold drug at the time of vagus nerve injection. |
| Insulin Syringe | EXEL INT, Comfort point | REF 26027 | Used to inject carprofen and local anesthetics. |
| Lidocaine 2% Injection | Covetrus | Reorder#002468 | Used to mix with Bupivacaine and inject at the site of incision. |
| Luxol Fast Blue MBSN | Acros Organics | 212170250 | Dye visible within the nerve, used to mix with drug so that injection mixture is visible. |
| Micro Bead Sterilizer with Glass Beads | Fine Science Tools | Item No. 18090-46 | Used to sterilize surgical tools in between the rat surgery. |
| NanoFil Needles-NF35BV-2 | World Precision Instrument | NC9708956 | Used to inject drug - dye mixture inside the vagus nerve. |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | Used in wound suturing. |
| Parafilm M Laboratory Wrapping Film, 4 Inches x 125 Feet, 1 Roll per Box, 12 Count | Honestmed | PM#996 | Used to hold the aliquoted 5 uL of drug-dye mixture so that loading of drug-dye mixture into the BDTM intradermic tubing is accurate. |
| PDI Alcohol Prep Pads | Honestmed | NDC 10819-3914-2 | Used to disinfect the surgical area. |
| Premium Care Sterile Type VII Gauze Sponges, 8-Ply, 2" x 2" | Dukal | Item C5119 | Used as cushon under the neck of rat at the time of surgery. |
| Press’n Seal Cling Film | Glad | Used to cover a rat at the time of surgery like a drape. | |
| Rat Retractor Set | Kent Scientific Corporation | Surgi 5002 | Used to keep the incision open so that it is easy to separate the vagus nerve from the carotid artery. |
| RightTemp Jr. | Kent Scientific Corporation | 20.3 cm W x 25.4 cm L (8 in W x 10 in L), used to keep rat warm. | |
| S&T Forceps - SuperGrip Tips | Fine Science Tools | 00632-11 | Used at the time of suturing to hold tissue without damage. |
| S&T Suture Tying Forceps | Fine Science Tools | 00272-13 | Used to tight the suture. |
| Scalpel blade #15 | Fine Science Tools | 10015-00 | Used to make an incision in the skin at the ventral side of neck. |
| Scalpel Handle-#7 | Fine Science Tools | 10007-12 | Used to hold the scalpel blade. |
| Syringe Pump | KD Scientific | 78-81-8052GL | Serial #D107034, Model#LEGATO-180, is a programmable pump that can pump small volume of mixture under a program. |
| TipOne Filter Tip Refill Starter Systems | USA Scientific | Item #1120-3510 | Used to pipette the drug and dye mixture. |
| Vaporizer for Isoflurane, Funnel Filled | Kent Scientific Corporation | Vetflow 1231 | Used to anesthetize rats. |
| Vetbond Tissue Adhesives | 3M Science Applied to Life | ID B00016067 | Used to seal tissue at the site of cut wound if suturing is not perfect. |
| Wahl BravMini+ Professional Cordless Clipper Kit | Kent Scientific Corporation | CL7300-Kit | Used to cut hair of rat. |
참고문헌
- Fischer, G., et al. Direct injection into the dorsal root ganglion: Technical, behavioral, and histological observations. J Neurosci Methods. 199 (1), 43-55 (2011).
- O'donnell, M., Fontaine, A., Caldwell, J., Weir, R. Direct dorsal root ganglia (drg) injection in mice for analysis of adeno-associated viral (AAV) gene transfer to peripheral somatosensory neurons. J Neurosci Methods. 411, 110268 (2024).
- Puljak, L., Kojundzic, S. L., Hogan, Q. H., Sapunar, D. Targeted delivery of pharmacological agents into rat dorsal root ganglion. J Neurosci Methods. 177 (2), 397-402 (2009).
- Rueter, L. E., Kohlhaas, K. L., Curzon, P., Surowy, C. S., Meyer, M. D. Peripheral and central sites of action for a-85380 in the spinal nerve ligation model of neuropathic pain. Pain. 103 (3), 269-276 (2003).
- Ulusoy, A., et al. Neuron-to-neuron alpha-synuclein propagation in vivo is independent of neuronal injury. Acta Neuropathol Commun. 3, 13 (2015).
- Helwig, M., et al. Brain propagation of transduced alpha-synuclein involves non-fibrillar protein species and is enhanced in alpha-synuclein null mice. Brain. 139 (Pt 3), 856-870 (2016).
- Chiang, B., et al. Development of a novel suprachoroidal-to-optic-nerve (scone) drug delivery system. Drug Deliv. 31 (1), 2379369 (2024).
- Ferrari, L. F., Cunha, F. Q., Parada, C. A., Ferreira, S. H. A novel technique to perform direct intraganglionar injections in rats. J Neurosci Methods. 159 (2), 236-243 (2007).
- Yuan, X. M., et al. Rapid injection of lumbar dorsal root ganglia under direct vision: Relevant anatomy, protocol, and behaviors. Front. Neurol. 14, 1138933 (2023).
- Mason, M. R., et al. Comparison of AAV serotypes for gene delivery to dorsal root ganglion neurons. Mol Ther. 18 (4), 715-724 (2010).
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Ertl, H. C. J. Immunogenicity and toxicity of AAV gene therapy. Front Immunol. 13, 975803 (2022).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유