Method Article
Protocole d’injection directe du nerf vague pour les rats
Dans cet article
Résumé
Nous présentons un protocole d’injection directe du nerf vague chez le rat, permettant l’administration directe du médicament dans le nerf sans complications post-injection. Cette méthode s’applique aux études neurologiques précliniques impliquant une manipulation du système nerveux autonome. Il peut être utilisé pour l’injection nerveuse directe pour d’autres nerfs chez les rats et d’autres espèces, avec les modifications nécessaires.
Résumé
Il existe une abondance relative de stratégies et de méthodologies pour faciliter l’administration de médicaments au système nerveux central. Cependant, l’administration de médicaments directement dans le système nerveux périphérique est moins courante, avec moins de publications de méthodes détaillées disponibles pour aider les chercheurs. Ici, nous décrivons une méthode d’injection nerveuse directe pour l’administration de médicaments dans le système nerveux périphérique, en utilisant le nerf vague comme nerf modèle. Cette méthode peut être utilisée dans le traitement des troubles du système nerveux autonome en ciblant le nerf vague gauche, bien que cette méthode d’injection générale puisse être extrapolée à l’injection d’autres nerfs avec une modification mineure. Cette méthode explique toutes les étapes critiques de la procédure impliquant la microchirurgie chez des rats adultes anesthésiés sous microscope disséquant. L’utilisation d’un colorant de suivi est décrite pour faciliter le suivi de la fidélité d’injection en temps réel. Des illustrations d’injections réussies et échouées sont fournies. Si elles sont effectuées correctement, les injections directes du nerf vague peuvent être effectuées de manière sûre et bien tolérée par le rat sans complications après l’accouchement. Par exemple, une fois que les chirurgiens ont été formés à cette méthode, six rats sur six ont été injectés avec succès sans aucune complication. Cette méthode d’injection nerveuse directe pour les études précliniques chez le rat est capable d’administrer des agents (y compris, mais sans s’y limiter, la thérapie génique) aux nerfs périphériques.
Introduction
L’application de la bonne méthode d’administration des médicaments est l’un des facteurs critiques pour obtenir des résultats thérapeutiques réussis. Malgré l’abondance de méthodes d’administration d’agents thérapeutiques dans le système nerveux central (SNC), seules quelques méthodes sont rapportées pour l’administration du système nerveux périphérique (SNP) par injection nerveuse directe. L’injection directe de nerfs, telle que l’injection dans les ganglions de la racine dorsale (DRG) chez le rat, a été testée dans des études précliniques pour mieux comprendre les mécanismes de la douleur, la toxicité des médicaments, le transfert de gènes 1,2,3 et le développement général de méthodes 1,4. D’autres rapports sur l’injection directe de nerfs comprennent l’injection de nerf spinal4, l’injection de nerf sciatique1 et l’injection de nerf vague chez le rat5 et la souris6. Récemment, une méthode d’injection suprachondriale a été proposée pour une meilleure distribution des traitements dans la tête du nerf optique chez le lapin7.
Le DRG est considéré comme l’endroit idéal pour l’injection directe de vecteurs chargés de transgènes tels que le virus adéno-associé (AAV) en raison de la fonction sensorielle des corps cellulaires dans le DRG2. Des méthodes chirurgicales et non chirurgicales d’injections de DRG ont été décrites 1,8. Cependant, des conclusions controversées ont été trouvées sur la cohérence des résultats avec la méthode non chirurgicale d’injection de DRG1. Une méthode chirurgicale impliquant une laminectomie partielle a été suggérée comme étant efficace à 100 % pour l’injection de DRG chez le rat sans aucune altération des résultats comportementaux3, ainsi qu’une méthode impliquant une ostéotomie partielle chez la souris9. Plusieurs études rapportent les méthodes d’injection de DRG pour l’administration de médicaments, qui ont été utilisées dans la recherche préclinique sur la thérapie génique chez les rats et les souris 1,2,10. Les études de thérapie génique à base de vecteurs impliquant des injections localisées peuvent inclure les avantages suivants : diminution de l’expression hors cible, réduction de la toxicité systémique, charges virales et volumes d’injection plus faibles, diminution du risque de complications immunogènes11,12.
La méthode d’injection directe dans le nerf sciatique, le nerf le plus long du corps, a été testée en exposant le nerf sciatique droit au niveau de la mi-cuisse d’un rat. La méthode utilisait une pipette en verre tiré équipée d’un système d’injection contrôlé par un microprocesseur pour injecter un volume total de 10 μL de colorant avec un débit de 1,2 μL/min1. Cette expérience a montré un manque de distribution du colorant au niveau du DRG, et la distribution était principalement limitée autour du site d’injection. De même, d’autres méthodes d’injections directes dans les nerfs, telles que les injections dans le nerf rachidien, ont été testées avec un colorant pour évaluer la quantité appropriée de volume d’injection et le modèle de distribution du colorant chez les rats. Il est suggéré que 2 μL sont optimaux pour l’injection du nerf rachidien, tandis que 3 μL de colorant par injection de DRG ont montré la distribution dans les ganglions de la racine dorsale et ventrale chez le rat1. Le volume d’injection de DRG chez la souris a été signalé comme étant optimal de 1,0 μL à 1,5 μL sur la base de la souche et de la taille corporelle 2,9.
La méthode d’injection directe du nerf vague a été utilisée chez le rat5 et la souris6 pour évaluer le rôle des lésions neuronales ou de l’intégrité cellulaire dans le transfert de la α-synucléine humaine. Ces deux études, menées par le même groupe de chercheurs, décrivent une brève méthode d’injection directe de vecteurs AAV dans le nerf vague gauche de la région cervicale. Chez le rat, la méthode impliquait un capillaire en verre avec un diamètre d’embout de 60 μm pour injecter un vecteur de 2 μL à un débit de 0,5 μL/min avec une seringue Hamilton de 5 μL. Chez la souris, un volume total de solution vectorielle de 750 nL a été injecté à un débit de 160 nL/min à l’aide d’une aiguille en acier émoussée de 36 G fixée sur une seringue NanoFil6 de 10 μL. Ces expériences ont montré que le transgène était délivré et exprimé dans les axones du pont et du mésencéphale des rats et des souris. De même, le noyau moteur dorsal du nerf vague gauche a montré une immunoréaction positive avec le transgène. Ces éléments de preuve illustrent que la méthode d’injection directe du nerf vague pourrait être une méthode fiable en thérapie génique où la transduction cellulaire est étendue à plusieurs endroits du cerveau, qui projettent des axones à travers le nerf vague. Cependant, ces méthodes ne mentionnent pas l’utilisation d’un colorant pour suivre la fidélité de l’injection.
Ici, une méthode est décrite pour l’injection directe dans le nerf vague gauche à l’aide de colorants de suivi non toxiques largement applicables aux chercheurs dans les études précliniques. Les pièges potentiels qui peuvent causer des difficultés dans l’administration des médicaments et les moyens de les surmonter sont discutés. Ces situations sont illustrées par des images pour montrer ce qui fait que la livraison échoue et la manière de la réussir.
Protocole
Le protocole suivant est mené conformément aux lignes directrices en matière d’éthique de l’établissement et à l’approbation du Comité institutionnel de protection et d’utilisation des animaux (IACUC).
1. Préparation du logement
REMARQUE : Ce protocole s’adresse aux rats adultes âgés d’au moins 2 mois. Des animaux plus petits (y compris les souris et les jeunes rats) sont possibles mais ne sont pas recommandés et seront beaucoup plus difficiles.
- Fournir de la nourriture humide ou tout autre aliment mou (gel de récupération vétérinaire) pendant 48 heures avant la chirurgie du nerf vague. Comme les animaux peuvent avoir de la difficulté à manger après l’intervention, présentez-les aux animaux avant la chirurgie pour les aider à se familiariser avec le goût de ces aliments et à les motiver à manger.
- Abriter les rats individuellement dans une cage au moins 1 semaine avant l’opération, ainsi que 1 semaine après l’opération. Cela leur permettra de s’acclimater au stress d’être seuls et d’éviter de gratter les plaies après une intervention chirurgicale par un compagnon de portée.
2. Préparation des articles chirurgicaux et de l’espace
- Faites une liste de tous les articles nécessaires à l’avance et vérifiez que tous les articles sont disponibles pour la chirurgie.
- Stérilisez tous les articles avec des méthodes de stérilisation appropriées avant la chirurgie.
- Installez l’espace chirurgical stérile sous le microscope de dissection. Placez un coussin chauffant sous le microscope pour garder le rat au chaud pendant l’opération.
- Placez tout le matériel chirurgical sur une table d’opération sur un champ stérile. Gardez suffisamment d’espace pour la chirurgie sous le microscope de dissection. Assurez-vous que la mise au point du microscope est optimale et qu’elle englobe la zone chirurgicale pour visualiser le nerf.
- Placez le pousse-seringue près de la phase chirurgicale de sorte que la longueur de la tubulure soit suffisante pour atteindre le site d’injection.
- Placez les outils chirurgicaux vers le côté de la main dominante du chirurgien.
3. Préparation d’un mélange du médicament candidat et du colorant de suivi
- S’assurer que le médicament candidat est dilué pour atteindre la concentration requise dans le diluant recommandé, de sorte que 5 μL du médicament mélangés à un colorant donnent la quantité requise du médicament candidat à administrer. Il est recommandé d’injecter au maximum 5 μL par la méthode du nerf vague direct (y compris le colorant de suivi, voir l’étape 3.2).
- Mélangez un colorant compatible avec le médicament candidat pour permettre le suivi de la fidélité de l’injection en temps réel. Par exemple, une concentration finale de 1 % de Luxol Fast Blue ou de 0,002 % de fluorescéine sont des colorants compatibles à utiliser.
ATTENTION : Utilisez le colorant à sa concentration optimale dans le mélange de colorant et de médicament candidat. Lorsque la concentration de colorant dans le mélange est trop faible, il peut ne pas être visible pour suivre l’injection. Lorsque la concentration de colorant est trop élevée, il peut en résulter un mélange trop épais et à forte viscosité, ce qui bloquera l’aiguille d’injection.
4. Chargement du mélange de médicament candidat et de colorant dans le tube
- Connectez une seringue en verre de 100 μL avec le piston retiré à une aiguille de 27 G.
- Connectez une extrémité d’environ 45 cm de tube en polyéthylène stérilisé à l’aiguille de 27 G.
- Prenez une seringue en plastique de 3 ml et ajustez-la avec une aiguille de 27 G. Chargez la seringue avec environ 0,5 mL de solution saline normale à 0,9 %.
- Remplissez le tube en polyéthylène avec la solution saline normale à 0,9 % à partir de l’extrémité ouverte pour remplir toute la longueur du tube et tout le corps de la seringue en verre jusqu’à ce qu’il déborde.
REMARQUE : Il est essentiel d’éviter que des bulles d’air ne se coincent à l’intérieur du tube. - Retirer et jeter la seringue de 3 ml et l’aiguille.
- Insérez le piston de la seringue dans le corps de la seringue en verre et poussez-le légèrement vers l’avant jusqu’au milieu du cylindre.
- Placez la seringue en verre dans le pousse-seringue.
- Tirez légèrement le piston vers l’arrière à l’aide de la pompe à seringue pour créer un espace d’air d’environ 1,5 cm à l’extrémité ouverte dans la longueur du tube.
- Pipeter au moins 5 μL de colorant et de mélange de médicament candidat à l’aide d’une micropipette de 10 μL et la déposer sur un morceau de parafilm stérilisé.
- Retirez le mélange de médicament candidat dans la tubulure en tirant le piston vers l’arrière via le pousse-seringue. Maintenez la bulle d’air entre la solution saline à 0,9 % et la solution d’injection, mais sinon, évitez de piéger des bulles d’air dans la solution d’injection. Marquez le niveau du mélange d’injection dans le tube à l’aide d’un marqueur.
REMARQUE : L’espace d’air entre le mélange médicament-colorant candidat et la solution saline stérile à l’intérieur de la tubulure est essentiel pour empêcher le mélange des deux solutions. - Ajustez l’aiguille de 35 G avec la tubulure. Fixez l’aiguille sur la surface propre de la scène chirurgicale avec du ruban adhésif afin que l’aiguille ne se détache pas, ne bouge pas et ne touche rien d’autre, et reste stérilisée.
5. Amorçage de l’aiguille d’injection
- Réglez le programme de pompe à seringue pour distribuer 0,5 μL/min.
- Démarrez le pousse-seringue pendant environ 10 à 15 secondes, jusqu’à ce que la solution d’injection commence à sortir de la pointe de l’aiguille. Une petite quantité du mélange à l’extrémité de l’aiguille sans fuite au niveau de l’articulation de la tubulure et de l’aiguille d’injection (ou n’importe où ailleurs sur la longueur de la seringue, du tube ou de l’aiguille) indique que la configuration est correcte.
REMARQUE : Si une minuscule gouttelette à l’extrémité de l’aiguille n’est pas visible, cela indique un blocage de l’aiguille. Le blocage de l’aiguille peut se produire en raison de la viscosité élevée du mélange de médicament et de colorant candidat, de l’excès d’air emprisonné dans le système et du fait que la seringue en verre n’est pas correctement installée dans le pousse-seringue. Voir la figure 1 pour un exemple de fuite à la jonction entre l’aiguille et le tube. L’amorçage est essentiel car il permet d’identifier si l’aiguille n’est pas obstruée et si l’injection à l’intérieur du nerf se ferait en douceur.
6. Préparation du rat à la chirurgie
- Obtenez le poids corporel du rat pour calculer la dose nécessaire d’analgésiques. Par exemple, le carprofène est utilisé à la dose de 5 mg/kg par voie sous-cutanée chez le rat.
REMARQUE : Il est recommandé de conserver le carprofène à 4 °C avant l’injection. - Anesthésie le rat avec un vaporisateur d’isoflurane en utilisant un débit de 3 % à 4 % pour l’induction de l’anesthésie pendant environ 2-3 min. Réduire le débit d’isoflurane à environ 1,75 % à 2 % pour le maintien de l’anesthésie.
- Transférez le rat sur une table séparée avec une configuration pour l’épilation et la préparation du site. Assurez-vous que cette table est proche de l’espace chirurgical.
- Appliquez une pommade artificielle lacrymogène dans les deux yeux du rat pour prévenir une sécheresse excessive.
- Administrer des analgésiques selon le protocole approuvé de l’établissement pour contrôler la douleur lorsque le rat reprend conscience.
- Rasez la zone chirurgicale avec une tondeuse à cheveux sur la face ventrale du cou dans la région cervicale. Rasez jusqu’à environ 2 cm à une distance perpendiculaire de la ligne médiane des deux côtés, du menton au sternum.
- Stérilisez la zone avec de l’alcool éthylique à 70 % et de la bétadine à 10 %, en essuyant la zone trois fois alternativement avec un tampon imbibé d’alcool et de la povidone iodée. Essuyez du centre de la zone vers l’extérieur selon un motif circulaire.
- Transférez le rat au stade chirurgical sous le microscope en position couchée. Ajustez la mise au point du microscope pour visualiser la zone de chirurgie dans la région cervicale.
7. Réalisation d’une chirurgie du rat pour injecter le médicament candidat directement dans le nerf vague gauche (Figure 2, Figure 3 et Figure 4)
REMARQUE : Cette partie de la méthode nécessitera une deuxième personne pour aider le chirurgien.
- Placez le rat sur un coussin chauffant en position couchée sous le microscope de dissection associé à une lumière montée.
- Accrochez les dents de la mâchoire supérieure avant du rat avec un morceau de suture non résorbable et fixez l’extrémité ouverte de la suture à l’intérieur du cône nasal de sorte que la narine du rat soit toujours à l’intérieur du cône nasal tout au long de l’anesthésie.
- Positionnez le rat de manière à ce que sa tête repose sur le côté gauche du chirurgien droitier (ou du côté droit d’un chirurgien gaucher). Dans cette position, la face avant du chirurgien est perpendiculaire au corps du rat. Placez un coussin de calibre stérilisé sous le cou et ajustez l’angle de la région cervicale du rat afin que la région cervicale devienne droite. Cela facilitera la localisation du nerf vague gauche et la réalisation de l’injection.
- Drapez tout le corps du rat avec un champ stérilisé, en gardant l’espace chirurgical ouvert.
- Fixez quatre goupilles d’écarteur individuellement avec 4 fixateurs magnétiques avec élastomères et placez les fixateurs aux quatre coins de la scène chirurgicale.
- Injectez des anesthésiques locaux par voie épidermique sur la ligne médiane de la région cervicale où l’incision est pratiquée. Par exemple, un mélange de lidocaïne et de bupivacaïne est généralement utilisé.
- Faites une incision cutanée longitudinale d’environ 2 cm de long sur la ligne médiane entre le menton et le sternum avec une lame de scalpel sur la face ventrale du cou dans la région cervicale (Figure 3A).
- Séparez les bords coupés de la peau à l’aide d’embouts en coton stérilisé.
- Rétractez les bords de la peau dans des directions opposées à partir du site de l’incision à l’aide d’embouts rétracteurs.
- Séparez le facia avec des cotons-tiges pour aller plus loin. Poussez les glandes salivaires vers le côté latéral.
- Séparez les muscles sterno-mastoïdiens avec des cotons-tiges et rétractez-les avec les épingles. Au fur et à mesure que la séparation du muscle sterno-mastoïdien progresse largement, la trachée apparaît au milieu, recouverte de muscle sterno-hyoïdien (Figure 3B).
REMARQUE : Veillez à ne pas exercer de pression sur la trachée. - Avancez la séparation des tissus sur le côté gauche de la trachée du rat jusqu’à ce que la gaine carotide apparaisse, qui contient l’artère carotide commune qui relie le nerf vague gauche.
- Faites soigneusement un petit trou ponctuel dans la gaine carotide avec une pince fine, en faisant attention à ne pas blesser l’artère carotide au microscope. Séparez le nerf vague gauche de l’artère carotide commune à l’aide de pinces fines.
REMARQUE : La zone chirurgicale est anatomiquement critique. La paroi de l’artère carotide est épaisse, glissante et ne se blesse pas facilement, mais la pointe acérée d’une pince fine peut la blesser et des saignements peuvent se produire. Dans le même temps, faites attention à ne pas blesser le nerf. - Une fois que le nerf est séparé de l’artère par la pince, utilisez une aiguille incurvée de 25 G ajustée à une seringue de 1 mL à partir de ce trou pour « accrocher » et tenir le nerf par la main non dominante (figure 4A).
REMARQUE : La pointe de l’aiguille incurvée est émoussée afin de ne pas blesser le nerf et l’artère. L’angle de courbure de la pointe de l’aiguille est calculé sur mesure à environ 90° à l’aide d’un hémostat (Figure 2). - Avec la main dominante, tenez l’aiguille chargée avec le mélange médicament-colorant candidat et piquez doucement le nerf dans la même direction que le nerf de manière à ce que le biseau de l’aiguille soit orienté vers le haut.
- Pour une piqûre facile, gardez le nerf droit en tirant doucement à l’aide du crochet de 25 G. Insérez l’aiguille dans le nerf et avancez vers l’avant, de plus de 0,5 cm, tout en gardant l’aiguille parallèle au nerf vague. Ensuite, tirez légèrement vers l’arrière pour qu’il reste environ 0,4 à 0,5 cm d’aiguille à l’intérieur du nerf.
REMARQUE : L’angle de l’aiguille doit être suffisamment peu profond pour pénétrer à l’intérieur du nerf sans passer de l’autre côté.
- Pour une piqûre facile, gardez le nerf droit en tirant doucement à l’aide du crochet de 25 G. Insérez l’aiguille dans le nerf et avancez vers l’avant, de plus de 0,5 cm, tout en gardant l’aiguille parallèle au nerf vague. Ensuite, tirez légèrement vers l’arrière pour qu’il reste environ 0,4 à 0,5 cm d’aiguille à l’intérieur du nerf.
- Il peut arriver que l’aiguille ne soit pas obstruée à l’extérieur du nerf au moment de l’amorçage, mais que le mélange médicament-colorant candidat ne passe pas en douceur à l’intérieur du nerf. Pour éviter cette situation, limitez le nombre de piqûres nerveuses par une seule aiguille pas plus de 3 fois. Si l’aiguille s’émousse, les risques de blocage ou d’injection médiocre augmenteront.
- Assurez-vous que l’aiguille est complètement à l’intérieur du nerf. Maintenez la position immobile et allumez le pousse-seringue.
REMARQUE : Vérifiez soigneusement au site d’injection pour vous assurer que le mélange médicament-colorant candidat ne reflue pas hors du nerf. - Pendant que l’injection se poursuit, vérifiez constamment que la perfusion reste à l’intérieur du nerf et circule doucement. Utilisez la marque faite sur la tubulure de perfusion pour surveiller le mouvement du mélange médicament-colorant à partir du point de départ.
- Si le mélange médicament-colorant candidat ne s’écoule pas correctement, retirez l’aiguille et répétez l’étape d’amorçage (étape 5.2). Ensuite, réinsérez l’aiguille dans le nerf et reprenez la perfusion.
- Le nerf commence à développer la couleur du colorant (Figure 4B). Poursuivre l’infusion à 0,5 μL/min pendant 10 min pour perfuser les 5 μL du mélange médicament-colorant candidat.
REMARQUE : Il est recommandé d’irriguer les tissus exposés avec une petite quantité de solution saline stérile chaude à 0,9 % au besoin pour éviter une sécheresse excessive et des dommages. - Une fois que les 5 μL ont été perfusés et que le tire-seringue s’est arrêté, maintenez l’aiguille en place pendant 1 minute supplémentaire pour permettre à tout le mélange médicament-colorant candidat de se propager à partir du site d’injection. Retirez l’aiguille.
- Retirez l’aiguille incurvée de 25 G. Utilisez des embouts en coton stériles pour remettre doucement les tissus à leur emplacement d’origine. Retirez les embouts de l’écarteur.
- Fermez la plaie avec une suture non résorbable (une suture résorbable peut également être utilisée). Appliquez une petite quantité de colle tissulaire entre les points de suture si nécessaire pour fermer parfaitement la plaie.
8. Soins postopératoires d’un rat
- Perfaction sous-cutanée d’environ 3 ml de solution saline tiède à 0,9 % après la fermeture de la plaie. Cela aide les rats à se réhydrater immédiatement.
- Placez le rat dans une source de chaleur jusqu’à ce qu’il récupère complètement de l’anesthésie et revienne à un état normal. Notez tout ce qui est observé qui est anormal pendant le processus de récupération.
REMARQUE : la durée de récupération peut être plus longue si la procédure d’injection nerveuse prend beaucoup de temps. - Transférez le rat dans sa cage d’accueil avec de la nourriture humide sur le sol de la cage. Assurez-vous que l’eau est disponible en tout temps. Observez le rat en postopératoire pendant environ 2 h pour vous assurer qu’il n’a pas froid.
REMARQUE : Placez le rat dans une source de chaleur pendant des heures supplémentaires s’il est froid. - Surveiller le rat à 12 h, 24 h, 36 h, 48 h et 72 h après la chirurgie avec des notes écrites d’observations. Répéter la prise d’analgésiques conformément au protocole approuvé de l’établissement pour contrôler la douleur. Par exemple, le carprofène est dosé à raison de 5 mg/kg par voie sous-cutanée deux fois à 24 h d’intervalle. Consulter un vétérinaire si la douleur persiste chez le rat pendant plus de 48 h.
- Répéter l’injection sous-cutanée d’environ 3 mL de solution saline chaude à 0,9 % à 24 h selon l’état du rat.
- Continuez à évaluer la plaie. Assurez-vous que la plaie est sèche et qu’elle est en train de guérir.
REMARQUE : La rougeur, l’enflure et l’état douloureux de la plaie avec l’inactivité et l’apathie du rat peuvent être une indication d’inflammation de la plaie et peuvent justifier une consultation vétérinaire supplémentaire. Un rat souffrant de douleur montrera un dos voûté, un pelage ébouriffé, des yeux rouges et un état inactif. On le trouve généralement dans un coin de la cage. - Retirez les sutures non résorbables dans les 2 semaines suivant la cicatrisation de la plaie.
Résultats
Six rats adultes (3 mâles et 3 femelles) ont été utilisés dans la présente étude. Sur six, un rat a été injecté plusieurs fois pour démontrer une condition d’injection d’échec qui montre une diffusion du colorant autour du site d’injection Figure 5A. Tous les autres rats ont montré une injection douce et une coloration nerveuse, comme le montrent les figures 4B et 5B.
La figure 1 illustre une situation où une fuite de colorant entre l’aiguille et la tubulure s’est produite lorsque le réglage de l’aiguille d’injection avec la tubulure n’est pas correct. Le colorant à 1 % utilisé dans cette expérience n’est pas trop épais, mais le passage du colorant à travers l’aiguille d’injection a échoué en raison d’un joint qui fuit. Ce type de problème peut être facilement identifié lors du processus d’amorçage (voir étape 5.2). Pour résoudre cette condition, vérifiez si la connexion entre l’aiguille et le tube est correctement faite. Assurez-vous qu’environ 3 mm d’aiguille ont été insérés dans le tube et assurez-vous que la taille du tube et de l’aiguille est correcte. Répétez l’amorçage après avoir corrigé la connexion défectueuse, en particulier si des bulles d’air sont introduites (répétez l’étape 5.2).
La figure 2 montre l’installation d’une aiguille incurvée et émoussée de 25 G montée sur une seringue en plastique de 1 ml. La pointe de l’aiguille est émoussée et pliée à un angle d’environ 90° par un porte-aiguille. Il est stérilisé avant utilisation et monté sur la seringue stérilisée de 1 mL au moment de l’intervention chirurgicale. Cette aiguille munie d’une seringue est utilisée pour séparer le nerf vague gauche de l’artère carotide commune, comme décrit à l’étape 7.14, l’accrocher et le tenir au moment de l’injection, comme le montre la figure 4A.
La figure 3 montre une procédure aseptique d’incision médiane avec une lame de scalpel dans la région ventrale du cou d’un rat pour couper la couche de peau. Une fois que le rat est recouvert d’un champ stérilisé, une incision horizontale d’environ 2 cm de long est pratiquée pour couper la couche de peau, Figure 3A. Une fois la peau coupée, les deux bords de la peau coupée sont tirés sur les côtés opposés à l’aide de goupilles reliées par des élastomères. La traction des bords coupés du côté opposé crée un espace plus large pour aller plus loin. La couche de facia sous la peau et les muscles sterno-mastoïdiens sont carrément séparés par des embouts en coton stérilisé, comme le montre la figure 3B. Une fois que le nerf vague gauche apparaît sur le côté gauche de la trachée à l’intérieur de la gaine carotide commune, comme décrit à l’étape 7.12, il est séparé par de fines pinces et accroché comme sur la figure 4A.
La figure 4 montre une situation de séparation du nerf vague gauche de l’artère carotide commune et de son maintien prêt à l’injection. Le chirurgien tient l’aiguille d’injection avec sa main dominante (main droite) et l’autre main (gauche) tient le nerf vague gauche du rat à l’aide d’une aiguille incurvée fixée à une seringue de 1 mL, figure 4A. Le nerf vague gauche est bien séparé de l’artère carotide commune et suffisamment étiré pour y être injecté. Le rectangle pointillé sur le côté droit du nerf montre la zone de la trachée recouverte de muscle sterno-hyoïde. La figure 4B montre le nerf vague gauche coloré de la couleur du colorant bleu après une injection réussie sans diffusion du colorant. Le rectangle pointillé blanc est la zone de la trachée. La figure 4B est plus étirée que la figure 4A pour montrer une image claire du nerf et de son environnement après l’injection.
La figure 5 montre des exemples d’injections ratées et réussies dans le nerf vague gauche d’un rat. Ces injections ont utilisé 5 μL de colorant à 1 % à un débit de 0,5 μL/min dans le nerf. La figure 5A montre une condition d’échec de l’injection car le colorant n’est pas limité à l’intérieur du nerf (voir encadré). Au contraire, le colorant s’est répandu sur toute la zone autour du nerf. De plus, le site d’injection réel dans le nerf n’est pas clair. Cela suggère que l’injection n’était pas à l’intérieur du nerf et qu’une quantité importante de volume d’injection s’est échappée et s’est diffusée dans la zone environnante.
Une situation similaire peut être observée dans des conditions où l’aiguille doit être réinsérée ou repositionnée dans le nerf. Cela peut être nécessaire lorsque l’aiguille se bouche et ne passe pas le mélange ou si l’aiguille s’émousse et ne peut pas passer facilement dans le nerf. Dans l’exemple de la figure 5A, la petite quantité de sang accumulée dans la zone montre la rupture accidentelle de minuscules vaisseaux sanguins dans la zone. Cela se produit lorsque les vaisseaux sanguins de la région sont endommagés lors de la séparation nerveuse.
La figure 5B montre une injection réussie dans le nerf. Il montre un point d’injection clair et un nerf bien coloré, distinctif de la zone environnante. Une petite zone de coloration à l’extérieur du nerf est due à une petite quantité de la solution de colorant à l’extrémité de l’aiguille qui est présente après l’amorçage (voir encadré). L’amorçage est effectué pour tester l’obstruction de l’aiguille juste avant de piquer le nerf.

Figure 1 : Fuite de colorant (flèche) due à un joint défectueux entre l’aiguille et le tube. Ce type d’erreur se produit si la tubulure n’est pas correctement ajustée avec la pointe de l’aiguille. Pour éviter ce type de fuite, environ 3 mm ou plus de la pointe de l’aiguille sont insérés dans le tube et la taille correcte de l’aiguille et du tube est utilisée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Une aiguille émoussée de 25 G, incurvée sur mesure à un angle d’environ 90° et montée sur une seringue en plastique de 1 ml. Veuillez cliquer ici pour voir une version agrandie de cette figure.
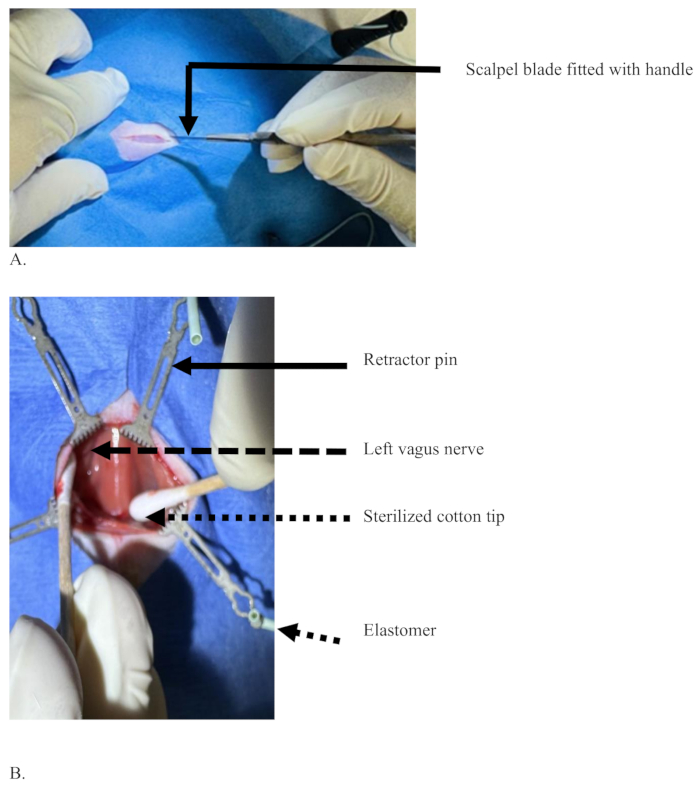
Figure 3 : Une incision médiane avec une lame de scalpel dans la région ventrale du cou d’un rat pour couper la couche de peau. (A) Une incision avec seulement la peau coupée mais sans sang, et une lame de scalpel avec un manche tenu avec la main dominante du chirurgien. (B) Les embouts en coton stérilisé (flèche pointillée) séparant les tissus pour exposer le nerf vague gauche (flèche pointillée), tissus écartés à l’aide d’épingles (flèche pleine) soutenues par un élastomère (flèche pointillée courte). Veuillez cliquer ici pour voir une version agrandie de cette figure.
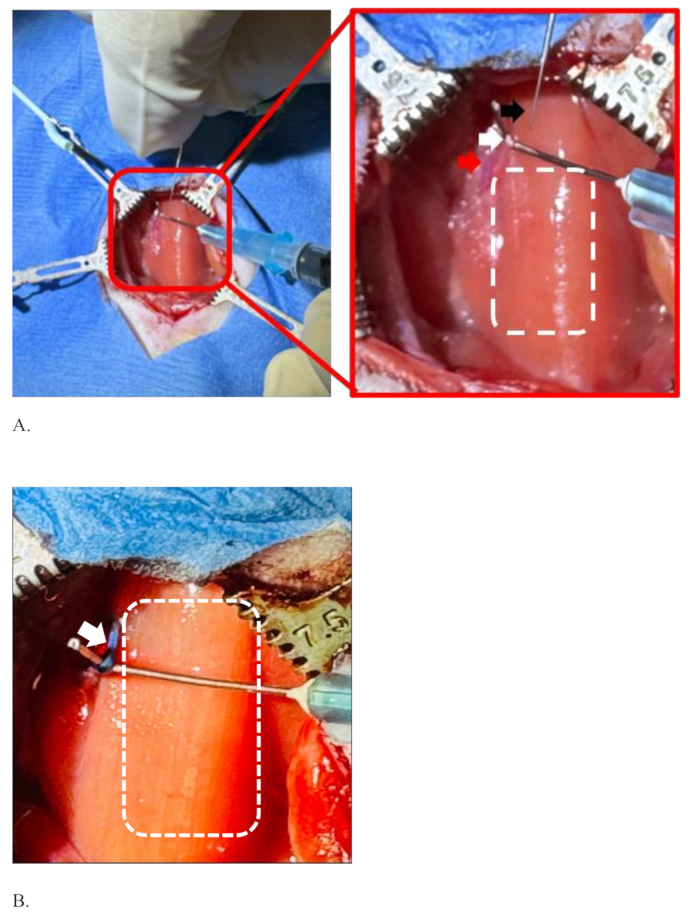
Figure 4 : Illustration de la séparation du nerf vague gauche de l’artère carotide commune, en la maintenant avant et après l’injection. (A) L’aiguille d’injection (flèche noire), le nerf vague gauche (flèche blanche), l’artère carotide commune (flèche rouge) et le rectangle pointillé montrant la zone de la trachée recouverte de muscle sterno-hyoïde. (B) Le nerf vague gauche de couleur bleue, la couleur du colorant après une injection réussie sans diffusion du colorant (flèche blanche) et la zone de la trachée (rectangle pointillé). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Exemples d’une injection ratée et d’une injection réussie dans le nerf vague gauche d’un rat. (A,B) 5 μL de colorant à une concentration de 1 % ont été injectés dans le nerf vague gauche de rats. Le rectangle blanc pointillé montre la zone de la trachée dans les deux panneaux. (A) Une condition de défaillance montrant que le colorant n’est pas limité à l’intérieur du nerf, suggérant une perte importante de solution de colorant pendant la procédure. La petite quantité de sang accumulée dans la région montre une rupture accidentelle d’un minuscule vaisseau sanguin dans la région, qui a été endommagé lors de la séparation nerveuse. (B) Une injection réussie dans le nerf. Il montre un point d’injection unique clair et un nerf bien coloré, distinctif de la zone environnante. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La méthode d’injection directe dans le nerf vague gauche peut être réalisée en toute sécurité et sans complications post-opératoires chez le rat. L’administration de médicaments au nerf vague peut être utilisée pour cibler le système nerveux autonome (SNA). Cela implique certaines étapes critiques qui nécessitent de la pratique et un degré modéré à élevé de compétence chirurgicale.
Cette intervention chirurgicale nécessite une anesthésie générale équilibrée chez le rat. Le chirurgien vise à terminer l’intervention dans un délai plus court afin de limiter l’exposition aux anesthésiques pour une meilleure récupération, notamment chez les rats âgés. Cette méthode suppose également un chirurgien formé avec un certain niveau de compétences chirurgicales aseptiques pour assurer le succès de l’injection et de la récupération postopératoire. L’emplacement anatomique du nerf vague est profondément ancré dans un endroit critique13. Le nerf vague gauche coule avec l’artère carotide commune gauche, ce qui présente un risque de blessure à la fois à l’artère et au nerf au moment de la séparation et de l’injection. Un haut degré de pratique et d’habileté est nécessaire pour séparer correctement le nerf de l’artère carotide commune. Il doit être tenu à l’angle approprié pendant la procédure tout en gardant l’aiguille à l’intérieur du nerf.
Bien qu’il n’y ait que deux exemples publiés d’une procédure directe du nerf vague chez le rat5 et la souris6 par le même groupe de chercheurs, les deux études manquent d’une description détaillée de la façon de mener la procédure. L’utilisation d’une aiguille de 35 G pour injecter le nerf était pratique (c’est-à-dire qu’aucun équipement spécial n’était nécessaire pour préparer les aiguilles), et les résultats sont restés cohérents par rapport à l’utilisation de la micropipette en verre tiré utilisée par l’autre groupe. Comparé aux injections dans d’autres nerfs, tels que le nerf sciatique, le nerf vague est relativement plus petit en taille et ne peut contenir qu’un plus petit volume de mélange médicament-colorant à la fois. Dans une étude publiée injectant une solution de colorant de 10 μL dans le nerf sciatique, la diffusion du colorant a atteint une longueur totale de 2,3 cm à l’intérieur du nerf à partir du site d’injection sans atteindre le DRG1. Le nerf vague peut absorber jusqu’à 5 μL de volume de mélange médicament-colorant en toute sécurité en utilisant ce protocole d’injection.
Cette injection nécessite un microscope de dissection. Bien que l’utilisation d’un colorant dans la solution d’injection ne soit pas absolument requise, il est fortement recommandé de permettre la visualisation de la fidélité de l’injection en temps réel pendant la procédure. Dans le même temps, si la concentration de colorant est trop élevée dans le mélange de médicament candidat et de colorant, cela peut entraîner le blocage de l’aiguille au moment de l’injection. Limiter le nombre de piqûres d’injection par une seule aiguille est également essentiel dans cette méthode. Il est suggéré de ne pas utiliser la même aiguille pour plus de 3 à 5 piqûres nerveuses (l’équivalent de 3 rats par aiguille) afin d’éviter l’émoussement de l’aiguille. La réutilisation de l’aiguille (facultative) nécessite qu’elle soit stérilisée entre les animaux en l’essuyant trois fois avec de l’alcool à 70 %.
Les exemples d’études dans la littérature utilisant l’injection directe du nerf vague sont extrêmement limités, en particulier pour les rongeurs 5,6. Quelques études ont rapporté des injections directes de DRG et d’autres injections nerveuses avec des modifications dans les méthodes et la quantité de volume à injecter chez les souris et les rats 1,2,9. La méthode actuelle est très importante en tant qu’approche pour administrer les médicaments candidats ou d’autres agents à travers le nerf vague pour cibler des aspects du SNA. Le nerf vague est le nerf crânien le plus long et innerve presque tous les organes viscéraux pour réguler leurs fonctions physiologiques. Ainsi, l’application de cette approche a une importance présente et future dans les études précliniques, y compris, mais sans s’y limiter, la thérapie génique utilisant des rats. De plus, cette méthode peut être extrapolée à d’autres injections nerveuses, telles que le nerf sciatique, avec des modifications relativement mineures.
En bref, la méthode d’injection directe du nerf vague est une voie potentielle d’administration de médicaments pour les études sur des modèles de rats liés au SNA. D’après notre expérience, la procédure elle-même ne provoque aucun effet indésirable à long terme, car les animaux qui ont été maintenus plus d’un an après l’injection n’ont pas développé de complications à long terme. Cependant, elle implique également plusieurs étapes critiques et exige des pratiques en chirurgie des rongeurs. Tous ces points critiques ont été soigneusement inclus dans ce protocole détaillé, étape par étape, dans le texte. Une attention particulière est portée à plusieurs points critiques : 1) la séparation du nerf vague de l’artère carotide commune, 2) le maintien du nerf dans une position stable au moment et après l’insertion de l’aiguille dans le nerf vague tout au long de la période d’injection, et 3) une administration en douceur du mélange médicament-colorant sans blocage de l’aiguille. Une pratique chirurgicale extensive est le meilleur moyen de surmonter tous ces problèmes chirurgicaux.
Déclarations de divulgation
Les auteurs NR et XC n’ont aucun conflit d’intérêts. RMB et SJG sont les inventeurs de la propriété intellectuelle liée au transfert de gènes vers le SNA via des injections de nerf vague (brevet américain #11,753,655). SJG et RMB ont reçu des revenus de redevances de Taysha Gene Therapies, et SJG a reçu des revenus de conseil de Taysha Gene Therapies.
Remerciements
Nous tenons à remercier l’installation du Centre de ressources animales du sud-ouest de l’UT pour l’organisation de l’espace chirurgical pour les rats. Le financement de ce travail a été fourni par les sources suivantes à SJG : NIH/NINDS R01 NS087175, Hannah’s Hope Fund et Taysha Gene Therapies.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL BD Tuberculin Syringe with Detachable 25 G x 5/8". Needle | Becton, Dickinson and Company | SKU:309626 | Used to connect with curved needle to pull the vagus nerve and hold it at the time of injection. |
| 0.5% Bupivacaine Hydrochloride Injection | Hospira | NDC 0409-1162-19 | Local anesthetics used to anesthetize local tissue. |
| 100 mL 0.9% Sodium Chloride Irrigation USP | Stericare Solutions | Item #6240 | Normal saline, used to rehydrate rat and tissue. |
| 20 Blunt, Retractor Tips, 7.5 mm | Kent Scientific Corporation | Surgi 5018 | Used to pull apart and hold tissues at the time of surgery. |
| 3 mL BD-Luer-Lok Syringe, Sterile, Single Use | Becton, Dickinson and Company | SKU # 309657 | Used to inject saline in rat and fill the saline into the Polythene tubing. |
| AK-Fluor10% | Akorn | NDC 17478-253-10 | Fluorescein dye visible within the nerve. Used to track injection fidelity. |
| Animal Weighing Scale | Kent Scientific Corporation | SCL 4000 | Used to measure body weight of rat. |
| Ansell ENCORE Perry Style 42 PF Surgical Gloves | Ansell | ASTM D3577 | Sterilie glove, it is used at the time of surgery by a surgeon. |
| Artificial Tears Ointment 3.5g | Pivetal | NDC 46066-753-55 | Used in eyses to prevent excessive dryness of eyes. |
| Baby-Myxter Hemostat | Fine Science Tools | 13013-14 | Used to stop bleeding in case of emergency. Also used to bend the 25 G x 5/8" in needle. |
| BD Intramedic PE Tubing | Becton, Dickinson and Company | 14-170-12A | Used in the injection set up system to connect with Hamilton needle and NanoFil Needles. It also holds the injection mixture. |
| BD Precison Glide Needle, 25 G x 5/8" | Becton, Dickinson and Company | REF#305122 | Used to inject saline in rat, and to make a curved needle. |
| BD Precison Glide Needle, 27 G x ½" | Becton, Dickinson and Company | REF#301629 | Used to fill sterile saline into the BD Intradermic tubing. |
| Benchmark Accuris ”NextPette” Variable Volume Pipette Micro Starter Setincludes 4 pipettes: 10/20/200/1000 μL, plus stand | MilliporeSigma | BMSP7700S1 | Used to pippette sterile solution. |
| Betadine, Povidine Iodine 10% | Honestmed | 67618015017 | Used to disinfect the surgical area. |
| Carprofen Injectable solution 50 mg/mL | Supplied by Covtrus (6451506845) | SKU 591149 | In our case, we used diluted carprofen at the dose rate of 5 mg/kg provided by the Animal Resource Center of University of Texas Southwestern Medical Center. |
| Curved needle (custom made) | Becton, Dickinson and Company | REF#305122 | BD PrecisionGlide 25 G x 5/8" in needle is curved to 90 degrees with the help of a hemostat. The tip of the needle is made blunt. It needs to be sterilized before use. It is used to hook the vagus nerve and hold it at the time of separation and injection. |
| Dissecting microscope | Motic | SMZ-171-BLED (Binocular with Lights) | Used to magnify the crifical anatomical area at the time of vagus nerve separation, injeciton, and to check injection leakage. |
| Drape sheet | Dynarex | Reorder#8122 | Used as drape after sterilization. |
| Dukal Cotton Tip Applicators, Non-Sterile | Dukal | Item 9003 | Used to blunt separation of tissue, needs to sterilize before use. |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | Used to separate the left vagus nerve from common carotid artery. It is curved so easy to use. |
| Ethicon PDS II Undyed Monofilament Suture - SUTURE, 4/0 18 PDS II CLR MONO PS | Ethicon | VA - Z682G | Used in suturing the wound. |
| Ethilon Nylon Suture Black Monofilament | Ethicon | 1856G | Used in suturing the wound if non-absorbale suture is used. Also used to hook the rat tooth to fix nose inside the nose cone. |
| Fine Forceps - Mirror Finish | Fine Science Tools | 11412-11 | Used at the time of vagus nerve separation from the common carotid artery. This is straight. |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | Ued to cut tissue. |
| Hamilton cleaning solution | Hamilton | HT18311 | Used to clean the Hamilton after use. |
| Hamilton Needle, 27G, Small Hub RN Needle, 2”, PT3, 6/PK | Hamilton | 7762-01 | Used to connect BD Intramedic™ PE Tubing. |
| Hamilton Syringe , 710RN | Hamilton | 7638-01 | Used to hold drug at the time of vagus nerve injection. |
| Insulin Syringe | EXEL INT, Comfort point | REF 26027 | Used to inject carprofen and local anesthetics. |
| Lidocaine 2% Injection | Covetrus | Reorder#002468 | Used to mix with Bupivacaine and inject at the site of incision. |
| Luxol Fast Blue MBSN | Acros Organics | 212170250 | Dye visible within the nerve, used to mix with drug so that injection mixture is visible. |
| Micro Bead Sterilizer with Glass Beads | Fine Science Tools | Item No. 18090-46 | Used to sterilize surgical tools in between the rat surgery. |
| NanoFil Needles-NF35BV-2 | World Precision Instrument | NC9708956 | Used to inject drug - dye mixture inside the vagus nerve. |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | Used in wound suturing. |
| Parafilm M Laboratory Wrapping Film, 4 Inches x 125 Feet, 1 Roll per Box, 12 Count | Honestmed | PM#996 | Used to hold the aliquoted 5 uL of drug-dye mixture so that loading of drug-dye mixture into the BDTM intradermic tubing is accurate. |
| PDI Alcohol Prep Pads | Honestmed | NDC 10819-3914-2 | Used to disinfect the surgical area. |
| Premium Care Sterile Type VII Gauze Sponges, 8-Ply, 2" x 2" | Dukal | Item C5119 | Used as cushon under the neck of rat at the time of surgery. |
| Press’n Seal Cling Film | Glad | Used to cover a rat at the time of surgery like a drape. | |
| Rat Retractor Set | Kent Scientific Corporation | Surgi 5002 | Used to keep the incision open so that it is easy to separate the vagus nerve from the carotid artery. |
| RightTemp Jr. | Kent Scientific Corporation | 20.3 cm W x 25.4 cm L (8 in W x 10 in L), used to keep rat warm. | |
| S&T Forceps - SuperGrip Tips | Fine Science Tools | 00632-11 | Used at the time of suturing to hold tissue without damage. |
| S&T Suture Tying Forceps | Fine Science Tools | 00272-13 | Used to tight the suture. |
| Scalpel blade #15 | Fine Science Tools | 10015-00 | Used to make an incision in the skin at the ventral side of neck. |
| Scalpel Handle-#7 | Fine Science Tools | 10007-12 | Used to hold the scalpel blade. |
| Syringe Pump | KD Scientific | 78-81-8052GL | Serial #D107034, Model#LEGATO-180, is a programmable pump that can pump small volume of mixture under a program. |
| TipOne Filter Tip Refill Starter Systems | USA Scientific | Item #1120-3510 | Used to pipette the drug and dye mixture. |
| Vaporizer for Isoflurane, Funnel Filled | Kent Scientific Corporation | Vetflow 1231 | Used to anesthetize rats. |
| Vetbond Tissue Adhesives | 3M Science Applied to Life | ID B00016067 | Used to seal tissue at the site of cut wound if suturing is not perfect. |
| Wahl BravMini+ Professional Cordless Clipper Kit | Kent Scientific Corporation | CL7300-Kit | Used to cut hair of rat. |
Références
- Fischer, G., et al. Direct injection into the dorsal root ganglion: Technical, behavioral, and histological observations. J Neurosci Methods. 199 (1), 43-55 (2011).
- O'donnell, M., Fontaine, A., Caldwell, J., Weir, R. Direct dorsal root ganglia (drg) injection in mice for analysis of adeno-associated viral (AAV) gene transfer to peripheral somatosensory neurons. J Neurosci Methods. 411, 110268 (2024).
- Puljak, L., Kojundzic, S. L., Hogan, Q. H., Sapunar, D. Targeted delivery of pharmacological agents into rat dorsal root ganglion. J Neurosci Methods. 177 (2), 397-402 (2009).
- Rueter, L. E., Kohlhaas, K. L., Curzon, P., Surowy, C. S., Meyer, M. D. Peripheral and central sites of action for a-85380 in the spinal nerve ligation model of neuropathic pain. Pain. 103 (3), 269-276 (2003).
- Ulusoy, A., et al. Neuron-to-neuron alpha-synuclein propagation in vivo is independent of neuronal injury. Acta Neuropathol Commun. 3, 13 (2015).
- Helwig, M., et al. Brain propagation of transduced alpha-synuclein involves non-fibrillar protein species and is enhanced in alpha-synuclein null mice. Brain. 139 (Pt 3), 856-870 (2016).
- Chiang, B., et al. Development of a novel suprachoroidal-to-optic-nerve (scone) drug delivery system. Drug Deliv. 31 (1), 2379369 (2024).
- Ferrari, L. F., Cunha, F. Q., Parada, C. A., Ferreira, S. H. A novel technique to perform direct intraganglionar injections in rats. J Neurosci Methods. 159 (2), 236-243 (2007).
- Yuan, X. M., et al. Rapid injection of lumbar dorsal root ganglia under direct vision: Relevant anatomy, protocol, and behaviors. Front. Neurol. 14, 1138933 (2023).
- Mason, M. R., et al. Comparison of AAV serotypes for gene delivery to dorsal root ganglion neurons. Mol Ther. 18 (4), 715-724 (2010).
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Ertl, H. C. J. Immunogenicity and toxicity of AAV gene therapy. Front Immunol. 13, 975803 (2022).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon