Method Article
마우스 전기 침술 고정 장치 제작 당뇨병성 심근병증 마우스 모델에서 전기 침술 전처리
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 당뇨병성 심근병증의 마우스 모델을 확립하기 위한 프로토콜과 치료 중 마우스를 보다 부드럽게 고정할 수 있는 마우스의 전기침술을 사용하기 위한 마우스 전기침 고정 장치를 제시합니다.
초록
당뇨병성 심근병증(DCM)은 심부전으로 진행될 수 있는 당뇨병의 합병증이며 약물 사용에 의해 제한됩니다. 전기 침술은 당뇨병성 심근병증을 치료하기 위한 전통 한의학 외부 치료 방법으로 효과적인 방법입니다. 마우스 전기침술 고정 장치는 전기침술 치료 중에 마우스를 쉽고 부드럽게 고정할 수 있으며 마우스의 복부와 팔다리에 있는 경혈을 노출시킬 수 있습니다. 이 기사에서는 마우스 전기침 고정 장치를 제작하는 데 사용되는 모든 단계와 주의 사항을 설명하고, 혈당과 같은 혈액 생화학적 지표의 변화를 종합적으로 기록하기 위한 포괄적인 조치와 함께 당뇨병성 심근병증의 마우스 모델을 구축합니다. 실험은 대조군, 모델군, 전처리군의 3개 그룹으로 진행되었으며, 각 그룹에는 10마리의 쥐가 있었습니다. 전처리 그룹은 Biaoben 경혈 전기 침술 전처리로 격일로 총 7회 동안 치료를 받았습니다. 전기침술 후, 전처리 그룹의 마우스는 당뇨병 증상의 감소와 함께 혈당의 감소를 보였다.
서문
당뇨병성 심근병증(DCM)은 특정 병변의 심장 구조와 심실 이완기 및 수축 기능의 변화를 특징으로 하는 당뇨병의 흔한 합병증으로, 심부전으로 발전합니다. 당뇨병은 진성 당뇨병 환자의 주요 사망 원인 중 하나이며 1,2 최근 몇 년 동안 유병률이 증가함에 따라 광범위한 관심을 끌고 있습니다3. 이 질병의 발병 기전은 주로 인슐린 저항성, 염증 반응, 비정상적인 지질 대사, 산화 스트레스, 미토콘드리아 손상 4,5을 포함하는 것으로 밝혀졌습니다.
현재 당뇨병성 심근병증의 임상적 치료는 주로 혈당 조절과 심장 질환 증상 완화를 위한 경구용 약물 치료에 기반을 두고 있으나, 약물 반응, 신장 기능 영향, 장기 약물 의존성 등 한계가 있다6. 침술은 중국 전통 의학의 외부 치료법으로 당뇨병성 심근병증 환자의 혈당, 혈중 지질, 염증 반응 조절 효과가 우수하며, 임상적 효능이 현저하다7. 침 치료는 위장 및 신장 기능에 부정적인 영향을 미치지 않으며, 장기 치료는 의존성을 일으키지 않습니다. 비아오벤 경혈 이론은 전통적인 침술 이론8에서 경혈을 선택하고 사용하는 중요한 방법이다. 질병의 증상을 개선할 수 있는 경혈을 비아오 경혈(Biao acupoints)이라고 정의하며, 질병과 관련된 신체의 기본 기능을 조절하고 질병의 근본 원인을 치료할 수 있는 경혈을 벤 경혈(Ben acupoints)이라고 합니다. 침술과 동시에 Biao 경혈과 Ben 경혈을 자극하면 질병에 대한 신체의 저항력을 높이고 질병의 악화 및 재발을 예방할 수있을뿐만 아니라 질병을 치료하는 목적을 달성 할 수 있습니다9. 질병의 악화와 재발을 예방할 수 있습니다. 현대 연구에 따르면 Biaoben 경혈을 사용한 침술은 당뇨병성 심장병, 당뇨병성 신병증, 당뇨병성 망막병증, 당뇨병성 발 등을 포함한 당뇨병과 당뇨병의 많은 합병증에 효과적입니다10,11. Biaoben 경혈 이론에 따른 경혈 선택 계획은 Biao 경혈12와 같이 심장의 기능을 조절하고 염증 반응을 개선할 수 있는 PC6(Neiguan)과 혈당 및 혈당 상황을 개선하고 인슐린 저항성을 개선하며 산화 스트레스를 줄일 수 있는 ST36(Zusanli)을 Ben 경혈13과 같이 선택하는 것입니다.
동물 모델은 당뇨병성 심근병증에 의한 심장의 구조적 이상과 기능적 변화를 잘 모방하고 당뇨병성 심근병증의 생화학적 검출 지표에 필요한 샘플을 제공한다는 것이 실험적으로 입증되었기 때문에 당뇨병성 심근병증 연구에서 중요한 도구이다14,15. 생쥐를 유도하기 위해 스트렙토조토신 용액과 결합된 고설탕 및 고지방 사료를 사용하면 4-5주 내에 당뇨병 모델을 형성할 수 있어 모델링 시간을 효과적으로 단축하고 성공률을 향상시킬 수 있으며 사육 환경에 대한 특별한 요구 사항은 없습니다16,17. 당뇨병성 심근병증은 지속적인 고혈당증으로 인한 심장 구조와 기능의 손상으로 인해 발생하는 심근병증의 일종입니다. 질병의 진행이 길어짐에 따라 당뇨병성 심장 질환 모델은 장기 고혈당 하에서 당뇨병 모델에 의해 자연적으로 개발될 수 있습니다 18,19,20. 침술 전처리는 당뇨병이 형성된 후 명백한 심근 손상이 형성되기 전에 마우스를 전처리하는 것을 말합니다. 그러나 실험적 자극을 반복한 후 생쥐는 종종 움직이기 어려워지며, 폭력적인 실험적 조작 기법은 생쥐에게 부상을 입히거나 조증 또는 우울증을 유발할 수 있다21. 따라서, 마우스를 고정시키기 위한 적절한 방법이 필요하다. 일반적으로 사용되는 마우스 고정화 방법에는 마취와 스트래핑이 포함된다22. 마취 방법이 경혈을 더 잘 노출시킬 수 있지만 신경 전도에 영향을 미치고 궁극적으로 실험 결과에 영향을 미칠 수 있습니다. 스트래핑 방법은 물리적 고정 방법이며 마취와 동일한 생리학적 효과를 나타내지는 않지만, 결합된 마우스는 상당한 긴장, 근육 긴장도 증가 및 향상된 배변을 경험하게 됩니다22,23. 또한 바늘이 원하는 위치에 쉽게 도달 할 수 없습니다. 여기에서는 전기침술 치료 중 쥐가 움직이지 않도록 하고 경혈을 노출시켜 전기침 치료가 편리하고 안전하며 비폭력적으로 후유증 없이 시행될 수 있도록 사용할 수 있는 마우스 전기침 고정장치를 소개합니다.
이 기사에서는 마우스 전기 침술 고정 장치의 제작과 당뇨병성 심근병증의 마우스 모델 구축에 대해 자세히 설명합니다. 당뇨병성 심근병증을 Biaoben 경혈 전기침술 전처리로 치료하고, 마우스 고정장치에서 그 작동이 어떻게 실현되는지를 시연하고, 당지질 대사와 관련된 지표를 측정하여 당뇨병성 심근병증에 대한 Biaoben 경혈 전기침술 전처리의 치료 효과를 평가했습니다.
프로토콜
모든 동물 실험은 동물 윤리의 3R 원칙을 준수하며 후베이 중국 전통 의학 대학의 동물 실험 윤리 위원회(윤리 허가 번호 HUCMS00309300)의 검토 및 승인을 받았습니다. 여기서, 30 SPF 등급 마우스는 후베이 성 질병 통제 예방 센터 (품질 인증서 NO.42010200009690)에서 얻었습니다.
1. 전기침술 정착 장치의 제작
- 전기침술 고정기구를 조립하기 위해서는 투명한 아크릴 중공 플라스틱 튜브와 전기침술 치료 기구를 본체로 구한다(그림 1A). 튜브에서 튜브 본체를 유지하고 양쪽 끝의 개구부에 위치한 폐쇄 탭을 준비합니다. 각 끝 중앙에 있는 속이 빈 튜브에 홈을 만들고 수동으로 회전 가능한 나사를 사용하여 양쪽 끝의 홈에 있는 폐쇄 탭을 고정합니다.
- 속이 빈 튜브의 중간에 길이 약 2cm, 너비 1cm 정도의 타원형 구멍 3개를 서로 인접하게 분포시킵니다. 양쪽에 있는 구멍은 앞다리의 전기침술 치료를 위한 고정을 위해 마우스의 앞다리를 뽑아내는 데 사용되며, 중간에 있는 구멍은 흉부 및 복부 부위의 전기 침술 치료를 위해 마우스의 흉부 및 복부 부위의 경혈을 노출하는 데 사용할 수 있습니다.
- 속이 빈 튜브의 끝에서 중앙 홈의 양쪽에 대칭으로 분포된 타원형 구멍을 만들어 뒷다리의 전기 침술 치료를 위해 마우스의 뒷다리를 뽑는 데 사용할 수 있습니다(그림 1B).
- 속이 빈 플라스틱 튜브의 무결성을 확인하고 폐쇄 탭을 설치하십시오. 나사가 홈으로 미끄러질 때 튜브 본체의 닫힘 탭을 이동하여 마우스의 길이에 맞게 고정 길이를 조정할 수 있는지 확인합니다.
- 전기 침술 요법 기구를 켜고 작동 중인지 확인하십시오. 각 버튼은 한 번 눌러 조정할 수 있습니다(그림 1C).
- 생쥐에게 전기침술 치료를 수행하기 위해 속이 빈 플라스틱 튜브 옆에 놓을 전기 침술 치료 기구를 준비합니다. 전기 침술 치료 도구는 전기 침술 치료 기계와 여러 쌍의 에너지 클립으로 구성됩니다. 각 쌍의 에너자이징 클립은 에너자이징의 두 극을 제공할 수 있습니다.
- 클립을 사용하여 바늘 손잡이를 자르고 바늘에 전원을 공급하는 경우 클립을 사용하여 바늘을 고정하십시오.
- 전기 침술 요법 기계에는 11개의 버튼이 있습니다. 상위 5를 사용하여 전기 침술의 주파수, 시간 및 파형을 설정하고 주파수, 시간, 연속파, 희소 및 조밀파, 간헐파에 대해 왼쪽에서 오른쪽으로 사용됩니다. 아래쪽 6을 사용하여 전기 침술의 현재 강도를 설정합니다. 이러한 각 버튼에는 에너지 클립을 부착하기 위한 노치가 아래에 있습니다. 에너자이징 클립의 수는 마우스의 수에 따라 최대 6개까지 증가하거나 감소할 수 있습니다.
2. 당뇨병성 심근병증의 마우스 모델 구축
- 30마리의 마우스를 난수 표 방법에 따라 통제 그룹, 모델 그룹, 전처리 그룹의 3개 그룹으로 나누고 각 그룹에는 10마리의 마우스가 있습니다. 당뇨병성 심근병증의 모델을 확립하기 위해 모델 그룹과 전처리 그룹에서 총 20마리의 마우스를 대상으로 합니다. 전처리 그룹을 Biaoben 경혈 전기 침술로 치료합니다.
참고: 이 모델은 장기간에 걸쳐 구축되었으며 16주 후에 심각한 심근병증이 발생합니다. 치료 시간은 36일째부터 70일까지(6주차부터 10주차까지)입니다. 이 치료법은 당뇨병이 발병한 후 심각한 심근 손상이 발생하기 전에 선택되었습니다. 6주가 지난 후, 쥐의 심장을 제거했고 상당한 당뇨병성 심근병증이 있는 것으로 밝혀졌습니다. 따라서 이 시점에서 처리의 선택은 전처리의 범주에 속합니다. - 대조군의 쥐에게 16주 동안 일반 차우를 먹이십시오. 모델 그룹과 전처리 그룹의 마우스에게 16주 동안 고지방 및 고설탕 식단을 먹이어 당뇨병 상태와 매우 유사한 대사 상태를 유도합니다. 고지방 및 고당 사료 구성은 67.0% 표준 차우, 10.0% 라드, 2.5% 콜레스테롤, 20.0% 자당 및 0.5% 담즙염입니다.
- 마우스 당뇨병성 심근병증 모델을 확립하기 위해 복강내 스트렙토조토신 용액을 주입합니다.
- 29일째에 스트렙토조토신 1% 용액을 준비합니다. 구연산과 시트르산삼나트륨(pH = 4.4)을 혼합하여 제조된 완충액에 스트렙토조토신을 용해합니다.
- 29일째 12시간 동안 물만 제공하고 음식은 제공하지 않습니다. 그런 다음 아래 설명된 대로 각 마우스에 150mg/kg의 스트렙토조토신 용액을 복강내 1회 주사합니다.
- 오른손으로 마우스의 꼬리를 잡고 케이지 밖으로 이동합니다. 케이지 표면에 마우스를 놓고 꼬리를 부드럽게 당겨 빼냅니다. 왼손으로 마우스를 움직이지 못하게 하고 뒤집어 복부를 노출시킵니다.
- 이미 회수된 적절한 양의 Streptozotocin 용액으로 준비된 1mL 주사기를 오른손으로 마우스에 복강내 주사합니다.
- Biaoben 경혈에 의한 침술 치료를 수행합니다.
- Biaoben 경혈13 의 이론에 따라 양측 PC6 및 ST36을 포함한 경혈을 선택합니다. 전처리 그룹의 경우, 36일째에 침술을 시행하고, 격일에 한 번씩 총 18회 치료를 시행하며, 치료는 총 5주(36일째부터 70일까지; 그림 2).
- 비아오 경혈: Biao 경혈로 양측 PC6을 선택합니다. PC6는 손목 관절에서 약 3mm 떨어진 척골-방사형 봉합사 사이의 앞다리 내측에 위치합니다. 벤 경혈: 벤 경혈로 양측 ST36을 선택합니다. ST36은 무릎 관절의 후측방, 비골 결절 아래 약 2mm에 위치합니다.
- 쥐를 잡고 꼬리를 꼬집어 케이지 표면에 놓습니다. 아크릴 속이 빈 플라스틱 튜브의 입구를 수평면에 대해 30° 각도로 유지하고 중앙의 작은 구멍이 지면을 향하고 튜브의 입구가 마우스의 머리와 정렬되도록 합니다.
- 마우스의 머리를 튜브 입에 수용합니다. 자발적인 움직임과 약간의 밀기를 사용하여 마우스의 머리를 튜브 안으로 천천히 돌립니다. 마우스의 엉덩이를 부드럽게 두드려 마우스가 자율적으로 완전히 튜브 안으로 밀어 넣도록 합니다.
- 닫힘 탭을 조정하고, 홈에서 마우스의 꼬리를 들어 올리고, 너트를 조이고, 위쪽과 아래쪽 끝에 있는 닫힘 탭을 사용하여 마우스의 움직임을 제한합니다. 이 시점에서 마우스는 더 이상 튜브 본체에서 자유롭게 움직일 수 없습니다.
- 핀셋을 사용하여 양쪽에 있는 4개의 작은 구멍 각각에서 마우스의 4개의 팔다리를 부드럽게 당겨 빼냅니다. 작은 구멍에서 네 개의 팔다리를 빼낸 후 튜브 본체 바깥쪽에 부드럽게 고정합니다. 이 시점에서 쥐의 네 팔다리는 더 이상 이동할 수 없었습니다.
- 일회용 스테인리스 바늘 손잡이(0.3mm×13mm)를 오른손의 엄지와 검지로 잡고 왼손으로는 아크릴 튜브와 그 안에 꼼짝도 하지 않는 마우스를 잡습니다.
- 오른손 가운데 손가락으로 PC6 및 ST36이 있는 위치를 터치하고 찾은 다음 바늘 끝으로 마우스의 피부를 부드럽게 찌릅니다. 비스듬히 주입 한 바늘을 3mm 전후로 빠르게 삽입하고 오른손을 빠르게 제거합니다.
- Biaoben 경혈13 의 이론에 따라 양측 PC6 및 ST36을 포함한 경혈을 선택합니다. 전처리 그룹의 경우, 36일째에 침술을 시행하고, 격일에 한 번씩 총 18회 치료를 시행하며, 치료는 총 5주(36일째부터 70일까지; 그림 2).
- 전기침술 전처리 수행
- 전기 침술 요법 기계를 켜고 간헐적 인 1Hz로 조정합니다. 각 마우스에 대해 15분 동안 전기 침술 치료를 수행합니다.
- 전기 침술 요법 기계의 일치하는 동력 클립을 사용하여 바늘 손잡이를 잡고 바늘 손잡이 하나에 클립 하나를 잡습니다.
- 클립이 부착된 버튼의 전류를 1mA로 조정합니다(그림 3).
- 15분 동안 기다렸다가 전기침술 전처리 중 쥐의 상태를 관찰합니다.
- 시술이 끝나면 클립을 풀고 침을 제거합니다. 닫힘 탭을 조정하고 전기 침술 고정 장치에서 마우스를 분리합니다.
- 생쥐의 몸 전체를 검사하고 생쥐가 다쳤거나 이상이 있는지 관찰합니다.
- 스트렙토조토신 용액을 주입한 후 7일째 후 격일로 침 치료를 실시하여 36일째부터 70일까지 마우스 전기침 요법으로 총 18회 치료를 실시합니다.
- 112일째(16주차 종료)에 실험을 종료합니다.
- 2% 펜토바르비탈 나트륨의 복강내 주사로 마취하고 발가락 꼬집음 반응으로 마취를 확인합니다. 심장초음파를 사용하여 마우스의 심장 기능을 측정합니다.
- 좌심실 이완기 말단 직경(LVEDD), 좌심실 수축기 말단 직경(LVESD), 좌심실 박출률(LVEF) 및 좌심실 분획 단축(LVFS)을 기록합니다.
- 안락사 자궁 경부 탈구에 의한 쥐. 심장을 제거하고 생리식염수로 씻어낸 다음 4% 파라포름알데히드에 담그십시오.
- 2% 펜토바르비탈 나트륨의 복강내 주사로 마취하고 발가락 꼬집음 반응으로 마취를 확인합니다. 심장초음파를 사용하여 마우스의 심장 기능을 측정합니다.
3. Hematoxylin-eosin (HE) 염색
- 심장을 탈수, 내장, 절단, 탈왁스 및 표준 절차에 따라 HE 염색을 수행합니다.
- 광학 현미경으로 쥐 심장 조직의 병리학적 변화를 관찰합니다.
4. 생쥐에 대한 관찰
- 27일, 36일, 49일에 혈당 측정기를 사용하여 혈당을 측정합니다.
- 생쥐가 얼마나 많이 먹는지 관찰하고, 매일 수분 섭취량과 배뇨량을 정량화하고, 체중 변화를 기록합니다.
5. 통계 분석
- 혈당 데이터를 수집하고 일원 ANOVA를 사용하여 통계적 유의성을 식별합니다. 통계적 유의성을 p < 0.05로 설정합니다.
- 실험 조건에 대해 알지 못하는 조수에 의해 데이터를 정량화합니다. 데이터를 평균 ± 표준 편차로 표현합니다.
결과
우리는 위에서 설명한 절차를 따라 당뇨병성 심근병증의 마우스 모델을 확립했습니다. HE로 염색된 사진(그림 4)에서 볼 수 있듯이, 대조군의 마우스는 온전한 심근 조직 구조, 심근세포의 규칙적인 배열, 뚜렷한 병변이 없었습니다. 모델군에서는 심근세포가 불규칙하게 배열되었고, 일부 심근세포가 손상 및 분해되었으며(검은색 화살표), 간질에서 명백한 염증성 세포 침투가 관찰되었습니다(노란색 화살표). 모델 그룹의 마우스는 심근 손상이 있는 것으로 제안됩니다. 전처리군에서는 마우스의 심근 조직 구조가 명확하고, 심근 세포가 불규칙하게 배열되어 있으며, 소수의 심근 세포가 손상 및 분해되었으며(검은색 화살표), 다른 명백한 병변은 관찰되지 않았습니다. 이에 비해 대조군의 심근 조직에는 뚜렷한 병변이 없었고, 모델 그룹의 심근 조직 손상이 더 심각했다. 전처리군의 심근조직 손상 정도는 모델군보다 유의하게 낮았다. 이는 전처리 치료가 심근 손상을 줄일 수 있음을 시사합니다.
심초음파검사의 심장 기능 지수(그림 5)는 대조군에 비해 모델군의 좌심실 확장말단 용적량과 좌심실 수축기말 용적이 유의하게 증가했으며, 모델군의 좌심실 박출률과 좌심실 분획 단축이 유의하게 감소한 것으로 나타났다. 그 차이는 통계적으로 유의했다(P < 0.05). 모델 그룹의 마우스는 심근 수축기 및 이완기 기능이 감소하고 심장 형태 및 구조가 비정상인 것으로 제안되었습니다24,25. 모델군과 비교했을 때, 전처리군에서 좌심실 확장말단 직경과 좌심실 수축기 말단 직경이 유의하게 감소하였고, 전처리군에서 좌심실 박출률과 좌심실 분획 단축이 유의하게 증가하였다. 그 차이는 통계적으로 유의했다(P < 0.05). 전처리군에서 마우스의 심장 기능이 향상되었음을 시사한다. 이는 당뇨병성 심근병증 모델이 모델 그룹에서 성공적으로 확립되었으며 전처리 치료가 심장 기능을 향상시킬 수 있음을 보여주었다26.
마우스 전기침 고정 장치를 조립하고 전기 침술 치료 기구를 연결하여 그림 3과 같이 전기 침술을 수행합니다. 마우스는 양측 PC6 및 ST36을 니들링하는 동안 아크릴 플라스틱 튜브에 갇혀 있었고 투명 튜브를 통해 마우스를 항상 관찰할 수 있었습니다.
치료 중, 생쥐가 고정 장치에서 조용히 전기 침술을 받는 것을 관찰할 수 있었습니다. 풀려난 후 쥐는 스트레스 반응이 없었고 찢어지지 않았으며 케이지 안에서 빨리 뛰지 않았습니다. 이는 마우스 전기침술 고정 장치의 안전성과 반복성을 시사합니다.
스트렙토조토신 용액을 7일 동안 주입한 후 모델군과 전처리군의 마우스는 과도한 식수, 식사, 배뇨, 체중 감소와 같은 당뇨병과 관련된 증상을 보였습니다. 대조군과 비교했을 때, 36일째에 모델 및 전처리군의 혈당이 유의하게 높았고, 그 차이가 유의했으며(p < 0.05), 이는 당뇨병성 심장질환 마우스의 모델링이 성공적이었음을 나타낸다. 전기침술 요법을 완료한 후, 모델군과 비교했을 때, 전처리군에 속한 마우스의 혈당은 49일째에 유의하게 감소하였다. 그 차이는 유의미했는데(p < 0.05), 이는 Biaoben 경혈 전기침술 전처리 후 혈당이 현저히 감소했음을 나타냅니다(그림 6). 이는 전처리 요법이 혈당 수치를 효과적으로 조절하고 고혈당을 개선하여 심근 세포 손상을 완화하며 당뇨병성 심근병증을 개선할 수 있음을 보여주었습니다. 또한 마우스 전기 침술 고정 장치 보조 전기 침술 치료의 타당성을 입증했습니다.

그림 1: 전기침술 고정 장치의 구성. (A) 아크릴 중공 플라스틱 튜브는 튜브 본체와 양쪽 끝의 개구부에 위치한 폐쇄 탭으로 구성됩니다. 클로저 탭은 수동으로 회전 가능한 나사로 양쪽 끝의 홈에 고정됩니다. 튜브의 길이는 11cm, 지름은 3cm입니다. (B) 중앙 홈의 양쪽에 대칭으로 분포된 4개의 타원형 구멍이 있습니다. (C) 전기 침술기에는 11개의 버튼이 있습니다. 상위 5개는 전기 침술의 주파수, 시간 및 파형을 설정하는 데 사용되며 왼쪽에서 오른쪽으로 주파수, 시간, 연속파, 희소 및 조밀파, 간헐파를 설정합니다. 아래쪽 6개는 전기 침술의 현재 강도를 설정하는 데 사용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 실험의 흐름 및 시점. 대조군의 쥐는 16주 동안 일반 차우를 먹였습니다. 모델 그룹과 전처리 그룹의 마우스는 16주 동안 고지방 및 고설탕 식단을 먹였고 29일째에 스트렙토조토신 용액을 주입했습니다. 그 후 격일로 침 치료를 받았으며, 36일째부터 70일까지 마우스 전기 침술 고정 장치에 대한 총 18번의 치료가 이루어졌습니다. 그리고 112일째에 실험을 끝냈습니다. 생쥐에서 전기침 고정 장치의 타당성을 확인하기 위해 29일, 36일, 49일에 각 그룹에서 생쥐의 혈당을 검출했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 전기침술 고정 장치를 사용한 마우스의 전기침술. 전기 침술 요법 기계를 시작하고 전류를 1mA, 간헐파, 1Hz 및 15분으로 조정합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
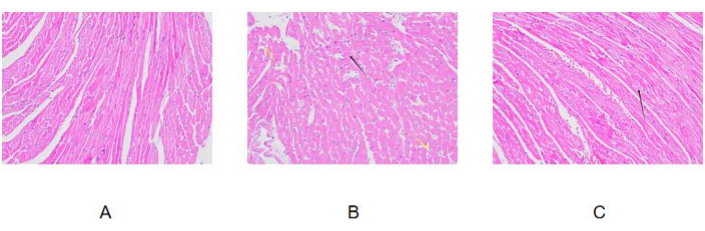
그림 4: HE 염색 결과. (A) 대조군; (B) 모델 그룹; (C) 전처리 그룹. 이미지는 200x로 촬영되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 각 그룹에 있는 마우스의 심장 기능 지수. (A) 좌심실 확장기 말단 직경(LVEDD); (B) 좌심실 수축말 직경(LVESD); (C) 좌심실 박출률(LVEF); (D) 좌심실 분획 단축(LVFS). 그래프는 평균 ± 표준 편차(n = 10)를 보여줍니다. 통계적 유의성은 일원 분산 분석(one-way ANOVA)을 사용하여 계산되었습니다. 대조군과 비교했을 때, ##P는 0<. 01; 모델 그룹 **P < 0.01과 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 27일, 36일, 49일에 각 마우스 그룹의 혈당 변화. 그래프는 평균 ± 표준 편차(n = 10)를 보여줍니다. 통계적 유의성은 일원 분산 분석(one-way ANOVA)을 사용하여 계산되었습니다. 대조군과 비교했을 때, ##P는 0<. 01; 모델 그룹 **P < 0.01과 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 연구에서는 혈당이 높고 당뇨병 징후를 보이는 마우스를 스트렙토조토신 용액의 복강내 주사로 수득하였는데, 이는 효과적이고 인정받는 모델링 방법이다27. PC6은 Biao point로, ST36은 Biaoben 경혈 이론에 따라 Ben point로 선택되었습니다28. 이 모든 지점은 마우스의 팔다리에 있으므로 복부를 노출시키고 팔다리를 고정시킬 수 있는 아크릴 튜브는 이 지점을 바늘로 고정하는 데 적합합니다. 쥐를 튜브 본체에 삽입하여 고정하고 니들링 후 전기 침술 치료를 위해 전기 침술 장치를 켰습니다. 전기침술로 치료한 국소 근육이 약간 떨리는 것을 관찰할 수 있는데, 이는 정상이며 부작용이 없습니다.
침술은 중국 전통 의학에서 중요한 도구로서 당지질 대사를 조절하고 염증 반응을 개선하여 당뇨병성 심근병증을 치료합니다29,30. 전기침술은 일반적으로 사용되고 정량적으로 시행되는 침술 요법 방법 중 하나이며, 당뇨병성 심근병증의 임상 치료에 널리 사용된다31. 전기침술은 침술 부위에 간헐적인 파동 형태의 전기 신호를 전달하여 지속적으로 침술에 자극을 주고 침술의 치료 효과를 향상시킵니다. 본 연구에서는 PC6을 Biao point로, ST36을 Ben point로 선정하였다. 그 중 PC6는 당뇨병성 심근병증이 있는 마우스의 심근 리모델링과 수축기 및 이완기 기능을 개선할 수 있으며 ST36은 산화 스트레스를 줄이고 인슐린 저항성을 개선하며 포도당 및 지질 대사 수준을 높일 수 있습니다. 전기 침술 요법과 병용하여 당뇨병성 심근병증 치료 목적을 달성합니다32. 본 실험에서 전기침술 전처리군의 마우스는 36일째부터 49일째까지 대조군의 마우스에 비해 혈당이 낮고 과도한 음주, 식사, 배뇨 등의 당뇨병 증상이 감소했다. 전처리가 혈당 수치를 조절하고 혈당을 줄여 심근 손상을 완화할 수 있음을 보여줍니다. 2주간의 치료 기간 동안 마우스 전기침술이 기존 마우스 코트보다 더 편리하고 안전하여 치료 효율이 크게 향상되는 것을 관찰했습니다. 이는 전기침술 요법을 보조하는 마우스 전기침술 고정 장치의 타당성을 보여줍니다.
현재 전기침술 치료 중 생쥐는 집에서 만든 생쥐 슈트를 사용하여 움직이지 못하게 되는데, 이는 생쥐를 만들고 사용하는 것이 불편하다33. 전기 침술 고정 장치는 전기 침술 치료를 위해 쥐의 팔다리를 빠르고 부드럽게 고정시킬 수 있습니다. 이 장치는 더 빠르고 안전하며 쥐를 동요시킬 가능성이 적고 자극, 무는 것 및 죽음을 피하여 동물의 복지와 실험자의 안전을 보호합니다. 마우스가 튜브 내벽을 심하게 긁거나 몸이 경련하는 등의 비정상적인 상태가 나타나면 이모빌라이저를 풀고 마우스를 제거한 다음 마우스를 평평한 탁상이나 마우스 케이지 프레임에 놓고 마우스를 진정시키면 이상이 빠르게 해결됩니다. 또한, 등과 같은 신체의 다른 부분에 있는 경혈이 니들링을 위해 필요한 경우, 이는 마우스의 진입 시 아크릴 튜브의 위치를 변경하기만 하면 달성할 수 있습니다. 이 장치의 한계는 마우스가 튜브 본체에 갇혀 복부, 등, 팔다리의 경혈만 노출되고 머리는 아크릴 튜브와 마개 시트로 둘러싸여 있기 때문에 머리에 위치한 경혈에 잘 작동하지 않는다는 것입니다. 또한 이 장치는 토끼, 개와 같은 대형 동물보다는 생쥐에 적합합니다. 앞으로 이 장치는 전기 침술로 마우스를 더 쉽게 치료하고 실험의 효율성을 개선하며 마우스와 실험자 모두의 안전을 보호하기 위해 널리 사용할 수 있도록 구현될 수 있습니다.
요약하면, 본 실험에서는 마우스 전기침술 고정장치를 제작하는 방법론에 대한 자세한 설명을 제공한다. 이 장치는 전기 침술 요법을 제공하기 위해 쥐의 복부와 팔다리에 있는 경혈을 노출시키고 고정시킵니다. 마우스 전기침 고정 장치의 사용은 당뇨병성 심근병증 마우스에 대한 전기침술 치료를 더 잘 사용하고 분석하는 데 도움이 되며 당뇨병성 심근병증에 대한 침술 치료의 탐구에 더 많은 가능성을 제공합니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 작업은 후베이 자연과학 재단 공동 프로젝트 2022CFD024의 보조금으로 지원됩니다. 중국 국립 자연 과학 재단, No. 81704142; 후베이 중국 전통 의학 대학 2023 더블 일류 건설 핵심 특별 과학 연구 프로젝트, 2023ZZXT005; 후베이성 중국 의학국의 핵심 프로젝트에서 심근 허혈-재관류 손상(MIRI)이 있는 쥐에서 심근 세포의 페롭토시스를 조절하기 위한 Biaoben 경혈 전기 침술 전조건의 메커니즘을 연구하기 위해, ZY2025D001; 우한 과학기술국의 지식 혁신 프로젝트, No. 2023020201010172; Hubei Shi Zhen Talent Engineering Project, E Wei Han [2024]256.
자료
| Name | Company | Catalog Number | Comments |
| acrylic hollow plastic | Henan Zhike | ZK-GDQ | |
| acupuncture needle | Hwato | 0.3 mm x 13 mm | |
| C57BL/6 mice | Hubei Provincial Center for Disease Control and Prevention | ||
| citric acid monohydrate | Sigma | C1909 | |
| electroacupuncture therapy instrument | Hwato | SDZ-V | |
| electronic balance | Henan Zhike | ZK-DST | |
| glucose meters | LifeScan | OneTouch VerioVue | |
| glucose test strip | LifeScan | OneTouch Verio | |
| streptozotocin | Sigma | S0130 | |
| trisodium citrate dihydrate | Sigma | W302600 | |
| tweezers | Labshark | 130302001 |
참고문헌
- Dillmann, W. H. Diabetic cardiomyopathy. Circ Res. 124 (8), 1160-1162 (2019).
- Murtaza, G., et al. Diabetic cardiomyopathy - a comprehensive updated review. Prog Cardiovasc Dis. 62 (4), 315-326 (2019).
- Peng, M. L., et al. Signaling pathways related to oxidative stress in diabetic cardiomyopathy. Front Endocrinol. 13, 907757(2022).
- Tong, M., et al. Mitophagy is essential for maintaining cardiac function during high fat diet-induced diabetic cardiomyopathy. Circ Res. 124 (9), 1360-1371 (2019).
- Jia, G., Demarco, V. G., Sowers, J. R. Insulin resistance and hyperinsulinaemia in diabetic cardiomyopathy. Nat Rev Endocrinol. 12 (3), 144-153 (2016).
- Nakamura, K., et al. Pathophysiology and treatment of diabetic cardiomyopathy and heart failure in patients with diabetes mellitus. Int J Mol Sci. 23 (7), 3587(2022).
- Ye, Y., et al. Acupuncture reduces hypertrophy and cardiac fibrosis, and improves heart function in mice with diabetic cardiomyopathy. Cardiovasc Drugs Ther. 34 (6), 835-848 (2020).
- Zhou, X. L., et al. Effect of acupuncture-moxibustion stimulation of combined "biao-ben" acupoints on autonomic nervous activity and related factors in rats with irritable bowel syndrome diarrhea. Zhen Ci Yan Jiu. 48 (7), 635-642 (2023).
- Chen, Q., Liang, F., Wu, S., Lu, W., Wang, H. Theoretic exploration and clinical application of acupoint combination based on biaoben theory. Zhongguo Zhen Jiu. 38 (5), 5053-5059 (2018).
- Chen, J., et al. Protective effect and mechanism of electroacupuncture of "biao-ben" acupoints combination for mitochondrial dysfunction in diabetic nephropathy rats. Zhen Ci Yan Jiu. 47 (9), 759-768 (2022).
- Wang, K. X., et al. Effect of electroacupuncture of "biao-ben" acupoints on renal function and hemorheology and enos level in patients with early diabetic nephropathy. Zhen Ci Yan Jiu. 47 (1), 46-52 (2022).
- Zhang, M., et al. Acupuncture at pc6 prevents cardiac hypertrophy in isoproterenol-treated mice. Acupunct Med. 37 (1), 55-63 (2019).
- Chen, Q., et al. Protective effect and metabonomics research of "biao-ben acupoint combination" electroacupuncture in chronic myocardial ischemia model rats. Zhen Ci Yan Jiu. 43 (11), 698-704 (2018).
- Pulinilkunnil, T., et al. Cardiac-specific adipose triglyceride lipase overexpression protects from cardiac steatosis and dilated cardiomyopathy following diet-induced obesity. Int J Obes (Lond). 38 (2), 205-215 (2014).
- Sverdlov, A. L., et al. High fat, high sucrose diet causes cardiac mitochondrial dysfunction due in part to oxidative post-translational modification of mitochondrial complex ii. J Mol Cell Cardiol. 78, 165-173 (2015).
- Marino, F., et al. Streptozotocin-induced type 1 and 2 diabetes mellitus mouse models show different functional, cellular and molecular patterns of diabetic cardiomyopathy. Int J Mol Sci. 24 (2), 1132(2023).
- Ren, B. C., et al. Curcumin alleviates oxidative stress and inhibits apoptosis in diabetic cardiomyopathy via sirt1-foxo1 and pi3k-akt signalling pathways. J Cell Mol Med. 24 (21), 12355-12367 (2020).
- Wang, H., et al. Inhibition of fatty acid uptake by tgr5 prevents diabetic cardiomyopathy. Nat Metab. 6 (6), 1161-1177 (2024).
- Wang, R., et al. Fibroblast growth factor 21 improves diabetic cardiomyopathy by inhibiting ferroptosis via ferritin pathway. Cardiovasc Diabetol. 23 (1), 394(2024).
- Xu, H., et al. Types of cell death in diabetic cardiomyopathy: Insights from animal models. Acta Biochim Biophys Sin (Shanghai). , (2024).
- Miyamoto, T., et al. Repeated cold stress enhances the acute restraint stress-induced hyperthermia in mice. Biol Pharm Bull. 40 (1), 11-16 (2017).
- Zhang, H. X., Wang, D. J., Yu, J. C., Han, J. X. Effect of the restriction on the efficacy of acupuncture in mice. Zhen Ci Yan Jiu. 34 (6), 429(2009).
- Chen, H. C., et al. Sub-acute restraint stress progressively increases oxidative/nitrosative stress and inflammatory markers while transiently upregulating antioxidant gene expression in the rat hippocampus. Free Radic Biol Med. 130, 446-457 (2019).
- Marwick, T. H., et al. Echocardiographic phenotypes of diabetic myocardial disorder: Evolution over 15 months follow-up in the arise-hf trial. Cardiovasc Diabetol. 24 (1), 16(2025).
- Fiordelisi, A., et al. L-arginine supplementation as mitochondrial therapy in diabetic cardiomyopathy. Cardiovasc Diabetol. 23 (1), 450(2024).
- Li, J. P., et al. Nlrp3 inflammasome-modulated angiogenic function of epc via pi3k/ akt/mtor pathway in diabetic myocardial infarction. Cardiovasc Diabetol. 24 (1), 6(2025).
- Racine, K. C., et al. The high-fat diet and low-dose streptozotocin type-2 diabetes model induces hyperinsulinemia and insulin resistance in male but not female c57bl/6j mice. Nutr Res. 131, 135-146 (2024).
- Wu, F., et al. Effects of moxibustion of "biaoben acupoint combination" on heart rate variability, atrial natriuretic peptide in the model rats of ibs-d complicated with anxiety. Zhongguo Zhen Jiu. 43 (10), 1139-1147 (2023).
- Zhang, S., et al. Research progress on the mechanism of acupuncture on type II diabetes mellitus. Zhen Ci Yan Jiu. 49 (6), 641-649 (2024).
- Zhang, Z., et al. Acupuncture-assisted lifestyle intervention improve the metabolic status and spontaneous brain activity of type 2 diabetes mellitus patients: A randomized, clinical trial. Diabetol Metab Syndr. 16 (1), 255(2024).
- Jia, X., et al. "Adjusting internal organs and dredging channelon" electroacupuncture glycolipid metabolism disorders in nafld mice by mediating the ampk/acc signaling pathway. Diabetol Metab Syndr. 16 (1), 173(2024).
- Li, S., Wang, S., Feng, X., Chang, Y., Yan, D. Biao and ben acupoints regulate mitochondrial function through p2x receptor to improve myocardial ischemia. Altern Ther Health Med. 29 (4), 43-51 (2023).
- Guo, J., et al. A new mouse-fixation device for iop measurement in awake mice. Vision Res. 219, 108397(2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유