Method Article
Mechanotransduction-driven, human-like hypertrophic scarring의 마우스 모델
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 인간과 같은 흉터를 시뮬레이션하기 위해 기계 전달 신호를 증가시키는 비대성 흉터 쥐 모델을 설정하는 방법을 설명합니다. 이 방법은 마우스의 치유 절개 부위를 가로질러 기계적 장력을 증가시키고 특수 장치를 사용하여 상세한 조직학 및 생물 정보학 분석을 위해 재현 가능한 과도한 흉터 조직을 만드는 것을 포함합니다.
초록
비대성 흉터(HTS)는 과도한 흉터 조직 형성을 초래하는 비정상적인 상처 치유 과정입니다. 지난 10년 동안 우리는 기계적 자극을 세포 반응으로 전환하는 메카노트랜스덕션(mechanotransduction)이 과도한 섬유성 흉터 치유를 유도한다는 것을 입증했습니다. 인간과 유사한 비대성 흉터를 평가하기 위한 마우스 모델은 다양한 치료법과 흉터를 줄이고 치유를 개선하는 능력을 검사하는 데 필수적인 도구가 될 것입니다. 특히, 우리 연구실은 인간과 같은 HTS를 촉진하기 위해 기계적 변형을 증가시키는 쥐 상처 모델을 개발했습니다. 이 프로토콜은 변형된 13mm 구개 확장기로 만든 생체 역학적 로딩 장치를 사용하며, 팔은 절개 부위의 양쪽에 배치되고 점진적으로 분산되어 치유 중에 상처 부위에 지속적인 장력을 가합니다. 거의 20년 동안 사용되어 온 이 모델은 효능과 재현성을 개선하기 위해 크게 발전했습니다. 쥐 HTS 모델을 사용하면 유의한 피부 섬유성 흉터를 인간의 비후성 흉터와 조직학적으로 비교할 수 있도록 유도할 수 있습니다. 이 쥐 모델은 HTS 및 이물질 반응과 같은 기계 전달 관련 조건의 치료와 관련된 생물학적 제제를 개발할 수 있는 환경을 제공합니다.
서문
상처 치유는 신체가 손상된 조직을 복구하고 피부 장벽을 재건하려고 시도하는 과정으로, 지혈, 염증, 증식 및 재형성 과정이 불규칙한 경우 비정형 치유를 초래할 수 있습니다1. 비대성 흉터(HTS)는 불규칙한 상처 치유의 한 예로, 손상 부위에 세포외 기질과 결합 조직이 과도하게 침착되어 흉터 조직 영역이 확대되는 것을 특징으로 합니다 1,2,3. 관절 주변이나 얼굴과 같이 반복적인 기계적 스트레칭 자극을 받는 신체 부위는 HTS와 섬유증이 발생하기 쉽습니다 4,5,6,7,8,9,10. 본 연구진과 다른 연구진은 상처 부위를 기계적으로 늘리는 것이 기계적 자극을 세포 반응으로 전환하는 기계전달 경로(mechanotransduction pathways)의 활성화를 통해 HTS 형성을 촉진한다는 것을 보여주었다 9,11.
HTS는 복잡한 생물학적 과정을 포함할 뿐만 아니라 영향을 받는 사람들에게 심각한 사회적, 의학적, 경제적 문제를 수반합니다. 영향을 받은 개인은 자존감과 우울증으로 어려움을 겪을 수 있으며, 특히 흉터가 얼굴과 손과 같은 눈에 보이는 부위에 있을 때 1,9,10,12. 과학적 문헌고찰 논문에 따르면 HTS의 유병률은 미국에서 32%에서 72% 사이로 다양하다고 합니다10,13. 특히 안면 부위에 심각한 화상을 입은 경우, 이러한 미적 우려의 심각성은 외모 개선을 위한 안면 이식 사례가 증가함에 따라 강조된다10. 이러한 흉터는 움직임을 제한하여 기능 장애를 유발할 수 있으며6,14 흉터를 절제하고 이동성을 회복하기 위해 종종 외과적 개입이 필요합니다10. HTS 치료 비용은 수술, 치료, 물리 치료 또는 장기 치료 비용을 포함하여 상당할 수 있습니다 1,10. 미국에서만 HTS 치료에 드는 연간 비용이 40억 달러를 초과합니다10.
HTS의 만연과 합병증을 해결하기 위해 취해진 극단적인 조치를 고려할 때, 기존 치료법(예: 외과적 절제술, 코르티코스테로이드 주사, 레이저 요법)은 여전히 매우 다양하다1,2,15,16,17. 이러한 치료법은 경우에 따라 완화를 제공할 수 있지만 흉터 병리학의 복잡한 특성으로 인해 충분하지 않을 수 있습니다. 개인들 간의 유전적 차이와 HTS를 유발하는 메커니즘에 대한 불완전한 이해와 같은 요인으로 인해 치료 전략은 임상적으로 불만족스러운 상태로 남아 있다 18,19,20. HTS 치료의 미래는 과도한 섬유성 흉터 치유를 유도하는 것으로 광범위하게 입증된 메카노트랜스덕션11,21과 같은 HTS의 세포 기계론적 동인을 표적으로 하는 새롭고 혁신적인 접근법에 있는 것으로 보입니다 5,6,7,8,11,21,22,23,24,25. 구체적으로, 우리는 이전에 인간과 같은 HTS9를 촉진하기 위해 상처 기계적 변형을 증가시키는 쥐 모델을 개발했습니다. 그러나 거의 20년 동안 사용된 후 이 모델은 효능과 재현성을 개선하기 위해 크게 발전했습니다. 이 프로토콜을 통해 연구자들은 업데이트되고 최적화된 HTS 마우스 모델을 최대한 활용하여 과도한 흉터 뒤에 있는 세포 집단과 동인을 탐색할 수 있습니다. 이 방법의 전반적인 목표는 쥐에서 인간과 유사한 비대성 흉터를 생성하도록 설계된 프로토콜을 연구자에게 제공하는 것입니다.
프로토콜
모든 실험에 대해 University of Arizona Institutional Animal Care and Use Committee(IACUC)의 승인을 받았습니다(통제 번호: 2021-0828). 이 프로토콜은 15주 된 C57BL/6J 수컷 마우스를 사용하지만 다른 연령 및 균주에 적용할 수 있습니다 9,26.
1. HTS 생체 역학적 로딩 장치 생성
참고: 구개 확장기를 HTS 장치로 수정하는 것은 실험 전 어느 시점에서나 발생할 수 있습니다.
- 수정되지 않은 구개 확장기를 가져 와서 그림 1A, B에 따른 사양으로 makerspace core 또는 fabrication core에 제시하십시오.
참고: 메이커스페이스 또는 제작 코어를 사용할 수 없는 경우 다음 단계를 계속합니다. - MUB(Mini Universal Bender) 와이어 굽힘 도구를 사용하여 그림 1A, B의 사양을 준수하도록 구개 확장기를 변경합니다.
- 그림 1A1과 같이 장치를 표면에 평평하게 놓습니다.
- 그림 90A1에서 볼 수 있듯이 장치가 MUB와 함께 평평하게 놓일 때 위쪽 팔의 경우 팔을 90° 위로, 아래쪽 팔의 경우 아래쪽 팔을 아래로 90° 구부립니다. 그림 1A3을 참조하여 암이 이제 장치 본체와 완벽하게 평행이 되는 표면에 평평하게 놓일 때 장치의 모양입니다.
- 그림 1A4에서 볼 수 있듯이 점선의 축을 따라 각 암을 90° 페이지로 다시 구부립니다. 구부린 후 장치에 대해서는 그림 1A5를 참조하십시오.
2. 수술 후 0일차 제모 및 초기 절개(POD 0)
알림: 수술 전에 여러 세트의 수술 도구(예: 해부 가위, 메스, Adson 겸자, 바늘 드라이버)를 세척하고 오토클레이브합니다. 사용할 수 있도록 멸균된 5-0 봉합사를 준비하고 수술용 마커를 준비합니다.
- 70% 에탄올 스프레이로 작업 공간을 청소하십시오.
- 수술 전 준비 테이블에 35°C로 설정된 가열 패드를 놓습니다. 발열 패드 위에 흡수 패드를 테이프로 감습니다. 이전 패드 위에 다른 흡수 패드를 놓습니다(면도한 모발을 모으기 위해). 흡수 패드에 마취 원뿔(또는 원뿔)을 테이프로 붙입니다.
참고: [선택 사항] 탁상용 흄 추출기를 사용할 수 있는 경우 원뿔을 작업 공간 근처에 놓고 흡입을 켭니다. - 마우스가 침착하게 숨을 쉴 때까지(2-3분) 1-3% 이소플루란과 2L/min 산소 흐름으로 마취 유도실에 마우스를 놓습니다.
- 각 마우스의 코를 콧방울 구멍에 삽입하여 1-3% 이소플루란과 2L/min의 산소로 구성된 마취를 흡입할 수 있습니다. 발가락 꼬집음에 대한 반응이 없어 적절한 마취를 확인하십시오. 안과 윤활 연고를 마우스의 눈에 바르십시오.
- 전기 면도기를 사용하여 그림 1C와 같이 해당 부위의 등쪽 털을 면도합니다.
- 장갑을 낀 손가락이나 면봉으로 제모 페이스트를 피부에 바르고 면도한 부위를 덮습니다. 45초 후 거즈와 알코올 면봉으로 페이스트를 닦아냅니다. 다른 알코올 면봉으로 등쪽을 닦아 제모 페이스트를 제거하고 털이 없는 패치를 남깁니다(그림 1C).
참고: 적당량의 페이스트를 사용하고, 페이스트를 즉시 제거하고, 페이스트를 제거한 후 마우스를 닦아 제모 페이스트로 인한 피부 화상을 방지하는 것이 중요합니다. 쥐 피부는 얇아서 쥐의 건강과 실험 품질 모두에 해로운 영향을 미칠 수 있는 급격한 화학적 화상에 취약합니다. - 귀 태그 식별을 위해 마우스를 표시합니다.
- 털을 제거한 후 마우스를 케이지에 다시 넣어 과도한 이소플루란 노출을 방지합니다. 마우스를 모니터링합니다.
- 머리카락으로 덮인 상단 흡수 패드를 제거하여 깨끗한 수술 전 활력 운동 공간을 만드십시오.
- 별도의 수술 작업 공간을 설정하십시오. 수술 테이블에 35°C로 설정된 가열 패드를 놓습니다. 발열 패드 위에 흡수 패드를 테이프로 감습니다. 흡수 패드에 마취 원뿔(또는 원뿔)을 테이프로 붙입니다.
- 마우스가 침착하게 숨을 쉴 때까지(2-3분) 2-4% 이소플루란과 2L/min 산소 흐름으로 마취 유도실에 마우스를 놓습니다.
- 인덕션 챔버에서 마우스를 꺼내 작동 표면에 놓습니다. 각 마우스의 코를 콧방울 구멍에 삽입하여 1-3% 이소플루란과 2L/min의 산소로 구성된 마취를 흡입할 수 있습니다. 발가락 꼬집음에 대한 반응이 없어 적절한 마취를 확인하십시오. 안과 윤활 연고를 마우스의 눈에 바르십시오.
- 수술 후 통증 치료를 위해 21G 바늘을 사용하여 0.05mg/kg 서방형 부프레노르핀을 어깨에 피하로 주사합니다.
- 요오드/클로르헥시딘 기반 스크럽과 알코올 면봉을 번갈아 가며 세 번 사용하여 마우스의 등쪽을 소독합니다. 수술용 마킹 펜과 자를 사용하여 그림 1D와 같이 전체 두께를 절개할 등 쪽 정중선에 2cm 선을 표시합니다.
- 메스 또는 절개 가위(수술 선호)를 사용하여 표시된 부위를 통해 전체 두께의 등쪽 정중선을 절개합니다.
알림: 그림 1D에서 볼 수 있듯이 기본 조직(예: 근육)을 절단하지 않도록 주의하십시오. - 간단한 중단 패턴으로 5-0 봉합사를 사용하여 그림 1D와 같이 상처를 이등분하여 절개 부위를 닫습니다. 최소 5개의 균일한 간격으로 봉합사를 사용하십시오.
- 텔파 거즈를 3cm x 1cm 조각으로 자릅니다. 폼 접착 드레싱의 중앙에 놓고 그림 1D와 같이 거즈가 절개 부위를 덮도록 마우스 등쪽에 접착 드레싱을 놓습니다. 복부에 반으로 자른 드레싱을 놓고 등쪽 드레싱과 만날 때까지 둘레로 감습니다.
- 드레싱이 완료되면 마우스를 별도의 멸균 케이지에 넣고 마취제에서 완전히 회복될 때까지 모니터링합니다.
- 실험 그룹에 관계없이 모든 마우스에 대해 절차를 반복합니다. 다음 단계를 수행하기 전에 절개 부위가 4일 동안 치유되도록 합니다.
3. HTS 생체역학적 로딩 장치(POD 4) 배치
알림: 수술 전에 HTS 장치와 여러 세트의 수술 도구(예: 해부 가위, 메스, Adson 집게, 바늘 드라이버, 피부 스테이플러, 피부 스테이플)를 세척하고 고압증기멸균하십시오. 멸균된 5-0 봉합사를 사용할 수 있도록 준비합니다. [선택 사항] 탁상용 흄 추출기를 사용할 수 있는 경우 원뿔을 작업 공간 근처에 놓고 흡입을 켭니다.
- 2.1단계와 2.2단계에 설명된 대로 수술 부위를 준비합니다.
- 마우스를 마취하고 2.11-2.13 단계에 따라 진통제를 제공합니다.
- 집게 또는 바늘 드라이버를 사용하여 도구를 복부 쪽에 대해 좌우로 작업하여 마우스의 복부에서 드레싱을 분리합니다. 가죽에서 드레싱을 들어 올리기 위해 랩과 피부 사이에 도구를 남겨두고 가위를 사용하여 드레싱을 잘라냅니다.
알림: 마우스 피부를 자르거나 드레싱을 찢어버리거나 치유 절개 부위를 방해하지 않도록 주의하십시오. - 알코올 면봉으로 등쪽을 청소하십시오. 절개 부위에 상처 탈구나 감염 징후가 있는지 검사합니다.
- HTS 장치가 확장/확장되지 않고 그림 1B와 같이 가장 축소된 형태인지 확인합니다. 장치의 팔에 의료용 접착제를 가볍게 코팅하십시오.
- 한 손으로 마우스 등쪽의 피부를 가로 방향으로 약간 팽팽하게 만듭니다. 다른 한편으로, 절개 부위가 HTS 장치의 각 팔에서 등거리가되도록 HTS 장치를 마우스 등쪽에 올려 놓음으로써 절개 부위의 중앙에 장치를 놓습니다. HTS 장치의 팔 사이의 피부가 균일하게 팽팽한지 확인하십시오. 그림 30A와 같이 접착제가 마를 때까지(~2초) 장치를 제자리에 고정합니다.
알림: 장치를 사용하여 절개 부위에 동일한 양의 장력이 가해지도록 피부를 균일하게 팽팽하게 유지하는 것이 중요합니다. 장치를 배치하는 과정에서 피부에 기계적 장력이 추가되어 치유 절개 부위를 다시 열 수 있으므로 이 과정에서 봉합사를 그대로 두십시오. 봉합사는 상처가 봉합된 상태로 유지되도록 스트레칭 첫날까지 제자리에 남아 있습니다. - 그림 2B와 같이 각 팔 주위와 피부를 통해 4개의 봉합사를 고정합니다. 봉합하는 동안 바늘이 절개 부위를 향해 피부를 빠져나오는지 확인하십시오.
알림: 장치의 절개 쪽에서 바늘을 삽입하면 피부에 구멍을 뚫는 데 필요한 힘으로 인해 절개 부위가 찢어질 수 있습니다. - 이제 그림 2B와 같이 팔 주위와 피부를 통해 세 개의 스킨 스테이플을 놓고 HTS 장치를 피부에 고정합니다.
- 2.17 및 2.18 단계에 따라 마우스에 붕대를 감습니다.
- 실험 그룹에 관계없이 모든 마우스에 대해 절차를 반복합니다.
참고: 모든 마우스는 동일한 제제를 받습니다. 그러나 실험 설계에서 마우스의 편향되지 않은 분포를 보장하기 위해 각 실험 그룹(예: 대조군, 스트레치)에 무작위로 할당됩니다. 특히, 대조군 마우스와 스트레치 마우스 모두 등쪽에 장치를 부착합니다. 대조군 마우스의 장치는 그대로 유지되고 스트레치 마우스는 다음 단계를 거칩니다.
4. HTS 생체역학적 로딩 장치(POD 5)의 초기 신장
알림: 수술 전에 여러 세트의 수술 도구(예: 해부 가위, 메스, Adson 집게, 바늘 드라이버)를 세척하고 오토클레이브합니다. [선택 사항] 탁상용 흄 추출기를 사용할 수 있는 경우 원뿔을 작업 공간 근처에 놓고 흡입을 켭니다.
- 귀 태그를 통해 각 마우스를 원하는 그룹에 무작위로 할당합니다. 대조군 마우스의 경우 절개 부위의 봉합사를 제거하고 상처 드레싱을 교체하기만 하면 됩니다(1-6단계, 8-9단계). 원하는 경우, 스트레칭 시 장치를 제거하고 흉터 크기를 추적하기 위한 저울 측정 도구로 사진을 찍습니다.
- 수술 부위를 준비하고, 마우스를 마취하고, 3.1-3.4단계를 수행하여 드레싱을 제거합니다.
알림: 드레싱이 찢어지거나 치유 절개 부위를 방해하지 않도록 주의하십시오. HTS 장치의 암이 피부에서 분리된 경우 제자리에 가볍게 접착제를 붙이고 분리의 크기에 따라 피부 스테이플 또는 봉합사를 추가합니다. - 해부 가위 또는 다른 선택한 방법으로 상처에서 봉합사를 제거하십시오.
- HTS 장치 키를 장치에 삽입하고 그림 2C와 같이 피부가 팽팽하지만 피부가 찢어질 위험이 없을 때까지 장치를 돌려 확장합니다.
알림: 이 초기 산만함은 장치의 팔 사이의 피부가 헐거워질 수 있으므로 키를 약 4-8바퀴 완전히 돌려야 할 수 있습니다. - 2.17 및 2.18 단계를 수행하여 마우스에 붕대를 감습니다.
5. HTS 생체 역학적 로딩 장치의 후속 확장(POD 7, 9, 11, 13, 15, 17)
알림: 수술 전에 여러 세트의 수술 도구(예: 해부 가위, 메스, Adson 집게, 바늘 드라이버)를 세척하고 오토클레이브합니다. [선택 사항] 탁상용 흄 추출기를 사용할 수 있는 경우 원뿔을 작업 공간 근처에 놓고 흡입을 켭니다.
- 대조군 마우스의 경우 상처의 드레싱을 변경하기만 하면 됩니다(1-5단계, 13-14단계). 원하는 경우 스트레칭 시 장치를 제거하고 흉터 크기를 추적하기 위해 저울 측정 도구로 흉터 사진을 찍습니다.
- 3.1-3.4단계에 따라 수술 부위를 준비하고 마우스를 마취하고 드레싱을 제거합니다.
참고: HTS 장치의 암이 피부에서 분리된 경우 제자리에 붙이고 분리의 크기에 따라 피부 스테이플 또는 봉합사를 추가하십시오. - HTS 장치 키를 장치에 삽입하고 피부가 팽팽해지지만 피부가 찢어질 위험이 없을 때까지 장치를 돌려 확장합니다.
알림: 이것은 약 4바퀴 또는 총 ~2mm의 산만함이 필요할 수 있습니다. 장치가 최대 확장에 도달하여 더 이상 확장할 수 없는 경우 5.4-5.7단계를 수행하여 새 장치를 분리하고 다시 연결하십시오. 그렇지 않으면 2.17 및 2.18 단계를 수행하여 마우스에 붕대를 감습니다. - 장치가 최대 확장에 도달한 경우 스테이플 제거제로 스테이플을 제거하거나 스테이플의 갈래를 열어 가위로 마우스를 들어 올려 마우스의 등쪽에서 장치를 제거합니다. 그런 다음 봉합사를 제거하고 장치를 조심스럽게 제거하십시오.
- 메스, 알코올 면봉, 종이 타월로 장치를 청소하십시오. 청소를 돕기 위해 장치를 70% 에탄올에 ~20분 동안 담그십시오. 그런 다음 키를 사용하여 장치를 가장 얇은 형태로 축소합니다.
- 3.5-3.8단계에 따라 HTS 장치를 다시 연결합니다.
- 2.17 및 2.18 단계에 따라 마우스에 붕대를 감습니다.
6. HTS 조직 채취(POD 19)
참고: 조직 채취는 공정의 어느 지점에서나 이루어질 수 있습니다. 우리는 초기 시점을 검사하기 위해 단 4일 동안 스트레칭 후 조직을 채취했습니다. 그러나 조직은 POD 19(균주 시작 후 2주 후)에서 가장 일관되게 수확됩니다. 수술 전에 여러 세트의 수술 도구(예: 해부 가위, 메스, Adson 겸자)를 세척하고 오토클레이브합니다. 시간 경과에 따른 흉터 사진을 얻으려면 각 스트레칭 단계 전에 장치를 제거하여 장치를 다시 적용하고 기계적 변형을 다시 시작하기 전에 흉터 사진을 찍을 수 있습니다. [선택 사항] 탁상용 흄 추출기를 사용할 수 있는 경우 원뿔을 작업 공간 근처에 놓고 흡입을 켭니다. 벤치탑 흄 추출기는 이소플루란 가스가 더 이상 사용되지 않을 때 꺼질 수 있습니다.
- 3.1-3.4단계에 따라 수술 부위를 준비하고 마우스를 마취하고 드레싱을 제거합니다.
- 경추 탈구를 통해 마우스를 희생합니다.
알림: 피부를 잡아당기거나 마우스의 등쪽이 찢어지지 않도록 주의하십시오. - 해부 가위나 피부 스테이플 제거제를 사용하여 피부 스테이플을 제거합니다. 봉합사를 잘라냅니다. 피부가 찢어지지 않도록 주의하면서 HTS 장치를 부드럽게 제거합니다.
- 메스나 가위를 사용하여 HTS 흉터 주위의 피부를 자릅니다. 원하는 방식으로 조직학적 분석을 위해 피부를 보존합니다.
참고: 피부를 전사체 또는 단백질 분석(예: qPCR, 웨스턴 블롯, 단세포 분석)에 사용하는 경우 주변의 건강한 조직의 양을 최소화하기 위해 HTS 흉터 조직만 절제해야 합니다. 이렇게 하면 분석에서 흉터 조직만 캡처할 수 있습니다. - 메스로 HTS 장치를 깨끗이 긁습니다. 70% 에탄올이 함유된 비커에 장치를 넣어 남아 있는 접착제나 조직을 부드럽게 합니다.
알림: 70% 에탄올에 담근 후 장치는 고압증기멸균 전에 추가로 닦고, 긁어내고, 청소해야 할 수 있습니다.
7. 평균 흉터 너비 측정
참고: 이 작업은 이미지 분석 소프트웨어 ImageJ를 사용하여 수행되었으며 정보는 스프레드시트에 기록되었습니다.
- ImageJ에서 이미지를 엽니다. 폴리곤 도구로 흉터의 가장자리를 추적합니다. analyze(분석) | measure(측정 )를 클릭하여 이 영역을 측정합니다.
참고: 흉터는 변색과 모낭이 없는 것으로 식별할 수 있습니다. - 세그먼트 도구를 사용하여 흉터의 끝에서 끝까지 길이를 측정합니다. 분석 | 측정을 클릭하여 이 길이를 측정합니다.
- 세그먼트 도구를 사용하여 그림에서 1cm 또는 기타 표준화된 길이 단위의 길이를 측정합니다. 분석 | 측정을 클릭하여 이 길이를 측정합니다.
- 스프레드시트를 사용하여 흉터의 면적 (픽셀 단위, px)을 흉터의 길이 (px 길이)로 나눕니다. 이 결과는 평균 흉터 너비를 픽셀 단위로 제공합니다.
- 이 결과를 측정된 표준 길이 단위 (px 길이)로 나눕니다. 결과는 실험에 사용된 표준 길이 단위(예: cm)의 평균 흉터 너비가 됩니다.
결과
HTS 프로토콜의 효과적인 사용을 명확하게 입증하고 성공적인 "긍정적인" 결과를 식별하기 위해 그림 3A와 같이 모델을 설정했습니다. 대표적인 연구에서는 두 그룹이 있었습니다: No Stretch Control(n = 6) 및 Mechanical Stretch HTS 그룹(n = 6)은 절개 부위를 가로질러 인간과 유사한 수준의 기계적 변형을 유도하여 그림 3B,C에서 볼 수 있듯이 HTS를 생성했습니다. 그림 3A-C에 제시된 실험 계획 내에서, POD 5, 9, 15, 19의 흉터에 대한 총체적인 사진이 촬영되었다. 흉터는 ImageJ로 추적되었으며 서로 다른 시점에서 흉터의 평균 너비를 분석했습니다(그림 3D). 평균 흉터 너비는 그림 3E에서 시간과 그룹 간에 대해 그래프로 표시되었습니다. 스트레치와 컨트롤 간에 흉터가 크게 다르지 않은 POD 5에 기계적 변형을 적용한 후, 스트레치 그룹은 대조군보다 훨씬 더 넓은 흉터를 보였으며 POD 9에서 0.99mm의 최대 너비에 도달했습니다(p = 0.045). 대조군에 비해 흉터 너비가 현저히 넓어졌으며 POD 15(p = 0.043) 및 19(p = 0.045)에서 계속되었습니다. HTS 장치가 흉터의 적절한 촬영을 방해하기 때문에 HTS 장치를 제거해야 하는 날(즉, HTS 장치가 최대 팽창에 도달하여 다시 부착해야 하거나 제거하는 동안)에만 총 사진을 촬영하는 것이 좋습니다. 이 프로토콜에서는 여러 시점에 걸친 이미지 및 흉터 너비 분석을 통해 판독기가 모델의 상처 진행 상황을 보다 명확하게 볼 수 있습니다.
HTS 조직의 분석은 섬유성 마커에 대한 IHC 염색, 조직학적 흉터 영역을 검사하기 위한 H&E 및 Trichrome 염색, 흉터의 콜라겐 구조를 평가하기 위한 picrosirius red 염색 및 상처 분석을 위한 기타 방법과 같은 여러 가지 방법으로 수행될 수 있습니다. 8,21,24,25,27,28 (그림 4). 그림 4는 융기된 흉터 조직(그림 4A), 부속 구조 및 모낭의 손실(그림 4B), 기계적 로딩 방향의 콜라겐 섬유 정렬(그림 4C) 및 콜라겐 소용돌이(그림 4F)와 같은 HTS 조직의 조직학적 특징을 보여줍니다. 또한 그림 4는 쥐 HTS의 비만 세포 밀도 및 혈관 구조에 대한 면역조직화학적 염색을 보여주고 이를 인간 HTS 조직과 비교합니다(그림 4D,E,G,H). 또한, 조직을 채취 및 준비하여 절제 직후 생물정보학 코어로 가져가는 경우 HTS 흉터를 단세포 분석으로 분석할 수 있습니다.

그림 1: HTS 장치 및 마우스의 등쪽 준비. (A) HTS 장치를 만들기 위한 13mm 구개 확장기의 변형 과정, (1) 초기 확장기 구조를 보여주고, (2) 장치가 평평하게 놓일 때 팔의 경우 위쪽 팔의 경우 위쪽으로, 아래쪽 팔의 경우 아래쪽 팔의 경우 아래로 90° 굽힘, (3) 이제 팔이 장치의 몸체와 완벽하게 평행한 초기 굽힘의 결과, (4) 측정과 함께 최종 장치를 형성하기 위해 팔을 구부리는 것; 암은 (90) 최종 장치에서 볼 수 있듯이 페이지 안으로 5° 구부러져야 합니다. (B) 확장되지 않은 각도와 확장된 각도에서 완전히 조립된 HTS 장치. (C) 마우스의 등받이를 준비하기 위한 순차적 단계: (1) 털이 있는 초기 상태, (2) 면도 후, (3) 제모 페이스트 도포 후. (D) 등쪽 절개 절차: (1) 절개 부위에 2cm 가이드라인 표시, (2) 절개, (3) 상처 봉합, (4) 텔파 거즈 적용, (5) 접착 드레싱으로 고정. (E) (1) 절개 부위 및 (2) 절개 부위를 봉합한 후의 전체적인 사진. 약어 : HTS = 비대성 흉터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: HTS 장치 위치 지정 및 스트레칭. (A) 절개 부위와 적절한 정렬을 보장하기 위해 마우스의 등쪽에 HTS 장치를 올바르게 배치하는 그림. 왼쪽 이미지는 후방 위치에서 본 장치 배치를 보여줍니다. 오른쪽 이미지는 측면으로 본 장치 배치를 보여줍니다. (B) HTS 장치의 부착 그림: (1) 초기 배치, (2) 봉합사 위치, (3) 피부 스테이플 위치. (C) 라벨이 붙은 HTS 장치 키로 HTS 장치를 늘리는 시연: (1) 시작 구성, (2) 장력 적용, (3) 비대성 흉터 형성을 촉진하기 위해 치유 절개 부위에 일관된 기계적 변형을 가하도록 설계된 최종 확장 상태, 2mm 확장 적용. (D) HTS 장치 키에 라벨이 표시된 HTS 장치에 장력을 가하는 총 사진. (E) 붕대를 완전히 감은 쥐의 거친 사진. 약어 : HTS = 비대성 흉터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
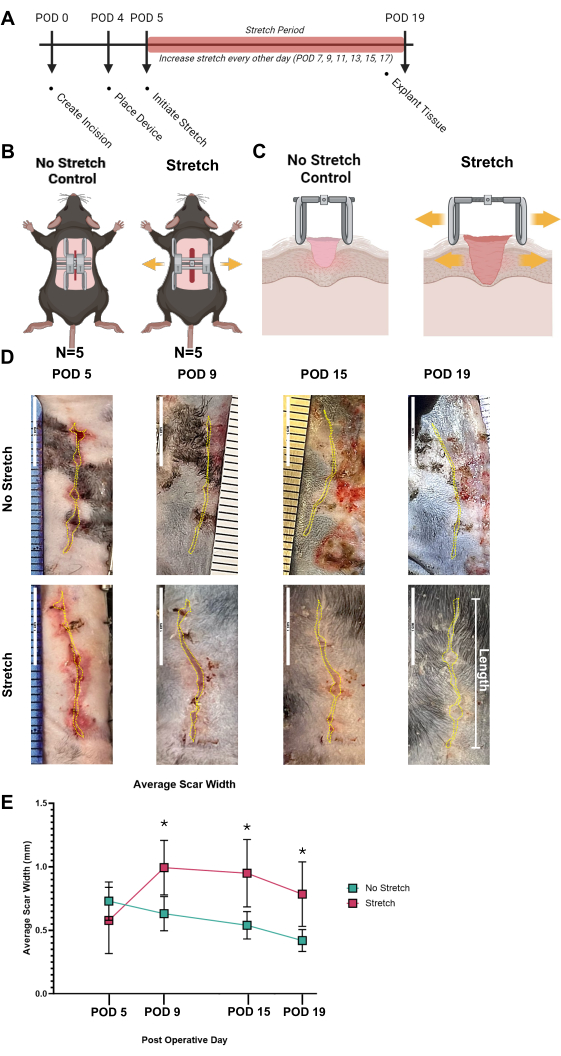
그림 3: 흉터를 발생시키기 위한 기계적 변형의 적용. (A) 절개 부위(POD 0) 생성부터 기계적 변형 적용(POD 4) 및 스트레칭 기간(POD 5에서 POD 19까지)을 거쳐 조직 이식(POD 19)에 이르는 실험 절차의 타임라인. (B) 두 그룹의 그림: 스트레치 제어 없음 및 기계적 스트레치 HTS 그룹. (C) No Stretch Control과 Stretch HTS 그룹 간의 조직 반응 차이를 나타내는 단면 개략도. (D) 수술 후 며칠(POD 5, 9, 15, 19)에 No Stretch Control 및 Stretch HTS 그룹의 흉터를 대표하는 총 이미지로, 비후성 흉터는 노란색 점선으로 표시되어 있습니다. (E) 시간 경과에 따른 평균 흉터 너비의 정량적 분석, No Stretch와 Stretch 그룹 간의 흉터 발달에 상당한 차이가 있음을 보여주며, 오차 막대는 표준 편차를 나타냅니다. 중요한 차이점은 별표(*)로 표시됩니다. 통계 분석은 양방향 분산 분석(ANOVA)을 사용하여 수행되었습니다. *p < 0.05의 값은 통계적으로 유의한 것으로 간주되었습니다. 약어: HTS = 비대성 흉터; POD = 수술 후일. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 흉터의 조직학. 이 쥐 흉터 조직학은 이전에 발표된 연구9,26에서 2주간의 기계적 스트레스 후 수확되었습니다. (A) 더 큰 이미지는 흉터 단면의 H&E 조직학적 이미징을 보여주고, 오른쪽 하단은 흉터 단면의 트리크롬 조직학적 이미징으로 흉터 영역이 어떻게 올라가는지를 보여줍니다. (B) 더 큰 이미지는 흉터 단면의 H&E 조직학적 이미징을 보여주고, 오른쪽 하단은 흉터 단면의 트리크롬 조직학적 이미징으로, 흉터 영역이 부속기 구조와 모낭의 손실을 어떻게 보여주는지 보여줍니다. (C) 더 큰 이미지는 흉터 단면의 피크로시리우스 적색 이미징을 보여주고, 오른쪽 하단은 흉터 단면의 트리크롬 조직학적 이미징으로, 기계적 하중 방향으로 정렬된 콜라겐 섬유를 보여줍니다. (D) 더 큰 이미지는 쥐 HTS 조직에서 CD117 면역조직화학의 이미징을 보여주고, 오른쪽 하단은 인간 조직에서 CD117 면역조직화학의 이미징을 보여주며, 인간 HTS 조직과 유사한 비만 세포 밀도를 보여줍니다. (E) 더 큰 이미지는 쥐 HTS 조직에서 혈관 구조의 CD31 면역조직화학의 이미징을 보여주고, 오른쪽 하단은 인간 조직에서 CD117 면역조직화학의 이미징을 보여주며, 이는 인간 HTS 조직과 유사한 비만 세포 밀도를 보여줍니다. (F) 오른쪽 하단 이미지에서 성숙한 인간 비후성 흉터에서 볼 수 있는 콜라겐 소용돌이는 쥐 H&E 이미징에서 원으로 표시된 영역에서 24주 후에 로드된 쥐 흉터에서도 볼 수 있습니다. (G) 대조군 (절개 + 스트레치 없음), 스트레치 컨트롤 그룹 (절개 없음 + 스트레치) 및 스트레치 HTS 그룹의 흉터의 대표적인 총 이미지. (H) 대조군(절개 + 스트레치 없음)과 스트레치 HTS 그룹을 비교한 면역조직화학을 보여줍니다. 섬유화 마커 pEPF, aSMA 및 YAP에 DAPI와 함께 공동 염색을 사용하면 HTS 그룹에서 섬유 마커가 증가합니다. A-F 는 Aarabi, S. et al.9에서 각색되었습니다. G,H 는 Mascharak, S. et al.에서 각색되었습니다. FASEB26 의 허가를 받아 재인쇄했습니다.약어: HTS = 비대성 흉터; H&E = 헤마톡실린 및 에오신; pEPF = Engrailed-positive 섬유아세포; aSMA = 알파-평활근 액틴; YAP = 예 관련 단백질; DAPI = 4',6-디아미디노-2-페닐린돌. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
HTS 마우스 모델은 메카노트랜스덕션(mechanotransduction)을 통해 HTS를 유도하고 잠재적인 치료법을 개발하기 위한 비용 효율적이고 재현성이 높은 방법입니다. 모델을 효과적으로 사용하기 위한 초기 학습 곡선이 있지만, 프로토콜은 수술 훈련 없이 모든 연구자가 연습을 통해 수행할 수 있습니다. 이 모델을 사용하면 연구자들이 HTS 형성과 상처 치유에서 기계 전달의 역할을 더 잘 이해할 수 있으며, 이는 환자 상처 치료의 가시적인 개선으로 이어질 수 있습니다. 이 프로토콜과 함께 제공되는 비디오 데모는 이상적으로 연구자의 학습 곡선을 줄이고 향후 연구에서 이 모델을 원활하게 구현할 수 있도록 합니다. 그러나 프로토콜에는 사용자의 명확성을 높이기 위해 추가 설명이 도움이 될 수 있는 여러 가지 중요한 단계가 있습니다.
프로토콜의 시작부터 시간순으로 진행되는 첫 번째 핵심 단계는 수술 후 0일차(POD 0)에 수술 절개 부위를 봉합하는 것입니다. 절개 부위는 피부층이 완벽하게 부착된 상태에서 완전히 닫혀야 한다29. 이는 절개 부위가 제대로 치유되고 장치를 놓고 상처 전체에 장력이 가해지면 열리지 않도록 하기 위한 것입니다. 상처가 벌어지면(탈구), 동물을 더 이상 실험에 사용해서는 안 됩니다.
HTS 장치를 POD 4에 배치할 때 마우스의 등쪽 전체에 동일한 양의 장력을 유지하는 것이 중요합니다. 장치를 적절하게 배치하면 가해지는 장력이 절개 부위 전체에 걸쳐 균일하게 유지되어 차선의 실험 결과(불균일한 흉터)를 초래할 수 있는 가변 힘 적용의 위험을 완화할 수 있습니다. 장치가 잘못 부착되면 절개 부위의 일부가 HTS를 유도하기 위해 격일로 평균 2mm의 주의를 산만하게 받지 못합니다. 장치를 확장하면 피부의 느슨함이 제거되고 팽팽하게 만들어야합니다. 동시에 상처가 쩍 줄어들 수 있는 장치의 과도한 확장을 방지하기 위해 주의를 기울여야 합니다. 장치를 여러 차례의 실험에 사용하면 장치를 확장 및 수축하기 위해 키를 배치하는 회전 기어가 느슨해질 수 있습니다. 이 경우 새 장치를 만들고 이전 장치를 폐기해야 합니다.
POD 5에서 긴장이 시작되면 흉터 예방을 위한 모든 요법이 시행되기 시작해야 합니다. 국소 연고와 같은 요법은 일반적으로 절개 부위에 분산시켜 긴장이 시작될 때 격일로 투여됩니다. 하이드로겔은 절개 부위에 유사하게 배치됩니다. 전신 요법은 꼬리 정맥을 통해 또는 후안와로 혈류에 주입할 수 있습니다.
POD 19의 흉터 주위 또는 흉터를 촬영하기 전에 면도 및/또는 제모 페이스트를 마우스의 등쪽에 가볍게 바르는 것이 좋습니다. 이렇게 하면 ImageJ를 사용하여 흉터 크기에 대한 가시성과 후속 분석이 향상됩니다. 또한 제모 페이스트를 사용할 때는 페이스트를 줄이고 시간을 단축하는 측면에서 실수를 저지르십시오. 마우스의 등쪽이 페이스트에 과도하게 노출되면 상처 치유 과정을 방해할 수 있는 화학적 화상을 입을 수 있습니다. 쥐의 피부는 사람의 피부보다 얇고 화학적 화상을 입기 쉽다30.
HTS 마우스 모델은 인간의 피부를 사용하지 않기 때문에 인간의 HTS를 완전히 재현할 수 없기 때문에 본질적으로 제한적입니다. 그러나 다른 동물 모델에 비해 상당한 물류 이점이 있습니다. 적절하게 수행된 이 마우스 HTS 모델은 신뢰할 수 있고 저렴하며 쉽게 수행할 수 있습니다. 생물학적으로 HTS는 기계적 신호의 물리적 증가를 통해 유도됩니다. 토끼에서 HTS의 다른 모델은 열 및 화학적 손상을 사용하여 귀나 등쪽에 HTS를 유도합니다 30,31,32. 토끼 귀의 복부 쪽에 있는 피부는 치유 중 피부 세포 외에 연골 세포 1,30과 같은 많은 세포를 포함하지 않습니다. 또 다른 방법은 돼지 껍질에 HTS 모델을 태우는 것이지만33 비용 및 취급 측면에서 물류적으로 어려울 수 있습니다. 돼지 모델은 인간 HTS를 재현하는 데 가장 유사할 것입니다. 그러나 초기 결과를 수집하는 데 비용이 많이 드는 방법입니다. 최종 HTS 모델은 절제된 인간 HTS 피부를 마우스에 이종 이식하는 것이지만, 이는 면역 반응을 유발할 수 있으며 새로운 흉터의 형성을 탐색하지 않습니다34.
동물 모델에서 HTS를 유도하는 위의 방법은 인간의 HTS 흉터가 형성되는 것과 같은 방식으로 신체의 자연 치유 반응을 적절하게 유발하지 않습니다. 대조적으로, 메카노트랜스덕션 기반 마우스 HTS 모델은 기계적 변형을 사용하여 비대성 흉터를 시작하며, 이는 인간 HTS 1,9,21을 밀접하게 반영합니다. 이 방법은 섬유증의 배후에 있는 기저 조직 생체 역학 및 세포 집단 동인을 포착하기 위해 기계 전달 신호의 생리학적 과정에 의존합니다. 이 모델은 기계적 전달 경로를 억제하거나 유도하기 위한 생물학적 표적을 연구하는 데 최적이며, 잠재적으로 새로운 중개 요법의 발견으로 이어질 수 있습니다.
공개
저자는 이 기사의 내용과 관련된 상충되는 이해관계나 기타 충돌이 없습니다.
감사의 말
이 연구는 National Institute of Dental and Craniofacial Research(U24 DE026914)(GCG)와 Plastic Surgery Foundation Translational Research Grant(837107)(K.C.)가 후원하는 Center for Dental, Oral, and Craniofacial Tissue and Organ Regeneration Interdisciplinary Translational Project Awards의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 mL PYREX Griffin beaker | Milipore Signma | CLS1000100 | |
| Aesculap Exacta mini trimmer | Aesculap | ||
| AutoClip System | Fine Surgical Instruments | 12020-00 | |
| BD brand isopropyl alcohol swabs | Fisher Scientific | 13-680-63 | |
| Buprenorphine SR (0.5 mg/mL) | Buprenex, Indivior Inc. | 12496-0757-1 | |
| C57/BL6 females (6–8 weeks old) | The Jackson Laboratory | 000664 | |
| Covidien sterile gauze | Fisher Scientific | 2187 | |
| Covidien TelfaTM non-adherent pads | Fisher Scientific, Covidien | 1961 | |
| Dental surgical ruler | DoWell Dental Products | S1070 | |
| Depilatory cream (Nair Hair Remover Lotion) | Church&Dwight, CVS | 339823 | |
| Ethanol 70% solution | Fisher Scientific | 64-17-5 | |
| Excel | Microsoft Cooperation | Microsoft.com | software program |
| ImageJ | ImageJ, Wayne Rasband | imagej.net | software program |
| Inhalation anesthesia system | VetEquip | 922130 | |
| Iris scissors 4½ in. stainless | McKesson | 43-2-104 | |
| Isoflurane, USP | Dechra Veterinary Products | 17033-094-25 | |
| Kaka industrial MUB-1 | Kaka Industrial | 173207 | Only necessary if there is no maker space or fabrication shop available |
| Leone Rapid Palatal Expander- 13 mm | Great Lakes Dental Technologies | 125-004 | The key necessary to expand and cotnract the device will come with this product in the box |
| Liquid repellent drape 75 x 90 cm with adhesive hole 6 x 9 cm | Omnia S.p.A. | 12.T4362 | |
| Medequip Depot Silk Black Braided Sutr 6-0 Rx | Medequip Depot D707N, Fisher Scientific | NCO835822 | |
| Needle holder 5 in. with serrated jaws | McKesson | 43-2-842 | |
| Prism 9 | GraphPad Holdings, LLC | graphpad.com | software program |
| Puralube ophthalmic ointment | Dechra, NDC | 17033-211-38 | |
| R studio Desktop | RStudio PBC | rstudio.com | software program |
| Surgical skin marker | McKesson | 19-1451_BX | |
| Tegaderm, 3 M | VWR | 56222-191 | foam adhesive dressing |
| Thermo-peep heating pad | K&H, Amazon | ||
| Tissue forceps 4¾ in. stainless 1 x 2 teeth | Mckesson | 43-2-775 | |
| Vetbond (3 M) | Saint Paul, MN | 1469SB |
참고문헌
- Mony, M. P., Harmon, K. A., Hess, R., Dorafshar, A. H., Shafikhani, S. H. An updated review of hypertrophic scarring. Cells. 12 (5), 678 (2023).
- Limandjaja, G. C., Niessen, F. B., Scheper, R. J., Gibbs, S. Hypertrophic scars and keloids: Overview of the evidence and practical guide for differentiating between these abnormal scars. Exp Dermatol. 30 (1), 146-161 (2021).
- Cao, X., Sun, L., Luo, Z., Lin, X., Zhao, Y. Aquaculture derived hybrid skin patches for wound healing. Engineered Regeneration. 4 (1), 28-35 (2023).
- Ishise, H., et al. Hypertrophic scar contracture is mediated by the trpc3 mechanical force transducer via nfkb activation. Sci Rep. 5 (1), 11620 (2015).
- Padmanabhan, J., et al. Allometrically scaling tissue forces drive pathological foreign-body responses to implants via rac2-activated myeloid cells. Nat Biomed Eng. 7 (11), 1419-1436 (2023).
- Kussie, H. C., et al. Avenanthramide and β-glucan therapeutics accelerate wound healing via distinct and nonoverlapping mechanisms. Adv Wound Care (New Rochelle). 13 (4), 155-166 (2024).
- Chen, K., et al. Disrupting biological sensors of force promotes tissue regeneration in large organisms. Nat Commun. 12 (1), 5256 (2021).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proc Natl Acad Sci USA. 115 (5), 986-991 (2018).
- Aarabi, S., et al. Mechanical load initiates hypertrophic scar formation through decreased cellular apoptosis. FASEB J. 21 (12), 3250-3261 (2007).
- Aarabi, S., Longaker, M. T., Gurtner, G. C. Hypertrophic scar formation following burns and trauma: New approaches to treatment. PLoS Med. 4 (9), e234 (2007).
- He, J., et al. Mechanical stretch promotes hypertrophic scar formation through mechanically activated cation channel piezo1. Cell Death Dis. 12 (3), 226 (2021).
- Weng, W., et al. Ellipsoidal porous patch with anisotropic cell inducing ability for inhibiting skin scar formation. Engineered Regeneration. 3 (3), 262-269 (2022).
- Lawrence, J. W., Mason, S. T., Schomer, K., Klein, M. B. Epidemiology and impact of scarring after burn injury: A systematic review of the literature. J Burn Care Res. 33 (1), 136-146 (2012).
- Ziolkowski, N., et al. Psychosocial and quality of life impact of scars in the surgical, traumatic and burn populations: A scoping review protocol. BMJ Open. 9 (6), e021289 (2019).
- Gauglitz, G. G., Korting, H. C., Pavicic, T., Ruzicka, T., Jeschke, M. G. Hypertrophic scarring and keloids: Pathomechanisms and current and emerging treatment strategies. Mol Med. 17 (1-2), 113-125 (2011).
- Fu, X., et al. Oxygen atom-concentrating short fibrous sponge regulates cellular respiration for wound healing. Advanced Fiber Materials. 5 (5), (2023).
- Fu, X., et al. Living electrospun short fibrous sponge via engineered nanofat for wound healing. Advanced Fiber Materials. , (2022).
- Fomovsky, G. M., Holmes, J. W. Evolution of scar structure, mechanics, and ventricular function after myocardial infarction in the rat. Am J Physiol Heart Circ Physiol. 298 (1), H221-H228 (2010).
- Macintyre, L., Baird, M. Pressure garments for use in the treatment of hypertrophic scars--a review of the problems associated with their use. Burns. 32 (1), 10-15 (2006).
- Brissett, A. E., Sherris, D. A. Scar contractures, hypertrophic scars, and keloids. Facial Plast Surg. 17 (4), 263-272 (2001).
- Chen, K., et al. Disrupting mechanotransduction decreases fibrosis and contracture in split-thickness skin grafting. Sci Transl Med. 14 (645), eabj9152 (2022).
- Ogawa, R., et al. Clinical applications of basic research that shows reducing skin tension could prevent and treat abnormal scarring: The importance of fascial/subcutaneous tensile reduction sutures and flap surgery for keloid and hypertrophic scar reconstruction. J Nippon Med Sch. 78 (2), 68-76 (2011).
- Chen, K., Henn, D., Gurtner, G. C. Holy grail of tissue regeneration: Size. Bioessays. 44 (9), e2200047 (2022).
- Sivaraj, D., et al. Nitric oxide-releasing gel accelerates healing in a diabetic murine splinted excisional wound model. Front Med (Lausanne). 10, 1060758 (2023).
- Chen, K., et al. Pullulan-collagen hydrogel wound dressing promotes dermal remodelling and wound healing compared to commercially available collagen dressings. Wound Repair Regen. 30 (3), 397-408 (2022).
- Mascharak, S., et al. Preventing engrailed-1 activation in fibroblasts yields wound regeneration without scarring. Science. 372 (6540), eaba2374 (2021).
- Fischer, K. S., et al. Protocol for the splinted, human-like excisional wound model in mice. Bio Protoc. 13 (3), e4606 (2023).
- Wang, P. H., Huang, B. S., Horng, H. C., Yeh, C. C., Chen, Y. J. Wound healing. J Chin Med Assoc. 81 (2), 94-101 (2018).
- Azmat, C. E. Wound closure techniques. Statpearls. , (2024).
- Tunca, M., et al. Cryosurgery to remove perichondrium for the rabbit ear hypertrophic scar model: A simplified method. Acta Dermatovenerol Alp Pannonica Adriat. 28 (2), 57-59 (2019).
- Sun, Q., et al. The effects of timing of postoperative radiotherapy on hypertrophic scar in a rabbit model. Med Sci Monit. 26, e921263 (2020).
- Zu, W., Jiang, B., Liu, H. Establishment of a long-term hypertrophic scar model by injection of anhydrous alcohol: A rabbit model. Int J Exp Pathol. 102 (2), 105-112 (2021).
- Molina, E. A., et al. Angiogenic gene characterization and vessel permeability of dermal microvascular endothelial cells isolated from burn hypertrophic scar. Sci Rep. 12 (1), 12222 (2022).
- Li, Z., et al. A highly simulated scar model developed by grafting human thin split-thickness skin on back of nude mouse: The remodeling process, histological characteristics of scars. Biochem Biophys Res Commun. 526 (3), 744-750 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유