Method Article
右後葉腫瘍に対する低侵襲解剖学的肝切除術におけるグリッソニアン椎弓根の末梢減算解剖
要約
右後肝葉に対するグリッソニアン椎弓根結紮術を含む低侵襲解剖学的肝切除術 (MIALR) は、腫瘍破裂、出血、および虚血再灌流障害 (IRI) を引き起こす可能性があります。この研究は、新しい外科的アプローチ、グリッソーニアン椎弓根の末梢減法解剖 (PSDGP) を提案しています。
要約
低侵襲解剖学的肝切除術(MIALR)は、近年大きな注目を集め、肝胆道外科の分野で急速に進歩しています。特に、杉岡淳のゲート理論のようなグリッソーニアンペディクルの解剖は、MIALRの基本的な操作技術を表しています。この技術は、Laennecカプセルの解剖学的構造に基づいており、それにより科学的に厳密な方法でMIALRを促進および実装しています。ただし、臨床診療のMIALR中に出血、虚血再灌流障害(IRI)、腫瘍破裂などの潜在的なリスクが発生する可能性があり、特にグリッソーン椎弓の分岐部近くの右後肝葉に位置する腫瘍に適用される場合(肺門胆管癌を除く)。これらの課題に対処するために、この研究では、グリッソーン椎弓根の末梢減法解剖 (PSDGP) と呼ばれる独自の外科的アプローチを導入します。 これらの潜在的な合併症を軽減するように設計されています。肝腫瘍に対する MIALR の PSDGP 手順では、嚢胞プレート アプローチを利用して肝外解離を促進します。最初に、非吸収性縫合糸は、非外傷性鉗子(または同様の器具)の指導の下でゲートVIからゲートIVに通されます。その後、非外傷性鉗子を再度ゲートVに通し、ゲートIVから非吸収性縫合糸を回収します。最後に、ゲートVとゲートVIの両方を使用して、右後部グリッソーニアンペディクルの分離を実現します。この方法は、腫瘍切除のノータッチおよび一括原則を厳守しているため、手術の成功率を向上させ、腫瘍学的転帰を改善する可能性があります。
概要
腹腔鏡下肝手術は、散発的な肝臓切除から精密な低侵襲解剖学的肝臓切除術(MIALR)へと進化し、30年以上にわたって継続的に研究され、開発されてきました。これは肝胆道外科の顕著な領域になり、近年かなりの注目を集めています1,2,3,4,5。この技術には、術野の視覚化と拡大の強化など、いくつかの利点があり、正確な外科手術が可能になります。グリッソーン椎弓根アプローチの正確な理解と洗練は、MIALRの基本的なスキルであり、安全性、効率性、および精度を確保します3,4,5。杉岡淳のゲート理論は、ラエネックカプセルの解剖学的構造に基づいており、広く認識されている確立された解決策を提供します6,7(図1A、B)。また、肝葉に対応するグリッソーニ椎弓根の初期分離と結紮、続いて肝葉の切除を含むMIALRの外科的処置についても説明します。
臨床診療では、右後肝葉の従来の肝切除術は、通常、ルーヴィエールの溝にある右後グリッソニアン椎弓根を解剖して結紮するか、ポルタ7,8を介してゲートVおよびゲートVIに直接アクセスすることによって行われます。しかしながら、手術の制限、触覚感度の低下、全体的な視覚制御能力の低下、および解剖学的ばらつきにより、肝臓のグリッソーニアン椎弓根の分岐部近くに位置する腫瘍(肺門部胆管がんを除く)では、術中の解剖学的向きに混乱が生じることがある。これらの課題は、後門脈の異なる血管への不注意な損傷、その後の出血、および腫瘍嚢の破裂につながる可能性があります5,9,10,11。さらに、術中の出血を最小限に抑えるために、従来の右後肝葉の肝切除術、または肝十二指腸靭帯または右グリッソニアン椎弓根の閉塞がしばしば必要である2,3。しかし、この閉塞は、肝臓の腫瘍発生側に虚血を誘発するだけでなく、正常側にも影響を及ぼし、肝虚血再灌流障害(IRI)を悪化させます1,12。
Takasakiらは、以前に減算法を用いた後部切片椎弓根の肝外隔離について説明した7,8、一方、杉岡と加藤は、末梢分節椎弓根の肝外隔離のための減算技術について説明した13。これらのアプリケーションは、グリッソーニアン椎弓根の末梢減算解剖(PSDGP)の文脈での肝臓切除と一致しており、主な目的は、直接椎弓根分離中の椎弓根損傷または腫瘍破裂を軽減することです。したがって、この研究では、肝臓のグリッソン椎弓根の分岐部近くに位置する特定の腫瘍タイプに対する PSDGP 技術の使用を提案しています (肺門胆管癌を除く)。主な目的は、右後肝椎弓根の分離中の出血リスクを軽減し、腫瘍嚢の破裂を防ぐと同時に、残存肝臓の IRI を減らすことです。
プロトコル
1. 患者様の選択
- 次の選択基準に基づいて患者を選択します: 右後葉の腫瘍 (良性腫瘍と悪性腫瘍の両方)。
- 次の除外基準に基づいて患者を除外します: 肺門胆管癌および転移のない肝新生物。
2.外科的処置
- 静脈内吸入麻酔を組み合わせた後、患者を結石切開位置に置きます (施設で承認されたプロトコルに従います)。上腹部に5つのトロカールを挿入します。腹腔内圧を13mmHgに維持します。へそのテープを挿入して肝十二指腸靭帯を囲み、断続的なプリングル操作を体内で行います。
- 観察ポートの臍の上に10mmのトロカールを挿入します。
- アシスタントのポートの剣状突起の下に12mmのトロカールを挿入します。
- 剣状突起と臍をつなぐ線の上部3分の1に5mmのトロカールを挿入します。
- 鎖骨中央線と外科医のポートの肋骨縁の交点に12mmのトロカールを挿入します。
- 前腋窩線と2番目の外科医のポートの肋骨縁の交点に5mmのトロカールを挿入します。
- ラエネックのカプセルを慎重に露出させます 嚢胞板に沿って解剖することにより、右グリッソーネ科の茎の表面を通して。肝十二指腸靭帯の継続を特定することにより、肝臓の右グリッソニアン椎弓根を確認します。右後部と右前部の両方のグリッソニアン椎弓根の表面に到達するまで解剖を続けます(図1C)。
3.ペディクル管理
- 右上にある腹腔鏡の長く湾曲したグラッパーを使用して、セグメント4の基部を引っ込めます。体内プリングル操作を使用して、肝十二指腸靭帯を左下に引っ張ります。
- 肝門のセグメント4の基部にある内臓腹膜を露出させます(図2A)。非外傷性鉗子と超音波メスを使用して、セグメント 4 を覆うラエネックのカプセルと肺門板の上面との間の内臓腹膜を慎重に解剖します。右側のグリッソーニアンペディクルから小さな枝を解剖して結紮し、分離に十分なスペースを確保します。胆道の漏れを避けるために、小さな枝を細心の注意を払って解剖してください(図2B)。
- 肺門板の左側をセグメント4の基部から取り外します。アンビリカルプレートの右側まで解剖を続けます(図2C)。
- 肺門板の下降中に肝十二指腸靭帯を一時的に閉塞して、出血を最小限に抑え、Laennecのカプセルの汚染を防ぎます。.これにより、最適な視認性が確保され、その後の手続き介入が容易になります。
- 長さ15cmのサイズ0の非吸収性縫合糸(3.5メートル法)または同様の縫合糸を準備し、「a」と「b」とラベル付けし、端を「b」と事前に固定します。
- 非外傷性鉗子を使用して、非吸収性縫合糸(3-0)の端「a」をゲートVIからゲートIVに導き、右グリッソーニアン椎弓根へのアクセスを容易にします(図3A)。
- 非外傷性鉗子を使用して、非吸収性縫合糸の「a」をゲートIVから右側のゲートVに向け、右前グリッソニアン椎弓根を獲得します(図3B)。
- 非吸収性縫合糸の両端(「a」と「b」)を同時に引っ張って、右後部グリッソニアン椎弓根を露出させます(図3C)。
- 非吸収性縫合糸の「a」および「b」の端に張力をかけて、右後部グリッソニアン椎弓根を閉塞します(図4A)。プリングル操作を使用して右グリッソーニアン椎弓根を閉塞し、肝切除中の出血を減らし、虚血再灌流障害(IRI)を最小限に抑えます(図4B)。
注:このアプローチにより、最適な結果が得られ、最終的に右後肝葉の正確なMIALRが達成されます(図4C)。
4. 術後の患者ケアとモニタリング
- 患者を監視し、手術後1日目に 低流量酸素を投与します。
- 術後の最初の日に手術後の回復強化(ERAS)プロトコルを開始し、患者が流動食を開始し、ベッドサイドでの活動に従事できるようにします。
- 肝保護薬、アルブミン、抗炎症薬、鎮痛薬、および利尿薬のための低用量スピロノラクトンを投与します。
- 肝機能(アラニンアミノトランスフェラーゼ[ALT]、アスパラギン酸アミノトランスフェラーゼ[AST]、総ビリルビン[TBIL]、直接ビリルビン[DBIL]])および凝固機能(プロトロンビン時間[PT]、活性化部分トロンボプラスチン時間[APTT]、トロンビン時間[TT]、フィブリノーゲン[FIB])を手術後1日目、3日目、および5日目 に監視します。
結果
手術は176分で完了し、術中出血は50mLと最小限に抑えられ、輸血の必要もありませんでした。右グリッソーニアン椎弓根は2回閉塞し、最初の閉塞は15分、2回目は20分続きました。手術中、肝十二指腸靭帯は閉塞せず、右肝静脈を温存しながら左肝臓への十分な血液供給が維持されました(図4C)。短期的な合併症は発生せず、患者の術後の回復は成功しました。総入院日数は11日間で、術後の入院期間は9日間でした。
術後5日目に、手術結果を評価するために強化されたCTスキャンが行われました。術前CTと比較して、結果は右肝静脈(RHV)が滑らかな血流を示し、血管狭窄や血栓症の証拠がないことを示しました(図5A、B)。主門脈(PV)とその左右の枝は、右の枝が右の前枝として続いていることも含めて、血管狭窄や血栓症の兆候はなく、正常に見えました。さらに、肝臓の周囲には血腫や滲出液は観察されませんでした(図5C、D)。
術後 1 日目のアラニン アミノトランスフェラーゼ (ALT) レベルは 354 U/L でしたが、5 日目までに正常に戻りました。総ビリルビンレベルは、周術期を通じて安定していました。手術前後に複数回モニタリングされた凝固機能指標は、正常範囲内にとどまっていました。さらに、α-フェトプロテイン(AFP)レベルは、手術前の1,210 ng/mLから手術後は36 ng/mLに減少しました(表1)。
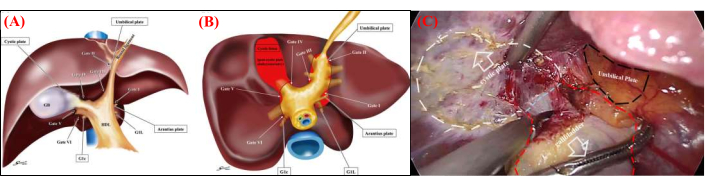
図1:肝臓の膜の解剖学的構造 (A)正面図の4つの解剖学的ランドマークと6つのゲートの概略図。これらのランドマークとゲートを認識することは、肝外グリッソン椎弓根分離の標準化に不可欠です。(B)尾側図の6つのゲートとラエネックのカプセルの概略図。6つの門とラエネックのカプセル(赤い部分で示されている)との関係が示されています。ラエネックのカプセルとグリッソンペディクル(プレートシステム)の間の隙間は、これらの6つのゲートからのみアクセスできます。ゲートI:アランティウスプレートの尾側の端。ゲートII:丸い靭帯と臍板の間の接合部。ゲートIII:臍部分のグリッソン椎弓根の右端。ゲートIV:嚢胞板の後肢の左端または前グリッソン椎弓根。ゲートV:右のメイングリッソンペディクルの分岐。ゲートVI:後部グリッソン椎弓根とG1cの間のスペース (C) 非外傷性鉗子を使用して胆嚢を引っ込め、嚢胞板に沿ってラエネックの膜を完全に解剖して、胆嚢をカロットの三角形の根元まで解放します。 この図の拡大版を表示するには、ここをクリックしてください。

図2:グリッソン椎弓根の露出 (A) プリングル法は、初期の肝門を閉塞するために使用され、組織の損傷を最小限に抑えます。非外傷性鉗子は、肝臓セグメント4bと肺門板を引っ込めるために使用されますが、別の非外傷性鉗子はラエネックのカプセルを穏やかに分離します。(B)肝門のセグメント4の基部にある内臓腹膜が露出しています。(C)肺門板を完全に解剖すると、右グリソン椎弓根が完全に露出します。 この図の拡大版を表示するには、ここをクリックしてください。
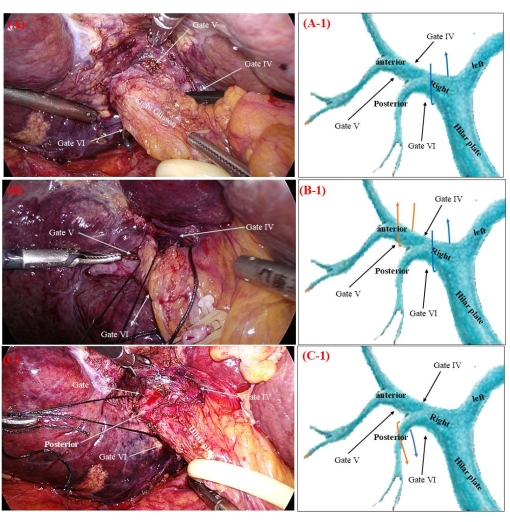
図3:グリッソーニアン椎弓根の末梢減法解剖 (A)ゴールドフィンガー(または非損傷性鉗子)は、非吸収性縫合糸のb端をゲートVIからゲートIVに導くために使用されます。(B) ゴールドフィンガーは、非吸収性縫合糸のb端をゲートIVからゲートVに導くために使用されます。 図A-1、B-1、C-1のオレンジと青の矢印は、非吸収性縫合糸の軌跡を示しています。この図の拡大版を表示するには、ここをクリックしてください。

図4:肝臓の精密な解剖学的切除 (A) 右後グリソン椎弓根の結紮により、右後肝葉に明らかな虚血が認められる(白い破線は境界を示す)。(B)右グリソン椎弓根の結紮により、右半弁に明らかな虚血が生じます(黄色の破線は境界を示します)。右後グリソン椎弓根がすでに結紮されていることを考えると、右グリソン椎弓根の閉塞は、右前グリソン椎弓根を閉塞することと同等です。(C)手術中に右肝静脈(RHV)を温存する右後肝葉の精密解剖学的切除術を行う(青の破線はRHVの変形を示す)。 この図の拡大版を表示するには、ここをクリックしてください。

図5:術前と術後の肝臓形態の比較解析 (A)術前の増強CT画像により、左、中、右の肝静脈の解剖学的構造が明らかになる(点線は肝静脈の一次経過を示す)。(B) 術後 5 日目に取得された強化された CT 画像により、左、中、右の肝静脈が無傷であることが確認されています。(C-D)術後の増強CT画像は、門脈の左右の枝、および右の肝静脈が、血管狭窄や血栓症の証拠なしに通常の経過をたどることを示しています。肝周囲領域には出血や滲出液は観察されません(実線は門脈の主要な経過を示します)。この図の拡大版を表示するには、ここをクリックしてください。
| 項目 | 業績 | |
| 動作時間(分) | 176 | |
| 術中出血量 (mL) | 50 | |
| 輸血量(mL) | 0 | |
| 血管閉塞時間のためのプリングル操作(分) | 35(15+20) | |
| 術後合併症 | 何一つ | |
| 入院期間(日) | 11 | |
| 術後入院期間(日) | 9 | |
| 術前のALTとアミラーゼのレベル | 19 | |
| POD1のALTアミラーゼレベル(U / L) | 354 | |
| POD3のALTアミラーゼレベル(U / L) | 132 | |
| POD5 の ALT アミラーゼレベル (U/L) | 31 | |
| 術前レベルのASTとアミラーゼ | 23 | |
| POD1のASTアミラーゼレベル(U / L) | 381 | |
| POD3上のASTアミラーゼレベル(U / L) | 119 | |
| POD5 の AST アミラーゼレベル (U/L) | 22 | |
| 術前のTbilレベル(ng / mL) | 16.9 | |
| POD1のTbilレベル(ng / mL) | 25.8 | |
| POD3 の Tbil レベル (ng/mL) | 19.7 | |
| POD5のTbilレベル(ng / mL) | 18.5 | |
| 術前凝固機能(TT/APTT/PT/FIB) | 正常 | |
| 後回し凝固機能(TT/APTT/PT/FIB) | 正常 | |
| 術前のAFPレベル(ng / mL) | 1210 | |
| 術後のAFPレベル(ng / mL) | 36 | |
表 1: 術中および術後のパラメーター。
ディスカッション
グリッソーニアン椎弓根の体外解剖法は、安全で効果的、かつ便宜的であり、MIALR 2,3,7,13 の基本的な技術となっています。グリッソニアンペディクルとその枝は、肝葉に血液を供給し、胆汁の流出を促進します。手術中のグリッソーニアン椎弓根の安全で効率的な解剖は、MIALRの成功に不可欠です。
ラエネックのカプセル解剖学理論に基づく杉岡淳の「ゲート理論」によれば、外科的処置は「ゲート」をガイドとして、ラエネックのカプセルを境界として、グリッソーニアン椎弓根の解剖学的アプローチとレベルを正確に決定します1,2,7,14。「ゲート理論」の適用における主要な操作空間は、ラエネックのカプセルとグリッソーニアン鞘との間の隙間にあります。肝臓の門脈系は、最初の肝門領域にある肥厚して融合したグリッソニアン嚢によって形成され、肝プレート、胆嚢プレート、臍帯静脈プレート、およびアランティウスプレート2,7の4つの異なるコンポーネントで構成されています。
肝板および嚢胞板の手術技術は、現在、比較的成熟した段階に達しており、徐々にMIALR手術に不可欠なステップに進化しています。MIALR手術の重要なステップは、腫瘍の位置に基づいて対応するグリッソニアン椎弓根の結紮を含み、これにはそれぞれのゲートを開く必要があります。たとえば、左半肝切除にはゲート1とゲート3を通過する必要があります。左側切開部の切除には、ゲート1とゲート2を通過する必要があります。左内側切開部の切除には、ゲート 2 とゲート 3 の通過が含まれます。右半球切除術は、ゲート4およびゲート6を通過する必要があります。右前眼部切除術は、ゲート4およびゲート5を通過する必要があります。右後部切除にはゲート5を通過する必要があります。
ただし、出血および腫瘍嚢破裂の潜在的なリスクは、尿細管癌 5,6,13 を除く、グリッソニアン茎の分岐部近くの右後肝葉に位置する腫瘍の臨床診療で MIALR 中に発生する可能性があります。これらのリスクを軽減するために、右後部グリッソーニアン椎弓根は PSDGP 法を通じて間接的に到達し、ゲート V とゲート VI を直接通過することを回避します。間接解剖によって得られた右後部グリッソーニアン椎弓根は、直接解剖に比べていくつかの利点があります。
まず、右グリッソニアン椎弓根の効果的な制御は、ゲート 4 からゲート 6 にアクセスすることで達成でき、右後肝葉切除中の血流閉塞を促進します。右グリッソニアン椎弓根の選択的閉塞は、従来の直接肝十二指腸靭帯閉塞法15,16,17と比較して、左肝葉の血流を損なうことなく、最大30分以上維持することができる。このアプローチは、肝虚血再灌流障害(IRI)を軽減し、術後の肝機能の回復を促進します18。第二に、右後部グリッソニアン椎弓根へのアクセスは、その深い解剖学的位置と解剖学的バリエーションの存在により、重大な外科的課題をもたらします。この椎弓根にアクセスするためにゲートVからゲートVIに直接渡ると、解剖学的変化が意図せずに見落とされ、周囲の膜構造を損傷して出血を引き起こすリスクが高まる可能性があります5,14,19。最後に、血管奇形などの良性腫瘍の切除中に腫瘍破裂の重大なリスクが存在し、グリッソーン椎弓根を解剖するときにかなりの出血につながる可能性があります。腫瘍が悪性の場合、グリッソーニアン椎弓根解離中の破裂は出血を引き起こすだけでなく、「ノータッチ」および「一括」切除の原則にも違反します。腫瘍が良性か悪性かにかかわらず、肝臓の右後葉に位置している場合、特に腫瘍の直径が3cm以上で、主要な血管および胆管の近くのセグメント7に位置している場合、外科的切除は特に困難になります。したがって、PSDGP 技術は、右前葉のグリッソニアン椎弓根を効果的に閉塞して出血を制御し、左肝実質の IRI を最小限に抑え、最終的に MIALR の目標を達成することができます。
肝葉切除術の術前計画には、CT、MRI、および補助的な3D視覚化を使用して、正確な手術計画4,8,20を作成することが含まれます。手術中のグリッソーニアン椎弓根の解剖はゲート理論の原則に従いますが、術中の超音波と蛍光イメージングを使用して、肝臓切除を正確に特定し、ガイドします。これらの技術は、外科医が術前計画に従って MIALR を実行するのを支援します。
この研究では、外科的処置中にラエネックのカプセルに PSDGP アプローチを実装すると、右後部グリッソニアン椎弓根を分離しながら正確な MIALR が可能になることを提案しています。特に、医療センターでの超音波装置やインドシアニングリーン蛍光イメージングデバイスへのアクセスが限られている経済的に発展途上の国や地域では、この技術により、右後グリッソニアン椎弓根の正確な制御が可能になり、椎弓根が見逃されることがなくなります。その後、肝実質は肝臓表面の虚血線に沿って切開され、下にある右肝静脈を明確に視覚化します。次に、右後葉の綿密な切除が、右肝静脈の正確な同定と完全な解剖に基づいて行われます。
右グリッソニアン椎弓根と右前グリッソニアン椎弓根は、PSDGP手術中にラエネック嚢に沿って解剖され、右後グリッソニアン椎弓根は、グリッソニアン椎弓根鞘の外側からの減法解剖によって得られ、椎弓根と周囲の結合組織の両方を効果的に結紮した7,9,10.外科医は、後部茎のグリッソーニアン椎弓根の減法解剖中に、右主椎弓根から分岐する尾状椎弓根に細心の注意を払う必要があります。
ゲイツIVおよびVIの正確な解剖は、後部椎弓根のPSDGPの最初のステップとして、右椎弓根の分離にとって最も重要です。この手順では、ゲートIVとVIを、尾状突起(G1c)と傍騎帯部分(G1r)の椎弓根の分岐点の外側の右側で慎重に解剖する必要があります。G1c または G1r が右椎弓根分離のスリング テープに関与している場合、これらの尾状椎弓根は、その後の減法切除中に潜在的な後椎弓根に含まれたままです。
PSDGP 手順のコンテキストでは、胆石などの良性疾患の患者の胆嚢の問題に対処するために、胆嚢摘出術を同時に実行できます。ただし、胆嚢が正常な患者に対するPSDGP技術に関連する制限があります。したがって、手術を進める前に、患者の明示的な同意を得る必要があります。さらに、日本の趙A教授ら21,22,23によると、グリッソニアン椎弓根の分岐点を囲む変異血管の結紮は、セグメント5の一部を供給し、切除縁に限局性肝虚血をもたらす可能性があります。その結果、これは術前に計画された切除と比較して、術後の肝臓肥大につながる可能性があります。門脈ドレナージ領域における肝臓切除の次元の理論的な増加は重要ではありませんが、PSDGP 手順の臨床的実現可能性、安全性、および限界を確認するには、さらなる研究が必要です。
臨床診療では、PSDGPは左外側葉、左内側葉、および肝臓の両葉を含む切除に効果的に使用できることが明らかになりました。しかし、臨床応用におけるその実現可能性、安全性、および限界を判断するには、さらなる調査が必要です。この研究は、限られた数の患者を含む単一のセンターで実施されたレトロスペクティブ分析です。彼らの半分は良性腫瘍と診断され、残りの半分は悪性腫瘍と診断されました。現在、長期のフォローアップ結果は入手できません。したがって、腫瘍学におけるPSDGPの技術的側面、適応症、禁忌、および長期的な治療効果を評価するには、さらなる検証が必要です。現在、将来の研究目標が進行中です。
開示事項
著者には、開示すべき利益相反や金銭的なつながりはありません。
謝辞
この研究は、四川省医学科学技術イノベーション研究協会(プロジェクトコード:YCH-KY-YCZD2024-075)によって財政的に支援されました
資料
| Name | Company | Catalog Number | Comments |
| Electrocantery | Hangzhou Kangji Medical Instrument Co., Ltd | KJ-SJ0205 | Sterile,dry heat sterilized, reusable |
| Gold finger | Hangzhou Kangji Medical Instrument Co., Ltd | 101.237Φ10*350mm | Sterile,dry heat sterilized, reusable |
| Non-absorbable suture | Johnson & Johnson MEDICAL (CHINA) Ltd | 2-0/W2512 | Sterile, ethylene oxide sterilized, disposable |
| Non-traumatic forceps | Hangzhou Kangji Medical Instrument Co., Ltd | Φ10×260 | Sterile,dry heat sterilized, reusable |
| Soft rubber ureteric catheter | Yangzhou Jinhuan Medical Appliance factory | Type A 5.3mm(16Fr) | Sterile, ethylene oxide sterilized, disposable |
| Trocar | Zhejiang Geyi Medical Instrument Co.,Ltd | GYTR-I Φ5/Φ10/Φ12 | Sterile, ethylene oxide sterilized, disposable |
参考文献
- Fujiyama, Y., et al. Latest findings on minimally invasive anatomical liver resection. Cancers (Basel). 15 (8), 2218 (2023).
- Reig, M., et al. Bclc strategy for prognosis prediction and treatment recommendation: The 2022 update. J Hepatol. 76 (3), 681-693 (2022).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Yang, J. D., Heimbach, J. K. New advances in the diagnosis and management of hepatocellular carcinoma. Bmj. 371, m3544 (2020).
- Cherqui, D. Laparoscopic liver resection: A new paradigm in the management of hepatocellular carcinoma. J Hepatol. 63 (3), 540-542 (2015).
- Morimoto, M., et al. Glissonean pedicle isolation focusing on the laennec's capsule for minimally invasive anatomical liver resection. J Pers Med. 13 (7), 1154 (2023).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic glissonean pedicle isolation for anatomical liver resection based on laennec's capsule: Proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Kato, Y., et al. Laparoscopic isolated liver segmentectomy 8 for malignant tumors: Techniques and comparison of surgical results with the open approach using a propensity score-matched study. Langenbecks Arch Surg. 407 (7), 2881-2892 (2022).
- Kim, J. H., Kim, H. Laparoscopic right hemihepatectomy using the glissonean approach: Detachment of the hilar plate (with video). Ann Surg Oncol. 28 (1), 459-464 (2021).
- Maeda, K., et al. Pure laparoscopic right hemihepatectomy using the caudodorsal side approach (with videos). J Hepatobiliary Pancreat Sci. 25 (7), 335-341 (2018).
- Wakabayashi, G., et al. Recommendations for laparoscopic liver resection: A report from the second international consensus conference held in morioka. Ann Surg. 261 (4), 619-629 (2015).
- Gotohda, N., et al. Expert consensus guidelines: How to safely perform minimally invasive anatomic liver resection. J Hepatobiliary Pancreat Sci. 29 (1), 16-32 (2022).
- Kato, Y., et al. Minimally invasive anatomic liver resection for hepatocellular carcinoma using the extrahepatic glissonian approach: Surgical techniques and comparison of outcomes with the open approach and between the laparoscopic and robotic approaches. Cancers (Basel). 15 (8), 2219 (2023).
- Xi, C., et al. A novel difficulty scoring system of laparoscopic liver resection for liver tumor. Front Oncol. 12, 1019763 (2022).
- Liu, J., et al. The difference in prolonged continuous and intermittent pringle maneuver during complex hepatectomy for hepatocellular carcinoma patients with chronic liver disease: A retrospective cohort study. Cancer Med. 10 (23), 8507-8517 (2021).
- Hu, Y., et al. Laennec's approach for laparoscopic anatomic hepatectomy based on Laennec's capsule. BMC Gastroenterol. 19 (1), 194 (2019).
- Zhang, Y., et al. Intermittent pringle maneuver versus continuous hemihepatic vascular inflow occlusion using extra-glissonian approach in laparoscopic liver resection. Surg Endosc. 30 (3), 961-970 (2016).
- Park, J. B., et al. Effect of intermittent hepatic inflow occlusion with the pringle maneuver during donor hepatectomy in adult living donor liver transplantation with right hemiliver grafts: A prospective, randomized controlled study. Liver Transpl. 18 (1), 129-137 (2012).
- Kawaguchi, Y., Fuks, D., Kokudo, N., Gayet, B. Difficulty of laparoscopic liver resection: Proposal for a new classification. Ann Surg. 267 (1), 13-17 (2018).
- Benson, A. B., et al. Hepatobiliary cancers, version 2.2021, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 19 (5), 541-565 (2021).
- Cho, A., et al. Relationship between right portal and biliary systems based on reclassification of the liver. Am J Surg. 193 (1), 1-4 (2007).
- Cho, A., et al. Anterior fissure of the right liver--the third door of the liver. J Hepatobiliary Pancreat Surg. 11 (6), 390-396 (2004).
- Cho, A., et al. Relation between hepatic and portal veins in the right paramedian sector: Proposal for anatomical reclassification of the liver. World J Surg. 28 (1), 8-12 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved