Method Article
ラットの心電図と神経放電に対する電気鍼治療のさまざまな接続モードの影響
要約
これまで、臨床研究や基礎研究において、電気鍼治療の接続方法に統一された方法はありませんでした。ラットの心電図(ECG)と神経放電に対するさまざまな接続方法の影響を比較して、電気鍼治療器具を接続する最も適切な方法を探ろうとしたプロトコルを紹介します。
要約
電気鍼灸(EA)は、鍼灸で最も一般的に使用される方法の1つであり、痛み、うつ病、感覚運動障害、およびその他の疾患に良い効果をもたらします。EAの有効性は、ツボ選択の精度、EA治療の期間と経過、EAパラメータなど、多くの要因に影響されます。ただし、経穴が異なる場所と距離にあるEA機器の正極と負極が治療効果に影響を与えるかどうかについては、ほとんど議論されていません。本実験では、EA装置を異なる位置や距離のツボにつなげた場合の心電図や曖昧な神経放電に及ぼす影響を観察し、EAの接続モードの違いによって形成される電界が身体の機能にどのような影響を与えるのかを事前に説明しました。この実験でのEAの接続モードは、体の両側に同じツボ、体の同じ側に同じ経絡または異なる経穴、同じツボ領域に2本の針が含まれていました。その結果、正極と負極が体の両側のツボに接続されていると、心電図と迷走神経活動の記録が妨げられることが示されました(前肢と後肢が同じ)。ツボが体の同じ側に接続されている場合、2つの針の間の距離が小さいほど、ECGと迷走神経活動の記録への影響は小さくなり、効果は電流の増加とともに増加しました。ツボが同じツボ領域にあった場合、2本の針が短絡を形成さなければ、心電図と迷走神経活動の記録は妨げられませんでした。
概要
電気鍼灸(EA)は、器具から出力されるパルス電流を人体の経絡点に適用することにより、病気を治療する鍼治療の一種です。EAには、定量化、タイミング測定、省力化が可能な安定した調整可能な刺激パラメータの利点があり、さまざまな神経痛や鍼治療麻酔、鍼治療鎮痛などの治療メカニズムの研究など、特定の疾患の治療や科学研究に特別な利点があります1。
ツボの精度、治療時間、波形、パルス強度、周波数などのEAパラメータなど、EAの有効性に影響を与える要因がいくつかあります。一般的に使用される臨床EAは双方向EAであり、組織の損傷が少なく、人体の正常な生理学的機能への干渉が少なくなります。また、病気を予防し、治すこともできます。ヒト組織は、水、無機塩、および荷電コロイド2で構成される複雑な電解質の導体です。EAを人体に適用すると、電界中の荷電粒子が移動し、人体の機能に影響を与える濃度と分布の変化を引き起こします。運動、濃度、粒子分布の変化は、EA療法1の基本です。
過去10年間で、EA研究の数は多くの疾患1,2,3で増加しています。EAの正極と負極の関係については、これを詳細に明らかにする研究はほとんど行われていません。EA中、EA機器の正極と負極を2本の鍼に接続して、電気刺激として機能する必要があります。現在、一般的なモードは次のとおりです:体の両側にある2つの針が同じツボに接続され、体の同じ側面の異なるツボが接続されています1。しかし、これらの接続方法の有効性はまだ証明されていません。一部の科学者は、体の両側にある2本の針を正と負の極に接続できないと推定しています。そうしないと、電流が心臓機能に影響を与えることになりますが、体の同じ側にある2つの異なる点を正極と負極3に接続できます。一部の研究者は、正極と負極をつなぐ鍼を単一のツボ領域で使用して、経絡のセンシングを促進するためにツボに電気刺激を形成するべきだと考えています2。
さまざまなツボでの電気鍼治療は、神経放電を活性化または抑制することができます4,5。多くの研究は、迷走神経6,7,8に対するTsusanli(ST36)のEAの刺激効果を説明しています。ただし、これらの研究では、EAの接続について詳しく説明しておらず、EA接続のさまざまなモードの影響の違いを説明していません。この研究のギャップを考慮して、この研究では電気生理学的手法を使用して、さまざまなEA接続がECGと神経活動に及ぼす影響を説明しました。この結果は、EAの正しい接続のさらなる証拠を提供します。
プロトコル
この実験プロトコルは、北京中医薬大学の標準化された実験動物倫理レビューによって承認され、実験プロトコル(倫理レビューコード:BUCM-2023110901-4046)に完全に従って実施されました。
1.動物とグループ化
- 動物
- 体重約200〜240gの健康な雄SPFラット48匹(生後8週齢)を入手します。
注:この研究では、動物はVital River Company[ライセンス番号:SYXK(北京)2020-0033]によって提供されました。 - すべてのネズミを北京中医薬大学の動物実験センターに収容します。実験中は、ラットが餌と水に自由にアクセスできることを確認してください。
- 12時間の概日リズムシフトに基づいて摂食環境を維持し、周囲温度を23±2°Cに制御します。
- すべての手術器具を75%アルコールとオートクレーブに浸します。動物取り扱い室をUVランプで滅菌します。
- すべての動物手術は麻酔下で行ってください。20%腹腔内ウレタン注射(1 g / kg)でラットに麻酔をかけ、ラットが自発的に呼吸を続けることを確認します。.
- 手術中は、サーモスタットプレートを使用してラットの体温を37°Cに保ちます。
- 実験中は、エリスロマイシン軟膏でラットの目を湿らせてください。.
- 実験の最後に麻酔下でラットの首を切って殺し、必要に応じて標本/サンプルを保管します。
- 体重約200〜240gの健康な雄SPFラット48匹(生後8週齢)を入手します。
- グループ
- 接続モードに従ってラットをランダムにグループ化します。各グループに8匹のラットをランダムに割り当てます。
- 対照群(鍼治療なし):治療なしでラットに通常どおり給餌します。
- グループA、左前肢グループの単一のツボ:正と負のEA電極をそれぞれQuchiポイントとQuchiポイントから3mmに接続します( 図1Aを参照)。肘関節の外側前方のくぼみにQuchiポイント(LI11)を配置し、位置決め後、針を~5mmの深さまで垂直に挿入します。
- グループB、左前肢グループの2つのツボ:正と負のEA電極をそれぞれQuchi(LI11)とWaiguan(TE5)ポイントに接続します( 図1Bを参照)。橈骨縫合糸と尺骨縫合糸の前腕の下 1/6 折り点の外側にワイグアン (TE5) ポイントを配置します。針を2mmの深さまで挿入します。
- グループC、左前肢と後肢の2つのツボ:正と負のEA電極をQuchi(LI11)とTsusanli(ST36)に接続します( 図1Cを参照)。腓骨頭の5 mm下、膝の後外側にTsusanli(ST36)ポイントを配置し、針を~1cmの深さまで垂直に挿入します。
- グループD、両後肢の同じツボ:正と負のEA電極を両側の通三里(ST36)で接続します( 図1Dを参照)。
- グループE、両前肢の同じツボ:正と負のEA電極を両側のQuchiに接続します( 図1Eを参照)。
2.ECG接続
- ラットを仰臥位に拘束し、徹底的に麻酔をかけます。
- ラットの右前肢手首、右後肢、左後肢の皮膚に平行に1/2インチの鍼を挿入し、筋肉を避けます。
- 針のハンドルを記録電極に接続します:右前肢の正(白)電極、左後肢の負(赤)電極、およびラットの右後肢の参照電極(黒)(( 図2を参照)。
- 生理信号レコーダーを使用して、ラットの標準的な肢リードII表面心電図をリアルタイムに記録します(サンプリングレート:1KHz、フィルタリング範囲:ローカットフィルター、200Hz、ハイカットフィルター、0.8Hz)。
3. 迷走神経の分離と迷走神経排出信号の記録
- 麻酔をかけたラットを仰臥位で固定した後、喉頭と胸骨の間の首の正中線に沿って2〜4cmの切開を行います。
- 右頸動脈鞘(頸動脈、迷走神経、交感神経鎖を含む)を特定した後、右迷走神経幹を約1〜2cm切断します( 図3Aを参照)。
注:交感神経は頸動脈の外側に位置し、迷走神経を伴います。頸部交感神経は迷走神経に比べて細いです。 - 神経幹を一対の銅フック電極で接続し、参照電極を切開部に固定して干渉を排除します。生理食塩水を使用して、実験全体を通して迷走神経活動を維持します( 図3Bを参照)。
- 電極と筋肉の間の絶縁を維持するために、傷口の表面を鉱物油で覆います。
- 生理信号記録装置を用いて、ラットの神経放電をリアルタイムに記録します(サンプリングレート:5KHz、フィルタリング範囲:ローカットフィルター100Hz、ハイカットフィルター1000Hz)。
4. EAの介入
注:心電図および迷走神経放電後のラットの鍼治療は安定していた。
- 2つのニードルハンドルをEA機器のニードルクリップに別々に接続します。
- EAの刺激を、波幅が0.3msの双方向の方形波に設定します。刺激強度を0.2mA、周波数を10Hz、刺激時間を20分に設定します。
- EAの異なる接続モードでのラットの心電図と神経放電の変化をリアルタイムで観察します。生理学的シグナルレコーダーを使用して、刺激なしで30秒間、EAの30秒前、EAの30秒後にデータを収集します。
- 記録ソフトウェアを使用して、ラットの心拍数、ECG波形、迷走神経分泌物の変化を記録します。
5. データの統計解析
- EA 接続のさまざまなモード (EA の前と後) でのラットの ECG と神経放電の変化を比較します。
- すべての実験データを平均誤差±標準誤差として表します。
- データが正規分布検定に合格したときに、スチューデントのt検定を実行します。対応のあるサンプルのt検定を実行して、EAの前後の変化を比較し、p<0.05を統計的に有意であると見なします。
結果
ラットの心電図に対するさまざまなEA接続モードの影響
対照群では、正常なラットの心電図を記録しました( 図4Aを参照)。ラットのベースライン条件は有意に異なることがわかりました。ラットの心拍数は258〜473bpmの範囲でした( 補足表1を参照)。
グループAでは、記録データはコントロールグループと同様でした。EA刺激後のグループAのラットの心拍数と波形に有意な変化はありませんでした( 図4Aを参照)。グループBの心電図波形は、対照群やグループAと比較して介入がほとんどなく、このグループの心拍数もリアルタイムで記録することができました。他のグループの結果は、ECGデータがEA周波数によって乱されることを示しました( 図4Aを参照)ため、EA介入中にECGをリアルタイムで記録できませんでした。したがって、EA介入の前後60秒間のデータを記録しました。
グループCとグループDの心拍数は、EAをオフにして短時間で前のレベルに戻した後に増加し、波形は影響を受けませんでした(図4Aを参照)。グループEの接続モードは、ECGデータに最も大きな影響を与えました。低電流(0.1mA)でもデータ記録には大きな影響がありました。帯電の20分後、心拍数はEA前と比較して有意に増加し(p < 0.05)、動物は次の30分間でさまざまな程度で回復しました。また、ラットの心電図波形は、高p波現象とSTセグメントの上昇を示し(図4C参照)、心臓が異常であったことを示しました。これらの変化は、実験観測が終了するまで続きました。
ラットの迷走神経分泌物に対する異なるEA接続モードの影響
その結果、迷走神経放電は規則的なクラスターであり、クラスターの数は30秒で31〜66個(補足表2を参照)であり、神経放電の記録はECGの記録と同じであることが示されました。対照群とグループAを除いて、他のグループの神経放電データはEAの頻度の影響を受け、EA介入中に正確に記録できませんでした(図5Aを参照)。そこで、EA介入前後の30秒間の放電振幅(ピーク値)の変化を記録し、30秒間のクラスター放電数を計算しました。グループBでは、迷走神経の放電はEAの周波数によってわずかに影響を受け、電流の増加とともに放電干渉が増加しました。しかし、30秒での放電変化と放電振幅は明らかではありませんでした。グループCの接続電流による電界は大きかったが、束放電の数と最大放電値はまだ安定していた。その後、グループDでは、EA介入後に放電頻度は減少したが、データはEA前と比較して有意ではなかった(p > 0.05)。グループEのデータは最も影響が強く、30秒間の束放電数が有意に減少しました(p < 0.05)(図5Bを参照)。対照的に、ピーク放電値は増加しました(p < 0.05)(補足表3の図5Cを参照)。
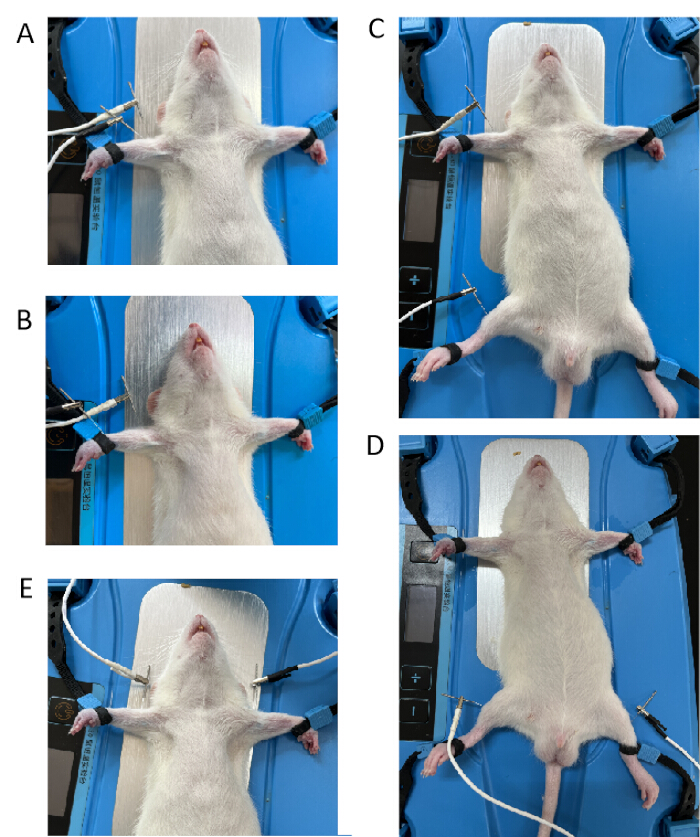
図1:正と負のEA電極の異なる接続モード(A)正と負のEA電極は、QuchiポイントとQuchiポイントから3mmに接続されました。(B)正と負のEA電極は、Quchi(LI11)とWaiguan(TE5)ポイントに接続されました。(C)正と負のEA電極をQuchi(LI11)とTsusanli(ST36)のポイントに接続しました。(D)正と負のEA電極を両側の通三里(ST36)ポイントに接続しました。(E)正と負のEA電極を両側のQuchi(LI11)ポイントに接続しました。この図の拡大版を表示するには、ここをクリックしてください。

図2:ECG観察の接続モード。 ラットの右前肢の正極(白)と左後肢の負極(赤)に針の柄を、ラットの右後肢に参照電極(黒)を接続した。 この図の拡大版を表示するには、ここをクリックしてください。

図3:迷走神経活動の記録方法(A)右迷走神経を分割した。交感神経は頸動脈の外側に位置し、迷走神経を伴います。左が交感神経、右が迷走神経です。(B)一対の銅フック電極を使用して迷走神経活動を記録し、参照電極を切開部に固定しました。この図の拡大版を表示するには、ここをクリックしてください。

図4:6つのグループでの心電図の記録データ。 (A)さまざまなEA接続モードでのECGのリアルタイム記録。対照群はラットの正常な心電図を示しました。グループAの心電図は対照群の心電図と同じでした。グループBでは、EAを接続した後、心電図がわずかに乱れました。(B) グループEでは、EAの周波数と比較して、EA後の心拍数が有意に増加した(p < 0.05)。(C)ラットのECG波形は、グループEで高いp波現象とSTセグメントの上昇を示しました。 この 図の拡大版を表示するには、ここをクリックしてください。

図5:ラットの迷走神経放電に対する異なるEA接続モードの影響(A)異なるEA接続モードでの迷走神経放電のリアルタイム記録データ。迷走神経放電はクラスター放電の規則性を有することが観察できる。グループAの迷走神経の放電は対照群と同様でしたが、グループB、C、D、およびEでは、EA機器の周波数によって放電が妨げられました。(B)グループEのデータは最も大きな影響を示し、30秒でクラスター放電の数が大幅に減少しました(p < 0.05)。(C)30秒での迷走神経分泌物のピーク値は有意に増加しました(p < 0.05)。この図の拡大版を表示するには、ここをクリックしてください。
補足表1:異なるグループでの20分間のEAセッションの前後30秒間のラットの平均心拍数。*グループEでは、平均心拍数は対照群と比較して有意差を示しましたが、他のグループでは有意差は示されませんでした。 この表をダウンロードするには、ここをクリックしてください。
補足表2:異なるグループでの20分間のEAセッションの前後30秒間のラットの迷走神経クラスター放電の総数。*グループEでは、ラットの迷走神経クラスター分泌物の総数は対照群と比較して有意差を示しましたが、他のグループでは有意差は示されませんでした。 この表をダウンロードするには、ここをクリックしてください。
補足表3:異なるグループでの20分間のEAセッションの前後30秒間のラットの迷走神経クラスター放電(μV)のピーク値。*グループEでは、迷走神経クラスター放電のピーク値は対照群と比較して有意差を示したが、他のグループでは有意差は示されなかった。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
この実験では、正極と負極の接続方法の違い(心拍数、迷走神経活動頻度、放電振幅など)の影響を観察しました。その結果、正極と負極が体の両方の前肢に接続されていると、生体電気の放出に影響を与えることが示されました。正極と負極が体の同じ側に接続されている場合、2つの針の間の距離が近いほど、生体電気への影響は少なくなります。電流が大きければ大きいほど、生体電気への影響は大きくなります。したがって、生体電気を変更しない同じツボでの接続モードをお勧めします。
一般に、電界は、本体抵抗1により、EAの正極と負極の間の距離が長くなるにつれて増加します。電界の影響が経絡の操作やツボの機能に影響を与えるかどうかは不明でした。これを証明するには、より厳密な実験計画が必要です。EA刺激中、エレクトロドリル刺激信号からのアーチファクトと組織からの電気信号の両方が同時に記録装置によって捕捉されます。その結果、録音された周波数はこれら2つの信号の合成を反映し、録音の歪みにつながります。その結果、一部の研究者は電気鍼治療セッション中に記録を中止し、このプロセス全体を通じて組織放電の変化を観察するのを防ぎます9。私たちの実験では、対側同点と同側の前肢と後肢の接続モードで電流が非常に少なかったとしても、EAの周波数はECG記録と神経放電記録に直接影響します。EA10の研究ではEAアーティファクトと呼ばれていました。いくつかの研究ではEAのアーティファクトが示されたため、EA11のアーティファクトを排除するために一部の機器が変更されました。実験では、アース線をつないで金属デバイスを錫箔で包むなど、刺激アーチファクトをなくすための多くの対策を講じました。その結果、1つのツボグループ(グループA)の心電図と神経放電は、実験全体を通して影響を受けなかったことがわかりました。対照的に、他のグループでは、EAの刺激周波数を測定データと重ね合わせました。この知見は、EA介入中にデータを記録する必要がある研究に対して、シンプルで効果的な解決策を提供する。
その結果、心電図と迷走神経分泌物は、前肢と後肢、両後肢と両前肢を連結することで影響を受けることが示された。しかし、この効果が体に良いのか悪いのかを見極めることは困難です。一般に、前肢を両側のツボに接続することで発生する電流は、心臓を直接通過すると考えられています。この方法による長期治療は、心臓にある程度の効果をもたらします1。この効果は、体の抵抗レベルに応じてさらに評価し、疾患モデルを使用してさらに証明する必要があります。薬物中絶の効果を高めるためのEAに関する以前の研究12 では、両側のツボ間の接続が小胞の排出を促進するだけでなく、鎮痛の効果を生み出し、月経時間を短縮することがわかりました。一方の側のHegu点とSanyinjiao点の間の接続では効果が弱まり、胎児嚢の排出率に影響を与えませんでした。しかし、薬物による中絶は人体を破壊するため、これらの接続モードでEAの効果を評価することは困難でした。別の研究13 では、腰椎椎間板ヘルニアの治療におけるJiajiポイントでのEAの2つの異なる接続モードの有効性を比較しました。その結果、腰椎椎間板ヘルニアには、JiajiツボでのEAのさまざまな接続モードが有効であり、脊髄横断対側Jiajiポイント接続法の長期有効性は、同側Jiajiポイント接続法よりも優れていることが示されました。
この実験は健康なラットに基づく予備的な観察であり、実験中にラット間で大きな違いがあることがわかりました。一部のラットの心拍数は不規則で、心電図の波形は最初は不安定でした。神経放電の観察では、一部のラットでは最初は分泌物が弱いことがわかりました。空気に長時間さらされると、神経が安定した状態を保つのが難しく、ラットが呼吸すると電極が筋肉に触れてしまい、観察できないほどの放電が生じました。私たちが使用した機器のデータ分析機能は比較的単純でした。今後は、より客観的なデータを得るために、より詳細な実験デザインやより高度な装置が必要とされるでしょう。
開示事項
著者は何も開示していません。
謝辞
この研究は、National Key Discipline of High Level Acupuncture and Moxibustion Administration of Traditional Chinese Medicine(助成金番号zyyzdxk-2023254)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Accupuncture Needle | Hwato | N/A | |
| BL-420N physiological signal recorder | Techman | LAB-0017-0002-CDTM | |
| Electroacupucture instrument | HANS | 200A | |
| Erythromycin ointment | Shuangji | N/A | |
| Mineral oil | Solarbio | 8012-95-1 | |
| Thermostatic rat plate | Techman | JR-30 |
参考文献
- Liu, L., Dai, S. . Clinical Electroacupuncture Therapy. , (2011).
- Han, J. Acupuncture: neuropeptide release produced by electrical stimulation of different frequencies. Trends Neurosci. 26 (1), 17-22 (2003).
- Yang, Z. . Acupuncture and Moxibustion. , (1996).
- Zhang, Z., et al. Electroacupuncture regulates inflammatory cytokines by activating the vagus nerve to enhance antitumor immunity in mice with breast tumors. Life Sci. 272, 119259 (2021).
- Liu, K., Jiang, J., Lu, S. Effect characteristics and mechanism of acupuncture in autonomic nerve regulation. Zhen Ci Yan Jiu. 46 (4), 335-341 (2021).
- Komegae, E. N., et al. Vagal afferent activation suppresses systemic inflammation via the splanchnic anti-inflammatory pathway. Brain Behav Immun. 73, 441 (2008).
- Lu, M., et al. Electroacupuncture at ST36 modulates gastric motility via vagovagal and sympathetic reflexes in rats. World J Gastroenterol. 25 (19), 49-60 (2019).
- Jiang, H., et al. Electroacupuncture pretreatment at Zusanli (ST36) ameliorates hepatic ischemia/reperfusion injury in mice by reducing oxidative stress via activating vagus nerve-dependent Nrf2 pathway. J Inflamm Res. 16, 1595-1610 (2023).
- Ye, Z. A straightforward device for the removal of electroacupuncture artifacts. Journal of the First Affiliated Hospital of Shanghai. 6, 474-475 (1981).
- Huo, R., et al. Responses of primary afferent fibers to acupuncture-like peripheral stimulation at different frequencies: Characterization by single-unit recording in rats. Neurosci Bull. 36 (8), 907-918 (2020).
- Ye, X., et al. Effect of electroacupuncture at "Zusanli" (ST36) on vagal electrical activity in the rat. Acupuncture Research. 5, 290-293 (2006).
- Zhu, J., et al. Clinical observation of electroacupuncture enhancing drug abortion. Chinese Acupuncture and Moxibustion. 7, 389-391 (2000).
- Chen, J., Ni, M., Yin, J. Electroacupuncture treatments for gut motility disorders. Neurogastroenterol. 30 (7), e13393 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved