Method Article
主培養海馬ニューロンを用いた軸索初期セグメントの組み立て研究
要約
ここでは、巨大なアンキリンGがないために組み立て済みのAISを欠く海馬ニューロンの軸索初期セグメント(AIS)の組み立てと構造を定量的に研究するプロトコルについて説明した。
要約
ニューロン軸索初期セグメント(AIS)は、作用電位の開始部位であり、分子構造、組立および活動依存性の可塑性について広く研究されている。AISのマスターオーガナイザーであるジャイアントアンキリンGは、膜をまたぐ電圧ゲート付きナトリウム(VSVG)およびカリウムチャネル(KCNQ2/3)、ならびにL1CAM細胞接着分子である186kDaニューロファシンと直接関連付けます。ジャイアントアンキリン-Gはまた、β-4-スペクトリン、および微小管結合タンパク質EB1/EB3およびNdel1を含む細胞質AIS分子に結合し、募集する。巨大なアンキリンGは、アンキリンG欠損ニューロンにおけるAIS形成を救うのに十分である。Ankyrin-Gはまた、AISの代わりに樹状脊椎に位置する小さな190 kDaアイソフォームを含み、AISに標的化したり、アンキリンG欠損ニューロンでAISを救出することができない。ここでは、ANK3-E22/23-floxマウスからの培養海馬ニューロンを用いたプロトコルについて説明し、Cre-BFPにトランスフェクトすると、アンキリンGのすべてのアイソフォームの喪失を示し、AISの形成を損なう。修飾されたバンカーグリア/ニューロン共培養システムを組み合わせて、AISの形成を救うのに十分な480 kDaアンキリンG-GFPプラスミドを持つアンキリンGヌルニューロンをトランスフェクトする方法を開発しました。さらに、サルザーと同僚が開発した定量方法を採用し、海馬ニューロン培養で起こるニューロン細胞体からのAIS距離の変動に対処する。このプロトコルは、AISのデノボアセンブリと動的挙動の定量的研究を可能にする。
概要
軸索初期セグメントは、ほとんどの脊椎動物ニューロンの近位軸索に位置する。機能的には、AISは、この領域の電圧ゲートナトリウムチャネルの高密度のためにアクション電位が開始される場所です。いくつかの興奮性ニューロンのAISはまた、GABAergicシナプス1、2、3を形成することによって阻害性インターニューロンによって標的にされる。したがって、AISは細胞シグナル伝達を統合し、ニューロンの興奮性を調節する重要な部位である。AISは通常20~60μmの長さで、細胞体から20μm以内に位置しています。AIS の長さと位置は、脳領域全体のニューロンで異なります, 同様に同じニューロンの異なる発達段階で 4,5.蓄積された証拠は、AISの組成と位置が神経活動4、5、6、7の変化に応答するに動的であることを示唆した。
480 kDaアンキリンGはAISのマスターオーガナイザーです。480 kDa ankyrin-G は、電圧ゲート付きナトリウムチャネルに直接結合する膜関連アダプタタンパク質であり、β4-spectrin、KCNQ2/3 チャネルを含む他の主要な AIS タンパク質に直接結合し、ナトリウムチャネル活性8、9、および 186 kDa ニューロファスシンをAIS10に誘導する L1CAM である。480 kDa ankyrin-Gは、短い190kDaアンキリンGアイソフォーム(ANK反復、スペクトリン結合ドメイン、調節ドメイン)に見られる正規アンキリンドメインを共有するが、脊椎動物にのみ見られ、特にニューロンで発現している巨大なエキソンによって区別される(図1A)11、12。AIS形成12には、480kDaアンキリン-Gニューロン特異的ドメイン(NSD)が必要である。190 kDa ankyrin-G は、AIS アセンブリを促進したり、アンキリン-G-ヌルニューロン12で AIS を標的としたりしません。しかし、190kDaアンキリン-Gは480kDaアンキリン-G12を含むAISに集中している。野生型ニューロンの組み立てられたAISを標的とする190 kDa ankyrin-Gのこの能力は、文献の混乱の原因であり、AISアセンブリにおける480 kDa ankyrin-Gの重要な特殊機能の評価を遅らせてきた。したがって、組み立て済みのAISを欠いているankyrin-G-nullニューロンでAISアセンブリを研究することが重要です。
ここでは、ANK3-E22/23-floxマウスの培養海馬ニューロンを用いてAISの組み立てと構造を研究する方法を提示し、アンキリン-G13のアイソフォームをすべて排除する(図1B)。 AISが組み立てられる前にCre-BFP構造を持つニューロンをトランスフェクトすることによって、AISを完全に欠けているアンキリンG欠損ニューロンを生成した(図1B、図2)。AISのアセンブリは、クレBFPプラスミドを用いた480kDaアンキリン-G-GFPプラスミドの共同トランスフェクションに続いて完全に救出される。この方法は、事前にアセンブルされていない AIS 環境で AIS アセンブリを調査する方法を提供します。我々はまた、出生後マウスニューロンに適用するために、以前は胚性18ニューロンのために設計された抗生物質を使用せずにゲイリー・バンカーからグリアニューロン共培養システムを改変し、AIS14,15の変動を正常化するために複数のニューロンからのAIS測定を平均化するAIS定量法を適応した。
プロトコル
注:このヒマチニューロンの培養法は、出生後0日ANK3-E22/23f/fマウスから、ゲイリー・バンカーのグリア/ニューロン共培養系から適応される。 従って、殺菌された用具を使用してきれいなフードで解剖した後のすべてのステップを行うことが重要である。このプロトコルは最大 1 か月かかります。図3にワークフローが表示されます。プロトコルはデューク大学の動物のガイドラインに従います.
1. カバーリップと神経メッキ料理の準備
- 培養日の少なくとも1週間前に、カバースリップラックにカバースリップを積み込み、硝酸(70%W/W)に一晩浸します(数日延長することができます)。
- 硝酸処理されたカバーリップを、ガラス瓶の低速シェーカーに蒸留水で2回、それぞれ1時間洗浄します。
- 飽和KOH中のカバーリップを一晩100%エタノールに溶解するインキュベート。溶解しなくなるまで、KOHをエタノールに加えます。
- 蒸留水で洗浄工程を繰り返します。100%エタノールで10分間に1回のカバーリップをすすいすります。
- カバースリップをラックからガラスビーカーに移します。ビーカーをアルミホイルで覆います。カバーリップを一晩225°Cのオーブンで焼き、カバーリップを殺菌します。(カバーリップは何週間もビーカーに保存することができます)。
- ペトリ皿にカバースリップを入れ、カバースリップに3〜4ワックスドットを適用して足として機能させます。パスツールピペットを使用して、ガラス瓶にゆでたワックスを浸します。その後、カバースリップに素早く触れてドットを作成します。60 mm ペトリ皿は4つのカバーリップを握ることができる。10mmペトリ皿は~10個のカバーリップを保持できます。
- 培養日の2日前に、カバースリップ(ワックスドット付きの側)を塗布し、フィルターを1 mg/mLポリL-リジンを0.1Mホウ酸(pH 8.5)で最低6時間塗布し、水で2回、1時間ずつすすをする。カバースリップは同じペトリ皿に残っています。
- めっき培地(MEMはグルコース0.6%(wt/vol)と10%(vol/vol)馬の血清を補充)をカバーリップを邪魔することなくゆっくりとプレートに加えます。培養日まで培養器にプレートを入れてニューロンをシードします。
2. グリア細胞フィーダー料理の準備(培養日の2週間前)
- 出生後1日齢のマウスの脳から皮質を解剖し、髄液を剥がす。
- きれいなベンチできれいなペトリ皿にきれいなはさみで皮質組織をできるだけ細かく刻みます。
- 刻んだ組織をHBSSの12 mLに移し、2.5%トリプシンと1%(wt/vol)DNaseの1.5 mLを加えます。37°Cの水浴で15分間インキュベートし、5分ごとにスイングします。よく消化された組織は粘着性になり、大きなクラスターを形成します。10 mLピペットで10-15回トリチュレートして組織を分解し、より良い消化を得る。
- ほとんどのチャンクが消え、媒体が曇りに変わるまで、5 mLピペットでよく消化された組織を10〜15回トリチュレートします。細胞ストレーナーを通過して残りの塊を取り除き、グリア培地(最小必須培地(MEM)にグルコース(0.6%wt/vol)、10%(vol/vol)馬血清、ペニシリン・ストレプトマイシン(1x)を加えて消化を止めます。
- 細胞を120xgで5分間遠心し、上清を吸引する。新鮮なグリア培地で細胞ペレットを再懸濁し、細胞培養皿に種子を入れ替えます(約105細胞/cm2)。
- 翌日、培地を新鮮なグリア培地に置き換え、未接続の細胞を除去します。
- 3~4日ごとにグリアの新鮮なグリア培地でグリア料理を食べさせてくれ。フラスコを手で5~10回平手打ちし、緩やかに付着した細胞を取り除いてから培地を変える。
- 10日間の培養後、グリア細胞はほぼコンフルエントであるべきである。0.25%トリプシン-EDTAでグリア細胞を取り外し、新しい60mm細胞培養皿に約105 個の細胞を播種します。残りのセルは、将来の使用のために凍結することができます。
- 培養日の3日前に、グリア培地を神経細胞培地(1x GlutaMAX-Iおよび1x B27サプリメントを有するニューロバサル-A培地)に変更する。
3. 培養海馬ニューロン
注: すべてのステップは室温で行われます。
- 部屋温帯でペトリ皿にHBSS培地を持つ ANK3-E22/23f/f マウスからの出生後1日齢の子犬から6-8カバピケを解剖する。解剖はさみで海馬を小さく刻みます。ペトリ皿から15mLチューブに海馬を移します。
- 管のHBSSの5 mLと海馬2倍を洗う。海馬は洗浄後、1x HBSSの4.5 mLに放置します。
- 2.5 mLのトリプシンを4.5mLのHBSSに加え、37°Cの水浴で15分間インキュベートします。チューブを5分ごとに反転します。よく消化された海馬は粘着性になり、クラスターを形成する必要があります。必要に応じて、消化をさらに5分間延長します。
- HBSSで海馬を3回、それぞれ5分間洗います。HBSSを取り外す場合は、真空を使用 しないでください 。海馬を取り除くのは非常に簡単です。
- 洗浄後にHBSSの2 mLを追加し、パスツールピペットでカバカンピを上下にピペット15回追加します。
- 火で研磨されたパスツールピペット(開いた直径が半分に狭い)で組織を10回トリチュレートします。まだチャンクが残っていても、10回を超 えないでください 。オーバーヒアリングはニューロンを殺す。
- すべてのチャンクが底に設定されるまで5分間チューブを休ませます。1 mL ピペットチップを使用して、解約したニューロンを含む上清をメッキ皿(105 細胞/60 mm皿)に移します。事前にインキュベートしためっき媒体に直接加え、プレートを軽く振ります。
- 残りのチャンクの大部分が消えるまで、ステップ 3.6~3.7 を繰り返します。
- 播種後2~4時間、めっき皿を軽顕微鏡で確認します。ニューロンの大半はカバースリップに取り付けられているはずです。接続されたセルは丸く明るいです。細かい先端鉗子を使用して、前もって調整された神経細胞培養培地を下向きのワックスドットで覆う。
- ニューロンは、グリア細胞フィーダー皿で最大1ヶ月間成長することができます。新鮮な神経培養培地の1 mLで7日ごとにニューロンを供給します。
- 任意ステップ:播種後1週間、シトシンアラビノシド(1-β-D-アラビノシルシトシン)を5μMの最終濃度に加えてグリア増殖を抑制する。
4. ニューロン開発初期段階におけるAnkyrin-GのノックアウトによるAISの破壊
- 3 div(in vitro)で、ワックスドット側を向いたカバーリップを、ニューロン培養培地を条件付きのグリア細胞フィーダー皿にひっくり返します。
- 1.7 mLチューブに0.5μgのアンキリンG-GFP(WT/変異型)DNAを0.5 μgと混ぜて4つのカバーリップをトランスフェクトします(DNAコピー数の割合は~2:1)。100 μL の培養培地 (Opti-MEM など) を加え、ラックに混ぜて休みます。Cre-BFP のみがトランスフェクトされた場合、GFP プラスミドバックボーンを使用して DNA の総量に一致します。
- 3 μLのトランスフェクション試薬(例えば、リポフェクトアミン2000)を100μLの培養培地と100μLの新しい1.7 mLチューブに混合します。RTで5分間インキュベートします。
- ステップ4.2のDNA溶液100μLをステップ4.3から100μLのトランスフェクション試薬と混合します。ラックの上で5〜10分間休みます。
- ステップ4.4からステップ4.4から50 μLのDNAミックスを、カバーリップに触れることなく、先端を媒体のすぐ下に挿入して追加します。DNAミックスの拡散を避けるためにゆっくりとピペット。
- ゆっくりと皿をインキュベーターに戻し、30〜45分間インキュベートします。
- カバースリップをホームグリアフィーダー皿に戻し、ワックスドットを下に向け、プレートをインキュベーターに戻します。
5. 軸索初期セグメントの定量化
- 興味深いタンパク質の標準的な免疫細胞化学プロトコルに従って、7-10 div上のニューロンを修正し、AISマーカーで染色します。
- 希望の顕微鏡で蛍光画像を収集します。
- Zシリーズセクションを取り、AIS全体の信号を収集します。すべての画像に同じ Z 深度を保ちます。
- 最高のピクセル強度ダイナミックレンジに到達するためにレーザー強度を調整します。
- すべてのAIS写真が同じ顕微鏡設定で撮影されていることを確認してください。
- 常にクレBFPの信号を確認してください。
- AIS の定量化
- フィジー(https://fiji.sc)と一緒に写真を開きます。
- Z シリーズ画像の最大投影を生成します。
- 画像から空のカバースリップのバックグラウンド信号を引きます。
- AIS に沿って線を引きます。線の幅は AIS を完全にカバーする必要があります。AIS 信号がバックグラウンドの上に上がる前にラインを開始し、バックグラウンドにドロップした後で停止します。
- 平均ピクセル強度をラインだけで測定し、スプレッドシートにエクスポートします(~10~15個のAIが必要です)。
- ベルガーらから適応MATLABスクリプトを使用してAISの平均強度曲線を生成します。
- 各実験に対して、Cre onlyとCreプラスワイルドタイプ480 kDa ankyrin-Gトランスフェクションニューロンを陰性および陽性対照として含め、AISのノックアウトが効率を高め、救助が成功することを確認します。
結果
実験の完全なセットは、陰性対照としてクレ-BFPのトランスフェクションのみを含む必要があります, Cre-BFPプラス 480 kDa ankyrin-Gは、正のコントロールとして、非トランスフェクションの状態を技術制御として.Cre-BFPのみ制御において、トランスフェクトされたニューロンは、AnkG(ankG)、β4-スペクトリン(β4)、ニューロファシン(Nf)および電圧ゲートナトリウムチャネル(VSVG)を含むAISマーカーの蓄積を欠いている(図4A)16。対照的に、Creと480 kDaアンキリン-G共トランスフェクションニューロンは、AISマーカーの存在によって明らかにされたAISを完全に組み立てている(図4B)。非トランスフェクションされた料理と比較して、培養の質を確認することが重要です。不健康なニューロンは、中止または異所AISのような異常なAIS構造を示す傾向がある(図4C)。
次に、アンキリン-Gヒト神経発達障害変異(ankG-K2864N)がAISアセンブリに与える影響を評価する例を示した(図5)。3 div ANK3-E22/23f/f ニューロンは、Cre-BFPおよび野生型480 kDaアンキリンG(ankG-WT)または480 kDaアンキリンGバーリングヒト突然変異(ankG-K2864)でトランスフェクトされた。ニューロンはdiv7で固定され、アンキリンGのために染色された。画像は、同じカバーリップ上の10〜15のトランスフェクトニューロンと10〜15コントロールニューロンから収集され、最大強度投影で処理されました。次に、AIS で示すように線を引き、線全体の平均強度を測定します。AIS強度を平均した後、相馬から遠位軸索までのAIS強度をプロットします。AIS濃縮タンパク質は、通常、近位軸索からのシグナルの速い増加と遠位軸索への信号のゆっくりとした減少を示した。ヒト変異体を有するアンキリン-Gで組み立てられたAISは、シグナルの増加および減少を示した。しかし、非トランスフェクトAISと整列すると、変異曲線は広く、カーブのピークはAISの構造変化を示唆する低い。野生型アンキリンGは、非トランスフェクトされたものと密接に一致するAISを組み立てた。

図1:ANK3-E22/23-floxのゲノム編集。 (A)3アンキリン-Gアイソフォームのタンパク質ドメインの概略表現。正規ドメイン内のexon 22および23符号化領域の位置は、ダッシュ線で示される。(B) ANK3-E22/23-floxマウスにおけるLoxP部位の位置は三角形で示される。 クレリコンビナーゼの現在では、エキソン22および23が削除され、アンキリンGの3つのアイソフォームの全ての発現を失う原因となる。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:CREリコンビナーゼの存在におけるANK3-E22/23-フロックスニューロンにおけるAISの損失。 図は、3 divでCreトランスフェクションを持つANK3-E22/23f/fニューロンと対比する野生型ニューロンのアンキリンG発現およびAISアセンブリの時間枠を示しています。

図3:プロトコルのワークフローこの図の大きなバージョンを表示するには、ここをクリックしてください。
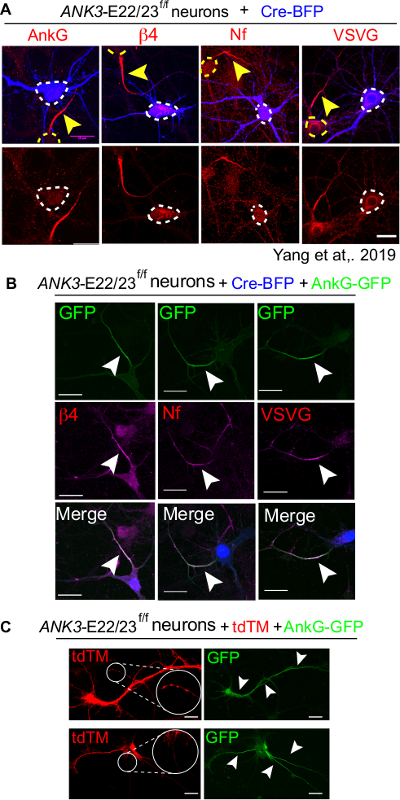
図4:CreにトランスフェクトしたANK3-E22/23-floxニューロンの480kDa AnkGによるAISの完全な救助。 ANK3-E22/23f/fマウスの3個のdivニューロンを、Cre-BFP(A)またはCre-BFPおよび野生型480kDaアンキリンG-GFP(B)でトランスフェクションした。ニューロンを7 divで固定し、アンキリンG(ankG)、β4-Spectrin(β4)、ニューロファスシン(Nf)および電圧ゲートナトリウムチャネル(VSVG)について染色した。白い矢印の頭は、トランスフェクトされたニューロンのAISを指しています。スケールバーは20μmです。この図は、ヤンら16から適応した。(C) tdTMおよび480 kDaアンキリン-G-GFPにトランスフェクトされた2つの不健康なニューロンが示された。凝集体の形成(白で丸で囲まれ、拡大)は、不健康なニューロンの徴候である。上:480 kDaアンキリン-Gは非AIS領域(白い矢印ヘッドで指す) に現れる。下:ニューロンは、3 AISと異所性蓄積を形成し、相馬にアンキリン-Gの蓄積。スケールバーは20μmです。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:AIS構造変化の定量化ANK3-E22/23f/fマウスのdiv3ニューロンを、Cre-BFPおよび野生型480kDaアンキリンGまたは480kDaアンキリン-G-K2864Nでトランスフェクトした。 7 divでは、ニューロンを固定し、アンキリンGに染色した。代表的な画像は、AISでのアンキリンG信号を示しています。緑色の線と黄色の線は、AIS強度測定の線が描かれた場所を示します。白いダッシュ線は、トランスフェクトされたニューロンの細胞体を囲んだ。スケールバーは20μmです。両方の条件の平均 AIS 強度は、距離を単独でプロットし、非トランスフェクトされた細胞 (n=10) に位置合わせされます。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
AISの組み立ては480 kDaアンキリン-Gによって組織される。しかし、ankyrin-Gは野生型ニューロンのAISを標的とすることができる短いアイソフォームを有し、AISアセンブリの構造機能解析の解釈が困難になる可能性がある。ここでは、AISのデノボアセンブリの研究を可能にするANK3-E22/23-floxマウスのニューロンを用いた方法を提示する。 3 divでCre-BFPでトランスフェクトすることにより、アンキリンGの内在性アイソフォームをすべて排除します。また、AISの形成を救うために480 kDa ankyrin-Gを共同トランスフェクトすることもできます。これにより、クリーンなシステムにおけるAIS形成の研究が可能になります。グリア細胞の過剰増殖を伴わずに生存率を向上させるバンカー培養システムをさらに採用することで、高いトランスフェクション効率に達し、AIS寸法の定量測定に十分なニューロンを提供することができました。
このプロトコルには、いくつかの重要な手順があります。最初の重要なステップは、AISの組み立てを防ぐのに十分早く、最高のトランスフェクション効率に達するのに十分遅れる必要があるトランスフェクションを行うための最良の時間枠を検討することです。クレ-BFPのみで約10%のトランスフェクション効率を与えた0 divエレクトロポレーショントランスフェクションを試しましたが、0divで480kDa Ankyrin-Gをトランスフェクトすることはできませんでした。プラスミドのサイズが大きいと考えられます(約20kb)。一次培養海馬ニューロンは、3〜5日の間であるトランスフェクションのための狭いウィンドウを持っています。AISでのアンキンGの蓄積は3divから始まります。3 divでCre-BFPをトランスフェクトすると、トランスフェクトされたニューロンではAIS形成は見られなかった(図4A)。180 kDa ankyrin-Gを1つの18mmカバースリップからトランスフェクトしたニューロンを10~20個得ることができました。また、共トランスフェクションレスキュー実験では、すべてのDNAを同じプロモーターで生成する必要があり、Cre-BFPと480 kDa ankyrin-G-GFPの比率を一致させる必要があります。今回の実験では、チキンβ-アクチンプロモーターを用いた。
もう 1 つの重要なステップは、バンカーカルチャの変更です。バンカー文化は、胚性ラットニューロンを培養するために開発されました。より敏感なマウスの出生後海馬ニューロンをより良くサポートするために、海馬を小さな部分に切り刻んでトリプシンの効率を向上させるステップが含まれています。硝酸処理後のKOH治療を加えることは、ガラスカバーリップからの毒性をさらに低下させ、ニューロンの付着と成長を改善するのに役立ちます。
残りの課題は、ankyrin-Gの発現レベルを制御する方法です。投薬用スクリーンは、トランスフェクションに使用されるプラスミドの最適な量を決定するのに役立ちました。今後は、ニューロン特異的プロモーターを使用して発現レベルを制御する方が良い。現在のデータ分析では、AIS の位置は測定されませんでした。この関数は将来に含まれる必要があります。
開示事項
著者らは開示するものは何もない。
謝辞
神経培養プロトコルに関する提案をしてくれたゲイリー・バンカー博士に感謝します。この研究は、ハワード・ヒューズ医学研究所、NIHからの助成金、ジョージ・バース・ゲラーが教授職(V.B.)によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 10xHBSS | Thermo Fisher Scientific | 14065-056 | |
| 18mm coverglass (1.5D) | Fisher Scientific | 12-545-84-1D | |
| 190kDa ankyrin-G-GFP | Addgene | #31059 | |
| 2.5% Tripsin without phenol red | Thermo Fisher Scientific | 14065-056 | |
| 480kDa ankyrin-G-GFP | lab made | Provide upon request | |
| ANK3-E22/23f/f mice | JAX | Stock No: 029797 | B6.129-Ank3tm2.1Bnt/J; |
| B27 serum-free supplement | Thermo Fisher Scientific | A3582801 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cell strainer with 70-mm mesh | BD Biosciences | 352350 | |
| Ceramic coverslip-staining rack | Thomas Scientific | 8542E40 | |
| Cre-BFP | Addgene | #128174 | |
| D-Glucose | Sigma-Aldrich | G7021 | |
| DMEM | Thermo Fisher Scientific | 11995073 | |
| GlutaMAX-I supplement | Thermo Fisher Scientific | A1286001 | |
| Lipofectamine 2000 | Thermo Fisher Scientific | 11668030 | |
| MEM with Earle’s salts and L-glutamine | Thermo Fisher Scientific | 11095-080 | |
| Neurobasal Medium | Thermo Fisher Scientific | 21103-049 | |
| Nitric acid 70% | Sigma-Aldrich | 225711 | |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher Scientific | 31985062 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin-streptomycin | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrochloride | Sigma-Aldrich | 26124-78-7 | |
| Potassium hydroxide | Sigma-Aldrich | 1310-58-3 |
参考文献
- Nelson, A. D., et al. Correction: Ankyrin-G regulates forebrain connectivity and network synchronization via interaction with GABARAP. Molecular Psychiatry. , (2019).
- Tseng, W. C., Jenkins, P. M., Tanaka, M., Mooney, R., Bennett, V. Giant ankyrin-G stabilizes somatodendritic GABAergic synapses through opposing endocytosis of GABAA receptors. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 1214-1219 (2015).
- Tai, Y., Gallo, N. B., Wang, M., Yu, J. R., Van Aelst, L. Axo-axonic Innervation of Neocortical Pyramidal Neurons by GABAergic Chandelier Cells Requires AnkyrinG-Associated L1CAM. Neuron. 102 (2), 358-372 (2019).
- Hofflin, F., et al. Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex. Frontiers in Cellular Neuroscience. 11, 332 (2017).
- Schluter, A., et al. Structural Plasticity of Synaptopodin in the Axon Initial Segment during Visual Cortex Development. Cerebral Cortex. 27 (9), 4662-4675 (2017).
- Kuba, H., Oichi, Y., Ohmori, H. Presynaptic activity regulates Na(+) channel distribution at the axon initial segment. Nature. 465 (7301), 1075-1078 (2010).
- Grubb, M. S., Burrone, J. Activity-dependent relocation of the axon initial segment fine-tunes neuronal excitability. Nature. 465 (7301), 1070-1074 (2010).
- Pan, Z., et al. A common ankyrin-G-based mechanism retains KCNQ and NaV channels at electrically active domains of the axon. Journal of Neuroscience. 26 (10), 2599-2613 (2006).
- Cooper, E. C. Made for "anchorin": Kv7.2/7.3 (KCNQ2/KCNQ3) channels and the modulation of neuronal excitability in vertebrate axons. Seminars in Cell & Developmental Biology. 22 (2), 185-192 (2011).
- Zhou, D., et al. AnkyrinG is required for clustering of voltage-gated Na channels at axon initial segments and for normal action potential firing. The Journal of Cell Biology. 143 (5), 1295-1304 (1998).
- Kordeli, E., Lambert, S., Bennett, V. AnkyrinG. A new ankyrin gene with neural-specific isoforms localized at the axonal initial segment and node of Ranvier. Journal of Biological Chemistry. 270 (5), 2352-2359 (1995).
- Jenkins, P. M., et al. Giant ankyrin-G: a critical innovation in vertebrate evolution of fast and integrated neuronal signaling. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 957-964 (2015).
- Jenkins, P. M., et al. E-cadherin polarity is determined by a multifunction motif mediating lateral membrane retention through ankyrin-G and apical-lateral transcytosis through clathrin. Journal of Biological Chemistry. 288 (20), 14018-14031 (2013).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1 (5), 2406-2415 (2006).
- Berger, S. L., et al. Localized Myosin II Activity Regulates Assembly and Plasticity of the Axon Initial Segment. Neuron. 97 (3), 555-570 (2018).
- Yang, R., et al. Neurodevelopmental mutation of giant ankyrin-G disrupts a core mechanism for axon initial segment assembly. Proceedings of the National Academy of Sciences of the U S A. 116 (39), 19717-19726 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved