Method Article
Uso di neuroni ippocampali coltivati primari per studiare l'assemblaggio dei segmenti iniziali di Axon
In questo articolo
Riepilogo
Qui, abbiamo descritto un protocollo per studiare quantitativamente l'assemblaggio e la struttura dei segmenti iniziali di axon (AIS) dei neuroni ippocampali che mancano di AIS pre-assemblato a causa dell'assenza di un anchirina-G gigante.
Abstract
I segmenti iniziali dell'assone neuronale (AIS) sono siti di iniziazione di potenziali d'azione e sono stati ampiamente studiati per la loro struttura molecolare, assemblaggio e plasticità dipendente dall'attività. L'anchirina gigante-G, il principale organizzatore dell'AIS, si associa direttamente ai canali del sodio gated al sodio (VSVG) e del potassio (KCNQ2/3), nonché alla neurofascina da 186 kDa, una molecola di adesione cellulare L1CAM. L'anchirina gigante-G si lega e recluta anche molecole di AIS citoplasmatiche tra cui beta-4-spectrin, e le proteine leganti i microtubuli, EB1/EB3 e Ndel1. L'anchirina gigante-G è sufficiente per salvare la formazione di AIS in neuroni carenti di anchirina-G. L'anchirina-G include anche un isoforma più piccolo da 190 kDa situato alle spine dendritiche invece dell'AIS, che non è in grado di mirare all'AIS o di salvare l'AIS in neuroni carenti di anchirina-G. Qui, abbiamo descritto un protocollo che utilizza neuroni ippocampali coltivati da topi ANK3-E22/23-flox, che, se trasfettato con Cre-BFP mostrano la perdita di tutta l'isoforma di anchirina-G e compromettono la formazione di AIS. Combinato un sistema di co-coltura Banker glia/neurone modificato, abbiamo sviluppato un metodo per trasfetto i neuroni nulli anchirina-G con un plasmide anchirina-G-GFP da 480 kDa, che è sufficiente per salvare la formazione di AIS. Utilizziamo inoltre un metodo di quantificazione, sviluppato da Salzer e colleghi per affrontare la variazione della distanza AIS dai corpi cellulari neuronali che si verifica nelle colture neuronali ippocampali. Questo protocollo consente studi quantitativi sull'assemblaggio de novo e sul comportamento dinamico dell'AIS.
Introduzione
Il segmento iniziale dell'assone si trova all'assone prossimale nella maggior parte dei neuroni vertebrati. Funzionalmente, AIS è il luogo in cui vengono avviati potenziali d'azione a causa dell'alta densità dei canali del sodio gated di tensione in questa regione. L'AIS di alcuni neuroni eccitatori è anche preso di mira da internauri inibitori formando sinapsi GABAergiche1,2,3. Pertanto, AIS è un sito critico per integrare la segnalazione cellulare e modulare l'eccitabilità dei neuroni. AIS è normalmente lungo 20-60 μm e si trova entro 20 μm dal corpo cellulare. La lunghezza e la posizione dell'AIS varia nei neuroni tra le regioni cerebrali, così come in diversi stadi di sviluppo dello stessoneurone 4,5. Le prove accumulate hanno suggerito che la composizione e la posizione dell'AIS sono dinamiche nel rispondere al cambiamento dell'attivitàneuronale4,5,6,7.
480 kDa ankyrin-G è il master organizer di AIS. 480 kDa anchirina-G è una proteina adattatore associata alla membrana che si lega direttamente ai canali del sodio gated di tensione e ad altre principali proteine AIS tra cui beta4-spectrina, canali KCNQ2/3 che modulano l'attività del canale del sodio8,9e 186 kDa neurofascina, un L1CAM che dirige le sinapsi GABAergice all'AIS2,10. 480 kDa ankyrin-G condivide domini di anchirina canonica trovati nel breve isoforma anchirina-G da 190 kDa (ANK ripete, dominio legante spectrin, dominio regolatore), ma si distinguono per un esone gigante che si trova solo nei vertebrati ed è specificamente espresso nei neuroni(Figura 1A)11,12. Il dominio specifico del neurone anchirina-G da 480 kDa (NSD) è necessario per la formazioneDIA 12. L'anchirina-G da 190 kDa non promuove l'assemblaggio AIS o l'AIS bersaglio nei neuroni anchirina-G-null12. Tuttavia, 190 kDa anchirina-G sono concentrati nell'AIS contenente 480 kDa anchirina-G12. Questa capacità dell'anchirina-G da 190 kDa di colpire l'AIS pre-assemblato dei neuroni di tipo selvatico è stata una fonte di confusione nella letteratura e ha rallentato l'apprezzamento delle funzioni critiche specializzate dell'anchirina-G da 480 kDa nell'assemblaggio AIS. Pertanto, è fondamentale studiare l'assemblaggio AIS in neuroni anchirina-G-null che mancano di un AIS pre-assemblato.
Qui presentiamo un metodo per studiare l'assemblaggio e la struttura dell'AIS utilizzando neuroni ippocampali coltivati da topi ANK3-E22/23-flox che elimina tutte le isoforme di anchirina-G13 (Figura 1B). Trasfettando i neuroni con un costrutto Cre-BFP prima che l'AIS sia assemblato, abbiamo generato neuroni carenti di anchirina-G completamente privi di AIS (Figura 1B, Figura 2). L'assemblaggio dell'AIS è completamente salvato a seguito della co-trasfezione di 480 kDa anchirina-G-GFP plasmide con un plasmide Cre-BFP. Questo metodo consente di studiare l'assembly AIS in un ambiente AIS non preassemblato. Abbiamo anche modificato il sistema di co-coltura glia-neurone da Gary Banker senza utilizzare antibiotici, precedentemente progettato per i neuroni del giorno embrionale 18, perl'applicazioneai neuroni del topo postnatale e adattato un metodo di quantificazione AIS alle misurazioni medie AIS da più neuroni per normalizzare la variazione di AIS 14,15.
Protocollo
NOTA: Questo metodo di coltura dei neuroni ippocampali dai topi ANK3-E22/23f/f postnatali è adattato dal sistema di co-coltura glia/neurone di Gary Banker. Pertanto, è fondamentale eseguire tutti i passaggi dopo la dissezione in una cappa pulita utilizzando strumenti sterilizzati. Questo protocollo richiede fino a 1 mese. Il flusso di lavoro viene visualizzato nella figura 3. Il protocollo segue le linee guida sugli animali della Duke University.
1. Preparazione di coverlips e piatti di placcatura neuronale
- Almeno una settimana prima del giorno di coltura, caricare le coperture sul rack di coverlip e immergerlo in acido nitrico (70% W / W) durante la notte (potrebbe essere esteso per giorni).
- Lavare le copertine trattate con acido nitrico con acqua distillata su uno shaker a bassa velocità in un barattolo di vetro 2 volte, 1 ora ciascuna.
- Incubare le copertine in KOH saturo sciolte al 100% di etanolo durante la notte. Aggiungere KOH in etanolo fino a quando non è più sciolto.
- Ripetere il passaggio di lavaggio con acqua distillata. Risciacquare le coverlips con etanolo al 100% una volta per 10 minuti.
- Trasferire le coverlips dal rack a un bicchiere di vetro. Coprire il becher con un foglio di alluminio. Cuocere le coverlips in un forno a 225 °C durante la notte per sterilizzare i copripasci. (Le copertine potrebbero essere conservate nel becher per settimane).
- Posizionare le copertine in una piastra di Petri e quindi applicare 3-4 punti di cera sul coperchio per fungere da piedi. Utilizzare una pipetta Pasteur per immergersi in cera bollita in una bottiglia di vetro. Quindi toccare rapidamente il coverslip per creare un punto. Una piastra di Petri da 60 mm può contenere 4 coverlips. Una piastra di Petri da 10 mm può contenere ~10 coverlips.
- 2 giorni prima del giorno della coltura, rivestire le labbra (il lato con i punti di cera) con filtro sterilizzato 1 mg/mL poli-L-lisina in acido borico 0,1 M (pH 8,5) per un minimo di 6 ore e risciacquare con acqua 2 volte, 1 ora ogni volta. Le coverlips rimangono nella stessa piastra di Petri.
- Aggiungere lentamente il mezzo di placcatura (MEM integrato con glucosio 0,6% (wt/vol) e 10% (vol/vol) siero di cavallo) alle piastre senza disturbare le coperture. Metti le piastre nell'incubatrice fino al giorno della coltura per seminare i neuroni.
2. Preparazione di piatti di alimentazione a celle glia (2 settimane prima del giorno della coltura)
- Sezionare la corteccia da un cervello postnatale di topi di 1 giorno e staccare le meningi.
- Tritare il tessuto della corteccia nel modo più fine possibile con forbici pulite in una piastra di Petri pulita in una panca pulita.
- Trasferire il tessuto tritato in 12 mL di HBSS e aggiungere 1,5 mL di tripside al 2,5% e 1% (wt/vol) DNasi. Incubare in un bagno d'acqua a 37 °C per 15 minuti, oscillare ogni 5 minuti. Beh, i tessuti digeriti diventano appiccicosi e formano un grande ammasso. Triturato 10-15 volte con una pipetta da 10 mL per abbattere il tessuto e ottenere una migliore digestione.
- Triturare il tessuto ben digerito 10-15 volte con una pipetta da 5 mL fino a quando la maggior parte dei pezzi scompare e il mezzo diventa torbido. Passare attraverso un colino cellulare per rimuovere i pezzi rimanenti e aggiungere 15 mL di mezzo glia (Mem (Minimal essential medium) integrato con glucosio (0,6% wt/vol), siero di cavallo 10% (vol/vol) e Penicillina-Streptomicina (1x) per fermare la digestione.
- Centrifugare le cellule a 120 x g per 5 minuti e aspirare il supernatante. Risospendare il pellet cellulare con mezzo glia fresco e semi in piatti di coltura cellulare (circa 105 celle/cm2).
- Sostituire il mezzo con un mezzo glia fresco il giorno successivo per rimuovere le celle non attaccate.
- Dai da mangiare ai piatti glia ogni 3-4 giorni con mezzo glia fresco. Schiaffeggiare il pallone 5-10 volte con una mano per spostare le cellule liberamente attaccate prima di cambiare il mezzo.
- Dopo 10 giorni di coltura, le cellule glia dovrebbero essere quasi confluenti. Staccare le cellule glia con lo 0,25% di tripside-EDTA e seminare circa 105 cellule in un nuovo piatto di coltura cellulare da 60 mm. Le cellule rimanenti potrebbero essere congelate per un uso futuro.
- 3 giorni prima del giorno della coltura, cambiare il mezzo di coltura da glia medio a neuronale (Neurobasal-A Medium con 1x GlutaMAX-I e 1x B27 supplemento).
3. Cultura neuroni ippocampali
NOTA: Tutti i passaggi vengono eseguiti a temperatura ambiente.
- Sezionare 6-8 ippocampi da cuccioli postnatali di 1 giorno da topi ANK3-E22/23f/f con mezzo HBSS in una piastra di Petri a temperatura ambiente temperata. Tritare gli ippocampi con forbici di dissezione a pezzi più piccoli. Trasferire gli ippocampi dalla piastra di Petri a un tubo da 15 ml.
- Lavare hippocampi 2x con 5 ml di HBSS nel tubo. Lasciare gli ippocampi in 4,5 mL di 1x HBSS dopo il lavaggio.
- Aggiungere 0,5 mL di tripside del 2,5% in 4,5 mL di HBSS e incubare in un bagno d'acqua a 37 °C per 15 minuti. Invertire il tubo ogni 5 minuti. Gli ippocampi ben digeriti dovrebbero diventare appiccicosi e formare un ammasso. Se necessario, prolungare la digestione per altri 5 minuti.
- Lavare gli ippocampi con HBSS 3 volte per 5 minuti ciascuno. Non utilizzare un vuoto per rimuovere l'HBSS. È molto facile rimuovere gli ippocampi.
- Aggiungere 2 mL di HBSS dopo il lavaggio e pipettare l'ippocampi su e giù con una pipetta Pasteur 15 volte.
- Triturare il tessuto con una pipetta Pasteur lucidata dal fuoco (il diametro dell'aperto è ristretto della metà) 10 volte. Non andare oltre 10 volte anche se ci sono ancora blocchi rimanenti. Il surriscaldamento uccide i neuroni.
- Riposare il tubo per 5 minuti fino a quando tutti i pezzi sono impostati sul fondo. Utilizzare delicatamente una punta di pipetta da 1 mL per trasferire il supernatante contenente i neuroni dissociati a piatti placcanti (piattoda 10 5 cellule / 60 mm). Aggiungerlo direttamente al mezzo di placcatura pre-incubato e agitare delicatamente la piastra.
- Ripetere il passaggio 3.6-3.7 con i blocchi rimanenti fino a quando la maggior parte dei pezzi non è scomparsa.
- 2-4 ore dopo la semina, controllare le stoviglie con un microscopio leggero. La maggior parte dei neuroni avrebbe dovuto attaccarsi al coverslip. Le celle attaccate sono rotonde e luminose. Capovolgere le copertine usando una punta fine si invola verso i piatti dell'alimentatore di cellule glia con mezzo di coltura neuronale precondizione con il lato dei punti di cera rivolto verso il basso.
- I neuroni possono crescere nei piatti di alimentazione delle cellule glia per un massimo di 1 mese. Nutrire i neuroni ogni 7 giorni con 1 mL di mezzo di coltura neuronale fresco.
- Passo opzionale: 1 settimana dopo la semina, aggiungere citosina arabinoside (1-β-D-arabinofuranosilcitosina) a una concentrazione finale di 5 μM per frenare la proliferazione gliale.
4. Interruzione dell'AIS da parte del knockout di Ankyrin-G nella fase precedente dello sviluppo dei neuroni
- Su 3 div (giorno in vitro),capovolgere i copripavimenti con punti di cera rivolti verso un piatto di alimentazione a cellule glia con mezzo di coltura neuronale condizionato.
- Mescolare 0,25 μg di DNA Cre-BFP con 0,5 μg di DNA anchirina-G-GFP (WT/mutante) in un tubo da 1,7 ml per trasfetto 4 coverlips (~ rapporto 2:1 del numero di copia del DNA). Aggiungere 100 μL di mezzo di coltura (ad esempio Opti-MEM), mescolare e riposare su un rack. Se viene transfettato solo cre-BFP, la spina dorsale plasmide GFP viene utilizzata per corrispondere alla quantità totale di DNA.
- Mescolare 3 μL di reagente di trasfezione (ad esempio, Lipofectamina 2000) (~ 3 volte di DNA) con mezzo di coltura di 100 μL in un nuovo tubo da 1,7 ml. Incubare per 5 minuti a RT.
- Mescolare 100 μL di soluzione di DNA dal passo 4.2 con 100 μL di reagente di trasfezione dal passo 4.3. Riposare per 5-10 minuti su un rack.
- Aggiungere 50 μL di miscela di DNA dal passo 4.4 proprio sopra ogni coverlip inserendo la punta appena sotto il mezzo senza toccare i copripacchi. Pipetta lentamente per evitare la diffusione del mix di DNA.
- Riportare lentamente il piatto nell'incubatrice e incubare per 30-45 minuti.
- Capovolgere i copripasta fino al piatto di alimentazione glia di casa con punti di cera rivolti verso il basso e rimettere il piatto nell'incubatrice.
5. Quantificazione del segmento iniziale di Axon
- Fissare i neuroni su 7-10 div e macchiare con marcatore AIS seguendo il protocollo immunocitochimica standard per la proteina di interessante.
- Raccogli immagini fluorescenti con la microscopia desiderata.
- Prendi le sezioni della serie Z per raccogliere il segnale dell'intero AIS. Mantieni la stessa profondità Z per tutte le immagini.
- Regola l'intensità del laser per raggiungere il miglior intervallo dinamico di intensità dei pixel.
- Assicurati che tutte le foto AIS siano scattate sulla stessa configurazione del microscopio.
- Controllare sempre il segnale di Cre-BFP.
- Quantificazione AIS
- Immagine aperta con Fiji (https://fiji.sc).
- Genera la massima proiezione di immagini della serie Z.
- Sottrarre il segnale di sfondo del coverslip vuoto dall'immagine.
- Disegna una linea lungo l'AIS. La larghezza della linea dovrebbe coprire completamente l'AIS. Avviare la linea prima che il segnale AIS sia sollevato sopra lo sfondo e fermarsi dopo che è uscita in background.
- Misura l'intensità media dei pixel da sola la linea ed esporta in un foglio di calcolo (sono necessari ~ 10-15 AIS).
- Generare la curva di intensità media di AIS utilizzando lo script MATLAB adattato da Berger etal.
- Per ogni esperimento, includere solo Cre e Cre più i neuroni trasfetati di anchirina-G di tipo selvaggio 480 kDa come controlli negativi e positivi per assicurarsi che il knockout dell'AIS sia efficienza e che il salvataggio abbia successo.
Risultati
Una serie completa di esperimenti dovrebbe includere la trasfezione solo Cre-BFP come controllo negativo, Cre-BFP più 480 kDa di co-trasfezione anchirina-G come controllo positivo e una condizione non trasfettata come controllo della tecnica. Nel controllo solo Cre-BFP, i neuroni trasfetti mancano dell'accumulo di marcatori AIS, tra cui anchirina-G (ankG), beta4-spectrina (β4), neurofascina (Nf) e canali di sodio gated di tensione (VSVG)(Figura 4A)16. Al contrario, i neuroni co-trasfetati Cre e 480 kDa ankyrin-G hanno completamente assemblato l'AIS rivelato dal presente dei marcatori AIS (Figura 4B). È importante confermare la qualità della cultura confrontandola con i piatti non trasfetturati. I neuroni malsani tendono a mostrare una struttura AIS anomala, come l'AIS fuori produzione o ectopica (Figura 4C).
Poi abbiamo mostrato un esempio di valutazione di come una mutazione del disturbo del neurosviluppo umano anchirina-G (ankG-K2864N) influenzi l'assemblaggio AIS(Figura 5). 3 div ANK3-E22/23f/f neuroni sono stati trasfetati con Cre-BFP e wildtype 480 kDa ankyrin-G (ankG-WT) o 480 kDa anchirina-G che barano la mutazione umana (ankG-K2864). I neuroni sono stati fissati a div7 e macchiati per l'anchirina-G. Le immagini sono state raccolte da 10-15 neuroni trasfettati e 10-15 neuroni di controllo sugli stessi coprispavimenti ed elaborate con proiezione di massima intensità. Quindi disegniamo una linea all'AIS come mostrato e misuriamo l'intensità media attraverso la linea. Dopo aver mediato l'intensità AIS, tracciamo l'intensità AIS dal soma all'assone distale. La proteina arricchita di AIS normalmente mostrava un rapido aumento del segnale dall'assone prossimale e una lenta diminuzione del segnale all'assone distale. L'AIS assemblato da anchirina-G con mutante umano mostrò un aumento e una diminuzione del segnale. Ma quando è allineata con l'AIS non trasfettata, la curva mutante è più ampia, e il picco della curva è inferiore suggerendo un cambiamento di struttura dell'AIS. Il tipo selvaggio ankyrin-G assemblato AIS strettamente allineato con quello non trasfetto.

Figura 1: L'editing genomico di ANK3-E22/23-flox. (A) Rappresentazione schematica dei domini proteici per 3 isoforme anchirina-G. La posizione delle regioni codificate exon 22 e 23 nel dominio canonico è puntata dalla linea del trattino. (B) La posizione dei siti LoxP nei topi ANK3-E22/23-flox è indicata dal triangolo. Nel presente di Cre ricombinasi, l'esone 22 e 23 viene cancellato e causa perdita l'espressione di tutte e 3 le isoforme di anchirina-G. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Perdita di AIS nei neuroni ANK3-E22/23-flox nel presente della ricombinazione cre. Un diagramma mostra l'ora dell'espressione anchirina-G e l'assemblaggio AIS nei neuroni di tipo selvaggio rispetto ai neuroni F/F ANK3-E22/23 con trasfezione Cre a 3 div.

Figura 3: Flusso di lavoro del protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
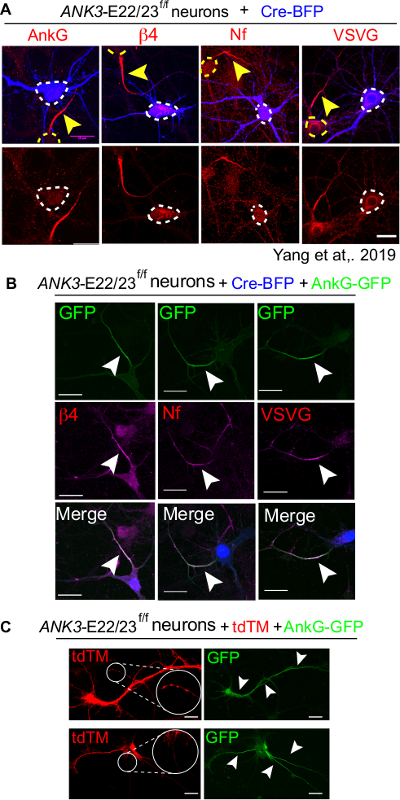
Figura 4: Un salvataggio completo di AIS di 480kDa AnkG nei neuroni ANK3-E22/23-flox trasfettato con Cre. 3 neuroni div di topi ANK3-E22/23f/f sono stati trasfetati con Cre-BFP (A) o con un Cre-BFP e un tipo selvaggio 480 kDa anchirina-G-GFP (B). I neuroni sono stati fissati a 7 div e macchiati per i canali del sodio anchirina-G (ankG), β4-spectrin (β4), neurofascina (Nf) e tensione gated sodium channels (VSVG). La testa di freccia bianca punta all'AIS di un neurone trasfetto. La barra di scala è di 20 μm. Questa cifra è stata adattata da Yang et al16. (C) Sono stati mostrati due neuroni malsani trasfettato con tdTM e 480 kDa anchirina-G-GFP. La formazione di aggregati (cerchiati in bianco e ingranditi) è un segno di neuroni malsani. In alto: 480 kDa anchirina-G si presenta nella regione non AIS (puntata da punte di freccia bianche. Fondo: Neurone formato 3 AIS e accumulo ectopico di anchirina-G su soma. La barra di scala è di 20 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Quantificazione dei cambiamenti strutturali dell'AIS. I neuroni div3 dei topi ANK3-E22/23f/f sono stati trasfetati con Cre-BFP e anchirina-G di tipo selvatico 480 kDa o anchirina-G-K2864N da 480 kDa. A 7 div, i neuroni erano fissi e macchiati per l'anchirina-G. Le immagini rappresentative mostrano il segnale anchirina-G all'AIS. La linea verde e la linea gialla indicano dove è stata tracciata la linea per la misurazione dell'intensità AIS. La linea del trattino bianco circondava il corpo cellulare del neurone trasfetto. La barra di scala è di 20 μm. L'intensità media AIS per entrambe le condizioni viene tracciata da sola e allineata con le celle non trasfette (n=10). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'assemblaggio dell'AIS è organizzato da 480 kDa ankyrin-G. Tuttavia, l'anchirina-G ha isoforme più corte che possono colpire l'AIS dei neuroni di tipo selvatico, il che può portare a difficoltà nell'interpretazione delle analisi struttura-funzione dell'assemblaggio AIS. Qui presentiamo un metodo che utilizza neuroni di topi ANK3-E22/23-flox che consente lo studio dell'assemblaggio de novo dell'AIS. Transfettando con Cre-BFP a 3 div, eliminiamo tutte le isoforme endogene di anchirina-G. Potremmo anche co-trasfetto 480 kDa ankyrin-G per salvare la formazione di AIS. Ciò consente lo studio della formazione ais in un sistema pulito. Adottando ulteriormente il sistema di coltura Banker che migliora la vitalità senza complicazioni di sovrase crescita delle cellule gliali, potremmo raggiungere un'elevata efficienza di trasfezione, che ci fornisce abbastanza neuroni per la misurazione quantitativa delle dimensioni AIS.
Ci sono diversi passaggi critici in questo protocollo. Il primo passo critico è considerare il miglior lacito di tempo per eseguire la trasfezione, che deve essere abbastanza presto per impedire l'assemblaggio di AIS e abbastanza tardi da raggiungere la massima efficienza di trasfezione. Abbiamo provato la trasfezione per elettroporazione a 0 div, che ha dato circa il 10% di efficienza di trasfezione solo con Cre-BFP, ma non siamo mai stati in grado di trasfezionare 480 kDa Ankyrin-G a 0 div. Sospettiamo che sia dovuto alle grandi dimensioni del plasmide (circa 20 kb). I neuroni ippocampali coltivati primari hanno una finestra stretta per la trasfezione, che è compresa tra 3-5 giorni. L'accumulo di anchirina-G all'AIS parte da 3 div. Quando trasfetteiamo Cre-BFP a 3 div, non è stata osservata alcuna formazione AIS nei neuroni trasfettati (Figura 4A). Potremmo ottenere 10-20 neuroni trasfettato con 480 kDa anchirina-G da un coverslip da 18 mm. Inoltre, per l'esperimento di salvataggio della co-trasfezione, tutto il DNA deve essere generato sotto lo stesso promotore e il rapporto tra Cre-BFP e 480 kDa ankyrin-G-GFP deve essere abbinato. In questo esperimento, abbiamo usato il promotore beta-actina di pollo.
Un altro passo fondamentale è la modifica della cultura banchiere. La cultura di Banker è stata sviluppata per coltivare neuroni di ratto embrionali. Per supportare meglio il neurone ippocampale postnatale del topo più sensibile, includiamo un passaggio di taglio degli ippocampi in pezzi più piccoli per migliorare l'efficienza di tripsicinazione. L'aggiunta del trattamento koh dopo il trattamento con acido nitrico ha ulteriormente ridotto la tossicità dai coprispacchi di vetro, che aiutano i neuroni ad attaccarsi e crescere meglio.
Una sfida rimanente è come controllare il livello di espressione di ankyrin-G. Uno schermo di dosaggio ha contribuito a determinare la quantità ottimale di plasmide utilizzato per la trasfezione. In futuro, è meglio usare un promotore specifico per i neuroni per controllare il livello di espressione. L'analisi dei dati corrente non ha misurato la posizione dell'AIS. Questa funzione dovrebbe essere inclusa in futuro.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Dr. Gary Banker per il suggerimento sul protocollo sulla cultura neuronale. Questo lavoro è sostenuto dall'Howard Hughes Medical Institute, una borsa di studio della NIH e una cattedra dotata di George Barth Geller (V.B.).
Materiali
| Name | Company | Catalog Number | Comments |
| 10xHBSS | Thermo Fisher Scientific | 14065-056 | |
| 18mm coverglass (1.5D) | Fisher Scientific | 12-545-84-1D | |
| 190kDa ankyrin-G-GFP | Addgene | #31059 | |
| 2.5% Tripsin without phenol red | Thermo Fisher Scientific | 14065-056 | |
| 480kDa ankyrin-G-GFP | lab made | Provide upon request | |
| ANK3-E22/23f/f mice | JAX | Stock No: 029797 | B6.129-Ank3tm2.1Bnt/J; |
| B27 serum-free supplement | Thermo Fisher Scientific | A3582801 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cell strainer with 70-mm mesh | BD Biosciences | 352350 | |
| Ceramic coverslip-staining rack | Thomas Scientific | 8542E40 | |
| Cre-BFP | Addgene | #128174 | |
| D-Glucose | Sigma-Aldrich | G7021 | |
| DMEM | Thermo Fisher Scientific | 11995073 | |
| GlutaMAX-I supplement | Thermo Fisher Scientific | A1286001 | |
| Lipofectamine 2000 | Thermo Fisher Scientific | 11668030 | |
| MEM with Earle’s salts and L-glutamine | Thermo Fisher Scientific | 11095-080 | |
| Neurobasal Medium | Thermo Fisher Scientific | 21103-049 | |
| Nitric acid 70% | Sigma-Aldrich | 225711 | |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher Scientific | 31985062 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin-streptomycin | Thermo Fisher Scientific | 15140122 | |
| Poly-L-lysine hydrochloride | Sigma-Aldrich | 26124-78-7 | |
| Potassium hydroxide | Sigma-Aldrich | 1310-58-3 |
Riferimenti
- Nelson, A. D., et al. Correction: Ankyrin-G regulates forebrain connectivity and network synchronization via interaction with GABARAP. Molecular Psychiatry. , (2019).
- Tseng, W. C., Jenkins, P. M., Tanaka, M., Mooney, R., Bennett, V. Giant ankyrin-G stabilizes somatodendritic GABAergic synapses through opposing endocytosis of GABAA receptors. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 1214-1219 (2015).
- Tai, Y., Gallo, N. B., Wang, M., Yu, J. R., Van Aelst, L. Axo-axonic Innervation of Neocortical Pyramidal Neurons by GABAergic Chandelier Cells Requires AnkyrinG-Associated L1CAM. Neuron. 102 (2), 358-372 (2019).
- Hofflin, F., et al. Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex. Frontiers in Cellular Neuroscience. 11, 332 (2017).
- Schluter, A., et al. Structural Plasticity of Synaptopodin in the Axon Initial Segment during Visual Cortex Development. Cerebral Cortex. 27 (9), 4662-4675 (2017).
- Kuba, H., Oichi, Y., Ohmori, H. Presynaptic activity regulates Na(+) channel distribution at the axon initial segment. Nature. 465 (7301), 1075-1078 (2010).
- Grubb, M. S., Burrone, J. Activity-dependent relocation of the axon initial segment fine-tunes neuronal excitability. Nature. 465 (7301), 1070-1074 (2010).
- Pan, Z., et al. A common ankyrin-G-based mechanism retains KCNQ and NaV channels at electrically active domains of the axon. Journal of Neuroscience. 26 (10), 2599-2613 (2006).
- Cooper, E. C. Made for "anchorin": Kv7.2/7.3 (KCNQ2/KCNQ3) channels and the modulation of neuronal excitability in vertebrate axons. Seminars in Cell & Developmental Biology. 22 (2), 185-192 (2011).
- Zhou, D., et al. AnkyrinG is required for clustering of voltage-gated Na channels at axon initial segments and for normal action potential firing. The Journal of Cell Biology. 143 (5), 1295-1304 (1998).
- Kordeli, E., Lambert, S., Bennett, V. AnkyrinG. A new ankyrin gene with neural-specific isoforms localized at the axonal initial segment and node of Ranvier. Journal of Biological Chemistry. 270 (5), 2352-2359 (1995).
- Jenkins, P. M., et al. Giant ankyrin-G: a critical innovation in vertebrate evolution of fast and integrated neuronal signaling. Proceedings of the National Academy of Sciences of the U S A. 112 (4), 957-964 (2015).
- Jenkins, P. M., et al. E-cadherin polarity is determined by a multifunction motif mediating lateral membrane retention through ankyrin-G and apical-lateral transcytosis through clathrin. Journal of Biological Chemistry. 288 (20), 14018-14031 (2013).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocol. 1 (5), 2406-2415 (2006).
- Berger, S. L., et al. Localized Myosin II Activity Regulates Assembly and Plasticity of the Axon Initial Segment. Neuron. 97 (3), 555-570 (2018).
- Yang, R., et al. Neurodevelopmental mutation of giant ankyrin-G disrupts a core mechanism for axon initial segment assembly. Proceedings of the National Academy of Sciences of the U S A. 116 (39), 19717-19726 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon