Method Article
Modello in vitro che integra la rigidità e il flusso del substrato per studiare le risposte delle cellule endoteliali
In questo articolo
Riepilogo
Abbiamo sintetizzato e caratterizzato un substrato sintonizzabile a base di gelatina per la coltura di cellule endoteliali vascolari (EC) in condizioni di flusso vascolare rilevanti. Questa superficie biomimetica replica sia le condizioni fisiologiche che quelle patologiche, consentendo lo studio delle forze meccaniche sul comportamento EC e facendo progredire la nostra comprensione della salute vascolare e dei meccanismi delle malattie.
Abstract
Presentiamo un innovativo modello in vitro volto a studiare gli effetti combinati della rigidità tissutale e dello stress di taglio sulla funzione delle cellule endoteliali (EC), che sono cruciali per comprendere la salute vascolare e l'insorgenza di malattie come l'aterosclerosi. Tradizionalmente, gli studi hanno esplorato gli impatti dello sforzo di taglio e della rigidezza del substrato sulle EC, in modo indipendente. Tuttavia, questo sistema integrato combina questi fattori per fornire una simulazione più precisa dell'ambiente meccanico del sistema vascolare. L'obiettivo è quello di esaminare la meccanotrasduzione delle EC in vari livelli di rigidità tissutale e condizioni di flusso utilizzando EC umane. Descriviamo in dettaglio il protocollo per sintetizzare idrogel di gelatina metacrilato (GelMA) con rigidità regolabile e seminarli con EC per ottenere la confluenza. Inoltre, descriviamo la progettazione e l'assemblaggio di una camera di flusso economica, integrata da simulazioni di fluidodinamica computazionale, per generare condizioni di flusso fisiologiche caratterizzate da flusso laminare e livelli di sforzo di taglio appropriati. Il protocollo incorpora anche la marcatura a fluorescenza per la microscopia confocale, consentendo la valutazione delle risposte EC sia alla compliance tissutale che alle condizioni di flusso. Sottoponendo le EC in coltura a più stimoli meccanici integrati, questo modello consente indagini complete su come fattori come l'ipertensione e l'invecchiamento possano influenzare la funzione EC e le malattie vascolari mediate dalla EC. Le conoscenze acquisite da queste indagini saranno fondamentali per chiarire i meccanismi alla base delle malattie vascolari e per sviluppare strategie di trattamento efficaci.
Introduzione
L'endotelio, che riveste la superficie interna dei vasi sanguigni, svolge un ruolo fondamentale nel mantenimento della salute vascolare. Le cellule endoteliali (EC) sono fondamentali per la regolazione di varie funzioni cardiovascolari, tra cui il controllo del tono dei vasi, la permeabilità selettiva, l'emostasi e la meccanotrasduzione 1,2. La ricerca ha strettamente collegato la disfunzione EC a un ruolo primario nello sviluppo dell'aterosclerosi. In particolare, le EC incontrano diverse forze meccaniche alle interfacce in cui interagiscono con il flusso sanguigno e i tessuti dei vasi sottostanti 3,4. Diversi studi hanno associato la disfunzione EC a cambiamenti anomali nei fattori meccanici all'interno dell'ambiente vascolare, come lo stress da taglio dei fluidi dovuto al flusso sanguigno e la rigidità dei tessuti 5,6,7.
Tuttavia, la ricerca precedente ha ricevuto un'attenzione limitata nella comprensione degli effetti combinati della rigidità dei tessuti e dello stress di taglio sulla funzione EC. Per migliorare la capacità di tradurre i risultati della ricerca in trattamenti efficaci per l'aterosclerosi e altre malattie cardiovascolari, è essenziale migliorare i modelli cellulari utilizzati sul campo. Sono stati compiuti progressi significativi nell'umanizzazione dei modelli cellulari impiegando EC umane e sottoponendole a stress di taglio o substrati con livelli di rigidità variabili 8,9,10. Tuttavia, l'adozione e il perfezionamento di modelli cellulari che integrano ambienti di flusso dinamico con substrati EC che possiedono proprietà di rigidità regolabili è progredito lentamente. La sfida consiste nell'ideare substrati EC non rigonfi per prevenire alterazioni dei parametri di flusso all'interno del canale di flusso, facilitando al contempo la coltivazione di monostrati EC intatti e ben aderenti. Un modello in vitro in grado di superare questi ostacoli potrebbe facilitare indagini più efficaci su come l'ipertensione, l'invecchiamento e le condizioni di flusso influenzino in modo collaborativo la meccanotrasduzione EC, la salute vascolare e, in ultima analisi, lo sviluppo dell'aterosclerosi. Sono stati sviluppati vari metodi per applicare lo sforzo di taglio sulle celle controllando la rigidità del substrato, tra cui piastre rotanti e dispositivi microfluidici. Nel metodo delle piastre rotanti, le celle vengono posizionate tra due piastre e la sollecitazione di taglio viene applicata attraverso il movimento rotatorio delle piastre. Questo metodo è meno complicato e fornisce un modello rapido; Tuttavia, soffre di una variazione spaziale dello sforzo di taglio, con zero sforzo di taglio al centro e massimo sforzo di taglio alla periferia11.
D'altra parte, i dispositivi microfluidici rappresentano la nuova generazione di strumenti con la capacità di controllare la rigidità del substrato e le condizioni di flusso. Questi sistemi sono adatti per imitare le microvascolarature in condizioni di flusso laminare. Tuttavia, lo studio dell'aterosclerosi con tali dispositivi non è pratico, poiché l'aterosclerosi si verifica in grandi vasi con flusso disturbato11. Questo articolo si propone di contribuire al dominio critico della ricerca sugli studi EC presentando un sistema economico in grado di esaminare gli effetti dei diversi livelli di rigidità nei substrati EC in diverse condizioni di flusso. Il sistema integra substrati con diverse rigidità per emulare vasi sanguigni patologici e fisiologici. Questo protocollo delinea il metodo per la creazione di idrogel a base di gelatina senza rigonfiamento e livelli di rigidità di 5 kPa e 10 kPa, che rappresentano rispettivamente rigidità fisiologica e patologica. Inoltre, viene descritta in dettaglio la costruzione di una camera di flusso a piastre parallele in grado di integrare questi substrati. La fluidodinamica computazionale (CFD) è stata impiegata per valutare le condizioni di sforzo di taglio e di flusso. Vengono descritti la preparazione di idrogel per la coltura EC e l'esecuzione di un esperimento a flusso di 6 ore, seguito da una discussione sull'immunocolorazione post-esperimento.
Protocollo
1. Sintesi di GelMA
- Preparare una soluzione 0,2 M di carbonato di sodio anidro e una soluzione 0,2 M di bicarbonato di sodio.
- Mescolare 46 mL di soluzione di bicarbonato di sodio con 15 mL di soluzione di carbonato di sodio e aggiungere 139 mL di acqua deionizzata (DI). Se necessario, regolare il pH a 9,5 utilizzando 0,1 M di NaOH e HCl.
- Aggiungere 10 g di gelatina di tipo A da 300 fioriture dalla pelle suina a 100 mL di tampone carbonato-bicarbonato a una concentrazione del 10% p/v.
- Sciogliere la gelatina a bagnomaria a 55 °C e agitare la soluzione a 700 giri/min con un agitatore magnetico. Una volta completamente disciolta, regolare il pH della soluzione di gelatina a 9,5 utilizzando 0,1 M NaOH.
- Per avviare la metacrilazione, aggiungere 938 μL di anidride metacrilico (MAH) goccia per goccia alla soluzione. Migliorare la distribuzione iniziale di MAH nella soluzione di gelatina iniettandola in varie posizioni, comprese diverse profondità e distanze radiali dal centro.
- Avvolgere il recipiente di reazione in un foglio di alluminio per evitare l'esposizione alla luce. Mantenere la temperatura a 55 °C e agitare la soluzione a 500 giri/min per 1 ora per completare la reazione (Figura 1A)12.
NOTA: La reazione si arresta a un pH inferiore a 7,4. - Preparare un bicchiere da 2 L contenente 1,8 L di acetone e un bicchiere da 0,6 L contenente 0,3 L di acetone.
- Aggiungere la soluzione di GelMA risultante goccia a goccia nel becher da 2 L mescolando a 200 giri/min per indurre la precipitazione13. Per massimizzare la raccolta del prodotto precipitato, posizionare un'asta o una spatola in acciaio inossidabile come sito di nucleazione per facilitare il trasferimento.
- Trasferire il prodotto dal bicchiere più grande a quello più piccolo e lasciarlo riposare per 10 minuti prima di procedere alla fase di asciugatura. Il GelMA precipitato dovrebbe apparire come fibre bianche.
- Raccogliere il prodotto su carta assorbente, asciugarlo in forno sottovuoto a temperatura ambiente (RT) e conservarlo a -20 °C fino a nuovo utilizzo.
NOTA: Ulteriori dettagli sulla caratterizzazione chimica del prodotto tramite risonanza magnetica nucleare protonica (1H NMR) possono essere trovati in un lavoro precedentemente pubblicato8.
2. Salinizzazione del vetro
NOTA: Il fissaggio di idrogel ai vetrini fornisce una superficie piana e uniforme, facilitando la manipolazione e garantendo stabilità sotto sollecitazione di taglio derivata dal flusso. La funzionalizzazione del vetro con 3-(trimetossisilil)metacrilato di propile è necessaria per migliorare le proprietà superficiali e consentire l'adesione covalente degli idrogel durante il processo di polimerizzazione.
- Tagliare con precisione i vetrini da microscopio semplici (spessore 1 mm) in pezzi simili alle dimensioni finali dell'idrogel utilizzando un tagliavetro. Lavare i vetrini tagliati con sapone per rimuovere i contaminanti superficiali e i detriti che potrebbero ostruire il trattamento della superficie del vetro.
NOTA: Se necessario, sonicare i vetrini per 5 minuti in etanolo, quindi asciugare all'aria. - Preparare una soluzione allo 0,5% di 3-(trimetossisilil)propil metacrilato in etanolo assoluto. Preparare una soluzione di acido acetico glaciale al 10% in acqua deionizzata. Mescolare le soluzioni per ottenere una concentrazione finale del 3% di acido acetico glaciale.
NOTA: La soluzione di acido acetico glaciale può essere preparata in grandi quantità e conservata. - Organizzare i vetrini in un contenitore di vetro per assicurarsi che le superfici di vetro non siano ostruite. Versare la soluzione risultante sui vetrini e tenerli per circa 5 minuti su un bilanciere a 80 giri/min per completare la reazione. Assicurarsi che entrambi i lati dei vetrini siano modificati rimuovendo eventuali bolle d'aria intrappolate.
- Al termine della reazione, aspirare la soluzione e lavare i vetrini con etanolo 2x. Asciugare i vetrini all'aria e conservarli al buio presso RT.
NOTA: I vetrini mantengono la loro modifica per 1 mese in queste condizioni.
3. Preparazione dell'idrogel
- Fabbricare idrogel utilizzando un metodo di polimerizzazione dei radicali liberi indotto da ossidoriduzione.
- Assemblare stampi in due pezzi in politetrafluoroetilene (PTFE) con una profondità adeguata e finestre di apertura di 10 mm2 per modellare il substrato finale. Tenere conto di un restringimento del 25% dell'altezza dell'idrogel dopo la polimerizzazione durante il processo di progettazione. Assicurarsi che gli stampi siano piatti e ben fissati alle piastre inferiore e superiore per evitare perdite.
NOTA: Le dimensioni dello stampo progettate sono intenzionalmente più grandi del 10% rispetto alle dimensioni previste dell'idrogel. Questo design ha molteplici scopi: previene i danni ai lati al momento della separazione dello stampo, migliora l'uniformità superficiale dell'idrogel spingendo le impurità o le bolle ai lati e compensa il restringimento previsto del 25% dopo l'equilibratura dovuto all'effetto sineresi, in cui gli idrogel altamente reticolati respingono l'acqua dopo l'equilibrio, causando il restringimento. La quantità di restringimento è specificata nel protocollo8. - Per garantire che gli idrogel abbiano una superficie uniforme e un'altezza costante, sospendere i vetrini modificati dalla piastra superiore dello stampo, consentendo un'apertura stretta per l'iniezione della soluzione polimerica. Utilizzare un vetro di copertura per sospendere i vetrini modificati (Figura 1B).
- Per creare il vetro di copertura, tagliare un vetro microscopico semplice più grande del 20% rispetto allo stampo. Fissare due distanziatori ai lati più corti. Calcolare lo spessore del distanziatore come segue:
Spessore del distanziatore = 1,33 x spessore finale del gel + 1 (spessore del vetro modificato) - profondità dello stampo - Applicare uno strato sottile di grasso sigillante compatibile con le celle sui lati più lunghi del vetro di copertura, sulla stessa faccia in cui sono fissati i distanziatori.
- Fissare il vetrino modificato al vetro di copertura tra i due distanziatori.
- Posizionare il vetro di copertura sullo stampo in modo che i distanziatori si trovino sullo stampo e il vetro modificato si estenda nello stampo. Questa configurazione fornisce uno spazio di 1,33 dell'altezza finale dell'idrogel tra il vetro modificato e il fondo dello stampo.
- Sciogliere GelMA in acqua deionizzata al 4% e al 10% p/v per idrogel da 5 kPa e 10 kPa, rispettivamente, e metterlo a bagnomaria a 45 °C.
NOTA: GelMA è un polimero termosensibile e il mantenimento della temperatura della soluzione a 45 °C impedisce la solidificazione prima della polimerizzazione e riduce la viscosità della soluzione, che è fondamentale per la fabbricazione di idrogel piatti. - Aggiungere TEMED (24 mM per 5 kPA di idrogel, 6,25 mM per 10 kPa di idrogel) alla soluzione polimerica e mescolare accuratamente.
NOTA: TEMED da solo non avvia la polimerizzazione, quindi assicurati che stampi, pipette e soluzioni siano preparati prima di procedere. - Aggiungere APS (24 mM per 5 kPA di idrogel, 24,5 mM per 10 kPa di idrogel) alla soluzione di GelMA e mescolare accuratamente.
NOTA: L'aggiunta di APS avvia la polimerizzazione e gli idrogel possono formarsi rapidamente, richiedendo un'azione tempestiva per prevenire idrogel difettosi. Ulteriori dettagli sulle misure di rigidezza possono essere trovati in un lavoro precedentemente pubblicato8. - Pipettare con cura la soluzione risultante nell'apertura tra il vetrino sospeso e lo stampo in RT e lasciarla reticolare. La forza capillare spinge la soluzione polimerica nello stampo. Evitare di aggiungere bolle ai gel e interrompere il pipettaggio quando rimane una piccola quantità di soluzione nel puntale della pipetta.
NOTA: Durante la polimerizzazione, i gruppi metacrilati di GelMA reagiscono con i residui di metacrilato sui vetrini modificati, determinando l'adesione chimica dell'idrogel al vetro. - Dopo 15 minuti, la reazione è completa. Staccare il substrato dallo stampo utilizzando un oggetto appuntito, come un ago, e far scorrere il substrato lontano dal vetro di copertura per separarlo.
- Trasferire gli idrogel in 1 soluzione salina tamponata con fosfato (PBS) in una piastra di Petri da 100 mm sigillata con pellicola di plastica ed equilibrare a 37 °C per rimuovere i reagenti e i sottoprodotti rimanenti.
- Poiché l'idrogel è leggermente più grande delle dimensioni finali, tagliare il gel in eccesso ai lati in modo che corrisponda alle dimensioni richieste per la finestra della camera di flusso.
- Utilizzare la camera di flusso per verificare le dimensioni dell'idrogel. Assicurarsi che l'idrogel si adatti correttamente alla camera di flusso senza spazi tra l'idrogel e lo stampo o difetti che potrebbero influire sui modelli di flusso. Se ci sono irregolarità di forma che possono influenzare il modello di flusso nella camera di flusso, portando a un comportamento cellulare avverso, conservare l'idrogel per condizioni statiche.
- Trasferire quattro idrogel in una piastra di Petri contenente 1x PBS per la sterilizzazione.
- Assemblare stampi in due pezzi in politetrafluoroetilene (PTFE) con una profondità adeguata e finestre di apertura di 10 mm2 per modellare il substrato finale. Tenere conto di un restringimento del 25% dell'altezza dell'idrogel dopo la polimerizzazione durante il processo di progettazione. Assicurarsi che gli stampi siano piatti e ben fissati alle piastre inferiore e superiore per evitare perdite.
- Sterilizzare l'idrogel come descritto di seguito utilizzando etanolo al 70%.
- Preparare soluzioni alcoliche al 25%, 50% e 70% per una disidratazione graduale dell'idrogel.
NOTA: Se non viene eseguita una disidratazione graduale, gli idrogel più rigidi possono restringersi e rompersi, mentre possono formarsi rughe sulla superficie degli idrogel più morbidi. - Aspirare la soluzione 1x PBS dalla piastra di Petri contenente idrogel. Aggiungere una soluzione di etanolo al 25% a ciascuna piastra di Petri per immergere gli idrogel da 5 kPa e 10 kPa per 15 minuti.
- Aspirare la soluzione alcolica al 25%. Aggiungere una soluzione alcolica al 50% a ciascuna capsula di Petri per immergere gli idrogel da 5 kPa e 10 kPa per 15 minuti.
- Aspirare la soluzione alcolica al 50%. Aggiungere una soluzione alcolica al 70% a ciascuna capsula di Petri, immergendo gli idrogel da 5 kPa e 10 kPa per 5 minuti. Posizionare la capsula di Petri su uno shaker a 100 giri/min.
- Lasciare gli idrogel da 5 kPa immersi per 40 minuti e gli idrogel da 10 kPa per 20 minuti.
NOTA: È stato osservato che gli idrogel da 5 kPa sono più inclini alla contaminazione rispetto agli idrogel da 10 kPa. - Trasferire i campioni in una piastra a 6 pozzetti in una cabina di biosicurezza e lavare gli idrogel 2x-3x utilizzando PBS sterile.
- Preparare soluzioni alcoliche al 25%, 50% e 70% per una disidratazione graduale dell'idrogel.
4. Rivestimento di idrogel
- Preparare una soluzione di gelatina da 60 μg/mL sciogliendo 3 mg di gelatina in 50 mL di PBS sterile (1x con sale di magnesio e calcio). Scaldare la soluzione a bagnomaria a 37 °C per 30 minuti o fino a quando tutta la gelatina non si sarà completamente sciolta.
- Filtrare in modo sterile la soluzione di rivestimento utilizzando un filtro per siringa da 0,2 μm. Aspirare la soluzione PBS 1x da ciascuna piastra a pozzetti e aggiungere una soluzione di gelatina a ciascun pozzetto, garantendo una copertura completa di ciascun idrogel. Per ridurre al minimo il rischio di contaminazione, aggiungere 40 unità/mL di penicillina e 10 μg/mL di streptomicina alla soluzione di rivestimento.
- Incubare ogni piastra a pozzetti in un incubatore a 37 °C, 5% CO2 per 45 minuti. Lavare gli idrogel con 1 soluzione di PBS.
- Aspirare il PBS e aggiungere terreni di coltura cellulare.
- Per non più di due giorni, conservare gli idrogel in terreni di coltura cellulare e incubarli in un incubatore a 37 °C, 5% CO2 fino alla semina cellulare.
NOTA: Nonostante le eccellenti proprietà di attaccamento cellulare della fibronectina, c'è una preoccupazione riguardo al suo uso a causa delle EC che depositano fibronectina endogena in condizioni aterosclerotiche, che possono portare a una risposta proinfiammatoria. Per evitare risposte cellulari stimolate chimicamente, ci asteniamo dall'uso della fibronectina. Inoltre, Orr et al. hanno dimostrato che il rivestimento di fibronectina, rispetto al rivestimento di collagene I, sovraregola i geni aterogeni. In particolare, hanno osservato un aumento dei livelli di espressione della molecola di adesione intercellulare 1 (ICAM-1), della molecola di adesione cellulare vascolare 1 (VCAM-1) e del fattore nucleare-κB (NF-κB)14.
5. Semina delle cellule sui substrati
- Preparare la sospensione cellulare seguendo i protocolli di distacco disponibili e contare le cellule utilizzando un emocitometro8.
- Aspirare accuratamente il mezzo dagli idrogel. Aggiungere 50.000 cellule/cm2 a ciascun campione. Aggiungere un volume adeguato di sospensione cellulare a ciascun campione per evitare il trabocco delle cellule.
NOTA: I substrati più rigidi sono più idrofobici; Pertanto, ridurre al minimo il tempo tra le fasi per migliorare la bagnabilità e la dispersione della sospensione cellulare sulla superficie del substrato. - Incubare gli idrogel con semi cellulari in un incubatore a 37 °C, 5% CO2 per 2 ore. Aggiungere terreni di coltura cellulare ai campioni una volta che le cellule sono attaccate ai gel.
6. Fabbricazione della camera di flusso
NOTA: L'approccio per la progettazione della camera di flusso è conveniente e richiede un'esperienza minima per la fabbricazione e l'utilizzo.
- Utilizzare il polimetilmetacrilato per la fabbricazione della camera per valutare visivamente la qualità del flusso, l'integrità dell'idrogel sotto stress di taglio e potenziali studi di biomarcatori in tempo reale durante gli esperimenti di flusso. Il design della camera è stato creato utilizzando un software di progettazione assistita da computer (CAD). La camera di flusso è stata depositata per un brevetto e i dettagli su questo dispositivo non possono essere divulgati nel presente protocollo.
- Valutazione computazionale delle condizioni di flusso nella camera di flusso
- Assemblare i singoli componenti della camera di flusso progettata (. SLDPRT) per creare la configurazione finale della camera.
- Tracciare una linea lungo la linea centrale del flusso tangente alla superficie dell'idrogel per analizzare la sollecitazione di taglio. Chiudere le aperture di ingresso e uscita per definire un volume di controllo chiuso.
- Aprire Flow Simulation dalla scheda Add-In del software CAD. Nella scheda Simulazione flusso, aprire la funzione Procedura guidata per immettere le proprietà. Specificare il sistema dell'unità e regolare la pressione e le unità di sollecitazione su dyne/cm2.
- Controllare il flusso del fluido e la gravità nelle caratteristiche fisiche. Impostare la gravità a -9,8 nel componente Z; I componenti X e Y devono essere pari a zero.
- Selezionate Interno (Internal ) per il tipo di analisi in Gestione geometria (Geometry Handling). Selezionate Acqua come fluido predefinito.
NOTA: Supponiamo che il fluido si comporti come l'acqua. - Scegliere Laminare e Turbolento per il tipo di flusso. Definisce la parete come parete adiabatica e inserisce la rugosità della superficie in Condizione parete.
- Impostare la temperatura su 37,5 °C (310,65 K) in condizioni iniziali. Definisci il dominio computazionale nei progetti di simulazione del flusso, assicurandoti che copra l'intero volume di controllo.
- Selezionare tutte le pareti che si interfacciano con il fluido per definire il sottodominio del fluido. In Condizione limite (Boundary Condition), designate la superficie interna del coperchio di ingresso come Flusso volumetrico in ingresso (Inlet Volume Flow) e specificate la portata (Q) e il flusso uniforme. Quindi, assegnare la superficie interna della guarnizione del coperchio di uscita come pressione statica.
- Determinare la dimensione globale della mesh in base alle risorse di calcolo disponibili. Premi Esegui per avviare la simulazione.
- Al termine, rivedere i risultati desiderati, inclusi i grafici delle sollecitazioni di taglio e le simulazioni del flusso.
- Ripetere i passaggi da 6.2.8 a 6.2.10 con varie portate per calcolare la sollecitazione di taglio applicata a velocità diverse. Utilizzare l'analisi di regressione per stabilire la relazione tra velocità di flusso e sollecitazione di taglio.
- Valuta la tolleranza del sistema alle variazioni delle dimensioni dell'idrogel per migliorare il realismo della simulazione.
7. Eseguire un flusso laminare uniforme
- Dopo aver coltivato le cellule sugli idrogel da 5 kPa e 10 kPa, assicurarsi che il monostrato cellulare sia confluenziale in un incubatore a 37 °C, 5% CO2 . Dovrebbe essere ottenuto un monostrato di cellule su ciascun idrogel.
- Sterilizzare i componenti autoclavabili del sistema a camera di flusso a piastre parallele (viti in acciaio inossidabile, spatola, pinze, guarnizione e serbatoio del fluido) con un ciclo di autoclave a gravità di 30 minuti. Sterilizzare le altre parti (componenti acrilici e sigillante/smorzatore del serbatoio) con esposizione ai raggi UV.
- Assemblare il dispositivo della camera di flusso in una cabina di biosicurezza. Fissare i campioni di idrogel nel dispositivo, garantendone l'uniformità. Utilizzare un riempitivo di dimensioni uguali agli idrogel se è disponibile un numero insufficiente di campioni per il flusso.
- Pre-bagnare la superficie interna della camera e le superfici dell'idrogel per ridurre al minimo la formazione di bolle e prevenire l'essiccazione delle celle durante l'assemblaggio.
- Aggiungere una quantità sufficiente di fluido al serbatoio di ingresso, consentendo al 20%-30% del fluido di fluire verso il serbatoio di uscita al momento del montaggio. Sigillare ermeticamente il serbatoio di ingresso utilizzando un damper/sigillante.
NOTA: L'accumulo di pressione nel serbatoio di ingresso determina il flusso ed eventuali perdite d'aria alterano le portate. Verificare la presenza di difetti del sigillante se si formano bolle nel tubo esterno. - Impostare la serranda di uscita sulla pressione atmosferica per stabilire la differenza di pressione. Posizionare il dispositivo e i serbatoi in un incubatore a 37 °C, 5% CO2 . Collegare il tubo del dispositivo a una pompa peristaltica posta all'esterno dell'incubatrice (Figura 1C).
- Accendere la pompa per iniziare ad applicare 3,6 dyne/cm2. Aumentare gradualmente la portata con incrementi di 2 mL/min (ad esempio, raggiungere 85 mL/min da 65 mL/min dopo 10 min) fino ad applicare circa 8 dyne/cm2.
- Aumentare ulteriormente la portata con incrementi di 2,5 mL/min fino a raggiungere 12 dyne/cm2 di sforzo di taglio.
NOTA: Attendere che le celle si adattino alla condizione dinamica, poiché un rapido aumento della velocità di flusso può staccare le cellule e danneggiare il monostrato. - Dopo 6 ore, interrompere il flusso, rimuovere il dispositivo dall'incubatrice e smontare la camera di flusso. Successivamente, trasferire i campioni di idrogel in una piastra a sei pozzetti.
- Lavare i campioni con PBS ghiacciato e fissare le cellule per l'immunocolorazione o lirle per l'isolamento delle proteine.
8. Impianto di immunocolorazione per microscopia confocale ad alto ingrandimento
NOTA: Per aumentare l'efficienza dello studio, è stato sviluppato un metodo per l'immunocolorazione di piccole porzioni di idrogel, consentendo l'esame di più bersagli biologici in un singolo campione.
- Preparare punzoni per biopsia o utensili da taglio preferiti con diametri di 3 o 4 mm.
- Utilizzare una scatola di puntali per pipette come camera di colorazione. Umidificare la camera per controllare l'evaporazione della soluzione colorante durante l'incubazione prolungata posizionando un tovagliolo di carta bagnato sul fondo della scatola dei puntali della pipetta.
- Riduci il consumo di anticorpi creando piccoli pool di soluzioni per i singoli campioni. Coprire la griglia della scatola delle punte con una pellicola trasparente, premendo delicatamente la pellicola contro i fori della griglia con la punta delle dita per formare delle fossette. Riempire le fossette con 70 μL di PBS.
- Trasferisci un singolo idrogel in una capsula di Petri vuota e taglialo usando un punzone per biopsia o uno strumento da taglio preferito. Utilizzare un microscopio per tagliare un'area campione rappresentativa. Tagliare un cilindro di gel completo per evitare problemi di microscopia confocale.
- Posizionare i campioni di idrogel tagliati nelle fossette create al punto 8.3. Eseguire la colorazione seguendo il protocollo standard15. Dopo il lavaggio finale di colorazione, ottenere un foglio di gomma siliconica che corrisponda allo spessore dell'idrogel.
NOTA: Preferibilmente, utilizzare un foglio con un lato adesivo per una migliore sigillatura. In questo studio, le fibre di actina sono state colorate utilizzando un anticorpo secondario fluorescente coniugato alla falloidina a una diluizione di 1:20. - Tagliare il foglio di gomma in quadrati di 15 mm x 15 mm. Praticare un foro da 6 mm utilizzando un punzone per biopsia o un utensile da taglio preferito.
- Creare un contenitore per campioni attaccando la gomma a un vetrino coprioggetti per microscopia (n. 1.5). Aggiungere 10 μl di terreno di montaggio umido alle fossette mentre il campione è ancora presente e incubarlo al buio per 10-15 minuti.
NOTA: Per questo studio, il terreno di montaggio conteneva 0,9 μg/mL di 4',6-diamidino-2-fenilindolo (DAPI) per abbreviare il protocollo di colorazione. - Estrarre il campione dalla camera di colorazione e posizionarlo nel contenitore creato al punto 8.7. Applicare 1-2 μl di terreno di montaggio sulla parte superiore del campione.
NOTA: La quantità di supporti di montaggio influisce sulla qualità dell'immagine ad alti ingrandimenti. Un numero eccessivo o insufficiente di supporti di montaggio può compromettere la nitidezza dell'immagine. - Posizionare un altro vetrino coprioggetti sulla parte superiore e premere delicatamente per assicurarsi che il campione tocchi il vetro. Conservare i campioni a 4 °C al buio fino all'imaging al microscopio.
Risultati
La Figura 1 illustra la configurazione sperimentale, delineando il processo di sintesi di GelMA attraverso una reazione di metacrilazione. Il prodotto risultante è stato quindi utilizzato per fabbricare il substrato di idrogel, su cui sono state seminate le EC. Successivamente, le celle sono state introdotte nella camera di flusso per un esperimento di flusso di 6 ore a 12 dyne/cm2.
1La spettroscopia H NMR è stata utilizzata per valutare il successo della reazione di metacrilazione (Figura 2A). La presenza di un gruppo metilico a 1,9 ppm e un picco vinilico compreso tra 5,4-5,6 ppm in GelMA ha confermato il successo della metacrilazione. Inoltre, la diminuzione del picco di lisina a 3 ppm in GelMA indica il consumo di residui di lisina, che vengono sostituiti con residui di metacrilato 12,13,16. La rigidità degli idrogel GelMA è stata valutata utilizzando un test di compressione, che ha dimostrato che i moduli di compressione aumentavano con le concentrazioni di GelMA (Figura 2B). Gli idrogel composti al 4% e all'8% (p/v) di GelMA sono stati utilizzati per imitare le rigidezze della matrice fisiologiche (5 kPa) e patologiche (10 kPa), rispettivamente8.
La camera di flusso è stata progettata per essere economica e per una facile sterilizzazione, utilizzando un polimero acrilico resistente ai raggi UV. La sua trasparenza facilita il monitoraggio in tempo reale degli idrogel e delle condizioni di flusso durante gli esperimenti. Progettata con tre strati distinti, la camera riduce al minimo il rischio di danni all'idrogel durante il carico o lo scarico: la piastra inferiore fornisce una base robusta, lo strato intermedio offre un supporto laterale per gli idrogel e la piastra superiore, lungo la guarnizione, crea il gioco necessario per il flusso del fluido (Figura 3A). Le simulazioni computazionali sono state condotte utilizzando la CFD per valutare le condizioni di flusso e lo stress di taglio all'interno della camera. La seguente equazione - sforzo di taglio = 0,0558 x portata - ha calcolato la sollecitazione di taglio applicata alle celle in base alla velocità di flusso come input (Figura 3B). In particolare, le modifiche alle proprietà dei materiali, come la rigidità, non hanno alterato lo sforzo di taglio nelle simulazioni. Per tenere conto delle differenze nelle dimensioni dell'idrogel nella configurazione sperimentale finale, gli idrogel sono stati intenzionalmente dimensionati leggermente più piccoli nel modello computazionale. È stato creato uno spazio di 0,5 mm tra un lato degli idrogel e le pareti centrali della piastra della camera, perpendicolare alla direzione del flusso. Questa configurazione ha permesso l'analisi degli effetti delle sollecitazioni di taglio in questi spazi vuoti. Mentre sono state osservate irregolarità nello sforzo di taglio nelle fessure (Figura 3B), il loro impatto è stato limitato a una piccola area adiacente alle fessure, con la superficie rimanente dell'idrogel che ha subito uno sforzo di taglio uniforme (Figura 3C). Queste intuizioni suggeriscono di scartare le cellule dai bordi degli idrogel per ridurre al minimo il potenziale impatto delle regioni turbolente. Vale la pena ricordare che una sollecitazione di taglio più elevata, fino a 15 dyne/cm², è stata applicata sperimentalmente a EC seminate su idrogel da 5 kPa e 10 kPa senza perdite nel dispositivo (dati non inclusi). Tuttavia, l'ulteriore aumento dello stress di taglio potrebbe potenzialmente causare il distacco delle cellule e il fallimento dell'idrogel, sottolineando la necessità di un'attenta ottimizzazione delle condizioni sperimentali.
Affinché le cellule di semina formino un monostrato, è fondamentale utilizzare una densità cellulare più elevata rispetto alle colture tradizionali. È stato dimostrato che una bassa densità di semina ostacola la formazione di monostrato su idrogel più morbidi8. Inoltre, il pre-rivestimento degli idrogel con gelatina prima della semina cellulare migliora l'adesione iniziale delle cellule e la diffusione su idrogel più morbidi. Tuttavia, è importante notare che l'effetto benefico di questo rivestimento è temporaneo, in quanto facilita principalmente l'interazione iniziale tra le cellule e il substrato.
La Figura 4 mostra come la rigidità e lo sforzo di taglio influenzino la formazione delle fibre di actina. Sotto sforzo di taglio, si sono formate fibre di stress più spesse, suggerendo un maggiore attaccamento alla superficie. Nei campioni più morbidi, c'erano più fibre periferiche di actina, che sono indicatori di condizioni fisiologiche. Tuttavia, nelle EC su substrati più rigidi, la presenza di fibre di stress più forti e di un minor numero di fibre periferiche potrebbe potenzialmente portare alla disfunzione dell'EC17. Questi dati confermano l'efficacia del sistema presentato nel modulare il comportamento dell'EC.

Figura 1: Panoramica dello studio attuale. (A) Sintesi di GelMA. La gelatina è stata modificata chimicamente in metacrilato di gelatina (GelMA) attraverso una reazione tra gelatina e anidride metacrilico (MAH) a 55 °C. Il prodotto è stato poi precipitato in acetone ed essiccato sotto vuoto. (B) Fabbricazione di idrogel. Il vetro di copertura è stato preparato fissando dei distanziatori. Quindi, il vetro modificato è stato fissato al vetro di copertura. Il vetro di copertura è stato posizionato sullo stampo, con i distanziatori che fornivano lo spazio desiderato tra il vetro modificato e il fondo dello stampo. La soluzione di GelMA contenente iniziatori è stata aggiunta all'apertura tra il vetro modificato e lo stampo, polimerizzando per formare un idrogel legato covalentemente al vetro modificato. (C) Esperimento di flusso. L'idrogel risultante è stato utilizzato per seminare le CE. Dopo aver formato un monostrato, le celle sono state sottoposte a un esperimento di flusso di 6 ore con uno sforzo di taglio di 12 dyne/cm². Questa figura è stata creata con BioRender.com. Clicca qui per visualizzare una versione più grande di questa figura.
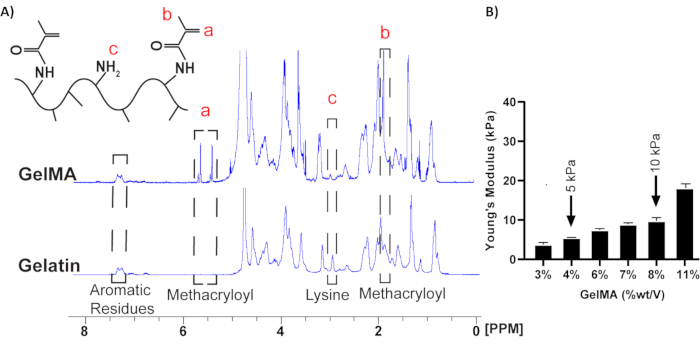
Figura 2: 1spettri H-NMR per gelatina e pre-polimerizzazione di GelMA. (A) Fare riferimento ai riquadri tratteggiati per i picchi pertinenti. I picchi di metacrilole (cioè gruppi vinilici e metilici) sono comparsi dopo la modificazione chimica della gelatina, mentre il gruppo lisina è stato utilizzato per quantificare il grado di sostituzione a seguito della reazione chimica18. (B) Il modulo di Young degli idrogel è stato misurato mediante un test di compressione, e il 4% (p/v) di idrogel di GelMA è stato considerato come substrato fisiologico e il 10% (p/v) è stato considerato come substrato patologico (n=4, media ± SEM). Questa cifra è stata modificata da8. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Progettazione di camere di flusso a piastre parallele e simulazione computazionale. (A) Sono state utilizzate tre piastre separate per ridurre la possibilità di danneggiare gli idrogel durante il carico o lo scarico; Dove la piastra inferiore forniva una superficie di supporto, la superficie centrale offriva un supporto laterale per gli idrogel e la piastra superiore e la guarnizione formavano il gioco per il flusso del fluido. (B) La camera di flusso è stata sottoposta a simulazioni computazionali11. Quando la portata è di 215 mL/min, lo sforzo di taglio lungo la linea tracciata è di circa 12 dyne/cm2, che rappresenta lo sforzo di taglio fisiologico. (C) L'influenza della fessura di 0,5 mm è limitata a una piccola area adiacente alla fessura. La superficie rimanente dell'idrogel subisce una sollecitazione di taglio uniforme. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Lo sforzo di taglio e l'idrogel rigido aumentano la formazione di fibre da stress. Altre fibre periferiche di actina si formano nelle EC su campioni di 5 kPa sotto flusso. Le fibre di stress più forti si sono formate quando le cellule sono state esposte a uno stress di taglio su idrogel da 10 kPa, dimostrando l'efficacia del modello sul comportamento dell'EC. Le frecce indicano l'actina periferica e gli asterischi indicano le fibre stressate. Barra della scala= 10 μm (Blu: DAPI, Rosso: Fibre di actina). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il sistema vascolare è un ambiente dinamico in cui varie forze influenzano in modo significativo il comportamento cellulare. Studiare gli eventi biologici nelle malattie cardiovascolari senza considerare queste forze sarebbe impreciso. Pertanto, i modelli cellulari in grado di emulare l'ambiente meccanico vascolare sono cruciali. I ricercatori hanno già compiuto progressi significativi nell'evidenziare l'effetto di queste forze sul comportamento cellulare11. Tuttavia, per comprendere il comportamento cellulare in condizioni patologiche e fisiologiche nel corpo umano, è essenziale sviluppare modelli più precisi che assomiglino più da vicino all'ambiente del vaso sanguigno. Pertanto, abbiamo mirato a sviluppare un sistema che replicasse in modo più accurato l'ambiente dei vasi sanguigni, mantenendo al contempo facilità di accesso e facilità d'uso.
Il modello è in grado di applicare uno stress di taglio derivato dal flusso controllato alle cellule umane su substrati con livelli di rigidità variabili, producendo condizioni più vicine alle realtà fisiologiche rispetto ai modelli esistenti. GelMA è stato sintetizzato e utilizzato in questo modello per soddisfare i seguenti criteri: 1) proprietà meccaniche regolabili, 2) comportamento non gonfio, 3) compatibilità e adesione cellulare e 4) capacità di incorporare cellule vascolari per modellare i vasi sanguigni in modo più accurato. La regolabilità delle proprietà meccaniche è stata ottenuta variando la concentrazione del biopolimero8 per imitare le condizioni fisiologiche e patologiche. Il secondo criterio era il comportamento non gonfio. È fondamentale disporre di un substrato non rigonfio per mantenere costanti le dimensioni della camera di flusso, le condizioni di flusso correlate e lo sforzo di taglio sulle celle. GelMA con un alto grado di metacrilazione ha dimostrato proprietà di non rigonfiamento, preservando la forma e la levigatezza della superficie dell'idrogel per tutta la durata dell'esperimento8. È importante sottolineare che la concentrazione e la rigidità non hanno influenzato il comportamento di rigonfiamento, il che ha semplificato il modello eliminando la necessità di aggiustamenti separati per ciascun gruppo sperimentale. Il terzo criterio era l'adesione cellulare, poiché un corretto attaccamento è necessario per prevenire il distacco delle cellule e preservare l'integrità del monostrato. GelMA ha fornito l'adesione cellulare, riducendo così la necessità di ulteriori passaggi per coniugare le molecole adesive cellulari al substrato, che è essenziale per molti biopolimeri. Inoltre, è stata considerata la capacità di GelMA per l'incapsulamento cellulare, sebbene non sia stata testata direttamente in questo studio. Il potenziale di incapsulamento cellulare ha indicazioni per supportare la coltura cellulare 3D e integrare strati di cellule, come cellule muscolari lisce vascolari o periciti, per migliorare l'accuratezza del modello19. Inoltre, la sintesi di GelMA è economica e richiede un'attrezzatura minima, il che lo rende un eccellente candidato come biomateriale per la fabbricazione di substrati 20,21,22.
La camera di flusso a piastre parallele è comunemente utilizzata per applicare sollecitazioni di taglio alle celle, ma è stata tradizionalmente utilizzata solo con vetrini coprioggetti o materiali rigidi. Tuttavia, tali materiali mancano di rilevanza fisiologica23. Al contrario, i dispositivi microfluidici hanno introdotto una maggiore complessità geometrica e substrati più morbidi utilizzando materiali a base di polimeri. Tuttavia, questi dispositivi spesso non sono in grado di controllare accuratamente il regime di flusso e le loro piccole dimensioni limitano la loro capacità di studiare solo un piccolo numero di cellule, limitando i risultati sperimentali11. Il dispositivo proposto combina i vantaggi di entrambi i sistemi integrando idrogel seminati con monostrato di cellule endoteliali con una camera di flusso che applica uno sforzo di taglio controllato con precisione.
Il dispositivo ha dimostrato la capacità di integrare sia le forze meccaniche derivate dal flusso che quelle derivate dai solidi. Quando è stato applicato uno sforzo di taglio di 12 dyne/cm2 per 6 ore, è stata osservata una formazione di fibre da stress citosolico, in contrasto con la predominanza di actina periferica nel gruppo del substrato più morbido. Ciò è in linea con molti rapporti che mostrano meno fibre di stress formate quando le EC vengono coltivate su superfici più morbide 24,25,26,27. D'altra parte, il flusso laminare potrebbe provocare una formazione di fibre da stress prominente. È stato dimostrato che la risposta del citoscheletro alle condizioni di flusso inizia entro 1 ora dall'esposizione al flusso, ma richiede un tempo notevolmente più lungo per completare la riorganizzazione 28,29,30. La rete periferica di actina è essenziale per varie funzioni dell'EC, tra cui l'adesione cellula-cellula e la funzionalità di barriera17. La sovraregolazione di questa rete in un gruppo sperimentale sano rispetto al gruppo patologico con fibre di stress estese approva il successo della modellazione del dispositivo di condizioni sane e malate.
Uno svantaggio di questo dispositivo è il potenziale danneggiamento degli idrogel, che potrebbe interrompere il flusso e diminuire il tasso di successo degli esperimenti. Questo problema deriva principalmente da difetti iniziali negli idrogel, che, sotto sforzo di taglio, possono peggiorare, portando al distacco del campione e all'ostruzione parziale del flusso. Pertanto, le fasi di preparazione del campione, tra cui la polimerizzazione, l'equilibratura e il taglio, devono essere eseguite con attenzione per evitare ulteriori danni ai campioni. Un'altra sfida in questo sistema è ottenere e mantenere l'integrità del monostrato. Mentre il rivestimento degli idrogel con gelatina può migliorare l'adesione iniziale delle cellule, il nostro lavoro precedente ha dimostrato che questo rivestimento non influisce sulla proliferazione cellulare8. Pertanto, per migliorare la formazione del monostrato, soprattutto considerando che la proliferazione cellulare è più lenta su idrogel più morbidi31, è utile aumentare la densità di semina. Inoltre, le celle possono staccarsi a causa dello sforzo di taglio indotto dal flusso del fluido. Pertanto, è fondamentale aumentare gradualmente la portata, lasciando alle celle il tempo sufficiente per adattarsi alle nuove condizioni ambientali.
In conclusione, il dispositivo rappresenta un progresso significativo nella simulazione dell'ambiente vascolare in modo più accurato grazie alla sua capacità di simulare simultaneamente forze meccaniche derivate da fluidi e solidi. Offre una piattaforma completa per lo studio del comportamento EC in varie condizioni fisiologiche e patologiche. Questa versatilità lo rende uno strumento prezioso per far progredire la nostra comprensione della biologia vascolare e della progressione della malattia. Questo modello può contribuire a una varietà di studi di ricerca, tra cui meccanobiologia, aterosclerosi, sviluppo di metastasi tumorali, ingegneria dei tessuti vascolari e angiogenesi e somministrazione e screening di farmaci.
Divulgazioni
Gli autori dichiarano che è stata depositata una domanda di brevetto provvisorio (n. 63/634.853) con il titolo Camera di flusso con substrato sintonizzabile meccanicamente e che non esistono altri interessi concorrenti.
Riconoscimenti
Gli autori estendono la loro gratitudine a Robert Egan per la sua assistenza nella fabbricazione della camera di flusso. Gli autori ringraziano Lucas McCauley per il suo aiuto durante gli esperimenti. Inoltre, vorrebbero riconoscere le strutture principali dell'Institute for Chemical Imaging of Living Systems (CILS) della Northeastern University per aver concesso l'accesso ai microscopi confocali. Gli autori riconoscono il sostegno finanziario fornito dal National Institutes of Health (NIH 1R01EB027705 assegnato a SB) e dalla National Science Foundation (NSF CAREER Awards: DMR 1847843 to SB e CMMI 1846962 to EE).
Materiali
| Name | Company | Catalog Number | Comments |
| (trimethoxysilyl)propyl methacrylate, tetramethylethylenediamine (TEMED) | Invitrogen | 15524-010 | Hydrogel Fabrication |
| 3-(Trimethoxysilyl)Propyl Methacrylate | Sigma-Aldrich | 440159 | Glass Salinization |
| 4’,6-diamidino-2-phenylindole (DAPI)-containing mounting media | Vector Laboratories | H-1200 | Immunostaining |
| Acetone | Thermo Fisher Scientifics | A18-4 | GelMA Synthesis |
| Alexa Fluor 555 Phalloidin | Cell Signaling Technology | 8953S | Immunostaining |
| Ammonium Persulfate (APS) | Bio-Rad | 1610700 | Hydrogel Fabrication |
| Clear Scratch- and UV-Resistant Cast Acrylic Sheet (45/64'') | McMaster-CARR | 8560K165 | Flow Chamber Fabrication |
| Confocal Microscope | Carl Zeiss Meditex AG | Zeiss LSM 800 | Immunostaining |
| Covidien Monoject Rigid Pack 60 mL Syringes without Needles | Fisher | 22-031-375 | Flow Experiment |
| EC growth kit | American Type Culture Collection (ATCC) | PCS-100-041 | Cell Culture |
| Ethanol 200 Proof | Decon Labs | 2701 | Glass Salinization |
| Gelatin Type A (300 bloom) from porcine skin | Sigma-Aldrich | G1890 | GelMA Synthesis |
| Glacial Acetic Acid | Thermo Fisher Scientifics | 9526-33 | Glass Salinization |
| High-Purity High-Temperature Silicone Rubber Sheet | McMaster-Carr | 87315K74 | Flow Chamber Fabrication |
| Human Umbilical Vein Endothelial Cells (HUVEC) | American Type Culture Collection (ATCC) | PSC-100-010 | Cell Culture |
| M3x30mm Machine Screws Hex Socket Round Head Screw 304 Stainless Steel Fasteners Bolts 20pcs | Uxcell | B07Q5RM2TP | Flow Chamber Fabrication |
| Masterflex L/S Digital Drive with Easy-Load® 3 Pump Head for Precision Tubing; 115/230 VAC | VWR | #MFLX77921-65 | Flow Experiment |
| Masterflex L/S Precision Pump Tubing, Puri-Flex, L/S 25; 25 ft | VWR | #MFLX96419-25 | Flow Experiment |
| Methacrylic Anhydride (MAH) | Sigma-Aldrich | 276685 | GelMA Synthesis |
| Paraformaldehyde | Thermo Fisher Scientifics | 043368.9M | Cell Culture |
| Phosphate-Buffered Saline (PBS) | Gibco | 14080-055 | General |
| Sodium Bicarbonate | Fisher Chemical | S233-3 | GelMA Synthesis |
| Sodium Carbonate | Fisher Chemical | S263-500 | GelMA Synthesis |
| SOLIDWORKS educational version | |||
| SOLIDWORKS Student Edition Desktop, 2023 | SolidWorks | N/A | Flow Chamber Design |
| Vascular Basal Medium | American Type Culture Collection (ATCC) | PCS-100-030 | Cell Culture |
Riferimenti
- Deanfield, J. E., Halcox, J. P., Rabelink, T. J. Endothelial function and dysfunction. Circulation. 115 (10), 1285-1295 (2007).
- Suowen, X., et al. Endothelial dysfunction in atherosclerotic cardiovascular diseases and beyond: From mechanism to oharmacotherapies. Pharmacol Rev. 73 (3), 924 (2021).
- Jansen, K. A., Atherton, P., Ballestrem, C. Mechanotransduction at the cell-matrix interface. Sem Cel Dev Biol. 71, 75-83 (2017).
- Tarbell, J. M., Pahakis, M. Y. Mechanotransduction and the glycocalyx. J Int Med. 259 (4), 339-350 (2006).
- Topper, J. N., Cai, J., Falb, D., Gimbrone, M. A. Identification of vascular endothelial genes differentially responsive to fluid mechanical stimuli: cyclooxygenase-2, manganese superoxide dismutase, and endothelial cell nitric oxide synthase are selectively up-regulated by steady laminar shear stress. Proc Natl Acad Sci. 93 (19), 10417-10422 (1996).
- Mitchell, G. F., et al. Arterial stiffness and cardiovascular events. Circulation. 121 (4), 505-511 (2010).
- Bonetti, P. O., Lerman, L. O., Lerman, A. Endothelial dysfunction. Arterioscler Thromb Vasc Biol. 23 (2), 168-175 (2003).
- Hamrangsekachaee, M., et al. Endothelial glycocalyx sensitivity to chemical and mechanical sub-endothelial substrate properties. Front Bioeng Biotechnol. 11, 1250348 (2023).
- Mensah, S. A., et al. Flow-regulated endothelial glycocalyx determines metastatic cancer cell activity. FASEB J. 34 (5), 6166-6184 (2020).
- Russell-Puleri, S., et al. Fluid shear stress induces upregulation of COX-2 and PGI2 release in endothelial cells via a pathway involving PECAM-1, PI3K, FAK, and p38. Am J Physiol-Heart Cir Physiol. 312 (3), H485-H500 (2016).
- Hamrangsekachaee, M., Wen, K., Bencherif, S. A., Ebong, E. E. Atherosclerosis and endothelial mechanotransduction: current knowledge and models for future research. Am J Physiol-Cell Physiol. 324 (2), C488-C504 (2022).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863 (2019).
- Kim, J., Bencherif, S. A., Li, W. A., Mooney, D. J. Cell-friendly inverse opal-like hydrogels for a spatially separated co-culture system. Macromol Rapid Comm. 35 (18), 1578-1586 (2014).
- Orr, A. W., et al. The subendothelial extracellular matrix modulates NF-kappaB activation by flow: a potential role in atherosclerosis. J Cell Biol. 169 (1), 191-202 (2005).
- Hamrangsekachaee, M., Baumann, H. J., Pukale, D. D., Shriver, L. P., Leipzig, N. D. Investigating mechanisms of subcutaneous preconditioning incubation for neural stem cell embedded hydrogels. ACS Appl Bio Mater. 5 (5), 2176-2184 (2022).
- Rezaeeyazdi, M., Colombani, T., Memic, A., Bencherif, S. A. Injectable hyaluronic acid-co-gelatin cryogels for tissue-engineering applications. Materials. 11 (8), 1374 (2018).
- Belvitch, P., Htwe, Y. M., Brown, M. E., Dudek, S. Cortical actin dynamics in endothelial permeability. Curr Top Membr. 82, 141-195 (2018).
- Krishnamoorthy, S., Noorani, B., Xu, C. Effects of encapsulated cells on the physical-mechanical properties and microstructure of gelatin methacrylate hydrogels. Int J Mol Sci. 20 (20), 5061 (2019).
- Jin, Q., et al. Bioprinting small-diameter vascular vessel with endothelium and smooth muscle by the approach of two-step crosslinking process. Biotechnol Bioeng. 119 (6), 1673-1684 (2022).
- Villard, P., et al. Autoclavable and injectable cryogels for biomedical applications. Adv Healthcare Mater. 8 (17), 1900679 (2019).
- Bencherif, S. A., et al. Influence of cross-linker chemistry on release kinetics of PEG-co-PGA hydrogels. J Biomed Mater Res A. 90 (1), 142-153 (2009).
- Rogers, Z. J., Zeevi, M. P., Koppes, R., Bencherif, S. A. Electroconductive hydrogels for tissue engineering: Current status and future perspectives. Bioelectricity. 2 (3), 279-292 (2020).
- James, B. D., Allen, J. B. Vascular endothelial cell behavior in complex mechanical microenvironments. ACS Biomater Sci Eng. 4 (11), 3818-3842 (2018).
- Yeh, Y. T., et al. Matrix stiffness regulates endothelial cell proliferation through septin 9. PLoS One. 7 (10), e4688 (2012).
- Fioretta, E. S., Fledderus, J. O., Baaijens, F. P. T., Bouten, C. V. C. Influence of substrate stiffness on circulating progenitor cell fate. J Biomech. 45 (5), 736-744 (2012).
- Geemen, D. v., et al. F-Actin-anchored focal adhesions distinguish endothelial phenotypes of human arteries and veins. Arterioscler Thromb Vasc Biol. 34 (9), 2059-2067 (2014).
- Dessalles, C. A., Leclech, C., Castagnino, A., Barakat, A. I. Integration of substrate- and flow-derived stresses in endothelial cell mechanobiology. Comm Biol. 4 (1), 764 (2021).
- Estrada, R., Giridharan, G. A., Nguyen, M. D., Prabhu, S. D., Sethu, P. Microfluidic endothelial cell culture model to replicate disturbed flow conditions seen in atherosclerosis susceptible regions. Biomicrofluidics. 5 (3), 32006 (2011).
- Inglebert, M., et al. The effect of shear stress reduction on endothelial cells: A microfluidic study of the actin cytoskeleton. Biomicrofluidics. 14 (2), 024115 (2020).
- Noria, S., et al. Assembly and reorientation of stress fibers drives morphological changes to endothelial cells exposed to shear stress. Am J Pathol. 164 (4), 1211-1223 (2004).
- Amer, M., Shi, L., Wolfenson, H. The 'Yin and Yang' of cancer cell growth and mechanosensing. Cancers (Basel). 13 (19), 4754 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon