Method Article
Modelo in vitro que integra la rigidez y el flujo del sustrato para estudiar las respuestas de las células endoteliales
En este artículo
Resumen
Sintetizamos y caracterizamos un sustrato a base de gelatina sintonizable para el cultivo de células endoteliales vasculares (CE) en condiciones de flujo vascular relevantes. Esta superficie biomimética reproduce condiciones fisiológicas y patológicas, lo que permite el estudio de las fuerzas mecánicas sobre el comportamiento de la CE y avanza en nuestra comprensión de la salud vascular y los mecanismos de la enfermedad.
Resumen
Presentamos un innovador modelo in vitro destinado a investigar los efectos combinados de la rigidez tisular y el estrés de cizallamiento en la función de las células endoteliales (CE), que son cruciales para comprender la salud vascular y la aparición de enfermedades como la aterosclerosis. Tradicionalmente, los estudios han explorado los impactos del esfuerzo cortante y la rigidez del sustrato en las CE, de forma independiente. Sin embargo, este sistema integrado combina estos factores para proporcionar una simulación más precisa del entorno mecánico de la vasculatura. El objetivo es examinar la mecanotransducción de la CE a través de varios niveles de rigidez tisular y condiciones de flujo utilizando CE humanas. Detallamos el protocolo para sintetizar hidrogeles de metacrilato de gelatina (GelMA) con rigidez sintonizable y sembrarlos con ECs para conseguir confluencia. Además, describimos el diseño y montaje de una cámara de flujo rentable, complementada con simulaciones de dinámica de fluidos computacional, para generar condiciones de flujo fisiológico caracterizadas por flujo laminar y niveles adecuados de esfuerzo cortante. El protocolo también incorpora el marcaje de fluorescencia para la microscopía confocal, lo que permite evaluar las respuestas de la CE tanto a la distensibilidad tisular como a las condiciones de flujo. Al someter las CE cultivadas a múltiples estímulos mecánicos integrados, este modelo permite realizar investigaciones exhaustivas sobre cómo factores como la hipertensión y el envejecimiento pueden afectar a la función de la CE y a las enfermedades vasculares mediadas por la CE. Los conocimientos obtenidos de estas investigaciones serán fundamentales para dilucidar los mecanismos subyacentes a las enfermedades vasculares y para desarrollar estrategias de tratamiento eficaces.
Introducción
El endotelio, que recubre la superficie interna de los vasos sanguíneos, desempeña un papel fundamental en el mantenimiento de la salud vascular. Las células endoteliales (CE) son fundamentales para regular diversas funciones cardiovasculares, incluyendo el control del tono de los vasos, la permeabilidad selectiva, la hemostasia y la mecanotransducción 1,2. La investigación ha relacionado firmemente la disfunción de la CE con un papel principal en el desarrollo de la aterosclerosis. En particular, las CE encuentran diversas fuerzas mecánicas en las interfaces donde interactúan con el flujo sanguíneo y los tejidos vasculares subyacentes 3,4. Varios estudios han asociado la disfunción de la CE con cambios anormales en los factores mecánicos dentro del entorno vascular, como el esfuerzo por cizallamiento del líquido del flujo sanguíneo y la rigidez de los tejidos 5,6,7.
Sin embargo, la investigación previa ha recibido una atención limitada en la comprensión de los efectos combinados de la rigidez del tejido y el esfuerzo cortante en la función de la CE. Para mejorar la capacidad de traducir los resultados de la investigación en tratamientos efectivos para la aterosclerosis y otras enfermedades cardiovasculares, es esencial mejorar los modelos celulares utilizados en el campo. Se han logrado avances significativos en la humanización de modelos celulares mediante el empleo de EC humanas y su sometimiento a esfuerzos cortantes o sustratos con diferentes niveles de rigidez 8,9,10. Sin embargo, la adopción y el refinamiento de modelos celulares que integran entornos de flujo dinámico con sustratos EC que poseen propiedades de rigidez ajustables ha progresado lentamente. El reto consiste en idear sustratos de EC que no se hinchen para evitar alteraciones en los parámetros de caudal dentro del canal de flujo y, al mismo tiempo, facilitar el cultivo de monocapas de EC intactas y bien adheridas. Un modelo in vitro capaz de superar estos obstáculos podría facilitar investigaciones más efectivas sobre cómo la hipertensión, el envejecimiento y las condiciones de flujo influyen en colaboración en la mecanotransducción de la CE, la salud vascular y, en última instancia, el desarrollo de la aterosclerosis. Se han desarrollado varios métodos para aplicar tensión de cizallamiento en las células mientras se controla la rigidez del sustrato, incluidas placas giratorias y dispositivos microfluídicos. En el método de placa giratoria, las celdas se colocan entre dos placas y se aplica un esfuerzo cortante a través del movimiento de rotación de las placas. Este método es menos complicado y proporciona un modelo rápido; sin embargo, sufre de variación del esfuerzo cortante espacial, con un esfuerzo cortante cero en el centro y un esfuerzo cortante máximo en la periferia11.
Por otro lado, los dispositivos microfluídicos representan la nueva generación de herramientas con la capacidad de controlar la rigidez del sustrato y las condiciones de flujo. Estos sistemas son adecuados para imitar microvasculaturas en condiciones de flujo laminar. Sin embargo, el estudio de la aterosclerosis con estos dispositivos es poco práctico, ya que la aterosclerosis ocurre en grandes vasos con flujo alterado11. Este artículo tiene como objetivo contribuir al dominio crítico de investigación de los estudios de CE mediante la presentación de un sistema rentable capaz de examinar los efectos de los diferentes niveles de rigidez en sustratos de CE bajo diferentes condiciones de flujo. El sistema integra sustratos con diferentes rigideces para emular vasos sanguíneos patológicos y fisiológicos. Este protocolo describe el método para crear hidrogeles a base de gelatina sin hinchazón y con niveles de rigidez de 5 kPa y 10 kPa, que representan la rigidez fisiológica y patológica, respectivamente. Adicionalmente, se detalla la construcción de una cámara de flujo de placas paralelas capaz de integrar estos sustratos. Se empleó la dinámica de fluidos computacional (CFD) para evaluar el esfuerzo cortante y las condiciones de flujo. Se describe la preparación de hidrogeles para el cultivo de CE y la ejecución de un experimento de flujo de 6 h, seguido de una discusión sobre la inmunotinción posterior al experimento.
Protocolo
1. Síntesis de GelMA
- Prepare una solución 0,2 M de carbonato de sodio anhidro y una solución 0,2 M de bicarbonato de sodio.
- Mezcle 46 mL de solución de bicarbonato de sodio con 15 mL de solución de carbonato de sodio y agregue 139 mL de agua desionizada (DI). Ajuste el pH a 9,5 utilizando 0,1 M de NaOH y HCl si es necesario.
- Añadir 10 g de gelatina tipo A de 300 floraciones de piel de cerdo a 100 mL de tampón de carbonato-bicarbonato a una concentración del 10% p/v.
- Disuelva la gelatina en un baño de agua a 55 °C mientras agita la solución a 700 rpm con un agitador magnético. Una vez que esté completamente disuelto, ajuste el pH de la solución de gelatina a 9,5 usando 0,1 M de NaOH.
- Para iniciar la metacrilación, agregue 938 μL de anhídrido metacrílico (MAH) gota a gota a la solución. Mejore la distribución inicial de MAH en la solución de gelatina inyectándola en varios lugares, incluidas diferentes profundidades y distancias radiales desde el centro.
- Envuelva el recipiente de reacción en papel de aluminio para evitar la exposición a la luz. Mantener la temperatura a 55 °C y agitar la solución a 500 rpm durante 1 h para completar la reacción (Figura 1A)12.
NOTA: La reacción se detiene a un pH inferior a 7,4. - Prepare un vaso de precipitados de 2 L que contenga 1,8 L de acetona y un vaso de precipitados de 0,6 L que contenga 0,3 L de acetona.
- Añadir la solución de GelMA resultante gota a gota al vaso de precipitados de 2 L mientras se agita a 200 RPM para inducir la precipitación13. Para maximizar la recolección del producto precipitado, coloque una varilla o espátula de acero inoxidable como sitio de nucleación para facilitar la transferencia.
- Transfiera el producto del vaso más grande al más pequeño y déjelo reposar durante 10 minutos antes de continuar con la etapa de secado. El GelMA precipitado debe aparecer como fibras blancas.
- Recoja el producto en papel absorbente, séquelo en un horno de vacío a temperatura ambiente (RT) y guárdelo a -20 °C hasta su uso posterior.
NOTA: Se pueden encontrar detalles adicionales sobre la caracterización química del producto mediante resonancia magnética nuclear de protones (RMN 1H) en un trabajo publicado anteriormente8.
2. Salinización del vidrio
NOTA: La fijación de hidrogeles a los portaobjetos de vidrio proporciona una superficie plana y uniforme, lo que facilita el manejo y garantiza la estabilidad bajo el esfuerzo cortante derivado del flujo. La funcionalización del vidrio con metacrilato de 3-(trimetoxisilil)propilo es necesaria para mejorar las propiedades de la superficie y permitir la unión covalente de hidrogeles durante el proceso de polimerización.
- Corte con precisión portaobjetos de microscopio lisos (1 mm de grosor) en piezas similares a las dimensiones finales del hidrogel utilizando un cortador de vidrio. Lave los portaobjetos cortados con jabón para eliminar los contaminantes de la superficie y los residuos que puedan obstruir el tratamiento de la superficie del vidrio.
NOTA: Si es necesario, sonique los portaobjetos de vidrio durante 5 minutos en etanol, luego séquelos al aire. - Prepare una solución al 0,5% de metacrilato de 3-(trimetoxisilil)propilo en etanol absoluto. Prepare una solución de ácido acético glacial al 10% en agua desionizada. Mezclar las soluciones para lograr una concentración final de 3% de ácido acético glacial.
NOTA: La solución de ácido acético glacial se puede preparar en grandes cantidades y almacenar. - Organice los portaobjetos de vidrio en un recipiente de vidrio para asegurarse de que las superficies de vidrio no estén obstruidas. Vierta la solución resultante sobre los portaobjetos de vidrio y manténgalos durante aproximadamente 5 minutos en un balancín a 80 rpm para que se complete la reacción. Asegúrese de que ambos lados de los portaobjetos de vidrio estén modificados eliminando las burbujas de aire atrapadas.
- Una vez completada la reacción, aspire la solución y lave los portaobjetos de vidrio con etanol 2x. Seque las diapositivas al aire y guárdelas en la oscuridad en RT.
NOTA: Los portaobjetos de vidrio conservan su modificación durante 1 mes bajo estas condiciones.
3. Preparación del hidrogel
- Fabricación de hidrogeles utilizando un método de polimerización por radicales libres inducido por redox.
- Ensamblar moldes de politetrafluoroetileno (PTFE) de dos piezas con una profundidad adecuada y ventanas de apertura de 10mm2 para dar forma al sustrato final. Tenga en cuenta una contracción del 25% en la altura del hidrogel después de la polimerización durante el proceso de diseño. Asegúrese de que los moldes sean planos y estén bien sujetos en las placas inferior y superior para evitar fugas.
NOTA: Las dimensiones diseñadas del molde son intencionalmente un 10% más grandes que el tamaño de hidrogel previsto. Este diseño sirve para múltiples propósitos: evita daños en los lados al separar el molde, mejora la uniformidad de la superficie del hidrogel al empujar las impurezas o burbujas hacia los lados, y compensa la contracción anticipada del 25% después del equilibrio debido al efecto de sinéresis, donde los hidrogeles altamente reticulados repelen el agua después del equilibrio, causando contracción. La cantidad de contracción se especifica en el protocolo8. - Para asegurarse de que los hidrogeles tengan una superficie uniforme y una altura constante, suspenda los portaobjetos de vidrio modificado de la placa superior del molde, permitiendo una abertura estrecha para inyectar la solución polimérica. Use una cubierta de vidrio para suspender los portaobjetos de vidrio modificado (Figura 1B).
- Para crear el cubreobjetos, corta un vidrio microscópico liso un 20% más grande que el molde. Coloque dos espaciadores en los lados más cortos. Calcule el espesor del espaciador de la siguiente manera:
Espesor del espaciador = 1,33 x espesor final del gel + 1 (espesor del vidrio modificado) - profundidad del molde - Aplique una capa delgada de grasa de sellado compatible con celdas en los lados más largos del cubreobjetos, en la misma cara donde se colocan los espaciadores.
- Coloque el portaobjetos de vidrio modificado en la cubierta de vidrio entre los dos espaciadores.
- Coloque la cubierta de vidrio en el molde de modo que los espaciadores se asienten en el molde y el vidrio modificado se extienda dentro del molde. Esta configuración proporciona un espacio libre de 1,33 de la altura final del hidrogel entre el vidrio modificado y el fondo del molde.
- Disuelva GelMA en agua desionizada al 4% y al 10% p/v para hidrogeles de 5 kPa y 10 kPa, respectivamente, y colóquelo en un baño de agua a 45 °C.
NOTA: GelMA es un polímero termosensible y mantener la temperatura de la solución a 45 °C evita la solidificación antes de la polimerización y reduce la viscosidad de la solución, que es crucial para la fabricación de hidrogeles planos. - Añada TEMED (24 mM para hidrogel de 5 kPa, 6,25 mM para hidrogel de 10 kPa) a la solución polimérica y mezcle bien.
NOTA: TEMED por sí solo no inicia la polimerización, así que asegúrese de que los moldes, pipetas y soluciones estén preparados antes de continuar. - Añada APS (24 mM para hidrogel de 5 kPa, 24,5 mM para hidrogel de 10 kPa) a la solución de GelMA y mezcle bien.
NOTA: La adición de APS inicia la polimerización y los hidrogeles pueden formarse rápidamente, lo que requiere una acción rápida para evitar hidrogeles defectuosos. Se pueden encontrar más detalles sobre las mediciones de rigidez en un trabajo publicado anteriormente8. - Pipetee con cuidado la solución resultante en la abertura entre el portaobjetos de vidrio suspendido y el molde en RT y deje que se reticule. La fuerza capilar impulsa la solución de polímero hacia el molde. Evite añadir burbujas a los geles y deje de pipetear cuando quede una pequeña cantidad de solución en la punta de la pipeta.
NOTA: Durante la polimerización, los grupos de metacrilato de GelMA reaccionan con los residuos de metacrilato en los portaobjetos de vidrio modificados, lo que resulta en la unión química del hidrogel al vidrio. - Después de 15 minutos, la reacción es completa. Separe el sustrato del molde con un objeto afilado, como una aguja, y deslice el sustrato lejos del vidrio de cobertura para separarlo.
- Transfiera los hidrogeles a 1x solución salina tamponada con fosfato (PBS) en una placa de Petri de 100 mm sellada con una película de plástico y equilibre a 37 °C para eliminar los reactivos y subproductos restantes.
- Como el hidrogel es ligeramente más grande que las dimensiones finales, recorte el exceso de gel en los lados para que coincida con las dimensiones requeridas para la ventana de la cámara de flujo.
- Utilice la cámara de flujo para verificar las dimensiones del hidrogel. Asegúrese de que el hidrogel encaje correctamente en la cámara de flujo sin espacios entre el hidrogel y el molde ni ningún defecto que pueda afectar los patrones de flujo. Si hay irregularidades en la forma que pueden afectar el patrón de flujo en la cámara de flujo, lo que conduce a un comportamiento celular adverso, guarde el hidrogel para condiciones estáticas.
- Transfiera cuatro hidrogeles a una placa de Petri que contenga 1x PBS para su esterilización.
- Ensamblar moldes de politetrafluoroetileno (PTFE) de dos piezas con una profundidad adecuada y ventanas de apertura de 10mm2 para dar forma al sustrato final. Tenga en cuenta una contracción del 25% en la altura del hidrogel después de la polimerización durante el proceso de diseño. Asegúrese de que los moldes sean planos y estén bien sujetos en las placas inferior y superior para evitar fugas.
- Esterilice el hidrogel como se describe a continuación utilizando etanol al 70%.
- Prepare soluciones de alcohol al 25%, 50% y 70% para una deshidratación gradual del hidrogel.
NOTA: Si no se lleva a cabo una deshidratación gradual, los hidrogeles más rígidos pueden encogerse y romperse, mientras que se pueden formar arrugas en la superficie de los hidrogeles más blandos. - Aspire la solución 1x PBS de la placa de Petri que contiene hidrogeles. Agregue una solución de etanol al 25% a cada placa de Petri para sumergir los hidrogeles de 5 kPa y 10 kPa durante 15 min.
- Aspire la solución de alcohol al 25%. Agregue una solución de alcohol al 50% a cada placa de Petri para sumergir los hidrogeles de 5 kPa y 10 kPa durante 15 min.
- Aspire la solución de alcohol al 50%. Agregue una solución de alcohol al 70% a cada placa de Petri, sumergiendo los hidrogeles de 5 kPa y 10 kPa durante 5 min. Coloque la placa de Petri en una coctelera a 100 rpm.
- Dejar los hidrogeles de 5 kPa sumergidos durante 40 min y los hidrogeles de 10 kPa durante 20 min.
NOTA: Se observó que los hidrogeles de 5 kPa son más propensos a la contaminación en comparación con los hidrogeles de 10 kPa. - Transfiera las muestras a una placa de 6 pocillos en una cabina de bioseguridad y lave los hidrogeles 2x-3x con PBS estéril.
- Prepare soluciones de alcohol al 25%, 50% y 70% para una deshidratación gradual del hidrogel.
4. Hidrogeles de recubrimiento
- Prepare una solución de gelatina de 60 μg/mL disolviendo 3 mg de gelatina en 50 mL de PBS estéril (1x con sal de magnesio y calcio). Calentar la solución al baño maría a 37 °C durante 30 minutos o hasta que toda la gelatina se haya disuelto por completo.
- Filtre estérilmente la solución de recubrimiento con un filtro de jeringa de 0,2 μm. Aspire la solución 1x PBS de cada placa de pocillo y agregue la solución de gelatina a cada pocillo, asegurando una cobertura completa de cada hidrogel. Para minimizar el riesgo de contaminación, agregue 40 unidades/mL de penicilina y 10 μg/mL de estreptomicina a la solución de recubrimiento.
- Incubar cada placa de pocillo en una incubadora de 37 °C, 5% de CO2 durante 45 min. Lave los hidrogeles con 1x solución de PBS.
- Aspire PBS y agregue medios de cultivo celular.
- Durante no más de dos días, mantenga los hidrogeles en medios de cultivo celular e incube en una incubadora a 37 °C, 5% CO2 hasta la siembra celular.
NOTA: A pesar de las excelentes propiedades de unión celular de la fibronectina, existe una preocupación sobre su uso debido a que las CE depositan fibronectina endógena en condiciones ateroscleróticas, lo que puede conducir a una respuesta proinflamatoria. Para evitar respuestas celulares estimuladas químicamente, nos abstenemos de utilizar fibronectina. Además, Orr et al. demostraron que el recubrimiento de fibronectina, en comparación con el recubrimiento de colágeno I, regulaba al alza los genes aterogénicos. En concreto, observaron un aumento de los niveles de expresión de la molécula de adhesión intercelular 1 (ICAM-1), la molécula de adhesión celular vascular 1 (VCAM-1) y el factor nuclear-κB (NF-κB)14.
5. Células de siembra en los sustratos
- Prepare la suspensión celular siguiendo los protocolos de desprendimiento disponibles y cuente las células con un hemocitómetro8.
- Aspire completamente los medios de los hidrogeles. Añadir 50.000 células/cm2 a cada muestra. Agregue un volumen adecuado de suspensión celular a cada muestra para evitar el desbordamiento de células.
NOTA: Los sustratos más rígidos son más hidrofóbicos; Por lo tanto, minimice el tiempo entre pasos para mejorar la humectabilidad y la dispersión de la suspensión celular en la superficie del sustrato. - Incubar los hidrogeles sembrados con células en una incubadora de CO2 al 5% a 37 °C durante 2 h. Agregue medios de cultivo celular a las muestras una vez que las células estén unidas a los geles.
6. Fabricación de la cámara de flujo
NOTA: El enfoque para diseñar la cámara de flujo es rentable y requiere una experiencia mínima para la fabricación y utilización.
- Utilice poli(metacrilato de metilo) para la fabricación de cámaras para evaluar visualmente la calidad del flujo, la integridad del hidrogel bajo esfuerzo cortante y los posibles estudios de biomarcadores en tiempo real durante los experimentos de flujo. El diseño de la cámara se creó utilizando un software de diseño asistido por ordenador (CAD). La cámara de flujo ha sido solicitada para una patente, y los detalles sobre este dispositivo no se pueden revelar en el presente protocolo.
- Evaluación computacional de las condiciones de flujo en la cámara de flujo
- Ensamble los componentes individuales de la cámara de flujo diseñada (. SLDPRT) para crear la configuración final de la cámara.
- Trace una línea a lo largo de la línea central del flujo tangencial a la superficie del hidrogel para analizar la tensión cortante. Cierre las aberturas de entrada y salida para definir un volumen de control cerrado.
- Abra Simulación de flujo desde la pestaña Complementos en el software CAD. En la pestaña Simulación de flujo, abra la función Asistente para introducir las propiedades. Especifique el sistema de unidades y ajuste la presión y las unidades de tensión a dyne/cm2.
- Verifique el flujo de fluido y la gravedad en las características físicas. Establezca la gravedad en -9,8 en el componente Z; Los componentes X e Y deben ser cero.
- Elija Interno para el tipo de análisis en Manejo de geometría. Seleccione Agua como fluido predeterminado.
NOTA: Suponga que el medio se comporta como el agua. - Elija Laminar y Turbulento para el tipo de flujo. Defina el muro como un muro adiabático y introduzca la rugosidad de la superficie en Condición de muro.
- Ajuste la temperatura a 37,5 °C (310,65 K) en condiciones iniciales. Defina el dominio computacional en los proyectos de simulación de flujo, asegurándose de que cubra todo el volumen de control.
- Seleccione todas las paredes que interactúan con el fluido para definir el subdominio del fluido. En Condición de contorno, designe la superficie interior de la tapa de entrada como Caudal volumétrico de entrada y especifique el caudal (Q) y el caudal uniforme. Luego, asigne la superficie interna del sellado de la tapa de salida como presión estática.
- Determine el tamaño de malla global en función de los recursos computacionales disponibles. Pulsa Ejecutar para iniciar la simulación.
- Al finalizar, revise los resultados deseados, incluidos los gráficos de esfuerzo cortante y las simulaciones de flujo.
- Repita los pasos 6.2.8 a 6.2.10 con varios caudales para calcular el esfuerzo cortante aplicado a diferentes velocidades. Utilice el análisis de regresión para establecer la relación entre el caudal y el esfuerzo cortante.
- Evalúe la tolerancia del sistema a las variaciones en las dimensiones del hidrogel para mejorar el realismo de la simulación.
7. Ejecute un flujo laminar uniforme
- Después de cultivar las células en hidrogeles de 5 kPa y 10 kPa, asegure la confluencia de la monocapa celular en una incubadora de CO2 al 5% a 37 °C. Se debe lograr una monocapa de células en cada hidrogel.
- Esterilice los componentes esterilizables en autoclave del sistema de cámara de flujo de placa paralela (tornillos de acero inoxidable, espátula, pinzas, junta y el depósito de medios) con un ciclo de autoclave por gravedad de 30 minutos. Esterilice otras piezas (componentes acrílicos y selladores/amortiguadores de depósitos) con exposición a la luz ultravioleta.
- Ensamble el dispositivo de cámara de flujo en un gabinete de bioseguridad. Asegure las muestras de hidrogel en el dispositivo, garantizando la uniformidad. Utilice un relleno de igual tamaño que los hidrogeles si no se dispone de un número suficiente de muestras para el flujo.
- Humedezca previamente la superficie interna de la cámara y las superficies de hidrogel para minimizar la formación de burbujas y evitar el secado de las células durante el montaje.
- Agregue suficientes medios al depósito de entrada, permitiendo que entre el 20% y el 30% de los medios fluyan hacia el depósito de salida durante el montaje. Selle herméticamente el depósito de entrada con un amortiguador/sellador.
NOTA: La acumulación de presión en el depósito de entrada impulsa el flujo, y cualquier fuga de aire altera los caudales. Verifique si hay defectos en el sellador si se forman burbujas en el tubo exterior. - Ajuste el amortiguador de salida a la presión atmosférica para establecer la diferencia de presión. Coloque el dispositivo y los depósitos en una incubadora de 37 °C con 5% de CO2 a 37 °C. Conecte el tubo del dispositivo a una bomba peristáltica colocada fuera de la incubadora (Figura 1C).
- Encienda la bomba para comenzar a aplicar 3,6 dyne/cm2. Aumente gradualmente el caudal en incrementos de 2 mL/min (por ejemplo, alcance 85 mL/min desde 65 mL/min después de 10 min) hasta aplicar aproximadamente 8 dyne/cm2.
- Aumentar aún más el caudal en incrementos de 2,5 mL/min hasta alcanzar 12 dinas/cm2 de esfuerzo cortante.
NOTA: Deje tiempo para que las células se adapten a la condición dinámica, ya que los aumentos rápidos de la tasa de flujo pueden desprender las células y dañar la monocapa. - Después de 6 h, detenga el flujo, retire el dispositivo de la incubadora y desmonte la cámara de flujo. Posteriormente, transfiera las muestras de hidrogel a una placa de seis pocillos.
- Lave las muestras con PBS helado y fije las células para la inmunotinción o líselas para el aislamiento de proteínas.
8. Configuración de inmunotinción para microscopía confocal con gran aumento
NOTA: Para aumentar la eficiencia del estudio, se desarrolló un método para inmunotinción de pequeñas porciones de hidrogeles, lo que permite el examen de múltiples objetivos biológicos en una sola muestra.
- Prepare punzones de biopsia o herramientas de corte preferidas con diámetros de 3 o 4 mm.
- Utilice una caja de puntas de pipeta como cámara de tinción. Humidifique la cámara para controlar la evaporación de la solución de tinción durante la incubación prolongada colocando una toalla de papel húmeda en el fondo de la caja de puntas de pipeta.
- Reduzca el consumo de anticuerpos mediante la creación de pequeños grupos de soluciones para muestras individuales. Cubra la rejilla de la caja de puntas con una película transparente, presionando suavemente la película contra los orificios de la rejilla con la yema de un dedo para hacer hoyuelos. Rellene los hoyuelos con 70 μL de PBS.
- Transfiera un hidrogel individual a una placa de Petri vacía y córtelo con un punzón de biopsia o una herramienta de corte preferida. Utilice un microscopio para cortar un área de muestra representativa. Corta un cilindro de gel completo para evitar problemas de microscopía confocal.
- Coloque las muestras de hidrogel cortadas en los hoyuelos creados en el paso 8.3. Realice la tinción siguiendo el protocolo estándar15. Después del lavado final de la mancha, obtenga una lámina de caucho de silicona que coincida con el grosor del hidrogel.
NOTA: Preferiblemente, use una hoja con un lado adhesivo para un mejor sellado. En este estudio, las fibras de actina se tiñeron utilizando un anticuerpo secundario fluorescente conjugado con faloidina en una dilución de 1:20. - Corta la lámina de goma en cuadrados de 15 mm x 15 mm. Haga un orificio de 6 mm con un punzón de biopsia o una herramienta de corte preferida.
- Cree un recipiente de muestra fijando la goma a un cubreobjetos de microscopía (n.º 1.5). Añada 10 μL de medio de montaje húmedo a los hoyuelos mientras la muestra aún está presente e incube en la oscuridad durante 10-15 minutos.
NOTA: Para este estudio, el medio de montaje contenía 0,9 μg/mL de 4',6-diamidino-2-fenilindol (DAPI) para acortar el protocolo de tinción. - Retire la muestra de la cámara de tinción y colóquela en el recipiente creado en el paso 8.7. Aplique 1-2 μL de medio de montaje sobre la muestra.
NOTA: La cantidad de medios de montaje afecta a la calidad de la imagen con grandes aumentos. Un soporte de montaje excesivo o insuficiente puede comprometer la claridad de la imagen. - Coloque otro cubreobjetos en la parte superior y presione suavemente para asegurarse de que la muestra entre en contacto con el vidrio. Almacene las muestras a 4 °C en la oscuridad hasta la obtención de imágenes de microscopía.
Resultados
La Figura 1 muestra la configuración experimental, describiendo el proceso de síntesis de GelMA a través de una reacción de metacrilación. El producto resultante se utilizó para fabricar el sustrato de hidrogel, sobre el que se sembraron las EC. Posteriormente, las células se introdujeron en la cámara de flujo para un experimento de flujo de 6 h a 12 dinas/cm2.
1Se utilizó espectroscopia de RMN H para evaluar el éxito de la reacción de metacrilación (Figura 2A). La presencia de un grupo metilo a 1,9 ppm y un pico vinílico entre 5,4-5,6 ppm en GelMA confirmó el éxito de la metacrilación. Además, la disminución del pico de lisina a 3 ppm en GelMA indica el consumo de residuos de lisina, que son reemplazados por residuos de metacrilato 12,13,16. La rigidez de los hidrogeles de GelMA se evaluó mediante una prueba de compresión, que mostró que los módulos de compresión aumentaban con las concentraciones de GelMA (Figura 2B). Se utilizaron hidrogeles compuestos por 4% y 8% (p/v) de GelMA para imitar las rigideces fisiológicas (5 kPa) y patológicas (10 kPa) de la matriz, respectivamente8.
La cámara de flujo fue diseñada para ser rentable y fácil de esterilizar, mediante la utilización de polímero acrílico que es resistente a los rayos UV. Su transparencia facilita el seguimiento en tiempo real de los hidrogeles y las condiciones de flujo durante los experimentos. Diseñada con tres capas distintas, la cámara minimiza el riesgo de daños en el hidrogel durante la carga o descarga: la placa inferior proporciona una base resistente, la capa intermedia ofrece soporte lateral para los hidrogeles y la placa superior, a lo largo de la junta, crea el espacio necesario para el flujo de fluido (Figura 3A). Se realizaron simulaciones computacionales utilizando CFD para evaluar las condiciones de flujo y el esfuerzo cortante dentro de la cámara. La siguiente ecuación, esfuerzo cortante = 0.0558 x caudal, calculó el esfuerzo cortante aplicado a las celdas en función del caudal como entrada (Figura 3B). En particular, los cambios en las propiedades del material, como la rigidez, no alteraron el esfuerzo cortante en las simulaciones. Para tener en cuenta las diferencias en el tamaño del hidrogel en la configuración experimental final, los hidrogeles se dimensionaron intencionalmente un poco más pequeños en el modelo computacional. Se creó un espacio de 0,5 mm entre un lado de los hidrogeles y las paredes de la placa central de la cámara, perpendicular a la dirección del flujo. Esta configuración permitió el análisis de los efectos de los esfuerzos cortantes en estos huecos. Si bien se observaron irregularidades en el esfuerzo cortante en las ubicaciones de los espacios (Figura 3B), su impacto se limitó a una pequeña área adyacente a los espacios, y la superficie restante del hidrogel experimentó un esfuerzo cortante uniforme (Figura 3C). Estos conocimientos sugieren descartar las células de los bordes de los hidrogeles para minimizar el impacto potencial de las regiones turbulentas. Cabe mencionar que se aplicó experimentalmente un mayor esfuerzo cortante, de hasta 15 dinas/cm², a las CE sembradas en hidrogeles de 5 kPa y 10 kPa sin fugas en el dispositivo (datos no incluidos). Sin embargo, el aumento del esfuerzo cortante podría resultar en el desprendimiento de la célula y la falla del hidrogel, lo que enfatiza la necesidad de una optimización cuidadosa de las condiciones experimentales.
Para que las células de siembra formen una monocapa, es crucial utilizar una densidad celular mayor que en los cultivos tradicionales. Se ha demostrado que la baja densidad de siembra dificulta la formación de monocapas en hidrogeles más blandos8. Además, el recubrimiento previo de los hidrogeles con gelatina antes de la siembra celular mejora la adhesión inicial de las células y su difusión en hidrogeles más blandos. Sin embargo, es importante tener en cuenta que el efecto beneficioso de este recubrimiento es temporal, ya que facilita principalmente la interacción inicial entre las células y el sustrato.
La Figura 4 demuestra cómo la rigidez y el esfuerzo cortante influyen en la formación de fibras de actina. Bajo tensión de cizallamiento, se formaron fibras de tensión más gruesas, lo que sugiere una unión más fuerte a la superficie. En las muestras más blandas, había más fibras periféricas de actina, que son indicadores de las condiciones fisiológicas. Sin embargo, en las CE sobre sustratos más rígidos, la presencia de fibras de tensión más fuertes y menos fibras periféricas podría conducir potencialmente a la disfunción de la CE17. Estos datos confirman la efectividad del sistema presentado en la modulación del comportamiento de la CE.

Figura 1: Resumen del estudio actual. (A) Síntesis de GelMA. La gelatina se modificó químicamente a gelatina de metacrilato (GelMA) a través de una reacción entre la gelatina y el anhídrido metacrílico (MAH) a 55 °C. A continuación, el producto se precipitó en acetona y se secó al vacío. (B) Fabricación de hidrogel. El cubreobjetos se preparó colocando espaciadores. Luego, el vidrio modificado se unió al vidrio de cubierta. La cubierta de vidrio se colocó en el molde, con los espaciadores proporcionando el espacio deseado entre el vidrio modificado y la parte inferior del molde. La solución de GelMA que contiene iniciadores se añadió a la abertura entre el vidrio modificado y el molde, polimerizando para formar un hidrogel unido covalentemente al vidrio modificado. (C) Experimento de flujo. El hidrogel resultante se utilizó para sembrar EC. Después de formar una monocapa, las células se sometieron a un experimento de flujo de 6 h a una tensión de cizallamiento de 12 dyne/cm². Esta figura fue creada con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
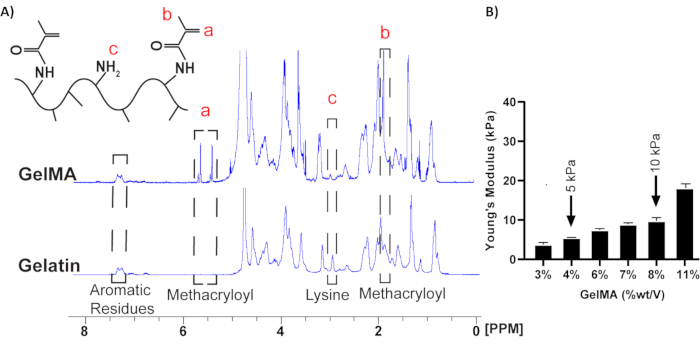
Figura 2: 1Espectros de RMN-H para prepolimerización de gelatina y GelMA. (A) Refiérase a los recuadros con líneas discontinuas para los picos relevantes. Los picos de metacriloilo (es decir, grupos vinílico y metilo) aparecieron después de la modificación química de la gelatina, mientras que el grupo lisina se utilizó para cuantificar el grado de sustitución después de la reacción química18. (B) El módulo de Young de los hidrogeles se midió mediante una prueba de compresión, y se consideró un 4% (p/v) de hidrogeles GelMA como sustratos fisiológicos, y un 10% (p/v) como sustrato patológico (n=4, media ± SEM). Esta cifra ha sido modificada de8. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Diseño de la cámara de flujo de placas paralelas y simulación computacional. (A) Se utilizaron tres placas separadas para reducir la posibilidad de dañar los hidrogeles durante la carga o descarga; Donde la placa inferior proporcionaba una superficie de respaldo, la superficie central ofrecía soporte lateral para los hidrogeles, y la placa superior y la junta formaban el espacio libre para que fluyera el fluido. (B) La cámara de flujo se sometió a simulaciones computacionales11. Cuando el caudal es de 215 mL/min, el esfuerzo cortante a lo largo de la línea dibujada es de aproximadamente 12 dinas/cm2, lo que representa el esfuerzo cortante fisiológico. (C) La influencia del espacio de 0,5 mm se limita a un área pequeña adyacente al espacio. La superficie restante del hidrogel experimenta una tensión de cizallamiento uniforme. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: La tensión de cizallamiento y el hidrogel rígido aumentan la formación de fibras de tensión. Se forman más fibras periféricas de actina en las CE en muestras de 5 kPa bajo flujo. Se formaron fibras de tensión más fuertes cuando las células se expusieron a una tensión de cizallamiento en hidrogeles de 10 kPa, lo que demuestra la eficacia del modelo en el comportamiento de la CE. Las flechas indican actina periférica y los asteriscos indican fibras estresadas. Barra de escala= 10 μm (Azul: DAPI, Rojo: Fibras de Actina). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El sistema vascular es un entorno dinámico en el que diversas fuerzas influyen significativamente en el comportamiento celular. Estudiar los eventos biológicos en las enfermedades cardiovasculares sin tener en cuenta estas fuerzas sería inexacto. Por lo tanto, los modelos celulares capaces de emular el entorno mecánico vascular son cruciales. Los investigadores ya han hecho progresos significativos en destacar el efecto de estas fuerzas en el comportamiento celular11. Sin embargo, para comprender el comportamiento celular en condiciones patológicas y fisiológicas en el cuerpo humano, es esencial desarrollar modelos más precisos que se asemejen más al entorno de los vasos sanguíneos. Por lo tanto, nuestro objetivo era desarrollar un sistema que reprodujera con mayor precisión el entorno de los vasos sanguíneos y, al mismo tiempo, mantuviera la facilidad de acceso y la facilidad de uso.
El modelo puede aplicar un esfuerzo de cizallamiento controlado derivado del flujo a células humanas en sustratos con diferentes niveles de rigidez, produciendo condiciones más cercanas a las realidades fisiológicas en comparación con los modelos existentes. GelMA se sintetizó y utilizó en este modelo para cumplir con los siguientes criterios: 1) propiedades mecánicas sintonizables, 2) comportamiento sin hinchazón, 3) compatibilidad y adhesión celular, y 4) la capacidad de incrustar células vasculares para modelar los vasos sanguíneos con mayor precisión. La capacidad de ajuste de las propiedades mecánicas se logró variando la concentración del biopolímero8 para imitar las condiciones fisiológicas y patológicas. El segundo criterio fue el comportamiento sin hinchazón. Es crucial tener un sustrato que no se hinche para mantener las dimensiones constantes de la cámara de flujo, las condiciones de flujo relacionadas y el esfuerzo cortante en las celdas. El GelMA con un alto grado de metacrilación demostró propiedades antiinflamación, preservando la forma del hidrogel y la suavidad de la superficie durante todo el experimento8. Es importante destacar que la concentración y la rigidez no afectaron el comportamiento de hinchamiento, lo que simplificó el modelo al eliminar la necesidad de ajustes separados para cada grupo experimental. El tercer criterio fue la adhesión celular, ya que la unión adecuada es necesaria para evitar el desprendimiento celular y preservar la integridad de la monocapa. GelMA proporcionó adhesión celular, reduciendo así la necesidad de pasos adicionales para conjugar las moléculas adhesivas celulares con el sustrato, lo cual es esencial para muchos biopolímeros. Además, se consideró la capacidad de GelMA para la encapsulación celular, aunque no se probó directamente en este estudio. El potencial de encapsulación celular tiene indicaciones para soportar el cultivo celular en 3D e integrar capas de células, como las células de músculo liso vascular o pericitos, para mejorar la precisión del modelo19. Además, la síntesis de GelMA es rentable y requiere un equipo mínimo, lo que lo convierte en un excelente candidato como biomaterial para la fabricación de sustratos 20,21,22.
La cámara de flujo de placa paralela se usa comúnmente para aplicar tensión de cizallamiento a las celdas, pero tradicionalmente solo se ha utilizado con cubreobjetos de vidrio o materiales rígidos. Sin embargo, estos materiales carecen de relevancia fisiológica23. Por el contrario, los dispositivos microfluídicos han introducido una mayor complejidad geométrica y sustratos más blandos mediante la utilización de materiales a base de polímeros. Sin embargo, estos dispositivos a menudo no pueden controlar el régimen de flujo con precisión, y sus pequeñas dimensiones limitan su capacidad para estudiar solo un pequeño número de células, lo que limita los resultados experimentales11. El dispositivo propuesto combina los beneficios de ambos sistemas mediante la integración de hidrogeles sembrados monocapa de células endoteliales con una cámara de flujo que aplica un esfuerzo de cizallamiento controlado con precisión.
El dispositivo ha demostrado la capacidad de integrar fuerzas mecánicas derivadas del flujo y derivadas de sólidos. Cuando se aplicó una tensión cortante de 12 dinas/cm2 durante 6 h, se observó una formación de fibras de tensión citosólica, contrastando con el predominio de actina periférica en el grupo de sustrato más blando. Esto está en línea con muchos informes que muestran que se forman menos fibras de tensión cuando las CE se cultivan en superficies más blandas 24,25,26,27. Por otro lado, el flujo laminar podría dar lugar a una formación de fibras de tensión prominente. Se ha demostrado que la respuesta del citoesqueleto a las condiciones de flujo comienza dentro de 1 h de la exposición al flujo, pero requiere un tiempo notablemente más largo para completar la reorganización 28,29,30. La red periférica de actina es esencial para diversas funciones de la CE, incluida la adhesión célula-célula y la funcionalidad de barrera17. La regulación positiva de esta red en un grupo experimental sano en comparación con el grupo patológico con fibras de estrés extensas aprueba el modelado exitoso del dispositivo de condiciones saludables y enfermas.
Un inconveniente de este dispositivo es la posibilidad de que se dañen los hidrogeles, lo que podría interrumpir el flujo y disminuir la tasa de éxito de los experimentos. Este problema surge principalmente de defectos iniciales en los hidrogeles, que, bajo esfuerzo cortante, pueden empeorar, lo que lleva al desprendimiento de la muestra y a la obstrucción parcial del flujo. Por lo tanto, los pasos de preparación de la muestra, incluida la polimerización, el equilibrio y el corte, deben realizarse con cuidado para evitar cualquier daño adicional a las muestras. Otro desafío en este sistema es lograr y mantener la integridad de la monocapa. Si bien el recubrimiento de los hidrogeles con gelatina puede mejorar la adhesión celular inicial, nuestro trabajo anterior demostró que este recubrimiento no afecta la proliferación celular8. Por lo tanto, para mejorar la formación de monocapas, especialmente teniendo en cuenta que la proliferación celular es más lenta en hidrogeles más blandos31, es beneficioso aumentar la densidad de siembra. Además, las células pueden desprenderse debido a la tensión de cizallamiento inducida por el flujo de fluido. Por lo tanto, es crucial aumentar gradualmente el caudal, permitiendo que las células tengan tiempo suficiente para adaptarse a las nuevas condiciones ambientales.
En conclusión, el dispositivo representa un avance significativo en la simulación del entorno vascular con mayor precisión debido a su capacidad para simular simultáneamente fuerzas mecánicas derivadas de fluidos y sólidos. Ofrece una plataforma completa para estudiar el comportamiento de la CE en diversas condiciones fisiológicas y patológicas. Esta versatilidad lo convierte en una herramienta valiosa para avanzar en nuestra comprensión de la biología vascular y la progresión de la enfermedad. Este modelo puede contribuir a una variedad de estudios de investigación, incluyendo la mecanobiología, la aterosclerosis, el desarrollo de metástasis del cáncer, la ingeniería de tejidos vasculares y la angiogénesis, y la administración y detección de fármacos.
Divulgaciones
Los autores declaran que se ha presentado una solicitud de patente provisional (Nº 63/634.853) con el título Cámara de flujo con un sustrato mecánicamente sintonizable, y que no existen otros intereses contrapuestos.
Agradecimientos
Los autores extienden su gratitud a Robert Egan por su ayuda en la fabricación de la cámara de flujo. Los autores agradecen a Lucas McCauley por su ayuda durante los experimentos. Además, les gustaría agradecer a las instalaciones centrales del Instituto de Imágenes Químicas de Sistemas Vivos (CILS) de la Universidad Northeastern por permitir el acceso a los microscopios confocal. Los autores agradecen el apoyo financiero proporcionado por los Institutos Nacionales de Salud (NIH 1R01EB027705 otorgado a SB) y la Fundación Nacional de Ciencias (NSF CAREER Awards: DMR 1847843 a SB y CMMI 1846962 a EE).
Materiales
| Name | Company | Catalog Number | Comments |
| (trimethoxysilyl)propyl methacrylate, tetramethylethylenediamine (TEMED) | Invitrogen | 15524-010 | Hydrogel Fabrication |
| 3-(Trimethoxysilyl)Propyl Methacrylate | Sigma-Aldrich | 440159 | Glass Salinization |
| 4’,6-diamidino-2-phenylindole (DAPI)-containing mounting media | Vector Laboratories | H-1200 | Immunostaining |
| Acetone | Thermo Fisher Scientifics | A18-4 | GelMA Synthesis |
| Alexa Fluor 555 Phalloidin | Cell Signaling Technology | 8953S | Immunostaining |
| Ammonium Persulfate (APS) | Bio-Rad | 1610700 | Hydrogel Fabrication |
| Clear Scratch- and UV-Resistant Cast Acrylic Sheet (45/64'') | McMaster-CARR | 8560K165 | Flow Chamber Fabrication |
| Confocal Microscope | Carl Zeiss Meditex AG | Zeiss LSM 800 | Immunostaining |
| Covidien Monoject Rigid Pack 60 mL Syringes without Needles | Fisher | 22-031-375 | Flow Experiment |
| EC growth kit | American Type Culture Collection (ATCC) | PCS-100-041 | Cell Culture |
| Ethanol 200 Proof | Decon Labs | 2701 | Glass Salinization |
| Gelatin Type A (300 bloom) from porcine skin | Sigma-Aldrich | G1890 | GelMA Synthesis |
| Glacial Acetic Acid | Thermo Fisher Scientifics | 9526-33 | Glass Salinization |
| High-Purity High-Temperature Silicone Rubber Sheet | McMaster-Carr | 87315K74 | Flow Chamber Fabrication |
| Human Umbilical Vein Endothelial Cells (HUVEC) | American Type Culture Collection (ATCC) | PSC-100-010 | Cell Culture |
| M3x30mm Machine Screws Hex Socket Round Head Screw 304 Stainless Steel Fasteners Bolts 20pcs | Uxcell | B07Q5RM2TP | Flow Chamber Fabrication |
| Masterflex L/S Digital Drive with Easy-Load® 3 Pump Head for Precision Tubing; 115/230 VAC | VWR | #MFLX77921-65 | Flow Experiment |
| Masterflex L/S Precision Pump Tubing, Puri-Flex, L/S 25; 25 ft | VWR | #MFLX96419-25 | Flow Experiment |
| Methacrylic Anhydride (MAH) | Sigma-Aldrich | 276685 | GelMA Synthesis |
| Paraformaldehyde | Thermo Fisher Scientifics | 043368.9M | Cell Culture |
| Phosphate-Buffered Saline (PBS) | Gibco | 14080-055 | General |
| Sodium Bicarbonate | Fisher Chemical | S233-3 | GelMA Synthesis |
| Sodium Carbonate | Fisher Chemical | S263-500 | GelMA Synthesis |
| SOLIDWORKS educational version | |||
| SOLIDWORKS Student Edition Desktop, 2023 | SolidWorks | N/A | Flow Chamber Design |
| Vascular Basal Medium | American Type Culture Collection (ATCC) | PCS-100-030 | Cell Culture |
Referencias
- Deanfield, J. E., Halcox, J. P., Rabelink, T. J. Endothelial function and dysfunction. Circulation. 115 (10), 1285-1295 (2007).
- Suowen, X., et al. Endothelial dysfunction in atherosclerotic cardiovascular diseases and beyond: From mechanism to oharmacotherapies. Pharmacol Rev. 73 (3), 924 (2021).
- Jansen, K. A., Atherton, P., Ballestrem, C. Mechanotransduction at the cell-matrix interface. Sem Cel Dev Biol. 71, 75-83 (2017).
- Tarbell, J. M., Pahakis, M. Y. Mechanotransduction and the glycocalyx. J Int Med. 259 (4), 339-350 (2006).
- Topper, J. N., Cai, J., Falb, D., Gimbrone, M. A. Identification of vascular endothelial genes differentially responsive to fluid mechanical stimuli: cyclooxygenase-2, manganese superoxide dismutase, and endothelial cell nitric oxide synthase are selectively up-regulated by steady laminar shear stress. Proc Natl Acad Sci. 93 (19), 10417-10422 (1996).
- Mitchell, G. F., et al. Arterial stiffness and cardiovascular events. Circulation. 121 (4), 505-511 (2010).
- Bonetti, P. O., Lerman, L. O., Lerman, A. Endothelial dysfunction. Arterioscler Thromb Vasc Biol. 23 (2), 168-175 (2003).
- Hamrangsekachaee, M., et al. Endothelial glycocalyx sensitivity to chemical and mechanical sub-endothelial substrate properties. Front Bioeng Biotechnol. 11, 1250348 (2023).
- Mensah, S. A., et al. Flow-regulated endothelial glycocalyx determines metastatic cancer cell activity. FASEB J. 34 (5), 6166-6184 (2020).
- Russell-Puleri, S., et al. Fluid shear stress induces upregulation of COX-2 and PGI2 release in endothelial cells via a pathway involving PECAM-1, PI3K, FAK, and p38. Am J Physiol-Heart Cir Physiol. 312 (3), H485-H500 (2016).
- Hamrangsekachaee, M., Wen, K., Bencherif, S. A., Ebong, E. E. Atherosclerosis and endothelial mechanotransduction: current knowledge and models for future research. Am J Physiol-Cell Physiol. 324 (2), C488-C504 (2022).
- Zhu, M., et al. Gelatin methacryloyl and its hydrogels with an exceptional degree of controllability and batch-to-batch consistency. Sci Rep. 9 (1), 6863 (2019).
- Kim, J., Bencherif, S. A., Li, W. A., Mooney, D. J. Cell-friendly inverse opal-like hydrogels for a spatially separated co-culture system. Macromol Rapid Comm. 35 (18), 1578-1586 (2014).
- Orr, A. W., et al. The subendothelial extracellular matrix modulates NF-kappaB activation by flow: a potential role in atherosclerosis. J Cell Biol. 169 (1), 191-202 (2005).
- Hamrangsekachaee, M., Baumann, H. J., Pukale, D. D., Shriver, L. P., Leipzig, N. D. Investigating mechanisms of subcutaneous preconditioning incubation for neural stem cell embedded hydrogels. ACS Appl Bio Mater. 5 (5), 2176-2184 (2022).
- Rezaeeyazdi, M., Colombani, T., Memic, A., Bencherif, S. A. Injectable hyaluronic acid-co-gelatin cryogels for tissue-engineering applications. Materials. 11 (8), 1374 (2018).
- Belvitch, P., Htwe, Y. M., Brown, M. E., Dudek, S. Cortical actin dynamics in endothelial permeability. Curr Top Membr. 82, 141-195 (2018).
- Krishnamoorthy, S., Noorani, B., Xu, C. Effects of encapsulated cells on the physical-mechanical properties and microstructure of gelatin methacrylate hydrogels. Int J Mol Sci. 20 (20), 5061 (2019).
- Jin, Q., et al. Bioprinting small-diameter vascular vessel with endothelium and smooth muscle by the approach of two-step crosslinking process. Biotechnol Bioeng. 119 (6), 1673-1684 (2022).
- Villard, P., et al. Autoclavable and injectable cryogels for biomedical applications. Adv Healthcare Mater. 8 (17), 1900679 (2019).
- Bencherif, S. A., et al. Influence of cross-linker chemistry on release kinetics of PEG-co-PGA hydrogels. J Biomed Mater Res A. 90 (1), 142-153 (2009).
- Rogers, Z. J., Zeevi, M. P., Koppes, R., Bencherif, S. A. Electroconductive hydrogels for tissue engineering: Current status and future perspectives. Bioelectricity. 2 (3), 279-292 (2020).
- James, B. D., Allen, J. B. Vascular endothelial cell behavior in complex mechanical microenvironments. ACS Biomater Sci Eng. 4 (11), 3818-3842 (2018).
- Yeh, Y. T., et al. Matrix stiffness regulates endothelial cell proliferation through septin 9. PLoS One. 7 (10), e4688 (2012).
- Fioretta, E. S., Fledderus, J. O., Baaijens, F. P. T., Bouten, C. V. C. Influence of substrate stiffness on circulating progenitor cell fate. J Biomech. 45 (5), 736-744 (2012).
- Geemen, D. v., et al. F-Actin-anchored focal adhesions distinguish endothelial phenotypes of human arteries and veins. Arterioscler Thromb Vasc Biol. 34 (9), 2059-2067 (2014).
- Dessalles, C. A., Leclech, C., Castagnino, A., Barakat, A. I. Integration of substrate- and flow-derived stresses in endothelial cell mechanobiology. Comm Biol. 4 (1), 764 (2021).
- Estrada, R., Giridharan, G. A., Nguyen, M. D., Prabhu, S. D., Sethu, P. Microfluidic endothelial cell culture model to replicate disturbed flow conditions seen in atherosclerosis susceptible regions. Biomicrofluidics. 5 (3), 32006 (2011).
- Inglebert, M., et al. The effect of shear stress reduction on endothelial cells: A microfluidic study of the actin cytoskeleton. Biomicrofluidics. 14 (2), 024115 (2020).
- Noria, S., et al. Assembly and reorientation of stress fibers drives morphological changes to endothelial cells exposed to shear stress. Am J Pathol. 164 (4), 1211-1223 (2004).
- Amer, M., Shi, L., Wolfenson, H. The 'Yin and Yang' of cancer cell growth and mechanosensing. Cancers (Basel). 13 (19), 4754 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados