Method Article
ויסות כימוגנטי בתאי קודמן שמקורם בתאי גזע מתוכנתים מחדש בטיפול במחלות נוירודגנרטיביות
In This Article
Summary
כאן, אנו מתארים פרוטוקול להנדסת תאי גזע שתוכנתו מחדש כימית כדי להשיג אפנון עצבי מדויק על ידי התמיינות תאים אלה לתאים קודמים דופמינרגיים, השתלתם במודלים של עכברים של מחלת פרקינסון, והערכת תוצאות התנהגותיות ואלקטרופיזיולוגיות כדי לאשר את האינטגרציה המוצלחת והיעילות התפקודית של התאים המושתלים.
Abstract
השילוב של קולטנים מעוצבים המופעלים באופן בלעדי על ידי תרופות מעצבים (DREADD) עם טיפולים מבוססי תאי גזע מציג אסטרטגיה מתקדמת לאפנון עצבי מדויק. כאן, השתמשנו בתאי גזע אנושיים מתוכנתים מחדש על ידי CRISPR המבטאים קולטני DREADD מעוררים (hM3Dq) או מעכבים (hM4Di) כדי להעריך את האינטגרציה והאפנון התפקודי של קודמנים דופמינרגיים מושתלים במודל עכברי של מחלת פרקינסון (PD). השלבים העיקריים כללו יצירת קווי תאי גזע המבטאים DREADD שאינם היתוך, התמיינות שלהם לקודמנים דופמינרגיים במוח האמצעי, והשתלת תאים אלה בסטריאטום של עכברים נגועים 6-הידרוקסידופמין (6-OHDA). ביצענו הערכות התנהגותיות והקלטות אלקטרופיזיולוגיות כדי לנתח את ההשפעות של התאים המושתלים. בדיקות התנהגותיות, כגון מבחן הצילינדר, הראו אפנון משמעותי של התפקוד המוטורי לאחר מתן קלוזפין-N-אוקסיד (CNO). באופן ספציפי, הפעלת hM4Di הפחיתה את תנועת הגפיים הקדמיות הנגדיות, בעוד שהפעלת hM3Dq הייתה קשורה להתנהגות מוטורית משופרת. הקלטות אלקטרופיזיולוגיות חשפו תגובות סינפטיות מובהקות. הפעלת hM4Di הגדילה את המרווחים הבין-אירועים והפחיתה את אמפליטודות השיא של זרמים פוסט-סינפטיים מעוררים ספונטניים (sEPSCs), בעוד שהפעלת hM3Dq הפחיתה את המרווחים הבין-אירועים והגדילה את אמפליטודות השיא, מה שמשקף איתות מעורר משופר. לסיכום, השילוב של הערכות התנהגותיות ואלקטרופיזיולוגיות מאמת את השילוב התפקודי המדויק של תאי גזע מתוכנתים מחדש כימית במעגלים עצביים מארחים.
Introduction
קולטנים מעצבים המופעלים באופן בלעדי על ידי תרופות מעצבים (DREADD) הם קולטנים מצומדים לחלבון G מהונדסים הניתנים להפעלה סלקטיבית על ידי ליגנדים סינתטיים אינרטייםאחרת 1. הגישה הכימוגנטית הפכה לכלי חיוני במדעי המוח בכך שהיא מאפשרת לחוקרים לחקור קישוריות של מעגלים עצביים בדיוק גבוה ולשפר את ההבנה שלנו לגבי תפקודים תאיים הן in vivo והן in vitro באמצעות הפעלה או עיכוב סלקטיביים של אזורי מוח ספציפיים או סוגי תאים 2,3.
טיפול מבוסס תאי גזע מציג אסטרטגיה מבטיחה לטיפול במחלות ניווניות. יעילותם של תאי השתל מסתמכת על אינטגרציה נכונה, הישרדות ותרומה תפקודית לרקמות המארח. פעילות תאית בלתי מבוקרת עלולה להוביל לתוצאות שליליות, כולל גידול4; מה שמחייב בקרה מדויקת על תאים אלה לאחר ההשתלה. מינוף טכנולוגיית DREADD בתאי גזע אנושיים מתוכנתים מחדש ונוירונים נגזרים מספק אמצעי לשליטה מדויקת בפעילות העצבית באמצעות מתן תרופת המעצב CNO 2,5. בהקשר של מחלת פרקינסון (PD), המאופיינת באובדן נוירונים דופמינרגיים, מניפולציה של פעילותם של נוירונים דופמינרגיים שמקורם בתאי גזע היא חיונית לחקירת התשומות הסינפטיות ודפוסי ההקרנה שלהם במודלים של מכרסמים 6,7,8,9,10. שילוב קולטני hM3Dq מעוררים ומעכבי hM4Di במודלים אלה מאפשר אפנון מדויק של הפעילות העצבית11,12.
השילוב של הערכות התנהגותיות של בעלי חיים ורישומים אלקטרופיזיולוגיים מאפשר הערכה מקיפה של ההשפעות של אפנון כימוגנטי על תאים מושתלים in vivo13. הערכות התנהגותיות, כולל סיבוב המושרה על ידי אפומורפין, מבחן הצילינדר ומבחן הרוטרוד, מעריכות את הקואורדינציה המוטורית ומספקות תובנות לגבי שינויים בתפקוד המוטורי הקשורים למודלים ניסיוניים של PD14. טכניקות אלקטרופיזיולוגיות, כגון הקלטות מהדק טלאי, מאפשרות ניטור בזמן אמת של תגובות סינפטיות ופוטנציאל פעולה, ומספקות מבט מקיף על האופן שבו תאים מושתלים משתלבים ברשתות עצביות קיימות15. על ידי שילוב הערכות התנהגותיות עם הערכות אלקטרופיזיולוגיות, אנו יכולים לחקור כיצד אפנון כימוגנטי משפיע על האינטגרציה והפונקציונליות של תאים אלה בתוך מעגלים עצביים מארחים16. ממצאים ראשוניים מצביעים על כך שמתן CNO מווסת ביעילות את הפעילות העצבית בתאים מושתלים, וכתוצאה מכך תוצאות תפקודיות משופרות במודלים של בעלי חיים.
בפרוטוקול זה, תאי גזע אנושיים שתוכנתו מחדש הונדסו לבטא קולטני hM3Dq או hM4Di על ידי שימוש בטכנולוגיית CRISPR. לאחר התמיינות תאי גזע שתוכנתו מחדש לתאי קודמן דופמינרגיים במוח האמצעי, תאים אלה הושתלו במודלים של עכברים של מחלת פרקינסון כדי להעריך את האינטגרציה והוויסות התפקודי שלהם במעגלים העצביים של המארח באמצעות הערכות התנהגותיות ורישומים אלקטרופיזיולוגיים.
Protocol
כל הניסויים בבעלי חיים בוצעו בהתאם להנחיות שנקבעו על ידי אגודת בייג'ינג למדעי חיות מעבדה והמכונים הלאומיים לבריאות לטיפול ושימוש בחיות מעבדה. תאים חד-גרעיניים מדם היקפי אנושי (PBMCs) התקבלו מתורם בריא עם הסכמה מדעת בכתב כמתואר במחקר קודם17.
1. בניית קווי תאים מבוססי גזע DREADD ללא היתוך
- בנה את הפלסמיד התורם DREADD.
הערה: יש לתכנן את אתרי העיכול בהתאם לרצף הווקטור. יש לסנתז ולהגביר את השברים עם חפיפות של 20-30 bp התואמות את זרועות השבר כדי לשפר את יעילות ההרכבה.- תכנן וסינתז את שבר T2A-ZsGreen (שבר I).
- הגביר את שבר hM3Dq/hM4Di-T2A מהפלסמיד המקורי באמצעות PCR (שבר II). הגדר את תגובת ה-PCR (נפח כולל של 50 מיקרוליטר) כך שתכיל 1x מאגר PCR, 200 מיקרומטר מכל תערובת dNTP, 0.5 מיקרומטר פריימרים קדימה ואחורה, 10-50 ננוגרם של תבנית DNA פלסמיד ו-1.25 U של DNA פולימראז בנאמנות גבוהה. בצע רכיבה תרמית בתנאים הבאים: דנטורציה ראשונית ב-98 מעלות צלזיוס למשך 2.75 דקות כדי לנטרל את התבנית במלואה; 32 מחזורי הגברה המורכבים מ-98 מעלות צלזיוס למשך 15 שניות (דנטורציה), 60 מעלות צלזיוס למשך 30 שניות (חישול פריימר) ו-72 מעלות צלזיוס למשך 60 שניות (הארכה); הארכה סופית ב-72 מעלות צלזיוס למשך 7 דקות.
- עכל את הפלסמיד הווקטורי עם האנזים המתאים כדי להשיג את הווקטור הליניארי. טהר את כל השברים על ידי אלקטרופורזה של ג'ל אגרוז וכימת אותם באמצעות ספקטרופוטומטר.
הערה: כאן, הפלסמיד המקורי עוכל עם MluI ו-SalI.
- מערבבים בעדינות 50-100 ננוגרם של הווקטור הליניארי, שבר I ושבר II ביחס מולארי של 1:3:3, יחד עם תערובת שיבוט פי 2. דגרו את התערובת בטמפרטורה של 55 מעלות צלזיוס למשך שעה אחת כדי להקל על רקומבינציה הומולוגית באמצעות מכלול גיבסון.
- הכנס את ה-RNA המנחה המכוון לאתר AAVS1 לאתר BbsI של וקטור pX458.
הערה: בצע אימות רצף על כל הפלסמידים הבנויים באמצעות ריצוף Sanger. - שמור על תאי הגזע המתוכנתים מחדש במדיה, במטרה להגיע לצפיפות תאים של 2-5 ×-106 תאים/מ"ל.
הערה: תאי הגזע שתוכנתו מחדש ושימשו כאן הושרו מ-PBMCs אנושיים כמתואר במחקר קודם17. ניטור בריאות התא הוא חיוני, מכיוון שמצב התא משפיע באופן משמעותי על יעילות האלקטרופורציה. ראה טבלת חומרים להשוואה בין המדיה. - מערבבים 2-5 × 106 תאים, 2 מיקרוגרם מכל פלסמיד תורם (hM4Di-T2A-ZsGreen או hM3Dq-T2A-ZsGreen), ו-2 מיקרוגרם של פלסמיד gRNA ב-100 מיקרוליטר של מאגר אלקטרופורציה ומעבירים לקובט לאלקטרופורציה.
הערה: ודא שהתערובת מעורבבת היטב וללא בועות לפני שתמשיך לאלקטרופורציה. אופטימיזציה של פרמטרי אלקטרופורציה על סמך סוג התא כדי למקסם את יעילות הטרנספקציה, מכיוון שהתקנים שונים עשויים לדרוש התאמות ספציפיות. - הגדר את ה-Nucleofector לתוכנית B16 והתחל אלקטרופורציה כדי להקל על העברה יעילה של iNSCs המטרה.
- הוסף 1 מ"ל של 50 מיקרוגרם/מ"ל פולי-D-ליזין (PDL) לכל באר של צלחת בת 6 בארות ודגר בטמפרטורת החדר למשך שעתיים לפחות. הסר את כל ה-PDL מהבארות והוסף 1.5 מ"ל של למינין של 5 מיקרוגרם/מ"ל לכל באר ודגירה בטמפרטורה של 37 מעלות צלזיוס למשך 2-4 שעות. השתמש מיד בצלחת המצופה או אחסן בטמפרטורה של 2-8 מעלות צלזיוס למשך שבוע.
- העבירו את התאים האלקטרופורטיים לצלחות בנות שש בארות שצופו ב-PDL ולמינין. מחלקים כ -500,000 תאים לבאר בנפח של 2 מ"ל מדיום תרבית לבאר.
- לאחר 72 שעות של אלקטרופורציה, השתמש בציטומטר זרימה כדי למיין תאים חיוביים פלואורסצנטיים.
- השעו מחדש תאים מנותקים ב-DPBS, וסננו דרך מסננת תאים של 70 מיקרומטר.
- הגדר את הממיין עם ערוץ FITC לזיהוי ZsGreen. כלול iNSCs לא מטופלים כבקרות שליליות כדי להגדיר את הקרינה הבסיסית.
- כייל את המכשיר באמצעות חרירי 100 מיקרומטר בלחץ נדן של 20 psi. יישם מצב מיון טוהר לארבעה כיוונים עם אישור תא יחיד.
- צלחו תאי ZsGreen+ בודדים בצלחות של 96 בארות מצופות מראש ב-PDL ולמינין, והוסיפו 200 מיקרוליטר של מדיום תרבית לכל באר כדי לתמוך בצמיחה הראשונית. יש לשמור בתרבית בינונית למשך 7-14 ימים
הערה: עקוב אחר בארות מדי יום לאיתור סימני צמיחה ופלואורסצנטיות המעידים על אינטגרציה מוצלחת וסמן את הבאר החיובית. - בודד שיבוטים בודדים המציגים פלואורסצנטיות באמצעות מיקרוסקופ פלואורסצנטי הפוך המצויד בסט מסנני GFP. שיבוטי מסך בהגדלה של פי 10. סמן בארות המכילות מושבות חד-שבטיות עם אות ZsGreen מתמשך ואחיד. צלם תמונות של שדה בהיר ופלואורסצנטי כדי לתעד מורפולוגיה ועוצמת הקרינה.
הערה: לפני ההדמיה, החלף מדיום טרי כדי להפחית את הקרינה ברקע. אל תכלול מושבות עם מורפולוגיה לא סדירה או אוטופלואורסצנטיות. - הרחב את התאים החיוביים על צלחות מצופות של 48 בארות. לאחר מכן התפצל לשני חלקים, האחד לתרבית והשני לגנוטיפ.
- חלץ DNA גנומי משיבוטים מועמדים. הכן תגובות PCR עם שני זוגות פריימרים: זוג אחד לאישור החדרת הגן המעניין, הפריימר השני להבחנה בין שיבוטים הומוזיגוטיים והטרוזיגוטים. בצע רכיבה תרמית בתנאים הבאים: דנטורציה ראשונית ב-95 מעלות צלזיוס למשך 5 דקות; 38 מחזורים של 95 מעלות צלזיוס למשך 30 שניות, 60 מעלות צלזיוס למשך 30 שניות ו-72 מעלות צלזיוס למשך 45 שניות; הארכה סופית ב-72 מעלות צלזיוס למשך 7 דקות. יש לפתור את מוצרי ה-PCR על ג'ל אגרוז 2%.
הערה: ראה טבלת חומרים עבור הפריימרים. אשר את החדרת הגן המעניין על ידי פס יחיד של 650 bp (פריימר 1). זהה שיבוטים הטרוזיגוטיים על ידי נוכחות של פס יחיד של 630 bp ושיבוטים הומוזיגוטיים על ידי היעדר פס זה (פריימר 2). - הרחב את התאים החיוביים על צלחות מצופות של שש בארות.
- עכל את התאים ושטוף אותם במי מלח עם חוצץ פוספט (PBS) על ידי צנטריפוגה בחום של 250 × גרם למשך 3 דקות. הקפיאו את התאים במדיום שימור בהקפאה עם 10% DMSO בצפיפות של 2.5 × 106 תאים לבקבוקון.
2. השתלת תאי מבשר שמקורם בתאי גזע DREADD בעכברים מדגם PD
- יש לתת זריקה תוך-צפקית של דזיפרמין בריכוז של 5 מ"ג/מ"ל (10 מ"ג/ק"ג) לעכברים מדוכאי חיסון 30 דקות לפני הניתוח. להרדים את העכברים עם 2% איזופלורן.
- בצע זריקות סטריאוטקסיות חד צדדיות של 3 מיקרוליטר של 6-הידרוקסידופמין (6-OHDA, 5 מיקרוגרם/מיקרוליטר). כוון את הקורפוס סטריאטום הימני באמצעות הקואורדינטות הבאות: אנטרופוסטריור = 0.5 מ"מ, לרוחב = 2.1 מ"מ ואנכי = -3.2 מ"מ.
הערה: יש להמיס 6-OHDA במי מלח המכילים 0.2% חומצה אסקורבית. הקפידו על מיקוד מדויק כדי למזער את השונות בחומרת הנגע.
אזהרה: 6-OHDA הוא ציטוטוקסי ומייצר מיני חמצן תגובתיים הגורמים ללחץ תאי. טפל בזהירות. - יש לתת זריקה תוך-צפקית של אפומורפין (1 מ"ג/ק"ג, 0.5 מ"ג/מ"ל מומס במי מלח) כדי לאמת את הנגעים 4 שבועות לאחר הניתוח. בחר עכברים נגועים המציגים יותר מ-100 סיבובים נגדיים בתוך תקופת תצפית של 30 דקות לניסויים הבאים.
הערה: אפומורפין הוא אגוניסט לקולטן דופמין, המפעיל ישירות קולטנים פוסט-סינפטיים סופר-רגישים בסטריאטום המנותק, ומפר את פעילות המעגל הניגרוסטריאטלי הדו-צדדי. סיבוב המושרה על ידי אפומורפין משמש להערכת חומרת הנגעים הדופמינרגיים החד-צדדיים על ידי 6-OHDA. - תאי זרע ותרבית בצלחות מצופות של שש בארות (150,000 תאים לבאר). דגירה במדיום התמיינות שלב 1 למשך 10 ימים, רענון המדיום כל יומיים. ביום ה-11, עברו למדיום ההתמיינות של שלב 2 והמשיכו בדגירה עד היום ה-13, והחליפו את המדיום בכל יום.
הערה: ראה טבלת חומרים להשוואה בין מדיום התמיינות. - קצרו את התאים בימים 10 ו-13 של התמיינות, ואז ערבבו אותם ביחס של 1:7. השעו את התערובת במאגר ההשתלה בריכוז של 100,000 תאים/מיקרוליטר.
הערה: ראה טבלת חומרים להשוואה של מאגר השתלה. - לתת הזרקה סטריאוטקסית בנפח כולל של 4 מיקרוליטר של תרחיף התאים המוכן לעכבר PD.
- בצע את בדיקת הצילינדר בנקודות זמן שונות לאחר השתלת התאים. הניחו זכוכית (קוטר: 20 ס"מ, גובה: 30 ס"מ) על משטח שטוח ולא מחזיר אור. מקם מצלמה בתצוגה עליונה מעל הגליל כדי ללכוד את הקוטר המלא.
הערה: סגור את הצילינדר בווילונות שחורים כדי למנוע גירויים חזותיים חיצוניים. - הנח כל עכבר במרכז הגליל והתחל הקלטת וידאו בו זמנית (3 דקות למפגש). לאחר ההפעלה, החזר את העכבר לכלוב הביתי שלו.
הערה: אקלום עכברים לחדר הבדיקה למשך 30 דקות בתנאי תאורה. נקה את הצילינדר עם 70% אתנול בין הניסויים כדי למנוע סימני ריח. - העריכו את יכולת התנועה של הגפיים העליונות של העכברים למשך 3 דקות. חשב את מספר מגעי הקיר שנוצרו על ידי הגפה הקדמית הפגומה ביחס למספר הכולל של המגעים שנוצרו על ידי שתי הגפיים הקדמיות.
- יש לתת מי מלח או CNO במינון של 1.2 מ"ג/ק"ג באמצעות הזרקה תוך צפקית. בצע את בדיקת הצילינדר כדי להעריך אפנון התנהגותי במודל עכבר PD לאחר מתן CNO
הערה: אפשר תקופת התאוששות של כ-40 דקות לפני שתמשיך בהערכה.
3. פרופיל אלקטרופיזיולוגי in vivo של תאים מווסתים כימוגנטית
- להרדים עכברים על ידי הזרקה תוך צפקית של 250 מ"ג/ק"ג פנטוברביטל. חלצו את המוח והניחו אותו מיד בנוזל מוחי שדרתי מלאכותי על בסיס סוכרוז קר כקרח (s-ACSF) כדי לשמור על שלמות התאים. בעזרת ויברטום, חתכו את המוח למקטעים בעובי של 300-400 מיקרומטר.
הערה: עבדו במהירות כדי לשמור על המוח בטמפרטורות נמוכות כדי לשמר את תפקוד התאים. ראה טבלת חומרים עבור s-ACSF המשמש להכנת חתך מוח טרי. - העבירו את הדגימות לתא מלא ב-ACSF מאוזן עם 95% O2 ו-5% CO2 ב-34 מעלות צלזיוס, והבטיחו שטמפרטורה זו נשמרת לאורך כל הניסוי.
הערה: ראה טבלת חומרים עבור ACSF. - טען פיפטות זכוכית עם תמיסה תוך-תאית קרה, עם התנגדות אלקטרודה הנעה בין 7 ל-10 MΩ.
הערה: ראה טבלת חומרים לתמיסה תוך-תאית. פיפטות זכוכית מיוצרות מנימי זכוכית על ידי מושך מיקרופיפטה18. בדוק אם יש נזילות בפיפטות הזכוכית לפני תחילת הניסויים, וודא שהקצוות חדים מספיק כדי לחדור לקרום התא. הכן פיפטות במהירות כדי למזער את תנודות הטמפרטורה בתמיסה התוך תאית. - הרכיבו פרוסות בתא הקלטה שקוע (2 מ"ל/דקה) עם ACSF מחומצן ב-34 מעלות צלזיוס. מקם פיפטות באמצעות מיקרומניפולטורים ממונעים תחת מיקרוסקופ ניגודיות הפרעות דיפרנציאליות אינפרא אדום. ביסוס תצורת תא שלם על ידי הפעלת יניקה עדינה (התנגדות > 1 GΩ) על נוירונים טלאים בתוך אזורי השתל. תאי מהדק ב -70 mV באמצעות מגבר מהדק תיקון; רכשו רכיבי sEPSC בסיסיים למשך 8 דקות בקצב דגימה של 10 kHz (מסוננים ב-2 kHz), וניטור רציף של התנגדות הגישה (יעד: <20 MΩ; השליכו אם >25 MΩ או תנודות >10%).
הערה: השתמש בלחץ מתאים בעת הפעלת יניקה כדי למנוע תזוזה או קרע לא רצויים של תאים, והתאם בזהירות את מיקום הפיפטה כדי להשיג אטימה טובה. אם איכות האיטום ירודה, השליכו את הפיפטה ונסו שוב. - הוסף 50 מיקרומטר CNO לתא ההקלטה מיד לאחר השלמת המדידה הבסיסית והמשך להקליט נתונים למשך 16 דקות נוספות תוך התבוננות בשינויים בתדר או במשרעת sEPSC.
- בצע הליך שטיפה על ידי החלפת תמיסת CNO ב-ACSF טרי כדי להסיר ביעילות CNO מתא ההקלטה. המשך לרשום נתונים להמשך הניסוי כדי להעריך כל התאוששות בפעילות הסינפטית.
תוצאות
איור 1 מציג את השלבים העיקריים של גישה מתודולוגית זו עבור תאי גזע אנושיים מתוכנתים מחדש המבטאים קולטני DREADD מעוררים (hM3Dq) או מעכבים (hM4Di) כדי להעריך את האינטגרציה התפקודית והאפנון של קודמנים דופמינרגיים נגזרים במודל עכבר של מחלת פרקינסון (PD). איור 2 מתאר את אסטרטגיית הדפיקה הגנטית בתיווך CRISPR/Cas9 להכנסת מבנים שאינם היתוך של hM4Di-T2A-ZsGreen ו-hM3Dq-T2A-ZsGreen לתאי גזע מתוכנתים מחדש ומאומתים על ידי גנוטיפ.
איור 3 מאפיין את ההשפעות התפקודיות והסינפטיות של אפנון כימוגנטי בתאים מושתלים. ערכנו הערכות התנהגותיות והקלטות אלקטרופיזיולוגיות כדי לנתח את ההשפעות של תאי DREADD המושתלים. איור 3A מציג את הניתוח הסטטיסטי של תוצאות תנועת הגפיים הקדמיות הנגדיות בבדיקת צילינדר על פני קבוצות ביקורת, hM4Di ו-hM3Dq בתנאי שטיפה מלוחים, CNO ו-postCNO. מתן CNO הפחית את מעורבות הגפיים הקדמיות הנגדיות בבעלי חיים מושתלים ב-hM4Di אך שיפר את הביצועים המוטוריים בקבוצת hM3Dq בהשוואה לביקורת מי מלח. איור 3B-D מציג ניתוח אלקטרופיזיולוגי של זרמים פוסט-סינפטיים מעוררים ספונטניים (sEPSCs). הקבוצה המושתלת ב-hM4Di הראתה מרווחים ממושכים בין אירועים וירידה באמפליטודות שיא, מה שמעיד על השתקה סינפטית, בעוד שתאים מושתלים ב-hM3Dq הראו מרווחים מקוצרים ואמפליטודות מוגברות, בהתאם להעברה עצבית מעוררת משופרת. איור 3E,F מאפיינים את התאים המושתלים in vivo על ידי אימונופלואורסצנטיות.

איור 1: בקרה כימוגנטית בתאי קודמן שמקורם בתאי גזע מתוכנתים מחדש לטיפול במחלות ניווניות במודל עכבר. דיאגרמת זרימה הממחישה את הגישה המתודולוגית לביסוס מודל עכברי פרקינסון והערכת תוצאות התנהגותיות באמצעות ויסות כימוגנטי בתאי קודמן שמקורם בתאי גזע שתוכנתו מחדש. שלב 1: בניית קווי תאי גזע DREADD ללא היתוך תוך שימוש בטכנולוגיית CRISPR. שלב 2: הקמת מודל עכברי פרקינסון, ואחריו השתלת תאי קודמן שמקורם בתאי גזע DREADD למוח. שלב 3: הערכת תוצאות התנהגותיות ואלקטרופיזיולוגיות כדי לאמת את האינטגרציה המוצלחת והאפנון התפקודי של התאים המושתלים. קיצורים: CRISPR = אשכול חוזר פלינדרומי קצר במרווחים קבועים; DREADD = קולטנים מעצבים המופעלים באופן בלעדי על ידי תרופות מעצבים; מחלת פרקינסון = מחלת פרקינסון; 6-OHDA = 6-הידרוקסידופמין; CNO = קלוזפין N-אוקסיד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הנדסה בתיווך CRISPR/Cas9 של תאי גזע המבטאים DREADD שאינם היתוך. (A) תרשים זרימה הממחיש את אסטרטגיית ה-knock-in של הגנים בתיווך CRISPR/Cas9 לשילוב מבנים hM4Di-T2A-ZsGreen או hM3Dq-T2A-ZsGreen שאינם היתוך בתאי גזע מתוכנתים מחדש. (B) הפלסמיד התורם של hM4Di-T2A-ZsGreen או hM3Dq-T2A-ZsGreen שאינו היתוך שונה באמצעות אסטרטגיית שיבוט רב-שלבית. ייצוג האלל הממוקד ממחיש את הפגיעה בגנים של hM4Di-T2A-ZsGreen או hM3Dq-T2A-ZsGreen בתאי גזע מתוכנתים מחדש. תמונות פלואורסצנטיות מאשרות שהתאים המהונדסים מציגים פלואורסצנטיות ירוקה הומוגנית, מה שמעיד על ביטוי טרנסגנים מוצלח. סרגל קנה מידה = 200 מיקרומטר. (C) תוצאות הגנוטיפ מאשרות את השילוב המוצלח של מבני DREADD בגנום של קווי תאי הגזע הממוקדים. נתון זה שונה מ-Wang et al.19. קיצורים: gRNA = RNA מדריך; FACS = מיון תאים המופעל על ידי פלואורסצנטיות; DREADD = קולטנים מעצבים המופעלים באופן בלעדי על ידי תרופות מעצבים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
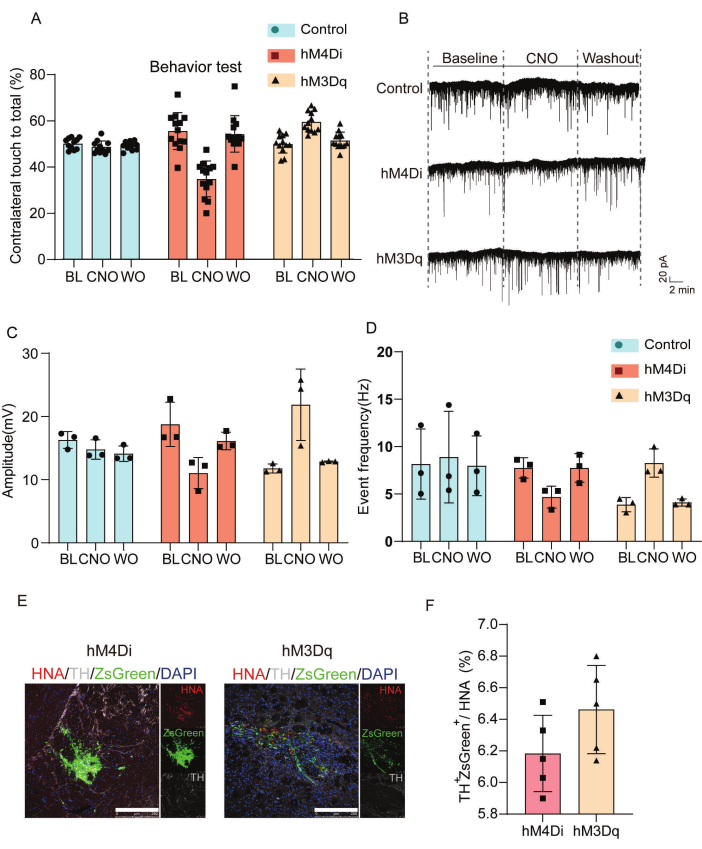
איור 3: הערכת תוצאות התנהגותיות ואלקטרופיזיולוגיות לאישור אינטגרציה ואפנון תפקודי של תאים מושתלים. (A) הערכת אפנון התנהגותי במודל עכבר PD לאחר מתן CNO; ניתוח סטטיסטי מפורט המשווה את תוצאות תנועת הגפיים הקדמיות הנגדיות במבחן הצילינדר בקרב קבוצות hM4Di, hM3Dq וקבוצת הביקורת בנקודת ההתחלה ו-8 שבועות לאחר ההשתלה, עם הערכות שנערכו לאחר טיפול במי מלח ו-CNO, כמו גם שטיפה לאחר CNO. (B) הקלטות מהדק טלאי של תאים שלמים שחושפות sEPSCs מהשתלים של קבוצות הביקורת, hM4Di או hM3Dq שנותחו בנקודת ההתחלה ובמהלך טיפול CNO (50 מיקרומטר), יחד עם שלבי שטיפה של CNO. (ג) ניתוח סטטיסטי של מדידות משרעת שיא עבור ה-sEPSCs על פני שטיפה בסיסית, CNO ו-CNO. (D) סטטיסטיקות תדירות אירועים של sEPSCs שנרשמו מהשתלים של קבוצות הביקורת, hM4Di ו-hM3Dq. (ה)אפיון תאים מושתלים in vivo באמצעות אימונופלואורסצנטיות. פסי קנה מידה = 250 מיקרומטר. (F) ניתוח כמותי של ביטוי של טירוזין הידרוקסילאז ו-ZsGreen בקבוצות hM4Di ו-hM3Dq, ביחס לביטוי אנטיגן גרעיני אנושי. נתון זה שונה מ-Wang et al.19. קיצורים: BL = קו בסיס; טיפול ב-CNO = קלוזפין N-אוקסיד (CNO, 50 מיקרומטר); WO = לשטוף CNO; מחלת פרקינסון = מחלת פרקינסון; sEPSCs = זרמים פוסט-סינפטיים מעוררים ספונטניים; TH = טירוזין הידרוקסילאז; HNA = אנטיגן גרעיני אנושי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה השתמש בטכנולוגיית CRISPR כדי להנדס תאי גזע אנושיים שתוכנתו מחדש כדי לבטא קולטני hM3Dq מעוררים ומעכבי hM4Di. אפנון הפעילות העצבית על ידי CNO הוערך באמצעות השתלת תאים במודלים עכבריים של מחלת פרקינסון, בליווי הערכות התנהגותיות ורישומים אלקטרופיזיולוגיים.
הצעד הקריטי הראשון ביצירת מבני DREADD המתבטאים ביציבות ולא היתוך בתאי גזע מתוכנתים מחדש כימוגנטית כרוך בקלטת הביסיסטרונית T2A-ZsGreen. עם זאת, פלסמידים המבטאים חלבון היתוך, כגון hM3Dq-mCherry ו-hM4Di-mCherry7, אינם יעילים עבור קו תאי גזע עצבי מושרה זה. כדי לעקוף זאת, הנדסנו פלסמיד תורם באמצעות מכלול גיבסון, כמפורט בשלבי פרוטוקול 1.1-1.2.
ביסוס מודל PD על ידי מתן חד צדדי של הזרקה סטריאוטקסית של 6-OHDA לקורפוס סטריאטום של עכברים חסרי חיסון הוא חיוני לאפנון מדויק in vivo. במהלך כל תקופת המחקר, כולל השתלת תאים וטיפולים תרופתיים, חלק מבעלי החיים עלולים לחוות תמותה בלתי צפויה. לכן, יש לתכנן בקפידה את גודל המדגם הראשוני כדי להבטיח מספרים מספיקים לקבוצות הניסוי15,17.
ניתן להשתמש במספר מבחנים התנהגותיים הקשורים לתפקוד מוטורי כדי להעריך את התגובות ההתנהגותיות של בעלי החיים לאפנון DREADD, כולל מבחן סיבוב המושרה על ידי אפומורפין, מבחן צילינדר ומבחן רוטרוד. כאן השתמשנו במבחן הצילינדר, המודד כמותית את המגע של הגפיים הקדמיות עם דפנות גליל20. על ידי הערכת שינויים בשימוש בגפיים העליונות הנובעים מנזק עצבי, בדיקת הצילינדר מספקת תובנות חשובות לגבי האופן שבו CNO עשוי לשפר את התפקוד המוטורי.
האינטגרציה התפקודית והקישוריות הסינפטית של תאי תורם מתוכנתים מחדש כימוגנטית בתוך מעגלים עצביים של המארח הם גורמים קריטיים ליעילות הטיפולית בהפרעות ניווניות כמו PD16. הקלטות מהדק טלאי של תאים שלמים שנערכו על פרוסות מוח לאחר ההשתלה מספקות תובנות לגבי האופן שבו תאים מהונדסים אלה מתקשרים עם מעגלים עצביים מקומיים. נוירונים קוצניים בינוניים (MSNs) בסטריאטום הם מטרות במורד הזרם של איתות דופמינרגי
באמצעות הקלטת MSNs של מהדק טלאי, אנו יכולים להעריך במדויק כיצד תאים שעברו שינוי DREADD משתלבים במעגלים עצביים ומשפיעים על תפקודם21. הרכב נוזל המוח המלאכותי (ACSF) עבור שלבים פרוצדורליים מובהקים הוא קריטי עבור מהדק התיקון. במהלך הכנת הפרוסה, מומלץ בחום נוזל מוחי מלאכותי על בסיס סוכרוז (s-ACSF). התכונות ההיפראוסמוטיות של סוכרוז מפחיתות נפיחות עצבית במהלך החיתוך תוך שמירה על שיפועים יוניים החיוניים לכדאיות התא. ייצור אלקטרודות ובקרת איכות מכתיבים ישירות את יציבות ההקלטה. פיפטות זכוכית בורוסיליקט הנמשכות להתנגדות קצה של 7-10 MΩ מייצגות תנאי מוקדם שאינו ניתן למשא ומתן להקלטות sEPSC מתמשכות. פיפטות תת-אופטימליות עם התנגדות מתחת ל-5 MΩ מציגות חילופי דיפוזיה מואצים בין תמיסת פיפטה לציטופלזמה, מה שמוביל לירידה מתקדמת בזרם תוך 3-5 דקות.
עם זאת, מחקר זה מדגים אפנון כימוגנטי של התנהגות מוטורית ופעילות סינפטית בעכברי פרקינסון באמצעות iNSC-DAP מהונדס, שחיקה פרוצדורלית משמעותית הקשורה להתערבויות סטריאוטקסיות כפולות ומתן CNO כרוני מדגיש את הצורך בפרדיגמות קסנו-השתלה מעודנות במודלים מדוכאי חיסון, במיוחד בכל הנוגע לסטנדרטיזציה כירורגית. אסטרטגיה זו המשלבת הנדסת קולטני DREADD בתיווך CRISPR/Cas9 עם חקירה ברמת המעגל באמצעות מבחנים התנהגותיים (מבחן צילינדר) ואלקטרופיזיולוגיה של תא שלם, מספקת תוכנית נוירומודולציה ספציפית לתת-סוג של נוירונים ומציעה ערכת כלים רב-תכליתית לקידום טיפולים תאיים מדויקים להפרעות ניווניות.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן למדעי הטבע של בייג'ינג (7242068), הקרן הלאומית למדעי הטבע של סין (82171250), קרן ועדת הבריאות העירונית של בייג'ינג (PXM2020_026283_000005) והפרויקט לפיתוח טכנולוגיה של מכוני מחקר רפואיים המסונפים לבייג'ינג (11000023T000002036310).
Materials
| Name | Company | Catalog Number | Comments |
| 2 x Rapid Taq Master Mix | Vazyme | P222-01 | used for genotyping analysis |
| 2×Seamless Cloning Mix | Biomed Gene Tech. | CL117-01 | used for plasmid construction |
| 6-OHDA | Sigma-Aldrich | H4381 | used for establishing PD mice model |
| AAVS1-Pur-CAG-EGFP | Addgene | 80945 | used as control |
| AAVS1-Pur-CAG-hM4Di-mCherry | Addgene | 80947 | original plasmid for construction of hM4Di-T2A-ZsGreen |
| AAVS1-Pur-CAG-hM3Dq-mCherry | Addgene | 80948 | original plasmid for construction of hM3Dq-T2A-ZsGreen |
| AAVS1-CAG-hM4Di-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80947 |
| AAVS1-CAG-hM3Dq-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80948 |
| Accutase | Invitrogen | A11105-01 | Used for digesting cells |
| AMAXA Nucleofector | Lonza | AAD-1001S | |
| Apomorphine | Sigma-Aldrich | A4393 | |
| Artificial cerebrospinal fluid (ACSF) | N/A | N/A | 125 mM NaCl, 2.5 mM KCl, 2 mM CaCl2, 1.25 mM NaH2PO4, 1 mM MgSO4, 25 mM glucose, and 26 mM NaHCO3 |
| Ascorbic acid | Sigma-Aldrich | 1043003 | |
| B-27 Supplement | Gibco | 17504044 | |
| BDNF | Peprotech | 450-02 | |
| cAMP | Sigma-Aldrich | D0627 | |
| CHIR99021 | Yeasen | 53003ES10 | |
| Clozapine-N-oxide | Enzo | BML-NS105 | |
| DAPT | Sigma-Aldrich | D5942 | |
| Desipramine | Sigma-Aldrich | D3900 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 11330-032 | |
| DMEM/F12 | Gibco | 11320-033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| FGF8 | Peprotech | 100-25 | |
| GDNF | Peprotech | 450-10 | |
| GlutaMax | Gibco | 35050-061 | |
| Hank’s Balanced Salt Solution (HBSS) | Gibco | 14175095 | |
| Human leukemia inhibitory factor (hrLIF) | Millipore | LIF1010 | |
| Iced intracellular fluid | N/A | N/A | 130 mM K-gluconate, 16 mM KCl, 0.2 mM EGTA, 2 mM MgCl2, 10 mM HEPES, 4 mM Na2-ATP, 0.4 mM Na3-GTP, 0.3% of neurobiotin |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| Laminin | Roche | 11243217001 | |
| Micropipette Puller | Sutter Instrument Company | P-1000 | |
| N-2 Supplement | Thermo Fisher | 17502048 | |
| Neurobasal-A Medium | Gibco | 10888-022 | |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | |
| PBS | Gibco | 10010023 | |
| pCLAMP 11 software suite | Molecular Devices | N/A | Patch-clamp electrophysiology data acquisition and analysis software |
| Phase 1 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, 1% GlutaMax, 1 µM SAG1, and 100 ng/mL FGF8 |
| Phase 2 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, and 1% GlutaMax, 10 ng/mL BDNF, 10 ng/mL GDNF, 1 ng/mL TGF-βIII, 10 µM DAPT, 0.2 mM ascorbic acid, and 0.5 mM cAMP. |
| Poly-D-lysine hydrobromide (PDL) | Sigma-Aldrich | P7886 | |
| Primers for genotyping | N/A | N/A | Insertion Foward: TCTTCACTCGCTGGGTTCCCTT; Insertion Reverse: CCTGTGGGAGGAAGAGAAGAGGT; Homozygosity Foward:CGTCTCCCTGGCTTTAGCCA; Homozygosity Reverse: GATCCTCTCTGGCTCCATCG |
| pX458 | Addgene | 152199 | |
| SAG1 | Enzo | ALX-270-426-M01 | |
| SB431542 | Yeasen | 53004ES50 | |
| sucrose-based artificial cerebrospinal fluid (s-ACSF) | 234 mM sucrose, 2.5 mM KCl, 26 mM NaHCO3, 1.25 mM NaH2PO4, 11 mM Dglucose, 0.5 mM CaCl2, and 10 mM MgSO4 | ||
| Stem cell culture media | N/A | N/A | 48% DMEM/F12 (Gibco, 11330-032) and 48% Neurobasal, with the addition of 1% B27, 1% N2, 1% NEAA, 1% GlutaMax, 10 ng/mL hrLIF, 2 µM SB431542, and 3 µM CHIR99021 |
| TGF-βIII | Peprotech | 100-36E | |
| Transplantation buffer | N/A | N/A | HBSS buffer with 5 g/L D-glucose, 100 ng/mL BDNF, 100 ng/mL GDNF, and 0.2 mM ascorbic Acid |
| Vibratome | Leica | VT1000 S | |
| Whole-cell patch-clamp | Molecular Devices | MultiClamp700B |
References
- Thiel, G. Designer receptors exclusively activated by designer drugs. Humana Press (2015).
- Roth, B. L. Dreadds for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Gomez, J. L. et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357 (6350), 503-507 (2017).
- Chehelgerdi, M. et al. Exploring the promising potential of induced pluripotent stem cells in cancer research and therapy. Mol Cancer. 22 (1), 189 (2023).
- Song, J., Patel, R. V., Sharif, M., Ashokan, A., Michaelides, M. Chemogenetics as a neuromodulatory approach to treating neuropsychiatric diseases and disorders. Mol Ther. 30 (3), 990-1005 (2022).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nat Rev Neurosci. 21 (2), 103-115 (2020).
- Dell'anno, M. T. et al. Remote control of induced dopaminergic neurons in Parkinsonian rats. J Clin Invest. 124 (7), 3215-3229 (2014).
- Chen, Y. et al. Chemical control of grafted human PSC-derived neurons in a mouse model of Parkinson's disease. Cell Stem Cell. 18 (6), 817-826 (2016).
- Bjorklund, A. Parmar, M. Dopamine cell therapy: From cell replacement to circuitry repair. J Parkinsons Dis. 11 (S2), S159-S165 (2021).
- Alcacer, C. et al. Chemogenetic stimulation of striatal projection neurons modulates responses to Parkinson's disease therapy. J Clin Invest. 127 (2), 720-734 (2017).
- Alexander, G. M. et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Stachniak, T. J., Ghosh, A., Sternson, S. M. Chemogenetic synaptic silencing of neural circuits localizes a hypothalamus midbrain pathway for feeding behavior. Neuron. 82 (4), 797-808 (2014).
- Kang, H. J., Minamimoto, T., Wess, J., Roth, B. L. Chemogenetics for cell-type-specific modulation of signalling and neuronal activity. Nat Rev Methods Primers. 3 (1), 93 (2023).
- Miyanishi, K. et al. Behavioral tests predicting striatal dopamine level in a rat hemi-Parkinson's disease model. Neurochem Int. 122, 38-46 (2019).
- Zheng, X. et al. Human IPSC-derived midbrain organoids functionally integrate into striatum circuits and restore motor function in a mouse model of Parkinson's disease. Theranostics. 13 (8), 2673-2692 (2023).
- Xiong, M. et al. Human stem cell-derived neurons repair circuits and restore neural function. Cell Stem Cell. 28 (1), 112-126.e116 (2021).
- Yuan, Y. et al. Dopaminergic precursors differentiated from human blood-derived induced neural stem cells improve symptoms of a mouse Parkinson's disease model. Theranostics. 8 (17), 4679 (2018).
- Zhu, M. et al. Preparation of acute spinal cord slices for whole-cell patch-clamp recording in substantia gelatinosa neurons. J Vis Exp. (143) (2019).
- Wang, X., Han, D., Zheng, T., Ma, J., Chen, Z. Modulation of human induced neural stem cell-derived dopaminergic neurons by DREADD reveals therapeutic effects on a mouse model of Parkinson's disease. Stem Cell Res Ther. 15 (1), 297 (2024).
- Iancu, R., Mohapel, P., Brundin, P., Paul, G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav Brain Res. 162 (1), 1-10 (2005).
- Surmeier, D. J. et al. The role of dopamine in modulating the structure and function of striatal circuits. Prog Brain Res. 183, 148-167 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved