Method Article
Localisation de cibles spécifiques à la fonction pour la stimulation magnétique transcrânienne en l’absence d’équipement de navigation
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article décrit comment localiser des cibles spécifiques à une fonction pour des interventions ou des traitements répétitifs de stimulation magnétique transcrânienne lorsque l’équipement de navigation n’est pas disponible.
Résumé
La stimulation magnétique transcrânienne répétitive (SMTr) est une technique non invasive qui module l’activité neuronale dans le cerveau. Des études ont montré que la SMTr peut réguler la plasticité neuronale, favoriser la réorganisation du réseau neuronal et a été largement appliquée aux troubles neuropsychiatriques tels que les accidents vasculaires cérébraux. Bien que certaines études suggèrent que la SMTr peut aider à la réadaptation post-AVC, son efficacité reste incertaine, peut-être en raison des limites de la localisation traditionnelle du point chaud de la motricité de la main.
Le point chaud moteur de la main est déterminé par les potentiels évoqués moteurs (MEP), qui reflètent la conductivité du tractus corticospinal ou pyramidal, représentant le mouvement non volontaire. En revanche, les points d’activation de l’imagerie par résonance magnétique fonctionnelle (IRMf) d’une tâche motrice définissent des cibles spécifiques à la fonction, qui impliquent à la fois la perception et l’exécution motrice, représentant le mouvement volontaire. Sur cette base, nous proposons le concept de cibles spécifiques à une fonction - des cibles identifiées par des techniques d’imagerie cérébrale visant des fonctions spécifiques. Les cibles spécifiques à la fonction présentent une connectivité fonctionnelle plus forte et plus étendue avec les régions du cerveau liées à la cognition motrice, offrant potentiellement des effets régulateurs plus efficaces que les points chauds.
Nous avons exploré et validé les effets modulateurs de cibles spécifiques à une fonction dans des études précédentes. Cependant, les institutions sans équipement de navigation ne sont pas en mesure d’utiliser ces cibles spécifiques à une fonction. Par conséquent, nous avons développé une méthode de localisation non navigée pour les cibles spécifiques à une fonction, spécialement conçue pour définir et localiser les cibles rTMS dans l’hémisphère ipsilatéral post-AVC, répondant ainsi aux défis rencontrés par les institutions manquant d’équipement de navigation lors de l’application d’une rTMS ciblée spécifique à une fonction.
Introduction
La stimulation magnétique transcrânienne répétitive (SMTr) est une technique de neuromodulation non invasive qui peut réguler l’activité cérébrale et a été largement utilisée dans le traitement des troubles neuropsychiatriques, tels que la réadaptation de la dysfonction motrice de la main chez les patients victimes d’un AVC. Certaines études ont montré que la SMTr a des effets thérapeutiques sur les séquelles post-AVC 1,2,3, mais son efficacité reste incertaine. L’une des principales raisons de cette incertitude est la difficulté d’identifier des cibles de stimulation précises. Les études TMS ciblant la fonction motrice s’appuient souvent sur le système d’électroencéphalogramme International 10-20 pour la localisation, en utilisant C3/C4 comme cibles de stimulation, ou elles utilisent des cibles individualisées, telles que le point chaud du moteur de la main. Cependant, ces méthodes ne peuvent pas déterminer avec précision les zones corticales affectées par la TMS. La SMTr ciblée guidée par l’imagerie par résonance magnétique fonctionnelle (IRMf) a été largement utilisée dans le traitement de la dépression.
Nos recherches antérieures ont également exploré son application dans le traitement du syndrome de Gilles de la Tourette en stimulant l’aire motrice supplémentaire4, mais elle n’a pas encore été appliquée à l’aire motrice primaire (M1). Pour la SMTr, M1 se distingue des autres régions du cerveau parce qu’elle contient le point chaud du moteur manuel. Les contractions musculaires induites par la TMS représentent des mouvements involontaires, reflétant une conduction descendante à travers les voies corticospinales ou pyramidales. En revanche, les voxels de pointe d’activation définis par l’IRMf pendant les tâches de tapotement des doigts sont plus fonctionnellement connectés aux régions du cerveau impliquées dans la cognition motrice, représentant des mouvements volontaires5. Par conséquent, lors du traitement des troubles du mouvement, l’utilisation de l'« activation » liée à la tâche définie par l’IRMf comme cibles spécifiques à la fonction peut conduire à de meilleurs résultats thérapeutiques 5,6. Dans nos travaux précédents, nous avons comparé les modèles d’activation cérébrale entre la tâche guidée par la vue et la tâche auto-initiée à l’aide de l’IRMf et déterminé que la tâche auto-initiée s’aligne plus étroitement avec les exigences de l’entraînement de réadaptation active6. Nous avons confirmé cette constatation en réanalysant un sous-ensemble de données de l’étude originale (figure 1).
Cibler avec précision des zones spécifiques des fonctions cérébrales nécessite des outils de navigation précis. Cependant, les systèmes actuels sont non seulement lourds à utiliser et limités en termes de fonctionnalités, mais les calibrateurs montés sur la tête ne parviennent souvent pas à rester stables pendant les procédures, sont sujets à se déplacer et sont coûteux - coûtant parfois jusqu’à un million de yuans chinois (CNY), soit environ 140 000 dollars américains (USD). Selon une enquête sur les habitudes d’utilisation parmi les institutions membres du Consortium de médecine de précision pour la thérapie de stimulation magnétique transcrânienne guidée par l’imagerie (PRECISE), ces inconvénients ont conduit à l’utilisation des technologies de navigation dans moins de 5 % de la recherche et de la pratique clinique de la TMS en Chine, malgré leurs avantages potentiels. Mais ce qui est encore plus important, c’est que ces systèmes se concentrent uniquement sur la « localisation » des sites de stimulation sans aborder la question critique de la « définition » de la cible, c’est-à-dire de la sélection de la zone la plus appropriée pour la stimulation. Compte tenu des coûts élevés, de la complexité opérationnelle et des exigences de temps, c’est pourquoi ces dispositifs n’ont pas encore été largement adoptés en clinique.
Pour relever le défi de l’utilisation de cibles spécifiques à une fonction sans dispositifs de navigation, nous avons exploré la méthode de la SMTr ciblée et non naviguée. À l’aide de l’IRMf, nous avons identifié des cibles spécifiques à une fonction dans le cortex moteur et les avons projetées sur la surface du cuir chevelu, ce qui a permis de définir et de localiser la ciblesans avoir besoin d’un équipement de navigation7. Bien que la SMTr non navigée ne fournisse pas de surveillance en temps réel tout au long du processus, elle résout les problèmes de précision de la localisation de la cible dans des conditions cliniques où les appareils de navigation ne sont pas disponibles. Cet article développe la raison d’être globale de l’étude et décrit le processus expérimental complet, en mettant l’accent sur la comparaison des effets de cibles spécifiques à la fonction sur la fonction cérébrale dans des conditions de navigation et de non-navigation. Pour vérifier la faisabilité d’une SMTr ciblée spécifique à la fonction, la présente étude n’a inclus que des personnes en bonne santé.
Protocole
Ce travail a été approuvé par le comité d’éthique de l’Université du sport de Chengdu, et tous les participants ont fourni un consentement éclairé écrit (Figure 2). Ce protocole décrit la SMTr ciblée spécifique à une fonction non navigée par rapport à une fonction naviguée.
1. Recrutement des participants
- Recruter 10 participants adultes droitiers en bonne santé (âgés de 22 à 29 ans, avec 5 femelles et 5 mâles ; âge moyen de 24 ± 2 ans). Exclure un participant en raison d’un mouvement de la tête supérieur à 2,5 mm en translation ou 2,5 ° en rotation. Enfin, incluez 9 participants dans l’analyse statistique.
- Critères d’inclusion
- Recrutez des participants âgés de 18 à 30 ans, qui sont droitiers, qui réussissent les dépistages de sécurité par IRM et TMS et qui n’ont pas d’antécédents d’épilepsie ou d’autres troubles neurologiques ou psychiatriques.
- Assurez-vous que les participants répondent à des critères supplémentaires tels qu’aucune contre-indication à l’IRM, aucun antécédent de lésion cérébrale ou de maladie cardiaque grave, et qu’ils ne prennent pas actuellement de médicaments antiépileptiques ou anticoagulants.
- Recrutez des participantes qui n’ont pas de troubles de la conscience, pas d’objets métalliques dans leur corps (tels que des stimulateurs cardiaques, des implants dentaires métalliques ou un dispositif intra-utérin), pas de claustrophobie sévère ou de grossesse, et dont la vision est normale ou corrigée à la normale.
- Critères d’inclusion
- Critères d’exclusion des données post-expérience
- Exclure les données des participants qui ne sont pas en mesure de terminer l’expérience ou dont le mouvement de la tête pendant l’IRMf dépasse 2,5 mm de translation ou 2,5° de rotation.
- Directives pour les participants à l’expérience
- Assurez-vous que tous les participants ont signé le formulaire de consentement éclairé, qui explique l’objectif de la recherche, les procédures expérimentales ainsi que les effets secondaires et les risques potentiels.
- Effectuer des contrôles de sécurité pour les participants.
- Expliquer les procédures expérimentales et les précautions à prendre pour assurer le bon déroulement de l’expérience.
- Conseillez aux participants d’éviter l’alcool, le café ou l’exercice vigoureux avant l’expérience.
- Rappelez aux participants de dormir suffisamment et d’éviter de se coucher tard.
2. Acquisition des données IRMf
REMARQUE : Tous les participants subissent une IRM au Centre d’imagerie cérébrale par résonance magnétique sur le campus de Qingshuihe de l’Université des sciences et technologies électroniques de Chine, à l’aide d’un scanner 3T GE MR750. Chaque session de balayage comprend une image structurelle pondérée en T1, une IRMf à l’état de repos de 8 minutes (RS-fMRI) et une IRMf de tâche de 4 minutes. Les participants reçoivent deux interventions de SMTr : une avec navigation et une sans, avec un intervalle de 1 semaine entre les séances pour éliminer les effets résiduels. Effectuer des examens IRM avant et après chaque intervention, soit un total de quatre examens.
REMARQUE : Contrebalancez la séquence des conditions de navigation et de non-navigation entre les participants.
- Procédures de balayage
- Avant d’entrer dans la salle d’IRM, mettez des bouchons d’oreille aux participants pour réduire le bruit et assurez-vous que tous les objets métalliques sont retirés.
- Expliquez les tâches que les participants doivent effectuer pendant l’analyse.
- Assurez-vous que les participants sont allongés sur le dos sur le lit de balayage, la tête solidement fixée à l’aide de coussinets en mousse pour minimiser les mouvements de la tête.
- Pendant l’IRMf, demandez aux participants de fermer les yeux, d’éviter de penser délibérément et de rester éveillés pour éviter de s’endormir.
- Exportez manuellement les images vers le lecteur réseau ou le périphérique de stockage externe désigné.
- Paramètres de balayage
- Utilisez les paramètres de balayage RS-fMRI suivants : temps de répétition (TR) = 2 000 ms, temps d’écho (TE) = 30 ms, angle de retournement (FA) = 90°, champ de vision (FOV) = 220 mm × 220 mm, matrice = 64 x 64, épaisseur/espace de la tranche = 3,4 mm/0 mm, avec 41 tranches au total, couvrant l’ensemble du cerveau, et 240 points temporels collectés.
- Utilisez les paramètres de balayage d’images structurelles pondérées T1 suivants : séquence SPRG (Spoiled Gradient Recall Echo), balayage sagittal TR/TE = 8,2 ms/2,98 ms, FA = 8°, FOV = 256 mm x 256 mm, matrice = 256 x 256, épaisseur/espace de la tranche = 1 mm/0 mm, avec 166 tranches couvrant l’ensemble du cerveau.
- Utilisez des paramètres de balayage task-fMRI identiques à ceux de l’IRMf RS, sauf que seuls 120 points de temps sont collectés.
- Détails de l’exécution des tâches
- Placez les participants avec leurs paumes vers le haut et tenant une boîte à boutons.
- Placez des serviettes entre la tête des participants et la bobine pour stabiliser leur tête et minimiser les mouvements.
- Conception de blocs, tâche auto-initiée (4 min) : Lorsqu’une image d’un « + » apparaît à l’écran, demandez aux participants de se reposer. Lorsqu’une image d’une horloge apparaît à l’écran, demandez au participant d’appuyer sur le bouton avec son pouce droit toutes les 2 s, en le chronométrant lui-même (figure supplémentaire S1).
3. Mesure du seuil du moteur de repos (RMT)
REMARQUE : Utilisez l’électromyographie de surface (EMG) pour enregistrer l’amplitude du potentiel évoqué moteur (MEP) du muscle abducteur droit du muscle droit (APB), à l’aide d’une bobine en huit de 70 mm fixée au stimulateur Magstim Super Rapid2 pour mesurer le RMT avec une stimulation à impulsion unique.
- Retirez tous les objets métalliques avant le test pour éviter les interférences et assurer la sécurité.
- Demandez aux participants de s’asseoir sur une chaise et de se détendre complètement.
- Appliquez un gommage exfoliant et de l’alcool à 75 % sur les mains des participants.
- Placez des électrodes de surface argent/chlorure d’argent (Ag/AgCl) sur le ventre musculaire.
- Positionnez l’électrode de référence sur l’articulation métacarpo-phalangienne, en veillant à ce que la distance entre les électrodes soit comprise entre 20 mm et 30 mm.
REMARQUE : Paramètres pertinents : Utilisez des électrodes d’un diamètre de 9 mm pour les mesures. Le signal EMG du muscle APB est amplifié 1 000 fois, filtré passe-bande entre 20 Hz et 2,5 kHz, puis numérisé via une interface micro-numérique à une fréquence d’échantillonnage de 5 kHz. Les données sont ensuite stockées sur un ordinateur et affichées sur un écran. - Chargez l’image structurelle T1 de l’individu. Placez la bobine sur la zone motrice primaire controlatérale, plus précisément au niveau du « genou moyen » du sillon central, également connu sous le nom de « bouton de la main », qui représente la zone de la main dans le cortex moteur primaire.
REMARQUE : Confirmez la relaxation musculaire à la fois visuellement et via la surveillance EMG. - Déplacez la bobine autour du « bouton à main » par incréments de 0,5 cm.
- Positionnez la poignée à un angle de 45° par rapport au plan médio-sagittal pour mesurer la MEP.
- Commencez à l’intensité de stimulation inférieure au seuil, en l’augmentant de 5 % de la production maximale du stimulus à chaque fois. Lorsque l’amplitude crête à crête du MEP dépasse 50 μV, diminuez progressivement l’intensité de la stimulation de 1 % de la puissance maximale.
- Enregistrer l’intensité minimale de stimulation qui évoque au moins cinq MEP supérieures ou égales à 50 μV dans 10 stimulations consécutives à impulsion unique en tant que RMT, cet emplacement étant identifié comme le point chaud. Si un point chaud ne peut pas être déterminé après six stimulations, déplacez la bobine à l’emplacement suivant.
4. SMTr ciblée individualisée et spécifique à la fonction
- Définissez l’objectif individualisé spécifique à la fonction.
- Après avoir ouvert le logiciel de prétraitement, cliquez sur DPARSF 5.4, puis sélectionnez DPARSF Advanced Edition pour prétraiter les données d’état de la tâche à l’aide des paramètres spécifiques indiqués dans le fichier supplémentaire 1. Effectuez des corrections de synchronisation de tranche et de mouvement de tête. Co-enregistrez les images fonctionnelles dans les images structurelles et appliquez un lissage spatial avec une largeur totale à mi-hauteur (FWHM) de 6 mm.
REMARQUE : Ajustez les paramètres spécifiques en fonction du modèle de machine ou de la tâche de numérisation. - Ouvrez SPM12 et cliquez sur Coregister Estimate. Pour l’image de référence, sélectionnez le fichier nommé « sub*crop_1.nii » dans le dossier T1Img. Pour l’image source, choisissez le fichier « mean*.nii » dans le dossier RealignParameter. Pour l’autre image, sélectionnez le fichier « ra*.nii » dans le dossier FunImgAR.
REMARQUE : Utilisez le fichier d’image fonctionnel généré après la correction de mouvement et la correction de synchronisation de tranche comme « Autre image ». D’autres fichiers peuvent être sélectionnés en fonction de l’objectif de la recherche. - Cliquez sur Segment | volumes et sélectionnez le fichier nommé « sub*crop_1.nii » dans le dossier T1Img. Pour Champs de déformation, sélectionnez Inverse + Avant, puis cliquez sur Exécuter. Répétez ce processus pour segmenter le fichier « sub*.nii » à partir du dossier T1Img.
REMARQUE : Segmentez « sub*crop_1.nii » pour calculer le point d’activation de chaque tâche. Segmentez « sub*.nii » pour transformer le masque d’espace standard en espace individuel. - Cliquez sur Smooth, sélectionnez les fichiers « ra*.nii » dans le dossier FunImgAR pour l’option Image to Smooth , et entrez 6 6 6 6 dans le champ FWHM .
- Effectuez une analyse de premier niveau pour obtenir des cartes d’activation individuelles et identifier le voxel maximal de l’activation comme cible de stimulation. Incluez les trois étapes suivantes :
- Créez un nouveau dossier nommé « indiv_act » et cliquez sur Spécifier le 1er niveau. Dans le champ Répertoire , sélectionnez le dossier « indiv_act », cliquez sur Unités pour la conception, choisissez Numérisations et entrez 2 pour l’intervalle entre les balayages. Dans la section Data & Design , sélectionnez les fichiers « sra*.nii » sous Numérisations ; dans la section Condition , définissez le nom sur ( nom personnalisé), entrez 0 30 60 90 pour le début et définissez les durées sur 15. Cliquez sur Plusieurs régresseurs et sélectionnez le fichier « rp_a*.txt » dans les RealignParameters.
REMARQUE : Remplissez les informations sur le début et la durée en fonction du plan d’expérience réel. - Estimation : Dans « Sélectionnez SPM.mat », choisissez le fichier « SPM.mat » dans le dossier « indiv_act » et générez la carte d’activation des tâches individuelles, « spmT_0001 ».
- Cliquez sur Résultats, sélectionnez le fichier « SPM.mat » dans le dossier « indiv_act », cochez t-contrast et cliquez sur Définir un nouveau contraste. Entrez un nom personnalisé dans le champ du nom, entrez 1 0 dans le champ de contraste , cliquez sur Soumettre | D’accord | C’est fait. Dans Appliquer le masquage, sélectionnez Aucun ; sous Réglage de la valeur p sur Contrôle, choisissez Aucun, avec une valeur de 0,001 ; Définissez la valeur du seuil & Extend sur 0.
- Créez un nouveau dossier nommé « indiv_act » et cliquez sur Spécifier le 1er niveau. Dans le champ Répertoire , sélectionnez le dossier « indiv_act », cliquez sur Unités pour la conception, choisissez Numérisations et entrez 2 pour l’intervalle entre les balayages. Dans la section Data & Design , sélectionnez les fichiers « sra*.nii » sous Numérisations ; dans la section Condition , définissez le nom sur ( nom personnalisé), entrez 0 30 60 90 pour le début et définissez les durées sur 15. Cliquez sur Plusieurs régresseurs et sélectionnez le fichier « rp_a*.txt » dans les RealignParameters.
- Cliquez sur Normaliser (Écrire) | Données. Dans Champs de déformation, sélectionnez le fichier « iy_Crop_1 » dans le dossier T1Img. Pour Image à écrire, choisissez le masque de région cérébrale M1. Entrez les tailles individuelles de la boîte englobante et du voxel.
REMARQUE : Entrez les tailles de cadre englobant et de voxel en fonction des caractéristiques spécifiques des données. - Cliquez sur Coregister (Reslice), puis sélectionnez-spmT_0001 dans le dossier « indiv_act » pour Image Defining Space. Pour Image à redécouper, choisissez le fichier « w*.nii » généré à l’étape 4.1.6.
- Calculer le pic d’activation de chaque tâche : dans MATLAB, exécutez le code positif de tri . Pour InputName1, sélectionnez le chemin du fichier « rw*.nii » généré à l’étape 4.1.7 ; pour InputName2, sélectionnez le chemin du fichier « spmT_0001 » dans le dossier « indiv_act » ; pour InputName3, sélectionnez le chemin d’accès au dossier de sortie. La première coordonnée X avec une valeur négative (l’hémisphère gauche) dans les résultats triés est le pic d’activation de la tâche individuelle ; Notez les coordonnées de ce point.
- Après avoir ouvert le logiciel de prétraitement, cliquez sur DPARSF 5.4, puis sélectionnez DPARSF Advanced Edition pour prétraiter les données d’état de la tâche à l’aide des paramètres spécifiques indiqués dans le fichier supplémentaire 1. Effectuez des corrections de synchronisation de tranche et de mouvement de tête. Co-enregistrez les images fonctionnelles dans les images structurelles et appliquez un lissage spatial avec une largeur totale à mi-hauteur (FWHM) de 6 mm.
- Localisez la cible spécifique à la fonction individualisée (naviguée).
- Déterminez l’intensité de sortie du stimulateur en fonction de la RMT du participant.
- Utilisez un système de neuronavigation à suivi optique stéréotaxique sans cadre, avec le participant assis confortablement et portant un calibrateur monté sur la tête.
- Cliquez sur l’option anatomique : Importez les images structurelles pondérées T1 du participant dans le système de navigation pour la modélisation de la tête.
- Cliquez sur l’option Reconstruction : Reconstruire l’habillage sur l’image.
- Cliquez sur l’option Points de repère : utilisez l’outil d’alignement de piste pour marquer quatre points de repère (la nasion, le bout du nez et les points préauriculaires des deux côtés) sur la tête.
- Cliquez sur l’option Cible : Identifiez et établissez la trajectoire cible dans la région du cerveau. Localisez la cible de stimulation sur les images individuelles du participant. Après le positionnement, déplacez la cible pour l’aligner avec le réticule. Localisation complète du TMS.
REMARQUE : Placez la bobine tangente au cuir chevelu et alignez le foyer de stimulation avec la cible.
- Localisez la cible spécifique à la fonction individualisée (non naviguée).
REMARQUE : Tout le code pour la localisation de la cible du cuir chevelu est fourni dans Dossier supplémentaire 2.- Utilisez SPM12 pour segmenter le modèle standard du cerveau de l’Institut neurologique de Montréal (INM) (mni_icbm152_t1_tal_nlin_asym_09c.nii, situé dans le dossier Modèles de DPABI) afin d’obtenir le masque standard pour cuir chevelu. Les étapes spécifiques sont les suivantes :
- Ouvrez SPM12, cliquez sur IRMf, puis sélectionnez Segment dans le menu contextuel. Dans l’interface des paramètres , cliquez sur le bouton Volumes , sélectionnez le fichier de modèle de cerveau standard (c’est-à-dire le modèle de cerveau MNI) à partir de l’option Volumes , puis cliquez sur Champs de déformation pour sélectionner Inverse + Avant.
- Tracez le contour des bords intérieur et extérieur du cuir chevelu standard : dans MATLAB, exécutez les bords du code. Dans la fenêtre contextuelle, sélectionnez l’image c5.nii , cliquez sur Terminé, et générez le fichier « c5_edges.nii ».
- Tracez le contour de l’image du bord le plus externe du cuir chevelu standard : dans MATLAB, exécutez le code outer_edge . Dans l’interface contextuelle, sélectionnez le fichier c5_edges.nii et cliquez sur Terminé pour générer le fichier « c5_outer_edge.nii », qui représente la limite du cuir chevelu dans l’espace standard.
- Utilisez SPM12 pour transformer le bord standard du cuir chevelu en espace individuel. Dans l’interface du menu , cliquez sur Normaliser (Écrire), puis, dans l’interface des paramètres , cliquez sur Données. Dans Champs de déformation, sélectionnez le fichier iy_sub*.nii dans le dossier T1Img. Choisissez c5_outer_edge.nii pour Images à écrire, puis saisissez la boîte englobante et les tailles de voxel individuelles.
- Convertir les coordonnées corticales en coordonnées du cuir chevelu : ouvrez le code TransCortex2Scalp dans MATLAB et exécutez la première ligne. Dans l’interface contextuelle, entrez les coordonnées du point d’activation de chaque tâche et sélectionnez le fichier wc5_outer_edge.nii . Enregistrez les coordonnées du cuir chevelu.
- Ouvrez DPABI_Viewer, cliquez sur Sous-couche et sélectionnez l’image structurelle T1 individuelle. Localisez et enregistrez les coordonnées des quatre points de repère : les pics auriculaires gauche et droit, la nasion et l’inion.
- Définir l’origine du cuir chevelu : ouvrez le code d’intersection dans MATLAB. Dans l’éditeur, entrez les coordonnées des quatre points de repère à leurs positions spécifiées. Exécutez le code pour calculer les coordonnées d’intersection de la ligne reliant les embouts de l’oreille gauche et de l’oreille droite avec la ligne reliant la nasion et l’inion, puis notez les coordonnées.
- Déplacez le point d’intersection le long de l’axe Z jusqu’au cuir chevelu : ouvrez le code d’origine dans MATLAB. Entrez les coordonnées du point d’intersection à la position Définir le point H dans l’éditeur. Exécutez le code, puis sélectionnez le fichier wc5_outer_edge.nii dans la fenêtre contextuelle pour obtenir les coordonnées d’origine du scalp O.
- Tracez une ligne reliant les deux embouts auriculaires pour définir l’axe des abscisses, et une ligne reliant la nasion et la protubérance occipitale externe pour définir l’axe des ordonnées. L’axe perpendiculaire aux deux définit l’axe Z. Le plan bidimensionnel formé par l’axe XY est le plan XY.
- Calculez la distance réelle entre l’origine du cuir chevelu O et chaque point : exécutez le code de distance , sélectionnez le fichier wc5_outer_edge dans l’interface contextuelle, et dans la fenêtre de commande , suivez les instructions pour saisir l’origine du cuir chevelu, la cible du cuir chevelu et les quatre points de repère.
REMARQUE : « Chaque point » fait référence aux quatre points de repère du scalp à l’étape 4.3.4 et à la cible du scalp. Ce code ne peut calculer la distance de l’arc qu’entre un point et un autre à la fois. Pour calculer la distance entre une paire de points différente, vous devez exécuter à nouveau le code. - Calculez l’angle entre la ligne reliant la cible du cuir chevelu et l’origine du cuir chevelu et l’axe X dans le plan XY : Ouvrez le code calculate_angle_X_axis et exécutez la première ligne. Dans la fenêtre de commande , entrez les coordonnées de l’origine du cuir chevelu et de la cible de stimulation comme demandé.
- À l’aide de la règle de visée (comme illustré à la figure 3), fixez la position correspondante de la règle souple en fonction de la distance et de l’angle calculés lors des étapes précédentes. Marquez le cuir chevelu avec un stylo lavable. Terminez la localisation de la cible de stimulation du cuir chevelu (Figure 4).
- Utilisez SPM12 pour segmenter le modèle standard du cerveau de l’Institut neurologique de Montréal (INM) (mni_icbm152_t1_tal_nlin_asym_09c.nii, situé dans le dossier Modèles de DPABI) afin d’obtenir le masque standard pour cuir chevelu. Les étapes spécifiques sont les suivantes :
- SMTr
- Sélectionnez le mode répétitif pour régler les paramètres de stimulation, notamment l’intensité de la stimulation, la fréquence (10 Hz), la durée (3 s), le nombre d’impulsions dans chaque train (30 impulsions), le temps d’attente (12 s), le nombre de trains (60 trains) et le nombre total d’impulsions délivrées par jour (1 800 impulsions).
- Enregistrez la séance et appuyez sur le bouton Exécuter pour lancer la stimulation.
REMARQUE : L’intensité de la stimulation est réglée en fonction du RMT du participant, qui dans cette étude est fixé à 100 % RMT. - Dans la demi-heure qui suit la fin de la stimulation, faites subir au participant une autre IRM, en utilisant la même séquence de balayage que celle utilisée avant la stimulation.
5. Détection de l’effet modulatoire de la SMTr (traitement et analyse des données IRM)
REMARQUE : Utilisez un logiciel de prétraitement pour effectuer le prétraitement des données RS-fMRI, qui comprend les étapes spécifiques suivantes :
- Supprimez les 10 premiers points temporels pour atteindre l’équilibre du signal et permettre aux participants de s’adapter au bruit du scanner.
- Corrigez le délai d’acquisition entre les tranches.
- Effectuez une correction des mouvements de la tête.
REMARQUE : Différentes limites de mouvement de la tête peuvent être définies en fonction des exigences spécifiques de l’étude. - Normalisez les images fonctionnelles dans l’espace MNI à l’aide du modèle EPI.
- Faites régresser les signaux intempestifs, y compris ceux provenant de la substance blanche, du liquide céphalo-rachidien et de six paramètres de mouvement de la tête.
- Supprimez les tendances linéaires.
- Appliquez un filtrage passe-bande (0,01-0,1 Hz).
- Effectuer un lissage spatial à l’aide d’un noyau gaussien avec un FWHM de 6 mm.
- Calculez les paramètres d’activité cérébrale après le prétraitement, y compris l’amplitude de la fluctuation basse fréquence (ALFF) et la connectivité fonctionnelle (FC). Calculer les différences dans les mesures de l’activité cérébrale locale (ALFF et FC) entre la SMTr pré-r et la SMTr post-r dans des conditions de navigation et de non-navigation, et effectuer des tests t appariés sur les cartes de différence (correction GRF, voxel p < 0,001, cluster p < 0,05).
Résultats
Les résultats du test t apparié et de l’ANOVA à deux facteurs ont indiqué qu’il n’y avait pas de différences significatives dans les changements de l’ALFF ou du FC avant et après la SMTr dans des conditions de navigation et de non-navigation (correction GRF, voxel p < 0,001, cluster p < 0,05). Aucune différence significative n’a été observée entre les conditions de navigation et les conditions de non-navigation. Ce résultat correspond à nos attentes, indiquant que notre méthode de non-navigation ne présente pas d’inconvénient significatif par rapport à la méthode de navigation. Pour éviter de faire des affirmations non étayées de l’absence de différences significatives, nous présentons ici les cartes du test t à un échantillon pour les deux conditions de rTMS (non corrigée, voxel p < 0,05) (Figure 5). Ces résultats ne survivent à aucun type d’ajustement de comparaison multiple, tel que la correction FDR ou GRF. Pour évaluer l’équivalence des changements de la fonction cérébrale induits par les méthodes non navigée et naviguée, une analyse de puissance a été effectuée à l’aide du d de Cohen. Les résultats ont indiqué que la valeur d de Cohen pour ALFF était de 0,22, tandis que la valeur d de Cohen pour FC était de 0,56.

Figure 1 : Résultats des tests t appariés. (A) Les différences entre la connectivité fonctionnelle basée sur l’activation et la connectivité basée sur le point d’accès APB (correction GRF, voxel unique p < 0,001, niveau de cluster p < 0,05). (B) Les différences d’activation cérébrale entre les tâches auto-initiées et les tâches de tapotement visuel chez 25 participants (correction FDR, q < 0,05). (C) Les différences entre la connectivité fonctionnelle basée sur l’activation d’état auto-initiée et guidée visuellement chez 35 participants (correction GRF, voxel unique p < 0,001, cluster p < 0,05). La figure 1A a été adaptée de Wang et al. (2020)5 ; Les figures 1B et C ont été préparées en extrayant un sous-ensemble différent de données de Wang et al. (2023)6. Abréviations : APB = Abductor Pollicis Brevis ; GRF = Champ aléatoire gaussien ; FDR = Taux de fausses découvertes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
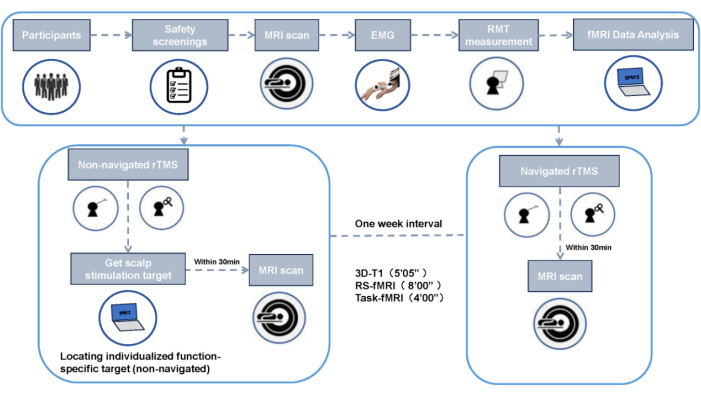
Figure 2 : Organigramme du plan expérimental. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Schéma de principe de la règle de ciblage. (A) Vue de face de la règle de ciblage. 1. Poignée ; 2. Point d’ancrage du cuir chevelu (c’est-à-dire l’origine du cuir chevelu dans le plan XY) ; 3. Règle de mesure rigide (matériau acrylique) ; 4. Règle de mesure rotative et flexible (matériau en silicone). (B) Vue agrandie du point d’ancrage du cuir chevelu (c’est-à-dire une vue agrandie de 2 en A). (C) Vue agrandie de la règle de mesure flexible (c’est-à-dire vues agrandies de 3 et 4 en A). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Conversion de la cible corticale spécifique à la fonction en cible du cuir chevelu spécifique à la fonction. Le point rouge représente la cible corticale spécifique à la fonction, le point vert représente la cible du cuir chevelu spécifique à la fonction et le point bleu indique l’origine du système de coordonnées 2D sur le cuir chevelu. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Résultats des tests t à un échantillon. (A) Effets modulateurs de la SMTr non navigée sur la fonction cérébrale (p < 0,05, non corrigé). (B) Effets modulateurs de la rTMS navigée sur la fonction cérébrale (p < 0,05, non corrigé). Abréviations : FC = connectivité fonctionnelle ; ALFF = amplitude de la fluctuation des basses fréquences ; rTMS = stimulation magnétique transcrânienne répétitive. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Paramètres utilisés dans DPARSF Advanced Edition, comme mentionné dans la section 4.1.1 du protocole. Veuillez cliquer ici pour télécharger ce fichier.
Supplemental File 2 : Le dossier zip contenant le code MATLAB utilisé dans cette étude. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire S1 : Tâche de tapotement des doigts auto-initiée. La tâche consistait en huit blocs, d’une durée de 30 s chacun, pour une durée totale de 4 min. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans cette étude, nous proposons le concept de cibles spécifiques à une fonction, qui sont des régions cérébrales associées à des fonctions spécifiques identifiées par des techniques de neuroimagerie. Inspirés par des études précédentes 8,9,10, nous avons développé une nouvelle boîte à outils 7,11,12 pour localiser les cibles du cuir chevelu correspondant à des zones corticales spécifiques à une fonction, permettant une rTMS ciblée spécifique à la fonction sans avoir besoin d’un équipement de navigation. Par rapport à la stimulation à l’aide d’un équipement de navigation, aucune différence significative n’a été observée dans les effets de la fonction cérébrale. Cela suggère que, dans certains cas, notre méthode peut réaliser une rTMS ciblée individualisée et spécifique à une fonction sans avoir besoin d’un équipement de navigation coûteux.
Étapes essentielles du protocole expérimental
Pour assurer l’exactitude de la localisation de la SMTr sans navigation, l’opérateur doit aligner l’échelle sur la règle de ciblage avec les points de repère des oreilles gauche et droite, la nasion et l’ion. La balance doit être fermement appuyée contre la surface du cuir chevelu pour minimiser les erreurs de mesure causées par l’épaisseur des cheveux. Ce processus est crucial pour améliorer la précision de la localisation et assurer un ciblage précis du site de stimulation.
Améliorations de la méthode expérimentale et problèmes techniques potentiels
Étant donné que cette méthode est une version avancée d’une technique précédemment développée11, aucun domaine d’amélioration n’a été identifié jusqu’à présent. En ce qui concerne les problèmes techniques potentiels, les différences individuelles dans la forme du crâne peuvent entraîner des protubérances occipitales moins proéminentes chez certains participants, ce qui pourrait entraîner des erreurs de localisation. Dans de tels cas, la protubérance occipitale peut être omise, et d’autres points de repère (tels que les marqueurs de l’oreille gauche et droite et la nasion) peuvent être utilisés pour la localisation sans compromettre la précision, car la redondance a déjà été prise en compte dans la phase de développement.
Limites de la méthode rTMS non navigée
La principale différence par rapport à la rTMS navigée est l’incapacité de surveiller la distance relative et la direction de la bobine par rapport à la cible de stimulation en temps réel. Cependant, même avec le rTMS navigué, la surveillance en temps réel nécessite toujours des opérateurs expérimentés pour effectuer des ajustements manuels.
Importance de la méthode expérimentale par rapport aux méthodes existantes
Par rapport aux équipements de navigation, notre méthode ne nécessite pas de positionnement long ou d’étalonnage de l’équipement. Au lieu de cela, les utilisateurs saisissent simplement les données IRM dans le script de code, puis calculent les distances correspondantes à l’aide d’un code, après quoi le positionnement est rapidement effectué à l’aide d’un outil de mesure. D’après notre expérience, cette méthode permet de gagner au moins 15 minutes par rapport aux procédures complexes qu’implique la navigation. L’équipement de navigation nécessite généralement du matériel coûteux et une formation spécialisée, tandis que notre méthode ne nécessite que des images IRM et des calculs standard pour obtenir une localisation rapide, pratique et précise, réduisant considérablement les coûts initiaux et la complexité opérationnelle.
En termes de coût, notre outil de mesure a obtenu un brevet d’invention (ZL202411874788.9)12., ce qui permet de protéger la propriété intellectuelle mais n’augmente pas significativement les coûts de production. La modélisation 3D est actuellement en cours, et nous serons bientôt en mesure d’imprimer l’outil en 3D pour nos collaborateurs cliniques. Les considérations de coût ont été intégrées dès le départ dans la phase de conception. Pour les non-collaborateurs souhaitant acheter l’outil, le prix n’est que de 500 CNY (environ 70 USD), ce qui reste abordable malgré la protection par brevet.
Importance et applications potentielles de la méthode dans des domaines de recherche spécifiques
Ces dernières années, l’intervention et le traitement de la SMTr ont gagné en popularité dans la recherche et les domaines cliniques. Comme toutes les techniques thérapeutiques, le développement s’oriente vers des traitements précis et individualisés ciblant des fonctions spécifiques. Cependant, les systèmes et les équipements de navigation sont coûteux et la plupart des hôpitaux en Chine n’ont actuellement pas accès à de tels appareils. Cette méthode aborde la question de la SMTr ciblée individualisée et spécifique à la fonction, sans qu’il soit nécessaire de naviguer. Il projette les coordonnées corticales de la cible sur le cuir chevelu et utilise un outil pour marquer les coordonnées à la surface du cuir chevelu. La méthode de ciblage cortical basée sur l’IRMf utilisée dans cette approche est identique aux coordonnées de la cible IRMf utilisées par les systèmes et équipements de navigation à l’échelle internationale. Bien qu’il ne puisse pas surveiller la distance et la direction relatives en temps réel entre la bobine et la cible de stimulation, il offre tout de même des avantages par rapport aux méthodes cliniques actuelles de « ciblage aveugle » (telles que l’utilisation de repères anatomiques à la surface de la peau ou la sélection du point chaud du moteur de la main). Cette méthode sert d’approche transitoire entre la navigation précise en temps réel et le « ciblage aveugle ». Pour les établissements cliniques sans systèmes et équipements de navigation, il peut résoudre des problèmes cliniques pratiques. Cette méthode favorisera considérablement le traitement de précision de la SMT guidée par IRMf, conduisant à la découverte de cibles de stimulation plus efficaces et à l’amélioration de l’efficacité des traitements pour divers troubles neurologiques et psychiatriques.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Cette étude a été soutenue par le Programme de soutien à la science et à la technologie de la province du Sichuan (n° 2024ZYD0189). Les auteurs tiennent à remercier le Consortium de médecine PREcision pour le transfert de stimulation magnétique transcrânienne guidée par imagerie (PRECISE) pour ses conseils professionnels.
matériels
| Name | Company | Catalog Number | Comments |
| Brainsight Neuronavigation system | Rogue Research Inc. | KITBSF0104 | |
| DPABI_V7.0 toolkit | DeepBrain | for RS-fMRI and task-based fMRI data analysis | |
| Magstim Rapid2 | The MAGSTIM Company Limited | 3012-00 | |
| SPM12 (7771) | Wellcome Centre for Human Neuroimaging | for RS-fMRI and task-based fMRI data analysis | |
| The Brainsight 2 channel electromyography acquisition device | Rogue Research Inc. | NTBX001001 |
Références
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon