Method Article
Techniques de patch-clamp pour l’analyse d’une vésicule endolysosomale unique
Dans cet article
Résumé
Ce protocole détaille une méthode permettant de mesurer directement l’activité des canaux ioniques sur les vésicules intracellulaires à l’aide d’un système manuel de patch-clamp endolysosomal. Nous illustrons la méthode qui consiste à agrandir les endolysosomes et à isoler manuellement ces vésicules. Cette approche permet aux chercheurs de reproduire et d’appliquer avec précision la procédure.
Résumé
Les canaux ioniques endolysosomales sont essentiels à l’homéostasie des ions endolysosomales et du pH, à la régulation du potentiel membranaire et au trafic vésiculaire. Cependant, l’accès électrophysiologique à ces canaux dans de petites vésicules intracellulaires a été un défi. Le développement de techniques de patch-clamp endolysosomal a permis de surmonter cet obstacle, permettant de mesurer directement l’activité des canaux ioniques dans les membranes endolysosomales.
Par rapport aux techniques de patch-clamp planaire existantes, le patch-clamp endolysosomal peut enregistrer simultanément plusieurs cellules et se combiner facilement avec d’autres méthodes de mesure. Le fonctionnement manuel offre l’avantage de visualiser des vésicules ciblées. Il aborde également la limitation de la présence indispensable de Ca2+ d’un côté de la membrane endolysosomale, augmentant ainsi la flexibilité de la conception expérimentale. L’utilisation de techniques de patch-clamp endolysosomal permet de mesurer et d’analyser directement l’activité des canaux ioniques dans les endolysosomes.
Étant donné le lien étroit entre la fonction aberrante des canaux ioniques endolysosomales et des maladies telles que les maladies neurodégénératives et les troubles métaboliques, l’étude et la modulation de ces canaux pourraient révéler de nouvelles cibles médicamenteuses. En rétablissant l’équilibre ionique intracellulaire, nous pouvons soulager ou guérir les maladies associées. Par conséquent, cette technique est essentielle pour découvrir de nouvelles cibles médicamenteuses et développer des médicaments pertinents.
Introduction
Les canaux ioniques jouent un rôle crucial dans de nombreux processus physiologiques. Alors que les canaux ioniques de surface ont fait l’objet d’une attention considérable, l’importance des canaux intracellulaires, en particulier ceux à l’intérieur des endolysosomes, est progressivement reconnue. Le système endolysosomal est composé d’organites multifonctionnels liés à une membrane spécialisés dans les fonctions cellulaires fondamentales, notamment les endosomes de recyclage (RE), les endosomes précoces (EE), les endosomes tardifs (LE), les lysosomes (LY) et les organites hybrides avec à la fois des caractéristiques endolysosomales et d’autres caractéristiques de compartiment, tels que les phagosomes et les autophagosomes.
L’EE, également connue sous le nom d’endosomes de tri (SE), est l’une des premières destinations des matériaux internalisés à partir de la membrane plasmique (PM). Les EE sont des compartiments critiques responsables du tri de la cargaison dans diverses voies endocytaires, telles que la voie de maturation vers l’EL/LY pour la dégradation, la voie de recyclage rapide vers le PM et la voie de recyclage lente impliquant le compartiment de recyclage ou l’ER périphérique. Les corps multivésiculaires (MVB) dérivés des endosomes sont des compartiments sphériques entourés d’une membrane limitante, qui peuvent être remplis de vésicules intraluminales (ILV)1. Pour maintenir le fonctionnement normal de ces organites, ils ont besoin de canaux ioniques membranaires pour réguler le pH vésiculaire, l’osmolarité et la transduction du signal. Cependant, il n’est pas simple de mesurer l’activité de ces canaux.
Pour les canaux ioniques situés sur la membrane plasmique, la technique du patch-clamp développée dans les années 1970 a longtemps été la méthode de référence2. Cependant, l’accès électrophysiologique aux canaux à l’intérieur de petites vésicules intracellulaires est resté un défi. L’application de l’étalon-or pour la mesure des canaux ioniques sur la membrane plasmique à celle des organites intracellulaires est confrontée à trois défis principaux. Tout d’abord, la taille des endolysosomes est généralement très petite (moins de 1 m de diamètre), ce qui les rend difficiles à observer et à isoler au microscope et plus petite que le diamètre d’ouverture des micropipettes en verre typiques, ce qui rend l’expérience inopérante. Deuxièmement, isoler les endolysosomes directement des cellules cibles tout en maintenant l’intégrité des organites nécessite des compétences particulières. Troisièmement, en raison de l’absence de cytosquelette dans les organites intracellulaires, il peut être difficile de former un joint sur la membrane endolysosomale à l’intérieur de la pipette patch, puis de la rompre pour obtenir une configuration endolysosomique entière, car elle compromet l’intégrité structurelle de l’organite3.
Plusieurs méthodes ont été développées pour surmonter ces problèmes, notamment l’enregistrement des bicouches lipidiques, la modification des séquences de ciblage lysosomale et les techniques d’électrophysiologie membranaire à support solide (SSM ou SSME). La méthode d’enregistrement des bicouches lipidiques consiste à reconstruire des membranes phospholipidiques synthétiques avec des canaux ioniques purifiés, ce qui permet une étude électrophysiologique détaillée de la fonction des protéines membranaires dans des conditions contrôlées 4,5. La modification des séquences de ciblage lysosomale sur les canaux ioniques implique la redirection des canaux ioniques endolysosomales vers la membrane plasmique pour la mesure à l’aide des méthodes conventionnelles de patch-clamp6. Les techniques d’électrophysiologie membranaire à support solide (SSM ou SSME), également connues sous le nom de méthode endolysosomale planaire patch-clamp, utilisent des copeaux de verre planaire à substrat solide avec de petites ouvertures (<1 μm de diamètre) dans des copeaux de borosilicate planaires microstructurés. Ces éclats de verre à petite ouverture permettent d’analyser de petits endolysosomes, même natifs, à l’aide d’un système de contrôle de pression-aspiration (Nanion). Cependant, dans les deux premières méthodes, les canaux ioniques ne sont pas dans leur environnement physiologique naturel. Les tentatives d’enregistrement des canaux lysosomales exprimés sur la membrane plasmique ou reconstitués en bicouches lipidiques ont largement donné des résultats incertains et contradictoires.
Bien que les techniques de patch-clamp planaire aient permis de résoudre efficacement la problématique des interférences artificielles et offrent l’avantage de mesures à haut débit, les solutions utilisées sont également limitées par cette méthode. La technique du patch-clamp endolysosomal présentée dans cet article permet d’enregistrer simultanément plusieurs cellules et de se combiner facilement avec d’autres méthodes de mesure. Le fonctionnement manuel offre l’avantage de visualiser les vésicules cibles. Il permet également de surmonter la limitation inévitable du Ca2+ dans la solution d’un côté de la membrane endolysosomale, augmentant ainsi la liberté de conception expérimentale3. Récemment, les techniques de patch-clamp endolysosomal ont joué un rôle clé dans la recherche sur le développement de médicaments. Par exemple, dans les maladies neurodégénératives, cette technique a permis d’identifier de nouveaux médicaments ciblant les canaux ioniques endolysosomaux associés aux maladies d’Alzheimer et de Parkinson 7,8. Les chercheurs peuvent également utiliser cette technique pour explorer le rôle des canaux ioniques endolysosomales dans les cellules tumorales9, contrôlant ainsi la croissance et la prolifération tumorales. En ce qui concerne les maladies métaboliques, des études endolysosomales par patch-clamp révèlent des composés qui régulent les canaux ioniques endolysosomaux, offrant de nouvelles approches de traitement du diabète et de l’obésité. La technique du patch-clamp endolysosomal aide à comprendre le dysfonctionnement endolysosomal et à trouver des thérapies potentielles6, améliorant considérablement notre compréhension des fonctions des canaux ioniques endolysosomales et favorisant la découverte de nouvelles cibles médicamenteuses.
Protocole
1. Configuration de l’instrument
- Matériel
REMARQUE : Voir la figure 1 pour une configuration standard de l’appareil d’électrophysiologie.- Protégez l’installation des interférences externes à l’aide d’une table et d’une cage de Faraday.
- Utilisez un microscope inversé avec un micromanipulateur pour positionner la microélectrode de manière stable.
- Installez un amplificateur pour collecter et amplifier les signaux acquis.
- Utilisez un numériseur pour convertir les signaux analogiques en signaux numériques.
- Utilisez un logiciel d’acquisition et d’analyse de données pour mettre en place des protocoles expérimentaux et extraire des résultats significatifs et analysables des données recueillies.
- Électrodes
- Utilisez deux électrodes : une électrode de bain et une électrode de pipette.
REMARQUE : Le platine et le chlorure d’argent ont les meilleures propriétés de polarisation. Les électrodes de chlorure d’argent sont constituées de fils ou de pastilles d’argent qui ont été chlorés, ayant ainsi une couche d’AgCl sur la surface externe du fil ou de la pastille (Figure 2).
- Utilisez deux électrodes : une électrode de bain et une électrode de pipette.
- Préparation des pipettes
- Tirage
- Installez le tube capillaire dans l’extracteur.
REMARQUE : Les paramètres utilisés ci-dessous pour la fabrication des pipettes sont spécifiques à l’instrument. L’instrument que nous avons utilisé dans cet article est mentionné dans la Table des matériaux. - Dans des conditions expérimentales (température ambiante de 22 °C, filament chauffant en forme traversante, verre borosilicaté avec filament) qui ne brûlent pas le filament chauffant, exécutez un test RAMP sur l’extracteur pour déterminer la valeur calorifique (HEAT) nécessaire pour faire fondre le capillaire en verre.
- Concevez un nouveau programme de traction avec six cycles de traction distincts à l’aide des paramètres HEAT, vitesse (VEL) et temps (TIME) (Tableau 1).
REMARQUE : HEAT fait référence au paramètre qui chauffe le filament de l’appareil de chauffage, permettant au filament de verre de fondre. La vitesse indique la vitesse à laquelle l’extracteur tire le filament dans les deux sens. Le temps représente la durée de l’intervalle entre chaque cycle. - Appuyez sur le bouton vert Pull du clavier.
- Desserrez le bouton de serrage et retirez les pipettes de l’extracteur.
- Inspectez les pointes de pipette sous l’oculaire de la microforge pour déterminer le diamètre, la netteté et la géométrie de la pointe. Assurez-vous que le diamètre de la pointe est de 0,5 à 0,9 μm.
REMARQUE : Comme le filament est utilisé plus fréquemment, la valeur thermique nécessaire pour faire fondre le capillaire en verre changera. - Si la taille de l’embout ne répond pas aux attentes, ajustez les paramètres HEAT et VEL. Des températures plus élevées et des vitesses plus rapides produiront des pointes plus fines et plus longues, et vice versa. Ajustez la CHALEUR par incréments de 5 degrés et la vitesse par incréments de 3.
- Installez le tube capillaire dans l’extracteur.
- Polissage
- Placez les pipettes à patch tirées dans le support de microforge.
- Inspectez les pointes de pipette à l’aide d’un objectif 35x (combiné à un oculaire 15x, ce qui permet d’obtenir un grossissement de 525x ).
- Utilisez le micromanipulateur pour rapprocher les pipettes patch du filament.
- Réglez le cadran de température sur 80.
- Utilisez la pédale pour allumer le chauffage et appliquer une brève impulsion de chaleur (1 à 2 s), en surveillant le processus de polissage à travers l’oculaire à microforge.
- Répétez le processus jusqu’à ce que toutes les pipettes soient polies.
- Placez les pipettes terminées dans une boîte scellée pour empêcher la poussière de pénétrer.
REMARQUE : L’objectif est de faire fondre rapidement la pointe afin que le verre reforme la géométrie finale de la pointe sans la rendre trop tranchante. Cela empêche la pipette de pénétrer dans la membrane vésiculaire contre laquelle elle est pressée et favorise efficacement la formation d’un joint. Après le polissage final, le chemin intérieur de la pointe de la pipette doit être très étroit, droit et linéaire.
Les meilleures pipettes d’enregistrement ont généralement une résistance de 5 à 8 MΩ après polissage au feu. Le diamètre de l’ouverture de la pointe doit être de 2 μm. Une pipette patch parfaitement polie est essentielle pour une formation réussie du gigaseal, car il s’agit de l’une des techniques clés cruciales pour le succès de la procédure.
- Tirage
2. Préparation de l’échantillon
- Culture cellulaire (en utilisant HEK293 comme exemple)
- Cultivez les cellules dans un incubateur humidifié standard à 37 °C avec 5 % de CO2.
- Cultivez les cellules HEK293 dans du DMEM à faible teneur en glucose complété par du sérum de veau fœtal inactivé à 10 % (FBS), de la pénicilline à 100 U/mL et de la streptomycine à 100 mg/mL.
- Placez des lamelles de 12 mm recouvertes de poly-L-lysine dans une plaque à 24 puits.
- Élargissement des organites
- Ajoutez 1 μM de vacuoline-1 aux cellules HEK293 dans la plaque à 24 puits (à partir de l’étape 2.1) et incubez à 37 °C avec 5 % de CO2 pendant la nuit jusqu’à ce que des vésicules élargies commencent à se former.
REMARQUE : La taille des endolysosomes hypertrophiés peut atteindre 1 à 10 μm, selon l’outil, le composé, le temps d’incubation et le type de cellule (figure 3 et tableau 2).
- Ajoutez 1 μM de vacuoline-1 aux cellules HEK293 dans la plaque à 24 puits (à partir de l’étape 2.1) et incubez à 37 °C avec 5 % de CO2 pendant la nuit jusqu’à ce que des vésicules élargies commencent à se former.
- Préparation de la solution
REMARQUE : La préparation de la solution standard vise à simuler les concentrations ioniques à l’intérieur de la cellule et des organites. Par exemple, les solutions standard pour mesurer les canaux ioniques sur les lysosomes sont les suivantes :- Préparer la solution pour le bain (en mM) : 140 K-méthanesulfonate (MSA), 5 KOH, 4 NaCl, 0,39 CaCl2, 1 EGTA, 10 HEPES. Ajustez le pH à 7,2 avec du KOH. Ajustez l’osmolarité à 300 mosm/L avec du glucose.
- Préparer la solution de pipette (en mM) : 140 Na-MSA, 5 K-MSA, 2 Ca-MSA, 1 CaCl2, 10 HEPES, 10 MES. Ajustez le pH à 4,6 avec MSA. Ajustez l’osmolarité à 310 mosm/L avec du glucose.
REMARQUE : Passez la solution à travers un filtre de 0,2 μm, préparez des aliquotes de 45 mL dans des tubes coniques de 50 mL et conservez-les à 4 °C jusqu’à 2 à 4 semaines.
3. Isolement des organites
- Retirer une lamelle avec des cellules traitées (voir rubrique 2) de la plaque à 24 puits, la transférer dans la chambre du microscope et ajouter 1 mL de solution de bain.
REMARQUE : Les cellules ne doivent pas être stockées dans la solution du bain pendant >1 h pour les expériences de patch-clamp endolysosomal entier qui impliquent l’isolement, le scellement et l’enregistrement de l’endolysosome. Après 1 h, les endolysosomes hypertrophiés rétrécissent, adhèrent à la pipette et deviennent difficiles à isoler. - Utilisez une aiguille de remplissage en plastique faite maison pour remplir la pipette d’isolement avec la solution de pipette et installez la pipette à l’extrémité avant de la configuration patch-clamp.
- Réglez l’angle de mouvement diagonal du micromanipulateur pour qu’il soit proche de 30° (valeur d’usine par défaut).
- Au microscope (objectif 40x et oculaire 10x), examinez les cellules à la recherche d’endosomes suffisamment agrandis ou de lysosomes situés près du bord de la membrane cellulaire pour l’isolement. Déplacez la pipette d’isolement à proximité de la cellule sélectionnée.
- Abaissez la pipette d’isolement à l’aide du micromanipulateur jusqu’à ce qu’elle touche le bord de la membrane plasmique (Figure 4). Déplacez rapidement la pipette d’isolement horizontalement pour arracher un petit morceau de la membrane plasmique.
- À l’aide de la même pipette, appuyez sur la cellule du côté opposé pour extraire l’endosome/les lysosomes à une distance de ~2 μm de la cellule.
REMARQUE : S’il y a une membrane cellulaire résiduelle sur l’organite, cela peut empêcher la formation d’un gigaseal. - Examinez l’endolysosome isolé au microscope.
4. Formation gigasseal
- Remplissez une pipette patch fraîchement polie avec la solution de pipette appropriée et installez la pipette à l’extrémité avant de l’amplificateur.
- Appliquez une pression positive de 20 à 50 mbar sur la pipette (ou utilisez 0,03 à 0,05 mL d’une seringue de 1 mL pour le contrôle de la pression) et maintenez cette pression (verrouillez la valve).
REMARQUE : 1 mbar (millibar) = 0,001 bar = 0,1 kPa (kilopascal) = 1 hPa (hectopascal) = 1 000 dyn/cm2. - En déplaçant la pointe de la pipette dans la solution du bain, au centre du champ de vision, confirmez que la pression est suffisamment élevée pour voir le liquide s’écouler dans la solution du bain.
- Appliquez des impulsions de courant répétées (+5 mV ; 5 ms) pour déterminer la résistance de la pipette, la résistance d’étanchéité et la résistance série. Surveiller la taille de la pointe de la pipette, la formation du joint et l’établissement de la configuration endolysosomale entière.
- Déplacez rapidement la pipette près du haut de la vésicule cible. Approchez la pipette de la vésicule jusqu’à ce que celle-ci se déplace ou roule en raison de l’écoulement du fluide de la pipette (Figure 5).
- Réglez la tension de décalage de la pipette à 0 mV. Relâchez immédiatement la pression positive. Idéalement, la vésicule sera attirée vers la pipette et se connectera à la membrane, formant un gigaseal (1-20 GΩ) en 1 s.Recherchez une diminution à <10 pA de l’amplitude du courant évoquée par l’impulsion de tension de 5 mV, ce qui indique une formation réussie de gigaseal.
REMARQUE : Une pression positive stable est essentielle pour la formation de gigaseal. Parfois, des fuites dans le tube peuvent empêcher la formation de gigaseal. Il est recommandé d’utiliser un manomètre pour s’assurer qu’il n’y a pas de fuites. Si une fuite est détectée, rattachez le tube ou appliquez une petite quantité de vaseline sur les coutures pour améliorer l’étanchéité.
5. Mesure du courant
- Bris de membrane
REMARQUE : Selon les besoins expérimentaux, le contact électrode-membrane peut être classé en quatre modes : mode attaché à la cellule, mode cellule entière, mode intérieur-extérieur et mode extérieur-extérieur (Figure 6).- Pour l’enregistrement de la vésicule entière, utilisez une impulsion courte à haute tension (impulsion ZAP) de 200 μs ou 500 μs pour briser la membrane au point de contact entre la pipette et l’organite. Réglez la tension de -500 mV à -1 200 mV, en diminuant de 100 mV à chaque fois jusqu’à ce que la membrane soit rompue.
- Pour le mode intérieur-extérieur (enregistrement monocanal), après avoir formé le gigaseal, retirez la pipette de l’organite, en arrachant un petit morceau de la membrane, exposant le côté qui faisait à l’origine face à la lumière de la vésicule.
- Pour le mode extérieur-extérieur, après avoir formé le gigaseal et être passé au mode vésicule entier, retirez la pipette de l’organite, en arrachant un petit morceau de la membrane tout en conservant une petite structure vésiculaire.
- Enregistrement en cours
- Enregistrez le courant à travers la membrane endolysosomale lorsque la tension d’entrée varie dans les expériences endolysosomales.
- Contrôler ces tensions par paliers de tension ou rampes de tension ; utiliser une large gamme de tensions d’entrée (par exemple, -100 mV à +100 mV) dans des expériences de pince de tension endolysosomale.
- Enregistrez le courant à travers la membrane endolysosomale lorsque la tension d’entrée varie dans les expériences endolysosomales.
Résultats
Ce qui suit décrit les formes actuelles observées lors d’expériences de patch-clamp endolysosomale. Si la forme actuelle n’est pas celle attendue, cela peut être dû à un mauvais contact ou à une fuite. Un mauvais contact peut se produire si l’électrode de référence n’est pas complètement en contact avec la solution du bain ou si l’électrode de la pipette est sur le point de se rompre. Une fuite peut se produire s’il y a un espace entre la chambre et la lamelle permettant au fluide de s’écouler sur la lentille de l’objectif ou la platine ; Avoir trop ou trop peu de solution de pipette pourrait également entraîner de telles anomalies.
Insertion de l’aiguille dans la solution/contact de l’aiguille avec la surface de la cellule/ZAP
Lors de l’établissement du mode attaché au lysosome (formation de gigaseal), la réponse actuelle diminue rapidement. La résistance d’étanchéité peut être déterminée en divisant la tension de commande par la faible quantité de courant restant (Figure 7).
Rampe/fuite
L’application répétée d’une tension d’entrée continue allant de -100 mV à +100 mV peut enregistrer le courant à travers la membrane endolysosomale au fil du temps (Figure 8). En utilisant des solutions standard, la composition ionique à l’intérieur et à l’extérieur de l’organite diffère. Si le canal présente une sélectivité, le point d’intersection de la courbe courant-tension ne sera pas égal à zéro en raison de la perméabilité différente des ions qui entrent et sortent. Ce point d’intersection est appelé potentiel inverse du canal, et il peut être calculé à l’aide de la formule suivante10 :

Où dv : ions divalents ; MV : ions monovalents ; I : interne ; o : externe ; P : perméabilité de la membrane pour l’ion S mesurée en m·s−1 ; V : potentiel transmembranaire en volts ; F : Constante de Faraday, égale à 96 485 C·mol−1 ou J· V−1·mol−1 ; R : constante des gaz, égale à 8,314 J· K−1·mol−1 ; T : température absolue, mesurée en kelvins (= °C + 273,15).
Il peut y avoir des composants de courant passif associés à la conductance de fuite et à des canaux ioniques spécifiques dans les endolysosomes. Le courant de fuite est caractérisé par une relation linéaire courant-tension (I)-V, avec l’intersection à l’origine. Les courants de fuite des endolysosomes isolés à partir de cellules HEK293 non transfectées sont inférieurs à 50 pA à 100 mV ; Les canaux ioniques sous-jacents sont probablement des canaux de conductance potassium/sodium et des canaux chlorure.
Dans le cas de canaux ioniques activés par la tension, les composantes du courant de fuite dans le courant mesuré peuvent être soustraites en enregistrant une série d’impulsions de tension échelonnées avant ou après les courants endolysosomales voltage-dépendants stimulants. Les fuites peuvent également être soustraites hors ligne. L’amplitude de ces impulsions échelonnées est généralement d’un quart ou d’un cinquième de l’amplitude de l’impulsion expérimentale, un processus connu sous le nom de soustraction de fuite P/4 ou P/511. En raison de la très faible amplitude des courants de fuite, la soustraction P/4 ou P/5 n’est généralement pas utilisée.
Pince de tension
L’application répétée de sauts progressifs de la tension d’entrée peut enregistrer le courant à travers la membrane endolysosomale lorsque la tension change. Cela permet de déterminer si le canal est un canal ioniquevoltage-dépendant 12. En plus de la pince de tension, la pince de courant est également réalisable. L’activité monocanal peut être enregistrée à l’aide des configurations disponibles en mode de pince de tension12. La faible densité typique des canaux ioniques endolysosomales peut entraver le processus d’obtention de patchs contenant un seul canal. Le verre de pipette à paroi épaisse est le meilleur matériau pour produire des électrodes avec de petites pointes de pipette et une faible capacité. Le revêtement du verre avec du Sylgard ou de la cire peut réduire la capacité de la pipette.

Figure 1 : Vue d’ensemble des étapes du patch-clamp endolysosomal. Le protocole d’évaluation de l’activité des canaux ioniques dans les vésicules intracellulaires à l’aide d’un système manuel de patch-clamp endolysosomal peut être décrit dans un organigramme avec les étapes clés suivantes : (1) Préparation de la solution : Assembler toutes les solutions chimiques requises. (2) Préparation cellulaire : Cultivez et préparez les cellules pour l’extraction endolysosomale. (3) Fabrication de pipettes : Créez et polissez la pipette patch-clamp pour assurer une manipulation précise. (4) Isolement de l’endolysosome : Séparez manuellement les endolysosomes des cellules en culture. (5) Patch vésicule : Fixez la pipette à une seule vésicule endolysosomale. (6) Acquisition de signal : Capturez et amplifiez les signaux électriques de la vésicule. (7) Numérisation du signal : Convertissez les signaux analogiques en signaux numériques pour l’analyse. (8) Collecte et analyse des données : Recueillir les données et les interpréter pour étudier la fonction des canaux ioniques. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Configuration du matériel électrophysiologique. Lors des mesures à deux électrodes, l’électrode de mesure entre en contact avec la membrane cible, tandis que l’électrode de référence est placée dans la solution du bain. La différence de potentiel entre les deux est amplifiée par l’amplificateur, numérisée par le numériseur, puis capturée par l’ordinateur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
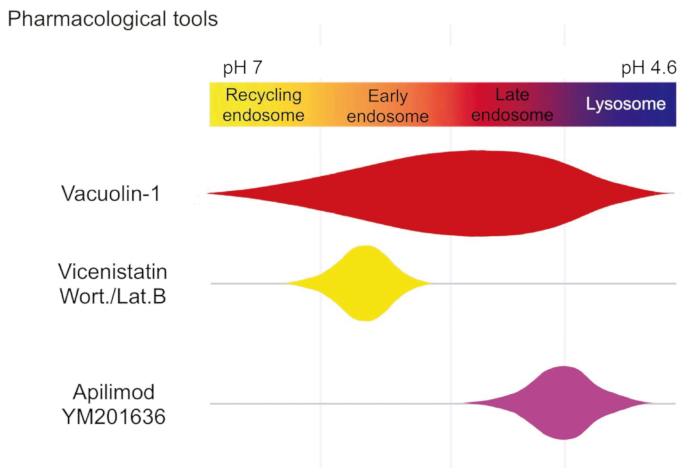
Figure 3 : Outils pharmacologiques utilisés pour l’analyse endolysosomale par patch-clamp. Schéma montrant les plages d’activité de différents agents pharmacologiques pour le patch-clamp. L’association de Wortmannin et de Latrunculin B est très spécifique pour les endosomes précoces, à l’exclusion des endosomes de recyclage. YM201636 agrandit sélectivement les endosomes/lysosomes tardifs. La vacuoline élargit les endosomes précoces, recyclant les endosomes, ainsi que les endosomes/lysosomes tardifs13. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Isolement d’organites hypertrophiés. Illustration schématique du processus d’isolement manuel d’une vésicule cible à partir d’une cellule. Les étapes sont les suivantes : (1) Préparation de la lamelle : La cellule cible contenant la vésicule cible est placée sur une lamelle. (2) Couper la membrane plasmique : La membrane plasmique de la cellule cible est découpée à l’aide d’une pipette d’isolement. (3) Pipette d’isolement : La pipette d’isolement est positionnée de manière à cibler la vésicule. (4) Pressez la vésicule cible à l’extérieur de la cellule : La vésicule cible est soigneusement pressée à l’extérieur de la cellule à l’aide de la pipette d’isolement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
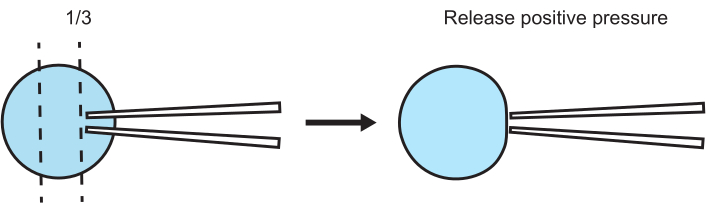
Figure 5 : Position relative recommandée entre la pipette patch et la vésicule pour la formation de gigaseal. Après avoir appliqué une pression positive, approchez-vous de l’organite par le haut avec la pipette patch. Positionnez la pointe à environ un tiers du haut de l’organite et abaissez lentement (mode 3-6) la pipette patch jusqu’à ce que la pression positive fasse bouger la membrane de l’organite. Au microscope, l’organite doit rouler ou être éloigné de la pointe. À ce moment-là, relâchez la pression positive et attendez que le gigaseal se forme. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Types de configurations. Selon la méthode de contact entre la pipette et l’organite, il existe quatre modes de mesure différents : organite ou vésicule attachée, vésicule entière, à l’envers et à l’extérieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Courants pour le calcul de la résistance de la pipette, de la résistance d’étanchéité, de la résistance série et de la capacité de la cellule. La pipette d’enregistrement est positionnée dans la solution du bain, et une impulsion de tension rectangulaire (durée 5 ms, 5 mV) produit une réponse de courant presque rectangulaire. La résistance de la pipette peut être déterminée en divisant la tension appliquée par le courant mesuré. Lorsque le gigaseal se forme en mode attaché au lysosome, la réponse actuelle diminue rapidement. La résistance d’étanchéité peut être calculée en divisant la tension par le courant très faible restant. Lorsqu’une impulsion ZAP est appliquée, la membrane se rompt rapidement, entraînant une augmentation des courants capacitifs, signalant la transition vers la configuration endolysosomale entière. Pour un endolysosome sphérique, le courant résultant suit une seule fonction exponentielle du temps. La résistance série est déterminée en divisant l’amplitude du courant capacitif par la tension de commande, et la capacité de l’endolysosome est calculée en divisant la constante de temps des courants capacitifs par la résistance série12. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Courants observés lors de l’enregistrement sur la rampe (p. ex., TPC2). Il s’agit d’un tracé de relation courant-tension (I-V), l’axe X représentant la tension allant de -100 à +100 mV, et l’axe Y indiquant le courant généré à différentes tensions. Le graphique utilise les mesures du canal TPC2 à titre d’exemple. La ligne noire montre les résultats obtenus directement après l’application de l’impulsion ZAP, la ligne rouge représente le courant généré lorsque le canal TPC2 est activé par l’agoniste TPC2-A1N, et la ligne verte indique le courant de fuite, qui peut résulter d’une étanchéité incomplète. Une mesure réussie peut être identifiée non seulement par la capture de la forme du canal, mais aussi par l’absence de courants de fuite. Si des courants de fuite sont présents, l’intersection du courant et de l’axe X sera à 0, formant une ligne droite (avec différents ions à l’intérieur et à l’extérieur de la membrane). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Pipette patch endolysosomale | Pipette patch à cellules entières | |||||||
| Cycle | CHALEUR | TIRER | VEL | HEURE | CHALEUR | TIRER | VEL | HEURE |
| 1 | Valeur déterminée par le protocole de rampe +10 | Blanc | 30 | 150 | Valeur déterminée par le protocole de rampe +10 | Blanc | 40 | 150 |
| 2 | 30 | 150 | 40 | 150 | ||||
| 3 | 30 | 150 | 40 | 150 | ||||
| 4 | 30 | 150 | 40 | 150 | ||||
| 5 | Valeur déterminée par le protocole de rampe +25 | 18 | 150 | - | - | |||
| 6 | Valeur déterminée par le protocole de rampe +20 | 15 | 150 | - | - | |||
Tableau 1 : Protocole de tirage de pipette de patch. Tout d’abord, utilisez la fonction rampe pour trouver la température HEAT appropriée, puis suivez le tableau pour ajuster les six cycles de traction.
| Endolysosomes non spécifiques (Vacuolin-1) / LE/LY spécifiques (YM201636) | Macrophage | 1 μM / 0,4 μM | 1-2 h / 1-3 h |
| COS-1, HEK293, Hela, fibroblaste, etc | 1 μM / 0,4 μM | Nuit / Nuit | |
| Cardiomyocytes, cellules musculaires squelettiques | 5 μM | 24 à 48 h |
Tableau 2 : La concentration et la durée du traitement nécessaires pour élargir les endolysosomes dans différents types de cellules à l’aide d’agents pharmacologiques. Différents types de cellules présentent des différences significatives dans leur efficacité d’élargissement sous traitement médicamenteux. Généralement, les cellules avec un système endolysosomal plus actif nécessitent des temps de traitement plus courts. Cependant, la durée optimale du traitement et la concentration doivent encore être déterminées expérimentalement13.
Discussion
Les dispositifs expérimentaux électrophysiologiques ont quatre exigences principales pour les laboratoires : i) environnement : méthodes pour maintenir l’échantillon en bonne santé ; ii) optique : méthodes de visualisation de l’échantillon ; iii) mécanique : méthodes pour positionner de manière stable la microélectrode ; et iv) l’électronique : méthodes d’amplification et d’enregistrement du signal.
Pour réaliser avec succès des expériences de patch-clamp endolysosomal, plusieurs étapes clés sont cruciales. Tout d’abord, l’état des cellules - les cellules doivent être étroitement collées à la lamelle de sorte que lorsque la pipette d’isolement est utilisée pour briser les cellules, la cellule entière ne bouge pas. Il est important de s’assurer que les cellules sont saines et bien réparties. Si les cellules ne peuvent pas rester fixées en place, il peut être utile de passer à un revêtement approprié sur la lamelle. De plus, la densité cellulaire doit être surveillée. Lorsque la densité cellulaire est trop élevée (supérieure à 90 %), l’efficacité de l’élargissement des organites induit par les médicaments diminue, ce qui rend les expériences difficiles à mener. Deuxièmement, la qualité de la pipette patch - la pointe de la pipette patch doit être de taille appropriée (5-8 MΩ), et le verre des deux côtés doit être lisse et parallèle.
Troisièmement, lors de la formation d’un gigaseal, s’il ne se forme pas immédiatement après avoir relâché une pression positive, l’application d’une quantité modérée de pression négative peut aider. Cependant, une fois que le gigaseal se forme, la pression négative doit être relâchée immédiatement pour éviter le risque que la vésicule entière soit aspirée dans la pipette. De plus, lors de l’exécution d’un patch-clamp sur l’endolysosome entier, une petite partie de la membrane doit être rompue. En raison de l’absence de cytosquelette dans les endolysosomes, ils sont très fragiles et deviennent souvent instables, ce qui entraîne l’aspiration de pièces dans la pipette. Dans ce cas, l’application d’une légère pression positive pour pousser la partie aspirée vers l’extérieur peut aider. Si la capacité de l’organite restant à l’extrémité de la pipette est inférieure à 1 pF, cela indique qu’il reste très peu de membrane, ne contenant probablement pas les canaux d’intérêt. Dans de tels cas, il est recommandé d’essayer une nouvelle vésicule. Enfin, lors de l’ajout de médicaments, évitez de frapper directement la pointe de la pipette, car un écoulement rapide du fluide peut perturber le gigaseal. De plus, lorsqu’il atteint la cage de Faraday, l’expérimentateur doit être correctement mis à la terre pour éviter de générer des signaux de bruit excessifs, ce qui peut entraver l’observation de résultats précieux.
Les enregistrements actuels avec l’ensemble de la structure endolysosomale présentent des défis car des facteurs des deux côtés de la membrane endolysosomale peuvent être perdus, ce qui peut entraîner des changements dans les caractéristiques de déclenchement pendant les enregistrements. Premièrement, des changements dans les caractéristiques du courant en fonction du temps peuvent résulter de la dilution ou de la perte de régulateurs spécifiques (petites molécules ou autres facteurs) par la solution de pipette dans la lumière lysosomale. De plus, les composants de la pipette ou de la solution cytosolique pourraient moduler des secondes voies de messager spécifiques qui régulent les canaux ioniques endolysosomaux. La combinaison du mode endolysosomal attaché avec des techniques de patch perforé serait idéale pour résoudre des problèmes spécifiques provenant du côté luminal de la membrane endolysosomale.
Deuxièmement, dans les enregistrements endolysosomaux par patch-clamp, parce que le côté cytosolique de la membrane est exposé à la solution d’enregistrement (solution cytosolique), les petites molécules ou facteurs associés au côté cytosolique de la membrane endolysosomale peuvent être emportés. Il a été démontré que l’ATP bloque la TPC du côté cytosolique de la membrane14. Une conception soigneuse de la solution du bain (p. ex., en s’assurant qu’aucun ATP n’est inclus dans la solution d’enregistrement cytosolique) peut minimiser ce problème particulier. L’exécution de contrôles dépendants du temps et le lancement de protocoles spécifiques à un moment cohérent après l’établissement de configurations d’enregistrement de l’endolysosomal entier peuvent également aider à gérer ce problème. Un autre problème pourrait être la perte de protéines régulatrices associées aux canaux ioniques endolysosomales en raison du lavage. Si ces facteurs régulateurs font partie d’une cascade de signalisation, la régulation physiologique des canaux endolysosomales pourrait être perdue.
Techniquement, bien que le patch-clamp endolysosomal soit actuellement la technique électrophysiologique la plus couramment utilisée pour étudier les canaux ioniques endolysosomaux, il nécessite généralement d’agrandir les vésicules et d’isoler manuellement les vésicules sélectionnées. Cette limitation est inhérente aux techniques électrophysiologiques basées sur des électrodes en verre capillaire. L’absence d’un cytosquelette pour maintenir la stabilité des organites et l’interférence des filaments intracellulaires restent les principales raisons du faible taux de réussite de ces expériences. Au-delà de l’accumulation d’expérience par les électrophysiologistes, les progrès futurs des systèmes optiques avancés et des outils fluorescents de haute précision à petites molécules pourraient permettre de mesurer l’activité des canaux ioniques dans les organites individuels au sein de cellules individuelles.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts financiers concurrents ou d’autres conflits d’intérêts.
Remerciements
Conseil national de la science et de la technologie de Taïwan (MOST 110-2320-B-002-022), Université nationale de Taïwan (NTU-112L7818) et Instituts nationaux de recherche en santé de Taïwan (NHRI-EX112-11119SC).
matériels
| Name | Company | Catalog Number | Comments |
| BOROSILICATE GLASS | SUTTER INSTRUMENT | BF150-75-10 | O.D.:1.5 mm, I.D. 0.75 mm 10 cm length, with filament |
| Digidata 1140A | Axon Instruments | ||
| Inverted microscope IX73 | OLYMPUS | ||
| MODEL P-97 micropipette puller | SUTTER INSTRUMENT | ||
| MPC-200 | SUTTER INSTRUMENT | ||
| MultiClamp 700B | Axon Instruments | ||
| POLISHER | |||
| Quick Release Chamber | Warner instruments | 641943 | QR-40LP, for 25 mm Coverslips |
Références
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nat Rev Mol Cell Biol. 19 (11), 679-696 (2018).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Kumar, P., Kumar, D., Jha, S. K., Jha, N. K., Ambasta, R. K. Ion channels in neurological disorders. Adv Protein Chem Struct Biol. 103, 97-136 (2016).
- Brailoiu, E., et al. An ancestral deuterostome family of two-pore channels mediates nicotinic acid adenine dinucleotide phosphate-dependent calcium release from acidic organelles. J Biol Chem. 285 (5), 2897-2901 (2010).
- Pitt, S. J., et al. TPC2 is a novel NAADP-sensitive Ca2+ release channel, operating as a dual sensor of luminal pH and Ca2+. J Biol Chem. 285 (45), 35039-35046 (2010).
- Gerndt, S., et al. Agonist-mediated switching of ion selectivity in TPC2 differentially promotes lysosomal function. Elife. 9, e54712 (2020).
- She, J., Guo, J., Jiang, Y., Wahl-Schott, C., Biel, M. Structure and function of plant and mammalian TPC channels. Endolysosomal voltage-dependent cation channels. , 155-180 (2023).
- Hu, M., et al. Parkinson's disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell. 185 (13), 2292-2308.e20 (2022).
- Grimm, C., Bartel, K., Vollmar, A. M., Biel, M. Endolysosomal cation channels and cancer: A link with great potential. Pharmaceuticals (Basel). 11 (1), 4 (2018).
- Gasnier, B., Zhu, M. X. . Ion and molecule transport in lysosomes. , (2020).
- Hernández-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca2+ release in adult skeletal muscle fibres. Prog Biophys Mol Biol. 108 (3), 98-118 (2012).
- Chen, C. C., et al. Patch-clamp technique to characterize ion channels in enlarged individual endolysosomes. Nat Protoc. 12 (8), 1639-1658 (2017).
- Chen, C. C., et al. Small molecules for early endosome-specific patch clamping. Cell Chem Biol. 24 (7), 907-916.e4 (2017).
- Cang, C., et al. mTOR regulates lysosomal ATP-sensitive two-pore Na+ channels to adapt to metabolic state. Cell. 152 (4), 778-790 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon