Method Article
Patch-Clamp-Techniken für die Analyse einzelner endolysosomaler Vesikel
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Methode zur direkten Messung der Ionenkanalaktivität auf intrazellulären Vesikeln unter Verwendung eines manuellen endolysosomalen Patch-Clamp-Systems. Wir veranschaulichen die Methode, bei der Endolysosomen vergrößert und diese Vesikel manuell isoliert werden. Dieser Ansatz stellt sicher, dass die Forscher das Verfahren genau replizieren und anwenden können.
Zusammenfassung
Endolysosomale Ionenkanäle sind entscheidend für die endolysosomale Ionen- und pH-Homöostase, die Regulierung des Membranpotentials und den Vesikeltransport. Der elektrophysiologische Zugang zu diesen Kanälen in kleinen intrazellulären Vesikeln war jedoch eine Herausforderung. Die Entwicklung endolysosomaler Patch-Clamp-Techniken hat maßgeblich dazu beigetragen, diese Barriere zu überwinden und die direkte Messung der Ionenkanalaktivität in endolysosomalen Membranen zu ermöglichen.
Im Vergleich zu bestehenden planaren Patch-Clamp-Techniken kann die endolysosomale Patch-Clamp mehrere Zellen gleichzeitig aufzeichnen und problemlos mit anderen Messmethoden kombiniert werden. Die manuelle Bedienung bietet den Vorteil, dass gezielte Vesikel sichtbar gemacht werden können. Es befasst sich auch mit der Begrenzung des unverzichtbaren Vorhandenseins von Ca2+ auf einer Seite der endolysosomalen Membran, wodurch die Flexibilität des Versuchsdesigns erhöht wird. Der Einsatz endolysosomaler Patch-Clamp-Techniken ermöglicht die direkte Messung und Analyse der Ionenkanalaktivität in Endolysosomen.
Angesichts des engen Zusammenhangs zwischen der Funktion aberranter endolysosomaler Ionenkanäle und Krankheiten wie neurodegenerativen Erkrankungen und Stoffwechselstörungen könnte die Untersuchung und Modulation dieser Kanäle neue Angriffspunkte für Medikamente aufdecken. Durch die Wiederherstellung des intrazellulären Ionengleichgewichts können wir damit verbundene Krankheiten lindern oder heilen. Daher ist diese Technik von entscheidender Bedeutung für die Entdeckung neuer Wirkstoffziele und die Entwicklung relevanter Medikamente.
Einleitung
Ionenkanäle spielen eine entscheidende Rolle bei zahlreichen physiologischen Prozessen. Während Oberflächenionenkanäle große Aufmerksamkeit erhalten haben, wird die Bedeutung intrazellulärer Kanäle, insbesondere in Endolysosomen, allmählich anerkannt. Das endolysosomale System besteht aus multifunktionalen, membrangebundenen Organellen, die auf grundlegende zelluläre Funktionen spezialisiert sind, darunter Recycling-Endosomen (RE), frühe Endosomen (EE), späte Endosomen (LE), Lysosomen (LY) und Hybridorganellen mit endolysosomalen und anderen Kompartimenteigenschaften wie Phagosomen und Autophagosomen.
EE, auch als Sortierendosomen (SE) bekannt, sind eine der früheren Adressen für Materialien, die von der Plasmamembran (PM) internalisiert werden. EEs sind kritische Kompartimente, die für die Sortierung von Fracht in verschiedene endozytäre Wege verantwortlich sind, wie z. B. den Reifungsweg zu LE/LY für den Abbau, den schnellen Recyclingweg zurück zum PM und den langsamen Recyclingweg zwischen dem Recyclingfach oder peripheren RE. Multivesikuläre Körper (MVBs), die von Endosomen abgeleitet sind, sind kugelförmige Kompartimente, die von einer Grenzmembran umgeben sind, die mit intraluminalen Vesikeln (ILVs) gefüllt werden kann1. Um die normale Funktion dieser Organellen aufrechtzuerhalten, benötigen sie Membranionenkanäle, um den vesikulären pH-Wert, die Osmolarität und die Signaltransduktion zu regulieren. Die Messung der Aktivität dieser Kanäle ist jedoch nicht einfach.
Für Ionenkanäle, die sich auf der Plasmamembran befinden, ist die in den 1970er Jahren entwickelte Patch-Clamp-Technik lange Zeit die Goldstandardmethode2. Der elektrophysiologische Zugang zu Kanälen in kleinen intrazellulären Vesikeln ist jedoch nach wie vor eine Herausforderung. Die Anwendung des Goldstandards für die Messung von Ionenkanälen auf der Plasmamembran auf die Messung intrazellulärer Organellen steht vor drei großen Herausforderungen. Erstens ist die Größe von Endolysosomen in der Regel sehr klein (weniger als 1 μm Durchmesser), was es schwierig macht, sie unter einem Mikroskop zu beobachten und zu isolieren, und kleiner als der Öffnungsdurchmesser typischer Glasmikropipetten, was das Experiment inoperabel macht. Zweitens erfordert die Isolierung von Endolysosomen direkt aus den Zielzellen bei gleichzeitiger Aufrechterhaltung der Integrität der Organellen besondere Fähigkeiten. Drittens kann es aufgrund des Fehlens eines Zytoskeletts in intrazellulären Organellen eine Herausforderung darstellen, eine Versiegelung der endolysosomalen Membran innerhalb der Patch-Pipette zu bilden und sie dann zu zerreißen, um eine Ganz-Endolysosomen-Konfiguration zu erreichen, da dies die strukturelle Integrität der Organellebeeinträchtigt 3.
Um diese Probleme zu überwinden, wurden mehrere Methoden entwickelt, darunter die Aufzeichnung von Lipiddoppelschichten, die Modifikation lysosomaler Targeting-Sequenzen und feststoffgestützte membranbasierte Elektrophysiologie (SSM oder SSME). Die Methode zur Aufzeichnung von Lipiddoppelschichten umfasst die Rekonstruktion synthetischer Phospholipidmembranen mit gereinigten Ionenkanälen, was eine detaillierte elektrophysiologische Untersuchung der Funktion von Membranproteinen unter kontrollierten Bedingungen ermöglicht 4,5. Die Modifikation lysosomaler Targeting-Sequenzen auf Ionenkanälen beinhaltet die Umleitung endolysosomaler Ionenkanäle zur Plasmamembran zur Messung mit herkömmlichen Patch-Clamp-Methoden6. Bei der feststoffgestützten membranbasierten Elektrophysiologie (SSM oder SSME), auch bekannt als endolysosomale planare Patch-Clamp-Methode, werden planare Glaschips mit festem Substrat und kleinen Öffnungen (<1 μm Durchmesser) in mikrostrukturierten planaren Borosilikatchips verwendet. Diese Glaschips mit kleiner Apertur ermöglichen die Analyse kleiner, sogar nativer Endolysosomen mit Hilfe eines Druck-Saug-Kontrollsystems (Nanion). Bei den ersten beiden Methoden befinden sich die Ionenkanäle jedoch nicht in ihrer natürlichen physiologischen Umgebung. Versuche, lysosomale Kanäle aufzuzeichnen, die auf der Plasmamembran exprimiert oder zu Lipiddoppelschichten rekonstituiert wurden, haben weitgehend zu unsicheren und widersprüchlichen Ergebnissen geführt.
Obwohl planare Patch-Clamp-Techniken das Problem der künstlichen Interferenz effektiv angegangen sind und den Vorteil von Hochdurchsatzmessungen bieten, sind auch die verwendeten Lösungen durch diese Methode begrenzt. Die in diesem Artikel vorgestellte endolysosomale Patch-Clamp-Technik kann mehrere Zellen gleichzeitig aufzeichnen und leicht mit anderen Messmethoden kombiniert werden. Die manuelle Bedienung bietet den Vorteil, dass Zielvesikel sichtbar gemacht werden können. Es überwindet auch die unvermeidliche Begrenzung von Ca2+ in der Lösung auf einer Seite der endolysosomalen Membran und erhöht die Freiheit des Versuchsdesigns3. In jüngster Zeit haben endolysosomale Patch-Clamp-Techniken eine Schlüsselrolle in der Arzneimittelentwicklungsforschung gespielt. Bei neurodegenerativen Erkrankungen hat diese Technik beispielsweise dazu beigetragen, neue Medikamente zu identifizieren, die auf endolysosomale Ionenkanäle abzielen, die mit Alzheimer- und Parkinson-Krankheiten in Verbindung gebracht werden 7,8. Forscher können diese Technik auch nutzen, um die Rolle endolysosomaler Ionenkanäle in Tumorzellen zu untersuchen9 und so das Wachstum und die Proliferation von Tumoren zu kontrollieren. In Bezug auf Stoffwechselerkrankungen zeigen endolysosomale Patch-Clamp-Studien Verbindungen auf, die endolysosomale Ionenkanäle regulieren, und bieten neue Behandlungsansätze für Diabetes und Fettleibigkeit. Die endolysosomale Patch-Clamp-Technik hilft beim Verständnis der endolysosomalen Dysfunktion und bei der Suche nach potenziellen Therapien6, wodurch unser Verständnis der Funktionen der endolysosomalen Ionenkanal erheblich verbessert und die Entdeckung neuer Wirkstoffziele gefördert wird.
Protokoll
1. Einrichtung des Instruments
- Hardware
HINWEIS: In Abbildung 1 finden Sie einen Standard-Elektrophysiologie-Rig-Aufbau.- Schirmen Sie das Setup mit einem Tisch und einem Faradayschen Käfig vor äußeren Einflüssen ab.
- Verwenden Sie ein inverses Mikroskop mit einem Mikromanipulator, um die Mikroelektrode stabil zu positionieren.
- Richten Sie einen Verstärker ein, um die erfassten Signale zu sammeln und zu verstärken.
- Verwenden Sie einen Digitalisierer, um die analogen Signale in digitale Signale umzuwandeln.
- Verwenden Sie Datenerfassungs- und Analysesoftware, um experimentelle Protokolle einzurichten und aussagekräftige, analysierbare Ergebnisse aus den gesammelten Daten zu extrahieren.
- Elektroden
- Verwenden Sie zwei Elektroden: eine Badeelektrode und eine Pipettenelektrode.
HINWEIS: Platin- und Silberchlorid haben die besten Polarisationseigenschaften. Silberchlorid-Elektroden bestehen aus Silberdraht oder Pellets, die chloridiert wurden und somit eine AgCl-Schicht auf der Außenfläche des Drahtes oder Pellets aufweisen (Abbildung 2).
- Verwenden Sie zwei Elektroden: eine Badeelektrode und eine Pipettenelektrode.
- Vorbereitung der Pipette
- Ziehen
- Setzen Sie das Kapillarrohr in den Abzieher ein.
HINWEIS: Die unten für die Pipettenherstellung verwendeten Parameter sind gerätespezifisch. Das Instrument, das wir in diesem Artikel verwendet haben, wird in der Materialtabelle erwähnt. - Unter experimentellen Bedingungen (Raumtemperatur 22 °C, durchgeformter Heizfaden, Borosilikatglas mit Glühfaden), die den Heizfaden nicht durchbrennen, führen Sie einen RAMP-Test am Abzieher durch, um den zum Schmelzen der Glaskapillare erforderlichen Heizwert (HEAT) zu bestimmen.
- Entwerfen Sie ein neues Zugprogramm mit sechs separaten Zugzyklen unter Verwendung der Parameter HEAT, Geschwindigkeit (VEL) und Zeit (TIME) (Tabelle 1).
HINWEIS: HEAT bezieht sich auf den Parameter, der den Glühfaden der Heizung erhitzt, so dass der Glasfaden schmelzen kann. Die Geschwindigkeit gibt die Geschwindigkeit an, mit der der Abzieher das Filament in beide Richtungen zieht. Die Zeit stellt die Dauer des Intervalls zwischen den einzelnen Zyklen dar. - Drücken Sie die grüne Pull-Taste auf der Tastatur.
- Lösen Sie den Klemmknopf und entfernen Sie die Pipetten aus dem Abzieher.
- Untersuchen Sie die Pipettenspitzen unter dem Okular der Mikroschmiede, um den Spitzendurchmesser, die Schärfe und die Geometrie zu bestimmen. Stellen Sie sicher, dass der Spitzendurchmesser 0,5 bis 0,9 μm beträgt.
HINWEIS: Wenn das Filament häufiger verwendet wird, ändert sich der Wärmewert, der zum Schmelzen der Glaskapillare erforderlich ist. - Wenn die Spitzengröße nicht den Erwartungen entspricht, passen Sie die Parameter HEAT und VEL an. Höhere Temperaturen und höhere Geschwindigkeiten führen zu feineren, längeren Spitzen und umgekehrt. Stellen Sie die HITZE in Schritten von 5 Grad und die Geschwindigkeit in Schritten von 3 Grad ein.
- Setzen Sie das Kapillarrohr in den Abzieher ein.
- Polieren
- Legen Sie die gezogenen Patch-Pipetten in den microforge-Halter.
- Prüfen Sie die Pipettenspitzen mit einer 35-fachen Objektivlinse (kombiniert mit einem 15-fachen Okular, was zu einer 525-fachen Vergrößerung führt).
- Verwenden Sie den Mikromanipulator, um die Patch-Pipetten in die Nähe des Filaments zu bringen.
- Stellen Sie den Temperaturregler auf 80.
- Schalten Sie die Heizung mit dem Fußschalter ein und legen Sie einen kurzen Wärmeimpuls (1 - 2 s) an, um den Poliervorgang durch das microforge-Okular zu überwachen.
- Wiederholen Sie den Vorgang, bis alle Pipetten poliert sind.
- Legen Sie die fertigen Pipetten in eine versiegelte Schachtel, um das Eindringen von Staub zu verhindern.
HINWEIS: Ziel ist es, die Spitze schnell zu schmelzen, damit das Glas die endgültige Spitzengeometrie neu formiert, ohne sie zu scharf zu machen. Dadurch wird verhindert, dass die Pipette in die Vesikelmembran eindringt, gegen die sie gedrückt wird, und die Dichtungsbildung wird effektiv gefördert. Nach der letzten Politur sollte der innere Weg der Pipettenspitze sehr schmal, gerade und linear sein.
Die besten Aufnahmepipetten haben in der Regel einen Widerstand von 5 - 8 MΩ nach dem Feuerpolieren. Der Öffnungsdurchmesser der Spitze sollte 2 μm betragen. Eine perfekt polierte Patch-Pipette ist für eine erfolgreiche Gigaseal-Bildung unerlässlich, da dies eine der Schlüsseltechniken ist, die für den Erfolg des Verfahrens entscheidend sind.
- Ziehen
2. Vorbereitung der Probe
- Zellkultur (am Beispiel HEK293)
- Kultivieren Sie die Zellen in einem befeuchteten Standard-Inkubator bei 37 °C mit 5 % CO2.
- Kultivieren Sie die HEK293-Zellen in glukosearmem DMEM, ergänzt mit 10 % hitzeinaktiviertem fötalem Rinderserum (FBS), 100 U/ml Penicillin und 100 mg/ml Streptomycin.
- Legen Sie Poly-L-Lysin-beschichtete 12-mm-Deckgläser in eine 24-Well-Platte.
- Vergrößerung der Organellen
- 1 μM Vacuolin-1 zu HEK293-Zellen in der 24-Well-Platte (aus Schritt 2.1) geben und über Nacht bei 37 ΰC mit 5 % CO2 inkubieren, bis sich vergrößerte Vesikel zu bilden beginnen.
HINWEIS: Die Größe der vergrößerten Endolysosomen kann je nach Werkzeug, Verbindung, Inkubationszeit und Zelltyp 1-10 μm erreichen (Abbildung 3 und Tabelle 2).
- 1 μM Vacuolin-1 zu HEK293-Zellen in der 24-Well-Platte (aus Schritt 2.1) geben und über Nacht bei 37 ΰC mit 5 % CO2 inkubieren, bis sich vergrößerte Vesikel zu bilden beginnen.
- Vorbereitung der Lösung
HINWEIS: Die Standardlösungszubereitung zielt darauf ab, die Ionenkonzentrationen in der Zelle und den Organellen zu simulieren. Die Standardlösungen für die Messung von Ionenkanälen an Lysosomen sind beispielsweise wie folgt:- Zubereitung der Badlösung (in mM): 140 K-Methansulfonat (MSA), 5 KOH, 4 NaCl, 0,39 CaCl2, 1 EGTA, 10 HEPES. Stellen Sie den pH-Wert mit KOH auf 7,2 ein. Stellen Sie die Osmolarität mit Glukose auf 300 mosm/L ein.
- Pipettenlösung (in mM) vorbereiten: 140 Na-MSA, 5 K-MSA, 2 Ca-MSA, 1 CaCl2, 10 HEPES, 10 MES. Stellen Sie den pH-Wert mit MSA auf 4,6 ein. Stellen Sie die Osmolarität mit Glukose auf 310 mosm/L ein.
HINWEIS: Die Lösung durch einen 0,2-μm-Filter passieren, 45 mL Aliquots in konischen 50 mL Röhrchen zubereiten und bis zu 2-4 Wochen bei 4 °C lagern.
3. Isolierung von Organellen
- Entfernen Sie ein Deckglas mit behandelten Zellen (siehe Abschnitt 2) von der 24-Well-Platte, geben Sie es in die Mikroskopkammer und fügen Sie 1 ml Badlösung hinzu.
HINWEIS: Zellen dürfen nicht für >1 h in der Badlösung gelagert werden, wenn Ganzendolysosomale Patch-Clamp-Experimente durchgeführt werden, bei denen Endolysosomen isoliert, versiegelt und aufgezeichnet werden. Nach 1 h schrumpfen die vergrößerten Endolysosomen, haften an der Pipette und lassen sich nur noch schwer isolieren. - Verwenden Sie eine selbstgemachte Kunststoff-Füllnadel, um die Isolationspipette mit Pipettenlösung zu füllen, und installieren Sie die Pipette am vorderen Ende der Patch-Clamp-Anordnung.
- Stellen Sie den diagonalen Bewegungswinkel des Mikromanipulators auf nahe 30° (Werkseinstellung) ein.
- Unter dem Mikroskop (40x Objektiv und 10x Okular) untersuchen Sie die Zellen auf ausreichend vergrößerte Endosomen oder Lysosomen, die sich in der Nähe des Zellmembranrandes zur Isolierung befinden. Bewegen Sie die Isolationspipette in die Nähe der ausgewählten Zelle.
- Senken Sie die Isolationspipette mit dem Mikromanipulator ab, bis sie den Rand der Plasmamembran berührt (Abbildung 4). Bewegen Sie die Isolationspipette schnell horizontal, um ein kleines Stück der Plasmamembran abzuschneiden.
- Drücken Sie mit derselben Pipette von der gegenüberliegenden Seite auf die Zelle, um das Endosom/die Lysosomen in einem Abstand von ~2 μm von der Zelle herauszudrücken.
HINWEIS: Wenn sich auf der Organelle eine restliche Zellmembran befindet, kann dies die Bildung eines Gigaseals verhindern. - Untersuchen Sie das isolierte Endolysosom unter dem Mikroskop.
4. Gigaseal-Bildung
- Füllen Sie eine frisch polierte Patch-Pipette mit der passenden Pipettenlösung und installieren Sie die Pipette am vorderen Ende des Verstärkers.
- Üben Sie einen Überdruck von 20 - 50 mbar auf die Pipette aus (oder verwenden Sie 0,03-0,05 mL aus einer 1-ml-Spritze zur Druckkontrolle) und halten Sie diesen Druck aufrecht (verriegeln Sie das Ventil).
HINWEIS: 1 mbar (Millibar) = 0,001 bar = 0,1 kPa (Kilopascal) = 1 hPa (Hektopascal) = 1.000 dyn/cm2. - Wenn Sie die Pipettenspitze in die Badlösung in der Mitte des Sichtfelds bewegen, vergewissern Sie sich, dass der Druck hoch genug ist, um die Flüssigkeit in die Badlösung fließen zu sehen.
- Legen Sie wiederholte Stromimpulse (+5 mV; 5 ms) an, um den Pipettenwiderstand, den Dichtungswiderstand und den Serienwiderstand zu bestimmen. Überwachen Sie die Größe der Pipettenspitze, die Dichtungsbildung und die Etablierung der gesamten endolysosomalen Konfiguration.
- Bewegen Sie die Pipette schnell nahe an die Oberseite des Zielvesikels. Bringen Sie die Pipette in die Nähe des Vesikels, bis sich das Vesikel aufgrund des Flüssigkeitsflusses aus der Pipette bewegt oder rollt (Abbildung 5).
- Stellen Sie die Offset-Spannung der Pipette auf 0 mV ein. Lassen Sie sofort den Überdruck ab. Im Idealfall wird das Vesikel zur Pipette gezogen und verbindet sich mit der Membran, wodurch innerhalb von 1 s ein Gigaseal (1-20 GΩ) entsteht.Achten Sie auf eine Abnahme der Stromamplitude auf <10 pA , die durch den Spannungsimpuls von 5 mV hervorgerufen wird, was auf eine erfolgreiche Gigaseal-Bildung hinweist.
HINWEIS: Ein stabiler Überdruck ist für die Bildung von Gigasiegeln unerlässlich. Manchmal können Undichtigkeiten in den Schläuchen die Bildung von Gigasealen verhindern. Es wird empfohlen, ein Manometer zu verwenden, um sicherzustellen, dass keine Lecks vorhanden sind. Wenn ein Leck festgestellt wird, befestigen Sie den Schlauch wieder oder tragen Sie eine kleine Menge Vaseline auf die Nähte auf, um die Abdichtung zu verbessern.
5. Strommessung
- Bruch der Membran
HINWEIS: Abhängig von den experimentellen Anforderungen kann der Elektroden-Membran-Kontakt in vier Modi eingeteilt werden: Zellgebundener Modus, Ganzzellmodus, Inside-Out-Modus und Outside-Out-Modus (Abbildung 6).- Für die Aufzeichnung ganzer Vesikel wird ein Hochspannungs-Kurzpuls (ZAP-Puls) von 200 μs oder 500 μs verwendet, um die Membran an der Kontaktstelle zwischen der Pipette und der Organelle zu durchbrechen. Stellen Sie die Spannung von -500 mV bis -1.200 mV ein und verringern Sie sie jedes Mal um 100 mV , bis die Membran unterbrochen wird.
- Ziehen Sie für den Inside-Out-Modus (Einkanal-Aufnahme) nach dem Formen des Gigaseals die Pipette von der Organelle weg, reißen Sie ein kleines Stück der Membran ab und legen Sie die Seite frei, die ursprünglich dem Vesikellumen zugewandt war.
- Für den Outside-Out-Modus ziehen Sie die Pipette nach der Bildung des Gigaseal und dem Übergang in den gesamten Vesikelmodus von der Organelle weg und reißen ein kleines Stück der Membran ab, während Sie eine kleine vesikuläre Struktur beibehalten.
- Aktuelle Aufzeichnung
- Zeichnen Sie den Strom über die endolysosomale Membran auf, während die Eingangsspannung in endolysosomalen Voltage-Clamp-Patch-Clamp-Experimenten variiert.
- Steuern Sie diese Spannungen durch Spannungsstufen oder Spannungsrampen; Verwenden Sie einen breiten Bereich von Eingangsspannungen (z. B. -100 mV bis +100 mV) in endolysosomalen Voltage-Clamp-Experimenten.
- Zeichnen Sie den Strom über die endolysosomale Membran auf, während die Eingangsspannung in endolysosomalen Voltage-Clamp-Patch-Clamp-Experimenten variiert.
Ergebnisse
Im Folgenden werden die Stromformen beschrieben, die bei endolysosomalen Patch-Clamp-Experimenten beobachtet wurden. Wenn die aktuelle Form nicht den Erwartungen entspricht, kann dies an einem schlechten Kontakt oder einer Leckage liegen. Ein schlechter Kontakt kann auftreten, wenn die Referenzelektrode nicht vollständig mit der Badlösung in Kontakt kommt oder wenn die Pipettenelektrode kurz vor dem Bruch steht. Eine Leckage kann auftreten, wenn zwischen der Kammer und dem Deckglas ein Spalt vorhanden ist, durch den Flüssigkeit auf die Objektivlinse oder den Tisch fließen kann. Zu viel oder zu wenig Pipettenlösung kann ebenfalls zu solchen Anomalien führen.
Einführen der Nadel in die Lösung/Nadelkontakt mit der Zelloberfläche/ZAP
Während der Etablierung des Lysosomen-gebundenen Modus (Gigaseal-Bildung) nimmt die Stromreaktion rapide ab. Der Dichtungswiderstand kann bestimmt werden, indem die Sollspannung durch den geringen Reststrom dividiert wird (Abbildung 7).
Rampe/Leck
Durch wiederholtes Anlegen einer kontinuierlichen Eingangsspannung von -100 mV bis +100 mV kann der Strom über die endolysosomale Membran über die Zeit aufgezeichnet werden (Abbildung 8). Bei Standardlösungen unterscheidet sich die Ionenzusammensetzung innerhalb und außerhalb der Organelle. Wenn der Kanal Selektivität aufweist, liegt der Schnittpunkt der Strom-Spannungs-Kurve aufgrund der unterschiedlichen Permeabilität der ein- und ausströmenden Ionen nicht bei Null. Dieser Schnittpunkt wird als Umkehrpotential des Kanals bezeichnet und kann mit der folgenden Formel10 berechnet werden:

Dabei dv: zweiwertige Ionen; mV: monovalente Ionen; I: intern; o: extern; P: Permeabilität der Membran für Ion S, gemessen in m·s−1; V: Transmembranpotential in Volt; F: Faraday-Konstante, gleich 96.485 C·mol-1 oder J· V−1·mol−1; R: Gaskonstante, gleich 8,314 J· K−1·mol−1; T: absolute Temperatur, gemessen in Kelvin (= °C + 273,15).
Es kann passive Stromkomponenten geben, die mit der Streuleitfähigkeit und spezifischen Ionenkanälen in Endolysosomen verbunden sind. Der Ableitstrom ist durch eine lineare Strom- (I)-Spannungsbeziehung (V) gekennzeichnet, wobei der Schnittpunkt am Ursprung liegt. Die Leckströme von Endolysosomen, die aus nicht transfizierten HEK293-Zellen isoliert wurden, betragen weniger als 50 pA bei 100 mV; Bei den darunter liegenden Ionenkanälen handelt es sich wahrscheinlich um Kalium/Natrium-Leitfähigkeitskanäle und Chloridkanäle.
Bei spannungsaktivierten Ionenkanälen können Ableitstromanteile im gemessenen Strom subtrahiert werden, indem eine Reihe von skalierten Spannungsimpulsen vor oder nach den spannungsgesteuerten endolysosomalen Takten aufgezeichnet wird. Leckagen können auch offline abgezogen werden. Die Amplitude dieser skalierten Pulse beträgt typischerweise ein Viertel oder ein Fünftel der experimentellen Pulsamplitude, ein Prozess, der als P/4- oder P/5-Lecksubtraktion11 bekannt ist. Aufgrund der sehr geringen Größe der Ableitströme wird in der Regel keine P/4- oder P/5-Subtraktion verwendet.
Spannungs-Zange
Durch wiederholtes Anlegen von schrittweisen Sprüngen in der Eingangsspannung kann der Strom über die endolysosomale Membran aufgezeichnet werden, wenn sich die Spannung ändert. Dies hilft bei der Bestimmung, ob es sich bei dem Kanal um einen spannungsgesteuerten Ionenkanal12 handelt. Neben der Spannungszange ist auch eine Stromzange realisierbar. Die Einkanalaktivität kann mit den verfügbaren Konfigurationen im Spannungsklemmenmodus12 aufgezeichnet werden. Die typischerweise geringe Dichte von endolysosomalen Ionenkanälen kann den Prozess der Gewinnung von Pflastern mit einem einzigen Kanal behindern. Dickwandiges Pipettenglas ist das beste Material für die Herstellung von Elektroden mit kleinen Pipettenspitzen und geringer Kapazität. Durch das Beschichten des Glases mit Sylgard oder Wachs kann die Pipettenkapazität verringert werden.

Abbildung 1: Übersicht der endolysosomalen Patch-Clamp-Schritte. Das Protokoll zur Beurteilung der Ionenkanalaktivität in intrazellulären Vesikeln mit einem manuellen endolysosomalen Patch-Clamp-System kann in einem Flussdiagramm mit den folgenden Schlüsselschritten skizziert werden: (1) Lösungsvorbereitung: Assemblieren Sie alle erforderlichen chemischen Lösungen. (2) Zellvorbereitung: Züchten Sie die Zellen und bereiten Sie sie für die endolysosomale Extraktion vor. (3) Pipettenherstellung: Erstellen und polieren Sie die Patch-Clamp-Pipette, um eine präzise Handhabung zu gewährleisten. (4) Isolierung von Endolysosomen: Trennen Sie die Endolysosomen manuell von den kultivierten Zellen. (5) Vesikel-Patching: Befestigen Sie die Pipette an einem einzelnen endolysosomalen Vesikel. (6) Signalerfassung: Erfassen und verstärken Sie elektrische Signale vom Vesikel. (7) Signaldigitalisierung: Wandeln Sie die analogen Signale zur Analyse in eine digitale Form um. (8) Datenerfassung und -analyse: Sammeln Sie die Daten und interpretieren Sie sie, um die Funktion der Ionenkanäle zu untersuchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Aufbau der elektrophysiologischen Hardware. Bei der Doppelelektrodenmessung berührt die Messelektrode die Zielmembran, während die Referenzelektrode in der Badlösung platziert wird. Die Potentialdifferenz zwischen den beiden wird vom Verstärker verstärkt, vom Digitalisierer digitalisiert und dann vom Computer erfasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
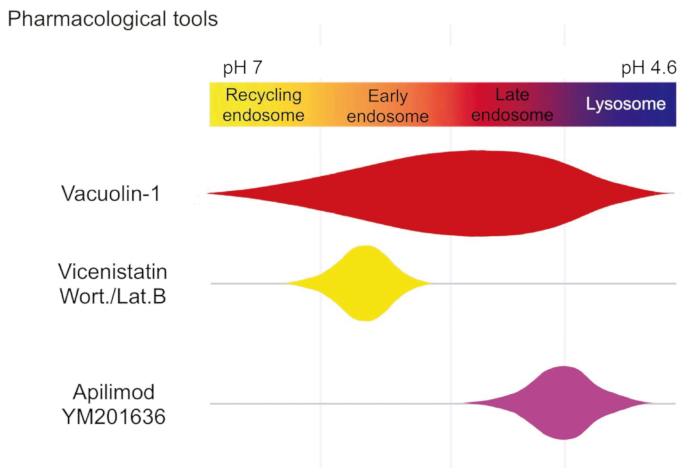
Abbildung 3: Pharmakologische Werkzeuge für die endolysosomale Patch-Clamp-Analyse. Schematische Darstellung der Wirkungsbereiche verschiedener pharmakologischer Wirkstoffe für Patch-Clamp. Die Kombination von Wortmannin und Latrunculin B ist hochspezifisch für frühe Endosomen, mit Ausnahme von Recycling-Endosomen. YM201636 vergrößert selektiv späte Endosomen/Lysosomen. Vacuolin vergrößert frühe Endosomen, Recycling-Endosomen sowie späte Endosomen/Lysosomen13. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Isolierung vergrößerter Organellen. Eine schematische Darstellung des manuellen Isolierungsprozesses eines Zielvesikels aus einer Zelle. Die Schritte sind wie folgt: (1) Vorbereitung des Deckglases: Die Zielzelle, die das Zielvesikel enthält, wird auf ein Deckglas gelegt. (2) Plasmamembran zerschneiden: Die Plasmamembran der Zielzelle wird mit einer Isolationspipette auseinandergeschnitten. (3) Isolationspipette: Die Isolationspipette ist so positioniert, dass sie auf das Vesikel abzielt. (4) Drücken Sie das Zielvesikel außerhalb der Zelle: Das Zielvesikel wird mit der Isolationspipette vorsichtig außerhalb der Zelle zusammengedrückt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
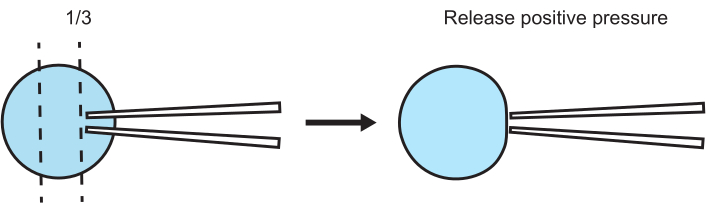
Abbildung 5: Empfohlene relative Position zwischen Patch-Pipette und Vesikel für die Gigasealbildung. Nachdem Sie positiven Druck ausgeübt haben, nähern Sie sich der Organelle von oben mit der Patch-Pipette. Positionieren Sie die Spitze etwa ein Drittel des Weges von der Oberseite der Organelle entfernt und senken Sie die Patch-Pipette langsam (Modus 3-6) ab, bis sich die Organellenmembran durch den positiven Druck bewegt. Unter dem Mikroskop muss die Organelle rollen oder von der Spitze weggeschoben werden. Lassen Sie in diesem Moment den Überdruck ab und warten Sie, bis sich das Gigasiegel gebildet hat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Arten von Konfigurationen. Abhängig von der Kontaktmethode zwischen der Pipette und der Organelle gibt es vier verschiedene Messmodi: Organellen- oder Vesikel-Attached, Ganzvesikel, Inside-Out und Outside-Out. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Ströme zur Berechnung des Pipettenwiderstands, des Dichtungswiderstands, des Serienwiderstands und der Zellkapazität. Die Aufzeichnungspipette wird in der Badlösung positioniert, und ein rechteckiger Spannungsimpuls (5 ms Dauer, 5 mV) erzeugt einen nahezu rechteckigen Stromgang. Der Widerstand der Pipette kann bestimmt werden, indem die angelegte Spannung durch den gemessenen Strom dividiert wird. Da der Gigaseal im lysosomengebundenen Modus gebildet wird, nimmt die Stromreaktion schnell ab. Der Dichtungswiderstand kann berechnet werden, indem die Spannung durch den verbleibenden, sehr kleinen Strom dividiert wird. Wenn ein ZAP-Impuls angelegt wird, reißt die Membran schnell, was zu einem Anstieg der kapazitiven Ströme führt und den Übergang zur gesamtendolysosomalen Konfiguration signalisiert. Bei einem sphärischen Endolysosom folgt der resultierende Strom einer einzigen Exponentialfunktion der Zeit. Der Serienwiderstand wird bestimmt, indem die kapazitive Stromamplitude durch die Befehlsspannung dividiert wird, und die Kapazität des Endolysosoms wird berechnet, indem die Zeitkonstante der kapazitiven Ströme durch den Serienwiderstand12 dividiert wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Ströme, die während der Rampenaufzeichnung beobachtet wurden (z. B. TPC2). Hierbei handelt es sich um ein Strom-Spannungs-Beziehungsdiagramm (I-V), wobei die X-Achse die Spannung im Bereich von -100 bis +100 mV darstellt und die Y-Achse den bei unterschiedlichen Spannungen erzeugten Strom angibt. Das Diagramm verwendet als Beispiel Messungen aus dem TPC2-Kanal. Die schwarze Linie zeigt die Ergebnisse, die direkt nach dem Anlegen des ZAP-Impulses erzielt wurden, die rote Linie stellt den Strom dar, der erzeugt wird, wenn der TPC2-Kanal durch den Agonisten TPC2-A1N aktiviert wird, und die grüne Linie zeigt den Leckstrom an, der aus einer unvollständigen Abdichtung resultieren kann. Eine erfolgreiche Messung lässt sich nicht nur an der Erfassung der Form des Kanals, sondern auch an der Abwesenheit von Leckströmen erkennen. Wenn Leckströme vorhanden sind, liegt der Schnittpunkt des Stroms und der X-Achse bei 0 und bildet eine gerade Linie (mit unterschiedlichen Ionen innerhalb und außerhalb der Membran). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Endolysosomale Patch-Pipette | Ganzzell-Patch-Pipette | |||||||
| Zyklus | WÄRME | ZIEHEN | VEL | ZEIT | WÄRME | ZIEHEN | VEL | ZEIT |
| 1 | Wert bestimmt durch das Rampenprotokoll +10 | Leer | 30 | 150 | Wert bestimmt durch das Rampenprotokoll +10 | Leer | 40 | 150 |
| 2 | 30 | 150 | 40 | 150 | ||||
| 3 | 30 | 150 | 40 | 150 | ||||
| 4 | 30 | 150 | 40 | 150 | ||||
| 5 | Wert bestimmt durch Rampenprotokoll +25 | 18 | 150 | - | - | |||
| 6 | Wert bestimmt durch Rampenprotokoll +20 | 15 | 150 | - | - | |||
Tabelle 1: Protokoll zum Ziehen der Patchpipette. Verwenden Sie zuerst die Rampenfunktion, um die geeignete HEAT-Temperatur zu finden, und folgen Sie dann der Tabelle, um die sechs Zugzyklen anzupassen.
| Unspezifische Endolysosomen (Vacuolin-1) / spezifisches LE/LY (YM201636) | Makrophage | 1 μM / 0,4 μM | 1-2 h / 1-3 h |
| COS-1, HEK293, Hela, Fibroblast usw. | 1 μM / 0,4 μM | Übernachtung / Übernachtung | |
| Kardiomyozyten, Skelettmuskelzellen | 5 μM | 24-48 h |
Tabelle 2: Die Konzentration und Behandlungsdauer, die erforderlich ist, um Endolysosomen in verschiedenen Zelltypen mit pharmakologischen Wirkstoffen zu vergrößern. Verschiedene Zelltypen weisen signifikante Unterschiede in ihrer Vergrößerungseffizienz unter medikamentöser Behandlung auf. Im Allgemeinen benötigen Zellen mit einem aktiveren endolysosomalen System kürzere Behandlungszeiten. Der optimale Behandlungszeitpunkt und die optimale Konzentration müssen jedoch noch experimentell bestimmt werden13.
Diskussion
Elektrophysiologische Versuchsaufbauten haben vier Hauptanforderungen an das Labor: i) Umgebung: Methoden, um die Probe gesund zu halten; ii) Optik: Methoden zur Visualisierung der Probe; iii) Mechanik: Methoden zur stabilen Positionierung der Mikroelektrode; und iv) Elektronik: Methoden zur Verstärkung und Aufzeichnung des Signals.
Für die erfolgreiche Durchführung endolysosomaler Patch-Clamp-Experimente sind mehrere wichtige Schritte entscheidend. Erstens, der Zustand der Zellen - die Zellen müssen fest mit dem Deckglas verbunden sein, damit sich die gesamte Zelle nicht bewegt, wenn die Isolierpipette zum Aufbrechen der Zellen verwendet wird. Es ist wichtig, dass die Zellen gesund und gut verteilt sind. Wenn die Zellen nicht fixiert bleiben können, kann der Wechsel zu einer entsprechenden Beschichtung auf dem Deckglas hilfreich sein. Zusätzlich muss die Zelldichte überwacht werden. Wenn die Zelldichte zu hoch ist (mehr als 90 %), nimmt die Wirksamkeit der medikamenteninduzierten Organellenvergrößerung ab, was die Durchführung von Experimenten erschwert. Zweitens muss die Qualität der Patch-Pipette – die Spitze der Patch-Pipette muss eine angemessene Größe (5-8 MΩ) haben, und das Glas sollte auf beiden Seiten glatt und parallel sein.
Drittens, während der Bildung eines Gigaseals, wenn es sich nicht unmittelbar nach dem Ablassen des Überdrucks bildet, kann das Anwenden eines moderaten Unterdrucks hilfreich sein. Sobald sich jedoch der Gigaseal bildet, muss der Unterdruck sofort abgelassen werden, um die Gefahr zu vermeiden, dass das gesamte Vesikel in die Pipette gesaugt wird. Darüber hinaus muss bei der Durchführung einer Ganzendolysosomen-Patch-Klemme ein kleiner Teil der Membran aufgerissen werden. Aufgrund des Fehlens eines Zytoskeletts in Endolysosomen sind sie sehr zerbrechlich und werden oft instabil, was dazu führt, dass Teile in die Pipette gesaugt werden. In diesem Fall kann es hilfreich sein, einen leichten Überdruck auszuüben, um das abgesaugte Teil herauszudrücken. Wenn die Kapazität der verbleibenden Organelle an der Pipettenspitze weniger als 1 pF beträgt, deutet dies darauf hin, dass nur noch sehr wenig Membran vorhanden ist, die wahrscheinlich die interessierenden Kanäle nicht enthält. In solchen Fällen wird empfohlen, ein neues Vesikel auszuprobieren. Vermeiden Sie schließlich beim Hinzufügen von Medikamenten einen direkten Schlag auf die Pipettenspitze, da ein schneller Flüssigkeitsfluss die Gigadichtung stören kann. Darüber hinaus sollte der Experimentator beim Eindringen in den Faradayschen Käfig ausreichend geerdet sein, um übermäßige Rauschsignale zu vermeiden, die die Beobachtung wertvoller Ergebnisse behindern können.
Derzeitige Aufzeichnungen mit der gesamten endolysosomalen Struktur stellen eine Herausforderung dar, da Faktoren auf beiden Seiten der endolysosomalen Membran verloren gehen können, was möglicherweise zu Veränderungen der Gating-Eigenschaften während der Aufzeichnungen führt. Erstens können zeitabhängige Änderungen der Stromeigenschaften durch die Verdünnung oder den Verlust spezifischer Regulatoren (kleine Moleküle oder andere Faktoren) durch die Pipettenlösung im lysosomalen Lumen resultieren. Darüber hinaus könnten Komponenten der Pipette oder der zytosolischen Lösung spezifische Second-Messenger-Signalwege modulieren, die endolysosomale Ionenkanäle regulieren. Die Kombination des endolysosomalen Attached-Modus mit perforierten Patch-Techniken wäre ideal, um spezifische Probleme zu lösen, die sich aus der luminalen Seite der endolysosomalen Membran ergeben.
Zweitens können bei endolysosomalen Patch-Clamp-Aufzeichnungen kleine Moleküle oder Faktoren, die mit der zytosolischen Seite der endolysosomalen Membran verbunden sind, weggespült werden, da die zytosolische Seite der Membran (zytosolische Lösung) ausgesetzt ist. Es wurde gezeigt, dass ATP TPC von der zytosolischen Seite der Membran blockiert14. Eine sorgfältige Gestaltung der Badlösung (z. B. die Sicherstellung, dass kein ATP in der zytosolischen Aufzeichnungslösung enthalten ist) kann dieses spezielle Problem minimieren. Das Ausführen zeitabhängiger Kontrollen und das Initiieren spezifischer Protokolle zu einem konsistenten Zeitpunkt nach der Einrichtung von Konfigurationen für die gesamtendolysosomale Aufzeichnung können ebenfalls helfen, dieses Problem zu lösen. Ein weiteres Problem könnte der Verlust von regulatorischen Proteinen sein, die mit endolysosomalen Ionenkanälen durch Auswaschen verbunden sind. Sind diese regulatorischen Faktoren Teil einer Signalkaskade, könnte die physiologische Regulation der endolysosomalen Kanäle verloren gehen.
Obwohl die endolysosomale Patch-Clamp derzeit die am häufigsten verwendete elektrophysiologische Technik zur Untersuchung endolysosomaler Ionenkanäle ist, erfordert sie in der Regel die Vergrößerung von Vesikeln und die manuelle Isolierung ausgewählter Vesikel. Diese Einschränkung ist den elektrophysiologischen Techniken inhärent, die auf Kapillarglaselektroden basieren. Das Fehlen eines Zytoskeletts zur Aufrechterhaltung der Organellenstabilität und die Interferenz durch intrazelluläre Filamente sind nach wie vor die Hauptgründe für die geringe Erfolgsrate dieser Experimente. Abgesehen von der Anhäufung von Erfahrungen durch Elektrophysiologen könnten zukünftige Fortschritte bei fortschrittlichen optischen Systemen und hochpräzisen fluoreszierenden niedermolekularen Werkzeugen die Messung der Ionenkanalaktivität in einzelnen Organellen innerhalb einzelner Zellen ermöglichen.
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen oder andere Interessenkonflikte.
Danksagungen
National Science and Technology Council, Taiwan (MOST 110-2320-B-002-022), National Taiwan University (NTU-112L7818) und die National Health Research Institutes, Taiwan (NHRI-EX112-11119SC).
Materialien
| Name | Company | Catalog Number | Comments |
| BOROSILICATE GLASS | SUTTER INSTRUMENT | BF150-75-10 | O.D.:1.5 mm, I.D. 0.75 mm 10 cm length, with filament |
| Digidata 1140A | Axon Instruments | ||
| Inverted microscope IX73 | OLYMPUS | ||
| MODEL P-97 micropipette puller | SUTTER INSTRUMENT | ||
| MPC-200 | SUTTER INSTRUMENT | ||
| MultiClamp 700B | Axon Instruments | ||
| POLISHER | |||
| Quick Release Chamber | Warner instruments | 641943 | QR-40LP, for 25 mm Coverslips |
Referenzen
- Cullen, P. J., Steinberg, F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nat Rev Mol Cell Biol. 19 (11), 679-696 (2018).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Kumar, P., Kumar, D., Jha, S. K., Jha, N. K., Ambasta, R. K. Ion channels in neurological disorders. Adv Protein Chem Struct Biol. 103, 97-136 (2016).
- Brailoiu, E., et al. An ancestral deuterostome family of two-pore channels mediates nicotinic acid adenine dinucleotide phosphate-dependent calcium release from acidic organelles. J Biol Chem. 285 (5), 2897-2901 (2010).
- Pitt, S. J., et al. TPC2 is a novel NAADP-sensitive Ca2+ release channel, operating as a dual sensor of luminal pH and Ca2+. J Biol Chem. 285 (45), 35039-35046 (2010).
- Gerndt, S., et al. Agonist-mediated switching of ion selectivity in TPC2 differentially promotes lysosomal function. Elife. 9, e54712 (2020).
- She, J., Guo, J., Jiang, Y., Wahl-Schott, C., Biel, M. Structure and function of plant and mammalian TPC channels. Endolysosomal voltage-dependent cation channels. , 155-180 (2023).
- Hu, M., et al. Parkinson's disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes. Cell. 185 (13), 2292-2308.e20 (2022).
- Grimm, C., Bartel, K., Vollmar, A. M., Biel, M. Endolysosomal cation channels and cancer: A link with great potential. Pharmaceuticals (Basel). 11 (1), 4 (2018).
- Gasnier, B., Zhu, M. X. . Ion and molecule transport in lysosomes. , (2020).
- Hernández-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca2+ release in adult skeletal muscle fibres. Prog Biophys Mol Biol. 108 (3), 98-118 (2012).
- Chen, C. C., et al. Patch-clamp technique to characterize ion channels in enlarged individual endolysosomes. Nat Protoc. 12 (8), 1639-1658 (2017).
- Chen, C. C., et al. Small molecules for early endosome-specific patch clamping. Cell Chem Biol. 24 (7), 907-916.e4 (2017).
- Cang, C., et al. mTOR regulates lysosomal ATP-sensitive two-pore Na+ channels to adapt to metabolic state. Cell. 152 (4), 778-790 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten