Method Article
Bibliothèque ATAC-Seq Préparation de neutrophiles dérivés de la moelle osseuse murine
Dans cet article
Résumé
Ce manuscrit décrit un protocole pour la préparation d’une banque ATAC-seq de neutrophiles à partir de moelle osseuse murine, visant à garantir une viabilité optimale des neutrophiles et une qualité de bibliothèque élevée. Il offre des instructions étape par étape sur la préparation des BMC, le tri immunomagnétique et la construction de bibliothèques, servant de guide précieux, en particulier pour les nouveaux venus dans l’étude des neutrophiles.
Résumé
Le dosage de la chromatine accessible à la transposase avec séquençage (ATAC-seq) est une technique puissante et à haut débit pour évaluer l’accessibilité de la chromatine et comprendre la régulation épigénomique. Les neutrophiles, en tant que type de leucocyte crucial dans les réponses immunitaires, subissent des modifications architecturales substantielles de la chromatine au cours de la différenciation et de l’activation, ce qui a un impact significatif sur l’expression des gènes nécessaires à leurs fonctions. L’ATAC-seq a joué un rôle déterminant dans la découverte de facteurs de transcription clés dans la maturation des neutrophiles, la révélation de signatures épigénomiques spécifiques aux agents pathogènes et l’identification de cibles thérapeutiques pour les maladies auto-immunes. Cependant, la sensibilité des neutrophiles au milieu externe complique la production de données ATAC-seq de haute qualité. Ici, nous proposons un protocole évolutif pour la préparation de banques ATAC-seq à partir de neutrophiles dérivés de la moelle osseuse de rongeurs, avec une séparation immunomagnétique améliorée pour assurer une viabilité cellulaire optimale et des banques de haute qualité. Les éléments vitaux ayant un impact sur la qualité de la bibliothèque et les principes d’optimisation pour l’extension méthodologique sont discutés en détail. Ce protocole soutiendra les chercheurs qui souhaitent étudier l’architecture de la chromatine et la reprogrammation épigénomique des neutrophiles, faisant ainsi progresser les études en immunologie fondamentale et clinique.
Introduction
Les neutrophiles sont l’un des types de cellules immunitaires les plus abondants et les plus cruciaux chez les vertébrés, constituant 50 à 70 % des leucocytes humains1. Les neutrophiles jouent un rôle central dans la détection et l’élimination des micro-organismes chez les hôtes. Lors du sepsis, les neutrophiles matures sont parmi les premiers intervenants2. Ils se mobilisent rapidement vers les sites d’infection via la chimiotaxie3, où ils combattent les agents pathogènes en ingérant des micro-organismes (phagocytose), en produisant des espèces réactives de l’oxygène dépendantes de la NADPH oxydase (sursauts respiratoires), en sécrétant des granules (dégranulation) et en formant des pièges extracellulaires neutrophiles (TNE) qui attrapent et tuent les bactéries extracellulaires une fois qu’elles arrivent au site d’inflammation4. Les neutrophiles immatures sont également rapidement mobilisés de la moelle osseuse dans la circulation périphérique par les chimiokines 5,6. Ces neutrophiles attirés par le site infectieux libèrent également des cytokines, qui sont impliquées dans plusieurs processus physiologiques, tels que l’hématopoïèse, l’angiogenèse et la cicatrisationdes plaies 7,8. Les patients atteints de maladies congénitales ou acquises qui entraînent une diminution du nombre de neutrophiles sont plus sensibles aux infections 9,10. Cependant, l’activation des neutrophiles est une arme à double tranchant. Une activation excessive et une libération excessive de cytokines peuvent causer des lésions aux tissus et aux organes, entraînant un dysfonctionnement de plusieurs organes si les infections ne sont pas rapidement contrôlées11,12. De plus, les neutrophiles contribuent également à diverses maladies inflammatoires et auto-immunes et peuvent influencer la progression du cancer et les métastases13,14. Cela souligne la nécessité d’étudier la régulation de l’activité des neutrophiles pour équilibrer une réponse immunitaire efficace et prévenir les dommages à l’hôte.
Dans les neutrophiles, l’architecture de la chromatine subit des changements distincts et dynamiques dans leur différenciation, migration et activation, exerçant des rôles régulateurs essentiels tout au long de la vie cellulaire. Ce voyage, du grand noyau rond et riche en euchromatine des myéloblastes à un noyau plus découpé dans les myélocytes et les métamyélocytes, puis à des cellules en bande en forme de C ou de S et fortement lobées avec une chromatine densément tassée dans les neutrophiles polynucléaires15,16, témoigne de la complexité de la biologie des neutrophiles. La configuration spécialisée de la chromatine assure l’expression sélective des gènes essentiels à la fonction des neutrophiles, tels que ceux impliqués dans la production de granules et les réponses transcriptionnelles rapides nécessaires à l’élimination efficace des agents pathogènes17. Lorsque les neutrophiles sont mobilisés vers des sites inflammatoires via la chimiotaxie, la migration transendothéliale exerce une pression sur le complexe de liaison du complexe nucléosquelette/cytosquelette (LINC), provoquant un remodelage de la chromatine et un potentiel d’activation plus élevé18. Dans le sepsis, les neutrophiles activés présentent un « décalage nucléaire-gauche », avec une morphologie anormale de la chromatine, comme des noyaux bilobés ou non lobés et une condensation de la chromatine significativement plus lâche19. Il en résulte une accessibilité accrue dans les régions génétiques associées à la réponse inflammatoire, induisant ainsi une expression significative de ces gènes. Si les infections ne sont pas correctement contrôlées, la citrullination des histones et la déconstruction ultérieure de la chromatine sont nécessaires pour former des TNE20,21. Par conséquent, la compréhension de l’architecture de la chromatine des neutrophiles est cruciale pour faire progresser la biologie des neutrophiles et développer des traitements contre les maladies inflammatoires et auto-immunes, offrant ainsi de l’espoir pour le traitement futur des maladies.
L’accessibilité de la chromatine sert de mesure de l’architecture de la chromatine au niveau épigénomique. Il indique comment les régions génomiques sont physiquement admissibles aux amplificateurs, aux promoteurs, aux isolants et aux facteurs de liaison à la chromatine et comment ces éléments influencent l’expression des gènes22. Le dosage de la chromatine accessible par transposase avec séquençage (ATAC-seq) est une technique largement utilisée pour évaluer l’accessibilité de la chromatine dans le génome23. Il ne nécessite pas de connaissance préalable des éléments régulateurs, ce qui en fait un outil puissant pour la recherche épigénétique. Cette méthode consiste à isoler les noyaux d’échantillons, à fragmenter l’ADN génomique par la transposase Tn5 et à ajouter des amorces de séquençage pour la préparation de la banque, le séquençage et l’analyse des données23. ATAC-seq a joué un rôle déterminant dans l’étude de la cartographie des nucléosomes, de l’analyse de la liaison des facteurs de transcription, des mécanismes de régulation dans divers types de cellules ou maladies, de l’identification de nouveaux amplificateurs, de la découverte de biomarqueurs, etc.22,23. Il est souvent combiné à d’autres techniques, telles que le séquençage de l’ARN, pour une analyse complète de l’expression des gènes.
ATAC-seq a fait progresser nos connaissances sur la biologie des neutrophiles en découvrant des mécanismes épigénétiques précis dans la santé et la maladie. Il a révélé plusieurs facteurs de transcription clés (c’est-à-dire RUNX1, KLF6, PU.1, etc.) dans la maturation des neutrophiles et les réponses effectrices24,25, découvert des signatures spécifiques à l’agent pathogène avec un potentiel de biomarqueur dans le sepsis26, élucidé les mécanismes épigénomiques de la mémoire immunitaire innée12 et identifié des cibles thérapeutiques dans la leucémie myéloïde aiguë (LMA) pédiatrique27. Cependant, en tant que composant cellulaire important dans la surveillance immunitaire, les neutrophiles présentent une grande sensibilité à leur milieu externe et posent donc un défi pour produire des données ATAC-seq de haute qualité. Dans des circonstances physiologiques, la demi-vie médiane des neutrophiles humains est de 3,8 jours, tandis que la demi-vie moyenne des neutrophiles de souris est de 12,5 h. Il convient de noter que leur demi-vie est considérablement plus courte lorsqu’ils sont étudiés in vitro28,29. Lors de l’exploitation in vitro de neutrophiles isolés, l’exposition à des micro-organismes ou à des modèles moléculaires associés à des agents pathogènes (PAMP), ainsi que des procédures expérimentales redondantes et des opérations difficiles, peuvent entraîner une activation aberrante des neutrophiles et une diminution de la viabilité cellulaire due à l’apoptose ou à la NETose. Les cellules décédées abritent généralement des quantités importantes d’ADN non chromatinisé très sensible au Tn5, ce qui augmente par conséquent le bruit de fond de l’ATAC-seq23.
Ici, nous proposons un protocole évolutif pour la préparation de banques ATAC-seq optimisées pour les neutrophiles dérivés d’échantillons de moelle osseuse de rongeurs. La figure 1 présente un aperçu graphique du protocole, qui comprend la séparation immunomagnétique des neutrophiles de la moelle osseuse, suivie de l’ATAC-seq. L’amélioration du tri immunomagnétique garantit la viabilité optimale des neutrophiles avant l’extraction du noyau pour la bibliothèque ATAC-seq, garantissant ainsi la haute qualité des banques et facilitant l’intégration d’évaluations supplémentaires des neutrophiles dans le schéma. La mise en œuvre de ce protocole aidera les chercheurs à comprendre les caractéristiques de l’architecture de la chromatine et les mécanismes de reprogrammation épigénomique des neutrophiles lorsqu’ils sont exposés à divers défis microenvironnementaux. On s’attend à ce que cela ait de vastes applications dans les études d’immunologie fondamentale et clinique.
Protocole
Toutes les procédures animales présentées ci-dessous étaient conformes aux directives et réglementations nationales en matière d’éthique et de bien-être animal, qui ont été approuvées par le Comité d’éthique de la recherche sur les soins aux animaux de la Capital Medical University, Pékin, Chine (sjtkl11-1x-2022(060)).
1. Préparation des suspensions de cellules de moelle osseuse (BMC)
- Sélectionnez des souris mâles C57BL/6J âgées de 6 à 8 semaines pesant de 19 à 21 g. Euthanasier les souris à l’aide d’une chambre de CO2 , suivie d’une luxation cervicale après la disparition du réflexe profond. Désinfectez-les avec un spray d’éthanol à 70 % sur un tapis de dissection.
- À l’aide de petits ciseaux et de pinces, séparez soigneusement le fémur de l’articulation de la hanche et du tibia, retirez la peau et le muscle squelettique attachés, et rincez le fémur avec une solution saline tamponnée au phosphate froid (PBS) dans une boîte de Pétri de 10 cm.
- Coupez les épiphyses du fémur, insérez doucement une aiguille de 28 G attachée à une seringue de 2 ml dans la cavité de la moelle osseuse et rincez la moelle osseuse avec du PBS froid contenant 2 % de sérum de veau fœtal (FBS).
- Répétez l’étape précédente jusqu’à ce que le liquide rouge foncé rincé devienne translucide. Trois récoltes sont généralement nécessaires.
REMARQUE : Évitez d’insérer l’aiguille trop profondément dans la cavité de la moelle osseuse pour assurer une acquisition cellulaire optimale. - À l’aide d’une crépine cellulaire de 70 μm, filtrer la suspension cellulaire dans un tube de tri cellulaire activé par fluorescence (FACS) (5 mL).
- Lyser les érythrocytes dans les BMC avec un tampon de lyse érythrocytaire commercial sans polyformaldéhyde.
- Centrifugez le tube à 500 x g pendant 5 min à 25 °C, retirez délicatement le surnageant en laissant environ 100 μL de liquide au fond, et tapotez doucement le tube pour détacher la pastille.
- Ajouter 2 mL de tampon de lyse, dilué à partir du tampon de lyse érythrocytaire (10x), et mélanger en retournant le tube trois fois. Ensuite, centrifugez le tube à 500 x g pendant 5 min, jetez le surnageant et remettez en suspension la pastille cellulaire en tapotant doucement.
- Lavez les cellules deux fois avec un milieu RPMI 1640 contenant 10 % de FBS et mettez-les en suspension dans un volume de 2 ml.
REMARQUE : Lorsqu’il s’agit d’amas de cellules non dispersées, il est recommandé d’utiliser une pointe de pipette de 200 μL pour les prélever au lieu de filtrer les suspensions cellulaires à travers une crépine de cellules de 70 μm. Cette méthode peut réduire la perte de cellules.
- Calculez la viabilité cellulaire et le nombre total de cellules vivantes par échantillon avec la coloration au bleu de trypan.
2. Marquage immunomagnétique des neutrophiles avec des billes magnétiques anti-Ly6G
- Remettre en suspension les cellules de la moelle osseuse (~2 x 10,7 cellules vivantes par souris) dans 2 mL de milieu RPMI 1640 contenant 10 % de FBS et centrifuger à 500 x g pendant 5 min à 25 °C.
REMARQUE : Étant donné l’exigence limitée de 1 x 105 cellules pour l’ATAC-seq, les neutrophiles excédentaires peuvent être alloués à des analyses épigénomiques supplémentaires (par exemple, ChIP-seq et Hi-C) ou à des évaluations de la fonction immunitaire (par exemple, production de cytokines, phagocytose et TNE) à l’aide de neutrophiles obtenus à partir de la même souris. - Aspirez la majeure partie du surnageant, laissant derrière vous environ 100 μL, et tapotez doucement le tube pour détacher la pastille.
- Ajoutez 30 μL de billes Ly6G et mélangez avec les BMC en tapotant doucement.
REMARQUE : Les billes magnétiques doivent être tourbillonnées pendant au moins 10 secondes avant d’être utilisées. Suite à l’ajout des billes aux BMC, il est recommandé de s’abstenir de vortex. - Incuber le tube à 25 °C pendant 15 min.
- Ajouter 2 mL de PBS pour remettre en suspension les billes et les cellules, puis centrifuger à 500 x g pendant 5 min à 25 °C.
- Aspirez la majeure partie du surnageant, laissant derrière vous environ 100 μL, et tapotez doucement le tube pour détacher la pastille. Ajouter du PBS supplémentaire pour un volume final de 1 ml.
REMARQUE : Lorsqu’il s’agit d’amas de cellules non dispersées, il est recommandé d’utiliser une pointe de pipette de 200 μL pour les prélever au lieu de filtrer les suspensions cellulaires à travers une crépine de cellules de 70 μm. Cette méthode peut réduire la perte de cellules.
3. Séparation des neutrophiles avec tri cellulaire immunomagnétique
- Prétraiter la colonne MS avec du PBS.
- Positionnez la colonne MS dans le champ magnétique d’un séparateur de tri de cellules activé par magnétisme (MACS) compatible. Placez un tube inoccupé de 5 mL sous le fluide qui s’écoule de la colonne MS.
- Rincez la colonne avec 500 μL de PBS. Répétez cette étape après le flux complet de PBS dans la colonne MS.
REMARQUE : Le PBS doit s’écouler progressivement, goutte à goutte, dans le tube de tri cellulaire activé par fluorescence (FACS) de 5 mL via la colonne MS. Assurez-vous qu’aucun air ne pénètre dans la colonne, car les bulles d’air peuvent obstruer la colonne.
- Appliquez la suspension BMC étiquetée magnétiquement sur la colonne MS en ajoutant 500 μL à la fois, en la remplissant immédiatement une fois que le réservoir de la colonne est vide.
REMARQUE : Assurez-vous que les suspensions cellulaires sont dépourvues de masse cellulaire. Au besoin, placez un nouveau tube FACS de 5 mL sous la colonne MS pour recueillir les cellules non marquées (p. ex. monocytes et lymphocytes) avant cette étape.
REMARQUE : Prenez note du débit de gouttelettes. Un débit lent pourrait suggérer que la colonne de tri est obstruée. - Lavez la colonne MS en ajoutant 500 μL de PBS chaque fois que le réservoir est vide, en répétant ce processus deux fois.
REMARQUE : L’ajout prématuré de PBS peut entraver l’entrée de certaines cellules dans la colonne de tri, ce qui peut compromettre la pureté du tri cellulaire. - Prélevez les neutrophiles marqués magnétiquement.
- Une fois le réservoir de la colonne épuisé, retirez-la du champ magnétique et positionnez-la soigneusement sur un tube de 5 ml.
REMARQUE : Avant de retirer la colonne, assurez-vous qu’il n’y a pas de liquide résiduel à l’intérieur de celle-ci pour éviter la perte de neutrophiles due à la décharge de gouttelettes pendant le processus. Les résidus dans la colonne peuvent être éliminés à l’aide d’une pipette. - Versez 2 ml de PBS sur la colonne, puis enfoncez immédiatement et fermement le piston dans la colonne pour expulser les neutrophiles marqués magnétiquement.
REMARQUE : Pour obtenir suffisamment de neutrophiles, assurez-vous d’un volume d’élution adéquat et restez court lorsque vous enfoncez le piston dans la colonne.
- Une fois le réservoir de la colonne épuisé, retirez-la du champ magnétique et positionnez-la soigneusement sur un tube de 5 ml.
- Utilisez un hémocytomètre pour dénombrer les cellules isolées. Identifiez la pureté des neutrophiles isolés en prélevant 100 μL de la suspension cellulaire après tri et en l’analysant par cytométrie en flux.
4. Extraction du noyau
- Centrifuger les 50 000 suspensions unicellulaires contenant les neutrophiles à 500 x g pendant 5 min à 4 °C dans un tube de 0,2 mL, puis jeter le surnageant.
- Remettre les neutrophiles en suspension dans 50 μL de tampon de lyse prérefroidi (voir le tableau 1), mélanger délicatement la solution à l’aide d’une pipette et incuber sur de la glace pendant 10 min.
REMARQUE : Si le volume de l’échantillon est inférieur à 5 μL, l’ajout direct du tampon de lyse est autorisé. La concentration en suspension cellulaire ne dépasse pas 1 x 107 cellules /mL. - Centrifuger à 500 x g pendant 5 min à 4 °C, puis jeter le surnageant et prélever le noyau. Placez le tube sur de la glace avant de commencer les procédures ultérieures.
REMARQUE : Pour minimiser la perte d’échantillon, désignez le côté de la paroi du tube où les granules s’accumulent et aspirez doucement le liquide du côté opposé lors du retrait du surnageant.
5. Marquage attaché aux nucléosomes avec transposase
- Préparez le mélange de réaction de marquage contenant la transposase Tn5 dans un tube d’amplification en chaîne par polymérase (PCR) conformément aux directives de la trousse de préparation de la bibliothèque d’ADN (voir le tableau 2) et préchauffez les billes de purification d’amplicon réfrigérées à 25 °C pendant au moins 30 min.
- Remettre le noyau des neutrophiles en suspension avec 50 μL de mélange de réaction de marquage et agiter doucement avec une pipette, suivie d’une centrifugation pendant 5 s à l’aide d’une centrifugeuse portative (~2600 x g).
- Incuber le tube réactionnel dans un instrument de PCR à 37 °C pendant 30 min.
- Ajoutez 100 μL de billes de purification d’amplicon pré-vortex au lysat, puis mélangez soigneusement les billes magnétiques dans la solution en pipetant de haut en bas 10 fois.
REMARQUE : Les billes magnétiques sont collantes et peuvent facilement se fixer aux pointes de la pipette, assurez-vous donc d’aspirer le bon volume et de les distribuer lentement à partir des pointes lors du transfert des billes. - Incuber le tube de réaction à 25 °C pendant 5 min, puis le centrifuger pendant 5 s avec une centrifugeuse portative (~2600 × g).
- Purifiez le fragment d’ADN interrompu en plaçant le tube réactionnel sur une grille magnétique jusqu’à ce que la solution devienne claire (environ 5 min). Ensuite, retirez soigneusement le surnageant sans déranger les billes magnétiques.
- Lavez la perle magnétique avec 200 μL d’éthanol à 80 % fraîchement préparé à chaque fois, tout en maintenant le tube de réaction sur la grille magnétique pendant 30 s. Évitez de déranger les billes lors de l’ajout d’éthanol. Répétez la procédure décrite à l’étape 5.7.
- Centrifugez le tube à réaction à l’aide d’une centrifugeuse portative (environ 2600 × g), aspirez l’éthanol avec des pointes de pipette de 10 μL, puis séchez les billes magnétiques pendant 3 à 5 minutes tout en ouvrant le couvercle.
REMARQUE : Les durées de séchage des billes magnétiques peuvent varier d’une région à l’autre en raison des variations des niveaux d’humidité. Les perles doivent être séchées jusqu’à ce qu’elles perdent leur éclat. Un séchage excessif peut compliquer le processus d’élution, tandis qu’un séchage inadéquat peut entraîner la présence de résidus d’alcool, ce qui a un impact sur les expériences ultérieures. De plus, le positionnement horizontal de la grille magnétique est plus propice au séchage uniforme des billes magnétiques. - Après avoir retiré le tube de réaction du rack magnétique, ajoutez 26 μL de ddH2O pour couvrir les billes magnétiques, en pipetant de haut en bas pour assurer un mélange complet. Ensuite, incuber à 25 °C pendant 2 min.
REMARQUE : Prolongez la durée d’incubation de manière appropriée si les billes magnétiques sont trop sèches. - Centrifuger brièvement le tube réactionnel à l’aide d’une centrifugeuse portative (environ 2600 × g) et séparer les billes magnétiques à l’aide d’une grille magnétique jusqu’à ce que la solution devienne claire (environ 5 min).
- Transférez avec précaution le surnageant de 24 μL dans le nouveau tube PCR.
6. Construction de bibliothèques pour le séquençage de nouvelle génération (NGS)
- Préparez le mélange réactionnel PCR dans un tube stérilisé à l’aide de fragments d’ADN purifiés et d’amorces contenant des adaptateurs de séquençage (voir le tableau 3).
- Effectuer la réaction PCR en suivant les procédures recommandées (voir le tableau 4), qui prend généralement environ 1 h.
REMARQUE : L’expérience peut être temporairement interrompue après cette procédure, et les produits PCR peuvent être conservés à -20 °C ou au moins 2 semaines. - Ajoutez 27,5 μL de billes de purification d’amplicon pré-vortex à 50 μL de produits PCR, puis mélangez soigneusement les billes magnétiques dans la solution en pipetant 10 fois de haut en bas.
REMARQUE : Le rapport incorrect entre les billes magnétiques et les produits PCR peut entraîner des écarts dans la longueur des fragments triés. Utilisez le ddH2O pour remplir le volume évaporé du produit PCR à 50 μL. Assurez-vous d’aspirer le bon volume de billes magnétiques et de les distribuer lentement à partir des pointes de la pipette pour minimiser les billes qui peuvent être attachées. - Incuber le tube de réaction à 25 °C pendant 5 min, puis le centrifuger pendant 5 s à l’aide d’une centrifugeuse à main (environ 2600 x g).
- Purifier l’ADN de la banque en plaçant le tube réactionnel sur un support magnétique jusqu’à ce que la solution devienne claire (environ 5 min). Ensuite, transférez soigneusement le surnageant dans un nouveau tube PCR stérilisé et jetez les billes magnétiques.
- Ajoutez 50 μl de billes de purification d’amplicons pré-vortex au surnageant, puis mélangez soigneusement les billes magnétiques dans la solution en pipetant de haut en bas 10 fois.
- Incuber le tube de réaction à 25 °C pendant 5 min, puis le centrifuger pendant 5 s à l’aide d’une centrifugeuse à main (environ 2600 x g).
- Placez le tube de réaction sur une grille magnétique jusqu’à ce que la solution devienne claire (environ 5 min), puis retirez délicatement le surnageant sans déranger les billes magnétiques.
- Lavez la perle magnétique deux fois avec 200 μL d’éthanol à 80 % fraîchement préparé, en maintenant le tube de réaction sur la grille magnétique pendant 30 secondes. Évitez de déranger les billes lors de l’ajout d’éthanol.
- Séchez les billes magnétiques pendant 5 min tout en ouvrant le couvercle.
- Après avoir retiré le tube de réaction de la grille magnétique, ajoutez 22 μL de ddH2O pour couvrir les billes magnétiques, en pipetant de haut en bas 10 fois pour assurer un mélange complet. Ensuite, incuber à 25 °C pendant 5 min.
- Centrifuger brièvement le tube réactionnel à l’aide d’une centrifugeuse portative (environ 2600 × g) et séparer les billes magnétiques à l’aide d’une grille magnétique jusqu’à ce que la solution devienne claire (environ 5 min).
- Transférez soigneusement le surnageant de 20 μL dans un nouveau tube PCR stérilisé et conservez-le à -20 °C.
REMARQUE : Pour obtenir une bibliothèque avec une distribution de longueur plus concentrée, envisagez d’utiliser un kit de récupération de gel pour trier le produit amplifié. Alternativement, s’il n’y a pas d’exigences spécifiques pour la plage de distribution de longueur, le produit amplifié peut être purifié directement à l’aide d’un kit de purification à billes magnétiques ou à colonne sans tri de longueur.
7. Contrôle de la qualité et séquençage de la bibliothèque
- Utilisez des plates-formes d’analyse de fragments d’ADN pour évaluer la distribution de la longueur de l’ADN de la banque.
- Utilisez les plates-formes NGS pour effectuer un séquençage à haut débit sur les bibliothèques qui ont réussi l’inspection de qualité.
Résultats
Le protocole décrit a été utilisé pour isoler les neutrophiles de la moelle osseuse de souris C57BL/6 et comparer leur variance respective dans l’accessibilité de la chromatine avant et après la stimulation par lipopolysaccharide (LPS) via ATAC-seq. En règle générale, 2 x 107 BMC peuvent être prélevés sur les deux fémurs d’une souris C57BL/6 âgée de 6 à 8 semaines, et par la suite, 2 à 5 x 106 neutrophiles peuvent être isolés. Parmi elles, 1 x 105 cellules sont utilisées pour l’ATAC-seq, tandis que les cellules excédentaires peuvent être allouées à l’analyse complète des neutrophiles.
L’immunophénotypage FACS a été adopté pour déterminer la pureté et la viabilité des neutrophiles après le tri immunomagnétique (Figure 2). Bien que la distribution de l’aire de diffusion directe (FSC-A) et de l’aire de diffusion latérale (SSC-A) puisse à elle seule fournir une estimation, une coloration spécifique des marqueurs neutrophiles a été utilisée ici pour démontrer l’effet de tri. Après le contrôle FSC-A et SSC-A, les cellules ont été contrôlées à l’aide du FSC-A et de la hauteur de diffusion vers l’avant (FSC-H) pour distinguer les cellules individuelles des cellules agrégées. Environ 99 % des cellules post-tri ont été identifiées comme uniques. Ensuite, la 7-amino-actinomycine D (7AAD), un colorant d’ADN efficacement excrété par les cellules vivantes, a été exclue pour marquer les cellules et identifier >99 % de la viabilité à partir du post-tri des cellules uniques. CD11b et CD48 ont été marqués pour identifier les cellules myéloïdes et distinguer les neutrophiles des monocytes dans les cellules myéloïdes, respectivement. Dans les BMC des souris C57BL/6, les cellules myéloïdes constituaient 46,7 % des cellules viables, les neutrophiles représentant 76,4 % de la population de cellules myéloïdes. Après le tri immunomagnétique, la pureté des neutrophiles dans les cellules viables a été vérifiée à 98,5 %, répondant ainsi aux exigences de la construction de la bibliothèque ATAC-seq.
Après avoir construit la bibliothèque ATAC-seq, l’ADN purifié a été soumis à une analyse de distribution de longueur à l’aide de l’analyseur de fragments d’ADN. Les résultats ont montré une longueur comprise entre 100 et 1000 pb sans contamination par des fragments petits ou grands (Figure 3A). Les concentrations des banques ATA-seq et les quantités des données de séquençage sont détaillées dans le tableau 5. Après avoir reçu les données de séquençage, nous avons également examiné la distribution de la longueur des fragments d’ATAC-seq (Figure 3B). Étant donné que le marquage des transposases Tn5 produit un motif de taille de signature de fragments dérivés des régions sans nucléosomes (NFR, < 100 pb), des mononucléosomes (~200 pb), des dinucléosomes (~400 pb), des trinucléosomes (~600 pb) et des oligonucléosomes plus longs provenant d’autres régions chromatiniennes ouvertes, une expérience ATAC-seq réussie devrait générer de manière coordonnée le graphique de distribution typique de la taille des fragments avec des pics décroissants périodiques correspondant à des multiples entiers de nucléosomes (Figure 3B). Les altérations des pics ATAC-seq ont généralement été identifiées pour illustrer le paysage dynamique des régions ouvertes de chromatine. Comme le montre la figure 3C, les régions où les signaux ATAC-seq ont augmenté ou diminué doivent être représentées par des cartes thermiques claires. Nous avons ensuite analysé l’accessibilité de la chromatine des gènes pour les facteurs inflammatoires qui sont principalement affectés par la stimulation du LPS, tels que IL10, Stat1, Il12a, Cxcl1 et Irak1, et nous avons constaté que ces gènes avaient une accessibilité plus élevée dans les neutrophiles stimulés par le LPS (Figure 3D). Dans l’ensemble, le contrôle de la qualité de la bibliothèque ATAC-seq que nous avons construite était satisfaisant, et les données produites étaient suffisantes pour analyser les changements épigénétiques des neutrophiles de souris après stimulation par LPS.

Figure 1 : Vue d’ensemble schématique du protocole de préparation de la bibliothèque ATAC-seq pour neutrophiles. La vue d’ensemble suit la préparation des suspensions de BMC, le marquage des neutrophiles avec des billes magnétiques anti-Ly6G, la séparation des neutrophiles par tri immunomagnétique, l’extraction du noyau des neutrophiles, le marquage attaché aux nucléosomes, la construction de la bibliothèque NGS et le séquençage. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : L’évaluation de la pureté et de la viabilité des neutrophiles à l’aide de la FACS avant et après le tri immunomagnétique. (A) Les BMC et (B) les neutrophiles isolés ont subi une coloration avec des anti-CD11b, des anti-Ly6G, des anti-CD48 et des 7AAD selon un protocole standardisé. Par la suite, les cellules uniques ont été exclues de la population cellulaire totale, à l’exclusion des cellules mortes avec 7AAD. Les cellules myéloïdes ont ensuite été contrôlées à partir de cellules vivantes, et enfin, les neutrophiles ont été séparés de la population de cellules myéloïdes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
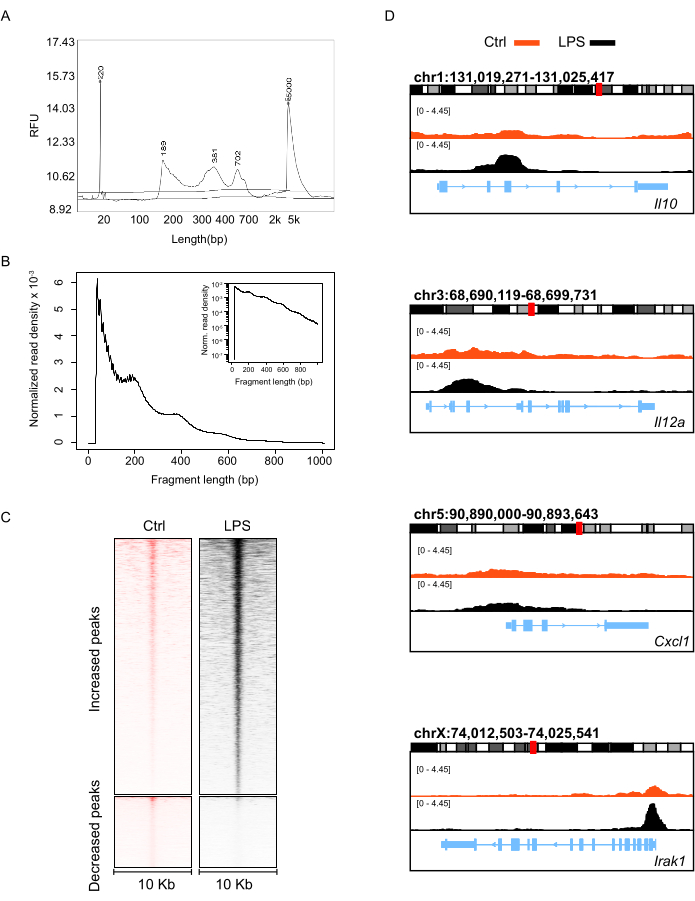
Figure 3 : Évaluation de la qualité de la banque ATAC-seq préparée à partir de neutrophiles de moelle osseuse murine. (A) La distribution de la longueur de l’ADN de la banque analysée par l’analyseur de fragments d’ADN, et (B) du fragment ATAC-seq a été déterminée par les données de séquençage. (C) Carte thermique d’empilement des régions génomiques atteignant l’accessibilité (± 10 kb autour du centre de ces pics) dans les neutrophiles non traités et stimulés par le LPS. (D) Vues IGV (Integrative Genomics Viewer) des signaux ATAC-seq au niveau de loci génétiques représentatifs correspondant à des facteurs inflammatoires, où les pics de signal rouge et noir représentent respectivement des neutrophiles non traités et stimulés par le LPS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Composant | Concentration finale |
| Tris· HCl (pH 7,4) | 10 millions d’euros |
| NaCl | 10 millions d’euros |
| MgCl2 | 3 millions d’euros |
| Igepal CA-630 | 0,1 % (v/v) |
Tableau 1 : Formulation du tampon de lyse pour l’extraction du noyau.
| Composant | Volume |
| 5x TTBL | 10 μL |
| TTE Mix V50 | 5 μL |
| jjH2O | 35 μL |
| Volume total | 50 μL |
Tableau 2 : Préparation du mélange de réaction de marquage.
| Composant | TD501 |
| Fragments purifiés d’ADN | 24 μL |
| jjH2O | - |
| 5xTAB | 10 μL |
| PPM | 5 μL |
| P5 Apprêt X* | 5 μL |
| P7 Apprêt X * | 5 μL |
| TAE | 1 μL |
| Volume total | 50 μL |
Tableau 3 : Préparation du mélange réactionnel PCR pour la construction de banques NGS.
| Escalier | Température | Heure | Cycles |
| Pré-extension | 72 °C | 3 minutes | 1 |
| Dénaturation initiale | 98 °C | 30 secondes | 1 |
| Dénaturation | 98 °C | 15 s | 14 cycles |
| Recuit | 60 °C | 30 secondes | |
| Extension | 72 °C | 30 secondes | |
| Prolongation finale | 72 °C | Durée : 5 minutes | 1 |
| Tenir | 4 °C | pour toujours |
Tableau 4 : Procédures recommandées pour la réaction PCR pour la construction de banques NGS.
| Bibliothèques | Concentration de la banque (ng/μL) | Quantité de données de séquençage brutes (paires lues) | Non. de la base de séquence (G) |
| Ctrl | 16.2 | 71409188 | 21.42 |
| LPS | 14.8 | 76453853 | 22.94 |
Tableau 5 : Aperçu des données de concentration et de séquençage de la bibliothèque ATAC-seq.
Discussion
Ce manuscrit fait état d’un protocole expérimental de préparation de banques ATAC-seq optimisées pour les neutrophiles dérivés d’échantillons de moelle osseuse de rongeurs. En raison de la grande sensibilité des neutrophiles et de leur capacité à s’activer, les efforts d’optimisation ont donné la priorité au maintien de la viabilité des neutrophiles isolés. Un traitement inapproprié peut entraîner une NETosis et d’autres formes de mort cellulaire, provoquant la libération de quantités importantes d’ADN non chromatinisé et contribuant ainsi au bruit de fond23. Nous avons simplifié la procédure avant l’extraction du noyau et choisi un tampon de lyse érythrocytaire sans polyformaldéhyde. Contrairement aux échantillons de sang périphérique, une quantité minime d’érythrocytes nécessite une brève période d’incubation des BMC avec le tampon de lyse des érythrocytes, minimisant efficacement la perte de neutrophiles tout en assurant la dissolution complète des érythrocytes. Pour minimiser les stimuli inutiles, il est impératif de préchauffer tous les réactifs à 37 °C avant l’incubation avec des BMC et de les manipuler avec le plus grand soin, en évitant des activités telles que le vortex, le filtrage répété avec des crépines cellulaires, la centrifugation prolongée avec une vitesse de rotation excessive, etc. Les améliorations apportées aux procédures ci-dessus améliorent la viabilité des neutrophiles triés, créant ainsi des conditions propices à des banques ATAC-seq de haute qualité.
Nous avons exploré trois techniques de tri largement utilisées pour obtenir des neutrophiles avec une viabilité optimale : la séparation immunomagnétique, la centrifugation par gradient de densité et le tri par cytométrie en flux. Lors de la centrifugation par gradient de densité, les neutrophiles peuvent traverser la couche de fluide de séparation, ce qui peut entraîner une pression osmotique et la formation de NET. Lors du tri par cytométrie en flux, les neutrophiles passant à travers la buse subissent des stimuli dus à la force de cisaillement mécanique. La durée du tri dépasse généralement une heure et la concentration cellulaire est diminuée après le tri, ce qui entraîne une perte de neutrophiles plus importante lors de la séparation et de la centrifugation ultérieure. Par rapport aux deux approches ci-dessus, la séparation immunomagnétique permet d’atteindre une pureté de 95 % et une viabilité de 99,5 % des neutrophiles en 30 minutes. Bien que cette méthodologie puisse entraîner des dépenses expérimentales plus élevées, nous la considérons essentielle pour obtenir des résultats de recherche fiables. À l’exception de l’ATAC-seq, la séparation immunomagnétique peut également être intégrée à d’autres expériences qui ont des critères stricts de viabilité des neutrophiles, telles que les évaluations de la fonction immunitaire (par exemple, la production de cytokines, la phagocytose, les TNE, etc.), les méthodologies « omiques » (par exemple, ChIP-seq, Hi-C, métabolomique ciblée à large spectre, etc.) et d’autres expériences de biologie moléculaire de routine. La méthodologie intégrée permet d’étudier de manière exhaustive les fonctions des neutrophiles et les mécanismes connexes sous divers angles au sein d’une seule souris.
Le protocole décrit est un schéma évolutif qui peut être étendu pour accueillir des neutrophiles de diverses espèces et de diverses sources tissulaires. Sur la base du rapport érythrocytaire dans les échantillons, il est conseillé d’optimiser au minimum la période d’incubation avec le tampon de lyse érythrocytaire tout en assurant une efficacité de dissolution suffisante. Lors du tri immunomagnétique, la quantité de billes magnétiques utilisées impacte significativement la pureté des cellules isolées. L’optimisation doit être adaptée à la quantité de cellules traitées dans les échantillons et au rapport de neutrophiles. Le maintien de la pureté des neutrophiles est l’objectif principal. Selon notre expérience, ajoutez 30 μL de perles pour 2 x 107 cellules de deux fémurs et 50 μL pour 4 x 107 cellules de deux fémurs et deux tibias. En raison de l’excellente reproductibilité entre les différents lots et de la large gamme de dosage des anticorps, l’optimisation ne doit être explorée qu’au départ. De plus, la génération de banques ATAC-seq stables et de haute qualité dépend du rapport approprié entre la transposase Tn5 et le noyau cellulaire investi30. Le montant optimal à investir est de 50 000 noyaux pour les neutrophiles dérivés de la moelle osseuse murine, avec des ajustements mineurs nécessaires pour d’autres échantillons.
Dans l’ensemble, nous proposons un schéma intégré de tri immunomagnétique des neutrophiles et de préparation de banques de suivi ATAC-seq, qui est très prometteur pour une utilisation extensive dans l’étude des neutrophiles. Il aidera les chercheurs à comprendre les caractéristiques de l’architecture chromatinienne des neutrophiles, à découvrir leurs mécanismes de régulation de la réponse inflammatoire et de la reprogrammation épigénomique en présence de divers défis microenvironnementaux, révélant ainsi des cibles thérapeutiques potentielles dans l’apparition et la progression de la maladie 12,24,25,26,27.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des subventions du programme de R&D de la Commission municipale de l’éducation de Pékin (KZ202010025041) et des Instituts chinois de recherche médicale de Pékin (subvention n° 100). CX24PY29).
matériels
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | Scientific | T10282 | |
| 1x phosphate-buffered saline | Biosharp | BL302A | |
| 20 bp–5000 bp Alignment marker | Bioptic | C109102-100A | DNA fragment analyzer supporting products |
| 5k Size marker(Standard 50 bp Ladder) | Bioptic | C109101-100A | DNA fragment analyzer supporting products |
| Amplicons Purification Beads | Beckman | A63881 | Amplicons Purification Beads is a nucleic acid purification kit for obtaining high quality DNA products. |
| Anti-Ly6G MicroBeads Ultrapure, mouse | miltenyi | 130-120-337 | The Anti-Ly-6G MicroBeads UltraPure, mouse were developed for positive selection or depletion of mouse neutrophils from single-cell suspensions of mouse bone marrow. |
| Anti-mouse CD11b-BV605 (1:200) | BD | Cat#563015 | |
| Anti-mouse CD48-PE-Cy7 (1:400) | BD | Cat#560731 | |
| Anti-mouse Ly6G-BV510 (1:200) | BD | Cat#740157 | |
| C57BL/6J mice, wild type, 8-week-old, male | The Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences | The Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences | |
| DNA Separation Buffer | Bioptic | C104406 | DNA fragment analyzer supporting products |
| E. coli derived ultrapure LPS (serotype0111: B4) | Sigma-Aldrich | Cat#L-2630 | |
| DNA Quantitative Reagent | vazyme | EQ111 | DNA Quantitative Reagentt is a simple, sensitive and accurate double-stranded DNA (dsDNA) fluorescence quantitative assay kit. |
| Erythrocyte lysis buffer (10x) | BioLegend | Cat#420301 | |
| Fetal bovine serum | Gibco | Cat#10099141C | |
| MS Separation columns | miltenyi | 130-042-201 | MS Columns are designed for positive selection of cells. |
| RPMI 1640 medium | Gibco | C11875500BT | |
| S2 Gel electrophoresis needle | Bioptic | C105101 | DNA fragment analyzer supporting products |
| Surgical instruments: scalpel, dissection scissors, microdissection scissors, fine forceps, blunt anatomical forceps, needle holder | Fisher Scientific | https://www.fishersci.com/us/en/browse/90184247/surgical-tools | Can be purchased from other qualified suppliers |
| Syringe (1 mL) | Fisher Scientific | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 | Can be purchased from other qualified suppliers |
| TruePrepTM DNA Library Prep Kit V2 for Illumina | vazyme | TD501-01 | TruePrep DNA Library Prep Kit V2 for Illumina is a purpose-built kit specifically developed for Illumina's high-throughput sequencing platform. Using the kit, DNA can be prepared into sequencing libraries dedicated to Illumina's high-throughput sequencing platform. |
| TruePrepTM Index Kit V2 for Illumina | vazyme | TD202 | TruePrep Index Kit V2 for Illumina is a Kit for the TruePrep DNA Library Prep Kit V2 for Illumina. It can be used to prepare 96 different double-ended Index libraries. |
Références
- Mortaz, E., Alipoor, S. D., Adcock, I. M., Mumby, S., Koenderman, L. Update on neutrophil function in severe inflammation. Front Immunol. 9, 2171 (2018).
- Lehrer, R. I., Ganz, T., Selsted, M., Babior, B. M., Curnutte, J. T. Neutrophils and host defense. Ann Intern Med. 109 (2), 127-142 (1988).
- De Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: Going forward in reverse. Nat Rev Immunol. 16 (6), 378-391 (2016).
- Herrera-Uribe, J., et al. Integrative profiling of gene expression and chromatin accessibility elucidates specific transcriptional networks in porcine neutrophils. Front Genet. 14, 1107462 (2023).
- Kipnis, E. Neutrophils in sepsis: Battle of the bands. Crit Care Med. 41 (3), 925-926 (2013).
- Kong, Y., et al. Sepsis-induced thymic atrophy is associated with defects in early lymphopoiesis. Stem Cells. 34 (12), 2902-2915 (2016).
- Cassatella, M. A. Neutrophil-derived proteins: Selling cytokines by the pound. Adv Immunol. 73, 369-509 (1999).
- Tecchio, C., Cassatella, M. A. Neutrophil-derived cytokines involved in physiological and pathological angiogenesis. Chem Immunol Allergy. 99, 123-137 (2014).
- Newburger, P. E. Autoimmune and other acquired neutropenias. Hematology Am Soc Hematol Educ Program. 2016 (1), 38-42 (2016).
- Skokowa, J., Dale, D. C., Touw, I. P., Zeidler, C., Welte, K. Severe congenital neutropenias. Nat Rev Dis Primers. 3, 17032 (2017).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- Wang, B., et al. Sepsis induces non-classic innate immune memory in neutrophils. Cell Rep. 42 (9), 113044 (2023).
- Dinauer, M. C. Primary immune deficiencies with defects in neutrophil function. Hematology Am Soc Hematol Educ Program. 2016 (1), 43-50 (2016).
- Shaul, M. E., Fridlender, Z. G. Tumour-associated neutrophils in patients with cancer. Nat Rev Clin Oncol. 16 (10), 601-620 (2019).
- Hong, C. W. Current understanding in neutrophil differentiation and heterogeneity. Immune Netw. 17 (5), 298-306 (2017).
- Carvalho, L. O., Aquino, E. N., Neves, A. C., Fontes, W. The neutrophil nucleus and its role in neutrophilic function. J Cell Biochem. 116 (9), 1831-1836 (2015).
- Tamassia, N., et al. Cutting edge: An inactive chromatin configuration at the il-10 locus in human neutrophils. J Immunol. 190 (5), 1921-1925 (2013).
- Shiraishi, K., et al. Biophysical forces mediated by respiration maintain lung alveolar epithelial cell fate. Cell. 186 (7), 1478-1492.e15 (2023).
- Chang, C. C., Sun, J. T., Chu, F. Y. Bacterial sepsis, neutrophils and intracellular organisms. QJM. 110 (6), 393-394 (2017).
- Walling, B. L., Murphy, P. M. Protean regulation of leukocyte function by nuclear lamins. Trends Immunol. 42 (4), 323-335 (2021).
- Sollberger, G., Tilley, D. O., Zychlinsky, A. Neutrophil extracellular traps: The biology of chromatin externalization. Dev Cell. 44 (5), 542-553 (2018).
- Klemm, S. L., Shipony, Z., Greenleaf, W. J. Chromatin accessibility and the regulatory epigenome. Nat Rev Genet. 20 (4), 207-220 (2019).
- Grandi, F. C., Modi, H., Kampman, L., Corces, M. R. Chromatin accessibility profiling by ATAC-seq. Nat Protoc. 17 (6), 1518-1552 (2022).
- Khoyratty, T. E., et al. Distinct transcription factor networks control neutrophil-driven inflammation. Nat Immunol. 22 (9), 1093-1106 (2021).
- Fischer, J., et al. Safeguard function of pu.1 shapes the inflammatory epigenome of neutrophils. Nat Immunol. 20 (5), 546-558 (2019).
- Ram-Mohan, N., et al. Profiling chromatin accessibility responses in human neutrophils with sensitive pathogen detection. Life Sci Alliance. 4 (8), e202000976 (2021).
- Wei, L., et al. Integrative analysis of single-cell rna-seq and atac-seq data across treatment time points in pediatric AML. Blood. 136 (1), 29 (2020).
- Kolaczkowska, E., Kubes, P. Neutrophil recruitment and function in health and inflammation. Nat Rev Immunol. 13 (3), 159-175 (2013).
- Pillay, J., et al. In vivo labeling with 2H20 reveals a human neutrophil lifespan of 5.4 days. Blood. 116 (4), 625-627 (2010).
- Orchard, P., Kyono, Y., Hensley, J., Kitzman, J. O., Parker, S. C. J. Quantification, dynamic visualization, and validation of bias in ATAC-seq data with ataqv. Cell Syst. 10 (3), 298-306.e4 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon