Method Article
小鼠骨髓来源的中性粒细胞的 ATAC-Seq 文库制备
摘要
本手稿概述了从小鼠骨髓制备中性粒细胞 ATAC-seq 文库的方案,旨在保证最佳的中性粒细胞活力和高文库质量。它提供了有关 BMC 制备、免疫磁性分选和文库构建的分步说明,可作为有价值的指南,特别是对于研究中性粒细胞的新手。
摘要
转座酶可及染色质测序检测 (ATAC-seq) 是一种强大的高通量技术,用于评估染色质可及性和了解表观基因组调控。中性粒细胞作为免疫反应中的关键白细胞类型,在分化和激活过程中会发生大量的染色质结构变化,这显着影响了其功能所需的基因表达。ATAC-seq 在揭示中性粒细胞成熟的关键转录因子、揭示病原体特异性表观基因组特征以及确定自身免疫性疾病的治疗靶点方面发挥了重要作用。然而,中性粒细胞对外部环境的敏感性使高质量的 ATAC-seq 数据生成复杂化。在这里,我们提出了一种可扩展的方案,用于从啮齿动物骨髓来源的嗜中性粒细胞制备 ATAC-seq 文库,具有改进的免疫磁性分离,以确保最佳细胞活力和高质量文库。详细讨论了影响文库质量的重要因素和方法扩展的优化原则。该方案将支持愿意研究嗜中性粒细胞染色质结构和表观基因组重编程的研究人员,推进基础免疫学和临床免疫学的研究。
引言
中性粒细胞是脊椎动物中最丰富和最重要的免疫细胞类型之一,占人类白细胞的 50%-70%1。中性粒细胞在检测和消除宿主中的微生物方面起着核心作用。在败血症期间,成熟的中性粒细胞是第一反应者之一 2。它们通过趋化性3 迅速动员到感染部位,在那里它们通过摄入微生物(吞噬作用)、产生 NADPH 氧化酶依赖性活性氧(呼吸爆发)、分泌颗粒(脱颗粒)和形成中性粒细胞细胞外陷阱 (NET) 来对抗病原体,一旦它们到达炎症部位,就会捕获并杀死细胞外细菌4.未成熟的中性粒细胞也被趋化因子迅速从骨髓动员到外周循环中 5,6。这些被吸引到感染部位的中性粒细胞还会释放细胞因子,这些细胞因子参与多个生理过程,例如造血、血管生成和伤口愈合 7,8。患有先天性或获得性疾病导致中性粒细胞计数减少的患者更容易受到感染 9,10。然而,中性粒细胞活化是一把双刃剑。过度激活和细胞因子释放会导致组织和器官损伤,如果感染得不到及时控制,会导致多器官功能障碍11,12。此外,中性粒细胞还会导致各种炎症和自身免疫性疾病,并可影响癌症进展和转移13,14。这强调了研究中性粒细胞活性调节以平衡有效免疫反应和防止对宿主的损害的必要性。
在嗜中性粒细胞中,染色质结构在其分化、迁移和激活方面经历独特和动态的变化,在整个细胞生命周期中发挥关键调节作用。这个过程,从成髓细胞的大而圆、富含常染色质的细胞核到中幼粒细胞和中幼粒细胞中更凹陷的细胞核,然后到 C 形或 S 形带内细胞,并在多形核中性粒细胞 15,16 中高度分叶状排列着致密的染色质15,16,证明了中性粒细胞生物学的复杂性。专门的染色质配置可确保中性粒细胞功能所必需的基因的选择性表达,例如参与有效消除病原体所必需的颗粒产生和快速转录反应的基因17。当中性粒细胞通过趋化性动员到炎症部位时,跨内皮迁移对核骨架/细胞骨架复合物接头 (LINC) 复合物施加压力,促进染色质重塑和更多的激活电位18。在脓毒症中,活化的中性粒细胞表现出“核左移”,具有异常的染色质形态,例如双叶或无裂片的细胞核和明显松散的染色质浓缩19。这导致与炎症反应相关的基因区域内的可及性增加,从而诱导这些基因的显着表达。如果感染没有得到适当控制,组蛋白瓜氨酸化和随后的染色质解构是形成 NET所必需的 20,21。因此,了解中性粒细胞染色质结构对于推进中性粒细胞生物学和开发炎症和自身免疫性疾病的治疗方法至关重要,为未来的疾病治疗带来希望。
染色质可及性是表观基因组水平染色质结构的指标。它表明基因组区域在物理上如何允许增强子、启动子、绝缘子和染色质结合因子,以及这些元件如何影响基因表达22。转座酶可及染色质测序检测 (ATAC-seq) 是一种广泛使用的技术,用于评估整个基因组的染色质可及性23。它不需要调控元件的先验知识,使其成为表观遗传学研究的有效工具。该方法包括分离样品核,通过转座酶 Tn5 片段化基因组 DNA,并添加测序引物用于文库制备、测序和数据分析23。ATAC-seq 在研究核小体定位、转录因子结合分析、各种细胞类型或疾病的调节机制、新型增强子鉴定、生物标志物发现等方面发挥了重要作用22,23。它通常与其他技术(如 RNA 测序)结合使用,以全面分析基因表达。
ATAC-seq 通过揭示健康和疾病中精确的表观遗传机制,推进了我们对中性粒细胞生物学的了解。它揭示了中性粒细胞成熟和效应反应中的几个关键转录因子(即 RUNX1、KLF6、PU.1 等)24,25,发现了脓毒症中具有生物标志物潜力的病原体特异性特征26,阐明了先天免疫记忆的表观基因组机制12,并确定了小儿急性髓性白血病 (AML) 的治疗靶点27.然而,作为免疫监视中的重要细胞成分,中性粒细胞对其外部环境表现出高度敏感性,因此对产生高质量的 ATAC-seq 数据构成挑战。据报道,在生理情况下,人嗜中性粒细胞的中位半衰期为 3.8 天,而小鼠嗜中性粒细胞的平均半衰期为 12.5 小时。值得注意的是,在体外研究时,它们的半衰期要短得多 28,29。在分离的中性粒细胞的体外作过程中,暴露于微生物或病原体相关分子模式 (PAMP),以及多余的实验程序和苛刻的作,可导致异常的中性粒细胞活化和细胞活力降低,这是由于细胞凋亡或 NETosis。死亡细胞通常含有大量对 Tn5 高度敏感的未染色质化 DNA,因此提高了 ATAC-seq23 的背景噪音。
在这里,我们提出了一种可扩展的方案,用于制备针对啮齿动物骨髓样本中性粒细胞优化的 ATAC-seq 文库。 图 1 显示了该方案的图形概述,其中包括中性粒细胞从骨髓中免疫磁性分离,然后是 ATAC-seq。改进的免疫磁性分选保证了中性粒细胞在为 ATAC-seq 文库提取细胞核之前的最佳活力,从而确保了文库的高质量并促进了将额外的中性粒细胞评估纳入方案。该协议的实施将有助于研究人员了解中性粒细胞在暴露于各种微环境挑战时的染色质结构特征和表观基因组重编程机制。预计这将在基础和临床免疫学研究中得到广泛应用。
研究方案
以下介绍的所有动物程序均符合国家道德和动物福利指南和法规,这些指南和法规已由中国北京首都医科大学动物护理研究伦理委员会 (sjtkl11-1x-2022(060)) 批准。
1. 骨髓细胞 (BMC) 悬液的制备
- 选择体重 6-8 周龄的雄性 C57BL/6J 小鼠,体重 19-21 g。使用 CO2 室对小鼠实施安乐死,然后在深反射消失后进行颈椎脱位。在解剖垫上用 70% 乙醇喷雾消毒。
- 使用小剪刀和镊子小心地将股骨与髋关节和胫骨分开,去除附着的皮肤和骨骼肌,并在 10 厘米培养皿中用冷磷酸盐缓冲盐水 (PBS) 冲洗股骨。
- 切掉股骨骨骺,将连接到 2 mL 注射器的 28 G 针头轻轻插入骨髓腔,然后用含有 2% 胎牛血清 (FBS) 的冷 PBS 冲洗骨髓。
- 重复上一步,直到冲洗的深红色液体变为半透明。通常需要三次冲水。
注意:避免将针头太深地插入骨髓腔,以确保最佳细胞采集。 - 使用 70 μm 细胞过滤器将细胞悬液过滤到荧光激活细胞分选 (FACS) 管 (5 mL) 中。
- 使用不含聚甲醛的市售红细胞裂解缓冲液裂解 BMC 中的红细胞。
- 在 25 °C 下以 500 x g 离心管 5 分钟,小心去除上清液,在底部留下约 100 μL 液体,然后轻轻敲击管以松开沉淀。
- 加入 2 mL 裂解缓冲液,从红细胞裂解缓冲液 (10x) 中稀释,并将试管倒置 3 次进行混合。然后,将试管以 500 x g 离心 5 分钟,弃去上清液,轻轻敲击重悬细胞沉淀。
- 用含有 10% FBS 的 RPMI 1640 培养基洗涤细胞两次,然后以 2 mL 的体积重悬细胞。
注:处理未散落的细胞团块时,建议使用 200 μL 移液器吸头将其挑出,而不是通过 70 μm 细胞过滤器过滤细胞悬液。这种方法可以减少细胞损失。
- 用台盼蓝染色计算每个样品的细胞活力和活细胞总数。
2. 用抗 Ly6G 磁珠对中性粒细胞进行免疫磁性标记
- 将骨髓细胞(每只小鼠 ~2 x 107 个活细胞)重悬于 2 mL 含有 10% FBS 的 RPMI 1640 培养基中,并在 25 °C 下以 500 x g 离心 5 分钟。
注:鉴于 ATAC-seq 对 1 x 105 个细胞的需求有限,可以使用从同一只小鼠获得的中性粒细胞将多余的中性粒细胞分配给额外的表观基因组分析(例如,ChIP-seq 和 Hi-C)或免疫功能评估(例如,细胞因子产生、吞噬作用和 NETs)。 - 吸出大部分上清液,留下大约 100 μL,然后轻轻敲击试管以松开沉淀。
- 加入 30 μL 的 Ly6G 珠子,轻轻敲击与 BMC 混合。
注:磁珠在使用前应涡旋至少 10 秒。将磁珠添加到 BMC 中后,建议避免涡旋。 - 将试管在 25 °C 下孵育 15 分钟。
- 加入 2 mL PBS 以重悬珠子和细胞,然后在 25 °C 下以 500 x g 离心 5 分钟。
- 吸出大部分上清液,留下大约 100 μL,然后轻轻敲击试管以松开沉淀。添加额外的 PBS,最终体积为 1 mL。
注:处理未散落的细胞团块时,建议使用 200 μL 移液器吸头将其挑出,而不是通过 70 μm 细胞过滤器过滤细胞悬液。这种方法可以减少细胞损失。
3. 使用免疫磁性细胞分选进行中性粒细胞分离
- 用 PBS 预处理 MS 柱。
- 将 MS 色谱柱置于兼容的磁激活细胞分选 (MACS) 分离器的磁场中。将一根未占用的 5 mL 管放在从 MS 色谱柱排出的液体下方。
- 用 500 μL PBS 冲洗色谱柱。在 PBS 完全流入 MS 柱后重复此步骤。
注:应让 PBS 通过 MS 色谱柱逐滴逐渐流入 5 mL 荧光激活细胞分选 (FACS) 管中。确保没有空气进入色谱柱,因为气泡可能会阻塞色谱柱。
- 将磁性标记的 BMC 悬浮液一次添加 500 μL 到 MS 色谱柱上,一旦色谱柱储液罐排空,立即重新填充。
注意:确保细胞悬液没有细胞团。如果需要,在 MS 色谱柱下方放置一个新的 5 mL FACS 管,以在此阶段之前收集未标记的细胞(例如,单核细胞和淋巴细胞)。
注意:记下液滴流速。流速慢可能表明排序列被阻塞。 - 每次储液槽为空时加入 500 μL PBS 洗涤 MS 色谱柱,重复此过程两次。
注:过早添加 PBS 可能会阻碍某些细胞进入分选柱,从而可能影响细胞分选的纯度。 - 收集磁性标记的嗜中性粒细胞。
- 柱储液槽耗尽后,将色谱柱从磁场中取出,并小心地将其放在 5 mL 管上。
注:在去除色谱柱之前,请确保其中没有残留液体,以防止在此过程中因液滴排出而导致嗜中性粒细胞损失。可以使用移液器去除色谱柱中的残留物。 - 将 2 mL PBS 分配到色谱柱上,然后立即用力将柱塞推入色谱柱,以排出磁性标记的中性粒细胞。
注:为了获得足够的嗜中性粒细胞,请确保足够的洗脱体积,并在将柱塞推入色谱柱时保持较短。
- 柱储液槽耗尽后,将色谱柱从磁场中取出,并小心地将其放在 5 mL 管上。
- 使用血细胞计数器计数分离的细胞。取 100 μL 分选后细胞悬液并用流式细胞术分析,鉴定分离的中性粒细胞的纯度。
4. 细胞核提取
- 在 4 °C 下在 0.2 mL 试管中以 500 x g 离心含有嗜中性粒细胞的 50,000 个单细胞悬液 5 分钟,然后弃去上清液。
- 将嗜中性粒细胞重悬于 50 μL 预冷的裂解缓冲液中(参见 表 1),使用移液管轻轻混合溶液,并在冰上孵育 10 分钟。
注:如果样品体积小于 5 μL,则允许直接添加裂解缓冲液。细胞悬液浓度不超过 1 x 107 个细胞/mL。 - 在 4 °C 下以 500 x g 离心 5 分钟,然后弃去上清液并收集细胞核。在开始后续程序之前,将试管放在冰上。
注:为了尽量减少样品损失,请标明沉淀物积聚的管壁一侧,并在去除上清液时从另一侧轻轻吸出液体。
5. 核小体栓系标记与转座酶
- 根据 DNA 文库制备试剂盒的指南(参见 表 2),在聚合酶链反应 (PCR) 管中制备含有 Tn5 转座酶的酶切反应混合物,并将冷藏的扩增子纯化珠在 25 °C 下预热至少 30 分钟。
- 用 50 μL 酶切反应混合物重悬中性粒细胞核,并用移液管轻轻搅拌,然后使用手持式离心机 (~2600 x g) 离心 5 秒。
- 将反应管在 PCR 仪器中于 37 °C 孵育 30 分钟。
- 向裂解物中加入 100 μL 预涡旋扩增子纯化珠,然后上下吹打 10 次,将磁珠在溶液中充分混合。
注意:磁珠具有粘性,很容易附着在移液器吸头上,因此,在转移磁珠时,请确保吸出正确的体积并从吸头缓慢分配磁珠。 - 将反应管在 25 °C 下孵育 5 分钟,然后用手持式离心机 (~2600 × g) 离心 5 秒。
- 将反应管放在磁力架上直至溶液变澄清(约 5 分钟),纯化中断的 DNA 片段。然后,小心地去除上清液,不要干扰磁珠。
- 每次用 200 μL 新鲜制备的 80% 乙醇洗涤磁珠,同时将反应管放在磁架上 30 秒。添加乙醇时避免干扰磁珠。重复步骤 5.7 中描述的过程。
- 用手持式离心机(约 2600 × g)离心反应管,用 10 μL 移液器吸头吸出乙醇,然后在打开盖子的同时干燥磁珠 3-5 分钟。
注:由于湿度水平的变化,磁珠的干燥时间可能因地区而异。珠子应该擦干,直到它们失去光泽。过度干燥会使洗脱过程复杂化,而干燥不充分可能会导致酒精残留,从而影响后续实验。此外,将磁珠水平放置更有利于磁珠的均匀干燥。 - 从磁力架上取下反应管后,加入 26 μL ddH2O 以覆盖磁珠,上下移液以确保充分混合。然后,在 25 °C 下孵育 2 分钟。
注:如果磁珠过度干燥,请适当延长孵育时间。 - 用手持式离心机(约 2600 × g)短暂离心反应管,并使用磁架分离磁珠,直到溶液变澄清(约 5 分钟)。
- 小心地将 24 μL 上清液转移到新的 PCR 管中。
6. 用于下一代测序 (NGS) 的文库构建
- 在无菌管中利用纯化的 DNA 片段和含有测序接头的引物制备 PCR 反应混合物(参见 表 3)。
- 按照推荐的程序(参见 表 4)进行 PCR 反应,通常需要大约 1 小时。
注意:此过程后实验可能会暂时停止,PCR 产物可以储存在 -20 °C 或至少 2 周。 - 将 27.5 μL 预涡旋扩增子纯化珠添加到 50 μL PCR 产物中,然后通过上下吹打 10 次,将磁珠在溶液中充分混合。
注:磁珠与 PCR 产物的比例不正确会导致分选片段的长度出现差异。使用 ddH2O 将 PCR 产物的蒸发体积填充至 50 μL。确保吸出正确体积的磁珠,并从移液器吸头缓慢分配,以尽量减少可能附着的磁珠。 - 将反应管在 25 °C 下孵育 5 分钟,然后用手持式离心机(约 2600 x g )离心 5 秒。
- 将反应管放在磁力架上直至溶液澄清(约 5 分钟),纯化文库 DNA。然后,小心地将上清液转移到新的灭菌 PCR 管中,并丢弃磁珠。
- 向上清液中加入 50 μl 预涡旋的扩增子纯化珠,然后通过上下吹打 10 次将磁珠在溶液中充分混合。
- 将反应管在 25 °C 下孵育 5 分钟,然后用手持式离心机(约 2600 x g )离心 5 秒。
- 将反应管放在磁架上,直到溶液变清(约 5 分钟),然后小心地去除上清液,不要干扰磁珠。
- 每次用 200 μL 新鲜制备的 80% 乙醇洗涤磁珠两次,将反应管放在磁架上 30 秒。添加乙醇时避免干扰磁珠。
- 打开盖子,将磁珠干燥 5 分钟。
- 从磁架上取下反应管后,加入 22 μL ddH2O 以覆盖磁珠,上下吹打 10 次以确保充分混合。然后,在 25 °C 下孵育 5 分钟。
- 用手持式离心机(约 2600 × g)短暂离心反应管,并使用磁架分离磁珠,直到溶液变澄清(约 5 分钟)。
- 小心地将 20 μL 上清液转移到新的灭菌 PCR 管中,并将其储存在 -20 °C。
注:为了获得长度分布更集中的文库,请考虑使用凝胶回收试剂盒对扩增的产物进行分选。或者,如果对长度分布范围没有特定要求,则可以使用磁珠或色谱柱纯化试剂盒直接纯化扩增产物,无需长度分选。
7. 文库质量控制和测序
- 利用 DNA 片段分析仪平台评估文库 DNA 的长度分布。
- 利用 NGS 平台对通过质量检查的文库进行高通量测序。
结果
概述的方案用于从 C57BL/6 小鼠的骨髓中分离中性粒细胞,并通过 ATAC-seq 比较它们在脂多糖 (LPS) 刺激前后染色质可及性各自的方差。通常,可以从 6-8 周龄的 C57BL/6 小鼠的双侧股骨上收获 2 x 107 个 BMC,随后可以分离出 2-5 x 106 个中性粒细胞。其中,1 x 105 个细胞用于 ATAC-seq,而多余的细胞可以分配用于全面的中性粒细胞分析。
采用 FACS 免疫表型来确定免疫磁性分选后的中性粒细胞纯度和活力 (图 2)。虽然仅前向散射区 (FSC-A) 和侧向散射区 (SSC-A) 的分布可以提供估计值,但这里使用特定的中性粒细胞标志物染色来证明分选效果。在 FSC-A 和 SSC-A 设门之后,使用 FSC-A 和前向散射高度 (FSC-H) 进一步设门细胞,以区分单个细胞和聚集细胞。大约 99% 的分选后细胞被鉴定为单个细胞。然后,排除 7-氨基放线菌素 D (7AAD),一种由活细胞有效排泄的 DNA 染料,以标记细胞并从分选后单个细胞中鉴定 >99% 的活力。进一步标记 CD11b 和 CD48 以分别识别髓系细胞和区分髓系细胞内的中性粒细胞和单核细胞。在 C57BL/6 小鼠的 BMC 中,髓系细胞占活细胞的 46.7%,其中中性粒细胞占髓系细胞群的 76.4%。免疫磁分选后,经验证活细胞内中性粒细胞纯度为 98.5%,满足 ATAC-seq 文库构建要求。
构建 ATAC-seq 文库后,使用 DNA 片段分析仪对纯化的 DNA 进行长度分布分析。结果显示长度在 100 bp 和 1000 bp 之间,没有小片段或大片段污染(图 3A)。ATA-seq 文库的浓度和测序数据的数量详见 表 5。收到测序数据后,我们还检查了 ATAC-seq 片段的长度分布(图 3B)。由于 Tn5 转座酶的标记化产生来自无核小体区域(NFR,< 100 bp)、单核小体(~200 bp)、二核小体(~400 bp)、三核小体(~600 bp)和来自其他开放染色质区域的较长寡核小体的片段的特征大小模式,成功的 ATAC-seq 实验应协调生成典型的片段大小分布图,其中周期性递减峰对应于核小体的整数倍(图 3B).通常确定 ATAC-seq 峰的改变以说明开放染色质区域的动态景观。如图 3C 所示,ATAC-seq 信号增加或减少的区域应由清晰的热图描绘。然后,我们分析了主要受 LPS 刺激影响的炎症因子基因的染色质可及性,例如 IL10、Stat1、Il12a、Cxcl1 和 Irak1,我们发现这些基因在 LPS 刺激的中性粒细胞中具有更高的可及性(图 3D)。综上所述,我们构建的 ATAC-seq 文库的质量控制令人满意,产生的数据足以分析 LPS 刺激后小鼠中性粒细胞的表观遗传变化。

图 1:中性粒细胞 ATAC-seq 文库制备方案的示意图概述。 概述介绍了 BMCs 悬液的制备、用抗 Ly6G 磁珠标记中性粒细胞、通过免疫磁性分选分离中性粒细胞、中性粒细胞核的提取、核小体栓系标记、NGS 文库构建和测序。 请单击此处查看此图的较大版本。

图 2:免疫磁性分选前后使用 FACS 评估中性粒细胞纯度和活力。 (A) BMC 和 (B) 分离的中性粒细胞根据标准化方案进行抗 CD11b、抗 Ly6G、抗 CD48 和 7AAD 染色。随后,从总细胞群中设门单细胞,排除具有 7AAD 的死细胞。然后从活细胞中设门,最后,从骨髓细胞群中设门中性粒细胞。 请单击此处查看此图的较大版本。
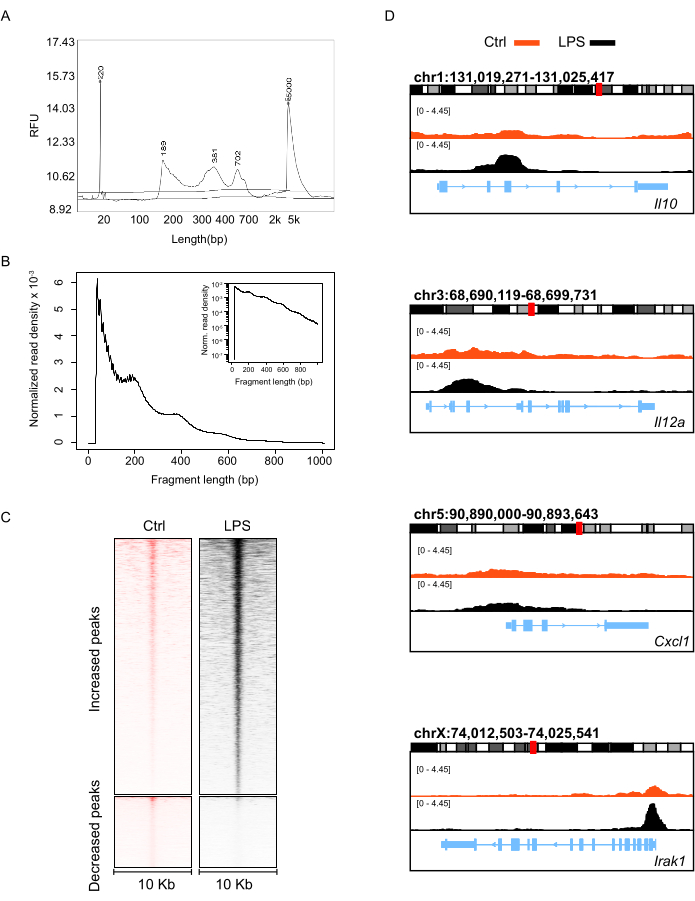
图 3:从小鼠骨髓中性粒细胞制备的 ATAC-seq 文库的质量评估。 (A) DNA 片段分析仪分析的文库 DNA 的长度分布,以及 (B) ATAC-seq 片段的长度分布由测序数据确定。(C) 在未处理和 LPS 刺激的中性粒细胞中实现可及性的基因组区域的堆积热图(在这些峰中心周围± 10 kb)。(D) 与炎症因子相对应的代表性基因位点的 ATAC-seq 信号的综合基因组学查看器 (IGV) 视图,其中红色和黑色信号峰分别代表未处理的和 LPS 刺激的中性粒细胞。 请单击此处查看此图的较大版本。
| 元件 | 最终浓度 |
| Tris·盐酸 (pH 7.4) | 10 毫米 |
| 氯化钠 | 10 毫米 |
| 氯化镁2 | 3 毫米 |
| 伊格帕尔 CA-630 | 0.1% (垂直/垂直) |
表 1:用于细胞核提取的裂解缓冲液配方。
| 元件 | 卷 |
| 5 倍 TTBL | 10 微升 |
| TTE 混合 V50 | 5 微升 |
| ddH2O | 35 微升 |
| 总体积 | 50 微升 |
表 2:片段化反应混合物的制备。
| 元件 | TD501 系列 |
| 纯化的 DNA 片段 | 24 微升 |
| ddH2O | - |
| 5xTAB | 10 微升 |
| 百万分之一 | 5 微升 |
| P5 引物 X* | 5 微升 |
| P7 引物 X * | 5 微升 |
| 泰 | 1 微升 |
| 总体积 | 50 微升 |
表 3:用于 NGS 文库构建的 PCR 反应混合物的制备。
| 步骤 | 温度 | 时间 | 周期 |
| 延长前 | 72 摄氏度 | 3 分钟 | 1 |
| 初始变性 | 98 摄氏度 | 30 秒 | 1 |
| 变性 | 98 摄氏度 | 15 秒 | 14 次循环 |
| 退火 | 60 °摄氏度 | 30 秒 | |
| 外延 | 72 摄氏度 | 30 秒 | |
| 最终扩展 | 72 摄氏度 | 5 分钟 | 1 |
| 拿 | 4 °C | 永远 |
表 4:NGS 文库构建的推荐 PCR 反应程序。
| 图书馆 | 文库浓度 (ng/μL) | 原始测序数据的数量(读取对) | 不。序列碱基数 (G) |
| Ctrl 键 | 16.2 | 71409188 | 21.42 |
| LPS公司 | 14.8 | 76453853 | 22.94 |
表 5:ATAC-seq 文库浓度和测序数据概述。
讨论
本手稿报告了制备针对啮齿动物骨髓样本中性粒细胞优化的 ATAC-seq 文库的实验方案。由于中性粒细胞高度敏感且易于激活的免疫细胞,因此优化工作优先考虑维持分离的中性粒细胞的活力。处理不当可能导致 NETosis 和其他形式的细胞死亡,促使释放大量未染色质的 DNA,从而产生背景噪音23。我们简化了细胞核提取前的程序,并选择了不含多聚甲醛的红细胞裂解缓冲液。与外周血样本相比,少量的红细胞需要 BMC 与红细胞裂解缓冲液的短暂孵育期,从而有效减少中性粒细胞的损失,同时确保红细胞的彻底溶解。为了尽量减少不必要的刺激,在与 BMC 一起孵育之前,必须将所有试剂预热至 37 °C,并极其小心地处理它们,避免涡旋、使用细胞过滤器重复过滤、以过快的转速进行长时间离心等活动。上述程序的改进提高了分选的中性粒细胞活力,从而创造了有利于高质量 ATAC-seq 文库的条件。
我们探索了三种广泛使用的分选技术来获得具有最佳活力的嗜中性粒细胞:免疫磁性分离、密度梯度离心和流式细胞术分选。进行密度梯度离心时,嗜中性粒细胞可以穿过分离液层,可能导致渗透压和 NET 形成。在进行流式细胞术分选时,通过喷嘴的中性粒细胞会受到机械剪切力的刺激。分选持续时间通常超过 1 小时,分选后细胞浓度降低,导致分离和随后离心过程中中性粒细胞损失更大。与上述两种方法相比,免疫磁性分离可在 30 分钟内实现 95% 纯度和 99.5% 的中性粒细胞活力。虽然这种方法可能会导致更高的实验费用,但我们认为它对于获得可靠的研究成果至关重要。除 ATAC-seq 外,免疫磁性分离还可以与对中性粒细胞活力有严格标准的其他实验相结合,例如免疫功能评估(例如,细胞因子产生、吞噬作用、NETs 等)、“组学”方法(例如,ChIP-seq、Hi-C、广谱靶向代谢组学等)和其他常规分子生物学实验。该综合方法允许在单只小鼠中从不同角度全面研究中性粒细胞功能和相关机制。
所描述的方案是一种可扩展的方案,可以扩展以适应来自不同物种和各种组织来源的中性粒细胞。根据样品中的红细胞比例,建议在确保足够的溶出效率的同时,将红细胞裂解缓冲液的孵育时间优化到最低。在免疫磁性分选过程中,磁珠的使用量会显著影响分离细胞的纯度。应根据样品处理的细胞数量和中性粒细胞比率进行优化。保持中性粒细胞的纯度是主要关注点。根据我们的经验,为来自两个股骨的 2 x 107 个细胞添加 30 μL 的珠子,为来自两个股骨和两个胫骨的 4 x 107 个细胞添加 50 μL。由于不同批次之间具有出色的重现性和广泛的抗体剂量范围,因此只需在开始时探索优化。此外,高质量和稳定的 ATAC-seq 文库的产生取决于 Tn5 转座酶与投资的细胞核30 的适当比例。对于小鼠骨髓来源的中性粒细胞,最佳投资量为 50,000 个细胞核,其他样品需要稍作调整。
综上所述,我们提出了一种中性粒细胞免疫磁分选和后续 ATAC-seq 文库制备的综合方案,这在中性粒细胞研究中具有广泛的应用前景。它将帮助研究人员理解中性粒细胞的染色质结构特征,揭示它们在存在各种微环境挑战的情况下炎症反应和表观基因组重编程的调节机制,从而揭示疾病发生和进展中的潜在治疗靶点 12,24,25,26,27。
披露声明
作者没有什么可披露的。
致谢
这项工作得到了北京市教育委员会 (KZ202010025041) 和北京中国医学研究所 (Grant No.CX24PY29)。
材料
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | Scientific | T10282 | |
| 1x phosphate-buffered saline | Biosharp | BL302A | |
| 20 bp–5000 bp Alignment marker | Bioptic | C109102-100A | DNA fragment analyzer supporting products |
| 5k Size marker(Standard 50 bp Ladder) | Bioptic | C109101-100A | DNA fragment analyzer supporting products |
| Amplicons Purification Beads | Beckman | A63881 | Amplicons Purification Beads is a nucleic acid purification kit for obtaining high quality DNA products. |
| Anti-Ly6G MicroBeads Ultrapure, mouse | miltenyi | 130-120-337 | The Anti-Ly-6G MicroBeads UltraPure, mouse were developed for positive selection or depletion of mouse neutrophils from single-cell suspensions of mouse bone marrow. |
| Anti-mouse CD11b-BV605 (1:200) | BD | Cat#563015 | |
| Anti-mouse CD48-PE-Cy7 (1:400) | BD | Cat#560731 | |
| Anti-mouse Ly6G-BV510 (1:200) | BD | Cat#740157 | |
| C57BL/6J mice, wild type, 8-week-old, male | The Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences | The Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences | |
| DNA Separation Buffer | Bioptic | C104406 | DNA fragment analyzer supporting products |
| E. coli derived ultrapure LPS (serotype0111: B4) | Sigma-Aldrich | Cat#L-2630 | |
| DNA Quantitative Reagent | vazyme | EQ111 | DNA Quantitative Reagentt is a simple, sensitive and accurate double-stranded DNA (dsDNA) fluorescence quantitative assay kit. |
| Erythrocyte lysis buffer (10x) | BioLegend | Cat#420301 | |
| Fetal bovine serum | Gibco | Cat#10099141C | |
| MS Separation columns | miltenyi | 130-042-201 | MS Columns are designed for positive selection of cells. |
| RPMI 1640 medium | Gibco | C11875500BT | |
| S2 Gel electrophoresis needle | Bioptic | C105101 | DNA fragment analyzer supporting products |
| Surgical instruments: scalpel, dissection scissors, microdissection scissors, fine forceps, blunt anatomical forceps, needle holder | Fisher Scientific | https://www.fishersci.com/us/en/browse/90184247/surgical-tools | Can be purchased from other qualified suppliers |
| Syringe (1 mL) | Fisher Scientific | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 | Can be purchased from other qualified suppliers |
| TruePrepTM DNA Library Prep Kit V2 for Illumina | vazyme | TD501-01 | TruePrep DNA Library Prep Kit V2 for Illumina is a purpose-built kit specifically developed for Illumina's high-throughput sequencing platform. Using the kit, DNA can be prepared into sequencing libraries dedicated to Illumina's high-throughput sequencing platform. |
| TruePrepTM Index Kit V2 for Illumina | vazyme | TD202 | TruePrep Index Kit V2 for Illumina is a Kit for the TruePrep DNA Library Prep Kit V2 for Illumina. It can be used to prepare 96 different double-ended Index libraries. |
参考文献
- Mortaz, E., Alipoor, S. D., Adcock, I. M., Mumby, S., Koenderman, L. Update on neutrophil function in severe inflammation. Front Immunol. 9, 2171 (2018).
- Lehrer, R. I., Ganz, T., Selsted, M., Babior, B. M., Curnutte, J. T. Neutrophils and host defense. Ann Intern Med. 109 (2), 127-142 (1988).
- De Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: Going forward in reverse. Nat Rev Immunol. 16 (6), 378-391 (2016).
- Herrera-Uribe, J., et al. Integrative profiling of gene expression and chromatin accessibility elucidates specific transcriptional networks in porcine neutrophils. Front Genet. 14, 1107462 (2023).
- Kipnis, E. Neutrophils in sepsis: Battle of the bands. Crit Care Med. 41 (3), 925-926 (2013).
- Kong, Y., et al. Sepsis-induced thymic atrophy is associated with defects in early lymphopoiesis. Stem Cells. 34 (12), 2902-2915 (2016).
- Cassatella, M. A. Neutrophil-derived proteins: Selling cytokines by the pound. Adv Immunol. 73, 369-509 (1999).
- Tecchio, C., Cassatella, M. A. Neutrophil-derived cytokines involved in physiological and pathological angiogenesis. Chem Immunol Allergy. 99, 123-137 (2014).
- Newburger, P. E. Autoimmune and other acquired neutropenias. Hematology Am Soc Hematol Educ Program. 2016 (1), 38-42 (2016).
- Skokowa, J., Dale, D. C., Touw, I. P., Zeidler, C., Welte, K. Severe congenital neutropenias. Nat Rev Dis Primers. 3, 17032 (2017).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- Wang, B., et al. Sepsis induces non-classic innate immune memory in neutrophils. Cell Rep. 42 (9), 113044 (2023).
- Dinauer, M. C. Primary immune deficiencies with defects in neutrophil function. Hematology Am Soc Hematol Educ Program. 2016 (1), 43-50 (2016).
- Shaul, M. E., Fridlender, Z. G. Tumour-associated neutrophils in patients with cancer. Nat Rev Clin Oncol. 16 (10), 601-620 (2019).
- Hong, C. W. Current understanding in neutrophil differentiation and heterogeneity. Immune Netw. 17 (5), 298-306 (2017).
- Carvalho, L. O., Aquino, E. N., Neves, A. C., Fontes, W. The neutrophil nucleus and its role in neutrophilic function. J Cell Biochem. 116 (9), 1831-1836 (2015).
- Tamassia, N., et al. Cutting edge: An inactive chromatin configuration at the il-10 locus in human neutrophils. J Immunol. 190 (5), 1921-1925 (2013).
- Shiraishi, K., et al. Biophysical forces mediated by respiration maintain lung alveolar epithelial cell fate. Cell. 186 (7), 1478-1492.e15 (2023).
- Chang, C. C., Sun, J. T., Chu, F. Y. Bacterial sepsis, neutrophils and intracellular organisms. QJM. 110 (6), 393-394 (2017).
- Walling, B. L., Murphy, P. M. Protean regulation of leukocyte function by nuclear lamins. Trends Immunol. 42 (4), 323-335 (2021).
- Sollberger, G., Tilley, D. O., Zychlinsky, A. Neutrophil extracellular traps: The biology of chromatin externalization. Dev Cell. 44 (5), 542-553 (2018).
- Klemm, S. L., Shipony, Z., Greenleaf, W. J. Chromatin accessibility and the regulatory epigenome. Nat Rev Genet. 20 (4), 207-220 (2019).
- Grandi, F. C., Modi, H., Kampman, L., Corces, M. R. Chromatin accessibility profiling by ATAC-seq. Nat Protoc. 17 (6), 1518-1552 (2022).
- Khoyratty, T. E., et al. Distinct transcription factor networks control neutrophil-driven inflammation. Nat Immunol. 22 (9), 1093-1106 (2021).
- Fischer, J., et al. Safeguard function of pu.1 shapes the inflammatory epigenome of neutrophils. Nat Immunol. 20 (5), 546-558 (2019).
- Ram-Mohan, N., et al. Profiling chromatin accessibility responses in human neutrophils with sensitive pathogen detection. Life Sci Alliance. 4 (8), e202000976 (2021).
- Wei, L., et al. Integrative analysis of single-cell rna-seq and atac-seq data across treatment time points in pediatric AML. Blood. 136 (1), 29 (2020).
- Kolaczkowska, E., Kubes, P. Neutrophil recruitment and function in health and inflammation. Nat Rev Immunol. 13 (3), 159-175 (2013).
- Pillay, J., et al. In vivo labeling with 2H20 reveals a human neutrophil lifespan of 5.4 days. Blood. 116 (4), 625-627 (2010).
- Orchard, P., Kyono, Y., Hensley, J., Kitzman, J. O., Parker, S. C. J. Quantification, dynamic visualization, and validation of bias in ATAC-seq data with ataqv. Cell Syst. 10 (3), 298-306.e4 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。