Method Article
Régénération cardiaque induite par la cryolésion dans l’axolotl et échocardiographie et histologie quantitative non biaisée pour évaluer la progression régénérative
Dans cet article
Résumé
Nous présentons ici un protocole chirurgical visant à induire une cryolésion du myocarde ventriculaire de l’axolotl. De plus, nous présentons un protocole pour estimer de manière non invasive la fraction d’infarctus pendant le processus de régénération avec échocardiographie et un protocole pour mesurer avec précision la fraction d’infarctus dans le cœur excisé avec une histologie quantitative non biaisée.
Résumé
Les amphibiens urodèles, les salamandres et les tritons, représentent le groupe phylogénétique le plus proche des mammifères capables d’effectuer une régénération myocardique complète après résection ventriculaire. Le modèle de résection a généré une connaissance de base des processus impliqués dans la réparation cardiaque. Cependant, le modèle ne se rapporte pas bien aux situations cliniques dans lesquelles les lésions tissulaires, l’apoptose, la nécrose, la fibrose et l’hypertrophie sont toutes des conséquences néfastes clés des infarctus du myocarde induits par l’ischémie plutôt que de l’ablation des tissus. D’autre part, l’infarctus du myocarde induit par une cryolésion ressemble plus à l’infarctus du myocarde induit par l’ischémie. Nous fournissons ici une description détaillée de la procédure de cryolésion chez l’axolotl (Ambystoma mexicanum), qui fournit un outil pour étudier les mécanismes de base de la réparation cardiaque dans un modèle de tétrapode. De plus, nous fournissons des méthodes quantitatives pour estimer la taille de l’infarctus de manière non invasive in vivo avec l’échocardiographie et pour mesurer la taille de l’infarctus avec précision avec une histologie quantitative non biaisée ex vivo.
Introduction
Les cardiopathies ischémiques sont l’une des principales causes de décès dans le monde 1,2. L’infarctus du myocarde induit par l’ischémie entraîne une mort cellulaire généralisée dans les cardiomyocytes3. Bien qu’une intervention médicale rapide puisse réduire le risque de mort immédiate, la réponse fibrotique qui s’ensuit que les humains partagent avec les mammifères modèles traditionnels (souris, rat, lapin, porc, etc.) entraîne la formation de tissu cicatriciel qui peut finalement conduire à une hypertrophie cardiaque, des arythmies et une insuffisance cardiaque4. Contrairement aux mammifères, la régénération cardiaque est bien établie chez certains modèles animaux non amnioniques tels que le poisson-zèbre5 et les salamandres6. Traditionnellement, la régénération cardiaque a été étudiée chez ces espèces après résection ventriculaire partielle ou pincement 5,6,7,8,9,10. Cependant, en 2011, trois groupes ont développé indépendamment une technique d’infarctus du myocarde induite par cryolésion chez le poisson-zèbre 11,12,13. La technique de la cryolésion entraîne une nécrose et une apoptose dans une partie majeure du ventricule cardiaque du poisson-zèbre et une accumulation initiale de tissu fibreux qui modélise plus étroitement le développement pathologique du cœur des mammifères après un infarctus ischémique par rapport à la résection ventriculaire 11,12,13 . De plus, des comparaisons méthodologiques de l’infarctus du myocarde induit par la cryolésion à l’infarctus du myocarde induit par l’ischémie par ligature de l’artère coronaire chez la souris et le porc ont prouvé que la technique de la cryolésion était une alternative utile dans les modèles animaux de mammifères14,15. En nous inspirant des méthodes utilisées dans le modèle de cryolésion du poisson-zèbre16,17, nous avons développé un modèle similaire chez l’axolotl18, un amphibien réputé pour ses capacités de régénération19, qui permet d’étudier les mécanismes impliqués dans la réparation cardiaque chez ce tétrapode après des lésions tissulaires plutôt qu’une ablation de tissus.
Nous présentons ici un protocole détaillé sur la façon de réaliser un infarctus du myocarde induit par une cryolésion chez l’axolotl. Nous mettons un accent particulier sur les étapes cruciales rapides et peu invasives qui augmentent la survie, la récupération et la reproductibilité expérimentale. De plus, nous fournissons des instructions pour les techniques appropriées d’évaluation de la régénération anatomique in vivo à l’aide de l’échocardiographie et ex vivo à l’aide de l’histologie quantitative non biaisée basée sur la stéréologie.
L’infarctus du myocarde induit par une cryolésion chez l’axolotl peut être appliqué pour étudier les mécanismes de base impliqués dans la régénération myocardique chez ce tétrapode. L’axolotl est tolérant à l’infarctus du myocarde induit par une cryolésion, qui affecte au moins 45 % du ventricule, entraînant une diminution du volume systolique et du débit cardiaque sans aucun changement de comportement dans son mode de vie relativement langoureux.
En bref, pour induire une cryolésion, une incision ventrale est pratiquée sur le thorax d’un axolotl anesthésié. On accède au ventricule à l’aide d’une dissection contondante et une cryosonde prérefroidie est appliquée pendant 10 secondes pour induire une cryolésion. L’incision ventrale est suturée et l’animal se rétablit rapidement sans aucun signe de changement de comportement une fois la conscience retrouvée. Les animaux témoins/simulacres reçoivent un traitement similaire, mais subissent une cryosonde non refroidie. Les performances cardiaques peuvent être surveillées à l’aide de l’échocardiographie (systèmes d’échographie à haute fréquence nécessaires, ≥20 MHz) comme décrit de manière exhaustive sur des cœurs d’axolotls sains précédemment20, et la fraction d’infarctus peut être estimée de manière non invasive et répétée au cours du processus de régénération. Les cœurs infarctus peuvent être prélevés à tout moment au cours du processus de régénération de 3 mois, cryosectionnés pour l’histologie et colorés à l’aide de procédures standard (par exemple, l’éosine et l’hématoxyline ou la coloration trichrome de Masson). En particulier, la coloration trichrome de Masson permet une distinction claire entre les parties infarctus et les parties saines du ventricule. La fraction d’infarctus du ventricule est déterminée à l’aide de techniques stéréologiques précédemment décrites pour les études cardiaques21.
Protocole
Ce protocole est conforme à toutes les réglementations et directives institutionnelles (Université d’Aarhus) et nationales (protocole # 2015−15−0201−00615) institutionnelles (Université d’Aarhus) et nationales (protocole # 2015−15−00615) en matière de soins aux animaux.
1. Préparation de la cryosonde
- Coupez trois brins de fil de cuivre de 1 mm de diamètre en morceaux de 10 cm.
- Enroulez des brins de cuivre en une seule corde.
- À l’aide d’une torche à gaz, faites fondre une extrémité de la corde de cuivre pour former une extrémité sphérique de 2 mm de diamètre.
REMARQUE : Le cuivre a une conductivité thermique élevée (401 W m-1 K-1 à 0 °C) et peut être moulé à des températures facilement gérables (point de fusion 1084,6 °C), mais une surface en cuivre a tendance à se corroder avec le temps, surtout si elle entre en contact avec du sang, ce qui réduit considérablement la conductivité thermique. Ainsi, une cryosonde à base de cuivre doit être polie de temps en temps. D’autres métaux plus stables qui peuvent également être utilisés pour les cryosondes sont l’argent (conductivité thermique 428 W, m-1 , K-1 à 0 °C, point de fusion 961,8 °C) et l’or (conductivité thermique 318 W, m-1 , K-1 à 0 °C, point de fusion 1064,2 °C). - Retirez le piston d’une seringue de 2 ml et retirez la tête en caoutchouc souple.
- Insérez l’extrémité non sphérique de la ficelle de cuivre dans la seringue et attachez-la au pistolet
- Remettez le piston en place dans la seringue (Figure 1A).
REMARQUE : Lorsque la cryosonde n’est pas utilisée, la corde de cuivre doit être protégée en tirant complètement le piston vers l’arrière. Lors de l’utilisation, le piston est enfoncé à fond pour exposer la corde de cuivre au bain de refroidissement.
2. Infarctus du myocarde induit par une cryolésion
- Anesthésie l’axolotl en l’immergeant dans 200 mg/L d’anesthésique benzocaïne. Trente minutes d’immersion donneront ~2,5 h d’anesthésie complète.
REMARQUE : La benzocaïne est insoluble dans l’eau et doit d’abord être solubilisée dans 3 mL (par 200 mg de benzocaïne) d’acétone qui est ensuite ajoutée au bain-marie. Une immersion prolongée dans la benzocaïne peut nuire à la récupération, c’est pourquoi le temps passé dans la benzocaïne doit être surveillé attentivement. - Placez l’axolotl avec la face ventrale vers le haut sur une boîte de chirurgie (tête à gauche pour un chirurgien droitier). Immobiliser en enveloppant toutes les parties du corps, à l’exception du thorax, dans des lingettes tissulaires imbibées de solution anesthésique (figure 1B).
REMARQUE : Enfermer l’animal dans des lingettes humides garantit un environnement humide crucial pour un amphibien aquatique et élimine le besoin de pommade vétérinaire sur les yeux. Utilisez des instruments autoclavés dans les étapes ultérieures pour assurer la stérilité pendant la chirurgie. - À l’aide de ciseaux d’iridectomie, faites une incision longitudinale de ~1 cm dans la peau, légèrement à droite jusqu’à la ligne médiane du thorax (figure 1C).
- Utilisez une pince pour libérer les plaques cartilagineuses de la ceinture pectorale.
REMARQUE : La ceinture pectorale est une structure délicate et des précautions doivent être prises pour ne pas endommager ses éléments car cela peut nuire à la cicatrisation ultérieure des plaies et à la locomotion et au bien-être des animaux. - Ouvrez doucement le péricarde exposé avec une incision sans endommager les structures cardiaques sous-jacentes. Avant que le liquide péricardique ne s’échappe, aspirez-le dans une seringue de 1 ml munie d’une aiguille émoussée de calibre 2 (figure 1D).
- Placez une pince émoussée avec une ouverture fixe (~1 cm) dans la plaie pour garder les bords de la plaie et les plaques de cartilage écartés (Figure 1E).
- Placez la cryosonde dans le liquide N2 avec le fil de cuivre exposé pendant au moins 2 minutes.
REMARQUE : Si la masse du fil de cuivre est trop petite (c’est-à-dire qu’elle est trop courte) ou s’il est insuffisamment refroidi, une cryolésion transmurale incomplète indésirable peut en résulter. - Essuyez doucement le ventricule exposé à l’aide d’un coton-tige ou de lingettes en tissu fermement roulées pour vous assurer qu’il n’y a pas de liquide à la surface du ventricule (figure 1F).
- Retirer la cryosonde refroidie à -196 °C du liquide N2 et l’appliquer directement sur le ventricule exposé (Figure 1H). Il se fixera au ventricule. La position de la cryosonde doit se faire sur le côté latéral du ventricule vers l’apex pour éviter d’endommager d’autres structures cardiaques et permettre des coupes transversales ultérieures pour la microscopie contenant à la fois du myocarde sain et du myocarde infarctus. Après 10 s, appliquez le liquide péricardique précédemment collecté sur l’extrémité de la cryosonde (Figure 1I). Cela dégèlera la sonde et permettra de se détacher du ventricule.
REMARQUE : L’application de la cryosonde sur un ventricule avec un excès d’eau entraîne soit un cryoinfarctus incomplet, si la sonde est chauffée trop rapidement, soit des lésions myocardiques trop étendues, si une fine couche d’eau couvrant toute la surface du ventricule est instantanément gelée. Aucune de ces situations n’est souhaitable. Dans le cas d’une induction réussie d’une cryolésion, un petit gonflement circulaire rouge apparaîtra sur le ventricule (Figure 1J). Lors de la manipulation d’animaux fictifs, une cryosonde non refroidie est placée de la même manière pendant 10 s (figure 1G). - Placez le péricarde sur le ventricule, retirez la pince qui maintenait la plaie ouverte et réorganisez les plaques cartilagineuses de la ceinture pectorale.
REMARQUE : Si vous effectuez une échocardiographie ultérieure pour évaluer la fonction cardiaque, il est crucial que toutes les poches d’air, même les minuscules bulles susceptibles de se produire sous les plaques cartilagineuses, soient éliminées car elles induisent des artefacts d’imagerie. Ces bulles peuvent être éliminées en pressant doucement le tissu ou en ajoutant une solution de Ringer d’amphibiens autoclavée (6,6 g/L de NaCl, 0,15 g/L de KCl, 0,15 g/L de CaCl2, 0,2 g/L de NaHCO3 dans de l’eau distillée) à la surface de la plaie pour dissoudre les bulles d’air. - Suturez la peau (3-5 points de suture) à l’aide d’un fil soluble (6-0) (Figure 1K).
- Couvrez la zone chirurgicale avec des lingettes humides soulevées au-dessus de la plaie, puis trempez-les dans une solution anesthésiante.
- Placez la boîte chirurgicale avec l’animal sur de la glace pendant 2 h pour permettre la formation initiale d’un épiderme de plaie, en scellant les bords de la plaie avant que l’animal ne soit exposé à son environnement aquatique non stérile.
- Transférez l’animal dans un récipient propre avec de l’eau d’aquarium. L’animal il devrait être en train de reprendre conscience à ce moment-là. Observez l’animal jusqu’à ce qu’il ait repris pleine conscience et coordonné ses mouvements. Cessez de vous nourrir et de changer d’eau pendant deux jours après l’opération et gardez l’axolotl seul dans son propre aquarium pour permettre la fermeture de la plaie avant que les perturbations ne soient réintroduites.
REMARQUE : Après avoir repris conscience, la plupart des axolotls ont le désir d’avaler de l’air. Pour faciliter ce processus et limiter la quantité de mouvement nécessaire, il peut être bénéfique d’abaisser le niveau d’eau dans l’aquarium peu de temps après la chirurgie pendant 1 à 2 jours après la chirurgie. Une faible concentration de benzocaïne (20 mg/L) peut être utilisée comme analgésique pendant 24 heures après la chirurgie.
3. Mesure non invasive de la fraction d’infarctus par échocardiographie
- Anesthésie l’axolotl comme décrit à l’étape 2.1.
- Placez l’animal en position couchée dans un petit récipient avec 3 à 5 mm de solution anesthésique couvrant la surface ventrale.
- Placez le transducteur à ultrasons le long de l’axe longitudinal de l’animal, légèrement à droite de la ligne médiane de la région thoracique.
- Pour une estimation bidimensionnelle de la fraction d’infarctus [IF(échographie, 2D)], faites défiler le transducteur jusqu’à ce que la zone d’infarctus et le ventricule apparaissent maximaux en mode B (Figure 2A-D, matériel supplémentaire 1-2).
- Acquérez ≥3 cycles cardiaques avec > 50 images/s.
- Mesurez la section transversale du ventricule (CSAv) et de la zone d’infarctus (CSAi) à la fin de la diastole et estimez la fraction d’infarctus bidimensionnelle en supposant une forme de ventricule sphérique et une forme de zone d’infarctus hémisphérique à l’aide de l’équation :
 (1)
(1)
REMARQUE : Pour évaluer les hypothèses géométriques de la forme du ventricule et de la zone d’infraction, la sonde peut être tournée de 90° pour afficher la vue du cœur dans l’axe court (Figure 2E-F, Matériel supplémentaire 3). - Pour une estimation tridimensionnelle de la fraction d’infarctus, positionnez le transducteur à gauche ou à droite jusqu’à ce que seule une petite partie du ventricule apparaisse à la fin de la diastole ventriculaire.
- Par pas (z) de 0,5 mm (pour les petits animaux, la masse corporelle ≤ de 20 g) ou de 1 mm (grands animaux, masse corporelle > 20 g), déplacez le transducteur sur le ventricule et acquérez au moins 3 cycles cardiaques par pas/tranche.
REMARQUE : Pour une précision raisonnable, 8 à 12 tranches (n) doivent être acquises. - Mesurer CSAv et CSAi à la fin de la diastole pour chaque tranche (j) et estimer la fraction d’infarctus tridimensionnelle [IF(échographie, 3D)] sans aucune hypothèse géométrique de forme du ventricule et de l’infraction à l’aide de l’équation :
 (2)
(2)
REMARQUE : L’acquisition bidimensionnelle et tridimensionnelle peut être utilisée pour mesurer géométriquement la fonction cardiaque (volume systolique et débit cardiaque), comme décrit dans les sections 3 et 6 de Dittrich et al. (2018)20. De même, les intégrales de temps de vitesse acquises de la vitesse des ondes pulsées (Figure 2G) peuvent également être utilisées pour mesurer la fonction cardiaque, comme décrit à la section 3 de Dittrich et al. (2018)20. - Extraire les régions d’intérêt de CSAv et CSAi dessinées à l’étape 3.9 sous forme de masques binaires avec un espacement z entre les coupes pour modéliser en trois dimensions le ventricule et la zone d’infarctus à la fin de la diastole et à l’extrémité de la systole (Figure 2H, matériel supplémentaire 4).
4. Histologie quantitative non biaisée pour mesurer la fraction d’infarctus
- Explorez le cœur d’un axolotl anesthésié décrit aux étapes 2.2 à 2.6.
- À l’aide d’une seringue de 1 mL munie d’une aiguille de calibre 26, injectez lentement 5 μL/g de masse corporelle de 1000 UI/mL de solution héparinée d’amphibiens de Ringer dans le sinus veineux et attendez 2 min pour laisser l’anticoagulant se répartir dans la circulation.
- Euthanasier par décapitation et hachement le cerveau et exciser tout le cœur en coupant d’abord les vaisseaux d’entrée, puis la voie d’écoulement.
- Transférez le cœur en le soulevant doucement par la voie d’évacuation dans une boîte de Pétride 60 × 15 mm 2 contenant une solution de Ringer d’amphibiens.
- Sous grossissement, laver tout sang restant dans le cœur en remplissant doucement le sinus veineux avec 100 UI/mL de solution de Ringer héparinisée.
REMARQUE : Bien que la pré-fixation du cœur puisse être effectuée en perfusant le cœur avec du formol tamponné ou du paraformaldéhyde, cela n’est pas nécessaire, car la section est effectuée à une température de congélation. Par la suite, la fixation des sections sur des lames de verre peut être effectuée. Un cœur entièrement lavé apparaîtra pâle et blanchâtre et ne contiendra aucune trace de globules rouges. De petits caillots sanguins à la surface du ventricule et des oreillettes sont susceptibles de se former. Ils n’affectent pas la précision de la procédure d’histologie quantitative ultérieure. - Transférer le cœur dans du papier de soie non pelucheux pour éponger pendant 1 min.
- Préparez un cryomoule de taille adéquate en appliquant une seule goutte de composé à température de coupe optimale et transférez le cœur dans la goutte. Pressez doucement le cœur vers le bas.
- Appliquez un composé de température de coupe plus optimal pour remplir le cryomoule et assurez-vous que le ventricule reste au fond. Laissez le moule pendant 5 minutes pour laisser la température de coupe optimale se répartir dans l’échantillon.
- Congelez le moule en le plaçant sur un couvercle à partir d’une boîte à pointes de pipette flottant sur de l’azote liquide.
REMARQUE : Pour une congélation instantanée plus contrôlée, les cœurs peuvent être conservés pendant 1 heure pendant la nuit dans une solution de saccharose à 10-30 % et la congélation instantanée peut être effectuée à l’aide d’isopentane refroidi à l’azote liquide (2-méthylbutane). D’après notre expérience, le résultat final n’est pas très différent. - Tremper le cryomoule dans un cryostat réglé entre -18 et -22 °C pendant au moins 1 h avant de sectionner.
- Section d’échantillonnage à 10 μm d’épaisseur de tranche et prélèvement toutes les 10e tranche pour obtenir une épaisseur de dalle (t) de 100 μm. Continuez à sectionner jusqu’à ce que tout le cœur soit sectionné.
REMARQUE : Différentes épaisseurs de tranches et de dalles peuvent être utilisées, mais il est important que la collecte des tranches commence au point même où la lame touche le ventricule et que tout le cœur soit sectionné avec au moins 10 à 12 dalles régulièrement espacées. Plus d’une tranche par dalle peut être collectée pour fournir des jeux en double. - Des coupes de tissus tachés avec des protocoles standard pour l’hématoxyline et l’éosine ou le trichrome de Masson pour fournir une distinction claire entre l’épicarde, le myocarde, les valves et la zone d’infarctus.
- Numériser la coupe de tissus à l’aide d’une caméra, d’un microscope ou d’un scanner de lames à un grossissement suffisant pour révéler clairement la structure trabéculée du ventricule axolotl (Figure 2I).
- Chargez la pile d’images dans ImageJ (https://imagej.nih.gov/ij/index.html) et initialisez le plug-in de compteur de cellules (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Exécutez une macro de grille polyvalente (https://imagej.nih.gov/ij/macros/Multipurpose_grid.txt) et générez une grille de points avec une densité de grille adéquate.
REMARQUE : La densité de la grille (surface de la grille) dépend de la taille et de la morphologie de l’échantillon. Pour fournir une précision souhaitable, au moins 100 à 200 intersections de points de la grille et de chacune des structures d’intérêt doivent être assurées. - Comptez le nombre d’intersections entre la grille de points et les structures d’intérêt à l’aide du plugin de compteur de cellules (Figure 2I, grossissement à droite).
REMARQUE : Il est important pour la précision de n’inclure que les intersections qui apparaissent précisément au point de visée du réticule. - Calculez la fraction d’infarctus à partir de l’aire de la grille de points prédéfinie [Ai(p) et Av(p)], de l’épaisseur de la dalle et du nombre d’intersections de la grille de points à chaque plaque (Pj) avec un myocarde infarctus et un myocarde ventriculaire total à l’aide de la formule :
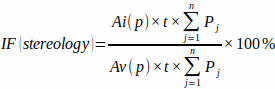 (3)
(3)
Résultats
Chez les axolotls d’une masse corporelle de 11,8 ± 1,3 g et d’une longueur totale de 11,8 ± 0,5 cm, la procédure de cryolésion effectuée avec une cryosonde de 2 mm (diamètre) aboutit à une zone infarctus couvrant 45,4 ± 14,2 % du myocarde ventriculaire à 7 jours après la blessure dans laquelle la zone d’infarctus est complètement développée [Figure 2I, comparer la section du cœur sain avant l’infraction (en haut) et 7 jours après l’infraction (en bas)]. La procédure a un taux de mortalité de 2,2 % (2/90 animaux). La procédure permet d’obtenir une zone de blessure bien définie qui peut être visualisée, quantifiée et modélisée à l’aide d’une échocardiographie non invasive (Figure 2C-H, matériel supplémentaire 1-4). Initialement, l’infarctus du myocarde induit par une cryolésion affecte significativement la fonction cardiaque, réduisant le volume systolique à 62,2 % et le débit cardiaque à 73,9 % 7 jours après la blessure par rapport à avant la blessure avec une récupération progressive de la forme et de la fonction sur trois mois (données non présentées). Aucun changement de comportement après une cryolésion myocardique n’est observé chez l’axolotl relativement tranquille.

Figure 1 : Procédure de cryoinfarctus. A, une cryosonde sur mesure est fabriquée en enroulant trois fils de cuivre, en faisant fondre l’extrémité en une sphère et en fixant le fil au piston d’une seringue de 2,5 ml. B-L, la procédure de cryoinfarctus. Après l’enveloppement de toutes les parties du corps à l’exception de la zone chirurgicale dans des lingettes humides (B), une incision ventrale sur le thorax légèrement à droite de la ligne médiane (illustrée sur B) est réalisée avec des ciseaux d’iridectomie (C), et la ceinture pectorale est libérée par dissection du moignon. Le péricarde est ouvert doucement à l’aide d’une incision et le liquide péricardique est aspiré dans une seringue de 1 mL à l’aide d’une aiguille émoussée de calibre 23 (D). Le ventricule est exposé et la plaie est maintenue ouverte à l’aide d’une pince d’une largeur d’ouverture prédéfinie (E) et tout liquide restant sur le ventricule est essuyé (F). Pour les chirurgies fictives, une cryosonde non refroidie (G) est appliquée de la même manière que pour les cryoblessures, dans laquelle la cryosonde refroidie à l’azote liquide (-196 °C) est appliquée sur la paroi latérale du ventricule vers l’apex (H). Au bout de 10 s, le liquide péricardique est réappliqué sur la cryosonde pour le libérer du ventricule (I). Cela donne une zone de cryolésion clairement définie (J). Enfin, le péricarde et la ceinture pectorale sont déposés sur le dessus du cœur et la peau est suturée (3 à 5 points de suture) avec une suture soluble (K). L’animal est laissé sur la glace pendant 2 heures pour amorcer le processus de cicatrisation (L). Le crâne est vers la gauche sur B-L, représentant l’orientation de l’animal pour un chirurgien avec une main droite dominante. Veuillez cliquer ici pour voir une version agrandie de cette figure.
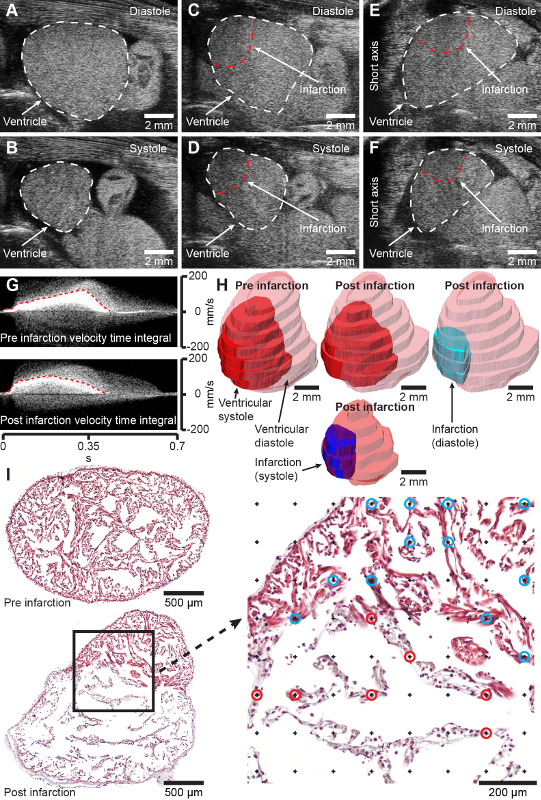
Figure 2 : Résultats attendus. Images axiales longues en mode B du ventricule axolotl sain en diastole (A) et systole (B). Images en mode C et D, grand axe en mode B du ventricule axolotl cryoléché (2 jours après la blessure) en diastole (C) et en systole (D). Images à axe court en mode B du ventricule axolotl cryoblessé (2 jours après la blessure) en diastole (E) et systole (F). G, le Doppler à ondes de pouls a acquis les intégrales de vitesse du cœur pré (en haut) et de 2 jours après l’infarctus (en bas). H, Modélisation du cœur pré-infarctus et 2 jours post-infarctus à partir de l’acquisition d’une échographie tridimensionnelle. I, coupes histologiques transversales représentatives à travers le ventricule axolotl 4 jours après le simulacre (en haut) et 7 jours après l’infarctus (en bas) coloré au trichrome de Masson. Le grossissement à droite montre la grille de points pour la mesure stéréologique de la fraction d’infarctus. Les points marqués par des cercles bleus et rouges représentent l’intersection avec des tissus sains (cercles bleus) et infarctus (cercles rouges). Le crâne est vers la droite dans A-D et la droite des animaux est vers la gauche dans E-F, ce qui représente l’affichage conventionnel des images échocardiographiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Matériel supplémentaire 1 : Axe long, ventricule sain avant l’infarctus, mode B (voir Figure 2A-B). Veuillez cliquer ici pour télécharger cette vidéo.
Matériel supplémentaire 2 : Axe long, ventricule infarctus (2 jours après l’infarctus), mode B (voir Figure 2C-D). Veuillez cliquer ici pour télécharger cette vidéo.
Matériel supplémentaire 3 : Axe axial court, ventricule infarctus (2 jours après l’infarctus), mode B (voir Figure 2E-F). Veuillez cliquer ici pour télécharger cette vidéo.
Matériel supplémentaire 4 : Modèles interactifs tridimensionnels du même cœur que ceux de la figure 2A-H et du matériel supplémentaire 1-3 avant et après l’infarctus. Lancez le fichier PDF interactif dans Adobe Acrobat Reader 9 ou version ultérieure. Cliquez sur le modèle pour activer la fonction 3D. Faites pivoter, zoomez et déplacez le modèle à l’aide du curseur. Dans l’arbre du modèle situé sur le côté gauche de l’écran, tous les segments peuvent être activés/désactivés ou rendus transparents. L’arbre du modèle est construit sous la forme d’une hiérarchie qui contient plusieurs sous-couches qui peuvent être ouvertes (en sélectionnant +). Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Pour minimiser les variations expérimentales, l’intervention chirurgicale de la cryolésion doit suivre des procédures stériles et une formation chirurgicale doit être effectuée sur un certain nombre d’animaux avant de tenter d’utiliser des animaux pour des expériences régénératives spécifiques. Avec de la formation, la procédure de cryolésion peut être menée sur une large gamme de tailles et d’âges d’axolotls, des juvéniles (5 g, 7 cm) aux adultes de grande taille (100 g, 25 cm). Il est essentiel que la cryosonde ait une taille suffisante et qu’elle soit refroidie de manière adéquate pour fournir une cryolésion robuste et reproductible au ventricule de l’axolotl. Pour les très petits animaux (5-8 g, 7-9 cm), la cryosonde peut être construite avec un diamètre plus petit. Bien qu’il soit impératif que le protocole de cryolésion soit effectué à l’aide d’un anesthésique ayant des propriétés analgésiques comme la benzocaïne et le MS-222 (ou avec l’application supplémentaire d’un agent analgésique secondaire), l’échocardiographie de suivi peut être réalisée avec d’autres anesthésiques n’ayant que des propriétés analgésiques limitées, tels que le propofol, qui a été décrit comme affectant moins la fonction cardiaque que la benzocaïne et le MS-222 dans l’axolotl22.
La procédure de cryolésion est limitée en ce sens qu’elle ne produit pas d’infarctus du myocarde induit par l’ischémie par occlusion de l’artère coronaire de la même manière que les procédures de ligature de l’artère coronaire qui ressemblent davantage aux cas cliniques d’infarctus du myocarde chez l’homme. Cependant, la méthode basée sur la ligature n’est pas applicable dans le cœur amphibien trabéculé avec très peu de vascularisation coronaire et un apport en oxygène principalement luminal. De plus, l’infarctus du myocarde induit par cryolésion a été décrit pour récapituler la plupart des conséquences pathologiques des infarctus du myocarde induits par l’ischémie14,16. La zone de lésion générée par la cryolésion est fortement localisée dans le tissu à proximité de la cryosonde et, bien que cela ne ressemble pas à un infarctus complexe et ramifié résultant d’un blocage coronarien, il est avantageux dans un cadre expérimental car la zone de frontière entre le tissu sain et le tissu infarctus peut être facilement reconnue, et la progression des cardiomyocytes nouvellement formés peut être étudiée.
L’axolotl est un animal considérablement plus grand que le poisson-zèbre avec un système cardiovasculaire plus compliqué, y compris un cœur composé de trois chambres (deux oreillettes, un ventricule) et une séparation fonctionnelle, bien que non anatomique, du flux sanguin dans les courants oxygénés et désoxygénés23 par rapport au cœur à deux chambres et au système de flux en série que l’on trouve chez les téléostéens. La procédure de cryolésion précédemment décrite chez le poisson-zèbre n’implique pas de suture postopératoire de la surface ventrale incisée16,17. Ceci est nécessaire chez l’axolotl pour éviter une exposition inutile du cœur à l’environnement aquatique non stérile de l’habitat de laboratoire de l’animal.
L’histologie quantitative non biaisée basée sur la stéréologie est actuellement sous-déclarée dans le domaine de la régénération, dans lequel la plupart des mesures quantitatives de la fraction d’infarctus reposent sur le dessin de zone sur une coupe histologique au milieu de la zone d’infarctus et, dans certains cas, sur deux coupes voisines24. Étant donné que le concept de stéréologie peut être appliqué dans les examens histologiques de n’importe quelle espèce modèle pour fournir des mesures plus robustes et non biaisées, nous proposons que cette méthode librement disponible soit incorporée dans les évaluations quantitatives de la régénération cardiaque non seulement chez l’axolotl, mais chez toutes les espèces régénératives.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier Casper Bindzus Foldager, Asger Andersen et Michael Pedersen (tous au Département de médecine clinique de l’Université d’Aarhus) et David Gardiner (Département de biologie du développement et cellulaire, Université de Californie à Irvine) pour leur aide dans le développement initial du modèle de cryolésion de l’axolotl et de l’examen échographique.
matériels
| Name | Company | Catalog Number | Comments |
| S&T Scissor SAS-15 | S&T AG - Microsurgical Instruments | Iridectomy scissors | |
| Vevo 2100 | Fujifilm, VisualSonics | High frequency ultrasound scanner |
Références
- Forouzanfar, M. H., et al. Assessing the global burden of ischemic heart disease, part 2: analytic methods and estimates of the global epidemiology of ischemic heart disease in 2010. Global Heart. 7, 331-342 (2012).
- Go, A. S., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129, 399-410 (2014).
- Murry, C. E., Reinecke, H., Pabon, L. M. Regeneration gaps: observations on stem cells and cardiac repair. Journal of the American College of Cardiology. 47, 1777-1785 (2006).
- Laflamme, M. A. Heart regeneration. Nature. 473, 326-335 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298, 2188-2190 (2002).
- Oberpriller, J. O., Oberpriller, J. C. Response of the adult newt ventricle to injury. Journal of Experimental Zoology. 187, 249-260 (1974).
- Cano-Martínez, A., et al. Functional and structural regeneration in the axolotl heart (Ambystoma mexicanum) after partial ventricular amputation. Archivos de Cardiología de México. 80, 79-86 (2010).
- Witman, N., Murtuza, B., Davis, B., Arner, A., Morrison, J. I. Recapitulation of developmental cardiogenesis governs the morphological and functional regeneration of adult newt hearts following injury. Developmental Biology. 354, 67-76 (2011).
- Mercer, S. E., Odelberg, S. J., Simon, H. -. G. A dynamic spatiotemporal extracellular matrix facilitates epicardial-mediated vertebrate heart regeneration. Developmental Biology. 382, 457-469 (2013).
- Piatkowski, T., Mühlfeld, C., Borchardt, T., Braun, T. Reconstruction of the myocardium in regenerating newt hearts is preceded by transient deposition of extracellular matrix components. Stem Cells and Development. 22, 1921-1931 (2013).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11 (21), (2011).
- González-Rosa, J. M., Martín, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138, 1663-1674 (2011).
- Schabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS ONE. 6 (4), 18503 (2011).
- Van den Bos, E. J., Mees, B. M. E., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. The American Journal of Physiology: Heart and Circulatory Physiology. 289, 1291-1300 (2005).
- Yang, Y., et al. Characterization of cryoinjury-induced infarction with manganese-and gadolinium-enhanced MRI and optical spectroscopy in pig hearts. Magnetic Resonance Imaging. 28, 753-766 (2010).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7, 782-788 (2012).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Lauridsen, H., Pedersen, M. Rebuilding a heart: complete regeneration after myocardial infarction in the axolotl. The Federation of American Societies for Experimental Biology Journal. 28 (1), (2014).
- McCusker, C., Gardiner, D. M. The axolotl model for regeneration and aging research: a mini-review. Gerontology. 57, 565-571 (2011).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D Echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments. (141), e57089 (2018).
- Mühlfeld, C., Nyengaard, J. R., Mayhew, T. M. A review of state-of-the-art stereology for better quantitative 3D morphology in cardiac research. Cardiovascular Pathology. 19, 65-82 (2010).
- Thygesen, M. M., Rasmussen, M. M., Madsen, J. G., Pedersen, M., Lauridsen, H. Propofol (2,6-diisopropylphenol) is an applicable immersion anesthetic in the axolotl with potential uses in hemodynamic and neurophysiological experiments. Regeneration (Oxf.). 4, 124-131 (2017).
- Malvin, G. M., Heisler, N. Blood flow patterns in the salamander, Ambystoma tigrinum, before, during and after metamorphosis. Journal of Experimental Biology. 137, 53-74 (1988).
- Juul-Belling, H., Hofmeister, W., Andersen, D. C. A systematic exposition of methods used for quantification of heart regeneration after apex resection in zebrafish. Cells. 9, 548 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon