Method Article
إصابات التبريد الناجمة عن تجديد القلب في قنافذ البحر وتخطيط صدى القلب والأنسجة الكمية غير المتحيزة لتقييم التقدم التجديدي
In This Article
Summary
نقدم هنا بروتوكول جراحة للحث على إصابة عضلة القلب البطينية في قنافذ البحر. بالإضافة إلى ذلك ، نقدم بروتوكولا لتقدير جزء الاحتشاء بشكل غير جراحي أثناء عملية التجدد باستخدام تخطيط صدى القلب وبروتوكول لقياس جزء الاحتشاء بدقة في القلب المستأصل مع الأنسجة الكمية غير المتحيزة.
Abstract
تمثل البرمائيات والسمندل والنيوت مجموعة النشوء والتطور الأقرب إلى الثدييات القادرة على إجراء تجديد كامل لعضلة القلب بعد استئصال البطين. ولد نموذج الاستئصال معرفة أساسية بالعمليات التي ينطوي عليها إصلاح القلب. ومع ذلك ، فإن النموذج لا يرتبط بشكل جيد بالمواقف السريرية التي يكون فيها تلف الأنسجة ، وموت الخلايا المبرمج ، والنخر ، والتليف ، والتضخم كلها عواقب ضارة رئيسية لاحتشاء عضلة القلب الناجم عن نقص التروية بدلا من إزالة الأنسجة. من ناحية أخرى ، يشبه احتشاء عضلة القلب الناجم عن الإصابات بالتبريد احتشاء عضلة القلب الناجم عن نقص التروية بشكل وثيق. نقدم هنا وصفا مفصلا لإجراء الإصابات بالتبريد في قنافذ البحر (Ambystoma mexicanum) ، والذي يوفر أداة للتحقيق في الآليات الأساسية في إصلاح القلب في نموذج رباعي الأرجل. بالإضافة إلى ذلك ، نقدم طرقا كمية لتقدير حجم الاحتشاء بشكل غير جراحي في الجسم الحي باستخدام تخطيط صدى القلب ولقياس حجم الاحتشاء بدقة باستخدام علم الأنسجة الكمي غير المتحيز من الجسم الحي.
Introduction
أمراض القلب الإقفارية هي سبب رئيسي للوفيات على مستوىالعالم 1،2. يؤدي احتشاء عضلة القلب الناجم عن نقص التروية إلى موت الخلايا على نطاق واسع في خلايا عضلة القلب3. على الرغم من أن التدخل الطبي السريع يمكن أن يقلل من خطر الزوال الفوري ، إلا أن الاستجابة الليفية التي يترتب عليها والتي يتشاركها البشر مع الثدييات التقليدية (الفأر ، الفئران ، الأرانب ، الخنازير ، إلخ) تؤدي إلى تكوين أنسجة ندبية يمكن أن تؤدي في النهاية إلى تضخم القلب وعدم انتظام ضربات القلب وفشل القلب4. على عكس الثدييات ، فإن تجديد القلب راسخ في بعض النماذج الحيوانية غير السلى مثل الزرد5 والسمندل6. تقليديا ، تمت دراسة تجديد القلب في هذه الأنواع بعد استئصال البطين الجزئي أو القرص5،6،7،8،9،10. ومع ذلك ، في عام 2011 ، طورت ثلاث مجموعات بشكل مستقل تقنية احتشاء عضلة القلب الناجم عن الإصابات بالتبريد في أسماك الزرد11،12،13. تؤدي تقنية الإصابة بالتبريد إلى نخر وموت الخلايا المبرمج في جزء كبير من بطين قلب الزرد وتراكم أولي للأنسجة الليفية التي تمثل عن كثب التطور المرضي لقلب الثدييات بعد الاحتشاء الإقفاري مقارنة باستئصال البطين11،12،13. بالإضافة إلى ذلك ، أثبتت المقارنات المنهجية لاحتشاء عضلة القلب الناجم عن الإصابات بالتبريد مع احتشاء عضلة القلب الناجم عن نقص التروية عن طريق ربط الشريان التاجي في الفأر والخنزير أن تقنية الإصابة بالتبريد هي بديل مفيد في نماذج الثدييات14،15. مستوحاة من الأساليب المتبعة في نموذج الإصابة بالتبريد لسمك الزرد16،17 ، قمنا بتطوير نموذج مماثل في قنافذ البحر18 ، وهي برمائيات تشتهر بقدراتها التجديدية19 ، والتي تسمح بالتحقيق في الآليات التي ينطوي عليها إصلاح القلب في هذا رباعي الأرجل بعد تلف الأنسجة بدلا من إزالة الأنسجة.
نقدم هنا بروتوكولا مفصلا حول كيفية إجراء احتشاء عضلة القلب الناجم عن الإصابة بالتبريد في قنفذ البحر. نحن نركز بشكل خاص على الخطوات الحاسمة السريعة والحد الأدنى من التدخل الجراحي التي تزيد من البقاء على قيد الحياة والتعافي والتكاثر التجريبي. بالإضافة إلى ذلك ، نقدم إرشادات للتقنيات المناسبة لتقييم التجديد التشريحي في الجسم الحي باستخدام تخطيط صدى القلب وخارج الجسم الحي باستخدام علم الأنسجة الكمي غير المتحيز القائم على علم النجم.
يمكن تطبيق احتشاء عضلة القلب الناجم عن الإصابات بالتبريد في قنافذ البحر للتحقيق في الآليات الأساسية المشاركة في تجديد عضلة القلب في هذا رباعي الأرجل. قنافذ البحر متسامحة مع احتشاء عضلة القلب الناجم عن الإصابات بالتبريد ، والذي يصيب ما لا يقل عن 45٪ من البطين ، مما يؤدي إلى انخفاض في حجم السكتة الدماغية ونتاج القلب دون أي تغييرات سلوكية في نمط حياته الضعيف نسبيا ، ومع ذلك ، فإن الإصابات الأكثر شدة من المحتمل أن تؤدي إلى انخفاض صحة.
باختصار ، للحث على الإصابة بالتبريد ، يتم إجراء شق بطني على الصدر من قنافذ البحر المخدرة. يتم الوصول إلى البطين باستخدام تشريح حاد ويتم تطبيق مسبار تبريد مبرد مسبقا لمدة 10 ثوان للحث على الإصابة بالتبريد. يتم خياطة الشق البطني ويتعافى بسرعة دون أي علامات على التغيرات السلوكية بعد استعادة الوعي. تتلقى التحكم / الزائفة معاملة مماثلة ولكنها تعاني من مسبار تبريد غير مبرد. يمكن مراقبة أداء القلب باستخدام تخطيط صدى القلب (أنظمة الموجات فوق الصوتية عالية التردد ضرورية ، ≥20 ميجاهرتز) كما هو موضح بشكل شامل على قلوب قنافذ البحر السليمة سابقا20 ، ويمكن تقدير جزء الاحتشاء بشكل غير جراحي ومتكرر أثناء عملية التجديد. يمكن حصاد القلوب الاحتشية في أي وقت خلال عملية التجدد التي تستغرق 3 أشهر ، وتقطيعها بالتبريد للأنسجة ، وتلطيخها باستخدام الإجراءات القياسية (على سبيل المثال ، اليوزين والهيماتوكسيلين أو تلطيخ ماسون ثلاثي الألوان). على وجه الخصوص ، يسمح تلطيخ ماسون ثلاثي الألوان بتمييز واضح بين الأجزاء الاحتشائية والسليمة من البطين. يتم تحديد جزء احتشاء البطين باستخدام التقنيات التجسيمية الموصوفة سابقا لدراسات القلب21.
Protocol
يتوافق هذا البروتوكول مع جميع اللوائح والمبادئ التوجيهية المؤسسية (جامعة آرهوس) والوطنية (بروتوكول التفتيش الوطني الدنماركي للتجارب على # 2015-15−0201-00615) لرعاية.
1. تحضير المسبار بالتبريد
- قطع ثلاثة خيوط من الأسلاك النحاسية بقطر 1 مم إلى قطع 10 سم.
- لفائف خيوط النحاس في سلسلة واحدة.
- باستخدام شعلة الغاز ، قم بإذابة أحد طرفي الخيط النحاسي لتشكيل نهاية كروية بقطر 2 مم.
ملاحظة: يتميز النحاس بموصلية حرارية عالية (401 واط م-1 K-1 عند 0 درجة مئوية) ويمكن تشكيله في درجات حرارة يمكن التحكم فيها بسهولة (نقطة الانصهار 1084.6 درجة مئوية) ولكن السطح النحاسي يميل إلى التآكل بمرور الوقت خاصة إذا لامس الدم ، مما يقلل من التوصيل الحراري بشكل ملحوظ. وبالتالي ، يجب تلميع المسبار المبرد القائم على النحاس من حين لآخر. المعادن البديلة الأكثر استقرارا التي يمكن استخدامها أيضا في المجسات المبردة هي الفضة (الموصلية الحرارية 428 واط م -1 K-1 عند 0 درجة مئوية ، نقطة الانصهار 961.8 درجة مئوية) والذهب (الموصلية الحرارية 318 واط م -1 K-1 عند 0 درجة مئوية ، نقطة الانصهار 1064.2 درجة مئوية). - قم بإزالة المكبس من حقنة سعة 2 مل واسحب الرأس المطاطي الناعم.
- أدخل الطرف غير الكروي للخيط النحاسي من خلال المحقنة واربطه بالمسدس
- أعد المكبس إلى مكانه في المحقنة (الشكل 1 أ).
ملاحظة: عندما لا يكون المسبار المبرد قيد الاستخدام ، يجب حماية الخيط النحاسي عن طريق سحب المكبس بالكامل للخلف. عند الاستخدام ، يتم دفع المكبس بالكامل لتعريض الخيط النحاسي لحمام التبريد.
2. احتشاء عضلة القلب الناجم عن الإصابة بالتبريد
- تخدير قنافذ البحر عن طريق غمره في 200 مجم / لتر من مخدر البنزوكايين. ثلاثون دقيقة من الغمر ستنتج ~ 2.5 ساعة من التخدير الكامل.
ملاحظة: البنزوكائين غير قابل للذوبان في الماء ويجب أولا إذابته في 3 مل (لكل 200 مجم بنزوكائين) الأسيتون الذي يضاف لاحقا إلى الحمام المائي. يمكن أن يؤدي الانغماس المطول في البنزوكايين إلى إعاقة الشفاء ، لذلك يجب مراقبة الوقت في البنزوكايين بعناية. - ضع قنافذ البحر مع الجانب البطني لأعلى على طبق الجراحة (الرأس إلى اليسار للجراح الأيمن). شل الحركة عن طريق تغليف جميع أجزاء الجسم باستثناء الصدر في مناديل مناديل مبللة بمحلول مخدر (الشكل 1 ب).
ملاحظة: يضمن تغليف بمناديل مبللة بيئة رطبة ضرورية للبرمائيات المائية ويلغي الحاجة إلى مرهم بيطري على العينين. استخدم الأدوات المعقمة في الخطوات اللاحقة لضمان العقم أثناء الجراحة. - استخدم مقص قزحية العين لعمل شق طولي ~ 1 سم في الجلد قليلا إلى خط الوسط للصدر (الشكل 1 ج).
- استخدم الملقط لتحرير ألواح الغضروف في الحزام الصدري.
ملاحظة: الحزام الصدري عبارة عن هيكل دقيق ويجب توخي الحذر حتى لا تتلف عناصره لأن ذلك قد يضعف التئام الجروح لاحقا وحركة ورفاهيتها. - افتح التامور المكشوف برفق بشق دون الإضرار بهياكل القلب الأساسية. قبل تسرب سائل التامور ، قم بشفطه في حقنة سعة 1 مل تحمل إبرة غير حادة قياس 2 (الشكل 1 د).
- ضع ملقطا حادا بفتحة محددة (~ 1 سم) في الجرح لإبقاء حواف الجرح وألواح الغضاريف منفصلة (الشكل 1 ه).
- ضع المسبار المبرد في السائل N2 مع تعرض السلك النحاسي لمدة دقيقتين على الأقل.
ملاحظة: إذا كانت كتلة السلك النحاسي صغيرة جدا (أي أنها قصيرة جدا) أو إذا تم تبريدها بشكل غير كاف ، فقد ينتج عن ذلك إصابة بالتبريد غير المرغوب فيها غير المكتملة. - امسح البطين المكشوف برفق بقطعة قطن أو مناديل ملفوفة بإحكام للتأكد من عدم وجود سائل على سطح البطين (الشكل 1F).
- قم بإزالة المسبار المبرد إلى -196 درجة مئوية من السائل N2 وقم بتطبيقه مباشرة على البطين المكشوف (الشكل 1H). سوف تعلق على البطين. يجب أن يكون وضع المسبار بالتبريد على الجانب الجانبي من البطين باتجاه القمة لتجنب تلف هياكل القلب الأخرى والسماح بأقسام عرضية لاحقة للفحص المجهري الذي يحتوي على عضلة القلب السليمة والاحتشاء. بعد 10 ثوان ، ضع سائل التامور الذي تم جمعه مسبقا على طرف المسبار المبرد (الشكل 1I). سيؤدي ذلك إلى إذابة المسبار والسماح بالانفصال عن البطين.
ملاحظة: يؤدي تطبيق المسبار بالتبريد على البطين الذي يحتوي على الماء الزائد إلى احتشاء غير مكتمل ، أو إذا تم تسخين المسبار بسرعة كبيرة ، أو تلف عضلة القلب بشكل كبير جدا ، إذا تم تجميد طبقة رقيقة من الماء تغطي السطح الكامل للبطين على الفور. ولا يمكن الاستحسان أي من الحالتين. في حالة التحريض الناجح للإصابات بالتبريد ، سيظهر تورم دائري أحمر صغير على البطين (الشكل 1J). عند التعامل مع الزائفة ، يتم وضع مسبار تبريد غير مبرد بطريقة مماثلة لمدة 10 ثوان (الشكل 1G). - ضع التامور فوق البطين ، وقم بإزالة الملقط الذي أبقى الجرح مفتوحا ، وأعد ترتيب صفائح الغضروف في الحزام الصدري.
ملاحظة: في حالة إجراء تخطيط صدى القلب اللاحق لتقييم وظائف القلب ، فمن الأهمية بمكان إزالة جميع الجيوب الهوائية ، حتى الفقاعات الدقيقة المعرضة للحدوث تحت صفائح الغضروف ، لأنها تحفز القطع الأثرية التصويرية. يمكن إزالة هذه الفقاعات عن طريق الضغط برفق على الأنسجة أو عن طريق إضافة محلول Ringer البرمائي المعقم (6.6 جم / لتر كلوريد الصوديوم ، 0.15 جم / لتر كلوريد الصوديوم ، 0.15 جم / لتر كلوريد الكنيسيوم2 ، 0.2 جم / لتر من NaHCO3 في الماء المقطر) إلى سطح الجرح لإذابة فقاعات الهواء. - خياطة الجلد (3-5 خصوش) باستخدام خيط قابل للذوبان (6-0) (الشكل 1 ك).
- قم بتغطية منطقة الجراحة بمناديل مبللة مرفوعة فوق الجرح ثم انقعها بمحلول مخدر.
- ضع طبق الجراحة مع على الجليد لمدة ساعتين للسماح بالتكوين الأولي لبشرة الجرح ، وإغلاق حواف الجرح قبل أن يتعرض لبيئته المائية غير المعقمة.
- انقل إلى وعاء نظيف به ماء الحوض. ال يجب أن يستعيد وعيه بحلول هذا الوقت. راقب حتى يستعيد وعيه الكامل وحركات منسقة. توقف عن التغذية وتغيير الماء لمدة يومين بعد الجراحة واحتفظ بقنافذ البحر بمفرده في حوض السمك الخاص به للسماح بإغلاق الجرح قبل إعادة إدخال الاضطرابات.
ملاحظة: بعد استعادة الوعي ، فإن معظم قنافذ البحر لديها رغبة في ابتلاع الهواء. لتسهيل هذه العملية والحد من مقدار الحركة المطلوبة ، قد يكون من المفيد خفض مستوى الماء في الحوض بعد فترة وجيزة من الجراحة لمدة 1-2 أيام بعد الجراحة. يمكن استخدام تركيز منخفض من البنزوكايين (20 مجم / لتر) كمسكن لمدة 24 ساعة بعد الجراحة.
3. قياس غير جراحي لجزء الاحتشاء باستخدام تخطيط صدى القلب
- تخدير قنافذ البحر كما هو موضح في الخطوة 2.1.
- ضع في وضع ضعيف في وعاء صغير به 3-5 مم من محلول التخدير الذي يغطي السطح البطني.
- ضع محول الطاقة بالموجات فوق الصوتية على طول المحور الطويل للحيوان قليلا على يمين خط الوسط للمنطقة الصدرية.
- للحصول على تقدير ثنائي الأبعاد لجزء الاحتشاء [IF (الموجات فوق الصوتية ، 2D)] ، قم بترجمة محول الطاقة حتى تظهر منطقة الاحتشاء والبطين بحد أقصى في الوضع B (الشكل 2A-D ، المواد التكميلية 1-2).
- احصل على ≥3 دورات قلبية ب > 50 إطارا / ثانية.
- قم بقياس مساحة المقطع العرضي للبطين (CSAv) ومنطقة الاحتشاء (CSAi) عند الانبساط النهائي وتقدير جزء الاحتشاء ثنائي الأبعاد بافتراض شكل البطين الكروي وشكل منطقة الاحتشاء نصف الكروي باستخدام المعادلة:
 (1)
(1)
ملاحظة: لتقييم الافتراضات الهندسية لشكل البطين ومنطقة الكسر ، يمكن تدوير محول الطاقة بزاوية 90 درجة لعرض عرض المحور القصير للقلب (الشكل 2E-F ، المواد التكميلية 3). - لتقدير ثلاثي الأبعاد لجزء الاحتشاء ، ضع محول الطاقة إما على اليسار أو اليمين حتى يظهر جزء صغير فقط من البطين في نهاية الانبساط البطيني.
- في الخطوات (ض) 0.5 مم (للحيوانات الصغيرة ، كتلة الجسم ≤ 20 جم) أو 1 مم (الكبيرة ، كتلة الجسم > 20 جم) حرك محول الطاقة عبر البطين واحصل على 3 دورات قلبية على الأقل لكل خطوة / شريحة.
ملاحظة: للحصول على دقة معقولة ، يجب الحصول على 8 - 12 شريحة (ن). - قم بقياس CSAv و CSAi عند الانبساط النهائي لكل شريحة (ي) وتقدير كسر الاحتشاء ثلاثي الأبعاد [IF (الموجات فوق الصوتية ، 3D)] دون أي افتراضات هندسية لشكل البطين والكسر باستخدام المعادلة:
 (2)
(2)
ملاحظة: يمكن استخدام كل من الاستحواذ ثنائي الأبعاد وثلاثي الأبعاد لقياس وظائف القلب (حجم السكتة الدماغية ونتاج القلب) هندسيا كما هو موضح في القسمين 3 و 6 من Dittrich et al. (2018) 20. وبالمثل ، يمكن أيضا استخدام تكاملات وقت السرعة المكتسبة من سرعة الموجة النبضية (الشكل 2G) لقياس وظيفة القلب كما هو موضح في القسم 3 في Dittrich et al. (2018) 20. - استخرج مناطق الاهتمام من CSAv و CSAi المرسومة في الخطوة 3.9 كأقنعة ثنائية مع تباعد z بين الشرائح لنمذجة ثلاثية الأبعاد للبطين ومنطقة الاحتشاء في نهاية الانبساط والانقباض النهائي (الشكل 2H ، المواد التكميلية 4).
4. علم الأنسجة الكمي غير المتحيز لقياس جزء الاحتشاء
- استكشف قلب قنافذ البحر المخدر الموصوفة في الخطوة 2.2 - 2.6.
- باستخدام حقنة سعة 1 مل مزودة بإبرة قياس 26 ، قم بحقن 5 ميكرولتر / غرام ببطء من كتلة الجسم من 1000 وحدة دولية / مل محلول رينجر البرمائي الهباري في الجيوب الأنفية الوريدية وانتظر دقيقتين للسماح لمضاد التخثر بالتوزيع في الدورة الدموية.
- القتل الرحيم عن طريق قطع الرأس وتقطيع الدماغ واستئصال القلب بالكامل عن طريق قطع أوعية التدفق أولا ثم مجرى التدفق.
- انقل القلب عن طريق رفعه برفق عن طريق مجرى التدفق إلى طبق بتري مقاس 60 × 15 مم2 يحتوي على محلول رينجر البرمائي.
- تحت التكبير، اغسل أي دم متبقي في القلب عن طريق ملء الجيوب الأنفية الوريدية برفق ب 100 وحدة دولية / مل من محلول رينجر الهيباريني.
ملاحظة: في حين أن التثبيت المسبق للقلب يمكن إجراؤه عن طريق حشو القلب بالفورمالين المخزن أو بارافورمالالديهايد ، فإن هذا ليس ضروريا ، حيث يتم التقسيم عند درجة حرارة متجمدة. بعد ذلك ، يمكن إجراء تثبيت الأقسام على الشرائح الزجاجية. سيبدو القلب المغسول بالكامل شاحبا وأبيض ولا يحتوي على أي آثار لخلايا الدم الحمراء. من المحتمل أن تتكون جلطات دموية صغيرة على سطح البطين والأذينين. لا تؤثر على الدقة في إجراء الأنسجة الكمي اللاحق. - انقل القلب إلى مناديل ورقية خالية من النسالة لتلطيخ لمدة 1 دقيقة.
- قم بإعداد CRYOOLD بحجم مناسب عن طريق وضع قطرة واحدة من مركب درجة حرارة القطع الأمثل ونقل القلب إلى القطرة. اضغط على القلب برفق إلى الأسفل.
- ضع مركب درجة حرارة القطع الأمثل لملء التبريد وتأكد من بقاء البطين في الأسفل. اترك القالب لمدة 5 دقائق للسماح لمركب درجة حرارة القطع الأمثل بالتوزيع في العينة.
- قم بتجميد القالب عن طريق وضعه على غطاء من صندوق طرف ماصة يطفو على النيتروجين السائل.
ملاحظة: للحصول على تجميد مفاجئ أكثر تحكما ، يمكن تخزين القلوب لمدة ساعة واحدة طوال الليل في محلول السكروز بنسبة 10-30٪ ويمكن إجراء التجميد المفاجئ باستخدام الأيزوبنتان المبرد بالنيتروجين السائل (2-ميثيل بوتان). في تجربتنا ، لا تختلف النتيجة النهائية بشكل ملحوظ. - قم بتلطيف التبريد في ناظم البرد على درجة حرارة -18 إلى -22 درجة مئوية لمدة ساعة واحدة على الأقل قبل التقسيم.
- قسم عينة بسمك شريحة 10 ميكرومتر وجمعكل شريحة 10 لتوفير سمك بلاطة (ر) 100 ميكرومتر. استمر في التقسيم حتى يتم تقسيم القلب بالكامل.
ملاحظة: يمكن استخدام سماكة مختلفة للشرائح والبلاطات ، ولكن من المهم أن يبدأ جمع الشرائح عند نفس النقطة التي تلامس فيها الشفرة البطين وأن يتم تقسيم القلب بأكمله بما لا يقل عن 10-12 لوحا متباعدة بشكل متساو. يمكن جمع أكثر من شريحة واحدة لكل لوح لتوفير مجموعات مكررة. - أقسام الأنسجة الملطخة مع البروتوكولات القياسية للهيماتوكسيلين واليوزين أو ماسون ثلاثي الألوان لتوفير تمييز واضح بين النخاب، عضلة القلب، الصمامات، ومنطقة الاحتشاء.
- قم برقمنة قسم الأنسجة باستخدام مجهر الكاميرا أو الماسح الضوئي للشرائح بتكبير كاف للكشف بوضوح عن الهيكل المربوطة للبطين الإبسولوتل (الشكل 2I).
- قم بتحميل مكدس الصور في ImageJ (https://imagej.nih.gov/ij/index.html) وتهيئة المكون الإضافي لعداد الخلايا (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- قم بتشغيل ماكرو شبكة متعدد الأغراض (https://imagej.nih.gov/ij/macros/Multipurpose_grid.txt) وقم بإنشاء شبكة نقطية بكثافة شبكة مناسبة.
ملاحظة: تعتمد كثافة الشبكة (مساحة الشبكة) على حجم العينة ومورفولوجيتها. لتوفير الدقة المرغوبة ، يجب ضمان ما لا يقل عن 100-200 تقاطع لنقاط الشبكة وكل من الهياكل ذات الأهمية. - احسب عدد التقاطعات بين الشبكة النقطية والهياكل ذات الأهمية باستخدام المكون الإضافي لعداد الخلية (الشكل 2I ، التكبير على اليمين).
ملاحظة: من المهم للدقة تضمين تلك التقاطعات التي تظهر بدقة عند نقطة الهدف من الشعيرات المتصالبة فقط. - احسب كسر الاحتشاء من منطقة الشبكة النقطية المحددة مسبقا [Ai (p) و Av (p)] ، وسمك البلاطة ، وعدد تقاطعات الشبكة النقطية في كل لوح (Pj) مع عضلة القلب الاحتشية وعضلة القلب البطينية الكلية باستخدام الصيغة:
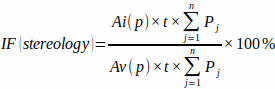 (3)
(3)
النتائج
في قنافذ البحر التي تبلغ كتلة جسمها 11.8 ± 1.3 جم وطولها الإجمالي 11.8 ± 0.5 سم ، ينتج عن إجراء الإصابة بالتبريد الذي يتم إجراؤه باستخدام مسبار تبريد بقطر 2 مم منطقة احتشاء تغطي 45.4 ± 14.2٪ من عضلة القلب البطينية في 7 أيام بعد الإصابة حيث يتم تطوير منطقة الاحتشاء بالكامل [الشكل 2I ، قارن القسم من القلب الصحي قبل الكسر (أعلى) و 7 أيام بعد الانتهاك (أسفل)]. يبلغ معدل وفيات الإجراء 2.2٪ (2/90). ينتج عن الإجراء منطقة إصابة محددة جيدا يمكن تصورها وتحديدها كميا ونمذجتها باستخدام تخطيط صدى القلب غير الجراحي (الشكل 2C-H ، المواد التكميلية 1-4). في البداية ، يؤثر احتشاء عضلة القلب الناجم عن الإصابة بالتبريد بشكل كبير على وظيفة القلب ، مما يقلل من حجم السكتة الدماغية إلى 62.2٪ ونتاج القلب إلى 73.9٪ بعد 7 أيام من الإصابة مقارنة بما قبل الإصابة مع التعافي التدريجي للشكل والوظيفة على مدى ثلاثة أشهر (البيانات غير معروضة). لم يلاحظ أي تغييرات سلوكية بعد إصابة عضلة القلب بالتبريد في قنافذ البحر الهادئة نسبيا.

الشكل 1: إجراء الاحتشاء بالتبريد. A ، يتم تصنيع مسبار التبريد المصنوع حسب الطلب عن طريق لف ثلاثة أسلاك نحاسية ، وإذابة الطرف في كرة وربط السلك بمكبس حقنة سعة 2.5 مل. B-L ، إجراء الاحتشاء بالتبريد. بعد تغليف جميع أجزاء الجسم باستثناء منطقة الجراحة في مناديل الأنسجة المبللة (B) ، يتم إجراء شق بطني على الصدر قليلا على يمين خط الوسط (كما هو موضح في B) باستخدام مقص استئصال القزحية (C) ، ويتم تحرير الحزام الصدري عن طريق تشريح الجذع. يتم فتح التامور برفق بشق ويتم شفط سائل التامور في حقنة سعة 1 مل باستخدام إبرة غير حادة عيار 23 (D). يتعرض البطين ويظل الجرح مفتوحا باستخدام ملقط بعرض فتحة محدد مسبقا (E) ويتم مسح أي سائل متبقي على البطين (F). بالنسبة للجراحة الوهمية ، يتم تطبيق مسبار التبريد غير المبرد (G) بنفس الطريقة المستخدمة في الإصابة بالتبريد ، حيث يتم تطبيق المسبار المبرد في النيتروجين السائل (-196 درجة مئوية) على الجدار الجانبي للبطين باتجاه القمة (H). بعد 10 ثوان ، يتم إعادة تطبيق سائل التامور على المسبار المبرد لتحريره من البطين (I). ينتج عن هذا منطقة إصابة بالتبريد محددة بوضوح (J). أخيرا ، يتم وضع التامور والحزام الصدري فوق القلب ويتم خياطة الجلد (3-5 خيوط) بخياطة قابلة للذوبان (K). يترك على الجليد لمدة ساعتين لبدء عملية التئام الجروح (L). تقع الجمجمة باتجاه اليسار على B-L ، وتمثل اتجاه للجراح الذي يتمتع بيده اليمنى المهيمنة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
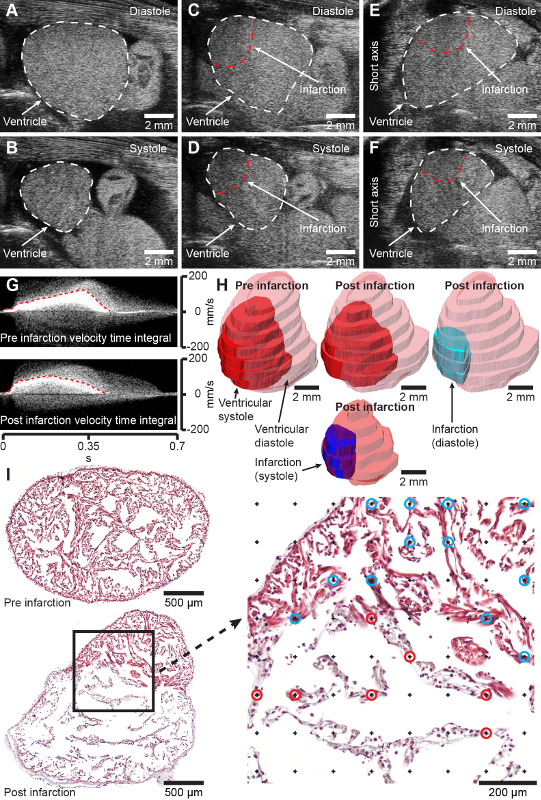
الشكل 2: النتائج المتوقعة. A و B ، صور المحور الطويل في الوضع B للبطين الإبسولي السليم في الانبساط (A) والانقباض (B). C و D ، صور المحور الطويل في الوضع B للبطين الإبيضي المبرد (2 أيام بعد الإصابة) في الانبساط (C) والانقباض (D). E و F ، صور المحور القصير في الوضع B للبطين الإبساطي المصاب بالتبريد (يومان بعد الإصابة) في الانبساط (E) والانقباض (F). G ، اكتسبت دوبلر الموجة النبضية تكاملات وقت السرعة من القلب قبل (أعلى) وبعد 2 يوم من الاحتشاء (أسفل). ح, نمذجة ما قبل الاحتشاء و2 يوم بعد احتشاء القلب من اكتساب الموجات فوق الصوتية ثلاثية الأبعاد. أنا ، أقسام الأنسجة المستعرضة التمثيلية من خلال البطين الإبسولوتل بعد 4 أيام من الوهم (أعلى) و 7 أيام بعد الاحتشاء (أسفل) ملطخة بثلاثي الألوان في ماسون. يظهر التكبير على اليمين شبكة نقطية للقياس التجسيمي لكسر الاحتشاء. تمثل النقاط المميزة بالدوائر الزرقاء والحمراء تقاطعا مع الأنسجة السليمة (الدوائر الزرقاء) والاحتشاء (الدوائر الحمراء). الجمجمة باتجاه اليمين في A-D اليمنى باتجاه اليسار في E-F ، والتي تمثل العرض التقليدي لصور تخطيط صدى القلب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
المواد التكميلية 1: محور طويل ، بطين صحي قبل احتشاء ، الوضع B (انظر الشكل 2أ-ب). الرجاء النقر هنا لتنزيل هذا الفيديو.
المواد التكميلية 2: محور طويل ، بطين احتشاء (يومان بعد الاحتشاء) ، الوضع B (انظر الشكل 2C-D). الرجاء النقر هنا لتنزيل هذا الفيديو.
المواد التكميلية 3: محور قصير ، بطين محتشاء (يومان بعد الاحتشاء) ، الوضع B (انظر الشكل 2E-F). الرجاء النقر هنا لتنزيل هذا الفيديو.
المواد التكميلية 4: نماذج تفاعلية ثلاثية الأبعاد لنفس القلب كما هو موضح في الشكل 2A-H والمواد التكميلية 1-3 قبل وبعد الاحتشاء. قم بتشغيل ملف PDF التفاعلي في Adobe Acrobat Reader 9 أو أعلى. انقر فوق النموذج لتنشيط ميزة 3D. قم بتدوير النموذج وتكبيره وتقليبه باستخدام المؤشر. في شجرة النموذج الموجودة على الجانب الأيسر من الشاشة ، يمكن تنشيط / إلغاء تنشيط جميع الأجزاء أو جعلها شفافة. يتم إنشاء شجرة النموذج كتسلسل هرمي يحتوي على عدة طبقات فرعية يمكن فتحها (عن طريق تحديد +). الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
لتقليل التباين التجريبي ، يجب أن يتبع الإجراء الجراحي للإصابات بالتبريد إجراءات معقمة ويجب إجراء تدريب جراحي على عدد من قبل محاولة استخدام في تجارب تجديدية محددة. من خلال التدريب ، يمكن إجراء إجراء الإصابات بالتبريد على مجموعة كبيرة من أحجام وأعمار قنافذ البحر ، من الأحداث (5 جم ، 7 سم) إلى البالغين الكبار (100 جم ، 25 سم). من الأهمية بمكان أن يكون للمسبار بالتبريد حجم كاف وأن يتم تبريده بشكل كاف لتوفير إصابة تبريد قوية وقابلة للتكرار للبطين الإبسولوتي. بالنسبة للحيوانات الصغيرة جدا (5-8 جم ، 7-9 سم) ، يمكن بناء المسبار المبرد بقطر أصغر. في حين أنه من الضروري إجراء بروتوكول الإصابة بالتبريد باستخدام مخدر ذو خصائص مسكنة مثل البنزوكايين و MS-222 (أو مع تطبيق إضافي لعامل مسكن ثانوي) ، يمكن إجراء تخطيط صدى القلب اللاحق مع مخدر آخر بخصائص مسكنة محدودة فقط ، مثل البروبوفول ، الذي تم وصفه بأنه يؤثر على وظائف القلب أقل من البنزوكايين و MS-222 في قنافذ البحر22.
إجراء الإصابة بالتبريد محدود بمعنى أنه لا ينتج عنه احتشاء عضلة القلب الناجم عن نقص التروية عن طريق انسداد الشريان التاجي بنفس طريقة إجراءات ربط الشريان التاجي التي تشبه إلى حد كبير الحالات السريرية لاحتشاء عضلة القلب لدى البشر. ومع ذلك ، فإن الطريقة القائمة على الربط غير قابلة للتطبيق في قلب البرمائيات المربقة مع القليل جدا من الأوعية الدموية التاجية وإمدادات الأكسجين اللمعية في الغالب. أيضا ، تم وصف احتشاء عضلة القلب الناجم عن الإصابات بالتبريد لتلخيص معظم العواقب المرضية لاحتشاء عضلة القلب الناجم عن نقص التروية14،16. منطقة الإصابة الناتجة عن الإصابة بالتبريد موضعية بدرجة كبيرة في الأنسجة القريبة من المسبار بالتبريد ، وعلى الرغم من أن هذا لا يشبه احتشاء معقد وشبيه بالفروع ناتج عن انسداد الشريان التاجي ، إلا أنه مفيد في بيئة تجريبية حيث يمكن التعرف بسهولة على المنطقة الحدودية بين الأنسجة السليمة والاحتشاء ، ويمكن دراسة تطور خلايا عضلة القلب المشكلة حديثا.
قنافذ البحر هو أكبر بكثير من سمكة الزرد مع نظام القلب والأوعية الدموية الأكثر تعقيدا ، بما في ذلك القلب الذي يتكون من ثلاث غرف (أذينان ، بطين واحد) وفصل وظيفي ، وإن لم يكن تشريحيا ، لتدفق الدم في التيارات المؤكسجة وغير المؤكسجة23 مقارنة بالقلب المكون من غرفتين ونظام التدفق التسلسلي الموجود في teleosts. لا يتضمن إجراء الإصابة بالتبريد الموصوف سابقا في أسماك الزرد خياطة ما بعد الجراحة للسطح البطني المشقوق16،17. يعد ذلك ضروريا في قنافذ البحر لتجنب التعرض غير الضروري للقلب للبيئة المائية غير المعقمة في موطن مختبر.
لا يتم الإبلاغ عن الأنسجة الكمية غير المتحيزة القائمة على علم الجراحة حاليا في مجال التجدد حيث تعتمد معظم القياسات الكمية لجزء الاحتشاء على مساحة تعتمد على القسم النسيجي في منطقة الاحتشاء الوسطى وفي بعض الحالات قسمينمتجاورين 24. نظرا لأنه يمكن تطبيق مفهوم علم التعقيم في الفحوصات النسيجية في أي نوع نموذجي لتوفير قياسات أكثر قوة وغير متحيزة ، فإننا نقترح دمج هذه الطريقة المتاحة مجانا في التقييمات الكمية لتجديد القلب ليس فقط في قنافذ البحر ، ولكن في جميع الأنواع المتجددة.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نود أن نتوجه بخالص الشكر إلى Casper Bindzus Foldager و Asger Andersen و Michael Pedersen (جميعهم في قسم الطب السريري بجامعة آرهوس) وديفيد غاردينر (قسم بيولوجيا النمو والخلية ، جامعة كاليفورنيا ، إيرفين) للمساعدة في التطوير الأولي لنموذج الإصابات بالتبريد في إبسولوتل والفحص بالموجات فوق الصوتية.
Materials
| Name | Company | Catalog Number | Comments |
| S&T Scissor SAS-15 | S&T AG - Microsurgical Instruments | Iridectomy scissors | |
| Vevo 2100 | Fujifilm, VisualSonics | High frequency ultrasound scanner |
References
- Forouzanfar, M. H., et al. Assessing the global burden of ischemic heart disease, part 2: analytic methods and estimates of the global epidemiology of ischemic heart disease in 2010. Global Heart. 7, 331-342 (2012).
- Go, A. S., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129, 399-410 (2014).
- Murry, C. E., Reinecke, H., Pabon, L. M. Regeneration gaps: observations on stem cells and cardiac repair. Journal of the American College of Cardiology. 47, 1777-1785 (2006).
- Laflamme, M. A. Heart regeneration. Nature. 473, 326-335 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298, 2188-2190 (2002).
- Oberpriller, J. O., Oberpriller, J. C. Response of the adult newt ventricle to injury. Journal of Experimental Zoology. 187, 249-260 (1974).
- Cano-Martínez, A., et al. Functional and structural regeneration in the axolotl heart (Ambystoma mexicanum) after partial ventricular amputation. Archivos de Cardiología de México. 80, 79-86 (2010).
- Witman, N., Murtuza, B., Davis, B., Arner, A., Morrison, J. I. Recapitulation of developmental cardiogenesis governs the morphological and functional regeneration of adult newt hearts following injury. Developmental Biology. 354, 67-76 (2011).
- Mercer, S. E., Odelberg, S. J., Simon, H. -. G. A dynamic spatiotemporal extracellular matrix facilitates epicardial-mediated vertebrate heart regeneration. Developmental Biology. 382, 457-469 (2013).
- Piatkowski, T., Mühlfeld, C., Borchardt, T., Braun, T. Reconstruction of the myocardium in regenerating newt hearts is preceded by transient deposition of extracellular matrix components. Stem Cells and Development. 22, 1921-1931 (2013).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11 (21), (2011).
- González-Rosa, J. M., Martín, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138, 1663-1674 (2011).
- Schabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS ONE. 6 (4), 18503 (2011).
- Van den Bos, E. J., Mees, B. M. E., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. The American Journal of Physiology: Heart and Circulatory Physiology. 289, 1291-1300 (2005).
- Yang, Y., et al. Characterization of cryoinjury-induced infarction with manganese-and gadolinium-enhanced MRI and optical spectroscopy in pig hearts. Magnetic Resonance Imaging. 28, 753-766 (2010).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7, 782-788 (2012).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Lauridsen, H., Pedersen, M. Rebuilding a heart: complete regeneration after myocardial infarction in the axolotl. The Federation of American Societies for Experimental Biology Journal. 28 (1), (2014).
- McCusker, C., Gardiner, D. M. The axolotl model for regeneration and aging research: a mini-review. Gerontology. 57, 565-571 (2011).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D Echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments. (141), e57089 (2018).
- Mühlfeld, C., Nyengaard, J. R., Mayhew, T. M. A review of state-of-the-art stereology for better quantitative 3D morphology in cardiac research. Cardiovascular Pathology. 19, 65-82 (2010).
- Thygesen, M. M., Rasmussen, M. M., Madsen, J. G., Pedersen, M., Lauridsen, H. Propofol (2,6-diisopropylphenol) is an applicable immersion anesthetic in the axolotl with potential uses in hemodynamic and neurophysiological experiments. Regeneration (Oxf.). 4, 124-131 (2017).
- Malvin, G. M., Heisler, N. Blood flow patterns in the salamander, Ambystoma tigrinum, before, during and after metamorphosis. Journal of Experimental Biology. 137, 53-74 (1988).
- Juul-Belling, H., Hofmeister, W., Andersen, D. C. A systematic exposition of methods used for quantification of heart regeneration after apex resection in zebrafish. Cells. 9, 548 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved