Method Article
Establecimiento de modelos de ratas que imitan las terapias hormonales de afirmación de género
* Estos autores han contribuido por igual
En este artículo
Resumen
El protocolo describe el desarrollo de dos modelos de roedores que imitan las terapias hormonales de afirmación de género mediante la administración subcutánea de testosterona o estradiol más acetato de ciproterona (utilizado en terapias humanas para personas transgénero): ajuste de las dosis, identificación de biomarcadores relevantes y evaluación de los efectos.
Resumen
Las personas transgénero (TG) son individuos cuya identidad de género y sexo asignados al nacer no coinciden. A menudo se someten a la terapia hormonal de afirmación de género (GAHT), una intervención médica que permite la adquisición de características sexuales secundarias más alineadas con su identidad de género individual, proporcionando resultados consistentes en la mejora de numerosas variables sociopsicológicas. Sin embargo, el GAHT se dirige a diferentes sistemas corporales, y se han registrado algunos efectos secundarios, aunque aún no se han identificado y caracterizado por completo. Por lo tanto, las personas TG sometidas a GAHT pueden considerarse como un subgrupo susceptible de la población y se debe prestar especial atención en el marco de la evaluación de riesgos, por ejemplo, mediante el uso de modelos animales específicos. El presente trabajo describe los procedimientos establecidos para implementar dos modelos de ratas que imitan el GAHT: el modelo desmasculinizante-feminizante (dMF) que imita el GAHT para mujeres TG y el modelo desfeminizante-masculinizante (dFM) que imita el GAHT para hombres TG. Los modelos se han implementado mediante la administración de las mismas hormonas utilizadas para el GAHT humano, a saber, β-estradiol más acetato de ciproterona para el dMF y testosterona para el dFM, por las mismas vías de exposición durante un período de 2 semanas. Las ratas se examinan diariamente durante el tratamiento para evaluar el estado de salud y los comportamientos potencialmente agresivos. En el momento del sacrificio, se han tomado muestras de sangre y tejidos objetivo y se han almacenado para su análisis bioquímico, molecular e histopatológico. También se han evaluado los parámetros específicos del sexo, es decir, el recuento de espermatozoides y las dimensiones del clítoris. Además, las isoformas de CYP450, expresadas exclusiva y/o preferentemente en hígado de rata macho y hembra, se identifican y caracterizan como nuevos biomarcadores para verificar el éxito de GAHT y establecer el modelo. La afectación de la tiroides también se ha explorado como un objetivo clave en el sistema endocrino.
Introducción
La percepción psicológica del individuo de ser hombre, mujer, ninguno, ambos o en algún punto intermedio1 se llama identidad de género. Puede coincidir con el sexo biológico (cisgénero) o puede ser diferente (transgénero - TG). Un hombre TG es un individuo nacido como mujer pero que se identifica como hombre. Una mujer TG nace como hombre pero se identifica como mujer2. Se estima que, en la actualidad, hay 25 millones de personas TG en todo el mundo3, la mayoría de las cuales padecen disforia de género, una condición psicológica caracterizada por la incongruencia entre su género y el que se les asignó al nacer4, lo que puede resultar en discriminación social y dificultades en el trabajo y en la familia, a menudo conduciendo a la depresión. ansiedad y estrés5. Por estas razones, las personas TG a menudo se someten a la terapia hormonal de afirmación de género (GAHT) y/o a la cirugía de afirmación de género. La GAHT para los hombres TG se caracteriza por la administración de testosterona (T) (Tabla 1), y para las mujeres TG, estrógenos (E2) más antiandrógenos (Tabla 2)6.
La GAHT suele durar toda la vida del individuo, actuando de forma continua sobre el sistema endocrino 7,8. Por lo tanto, es importante analizar el impacto del GAHT en la salud de las personas TG y sus posibles efectos duraderos. Además, las personas TG están expuestas, al igual que la población general, a contaminantes químicos, en particular, los disruptores endocrinos (DE), que se dirigen al sistema endocrino como GAHT, lo que resulta en una sobreestimulación.
Los TCA son un grupo de sustancias químicas que afectan a los organismos y/o a su progenie alterando diferentes procesos hormonales y metabólicos, como la secreción, activación, síntesis, liberación y unión de hormonas naturales. Dado que los TCA están muy extendidos en el medio ambiente, los alimentos y productos de uso cotidiano (por ejemplo, botellas y recipientes de plástico, revestimientos de latas metálicas de alimentos, detergentes, retardantes de llama, alimentos, juguetes, cosméticos y pesticidas, etc.) la población general está continuamente expuesta durante toda la vida10. Además, incluso la exposición a dosis bajas de DE puede provocar daños en tejidos y órganos, y un fenómeno común asociado con la exposición a DE es la aparición de efectos específicos del sexo tanto en animales de laboratorio como en humanos11. Por ejemplo, la exposición al material en contacto con alimentos, el bisfenol A (BPA), está relacionada con riesgos para la salud, como la endometriosis y el síndrome de ovario poliquístico en las mujeres, así como con la reducción de la fertilidad, debido a sus efectos estrogénicos12. En los hombres, el BPA puede reducir los niveles y disminuir la calidad del esperma13. Además, los pesticidas se asocian con un mayor riesgo de cáncer de mama en las mujeres y problemas significativos de fertilidaden los hombres. Hasta el momento, no se dispone de herramientas específicas para estudiar los efectos toxicológicos de los contaminantes ambientales, incluida la disfunción eréctil, en las personas TG9.
El presente estudio tiene como objetivo describir los métodos y parámetros seleccionados para el desarrollo de dos modelos animales TG: un modelo desmasculinizante-feminizante (dMF) y un modelo desfeminizante-masculinizante (dFM). En particular, se evalúa la selección de los niveles de dosis adecuados, el tiempo y la forma de administración de las hormonas sobre la base de las terapias humanas actuales14. Además, se identifican y caracterizan los biomarcadores tisulares y funcionales que definen los modelos de forma única. Además, se describe en detalle la eficacia y tolerabilidad de la terapia en animales, así como la selección de los marcadores más adecuados para su uso en estudios a largo plazo, junto con las técnicas utilizadas para tales fines.
Para caracterizar los modelos, se analizan los siguientes criterios de valoración: nivel sérico de testosterona (T) (el mejor biomarcador para evaluar el éxito de la GAHT en ambos modelos 9,15); nivel sérico de estradiol (E2) (ambos modelos); hormona estimulante de la tiroides (TSH) y tiroxina (T4) (modelo dMF); recuento de espermatozoides (modelo dMF); dimensión del clítoris (modelo dFM); Análisis histopatológico de los órganos reproductores, hígado y tiroides (para ambos modelos). Además, también se analiza la expresión génica de las siguientes isoformas del citocromo p450 hepático específico del sexo (CYP450s, para ambos modelos)16,17: CYP2C11 (expresado específicamente en el hígado masculino), CYP3A18 (expresado 25 veces más en el hígado masculino que en el femenino), CYP2C12 (expresado específicamente en el hígado femenino) y CYP2C6 (expresado predominantemente en el hígado femenino, pero presente en niveles más bajos, también en el varón).
Protocolo
Los estudios se realizan siguiendo la Directiva 2010/63/UE, el Decreto Legislativo italiano n. 26 del 4 de marzo de 2014 y los Principios de Buenas Prácticas de Laboratorio (BPL) de la OCDE. El protocolo del estudio fue aprobado por el Ministerio de Salud italiano (autorización n.º 806/2021-PR). Aquí, se compran 16 ratas Sprague-Dawley jóvenes sexualmente maduras de ambos sexos (304 ± 13 g de ratas macho y 190 ± 7 ratas hembras, de 8-9 semanas de edad) y se alojan en dos jaulas en condiciones estándar de laboratorio (22 ± 0,5 °C, 50%-60% de humedad relativa, 12 h de alternancia de luz oscura con 12-14 cambios de aire por hora) con agua y alimento disponibles ad libitum. En todas las jaulas, para el enriquecimiento ambiental de cada animal, inserte bloques de madera para roer y reemplácelos semanalmente.
NOTA: Se han elegido los animales de 8 a 9 semanas de edad, ya que el GAHT puede comenzar durante la adolescencia (etapas de Tanner 2 a 3), correspondientes a 8-9 semanas en roedores, y dura mucho tiempo, potencialmente durante toda la vida de las personas TG9.
1. Dimensionamiento del grupo y cuidado de los animales
- Utilice ratas Sprague-Dawley adultas jóvenes macho y hembra (8-9 semanas de edad) como modelo, ya que la rata es la especie preferida indicada por la OCDE (por ejemplo, la Directriz 421 Prueba de Detección de Toxicidad Reproductiva/del Desarrollo) y la única especie de roedores propuesta y considerada en la Directriz 407 de la OCDE (estudio de toxicidad oral de 28 días a dosis repetidas en roedores, actualizado con los parámetros para la detección de IE).
- Utilice el software G*Power para el dimensionamiento del grupo. Para los modelos dFM y dMF, seleccione cuatro grupos de prueba: un grupo de control (C) y tres grupos de animales tratados con diferentes dosis de GAHT. Realizar el dimensionamiento con referencia a la comparación entre dos grupos (dosis de tratamiento versus C) con la prueba de Mann-Whitney, un nivel de significancia de dos colas alfa = 0,0167 (correspondiente a alfa = 0,05 con corrección de Bonferroni aplicada a las 3 comparaciones entre cada dosis de tratamiento y la C), y potencia 1-beta = 0,80.
- El número calculado de ratas/grupos es el siguiente:
para el modelo de DM, animales/grupo n=4, según Kinnear et al.18 indicando después de 2 semanas de tratamiento, los siguientes niveles: en el grupo control: 0,2 ± 0,3 ng/mL, en el grupo de terapia hormonal: 16 ± 5 ng/mL (media ± desviación estándar), correspondiente a una dimensión del efecto medida con d de Cohen = 4,46 (efecto muy grande).
para el modelo dMF: animales/grupo n=3, según Gómez et al.19 indicando después de 2 semanas de tratamiento, los siguientes niveles: grupo control: 1,901 ± 0,413 ng/mL y grupo de terapia hormonal: 0,043 ± 0,023 ng/mL (media ± error estándar) correspondiente a una dimensión del efecto medida con d de Cohen = 6,35 (efecto muy grande). - Para alinear los dos modelos, elija n = 4 animales por sexo/grupo, para un total de N = 32 animales.
- El número calculado de ratas/grupos es el siguiente:
- Después de 1 semana de aclimatación, dividir las ratas por sexo en dos grupos experimentales (dMF y dFM, 4 ratas/grupo), cada uno compuesto por un C (macho control, CM y hembra control, CF) y tres grupos de tratamiento del GAHT seleccionado.
- Monitoree todas las ratas 2 veces al día (a las 8:30 a.m. y a las 4:00 p.m.) para verificar las condiciones generales de salud y la posible agresividad debido a la administración de GAHT. Registre el peso corporal (pc) y el consumo de alimento 2 veces por semana, utilizando una balanza analítica con la función de ponderación dinámica óptima para el peso de los animales de laboratorio.
- En el modelo experimental dFM, se midió el diámetro del clítoris de todas las ratas inmediatamente antes del inicio del tratamiento (punto 0) y al final del tratamiento (punto 13), utilizando un medidor digital para lecturas de precisión.
- Pesar a todos los animales antes del sacrificio y, en el modelo dMF, inmediatamente después del sacrificio retirar el epidídimo para realizar el recuento de espermatozoides.
2. Selección y preparación de la dosis
- Utilice las siguientes tres dosis de hormonas para administrar a las ratas dFM: 5, 10,5 y 22,5 mg/kg por semana, para el modelo dMF, utilice los siguientes tres niveles de dosis seleccionados (DL): DL1 E2 0,045 mg/kg + CPA 0,2 mg/kg, DL2 E2 0,09 mg/kg + CPA 0,2 mg/kg y DL3 E2 0,18 mg/kg + CPA 0,2 mg/kg.
NOTA: Todas las dosis se seleccionan teniendo en cuenta las principales guías clínicas humanas utilizadas para las personas TG15 y los limitados datos disponibles en la literatura. - Prepare todas las soluciones madre semanalmente con una campana de seguridad química. Mezclar adecuadamente todas las sustancias en el aceite de sésamo como un vehículo, asegurando su completa solubilización.
NOTA: Para ambos modelos, use una calculadora de conversión de dosis (https://dosecal.cftri.res.in/) para ingresar la dosis a convertir, la especie para la cual se ha establecido la dosis, la especie animal y el peso para el cual se debe convertir la dosis. Para el modelo de dFM (Tabla 3), terapia hormonal humana, una dosis máxima de 100 mg de T por semana20. La dosis calculada en ratas es de 10,5 mg/kg de T por semana. La segunda dosis es de 22,5 mg/kg por semana en ratas18. La tercera dosis es de 5 mg/kg por semana, identificada manteniendo el factor de 2,1 entre las dos dosis calculadas. Para el modelo de DMdMF, ver Tabla 4, las dosis se basan en los regímenes recomendados para humanos21 y los datos disponibles a través de estudios in vivo 14,19,22.
3. Trato a los animales
- Realizar la administración subcutánea de T (para el modelo dFM) y E2 plus CPA (para el modelo dMF) pellizcando y levantando la piel en el lugar de la inyección, formando una especie de cortina. A continuación, inserte la aguja de una jeringa de 1 ml paralela al lomo del animal. Una vez dentro, inyectar lentamente el volumen requerido (100 μL para T; 200 μL para E2+CPA)23.
- Tratar a los animales de la siguiente manera: para el modelo dFM, administrar enantato de T disuelto en aceite de sésamo (vehículo) 2 veces por semana durante 2 semanas (100 μL por cada inyección subcutánea de T). Para el modelo dMF, administrar E2 más acetato de CPA disuelto en aceite de sésamo (vehículo) 5 veces por semana durante 2 semanas (200 μL por cada inyección subcutánea). Trate a las ratas del grupo C de la misma manera que el vehículo solo (aceite de sésamo).
4. Muestreo de sangre, sacrificio y muestreo de tejidos
- Después de 2 semanas de tratamiento, justo antes del sacrificio, use un sistema de anestesia gaseosa y anestesiar a todos los animales. Inducir la anestesia mediante dosis que varían del 2% al 3,5% de isoflurano en oxígeno al 100% a razón de 1,5 L/min hasta la pérdida de los reflejos en una cámara de inducción de poliestireno transparente. Coloque a la rata en posición prona sobre la almohadilla térmica y regule la dosis de isoflurano a una dosis de mantenimiento que varíe del 1,5% al 3,5% administrada por una mascarilla nasal estándar para ratas durante todo el procedimiento de muestreo de sangre intracardíaca.
- Prepare una jeringa de 5 mL con una aguja de 21G, eliminando el vacío. Sondeando el corazón con los dedos, inserte cuidadosamente la aguja en la pared torácica lateral perpendicular al cuerpo aproximadamente en el punto de los codos flexionados, entre las costillas 5 y 6. Una vez dentro del ventrículo cardíaco, la sangre entra en la jeringa por capilaridad. Retraiga el pistón de la jeringa lenta y continuamente hasta que se extraiga sangre.
- Después de la toma de muestras de sangre, coloque las ratas en la cámara de CO2 para realizar la eutanasia mediante asfixia con CO2 con una tasa de llenado del 30% al 70% de desplazamiento del volumen de la cámara por minuto. Después de 2-3 min, verifique la muerte de los animales monitoreando la respiración y los latidos del corazón24.
- Después del sacrificio, coloque a todos los animales en la mesa de disección en posición supina, con las patas delanteras hacia arriba y las traseras hacia abajo, y fíjelos con alfileres. Espolvorea el abdomen del animal con una solución desinfectante.
- Extirpar los siguientes órganos: testículos, epidídimo, útero, ovarios, hígado y tiroides. Pesarlos y almacenarlos en tubos de 50 mL con 35 mL de formalina tamponada al 10% (todos los órganos) o solución de Bouin (solo testículos) o recogerlos en tubos criogénicos (un órgano/tubo) y congelarlos inmediatamente en nitrógeno líquido (para almacenar a -80 °C).
- En primer lugar, corte la piel con unas tijeras en la línea media, desde el pubis hasta la parte superior del abdomen. Haga dos cortes laterales en la caja torácica y refleje la piel a ambos lados de la incisión para exponer las vísceras torácicas.
- Extirpe primero los órganos reproductivos; En ratas macho, se extirpan los testículos, órganos pareados de forma ovalada situados en la cavidad abdominal, en posición intraabdominal (saco escrotal). Corta y presiona el saco escrotal para asegurarte de que los testículos sobresalgan, luego agárralos suavemente. Sostenga la grasa visceral con unos alicates, luego corte los testículos lejos de las vísceras. Después de la escisión, pesar y almacenar los testículos en la solución de Bouin para el análisis histopatológico.
- En ratas hembras, primero se agarra el útero con delicadeza, luego se cortan los ovarios (que se encuentran al final de ambos cuernos uterinos) del tejido adiposo visceral. Después de la extirpación, pesa los ovarios.
- Tanto en ratas hembras como machos, se desplazan hacia el lado derecho de la cavidad abdominal, donde se encuentra el hígado. El hígado es un órgano multilobulado y es posible identificar muchas partes: medial izquierdo (más pequeño), lateral izquierdo (mayor), medial derecho (más pequeño), lateral derecho (mayor), caudado y lóbulo cuadrado25. Agarre el hígado con fórceps, teniendo cuidado de no romperlo. Sujete la apófisis xifoides con unos alicates y corte completamente el diafragma con unas tijeras.
- Use fórceps para levantar la apófisis xifoides y extraer el hígado de la cavidad abdominal. Separe el hígado del diafragma con unas tijeras. Después de eso, pese el hígado y guárdelo.
- Para la extracción de la tiroides, con la ayuda de unas tijeras, corte perpendicularmente a lo largo del cuello del animal, retire la piel y la musculatura, y recorte suavemente los extremos de la tráquea, en la que se encuentra la glándula tiroides. Guarde la tiroides para su posterior análisis26.
- Realice el recuento de espermatozoides como se describe a continuación.
- Después de la extirpación de los testículos, agarre el epidídimo, que está unido al margen posterior del testículo respectivo y contenido en el escroto.
- En este experimento, se toman muestras de semen de la cola del epidídimo derecho. En el momento de la recolección, limpie la cola de grasa y tejido conectivo con unas tijeras, sepárela de la parte restante y colóquela en una placa de Petri (35 mm x 10 mm) que contenga 1 mL de DMEM. Cortar con tijeras y fluir con una pipeta Pasteur para facilitar la liberación del contenido.
- Transfiera todo el líquido obtenido a un tubo de 15 mL y lleve el volumen a 10 mL con DMEM (factor de dilución 1:10 = 0,1). Pipetear el contenido para homogeneizar y crear una suspensión. Después de una ligera sacudida, tome 10 μL de la suspensión para cargar la cámara de Neubauer. Cargue la cámara y después de 3 minutos de carga de la cámara, comience el conteo.
5. Ensayo de inmunoabsorción ligado a enzimas (ELISA)
- Recoja muestras de sangre (alrededor de 2-5 mL por animal) en tubos de 2 mL y deje que se coagulen a temperatura ambiente durante 1 h. Centrifugar todas las muestras de sangre 2 veces durante 15 minutos a 4 °C y 3000 x g.
- La sangre centrifugada tiene una apariencia de múltiples capas con tres capas de diferentes colores. La capa superior está formada por plasma (generalmente amarillo o transparente), la porción líquida de la sangre; la capa debajo del plasma puede tener una coloración blanquecina o gris y es el pelaje leucocitario. La capa más baja contiene glóbulos rojos y el color puede aparecer rojo oscuro o rojo brillante. Para determinar los niveles de hormonas sexuales, recoja el suero de todas las muestras con una pipeta (sin tocar la capa leucocitaria ni las capas de eritrocitos), divídalas en alícuotas (500 μL) y guárdelas a -80 °C.
- En ambos modelos, se realiza la prueba ELISA para detectar y/o medir la presencia de proteínas, anticuerpos o antígenos en la muestra para la determinación de hormonas sexuales. Utilice el método directo y siga las instrucciones de cada kit ELISA. En este estudio, se determinaron los niveles séricos de las siguientes hormonas en ratas: E2, Rata Estradiol ELISA; T, ratón/rata testosterona Elisa; TSH, Kit ELISA para Ratas y T4, Kit ELISA para Ratas.
6. Análisis histopatológico
- Preparar portaobjetos histológicos de tejidos de acuerdo con los siguientes procedimientos.
- Fijar las muestras de útero, ovario, tiroides e hígado en el momento de la extracción en formol tamponado al 10% durante al menos 48 h.
PRECAUCIÓN: Trabaje bajo una cubierta química. No inhale la sustancia/mezcla. Evite generar vapores/aerosoles. - Lavar las muestras con agua corriente durante 1 h y luego almacenarlas en alcohol etílico al 80% (C2H5OH) hasta el procesamiento, para preservar la estructura protoplasmática de las alteraciones resultantes de la muerte celular.
- Fijar el testículo en la solución de Bouin compuesta por 15 mL de solución saturada de ácido pícrico, 5 mL de formalina concentrada (33%-40%) y 1 mL de ácido acético glacial durante 48 h. Lave las muestras con alcohol etílico al 80%.
PRECAUCIÓN: Trabaje bajo una cubierta química. - Realice la inclusión en parafina sólida utilizando un procesador automático de tejidos. Al final del proceso de inclusión, coloque las muestras en pequeños recipientes metálicos en los que se haya vertido parafina derretida y enfríe en una placa congelada, formando los bloques para el corte. Oriéntelos en función de la sección de corte deseada.
- Después de eso, corte las muestras con un micrótomo giratorio. Recoja secciones de 5-6 μm con pinceles pequeños, extiéndalas en agua a 37 °C durante unos segundos y colóquelas en portaobjetos de vidrio de microscopio. Dejar escurrir los portaobjetos perpendicularmente durante unos minutos y secarlos en el horno a 36 °C durante al menos 1 h.
- Realice la tinción de hematoxilina y eosina como se describe a continuación.
- Desparafinar los portaobjetos sumergiéndolos en un agente limpiador de origen terpénico (sustituto del xileno) durante 5 min.
- Rehidrate los portaobjetos sumergiéndolos en la siguiente serie de etanol graduado. Para cada solución, 2 minutos por inmersión: 100% etanol, 95% etanol, 80% etanol, 50% etanol y agua destilada.
NOTA: Puede ser un punto de parada para el protocolo, y los portaobjetos se pueden dejar en RT en el agua durante varias horas. Opcionalmente, los portaobjetos también se pueden almacenar a 4 °C en agua. - Coloque los portaobjetos en la hematoxilina de Mayer durante 5 min. Transfiéralos inmediatamente al recipiente con agua del grifo durante 5 minutos. Deje correr el agua del grifo en la esquina trasera del recipiente más alejada de las secciones. Vacíe periódicamente el recipiente hasta que el colorante púrpura del agua ya no esté presente.
NOTA: Para evitar que las secciones se despeguen de los portaobjetos, no deje correr el agua directamente sobre los portaobjetos. - Coloque los portaobjetos en la solución acuosa de eosina Y 1% durante 2 min. Transfiera los portaobjetos a agua destilada durante 15 s. Deshidrate los portaobjetos sumergiéndolos en la siguiente serie de etanol graduado. Para cada solución, 15 s por inmersión: 50% etanol, 80% etanol, 95% etanol.
- Coloque los portaobjetos en etanol al 100% durante 1 minuto y cámbielo a etanol al 100% fresco durante 1 minuto más. Coloque los portaobjetos en un agente de limpieza de origen terpénico (sustituto del xileno) durante 2 minutos y cámbielo por un agente de limpieza fresco de origen terpénico (sustituto del xileno) durante otros 2 minutos. Retire un portaobjetos a la vez y coloque un cubreobjetos.
- Cubra las secciones con medio de montaje y coloque un cubreobjetos en la parte inferior del portaobjetos.
NOTA: Asegúrese de que el medio de montaje tire de la corredera a su posición. Si el cubreobjetos no es plano, golpéelo suavemente en su lugar. Seque el exceso de medio de montaje con una toalla de papel. - Sumerja una toallita limpiadora en el agente limpiador de origen terpénico (sustituto del xileno) y limpie la parte posterior del portaobjetos para eliminar el medio goteado. Coloque la diapositiva plana sobre una superficie sólida móvil, como un trozo de cartón. Agregue cubreobjetos a todas las portaobjetos restantes como se describe en el paso 6.7.6. Deje que las correderas se sequen y que el medio de montaje se endurezca en RT en el capó.
PRECAUCIÓN: Trabaje bajo una cubierta química.
- Después de la tinción, cubra las muestras con un cubreobjetos y evalúelas con un microscopio óptico. Los cambios histopatológicos se han descrito en función de la distribución, la gravedad y las características morfológicas.
- Realizar la puntuación de las lesiones de forma semicuantitativa, utilizando una escala de valoración de 5 puntos (0 a 4), considerando la gravedad de los cambios en base a los criterios explicados por Shackelford et al.27 y resumidos de la siguiente manera:
Grado 0: sin cambios
Grado 1: cambio mínimo. El efecto es apenas visible en el tejido; pequeño y poco frecuente. Afecta a una porción de tejido menor o igual al 10%.
Grado 2: cambio de luz. Representa un pequeño cambio histológico. Este grado se utiliza cuando el tejido, o su estructura, ha mostrado un cambio de volumen entre el 11% y el 20%.
Grado 3: cambio moderado. El cambio es evidente en el tejido. El grado indica la presencia de variaciones entre el 21%-40% del tejido o su estructura
Grado 4: cambio marcado. Cambio histológico abrumador del tejido o de su estructura. Las variaciones afectan al 41%-100% del tejido. - Realizar análisis histomorfométricos cuantitativos en útero, ovario, testículo y tiroides. Examine las secciones de tejido utilizando un sistema de análisis de imágenes aplicado a un microscopio óptico y siga los pasos que se describen a continuación.
- Útero: Con un objetivo 2x, mida el área total de cada sección transversal del cuerno uterino derecho, el miometrio externo e interno y la luz uterina. Calcula el área del endometrio y el miometrio y la relación entre el área del endometrio y el miometrio28.
- Ovario: Utilice una de las secciones completas en la posición central del ovario para revelar folículos en varias etapas de desarrollo; contar los folículos primarios, secundarios, cuerpo lúteo, Graaf y atresicos utilizando un objetivo 4x. Realizar la clasificación de los folículos según Fortune29. Además, mida el área del ovario para cada muestra y su densidad folicular (número de folículos/área ovárica x 100)30.
- Testículos: Usando el objetivo 10x, mida 20 túbulos/muestra; Además, mida el área total del lumen, el área total, el diámetro longitudinal y el diámetro transversal28.
- Tiroides: Mida los siguientes parámetros: densidad folicular (relación entre el número de folículos y un área determinada, objetivo 10x); altura indirecta de las células foliculares (relación media del área del folículo y el área coloide en cinco folículos seleccionados al azar/muestra 40x objetivo); la relación media de las áreas de epitelio folicular y el número de núcleos (en el mismo folículo para determinar la maduración folicular); Altura de las células foliculares (media de cinco alturas de las células en cinco folículos/muestra seleccionados al azar, objetivo 64x)31.
7. Expresión génica
- Para ambos modelos, realice el análisis de expresión génica utilizando muestras de hígado almacenadas a -80 °C. Siga el protocolo de purificación de ARN total utilizando un kit, a partir de un lisado de tejido animal.
- Para obtener el lisado hepático, triture la muestra de tejido (10 mg) con un minipinner, añada 600 μL de RL BUFFER (suministrado con el kit) a la muestra de tejido y continúe moliendo hasta que la muestra se haya homogeneizado.
- Inmediatamente después de la extracción, cuantificar el ARN obtenido y evaluar su calidad (para la desnaturalización o la presencia de cualquier residuo de proteína) utilizando un fluorespectrómetro. Realice lecturas espectrofotométricas de absorbancia en longitudes de onda de 260 nm y 280 nm, donde los ácidos nucleicos y las proteínas absorben respectivamente.
- Después de la evaluación de la concentración total de ARN, utilizando un kit de síntesis de ADNc siguiendo las instrucciones del fabricante, transcriba inversamente el volumen apropiado que contenga 1 μg de ARN total de cada muestra a ADNc.
- Analizar el ADNc obtenido por RT-PCR.
- Para analizar las expresiones génicas de los genes de interés, se han diseñado cebadores directos e inversos específicos para cada gen diana, así como para el gen de referencia expresado constitutivamente por la gliceraldehído fosfato deshidrogenasa (GAPDH). Utilice la aplicación web Primer-BLAST (www.ncbi.nlm.nih.gov/tools/primer-blast) para elegir los mejores cebadores que garanticen la especificidad del emparejamiento solo para el gen de interés y obtener los oligonucleótidos sintetizados por un proveedor comercial. Las secuencias de los pares de cebadores utilizados se presentan en el Cuadro 5.
- Vuelva a suspender los cebadores liofilizados con agua destilada libre de ARNasa a una concentración final de 100 mM. Utilice un kit dedicado para realizar análisis de qPCR. Llevar a cabo las reacciones en un volumen final de 20 μL, diluyendo el ADNc recocido 1:40. Cargue cada muestra por duplicado en placas de PCR de 96 pocillos.
- Realice ejecuciones de qPCR en termociclador siguiendo este programa: 1 ciclo a 95 °C durante 10 min; 40 ciclos a 95 °C durante 15 s, 58 °C durante 30 s y 72 °C durante 1 min. Al final, realice un ciclo de disociación de 55 °C a 95 °C (30 s/°C) para verificar la especificidad del producto amplificado. Utilizando el software dedicado de la máquina, obtenga los valores de ciclo umbral (Umbral de ciclo, Ct) para cada muestra. Exprese los resultados como ΔΔ Ct (delta delta Ct) según la fórmula de Pfaffl32:
ΔCt Gen diana = Control de Ct - Tratamiento con Ct
Gen de referencia ΔCt = Control de Ct - Tratamiento con Ct
ΔCt = ΔCt Gen diana - ΔCt Gen de referencia
8. Análisis de datos
- Realice la gestión de datos mediante una hoja de cálculo. Realizar análisis utilizando software de análisis estadístico. Diseño de gráficos utilizando software específico.
- Representa la ganancia de peso corporal, el consumo de alimento, el peso absoluto y relativo de los órganos, los niveles séricos de hormonas, los datos morfométricos de los tejidos y los datos de expresión génica como media ± desviación estándar. Realizar un análisis no paramétrico de Kruskal-Wallis, seguido de comparaciones post-hoc por pares (prueba de Mann-Whitney).
- Analice los datos histológicos utilizando una prueba exacta de Fisher de 2 vías para identificar diferencias significativas con respecto al grupo de control, incluidas las muestras asignadas a una categoría sin ninguna referencia a las gradaciones de gravedad (incidencia total de hallazgos). Utilice la prueba de tendencia de Cochran-Armitage para identificar la tendencia dosis-respuesta. Considere las diferencias entre los grupos como significativas si el valor p es < 0,05.
Resultados
Como demostraron Tassinari et al.14 y Tammaro et al.33, los siguientes resultados mostraron el éxito de la GAHT en ratas y la idoneidad de los modelos.
No se registran muertes ni comportamientos anormales, como agresividad, y no se observan signos clínicos de toxicidad o sufrimiento (por ejemplo, disminución de la actividad, piloerección y aspecto despeinado)14.
Las concentraciones plasmáticas de T en ratas adultas macho y hembra durante el celo y el proestro son de 5,71 ± 0,84 ng/ml y de 1,24 ± 0,29 y 0,80 ± 0,36 ng/ml, respectivamente34. El nivel medio circulante de T en las ratas gonadalmente intactas es de 3,5 ± 0,5 ng/mL35. Los niveles de T y E2 medidos en las ratas control en ambos modelos se ubicaron dentro del rango fisiológico indicado en la literatura33. El rango fisiológico de E2 para ratas hembras está entre 5-140 pg/mL36. El rango fisiológico de E2 para ratas macho está entre 2-175 pg/mL37.
Modelo dFM
Considerando la variación del diámetro del clítoris, calculada como la diferencia entre el diámetro medido el último día (punto 13) y el primer día de tratamiento (punto 0), el diámetro se incrementa en todos los grupos de tratamiento (DL1= 0,45; DL2=095; DL3=2,05 mg di T por administración) en comparación con el grupo C (Tabla 6).
La ganancia de bw es significativa en los grupos DL2 y DL3 en comparación con el grupo C; el consumo de alimento aumentó significativamente en el grupo DL3 en comparación con el C (Figura 1).
Los niveles séricos de T aumentaron en todos los grupos de tratamiento, alcanzando el rango del cisgénero correspondiente (C MASCULINO = CONTROL MASCULINO); Los niveles de E2 disminuyeron en todos los grupos de tratamiento, alcanzando el rango del cisgénero correspondiente (Figura 2).
El peso absoluto y relativo de los ovarios disminuyó en los grupos DL2 y DL3, en comparación con el grupo C (Tabla 7; Figura 3), con disminución del peso absoluto del útero en el grupo DL2 (Tabla 7).
El análisis histopatológico de los ovarios en el grupo DL3 mostró un aumento significativo de los vasos hiperémicos dependiente de la dosis en comparación con el grupo C. El grupo DL3 mostró un aumento significativo en el número de folículos primarios y secundarios, y una disminución significativa en los folículos de Graaf en comparación con el grupo C (Tabla 8).
El útero mostró un aumento de los vasos hiperémicos, significativamente en el grupo DL3. Las áreas de luz, miometrio, endometrio y altura del epitelio luminal se reducen en todos los grupos de tratamiento (Tabla 8).
El análisis de la expresión génica mostró una regulación positiva significativa de los genes específicos del sexo masculino (Cyp2C11; Cyp3A18)17 en los grupos DL2 y DL3 y una disminución significativa del gen específico del sexo femenino (Cyp2C12)14 en los grupos DL2 y DL3 en comparación con el grupo C (Figura 4).
Modelo dMF
No se han registrado muertes ni efectos clínicos adversos para el modelo dMF. El recuento de espermatozoides disminuye de forma dosis-dependiente y estadísticamente en todos los grupos de tratamiento (DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg E2+CPA) en comparación con el grupo C (Figura 5).
La ganancia de peso corporal y el consumo de alimento disminuyeron significativamente en todos los grupos de tratamiento (DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg E2 + CPA) en comparación con el grupo C (Figura 6).
Los niveles séricos de T disminuyen significativamente y los niveles séricos de E2 aumentan estadísticamente en todos los grupos de tratamiento (DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg E2 + CPA) en comparación con el grupo C (Figura 7). Como era de esperar, no se muestran diferencias entre los niveles séricos de T de los grupos de tratamiento y el grupo femenino C.
Los niveles séricos de TSH se incrementan de forma dosis-dependiente en todos los grupos de tratamiento, significativamente en el grupo DL2 y con significación limítrofe en DL3 (p=0,06) en comparación con el grupo C (Figura 8).
El peso absoluto de los testículos disminuye significativamente en todos los grupos de tratamiento (DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg E2 + CPA) en comparación con C; no se observan diferencias en el peso relativo entre los tratamientos en comparación con el grupo C (Tabla 9).
La depleción de las células germinales y el aumento de la degeneración de los túbulos en los testículos se observan de manera dosis-dependiente con el análisis histopatológico. (DL1, 1/4 de muestra: grado 1; DL2, 2/4 muestras: grado 1; DL3, 2/4 muestras: grado 1 más 2/4 muestras: grado 2) y disminución estadísticamente significativa del área lumínica del túbulo en el grupo DL3 en comparación con el grupo C (Tabla 10; Figura 9).
El análisis histopatológico tiroideo reveló hipertrofia de células foliculares con folículos centrales apretados y más pequeños de lo normal en todos los grupos de tratamiento (DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg E2 + CPA) en comparación con el grupo C (Figura 10). La densidad folicular en todos los grupos de tratamiento aumenta significativamente con un aumento en el número de folículos. Sin embargo, la dimensión del folículo disminuye con la reducción del área tanto del folículo como del coloide en todos los grupos de tratamiento en comparación con el C. La altura de la célula del epitelio t y el área de los folículos no se ven afectadas (Tabla 10).
El análisis de la expresión génica indica que Cyp2c11 (isoforma específica del hombre) está regulada a la baja en el grupo DL3 y Cyp3a18 (isoforma predominantemente masculina) está significativamente regulada a la baja en todos los grupos de tratamiento (Figura 11A, B). Cyp2c12 (isoforma específica de la mujer) está regulado al alza en todos los grupos de tratamiento, estadísticamente significativo en DL1 y DL2 (Figura 11C), el Cyp2c6 (isoforma predominante femenina) está significativamente regulado al alza en el grupo DL2 en comparación con C (Figura 11D).

Figura 1: Datos generales de toxicidad en el modelo desfeminizante-masculinizante. (A) Aumento de peso corporal de ratas hembras Sprague-Dawley tratadas subcutáneamente con diferentes dosis de enantato de testosterona 2 veces por semana durante 2 semanas: C: 0-aceite de sésamo; DL1: 0,45; DL2: 0,95; DL3: 2,05 mg. (B) Consumo alimenticio de ratas hembras Sprague-Dawley tratadas subcutáneamente con diferentes dosis de enantato de testosterona 2 veces por semana, durante 2 semanas: CF: 0-aceite de sésamo; DL1: 0,45; DL2: 0,95; DL3: 2,05 mg. Los datos se presentan como media ± desviación estándar. Significación estadística: * p < 0,05 prueba de Mann-Whitney. Esta cifra ha sido modificada de14. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Niveles séricos de hormonas en el modelo desfeminizante-masculinizante (dFM). Evaluación bioquímica de hormonas mediante ensayo ELISA de ratas hembras Sprague-Dawley tratadas subcutáneamente con diferentes dosis de enantato de testosterona 2 veces por semana, durante 2 semanas: C: 0-aceite de sésamo; DL1: 0,45; DL2: 0,95; DL3: 2,05 mg y C MALE (hombre control) 0 mg. (A) testosterona, (B) estradiol. Los datos se presentan como media ± desviación estándar. Significación estadística: * p < 0,05 prueba de Mann-Whitney. Esta cifra ha sido modificada de14. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Características histopatológicas ováricas. Ovario de ratas hembras Sprague-Dawley tratadas subcutáneamente 2 veces por semana durante 2 semanas con (A) Panel de aceite de sésamo 0 y (B) 2,05 mg de enantato de testosterona. Barra de escala de 10 μm (aumento original: 20x; tinción de hematoxilina y eosina). Esta cifra ha sido modificada de14. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Expresión génica en el modelo feminizante-masculinizante. Análisis de la expresión génica de (A) los genes específicos del sexo masculino Cyp2c11 y Cyp3a18 y (B) los genes específicos de la mujer Cyp2c6 y Cyp2c12 mediante PCR en tiempo real en hígados de rata hembra tratados subcutáneamente con diferentes dosis de enantato de testosterona 2 veces por semana, durante 2 semanas: aceite de sésamo C 0, DL1 0,45, DL2 0,95 y DL3 2,05 mg. Los datos se presentan como valores medios de ΔΔCt ± desviación estándar, con las muestras de control como calibradores y el GAPDH como gen de referencia. Significación estadística: * p < 0,05 prueba de Mann-Whitney. Esta cifra ha sido modificada de14. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Recuento de espermatozoides. (A) Recuento de espermatozoides de ratas macho Sprague-Dawley tratadas subcutáneamente con valerato de estradiol más acetato de ciproterona, 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg. Los datos se presentan como media ± desviación estándar. Significación estadística: * p < 0,05 prueba de Mann-Whitney. (B) Fotos microscópicas ligeras del recuento de espermatozoides en la cámara de Neubauer (aumento original de 10x; área de 1/16 mm2). Esta cifra ha sido modificada de33. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Datos generales de toxicidad en el modelo desmasculinizante-feminizante. (A) Aumento de peso corporal (PC) de ratas macho Sprague-Dawley tratadas subcutáneamente con valerato de estradiol más acetato de ciproterona, 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg. (B) Consumo de alimento. Los datos se presentan como media ± desviación estándar. Significación estadística: * p < 0,05 prueba de Mann-Whitney. Esta cifra ha sido modificada de33. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Niveles séricos de hormonas en el modelo desmasculinizante-feminizante. Evaluación bioquímica de hormonas mediante ensayo ELISA de ratas macho Sprague-Dawley tratadas subcutáneamente con valerato de estradiol más acetato de ciproterona, 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg. (A) testosterona, (B) estradiol. Los datos se presentan como media ± desviación estándar. Significación estadística: * p < 0,05 prueba de Mann-Whitney. Esta cifra ha sido modificada de33. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Niveles séricos de biomarcadores tiroideos en el modelo desmasculinizante-feminizante. Evaluación bioquímica de hormonas mediante ensayo ELISA de ratas macho Sprague-Dawley tratadas subcutáneamente con valerato de estradiol más acetato de ciproterona, 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg. (A) TSH, (B) T4. Los datos se presentan como media ± desviación estándar. Significación estadística: * p < 0,05 prueba de Mann-Whitney. Esta cifra ha sido modificada de33. Haga clic aquí para ver una versión más grande de esta figura.
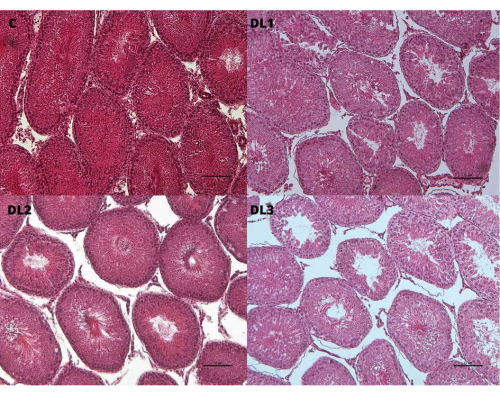
Figura 9: Características histopatológicas de los testículos. Degeneración de los túbulos testiculares con depleción de células germinales en ratas macho Sprague-Dawley tratadas subcutáneamente con valerato de estradiol más acetato de ciproterona, 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2:0,09 + 0,2 y DL3: 0,18 + 0,2 mg. Barra de escala 10 μm (aumento original 10x; tinción de hematoxilina y eosina). Esta cifra ha sido modificada de33. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Características histopatológicas tiroideas. Hipertrofia tiroidea en ratas macho Sprague-Dawley tratadas subcutáneamente con valerato de estradiol más acetato de ciproterona 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg. Barra de escala de 10 μm (aumento original 10x; tinción de hematoxilina y eosina). Esta cifra ha sido modificada de33. Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Expresión génica en el modelo desmasculinizante-feminizante. Análisis de expresión génica de (A) genes específicos masculinos Cyp2c11; (B) Cyp3a18 y (C) genes específicos de la hembra Cyp2c12 y (D) Cyp2c6 por PCR en tiempo real en hígados de ratas macho tratados subcutáneamente con diferentes dosis de estradiol más acetato de ciproterona, 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg. Los datos se presentan como valores medios de ΔΔCt ± desviación estándar, con las muestras de control como calibradores y el GAPDH como gen de referencia. Significación estadística: * p < 0,05 prueba de Mann-Whitney. Esta cifra ha sido modificada de14. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Terapia hormonal para hombres transgénero: vía de administración, formulación y dosis Haga clic aquí para descargar esta tabla.
Tabla 2: Terapia hormonal para mujeres transgénero: vía de administración, formulación y dosis Haga clic aquí para descargar esta tabla.
Tabla 3: Niveles de dosis hormonales del modelo desfeminizante-masculinizante. Niveles de dosis seleccionados para el modelo dFM en ratas hembras Sprague-Dawley tratadas subcutáneamente con diferentes dosis de enantato de testosterona 2 veces por semana durante 2 semanas: Control (C) 0-aceite de sésamo; DL1 0,45, DL2 0,95 y DL3 2,05 mg. Haga clic aquí para descargar esta tabla.
Tabla 4: Niveles de dosis hormonales del modelo desmasculinizante-feminizante. Niveles de dosis seleccionados para el modelo dMF en ratas macho Sprague-Dawley tratadas subcutáneamente con valerato de estradiol más acetato de ciproterona, 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2: 0,09 + 0,2 y DL3: 0,18 + 0,2 mg. Haga clic aquí para descargar esta tabla.
Tabla 5: Diseño de imprimaciones hacia adelante y hacia atrás. Haga clic aquí para descargar esta tabla.
Tabla 6: Dimensiones del clítoris. Variación en el diámetro del clítoris observada en milímetros (mm) de ratas hembras Sprague-Dawley cuando se administraron por vía subcutánea diferentes dosis de enantato de testosterona 2x durante una semana durante 2 semanas: aceite de sésamo C 0; DL1 0,45, DL2 0,95 y DL3 2,05 mg. Significación estadística: § p < 0,05 Prueba exacta de Fisher; # p < 0,05 tendencia lineal; * p < 0,05 prueba de Mann-Whitney. n: número. DE: desviación estándar. Haga clic aquí para descargar esta tabla.
Tabla 7:Peso absoluto y relativo de ovario y útero. Ovario y útero peso absoluto y relativo de ratas hembras Sprague-Dawley tratadas subcutáneamente con diferentes dosis de enantato de testosterona 2 veces por semana durante 2 semanas: aceite de sésamo C 0, DL1 0,45, DL2 0,95 y DL3 2,05 mg. Significación estadística: § p < 0,05 Prueba exacta de Fisher; ## p < 0,01 tendencia lineal; * p < 0,05 prueba de Mann-Whitney. n: número. DE: desviación estándar. Esta tabla ha sido modificada de14. Haga clic aquí para descargar esta tabla.
Tabla 8:Datos histopatológicos del modelo desfeminizante-masculinizante. Criterios de valoración histopatológicos en órganos diana de ratas hembras Sprague-Dawley tratadas por vía subcutánea con diferentes dosis de enantato de testosterona 2 veces por semana durante 2 semanas: aceite de sésamo C 0, DL1 0,45, DL2 0,95 y DL3 2,05 mg. Significación estadística: § p < 0,05 Prueba exacta de Fisher; ## p < 0,01 tendencia lineal; * p < 0,05 prueba de Mann-Whitney. n: número. DE: desviación estándar. Esta tabla ha sido modificada de14. Haga clic aquí para descargar esta tabla.
Tabla 9:Peso absoluto y relativo de los testículos. El peso absoluto y relativo de los testículos de ratas macho Sprague-Dawley tratadas subcutáneamente con valerato de estradiol más acetato de ciproterona, 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2:0,09 + 0,2 y DL3: 0,18 + 0,2 mg. Significación estadística: * p < 0,05 prueba de Mann-Whitney. N: número de muestra; DE: desviación estándar. Esta tabla ha sido modificada de33. Haga clic aquí para descargar esta tabla.
Tabla 10: Datos histopatológicos del modelo desmasculinizante-feminizante. Datos histopatológicos de los testículos y la tiroides de ratas macho Sprague-Dawley tratadas subcutáneamente con valerato de estradiol más acetato de ciproterona, 5 veces por semana durante 2 semanas: Control (C): 0-aceite de sésamo, DL1: 0,045 + 0,2, DL2:0,09 + 0,2 y DL3: 0,18 + 0,2 mg. Significación estadística: § p < 0,05 Prueba exacta de Fisher; ° p = 0,08, * p < 0,05 Prueba de Mann-Whitney; ## p < 0,01 Prueba de tendencia de Cochran-Armitage. N: número de muestra; DE: desviación estándar. Esta tabla ha sido modificada de33. Haga clic aquí para descargar esta tabla.
Discusión
La implementación de modelos de roedores que imiten el GAHT es crucial para estudiar la posible susceptibilidad específica y vulnerabilidad de las personas TG y los resultados a largo plazo de las terapias, que suelen durar toda su vida.
Dado el escaso número de estudios similares en la literatura, el punto crítico de este experimento es la selección de las dosis para establecer los modelos; Dichas dosis deben ser lo suficientemente bajas como para ser compatibles con la administración a largo plazo en animales sin causar efectos adversos, toxicidad y/o muerte. Otro punto crítico es la mejor vía de administración a adoptar, teniendo en cuenta la vía preferida en humanos. En efecto, aunque en el modelo de DM, la T se administra según la práctica clínica en los hombres TG15En el modelo de DM, la vía de administración no se solapó con la práctica clínica en las mujeres TG15. Se necesitan más experimentos para establecer un método más fiable. De hecho, los dos modelos de ratas están diseñados para imitar tanto como sea posible los tratamientos humanos. Proporcionan datos fundamentales sobre el impacto de ambos GAHT en varias funciones corporales, incluida la reproducción, la homeostasis tiroidea y el metabolismo hepático, llenando parte del vacío existente.
Se pueden aplicar varias medidas adicionales para mejorar los dos modelos y hacerlos aún más robustos y transferibles a los humanos. Por ejemplo, el uso de la administración subcutánea a través de la implantación de reservorios poliméricos que liberan E2 o T de forma diaria controlada, lo que se asemeja mucho a los parches de liberación de hormonas ampliamente utilizados en el ámbito clínico en la actualidad15. Además, la extensión de la duración del tratamiento puede simular mejor la exposición crónica de los pacientes que eligen someterse a GAHT.
Mención especial merece la expresión de CYPs hepáticos específicos por sexo, que se utilizan para evaluar el éxito de las terapias. De hecho, este parámetro ha sido establecido y desarrollado por primera vez en el presente trabajo y representa una valiosa herramienta para confirmar la implementación de los modelos.
Por último, se necesitan más estudios que evalúen la reversibilidad de las perturbaciones reproductivas debidas a la GAHT para mejorar la preservación de la fertilidad de las personas TG que deciden tener hijos38.
Divulgaciones
Los autores declaran que la investigación se llevó a cabo sin ninguna relación comercial o financiera que pudiera crear un conflicto de intereses.
Agradecimientos
Ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| Analytical balance ABJ 320-4NM | Kern | Z741091 | |
| Bouin | Biooptica | 05-M01008 | |
| Centrifuge 5415 R | Eppendorf | For eppendorf | |
| Cyproterone Acetate | Sigma-Aldrich | C3412 | |
| D-MEM medium | Gibco | ||
| ExcelTaq 2X Fast Q-PCR Master Mix (SYBR, ROX), 200 RXN | Smobio | TQ1210 | |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | |
| GraphPad Prism software version 5.0 for Windows | GraphPad Software | ||
| Hematoxylin | Biooptica | 05-06002/L | |
| Heosin | Biooptica | 05-10007/L | |
| Imaging Software | Nikon | NIS-BR | |
| JMP 10 statistical software | SAS Institute | ||
| Microm | Thermo Scientific | HM 325 | |
| Microscopy | Nikon Microphot FX | ||
| Mouse/Rat Testosterone ELISA | Biovendor | RTC001R | 96T |
| NanoDrop 1000 Spectrophotometer | Thermo Scientific | ND-1000 | |
| Paraffina | Biooptica | 087910 | |
| Portable Balances SCOUT STX2202 | OHAUS | 30253064 | |
| Primers | Life Technologies | Designed by PrimerBlast | |
| Rat Estradiol ELISA | Biovendor | RTC009R | 96T |
| Rat TSH(Thyroid Stimulating Hormone) ELISA Kit | ELK Biotechnology | ELK2283 | 96T |
| Rat TSH(Thyroid Stimulating Hormone) ELISA Kit | ELK Biotechnology | ELK2283 | 96T |
| SensiFASTcDNA Synthesis Kit | Bioline | BIO-65053 | 50 reaction |
| Sesam Oil | ACROS | AC241000010 | |
| Sprague Dawley rats male and female | Envigo | 8/9 weeks old | |
| Standard diets | Mucedola | 4RF18 | |
| T4(Thyroxine) ELISA Kit | ELK Biotechnology | ELK8716 | 96T |
| Testosterone enanthate | Sigma-Aldrich | T3006 | |
| Thermal Cycler LineGene 9600 Plus Bioer | Aurogene | ||
| Tissue processor | Shandon Excelsior ES, Thermo Scientific) | ||
| Total RNA purification KIT | Norgen | 17200 | 50 column |
| Victor 3 Multilabel reader | Perkin Elmer | ||
| β-Estradiol 17-valerate | Sigma-Aldrich | E1631 |
Referencias
- Rokach, A., Patel, K. Human sexuality: Function, dysfunction, paraphilias, and relationships. , Academic Press. (2021).
- American Psychological Association. Guidelines for psychological practice with transgender and gender nonconforming people. Am Psychol. 70 (9), 832-864 (2015).
- Ammari, T., Sluiter, E. C., Gast, K., Kuzon, W. M. Female-to-male gender-affirming chest reconstruction surgery. Aesthet Surg J. 39 (2), 150-163 (2019).
- Garg, G., Elshimy, G., Marwaha, R. Gender Dysphoria. , StatPearls Publishing. Treasure Island, FL. (2023).
- Chan, A. S. W., Wu, D., Lo, I. P. Y., Ho, J. M. C., Yan, E. Diversity and inclusion: Impacts on psychological wellbeing among lesbian, gay, bisexual, transgender, and queer communities. Front Psychol. 13, 726343(2022).
- Unger, C. A. Hormone therapy for transgender patients. Transla Androl Urol. 5 (6), 877(2016).
- Sofer, Y., et al. Gender‐affirming hormone therapy effect on cortisol levels in trans males and trans females. Clin Endocrinol. 100 (2), 164-169 (2024).
- Pirtea, P., Ayoubi, J. M., Desmedt, S. T. ’, Sjoen, G. Ovarian, breast, and metabolic changes induced by androgen treatment in transgender men. Fertil Steril. 116 (4), 936-942 (2021).
- Tassinari, R., Maranghi, F. Rodent model of gender-affirming hormone therapies as specific tool for identifying susceptibility and vulnerability of transgender people and future applications for risk assessment. Int J Environ Res Public Health. 18 (23), 12640(2021).
- Schug, T. T., Janesick, A., Blumberg, B., Heindel, J. J. Endocrine disrupting chemicals and disease susceptibility. J Steroid Biochem Mol Biol. 127 (3-5), 204-215 (2011).
- van Larebeke, N., Fucic, A. Challenges in endocrine disruptor toxicology and risk assessment. , The Royal Society of Chemistry. (2020).
- You, H. H., Song, G. Review of endocrine disruptors on male and female reproductive systems. Comp Biochem Physiol C Toxicol Pharmacol. 244, 109002(2021).
- Sifakis, S., Androutsopoulos, V. P., Tsatsakis, A. M., Spandidos, D. A. Human exposure to endocrine disrupting chemicals: effects on the male and female reproductive systems. Environ Toxicol Pharmacol. 51, 56-70 (2017).
- Tassinari, R., et al. Risk assessment of transgender people: Development of rodent models mimicking gender-affirming hormone therapies and identification of sex-dimorphic liver genes as novel biomarkers of sex transition. Cells. 12 (3), 474(2023).
- T’Sjoen, G., Arcelus, J., Gooren, L., Klink, D. T., Tangpricha, V. Endocrinology of transgender medicine. Endo Rev. 40 (1), 97-117 (2019).
- Dhir, R. N., Shapiro, B. H. Interpulse growth hormone secretion in the episodic plasma profile causes the sex reversal of cytochrome P450s in senescent male rats. Proc Natl Acad Sci. 100 (25), 15224-15228 (2003).
- Robertson, G. R., Farrell, G. C., Liddle, C. Sexually dimorphic expression of rat CYP3A9 and CYP3A18 genes is regulated by growth hormone. Biochem Biophys Res Comm. 242 (1), 57-60 (1998).
- Kinnear, H., et al. A mouse model to investigate the impact of testosterone therapy on reproduction in transgender men. Human Reprod. 34 (10), 2009-2017 (2019).
- Gómez, Á, et al. Effects of adult male rat feminization treatments on brain morphology and metabolomic profile. Hormones Behav. 125, 104839(2020).
- T'Sjoen, G., et al. European society for sexual medicine position statement "Assessment and hormonal management in adolescent and adult trans people, with attention for sexual function and satisfaction". J Sex Med. 17 (4), 570-584 (2020).
- Coleman, E., et al. Standards of care for the health of transgender and gender diverse people, version 8. Int J Transgender Health. 23 (sup 1), S1-S259 (2022).
- Sudhakar, D., Huang, Z., Zietkowski, M., Powell, N., Fisher, A. R. Feminizing gender‐affirming hormone therapy for the transgender and gender diverse population: An overview of treatment modality, monitoring, and risks. Neurourol Urodynamics. 42 (5), 903-920 (2023).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Laboratory Animal Sci. 50 (5), 600-613 (2011).
- Hickman, D. L. Minimal exposure times for irreversible euthanasia with carbon dioxide in mice and rats. J Am Assoc Laboratory Animal Sci. 61 (3), 283-286 (2022).
- Vdoviaková, K., et al. Importance rat liver morphology and vasculature in surgical research. Med Sci Monit. 22, 4716(2016).
- Fiette, L., Slaoui, M. Necropsy and sampling procedures in rodents. Methods Mol Biol. 691, 39-67 (2011).
- Shackelford, C., Long, G., Wolf, J., Okerberg, C., Herbert, R. Qualitative and quantitative analysis of nonneoplastic lesions in toxicology studies. Toxicol Pathol. 30 (1), 93-96 (2002).
- Tassinari, R., et al. short-term exposure to titanium dioxide nanoparticles in Sprague-Dawley rat: focus on reproductive and endocrine systems and spleen. Nanotoxicology. 8 (6), 654-662 (2014).
- Fortune, J. The early stages of follicular development: activation of primordial follicles and growth of preantral follicles. Animal Reprod Sci. 78 (3-4), 135-163 (2003).
- Maranghi, F., et al. Effects of the food contaminant semicarbazide following oral administration in juvenile Sprague-Dawley rats. Food Chem Toxicol. 47 (2), 472-479 (2009).
- Rasinger, J., et al. Low dose exposure to HBCD, CB-153 or TCDD induces histopathological and hormonal effects and changes in brain protein and gene expression in juvenile female BALB/c mice. Reprod Toxicol. 80, 105-116 (2018).
- Pfaffl, M. W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 29 (9), e45(2001).
- Tammaro, A., et al. Risk assessment of transgender people: implementation of a demasculinizing–feminizing rodent model including the evaluation of thyroid homeostasis. Biology Direct. 19 (1), 5(2024).
- Falvo, R. E., Kaltenbach, C. C., Pancoe, W. L. Determination of testosterone concentration in the plasma of normal and androgen-sterilized female rats, using a competitive protein binding technique. Neuroendocrinology. 10 (4), 229-234 (1972).
- Gibbs, R. B. Testosterone and estradiol produce different effects on cognitive performance in male rats. Horm Behav. 48 (3), 268-277 (2005).
- Ström, J. O., Theodorsson, A., Ingberg, E., Isaksson, I. M., Theodorsson, E. Ovariectomy and 17β-estradiol replacement in rats and mice: a visual demonstration. J Vis Exp. (64), e4013(2012).
- Cooke, P. S., Nanjappa, M. K., Ko, C., Prins, G. S., Hess, R. A. Estrogens in male physiology. Physiol Rev. 97 (3), 995-1043 (2017).
- Raja, N. S., Rubin, E. S., Moravek, M. B. A Review of animal models investigating the reproductive effects of gender-affirming hormone therapy. J Clin Med. 13 (4), 1183(2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados