Method Article
Zweidimensionale superauflösende Visualisierung der Mikrovaskulatur des Gehirns von Ratten mittels Ultraschall-Lokalisationsmikroskopie
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Protokoll für die Ultraschalllokalisationsmikroskopie (ULM), das eine räumliche Auflösung von 12,5 μm erreicht, um die Mikrovaskulatur des Gehirns bei Ratten abzubilden. Es ermöglicht eine detaillierte Visualisierung der Richtung und Geschwindigkeit des Blutflusses und bietet ein leistungsstarkes Werkzeug für die Weiterentwicklung von Studien zu zerebralen Durchblutungs- und Gefäßerkrankungen.
Zusammenfassung
Die zerebralen Mikrovaskulatur bildet ein komplexes Netzwerk von Gefäßen, die für die Aufrechterhaltung der Gehirnfunktion unerlässlich sind. Krankheiten wie Schlaganfall, Alzheimer, Gliome und vaskuläre Demenz können das mikrovaskuläre System tiefgreifend stören. Leider bieten die derzeitigen medizinischen Bildgebungsmodalitäten nur indirekte Beobachtungen in dieser Größenordnung. Inspiriert von der optischen Mikroskopie überwindet die Ultraschall-Lokalisationsmikroskopie (ULM) den klassischen Kompromiss zwischen Eindringtiefe und räumlicher Auflösung. Durch die Lokalisierung und Verfolgung einzelner injizierter Mikrobläschen (MBs) mit Subwellenlängenpräzision können Gefäß- und Geschwindigkeitskarten auf der Mikrometerskala erstellt werden. Hier stellen wir ein robustes Protokoll für die hochauflösende Bildgebung der Mikrovaskulatur des Gehirns in vivo bei Ratten unter Verwendung einer kommerziellen Ultraschallplattform vor. Diese Methode erreicht eine räumliche Auflösung von 12,5 μm, rekonstruiert die mikrovaskuläre Architektur und liefert detaillierte Informationen über die Richtung und Geschwindigkeit des Blutflusses, was unser Verständnis der zerebralen Mikrozirkulation erheblich verbessert. Das Protokoll kann auf Rattenkrankheitsmodelle ausgeweitet werden und bietet ein leistungsfähiges Werkzeug für die Früherkennung und Behandlung von neurovaskulären Erkrankungen.
Einleitung
Das zerebrale Mikrogefäßsystem, bestehend aus Kapillaren, Arteriolen und Venolen, ist für die Aufrechterhaltung der Gehirnfunktion unerlässlich, indem es die Nährstoffzufuhr, den Sauerstoffaustausch und die Abfallbeseitigung erleichtert 1,2. Störungen in diesem Netzwerk sind mit neurologischen Erkrankungen wie Schlaganfall3, Alzheimer4, Gliomen5 und vaskulärer Demenz6 verbunden, was zu Beeinträchtigungen der Gehirnphysiologie führt. Mikrovaskuläre Veränderungen gehen häufig dem Auftreten klinischer Symptome voraus, was sie zu einem kritischen Ziel für diagnostische und therapeutische Eingriffe macht 7,8. Ein umfassendes Verständnis der vaskulären Veränderungen sowohl auf struktureller als auch auf funktioneller Ebene ist der Schlüssel zur Weiterentwicklung der Forschung und der Behandlungsstrategien.
Die Darstellung der zerebralen Mikrovaskulatur ist jedoch aufgrund der geringen Größe und der teilweise tiefen Lage im Gehirn eine besondere Herausforderung. Herkömmliche bildgebende Verfahren wie die Magnetresonanztomographie (MRT)9 und die Computertomographie (CT)10 sind zwar für die Erfassung großflächiger Gefäßveränderungen geeignet, bieten aber eine räumliche Auflösung (~100 μm), die für die Visualisierung kleiner Gefäße viel zu grob ist. Optische Methoden wie die Zwei-Photonen-Mikroskopie11 bieten eine hervorragende räumliche Auflösung (bis zu 1 μm) für die Abbildung einzelner Kapillaren, werden jedoch durch ein begrenztes Sichtfeld und eine begrenzte Eindringtiefe (weniger als 1 mm) behindert, was ihre Fähigkeit, tiefe Hirnregionen abzubilden, einschränkt. Als ultraschallbasierte Technik bietet Doppler12 zwar eine Echtzeit-Blutflussmessung, bleibt aber durch eine Auflösung von 50-200 μm eingeschränkt, die für mikrovaskuläre Details nicht ausreicht. Insgesamt erfüllt derzeit keine einzelne Methode die doppelte Anforderung an eine hohe räumliche Auflösung und eine ausreichende Hirnpenetration, die für die Bildgebung der zerebralen Mikrovaskulatur erforderlich ist.
Inspiriert von der optischen Mikroskopie13,14 ermöglicht die Ultraschall-Lokalisationsmikroskopie (ULM) die Visualisierung feiner Strukturen auf der Mikrometerskala, indem sie einzelne injizierte Mikrobläschen (MBs) lokalisiert und ihre Verschiebung mit einer Subwellenlängenauflösungverfolgt 15. Sie umgeht den klassischen Kompromiss zwischen Penetration und Auflösung in der Ultraschallbildgebung16. Diese Studie beschreibt ein robustes Protokoll für die Implementierung von ULM in einem lebenden Rattenmodell, das eine hochauflösende Bildgebung der Mikrovaskulatur des Gehirns durch die kommerziell erhältliche Ultraschallplattform ermöglicht. Das Protokoll liefert nicht nur eine umfassende Rekonstruktion der mikrovaskulären Struktur, sondern auch detaillierte Informationen über die Richtung und Geschwindigkeit des Blutflusses, was mit herkömmlichen bildgebenden Verfahren nicht möglich ist. Obwohl das Protokoll an normalen Ratten validiert wurde, ist es auf Rattenkrankheitsmodelle erweiterbar und bietet Möglichkeiten für maßgeschneiderte Studien unter verschiedenen pathologischen Bedingungen.
Protokoll
Alle Tierversuche, die in dieser Arbeit durchgeführt werden, sind von der Ethikkommission der Fudan Universität genehmigt (Zulassungsnummer: 2022JS-004). Das Protokoll hält sich strikt an die Tierhaltungsrichtlinien der Fudan-Universität, um eine humane Behandlung der Tiere zu gewährleisten. Vor Beginn des Versuchs muss den Ratten eine einwöchige Periode zur Eingewöhnung in die Umgebung eingeräumt werden, in der sie ausreichend Futter und Wasser erhalten. Die Photoperiode wird sorgfältig in Übereinstimmung mit ihrem biologischen Rhythmus reguliert, um die Aufrechterhaltung normaler physiologischer Zustände zu gewährleisten. Am Ende des Experiments wird die Euthanasie mit einer Überdosis inhalativem Isofluran durchgeführt.
HINWEIS: Der Versuchsaufbau ist in Abbildung 1A-H dargestellt.
1. Vorbereitung der Tiere für die ULM-Bildgebung
- Anästhesie
- Induzieren Sie die Anästhesie bei der Ratte, indem Sie ein Gemisch aus 3,5 % Isofluran und 100 % Sauerstoff bei einer Flussrate von 3 l/min verabreichen. Nach ca. 4 Minuten wird das Tier aus der Kammer genommen und auf eine auf 37 °C vorgewärmte Bildgebungsplattform gelegt. Bestätigen Sie die Tiefe der Anästhesie, indem Sie feststellen, dass kein Rückzugsreflex an der festen Zehenklemme der Hintergliedmaße der Ratte vorhanden ist.
- Legen Sie die Nase der Ratte in eine Atemmaske, die mit dem Anästhesiesystem verbunden ist. Halten Sie eine stabile Sedierung aufrecht, indem Sie ein Gemisch aus 1,5 % Isofluran und 100 % Sauerstoff bei einer Durchflussrate von 1,5 l/min verabreichen.
HINWEIS: Anästhesiemethoden und Dosierungen folgen streng den Richtlinien des Herstellers.
- Präoperative Vorbereitung auf das Tier
- Befestigen Sie die oberen Schneidezähne der Ratte in der Kerbe der Schneidestange und positionieren Sie den Unterkiefer unter der Stange. Verwenden Sie Ohrstangen, um den Kopf der Ratte zu stabilisieren, indem Sie sie in der knöchernen Vertiefung etwas vor und oberhalb des Gehörgangs positionieren (mit der Hand tastbar), um sicherzustellen, dass die gesamte Schädeloberfläche horizontal bleibt (Abbildung 1A).
- Testen Sie vorsichtig die Stabilität der Fixierung, indem Sie einen kleinen Druck auf verschiedene Teile des Kopfes ausüben. Stellen Sie sicher, dass es zu keiner Bewegung oder einem Verrutschen aus der ursprünglichen Position kommt.
- Passen Sie die Höhe der Bildgebungsplattform an und passen Sie den Winkel des Rattenkopfes akribisch an, indem Sie die Kerbe der Schneideschneidestange anheben oder absenken, um eine ungehinderte Atmung zu gewährleisten.
- Tragen Sie Erythromycin-Salbe oder 30%ige Glycerinlösung auf die Augen der Ratte auf, um Schäden durch längere Exposition gegenüber OP-Leuchten zu vermeiden und die Augen unter Narkose feucht zu halten. Verwenden Sie außerdem eine Pinzette mit runder Spitze, um die Zunge der Ratte vorsichtig zu einer Seite des Mauls zu ziehen, um ein Ersticken während der Operation zu verhindern.
- Verwenden Sie eine elektrische Schermaschine und rasieren Sie den Kopf der Ratte gegen die Haarwuchsrichtung (von hinten nach vorne), typischerweise zwischen den Ohren, von den Augen bis zum Anfang des Halses (Abbildung 1B). Reinigen Sie den rasierten Bereich mit 1%iger Jodlösung, um den chirurgischen Schnitt vorzubereiten.
- Rattenkraniotomie
- Machen Sie einen Schnitt entlang der sagittalen Naht des Schädels der Ratte, beginnend direkt hinter dem Hinterhauptbein und etwa 4 cm nach vorne. Verwenden Sie Hämostatika, um die Haut auf beiden Seiten zurückzuziehen (Abbildung 1C). Optional können Sie die Haut über dem Schädel vollständig entfernen, um einen besseren chirurgischen Zugang zu ermöglichen, aber dies kann das Infektionsrisiko erhöhen.
- Entfernen Sie mit einer kleinen Schere das Periost vom Schädel, wodurch die harte Knochenschicht vollständig freigelegt wird.
- Führen Sie die Kraniotomie mit einem tragbaren Mini-Schädelbohrer durch, der mit einem kugelförmigen Bohrer ausgestattet ist (Abbildung 1D). Beginnen Sie mit einem groben Bohrer (2,5 mm Durchmesser) und klopfen Sie vorsichtig auf den Knochen, um ihn abzuschleifen, indem Sie den Bohrer jeweils 2-3 s lang anwenden. Beginnen Sie im mittleren Bereich und gehen Sie zu den dickeren Bereichen an den Seiten vor.
HINWEIS: Übermäßige Blutungen während der Kraniotomie beeinträchtigen die Durchblutung, was zu einer mangelnden Gefäßrekonstruktion in den kortikalen Bereichen führt (Abbildung 1H). - Pausieren Sie alle 2-3 s, um eine Überhitzung zu vermeiden, und injizieren Sie alle 2 Minuten etwa 1 ml 0,9 % NaCl mit einer Spritze in den Bohrbereich, um Schmutz abzukühlen und abzuspülen.
- Sobald das weiße Knochengewebe nicht mehr durchgehend verbunden erscheint, wechseln Sie zu einem feineren Bohrer (1 mm Durchmesser). Die Bohrung wird fortgesetzt, bis die zentralen großen Blutgefäße deutlich dunkelbraun sichtbar sind und der umgebende Bereich rosa erscheint, wobei die Mikrogefäße leicht rötlich sichtbar sind (Abbildung 1F).
HINWEIS: Der endgültige Kraniotomiebereich reicht von Bregma +3 mm bis Lambda anterior-posterior und 7 mm auf jeder Seite entlang der Mittellinie des Schädels (Abbildung 1E). Lassen Sie die Ratte nach Abschluss der Operation etwa 10 Minuten ruhen, um relativ stabile physiologische Bedingungen zu gewährleisten, bevor Sie mit der Datenerfassung beginnen.
2. Einrichtung vor der Datenerfassung
- Kontrastmittelaufbereitung und Injektion
- Lösen Sie das Kontrastmittel (eine Durchstechflasche mit 59 mg SF6-Gas und 25 mg lyophilisiertem Pulver) gemäß den offiziellen Richtlinien in 5 ml 0,9 % NaCl auf. Schütteln Sie die Mischung kräftig, um eine MB-Suspension zu bilden. Die Endkonzentration von SF6 in der Suspension beträgt 8 μL/ml.
- Ziehen Sie 0,8 mL der MB-Suspension in eine 1-ml-Spritze und befestigen Sie sie an einer Mikroinjektionspumpe, die für eine Infusion mit 100 μl/min programmiert ist.
- Führen Sie eine 26-G-Verweilnadel mit einem Katheter in die Schwanzvene der Ratte ein (Abbildung 1G).
- Auswählen der Bildebene
- Montieren Sie eine Sonde mit einer Zentralfrequenz von 15,625 MHz am Manipulatorarm des stereotaktischen Instruments des Gehirns, die mit einer Klemme ausgestattet ist (Bewegungsbereich: vertikal, horizontal und anterior-posterior bis 80 mm; Lesegenauigkeit: 0,1 mm).
- Positionieren Sie die Ultraschallsonde direkt über dem freiliegenden Rattengehirn. Tragen Sie das Kopplungsgel auf die freiliegende Gehirnoberfläche auf, um eine optimale Signalübertragung zu gewährleisten.
- Öffnen Sie die Hauptschnittstelle der Software, die einen Rattengehirnatlas mit Programmen zur Steuerung von Motorbewegungen integriert.
- Legen Sie den Bregma-Punkt als Ursprung fest. Die Softwareschnittstelle bietet eine Echtzeitanzeige der Flugbahn der Sonde und der entsprechenden Position der Rattenhirnschnitte. Wählen Sie die Ziel-Bildgebungsebene aus. zum Beispiel Bregma -1 mm.
3. Datenerfassung (Timing ~ 20 min)
HINWEIS: Verasonics (Ultraschallsystem) stellt die ursprünglichen MATLAB-Skripte für die Verwendung mit dem Vantage-System zur Verfügung und wurde nicht geändert.
- Software-Inbetriebnahme
- Starten Sie die Software MATLAB 2021a.
- Geben Sie das Datenerfassungsskript in MATLAB 2021a ein.
- Geben Sie im Stammverzeichnis im Befehlszeilenfenster activate ein, um die Laufzeitumgebung zu aktivieren.
- Parameterkonfiguration und Erfassung von HF-Signalen
- Legen Sie die Anfangs- und Endtiefe der Datenerfassung auf 5 bzw. 120 Wellenlängen fest, um den interessierenden Bereich effektiv zu erfassen.
HINWEIS: Anpassungen sollten auf der Grundlage der Bildgebungsebene und des zu untersuchenden Tieres vorgenommen werden. - Stellen Sie die Lenkwinkel der Plane-Wave-Übertragung von -5° bis 5° in Schritten von 2,5° ein, um die Bildauflösung und den Kontrast zu verbessern.
HINWEIS: Passen Sie diese Einstellungen basierend auf den spezifischen Bildgebungsanforderungen und Zielmerkmalen an. - Stellen Sie die Sendespannung auf 20 V ein, um eine ausreichende Durchdringung und ein optimales Signal-Rausch-Verhältnis für den interessierenden Bereich zu gewährleisten.
- Klicken Sie auf die Schaltfläche Ausführen , um die Datenerfassung zu starten und die Hochfrequenzsignale (RF) im .mat-Dateiformat zu speichern.
HINWEIS: Beginnen Sie mit der Datenerfassung 30 s nach dem Starten der Mikroinjektionspumpe, um eine gleichmäßige und stabile MB-Verteilung im Körper der Ratte zu gewährleisten.
- Legen Sie die Anfangs- und Endtiefe der Datenerfassung auf 5 bzw. 120 Wellenlängen fest, um den interessierenden Bereich effektiv zu erfassen.
4. Datenverarbeitung und -analyse (Timing ~ 8 h)
- Datenverarbeitung
- Importieren Sie die HF-Daten in MATLAB 2021a und demodulieren Sie sie, um In-Phase- und Quadratur-Daten (I/Q) zu generieren (siehe Materialtabelle).
- Klicken Sie auf die Schaltfläche Ausführen, um den DAS-Algorithmus (Delay-and-Sum) für das Beamforming der I/Q-Daten zu verwenden (siehe Materialtabelle).
HINWEIS: Post-Compounding-Bildrate von 800 Hz mit insgesamt 120.000 Bildern.
- ULM-Bildgebung
- Wenden Sie den raumzeitlichen Filteralgorithmus17 (Singular Value Decomposition, SVD) auf IQ-Daten an, um Hintergrundrauschen und Unordnung zu entfernen. Alle 800 Frames werden als Datenblock gespeichert, und der SVD-Schwellenwert wird auf [15, 800] festgelegt.
- Bestimmen Sie den Mittelpunkt jedes MB mit dem Gaußschen Anpassungsalgorithmus18.
- Verwenden Sie den Kuhn-Munkes-Algorithmus, um MB-Trajektorien über aufeinanderfolgende Frames basierend auf ihren Positionen zu verfolgen (siehe Materialtabelle).
- Ordnen Sie MB-Trajektorien auf ein 8x hochgerechnetes Gitter ab, indem Sie eine Hot-Colormap verwenden, um die Anzahl der MB-Trajektorien anzuzeigen, und eine Jet-Colormap, um die Strömungsgeschwindigkeit zu kodieren, indem Sie die berechnete Geschwindigkeit an jeder Position innerhalb des Mikrovaskulatursystems abbilden.
- Wenden Sie ein benutzerdefiniertes Farbschema an, um Aufwärts- und Abwärtsströmungsrichtungen zu unterscheiden, was zu hochauflösenden Bildern für eine verbesserte Visualisierung führt.
- Teilen Sie die ursprünglichen MB-Trajektorien nach dem Zufallsprinzip in zwei Gruppen auf, um zwei Unterbilder zu erstellen, führen Sie für jedes eine Fourier-Transformation durch und berechnen Sie die Fourier-Ring-Korrelation (FRC) als normierte Korrelation ihrer Spektren. Definieren Sie die Auflösung als Kehrwert der Ortsfrequenz, bei der der FRC unter den Schwellenwert19 fällt.
Ergebnisse
Abbildung 1 zeigt den detaillierten Aufbau für die mikrovaskuläre ULM-Bildgebung im Gehirn in vivo bei Ratten, wobei jedes Element sorgfältig entwickelt wurde, um die experimentelle Variabilität zu minimieren und eine genaue Datenerfassung für zuverlässige hochauflösende Bildgebungsergebnisse zu gewährleisten.
Abbildung 2A zeigt die ULM-rekonstruierte Struktur des Mikrovaskulatursystems im Rattengehirn, positioniert in einem Abstand von -1 mm vom Bregma-Punkt, mit einer Bildgebungstiefe von fast 12 mm. Die effektive Schichtdicke über die gesamte Bildgebungsebene reicht von 0,1 mm bis 0,3 mm. Sowohl flachere als auch tiefere Mikrogefäße sind deutlich sichtbar, und die Bildqualität verschlechtert sich nicht mit zunehmender Tiefe (Abbildung 2B). Durch Berechnung der vollen Breite bei halbem Maximum (FWHM) der Intensitätsverteilung entlang der gestrichelten Linie in den Regions of Interest (ROI) können Gefäße mit unterschiedlichen Durchmessern detektiert werden, wobei der kleinste 13 μm beträgt (Abbildung 2C). Unter Anwendung der Fourier-Ring-Korrelation (FRC) zur Auflösungsbeurteilung wird die räumliche Auflösung der Mikrovaskulaturbildgebung des Rattengehirns mit 12,5 μm quantifiziert (Abbildung 2D).
Informationen über den Blutfluss sind entscheidend für die Reflexion physiologischer Reaktionen und die Diagnose von Krankheiten. Abbildung 3A zeigt die Blutflussrichtungen in einem Querschnitt des Rattengehirns, wobei blau die Strömung in Richtung der Sonde und rot die Strömung weg von der Sonde anzeigt. Anhand dessen können spezifische Hirnregionen wie kleine Arterien in der Hirnrinde, die nach unten fließen, und kleine Venen, die nach oben fließen, unterschiedenwerden 20 (Abbildung 3B). Abbildung 3C zeigt eine Karte der Blutflussgeschwindigkeit des Gehirns, die in verschiedenen Farben kodiert ist, wobei größere Gefäße deutlich höhere Flussraten aufweisen. Die Verteilung der Geschwindigkeiten reicht von 1 bis 80 mm/s, wobei sie sich überwiegend im Bereich von 10-25 mm/s konzentriert (Abbildung 3D), was 81,57 % des gesamten Geschwindigkeitsbereichs entspricht. Dieser Anteil wird berechnet, indem die Anzahl der Geschwindigkeitsdatenpunkte im Bereich von 5 bis 25 mm/s relativ zur Gesamtzahl der Datenpunkte in der Geschwindigkeitsmatrix bestimmt wird.
Abbildung 4 zeigt die bildgebenden Ergebnisse eines Glioblastom-Rattenmodells unter Verwendung des vorgeschlagenen Protokolls. Die C6-Glioblastomzellen wurden in das Gehirn der Ratte implantiert. Abbildung 4A zeigt die mikrovaskuläre Struktur im Gehirn eines Glioblastom-Rattenmodells, wobei eine abnormale Gefäßerweiterung und strukturelle Unregelmäßigkeiten um den Tumor herum beobachtet wurden. Die Gefäße in der Tumorregion weisen im Vergleich zum Normalbereich auf der linken Seite eine größere Tortuosität auf. Abbildung 4B liefert Informationen über die Richtung des Blutflusses, die ein Verständnis der Flussmuster innerhalb der Tumorregion ermöglichen. Abbildung 4C zeigt eine Karte der Blutflussgeschwindigkeit, die die Heterogenität des Gefäßflusses innerhalb und um den Tumor herum zeigt.
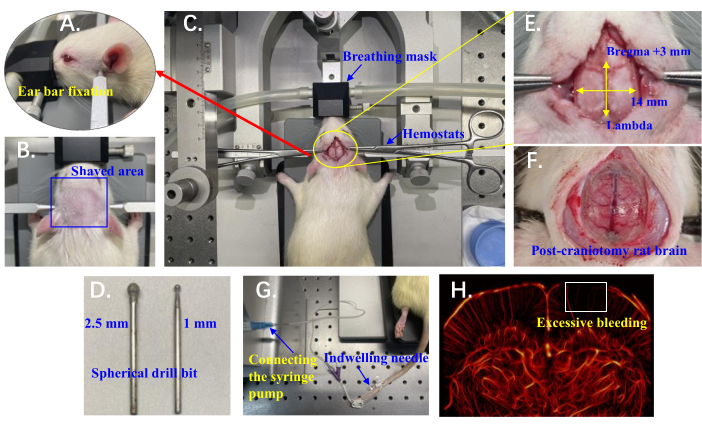
Abbildung 1: Details des Versuchsaufbaus für die in vivo ULM-Bildgebung von Mikrovaskulatur des Gehirns von Ratten. (A) Position der Ohrstangen, die zur Stabilisierung des Rattenkopfes verwendet wurden. (B) Der rasierte Bereich am Kopf der Ratte, der für den chirurgischen Zugang vorbereitet wurde. (C) Ratte, die mit einer Atemmaske auf dem stereotaktischen Instrument positioniert ist; Hämostatika werden verwendet, um die Haut auf beiden Seiten zurückzuziehen. (D) Kugelbohrer (2,5 mm und 1 mm), die für die Kraniotomie auf dem Schädelbohrer montiert sind. (E) Kraniotomiebereich relativ zu Bregma und Lambda markiert. (F) Exponiertes Rattengehirn nach Kraniotomie. (G) Eine Verweilnadel, die in die Schwanzvene der Ratte eingeführt und mit einer Spritzenpumpe für die Mikroinjektion verbunden wird. (H) Beispiel für ein Gefäßsystem des Gehirns der Ratte mit übermäßigen Blutungen; Der weiße Kasten zeigt eine Region, in der keine Gefäßrekonstruktion vorhanden ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
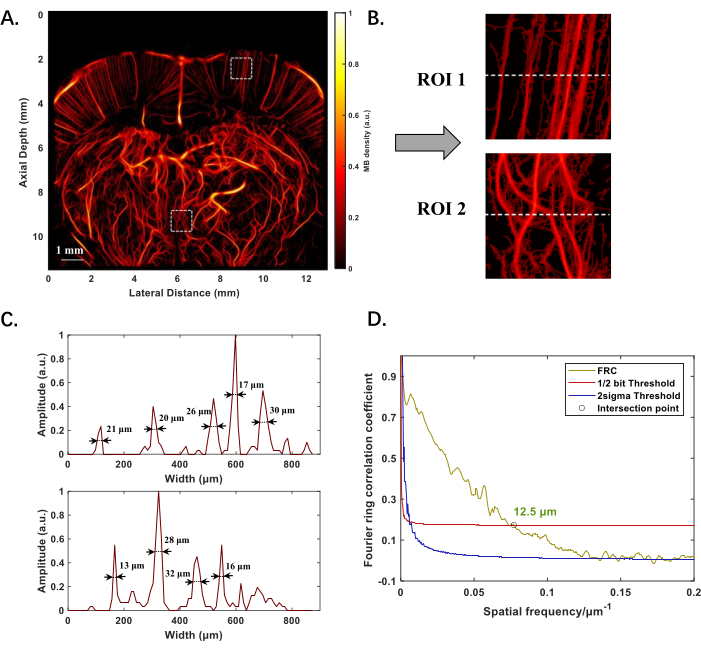
Abbildung 2: Experimentelle Ergebnisse der ULM-Rekonstruktion der mikrovaskulären Struktur des Rattengehirns in vivo. (A) Mikrovaskuläre Struktur des Rattengehirns -1 mm vom Bregma-Punkt entfernt. (B) Vergrößerte Bilder von zwei Regionen von Interesse (ROI) an flacheren und tieferen Stellen in A, um die Morphologie kleiner Gefäße hervorzuheben. (C) Intensitätsverteilung entlang der gestrichelten Linie in B, wobei numerische Werte die Gefäßdurchmesser angeben, die mit voller Breite bei halbem Maximum (FWHM) gemessen wurden. (D) Bewertung der ULM-Rekonstruktionsleistung Unter Verwendung der Fourier-Ring-Technik wurde das 1/2-Bit gewählt, um die Auflösung ohne Einbußen bei der Bildqualität zu standardisieren, die die höchste Ortsfrequenz definiert, bei der die Korrelation noch statistisch bedeutsame Informationen anzeigt. Das "○" markiert den Schnittpunkt der Korrelationskurve und der 1/2-Bit-Schwelle und gibt damit die Auflösungsgrenze an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
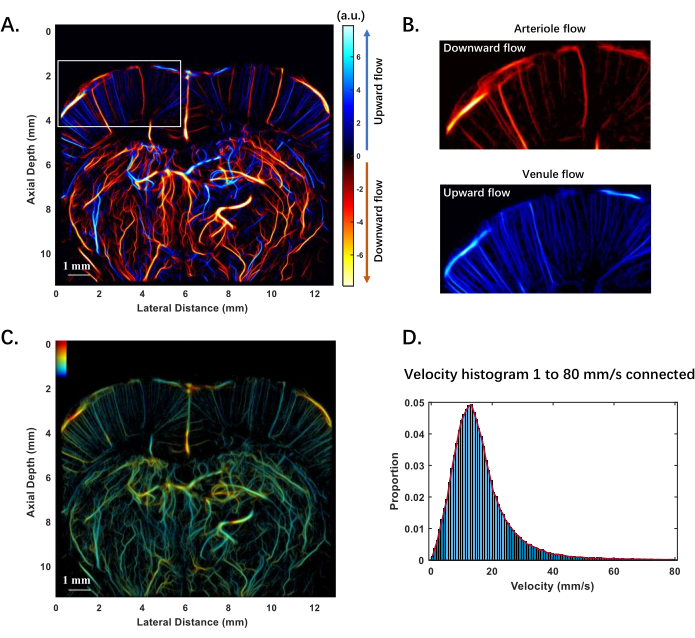
Abbildung 3: Experimentelle Ergebnisse der ULM-Rekonstruktion der mikrovaskulären Blutflussrichtung und -geschwindigkeit im Rattengehirn in vivo. (A) Richtung des Blutflusses im Rattengehirn. Blau zeigt eine Aufwärtsströmung in Richtung der Sonde an, und Rot zeigt eine Abwärtsströmung von der Sonde weg an. (B) Kleine Arterien und Venen in den kortikalen Regionen des Rattenhirns, die basierend auf der Richtung des Blutflusses abgegrenzt werden. (C) Blutflussgeschwindigkeit im Rattengehirn. (D) Geschwindigkeitshistogramm des Blutflusses im Rattengehirn, das die Verteilung von 1 mm/s bis 80 mm/s zeigt. Die hellblauen Balken stellen den Geschwindigkeitsbereich von 5-25 mm/s dar. Die rote Linie stellt die an die Daten angepasste Kurve dar und veranschaulicht das typische Geschwindigkeitsverteilungsprofil. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Experimentelle Ergebnisse der ULM-Rekonstruktion der mikrovaskulären Struktur im Glioblastommodell des Rattengehirns in vivo. (A) Mikrovaskuläre Struktur des Rattengehirns. (B) Richtung des Blutflusses im Rattengehirn. (C) Blutflussgeschwindigkeit im Rattengehirn. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll nutzte ULM erfolgreich, um eine hochauflösende Bildgebung von in vivo Mikrovaskulatur des Gehirns von Ratten durchzuführen. Im Vergleich zu anderen bildgebenden Verfahren berücksichtigt ULM gleichzeitig sowohl die räumliche Auflösung als auch die Eindringtiefe. Das freiliegende Rattengehirn wurde nicht durch den Schädel, sondern durch den Schädel abgebildet, um eine Abschwächung und Verzerrung durch das Vorhandensein von Knochen zu vermeiden. Unter einem Schallkopf mit einer Zentralfrequenz von 15,625 MHz wurden vaskuläre Strukturen in einer Tiefe von ca. 12 mm mit einer räumlichen Auflösung von bis zu 12,5 μm erfasst. Die Richtung des Blutflusses erleichterte die Unterscheidung bestimmter Regionen der kleinen Arterien und Venen. Darüber hinaus unterstützt die Technik eine breite Palette von Strömungsgeschwindigkeitsmessungen (1-80 mm/s).
Die Kraniotomie, die an Ratten durchgeführt wird, ist in diesem Protokoll von entscheidender Bedeutung. Während der Operation ist es wichtig, übermäßige Blutungen zu minimieren. Einerseits können übermäßige Blutungen die Durchblutung beeinträchtigen, wobei eine typische Manifestation das Fehlen einer Gefäßrekonstruktion in den kortikalen Bereichen ist. Andererseits kann es bei den Versuchstieren auch zu physiologischen Veränderungen oder sogar zum Tod führen. Das stereotaktische Gerät, das bei dem Eingriff verwendet wird, verfügt über ein automatisiertes Kraniotomieprogramm, das das Trauma reduzieren und die Erfolgsrate erhöhen kann, aber stark auf die Erfahrung des Behandlers angewiesen ist. Denn eine genaue Bestimmung der Lage und Tiefe des Bohrplatzes ist notwendig, um Schäden oder Folgeverletzungen am Rattengehirn zu vermeiden. Während eine Kraniotomie nicht immer erforderlich ist, ist die transkranielle ULM-Bildgebung vielversprechend, erfordert jedoch robuste Kompensations- oder Verzerrungskorrekturalgorithmen. Zusätzlich wird eine Mikroinjektionspumpe eingesetzt, um MBs stetig zu verabreichen, um sicherzustellen, dass sie spärlich und stabil im Gefäßsystem der Ratte bleiben. Dieser Ansatz ist für herkömmliche Lokalisierungstechniken geeignet, da er qualitativ hochwertige ULM-Rekonstruktionen ermöglicht. Es verlängert jedoch sowohl die Datenerfassung als auch die Bildgebungsdauer, was die ULM-Bildgebung zu einem langwierigen Prozess macht. Eine alternative Strategie beinhaltet die Verwendung von MB-Injektionen mit hoher Dichte, was die Implementierung fortschrittlicher Algorithmen wie Deep Learning21,22 erfordert, um die Bildauflösung ohne Beeinträchtigung aufrechtzuerhalten.
Die Isofluran-Anästhesie wurde nach der vom Gerätehersteller empfohlenen Dosierung angewendet, um die physiologische Stabilität bei der Ratte aufrechtzuerhalten. Wie jedoch in früheren Studien dokumentiert, hat die Isofluran-Anästhesie bekannte Auswirkungen auf das Kreislaufsystem, die möglicherweise kardiovaskuläre Parameter wie Blutdruck und Herzfrequenz beeinflussen23,24. Diese Änderungen können zu Schwankungen in der Blutflussdynamik führen, was sich möglicherweise auf die Genauigkeit von Blutflussmessungen auswirkt.
Zusammenfassend lässt sich sagen, dass dieses Protokoll das umfangreiche Anwendungspotenzial von ULM demonstriert und eine Referenz für die prospektive Erforschung von Hirnerkrankungen auf der Grundlage von Kleintiermodellen darstellt. Es ist von großem Wert für das Verständnis pathophysiologischer Veränderungen auf mikrovaskulärer Ebene und für die Beurteilung des Ansprechens des Krankheitsverlaufs auf Behandlungen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde teilweise unterstützt durch das National Key Research and Development Program of China im Rahmen des Grant 2023YFC2410903, die National Natural Science Foundation of China (Grants 12274092, 12034005), das Explorer Program of Shanghai (Grant 21TS1400200), das International Science and Technology Cooperation Program of Shanghai (Grant 24490710400) und die AI for Science Foundation der Fudan University (Grant FudanX24AI016).
Materialien
| Name | Company | Catalog Number | Comments |
| Alcohol | DICHANG | https://www.dehsm.com/goods-17187.html | 75% |
| Beamforming program | Institute of Biomedical Engineering at the University of Montreal | Matlab Ultrasound Toolbox 3.4 version | |
| Body temperature maintenance device | RWD Life Science Co., Ltd. | 69026 | |
| Brain stereotaxic instrument | RWD Life Science Co., Ltd. | 71000-R | Adaptable to breathing mask |
| Cranial Microinjection Surgical Instrument Kit | RWD Life Science Co., Ltd. | SP0005-R | |
| Digital microscope | RWD Life Science Co., Ltd. | DOM-1001 | |
| Drug delivery catheter | RWD Life Science Co., Ltd. | https://www.rwdls.com/product-solutions/life-sciences/administration/draw-blood | |
| Erythromycin ointment | Renhe Pharma | H36020018 | 1% x 15 g |
| Gas anesthesia machine | RWD Life Science Co., Ltd. | R500IE | Includes breathing mask |
| Handheld electric clipper | GUAZHOUMU | MJD-DTJ02 | |
| Handheld mini cranial drill | RWD Life Science Co., Ltd. | 78001 | |
| Indwelling needle | Kindly EnterpriseDevelopment Group Co., LTD | Positive Pressure Model | 26 G |
| Iodine solution | HYNAUT | https://www.hainuocn.com/index/detail/524.html | 4.5–5.5 g/L |
| IQ demodulation program | Institute of Biomedical Engineering at the University of Montreal | Matlab Ultrasound Toolbox 3.4 version | |
| Isoflurane | RWD Life Science Co., Ltd. | R510-22-10 | |
| MATLAB software | MathWorks | Version R2021a | |
| Microinjection pump | RWD Life Science Co., Ltd. | R462 | |
| Sodium chloride injection | SHENG'AO animals pharmaceutical Co., Ltd. | 270071460 | 0.90% |
| SonoVue | Bracco | https://www.bracco.com/en-se/product/sonovue | |
| Spherical drill bit | RWD Life Science Co., Ltd. | HM1027/HM1010 | |
| Supporting Positioning Software | RWD Life Science Co., Ltd. | V2.0.0.30400 | |
| Syringe | Kindly EnterpriseDevelopment Group Co., Ltd. | RWLB | 1 mL |
| Tracking program | Jean-Yves Tinevez | 2016 version | |
| Ultrasound gel | Junkang Medical Equipment Co., Ltd. | Model DS-1 | |
| Ultrasound probe | VERASONICS, INC. | L22-14vX LF | |
| Verasonics Ultrasound System | VERASONICS, INC. | Vantage-256 | ultrasound platform |
Referenzen
- Sweeney, M. D., Ayyadurai, S., Zlokovic, B. V. Pericytes of the neurovascular unit: Key functions and signaling pathways. Nat Neurosci. 19 (6), 771-783 (2016).
- Wardlaw, J. M., Smith, C., Dichgans, M. Mechanisms of sporadic cerebral small vessel disease: Insights from neuroimaging. Lancet Neurol. 12 (5), 483-497 (2013).
- Fang, J., Wang, Z., Miao, C. -. Y. Angiogenesis after ischemic stroke. Acta Pharmacol Sin. 44 (7), 1305-1321 (2023).
- Zlokovic, B. V. Neurovascular pathways to neurodegeneration in Alzheimer's disease and other disorders. Nat Rev Neurosci. 12 (12), 723-738 (2011).
- Kane, J. R. The role of brain vasculature in glioblastoma. Mol Neurobiol. 56 (9), 6645-6653 (2019).
- Iadecola, C. The pathobiology of vascular dementia. Neuron. 80 (4), 844-866 (2013).
- Ren, B., et al. Cerebral small vessel disease: Neuroimaging features, biochemical markers, influencing factors, pathological mechanism and treatment. Front Neurol. 13, 843953 (2022).
- Bradley, C. P., Berry, C. Microvascular arterial disease of the brain and the heart: A shared pathogenesis. QJM. 116 (10), 829-834 (2023).
- Baltes, C., Radzwill, N., Bosshard, S., Marek, D., Rudin, M. Micro MRI of the mouse brain using a novel 400 MHz cryogenic quadrature RF probe. NMR Biomed. 22 (8), 834-842 (2009).
- Brancaccio, R., Bettuzzi, M., Morigi, M. P., Casali, F., Ragazzini, L. Image quality and dose assessment in inner ear computed tomography imaging with a flat panel-based system. J Comput Assist Tomogr. 39 (2), 232-239 (2015).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Osmanski, B. -. F., et al. Ultrafast Doppler imaging of blood flow dynamics in the myocardium. IEEE T Med Imaging. 31 (8), 1661-1668 (2012).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (storm). Nat Methods. 3 (10), 793-796 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91 (11), 4258-4272 (2006).
- Christensen-Jeffries, K., et al. Super-resolution ultrasound imaging. Ultrasound Med Biol. 46 (4), 865-891 (2020).
- Couture, O., Hingot, V., Heiles, B., Muleki-Seya, P., Tanter, M. Ultrasound localization microscopy and super-resolution: A state of the art. IEEE Trans Ultrason Ferroelectr Freq Control. 65 (8), 1304-1320 (2018).
- Demené, C., et al. Spatiotemporal clutter filtering of ultrafast ultrasound data highly increases Doppler and fUltrasound sensitivity. IEEE Trans Med Imaging. 34 (11), 2271-2285 (2015).
- Errico, C., et al. Ultrafast ultrasound localization microscopy for deep super-resolution vascular imaging. Nature. 527 (7579), 499-502 (2015).
- Banterle, N., Bui, K. H., Lemke, E. A., Beck, M. Fourier ring correlation as a resolution criterion for super-resolution microscopy. J Struct Biol. 183 (3), 363-367 (2013).
- Lowerison, M. R., et al. Super-resolution ultrasound reveals cerebrovascular impairment in a mouse model of Alzheimer's disease. J Neurosci. 44 (9), e1251232024 (2024).
- Zhang, G., et al. ULM-MBCNRT: In vivo ultrafast ultrasound localization microscopy by combining multi-branch CNN and recursive transformer. IEEE Trans Ultrason Ferroelectr Freq Control. , (2024).
- Zhang, G., et al. In vivo ultrasound localization microscopy for high-density microbubbles. Ultrasonics. 143, 107410 (2024).
- Redfors, B., Shao, Y., Omerovic, E. Influence of anesthetic agent, depth of anesthesia and body temperature on cardiovascular functional parameters in the rat. Lab Anim. 48 (1), 6-14 (2014).
- Lenz, C., Rebel, A., Van Ackern, K., Kuschinsky, W., Waschke, K. F. Local cerebral blood flow, local cerebral glucose utilization, and flow-metabolism coupling during sevoflurane versus isoflurane anesthesia in rats. Anesthesiology. 89 (6), 1480-1488 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten