Method Article
Vorbereitung eines Mäusemodells für schwere akute Pankreatitis durch eine Kombination aus Caerulein und Lipopolysaccharid intraperitoneale Injektion
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die intraperitoneale Verabreichung von Arzneimitteln ist ein sicherer und wirksamer nicht-invasiver Ansatz zur Induktion von Pankreasverletzungen. In dieser Studie wurden fünf verschiedene intraperitoneale Injektionsprotokolle an Mäusen verglichen, um einen unterschiedlichen Grad an Pankreasschädigung zu induzieren, und ein Modell für schwere Pankreasverletzungen etabliert, um die pathologischen Veränderungen und Behandlungsstrategien für schwere akute Pankreatitis (SAP) zu untersuchen.
Zusammenfassung
Die Behandlung der schweren akuten Pankreatitis (SAP) mit hohen Mortalitätsraten stellt eine große klinische Herausforderung dar. Die Untersuchung der pathologischen Veränderungen, die mit SAP verbunden sind, anhand von Tiermodellen kann dabei helfen, potenzielle therapeutische Ziele zu identifizieren und neue Behandlungsansätze zu erforschen. Frühere Studien induzierten eine Pankreasschädigung primär durch retrograde Gallengangsinjektion von Natriumtaviaurocholat, aber der Einfluss der chirurgischen Schädigung auf die Qualität des Tiermodells bleibt unklar. In dieser Studie verwendeten wir verschiedene Häufigkeiten von intraperitonealen Caerulein-Injektionen in Kombination mit unterschiedlichen Dosen von LPS, um eine Pankreasschädigung bei C57BL/6J-Mäusen zu induzieren, und verglichen das Ausmaß der Schädigung über fünf intraperitoneale Injektionsprotokolle hinweg. In Bezug auf die Induktion einer akuten Pankreatitis bei Mäusen wird ein intraperitoneales Injektionsprotokoll vorgeschlagen, das innerhalb von 5 Tagen zu einer Mortalitätsrate von bis zu 80% führt. Konkret erhielten die Mäuse täglich zehn intraperitoneale Injektionen von Caerulein (50 μg/kg), gefolgt von einer Injektion von LPS (15 mg/kg) eine Stunde nach der letzten Caerulein-Verabreichung. Durch die Anpassung der Häufigkeit und Dosierung der injizierten Medikamente kann man die Schwere der Bauchspeicheldrüsenverletzung effektiv manipulieren. Dieses Modell weist eine starke Kontrollierbarkeit auf und hat einen kurzen Replikationszyklus, so dass es von einem einzelnen Forscher fertiggestellt werden kann, ohne dass teure Geräte erforderlich sind. Es simuliert bequem und genau die wichtigsten Krankheitsmerkmale, die bei menschlicher SAP beobachtet werden, und weist gleichzeitig ein hohes Maß an Reproduzierbarkeit auf.
Einleitung
Die schwere akute Pankreatitis ist gekennzeichnet durch einen raschen Beginn, ein rasches Fortschreiten und hohe Mortalitätsraten innerhalb des Krankheitsbereichs1 des Verdauungssystems. Die hohe Sterblichkeitsrate stand seit jeher im Mittelpunkt der klinischen Forschung. Aufgrund unvorhersehbarer Veränderungen der klinischen Bedingungen, der Heterogenität der Krankheitsmanifestationen und der begrenzten Verfügbarkeit menschlicher Proben ist die Etablierung von Tiermodellen für die Krankheitsforschung immer wichtiger geworden.
Die retrograde Injektion von Natriumtaurocholat in den Gallengang communis wird häufig verwendet, um ein Rattenmodell von SAP2 zu erstellen. Durch die Simulation einer pankreatikobiliären Obstruktion und die Induktion des Rückflusses von Galle und Pankreasflüssigkeit zeigt diese Modellierungstechnik eine hohe Erfolgsquote bei der Replikation von SAP-Tiermodellen. Es ist jedoch zu beachten, dass die invasive Chirurgie Auswirkungen auf das Tiermodell selbst hat. Darüber hinaus ist diese Methode auf größere Tiere, wie Ratten und Hunde, beschränkt, die in erster Linie als Versuchspersonen verwendet werden. Alternative Techniken, einschließlich der Duodenalintubation3, der direkten Duodenalpunktion4 und der direkten Punktion des Gallengangs-Pankreasgangs5, werden häufig zu Modellierungszwecken verwendet.
Intraperitoneale Injektions- und diätetische Modellierungsmethoden bieten nicht-invasive Vorteile, die auf Tiere jeder Größe angewendet werden können. Das Mausmodell der SAP, das durch die Fütterung von Cholin-defizientem Ethionin (CDE)6 induziert wird, weist bestimmte Komplikationen auf, wie z. B. schlecht kontrollierbare Hyperglykämie und Hypokalzämie, was es für die Bewertung neuer diagnostischer und therapeutischer Ansätze ungeeignet macht. Auf der anderen Seite stellt die intraperitoneale Injektion von Caerulein in Kombination mit L-Arginin7 die am häufigsten eingesetzte Methode zur Induktion einer akuten Pankreatitis bei Mäusen dar. Insbesondere die wiederholte intraperitoneale Verabreichung von Caerulein - einem Cholecystokinin-Analogon - bietet einen sehr geeigneten Ansatz zur Untersuchung verschiedener Aspekte im Zusammenhang mit dieser destruktiven Krankheit, einschließlich Pathogenese, Entzündung und Regenerationsprozessen. Aufgrund seiner strukturellen Ähnlichkeit mit Cholecystokinin (CCK) stimuliert Caerulein effektiv die Kontraktion der Gallenblase und die Enzymsekretion der Bauchspeicheldrüse, was zu einem Ungleichgewicht in der Enzymsekretion führt, gefolgt von einer anschließenden Selbstzerstörung8. Lipopolysaccharid (LPS), das als pathogenassoziiertes molekulares Mustermolekül allgegenwärtig ist und umfassend untersucht wurde, kann durch intraperitoneale Injektion mit Caerulein kombiniert werden, um ein effektives Mausmodell für SAP zu etablieren. Diese Kombination löst schnell eine beträchtliche Anzahl von entzündlichen Zytokinen aus und setzt diese frei, was zu einer übermäßigen lokalen und systemischen Entzündung führt. Mehrere Studien haben über die Induktion von SAP-Modellen bei Mäusen durch intraperitoneale Injektion von Caerulein in Kombination mit LPS berichtet. Dies kann auf die Tatsache zurückgeführt werden, dass die intraperitoneale Injektion von Caerulein bei Mäusen Pankreasödeme und Blutungen verursachen kann, während die Zugabe von LPS sofort eine Pankreasnekrose induzieren und die systemische Entzündungsreaktion, Sepsis und sogar Organversagen verschlimmern kann. Derzeit gibt es Schwankungen in der Dosierung und Häufigkeit von intraperitonealen Caerulein-Injektionen sowie Inkonsistenzen bei der zusätzlichen LPS-Dosierung. Das Erreichen von Konsistenz in Maus-SAP-Modellen ist eine Herausforderung 9,10,11,12; Daher ist es notwendig, ein standardisiertes Protokoll zu erstellen, um ein ideales Modell zu erhalten. In diesem Artikel beschreiben wir ein Protokoll für die intraperitoneale Injektion bei Mäusen und untersuchen die optimale Injektionshäufigkeit und zusätzliche Dosierung von LPS.
Protokoll
Dieses Protokoll wurde von der Ethikkommission des First Affiliated Hospital der Anhui University of Science and Technology (Huainan, China) geprüft und genehmigt (Ethikkodex: 2023-KY-905-001). Die Studie befolgte die Richtlinien der National Institutes of Health für die Pflege und Verwendung von Forschungsnagetieren in allen Tierverfahren. Für die vorliegende Studie wurden adulte Mäuse mit einem Gewicht von 20-30 g C57BL/6J verwendet. Die Mäuse wurden eine Woche lang unter kontrollierten Bedingungen (ca. 21 °C mit einem 12-stündigen Wechsel von Tag und Nacht) in einem Tierlabor untergebracht. Die Mäuse hatten ad libitum Zugang zu Futter und Wasser. Die Einzelheiten zu den in der Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Tiere
- Ordnen Sie 84 gesunde C57BL/6J-Mäuse sechs Gruppen zu, einschließlich der Kontrollgruppe, Pankreasverletzung (PI) I, PI II, PI III, PI IV und PI V.
- Bevor Sie mit dem Modellierungsverfahren beginnen, markieren Sie jede Gruppe von Mäusen mit Ohrkerben und lassen Sie sie 12 Stunden lang fasten.
2. Herstellung des induzierten Arzneimittelverdünnungsmittels
- Das Caerulein (1 mg) wird in 1 ml PBS aufgelöst und bei -20 °C in den Kühlschrank gestellt.
- Messen und notieren Sie das Gewicht der Versuchsmäuse 1 h vor der intraperitonealen Injektion des Arzneimittels.
- Die erforderliche Gesamtmasse von Caerulein wird in einem Verhältnis von 50 μg/kg extrahiert, basierend auf dem Gesamtgewicht aller Mäuse.
- Verdünnen Sie das erhaltene Caerulein-Medikament erneut mit PBS.
HINWEIS: Das Gesamtvolumen der PBS-Verdünnung sollte dem 5-fachen des Gesamtgewichtswerts aller Mäuse entsprechen. Die gleiche Verdünnungsmethode wurde verwendet, um das LPS-Verdünnungsmittel zu erhalten.
3. Intraperitoneale Injektion
HINWEIS: Intraperitoneale Injektionen wurden jeder Gruppe von Mäusen gemäß dem in der ergänzenden Tabelle 1 beschriebenen Protokoll verabreicht, um das Modell zu induzieren. Weitere 10 Mäuse wurden gruppiert und unter Beobachtung der 7-Tage-Überlebensraten behandelt.
- Greifen und halten Sie die Mäuse so, dass der Bauch der Mäuse nach oben zeigt und der Kopf tiefer als der Schwanz positioniert ist, um eine Schädigung der Organe beim Einführen der Spritze zu vermeiden.
- Desinfizieren Sie den Bauch der Mäuse mit Wattebällchen mit 75 % Alkohol.
- Halten Sie die Spritze in der rechten Hand (mit einer Nadel mit den Maßen ≤0,5/≥0,3) und führen Sie die Nadel in die Unterhaut auf der linken Seite der weißen Bauchlinie ein.
HINWEIS:Wechseln Sie für die nächste Injektion auf die rechte Seite. - Sobald die Nadel die Unterhautschicht erreicht hat, bewegen Sie sie ca. 3-5 mm nach vorne und führen Sie dann die Spritzennadel in einem Winkel von 45° in die Bauchhöhle ein. An dieser Stelle sollte man einen gewissen Widerstand spüren.
- Halten Sie die Nadel stationär und injizieren Sie die Substanz langsam.
HINWEIS: Überschreiten Sie nicht das 5-fache des Gewichtswerts der Mäuse als Volumen einer einzelnen intraperitonealen Injektion. - Ziehen Sie nach der Injektion die Nadel heraus und massieren und drücken Sie vorsichtig mit einem sterilen Wattestäbchen auf die Injektionsstelle, um das Medikament vollständig in die Bauchhöhle der Mäuse zu diffundieren.
- Verwenden Sie eine neue Spritze, um dies mit den nächsten Versuchsmäusen zu wiederholen.
4. Verhaltensfähigkeitstests im offenen Feld
HINWEIS: 12 Stunden nach der letzten intraperitonealen Injektion wurde ein Freifeld-Verhaltenstest durchgeführt, um die Gesamtaktivitätsdistanz und die Immobilitätszeit der Mäuse zu beurteilen.
- Platzieren Sie vier identische weiße Kästchen direkt unter der Kamera.
- Verbinden Sie die Kamera über ein Videokabel mit dem Computer.
- Stellen Sie sicher, dass die Experimentierbox sauber und frei von Gerüchen ist, bevor Sie mit dem Experiment beginnen.
- Positionieren Sie das Tier in der Mitte des Gitters, mit dem Gesicht vom Versuchsleiter abgewandt, und lassen Sie es 10 Minuten lang sich an die Umgebung anpassen.
- Starten Sie die Video-Tracking-Software und klicken Sie auf das Menü Datei , um ein neues Experiment zu erstellen.
- Richten Sie das Monitoring für vier gleichzeitige Sichtfelder ein.
- Markieren Sie die Länge und Breite des Experimentierobjekts, das sich innerhalb der Box bewegen kann, auf dem Echtzeit-Überwachungsbildschirm (30 cm × 30 cm).
- Sobald die Einrichtung abgeschlossen ist, beginnen Sie mit der Videoüberwachung und -aufzeichnung.
- Zeichnen Sie die Aktivität der Mäuse 15 Minuten lang auf.
- Nehmen Sie das Tier nach dem Test aus dem Gitter und setzen Sie es in seinen Käfig zurück. Reinigen Sie das Gitter gründlich mit einem Sterilisationsmittel, das Chlordioxid enthält.
5. Entnahme und Untersuchung des peripheren Blutes von Mäusen
- Euthanasieren Sie die Mäuse (gemäß dem institutionell anerkannten Protokoll).
- Die Euthanasie an den Versuchsmäusen ist 36 Stunden nach der intraperitonealen Injektion durchzuführen. Messen und notieren Sie das Körpergewicht der Mäuse vor der Euthanasie.
HINWEIS: Verabreichen Sie 0,18 ml 10% Chloralhydrat intraperitoneal, wobei darauf zu achten ist, dass keine Reaktion auf die Stimulation der Zehe oder des Schwanzes erfolgt. - Sichern Sie die Mäuse mit der linken Hand und halten Sie mit der rechten Hand die Schere, um die Schnurrhaare auf einer Seite der Mäuse zu kürzen.
- Drücken Sie sanft auf die Haut um das Auge, um eine Verstopfung und Vorwölbung des Augapfels zu induzieren.
- Fassen Sie den Augapfel mit einer gebogenen Pinzette und entfernen Sie ihn schnell, indem Sie peripheres Blut in einem Mikrozentrifugenröhrchen sammeln.
HINWEIS: Es wurden zwei verschiedene Arten von Mikrozentrifugenröhrchen verwendet, eines mit Antikoagulans und das andere ohne. - Drücken Sie gleichzeitig mit dem Mittelfinger der linken Hand leicht auf die Herzgegend der Maus, um die Pumpgeschwindigkeit des Herzens zu erhöhen.
- Die Euthanasie an den Versuchsmäusen ist 36 Stunden nach der intraperitonealen Injektion durchzuführen. Messen und notieren Sie das Körpergewicht der Mäuse vor der Euthanasie.
- Lassen Sie das periphere Blut ohne Antikoagulans 30 Minuten bei Raumtemperatur.
- Messen Sie die Konzentrationen von Serumamylase (Amy) und Lipase (Lip) mit einem automatisierten biochemischen Analysator nach der Enzymratenmethode und der Enzymzirkulationsmethode (gemäß den Anweisungen des Herstellers).
- Bestimmen Sie die Spiegel von Entzündungsindikatoren wie Pro Calcitonin (PCT) im Plasma mit der Chemilumineszenz-Methode unter Verwendung eines kommerziellen Chemilumineszenz-Imagers (gemäß den Anweisungen des Herstellers).
- Verwenden Sie ELISA-Kits, um die HMGB-1-, IL-6- und TNF-α-Spiegel im Mäuseserum zu messen (gemäß den Anweisungen des Herstellers).
- Analysieren Sie das mit Antikoagulans behandelte periphere Blut mit einem vollautomatischen Blutzellanalysator, um die relevanten Parameter zu beurteilen.
6. Entnahme des Bauchspeicheldrüsengewebes und Vorbereitung eines Paraffinschnitts
- Lege die Mäuse in Rückenlage und fixiere sie auf einer Schaumstoffplatte.
- Rasieren und desinfizieren Sie den Bereich, machen Sie dann einen Bauchschnitt und drehen Sie den Dünndarmschlauch nach rechts, um die Bauchspeicheldrüse vollständig freizulegen.
- Trennen Sie den Zwölffingerdarm und den Pylorusgang und lokalisieren Sie den Dünndarm unter der Bauchspeicheldrüse. Befreien Sie das Bauchspeicheldrüsengewebe entlang des Darmgangs vollständig.
- Klemmen Sie die Milz mit einer zahnlosen Pinzette fest und ziehen Sie sie sanft nach oben.
HINWEIS: Berühren Sie das Pankreasgewebe nicht direkt und vermeiden Sie während des gesamten Dissoziationsprozesses übermäßige Gewalt. - Präparieren Sie das hintere Pankreasbandgewebe scharf bis zum Kopf der Bauchspeicheldrüse und trennen Sie den Gallengang und die Blutgefäße.
- Entfernen Sie das Bauchspeicheldrüsengewebe, tupfen Sie die Oberflächenfeuchtigkeit mit saugfähigem Papier trocken, wiegen Sie es und protokollieren Sie.
- Die Hälfte des Bauchspeicheldrüsengewebes mit 4 % Paraformaldehyd fixieren und die andere Hälfte im Kühlschrank bei -80 °C lagern.
- Bereiten Sie die Pankreasparaffinabschnitte vor, indem Sie die folgenden Schritte ausführen.
- Reinigen Sie das fixierte Bauchspeicheldrüsengewebe mit 75% Alkohol und schneiden Sie es auf eine Größe von ca. 0,5 cm × 0,5 cm ab.
- Tauchen Sie das Gewebe 20 Minuten lang in 70 % Ethanol, weitere 20 Minuten in 80 % Ethanol und 15 Minuten in 90 % Ethanol.
- Behandeln Sie das Gewebe zweimal für jeweils 15 min mit 95% Ethanol und dann zweimal mit 100% Ethanol für jeweils 5 min.
- Setzen Sie das Gewebe zwei Runden von 12 Minuten und 5 Minuten Behandlungen mit Xylollösung aus, um die Transparenz zu gewährleisten.
- Das durchsichtige Tuch in einem Wachstank bei 65 °C 1 h einweichen.
- Betten Sie das Gewebe in geschmolzenes Paraffin ein und lassen Sie es abkühlen. Pankreasparaffinschnitte mit einem Hobel (Dicke: 5 μm) erhalten.
- Die erhaltenen Paraffinscheiben in 45 °C heißem Wasser flach drücken, aufsetzen und trocknen (Backbedingungen: 40 °C für 14-16 h).
7. Hämatoxylin- und Eosin-Färbung (H&E)
- Die Pankreasparaffinabschnitte werden 30 Minuten lang in Xylol I und II gelegt, dann für jeweils 5 Minuten in wasserfreiem, 95 %, 85 % und 75 % Alkohol und 5 Minuten in Reinstwasser.
- Färben Sie den Zellkern 160 s lang mit Hämatoxylin und spülen Sie ihn dann langsam mit fließendem Wasser ab.
- Tragen Sie eine Salzsäure-Alkohol-Differenzierungslösung für 5-10 s auf und spülen Sie sie dann schnell mit fließendem Wasser ab.
- Behandeln Sie die Abschnitte 5 Minuten lang mit wasserfreiem Alkohol.
- Inkubieren Sie das Zytoplasma 30 s lang mit Eosin, spülen Sie es dann mit fließendem Wasser ab.
- Tauchen Sie die Abschnitte jeweils 10 s lang in 75 %, 85 %, 95 % und 100 % Ethanol und behandeln Sie sie dann 5 Minuten lang mit Xylol, um sie zu dehydrieren.
- Zum Schluss versiegeln Sie die Schnitte mit neutralem Harz und betrachten sie unter dem Mikroskop.
- Führen Sie die pathologische Bewertung und Standardsdurch 13.
HINWEIS: Bestimmen Sie den Schweregrad der Pankreatitis anhand von Indikatoren wie Ödemen, Azinusnekrosen, Blutungen, Blutungen und Fettnekrosen sowie entzündlichen und perivaskulären Entzündungen. Verwenden Sie die zuvor veröffentlichten Implementierungsrichtlinien für die Bewertungvon 13.
8. Immunhistochemische Färbung
- Entwachsen Sie die in Paraffin eingebetteten Abschnitte des Pankreasgewebes in Xylol und rehydrieren Sie sie anschließend in einem Gradienten von Ethanollösungen.
- Nach einer 30-minütigen Membranruptur wird eine endogene Enzymblockierung mit 3%H2O2 für 20 min durchgeführt.
- Den Antikörper wird 30 Minuten lang mit 5 % Rinderserum bei Raumtemperatur blockiert und über Nacht bei 4 °C mit einer Verdünnung von Kaninchen-Anti-HMGB1 im Verhältnis 1:1500 inkubiert.
- Spülen Sie die Schnitte mit PBS und inkubieren Sie sie anschließend 30 min lang bei 37 °C in entsprechenden Sekundärantikörpern. Führen Sie danach die DAB-Farbentwicklung durch, die Hämatoxylin-Gegenfärbung und versiegeln Sie sie mit neutralem Gummi.
9. TUNEL-Verfahren zum Nachweis der Apoptose in Pankreasschnitten
- Entwachsen Sie die Pankreasparaffinabschnitte 5 Minuten lang in Xylol, wiederholen Sie dies zweimal und waschen Sie sie mit Gradientenethanol (100 % für 5 Minuten, 90 % für 2 Minuten, 70 % für 2 Minuten und destilliertes Wasser für 2 Minuten).
- Waschen Sie überschüssige Flüssigkeit um die Paraffinabschnitte herum mit PBS ab. Behandeln Sie jede Probe mit 100 μl Proteinase K, um eine vollständige Abdeckung des Gewebes zu gewährleisten. Inkubieren Sie die Proben bei 37 °C für 20 min. Anschließend die Proben 3 Mal jeweils 5 Minuten lang in PBS einweichen.
HINWEIS: Die Proteinase K-Lösung wurde hergestellt, indem die ursprüngliche Proteinase K-Lösung (200 μg/ml) mit PBS im Verhältnis 1:9 (Volumen) verdünnt wurde, was zu einer Endkonzentration von 20 μg/ml, ohne DNase, führte. Eine gründliche Reinigung von Proteinase K ist unerlässlich, um Interferenzen mit nachfolgenden Markierungsreaktionen zu vermeiden. - Geben Sie eine geeignete Menge von 3% H2O2 (verdünnt durch PBS) auf das Gewebe, um es vollständig zu infiltrieren und 20 Minuten lang zu inkubieren. Spülen Sie das Tuch 3 Mal für jeweils 5 Minuten mit PBS aus.
HINWEIS: Die Paraffinabschnitte sollten feucht gehalten werden. Um die endogenen Peroxidasen im Gewebe zu inaktivieren, sollte die Inkubationszeit nicht zu lang sein, um falsch positive Ergebnisse aufgrund eines DNA-Bruchs durch 3% H2O2 zu vermeiden. - Die gesamte Fläche der zu testenden Probe mit 50 μl Äquilibrierungspuffer abdecken und 10 min inkubieren.
- Entfernen Sie so viel Äquilibrierungspuffer wie möglich. Geben Sie dann 56 μl TdT-Inkubationspuffer zu jeder Gewebeprobe und inkubieren Sie 1 h lang (bei Raumtemperatur).
HINWEIS: Die Folie sollte nicht trocknen gelassen werden und Lichteinwirkung sollte vermieden werden. Der TdT-Inkubationspuffer wurde gemäß den Anweisungen des Herstellers hergestellt (Rekombinantes TdT-Enzym: Biotin-dUTP Labeling Mix: Equilibration Buffer = 1 μL: 5 μL: 50 μL). - Waschen Sie die Gewebeproben sofort mit PBS. Spülen Sie sie 4 Mal für jeweils 5 Minuten aus. Entfernen Sie vorsichtig überschüssige PBS-Lösung um die Proben herum mit Filterpapier.
- Für die Streptavidin-HRP-Reaktion werden jeder Gewebeprobe 100 μl zuvor verdünnte Streptavidin-HRP-Reaktionslösung (Streptavidin-HRP: TBST = 1: 300) zugegeben. 30 min inkubieren. Waschen Sie dann die Proben mit PBS und spülen Sie sie 3 Mal für jeweils 5 Minuten.
- Führen Sie eine DAB-Färbung durch, indem Sie 50 μl DAB zu jedem Paraffinabschnitt hinzufügen. Beobachten Sie die Färbung unter einem Mikroskop in Echtzeit. Nachdem eine positive Färbung auftritt, legen Sie die Objektträger sofort in eine feuchte Box. Stoppen Sie die Reaktion, indem Sie es mit reinem Wasser waschen.
- Tauchen Sie die Objektträger 3-5 Minuten lang in Hämatoxylin-Färbelösung und spülen Sie sie dann mit reinem Wasser ab.
- Differenzieren Sie ca. 2 s in Hämatoxylin-Differenzierungslösung, gefolgt von sofortigem Spülen mit reinem Wasser.
- Erzielen Sie eine blaue Färbung mit Hämatoxylin-Aufblaslösung für einige Sekunden und spülen Sie die Objektträger mit reinem Wasser sauber.
HINWEIS: Nach der Kernfärbung ist eine mikroskopische Untersuchung durchzuführen. Wenn die Färbung zu dunkel ist, geben Sie die Objektträger wieder in die Differenzierungslösung. Wenn die Färbung zu hell ist, starten Sie den Färbungsprozess ab dem nuklearen Färbungsschritt neu. - Dehydrieren Sie die Proben mit 4 Runden frischem wasserfreiem Ethanol für jeweils 5 Minuten. Weichen Sie sie dann 5 Minuten lang in Butanol und 5 Minuten in Xylol ein. Zum Schluss frisches Xylol für weitere 5 min verwenden.
- Montieren Sie die Dias mit neutralem Gummi. Lassen Sie sie an der Luft trocknen oder trocknen Sie sie im 60 °C Ofen.
- Führen Sie eine histologische Untersuchung mit einem Weißlichtmikroskop durch. Apoptotische Kerne erscheinen braun.
- Berechnen Sie den entsprechenden apoptotischen Index (AI).
HINWEIS: Betrachten Sie die Objektträger doppelblind. Bei TUNEL-positiven Objektträgern wählen Sie nach dem Zufallsprinzip 5 positive Bereiche unter hoher Vergrößerung (400x) aus und zählen Sie mindestens 100 Azinuszellen in jedem Bereich, um den Prozentsatz der positiven Zellen zu bestimmen. AI = (Gesamtzahl der apoptotischen Zellen/Gesamtzahl der Zellen) × 100%.
10. Durchflusszytometrie
- Besorgen Sie sich frisches Bauchspeicheldrüsengewebe und waschen Sie es gründlich, nachdem Sie es mit PBS durchblutet haben.
- Bereiten Sie eine 0,5%ige Kollagenase-IV-Verdauungslösung vor und verwenden Sie eine sterile Gewebeschere, um das Pankreasgewebe angemessen zu verdauen.
- Fügen Sie eine 5%ige BSA-Aufschlusslösung hinzu, abhängig vom Zustand der Pankreasfragmente und der Trübung der Flüssigkeit, und zentrifugieren Sie das Gemisch 5 Minuten lang bei niedriger Temperatur (~300 x g, 4 °C).
- Entsorgen Sie den Überstand, um die Verdauung zu beenden.
- Bereiten Sie ein Zellkulturmedium vor, das Phenylmethansulfonylfluorid (PMSF) und 2,5 % fötale Rinderserumzellsuspension enthält, um die Pankreaszellen zu resuspendieren.
- Filtern Sie die Azinus-Zellsuspensionen der Bauchspeicheldrüse durch ein 200-Mesh-Nylonnetz, um Zellsuspensionen durch Zellfilterung zu erhalten.
- Die Suspension der Pankreas-Azinuszellen wird bei niedriger Temperatur zentrifugiert (befolgen Sie die in Schritt 10.3 genannten Bedingungen).
- Entsorgen Sie den Überstand.
- Waschen Sie die Zellen mit vorgekühltem PBS.
- Resuspendieren Sie die Zellen vorsichtig in vorgekühltem 1x-Bindungspuffer durch zentrifugale Resuspension.
- Markieren Sie die Azinuszellen der Bauchspeicheldrüse mit Annexin V-FITC/PI gemäß den Anweisungen des Herstellers, nachdem Sie die Zellkonzentration eingestellt haben.
- Verwenden Sie die Durchflusszytometrie innerhalb von 1 h, um Apoptose in Pankreas-Azinuszellen nachzuweisen.
11. Western-Blot-Nachweis von Caspase-3 und HMGB-1
- Extrahieren Sie das Pankreasprotein.
- Extrahieren Sie 50 mg Pankreasgewebe und schneiden Sie es in kleine Fragmente.
- Fügen Sie 1 ml RIPA-Lysepuffer (enthält PMSF und phosphorylierten Proteaseinhibitor) hinzu.
- Homogenisieren Sie das Bauchspeicheldrüsengewebe 5 Minuten lang auf Eis mit einer elektrischen Mühle.
- Inkubieren Sie das homogenisierte Gewebe auf Eis unter leichtem Schütteln für 2 h.
- Das Homogenat wird bei 4 °C für 10 min bei 4.500 x g zentrifugiert.
- Die überstehende Lösung auffangen und bei -80 °C lagern.
- Führen Sie eine Proteinquantifizierung durch.
- Verdünnen Sie ein bestimmtes Volumen der BSA-Standardprobe (25 mg/ml) auf eine Konzentration von 0,5 mg/ml.
- Bereiten Sie eine bestimmte Menge BCA-Arbeitslösung vor, indem Sie 50 Volumen BCA-Lösung A mit 1 Volumen BCA-Lösung B mischen, um eine gründliche und gleichmäßige Mischung zu gewährleisten.
- Legen Sie die BSA-Standardprobe in die Standardprobenlöcher auf einer 96-Well-Platte in der Reihenfolge von 0, 1, 2, 4, 8, 12, 16 und 20 μl. Gleichen Sie das Volumen jedes Lochs mit destilliertem Wasser aus, was zu einem Gesamtvolumen von 20 μl führt.
- Geben Sie 2 μl Proben in die Probenlöcher und fügen Sie dann nacheinander 18 μl destilliertes Wasser zur Verdünnung hinzu (1:9).
- Füllen Sie jede Vertiefung mit 200 μl BCA-Arbeitslösung und lassen Sie sie ca. 20-30 Minuten bei 37 °C stehen.
- Messen Sie die Extinktion bei einer Wellenlänge von 562 nm. Berechnen Sie die Proteinkonzentration der Proben auf Basis der Standardkurve.
- Fügen Sie ein bestimmtes Volumen RIPA-Cracklösung und einen Verdünnungspuffer hinzu, um die Proben zu verdünnen, bis die Konzentration 5-10 μg/μl erreicht, was als angemessen erachtet wird.
- Lagern Sie die Proben nach der Proteindenaturierung (100 °C; 10 min) bei -20 °C.
- Führen Sie das Western Blotting durch.
- Bereiten Sie SDS-PAGE vor.
- Installieren Sie die Leimformen und überprüfen Sie deren Dichtleistung.
- TEMED zum 10%igen Trennkleber geben und gleichmäßig mischen.
- Injizieren Sie die Mischung in die Form, die etwa zwei Drittel des Volumens ausmacht, und vermeiden Sie dabei Blasen.
- Geben Sie Isopropanol in die Form und drücken Sie den Kleber ca. 40 min lang.
- Verwenden Sie das gleiche Programm, um den 5% konzentrierten Klebstoff zu konfigurieren.
- Gießen Sie Isopropanol aus und fügen Sie den Klebstoff sofort hinzu.
- Platzieren Sie den Kamm senkrecht, bis der Kleber vollständig polymerisiert ist.
- Führen Sie den Elektrophoresevorgang durch.
- Geben Sie die zu prüfende Probe in der erwarteten Versuchskontrollreihenfolge in umgekehrter Reihenfolge in die Probenahmelöcher des SDS-PAGE-Klebstoffs.
- Fügen Sie gleichzeitig die Proteinmarkierung hinzu, um die Position des Zielproteins und des internen Referenzproteins zu bestimmen.
- Legen Sie die Probe in den Elektrophoresetank, nachdem die Probenzugabe abgeschlossen ist.
- Führen Sie zunächst 30 Minuten lang bei 80 V laufen, gefolgt von einem Betrieb des Gels, um das Protein 60 Minuten lang bei 100 V zu trennen.
HINWEIS: Es sollte auf die Position von Bromphenolblau geachtet werden, um eine übermäßige Elektrophorese zu vermeiden.
- Führen Sie den Proteintransfer durch.
- Schneiden Sie die PVDF-Folie in der oberen rechten Ecke ab, um sie als Markierung zu verwenden.
- Legen Sie die PVDF-Folie zur Aktivierung 5-10 s in eine Methanollösung.
- Die PVDF-Folie ca. 15 min in einem Elektrophoresepuffer einweichen.
- Entfernen Sie das Gel nach der Elektrophorese vorsichtig und trimmen Sie überschüssiges Gel, wobei Sie sicherstellen, dass das Gel während des gesamten Prozesses feucht bleibt.
- Setzen Sie die Schiene in folgender Reihenfolge zusammen: Negativplatte → Schwamm → drei Schichten Filterpapier → Gel → PVDF-Folie → drei Lagen Filterpapier → Schwamm → Positivplatte.
HINWEIS: Stellen Sie sicher, dass sich keine Blasen zwischen dem Gel und der PVDF-Folie befinden. - Setzen Sie die zusammengebaute Klemme in die nasse rotierende Nut (schwarz nach schwarz) ein, um die herum Eiswürfel positioniert sind.
- Schalten Sie das Gerät ein und starten Sie die Filmübertragung bei 400 mA für 100 Minuten.
- Durchführung der PVDF-Folienversiegelung und Inkubation von primären und sekundären Antikörpern.
- Entfernen Sie die PVDF-Folie nach dem Transfer vorsichtig und spülen Sie sie 10 Minuten lang mit TBST, wobei Sie den Vorgang 3-5 Mal wiederholen.
- Versiegeln Sie die PVDF-Folie 2 h lang in 5 % Magermilch.
- Entfernen Sie die PVDF-Folie und spülen Sie sie 10 Minuten lang mit TBST, wobei Sie den Vorgang 4 Mal wiederholen.
- Die PVDF-Folie und den verdünnten Primärantikörper zusammen unter leichtem Schütteln bei 4 °C im Kühlschrank aufbewahren und über Nacht inkubieren.
- Entfernen Sie die PVDF-Folie am nächsten Tag und spülen Sie sie 10 Minuten lang mit TBST aus, wobei Sie den Vorgang 4 Mal wiederholen.
- Inkubieren Sie den PVDF-Film ca. 2 h lang in HRP-markiertem Sekundärantikörper-Verdünnungsmittel.
- Spülen Sie die PVDF-Folie 10 Minuten lang mit TBST ab und wiederholen Sie den Vorgang 4 Mal.
- Belichten Sie den Film und analysieren Sie ihn.
- Tragen Sie die vorbereitete ECL-Lösung gleichmäßig auf die Folie auf.
- Belichten Sie den Film in einem dunklen Raum mit einem Belichtungsmesser für ca. 2-3 Minuten und lagern Sie ihn dann.
- Führen Sie die Analyse mit der Software image J durch.
- Bereiten Sie SDS-PAGE vor.
Ergebnisse
Der Prozess der experimentellen Mausmodellierung ist in Abbildung 1 dargestellt. Nach 12 Stunden nach Abschluss der Injektion wurde ein Open-Field-Videorekorder verwendet, um die Bewegungsdistanz und die Immobilitätsdauer verschiedener Versuchsgruppen von Mäusen für 5 Zyklen zu überwachen (Abbildung 2A). Während der 5 Zyklen behielten die Mäuse in der PI V-Gruppe innerhalb von 3 Minuten einen niedrigen Bewegungsabstand bei, während das Immobilitätsverhältnis innerhalb von 3 Minuten mit jedem nachfolgenden Zyklus zunahm (Abbildung 2B, C). Zusätzlich wurde eine statistische Analyse der gesamten Bewegungsdistanz von Mäusen aus verschiedenen Versuchsgruppen während der 5 Zyklen durchgeführt. Die PI V-Gruppe zeigte im Vergleich zu den anderen Versuchsgruppen die geringste Gesamtbewegungsdistanz, und die Differenz war statistisch signifikant (p < 0,001) (Abbildung 2D,E). Mit Ausnahme der Kontrollgruppe und der PI I-Gruppe zeigten die Mäuse in den anderen Versuchsgruppen ein negatives Wachstum des D-Wert-Gewichts. Unter ihnen zeigte die PI V-Gruppe die größte Gewichtsveränderung, und der Unterschied in der Gewichtsveränderung im Vergleich zu den anderen Versuchsgruppen war statistisch signifikant (Abbildung 2F). Nach Auswertung der Überlebensrate von weiteren 10 Mäusen in jeder Versuchsgruppe zeigten die Ergebnisse, dass die Mortalitätsrate der Mäuse der Gruppe PI V am 5. Tag 80% erreichte. Es gab jedoch keinen statistisch signifikanten Unterschied in der Mortalitätsrate zwischen den anderen vier Versuchsgruppen und den Mäusen der Kontrollgruppe (Abbildung 2G).
Mit Hilfe eines Hochleistungsmikroskops wurden in den Mäusegruppen PI IV und PI V signifikante zelluläre Schwellungen, Nekrosen und inflammatorische Zellinfiltration beobachtet (Abbildung 3A,B). Unter Verwendung der in der ergänzenden Tabelle 2 angegebenen Bewertungskriterien wurde die Pankreaspathologie verschiedener Versuchsgruppen von Mäusen bewertet und signifikante Unterschiede im Pankreaspathologie-Score im Vergleich zu den Mäusen der Kontrollgruppe (p < 0,001) beobachtet (Abbildung 3C; Ergänzende Abbildung 1). Darüber hinaus waren die Serum-Amylase- und Lipase-Spiegel in den gemessenen Mäusen im Vergleich zur Kontrollgruppe in den Versuchsgruppen von PI II bis PI V signifikant höher, und die Unterschiede waren statistisch signifikant. Interessanterweise gab es keinen statistisch signifikanten Unterschied bei den Mäusen der PI I-Gruppe (Abbildung 3D,E). Die ELISA-Methode wurde verwendet, um die Spiegel der Entzündungsmarker14, einschließlich TNF-α und IL-6, im Serum von Mäusen zu bestimmen. Die Ergebnisse zeigten, dass die TNF-α- und IL-6-Spiegel in den Mäusen der PI V-Gruppe signifikant höher waren als in den anderen Versuchsgruppen, und die Unterschiede waren statistisch signifikant (Abbildung 3F,G). Im Vergleich zur Kontrollgruppe stiegen die PCT-Spiegel in allen vier Versuchsgruppen an, aber nur der Unterschied in der PI V-Gruppe war statistisch signifikant (p < 0,05) (Abbildung 3H).
Der apoptotische Status von Pankreasgewebe in verschiedenen Versuchsgruppen von Mäusen
Durch die Durchführung von TUNEL-Färbungen an den Pankreasgeweben jeder Gruppe von Mäusen wurde der zelluläre Nekrosestatus im Pankreasgewebe verschiedener Versuchsgruppen beobachtet (Abbildung 4A). Die Graustufenwerte (OD) pro Flächeneinheit von Pankreasgewebeschnitten und die positive Rate der zellulären Nekrose wurden mit der Software Image J semi-quantitativ analysiert. Die Ergebnisse zeigten, dass im Vergleich zu den anderen Versuchsgruppen das Ausmaß der Zellnekrose im Pankreasgewebe der PI V-Gruppe von Mäusen signifikant erhöht war, und der Unterschied war statistisch signifikant (p < 0,001) (Abbildung 4B,C). Protein-Immunblotting-Experimente wurden durchgeführt, um die Expressionsniveaus von Cysteinylaspartat-spezifischer Proteinase-3 (Caspase-3), einem zellulären Nekrosemarker, im Pankreasgewebe von Mäusen aus verschiedenen Versuchsgruppen zu bestimmen (Abbildung 4D). Die Quantifizierung der Caspase-3-Expression zeigte, dass das Expressionsniveau des Caspase-3-Proteins im Pankreasgewebe der PI V-Gruppe signifikant erhöht war, und die Differenz war statistisch signifikant (p < 0,001). Die Proteinexpressionsniveaus wurden quantifiziert und auf das interne Kontroll-GapDH normiert (Abbildung 4E). Zusätzlich wurden frische Azinuszellsuspensionen der Bauchspeicheldrüse mit Annexin V-FITC/PI markiert und mittels Durchflusszytometrie analysiert. Es zeigte sich, dass die PI V-Gruppe im Vergleich zu den anderen Versuchsgruppen von Mäusen eine signifikant höhere positive Zelltodrate aufwies, was statistisch signifikant war (p < 0,001) (Abbildung 4F,G).
Der Gehalt an HMGB-1 im peripheren Serum und das Expressionsniveau von HMGB-1 im Pankreasgewebe
Um den Zusammenhang zwischen dem HMGB-1-Protein und der Pankreasschädigung zu untersuchen, wurden immunhistochemische Färbungen und Quantifizierungen an den Pankreasgeweben von Mäusen in jeder Versuchsgruppe durchgeführt. Es zeigte sich ein statistisch signifikanter Unterschied zwischen der Versuchs- und der Kontrollgruppe (p < 0,001) (Abbildung 5A,B). ELISA wurde verwendet, um die Spiegel von HMGB-1 im Serum von Mäusen aus verschiedenen Versuchsgruppen zu messen. Die Ergebnisse zeigten, dass die Serumspiegel von HMGB-1 im Vergleich zur Kontrollgruppe in allen Versuchsgruppen signifikant höher waren, wobei der höchste Spiegel in der PI V-Gruppe beobachtet wurde, und der Unterschied statistisch signifikant war (p < 0,001) (Abbildung 5C). Darüber hinaus wurde bei der Western-Blot-Analyse in allen Versuchsgruppen eine erhöhte Expression des HMGB-1-Proteins im Pankreasgewebe von Mäusen nachgewiesen, mit statistisch signifikanten Unterschieden zur Kontrollgruppe (p < 0,001) (Abbildung 5D,E).

Abbildung 1: Experimentelles Flussdiagramm. Tag 2 und Tag 3: Intraperitoneale Injektion. Tag 4: Das Freilandexperiment wurde nach 12 h nach der letzten intraperitonealen Injektion begonnen. Tag 5: Euthanasiert 36 h nach der intraperitonealen Injektion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Makroskopische Veränderungen im PI-Mäusemodell. (A) Das Echtzeit-Bewegungstrajektoriendiagramm von Mäusen ist dargestellt. (B) Die Gesamtstrecke der Bewegung innerhalb jedes Überwachungszeitraums für verschiedene Versuchsgruppen von Mäusen. (C) Der Prozentsatz der Immobilitätszeit innerhalb jedes Überwachungszeitraums für verschiedene Versuchsgruppen von Mäusen. (D,E) Die Gesamtbewegungsdistanz und der prozentuale Prozentsatz der Immobilitätszeit während 15 Minuten wurden für Mäuse in verschiedenen Versuchsgruppen analysiert. (F) Der D-Wert, der das Gewicht von Mäusen vor und nach dem Modellierungsprozess darstellt, wird angezeigt. (G) Das Überleben von 10 Mäusen in jeder Gruppe wurde für die 7 Tage nach der intraperitonealen Injektion beobachtet. Die Daten werden als Mittelwerte ± SEM ausgedrückt, n = 4. "ns" bedeutet nicht signifikant, *P < 0,05, ****P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
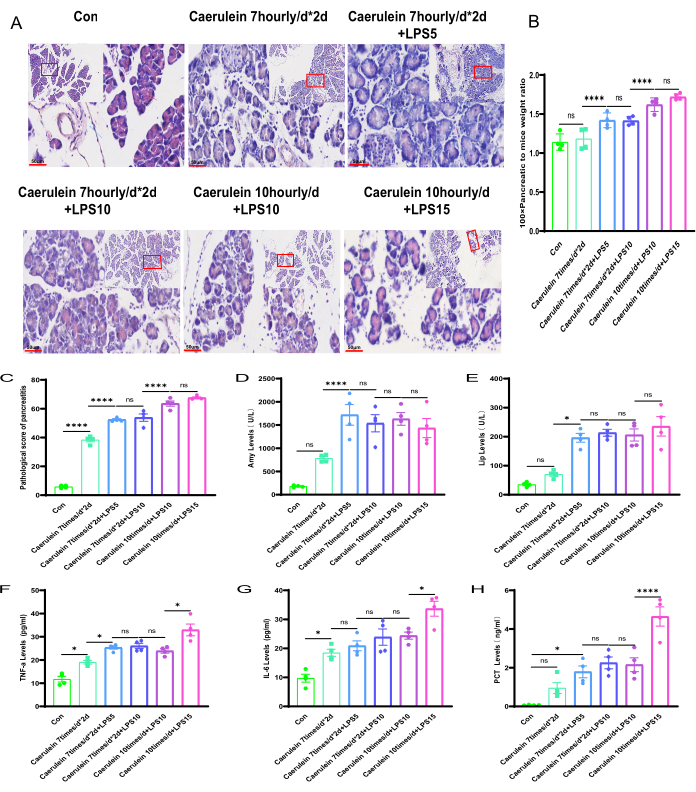
Abbildung 3: Pathologische Veränderungen bei der Pankreatitis bei Mäusen in verschiedenen Versuchsgruppen. (A) Die H&E-gefärbten histologischen Schnitte des Pankreasgewebes von Mäusen in verschiedenen Versuchsgruppen (Paraffin-eingebettete Pankreasgewebeschnitte, gefärbt mit Hämatoxylin und Eosin, Vergrößerungen von 100-fach und Skalenbalken von 200 μm bzw. 400-fach und Skalenbalken von 50 μm). Gelbe lange Pfeile zeigen Inselchen an; rote lange Pfeile zeigen Azinuszellen an; braune lange Pfeile zeigen Blutgefäße an; Blaue lange Pfeile zeigen Rohre an). (B) Berechnung des Verhältnisses des Pankreasgewichts zum Körpergewicht bei Mäusen. (C) Pathologisches Scoring der Bauchspeicheldrüse von Mäusen. (D,E) Nachweis von Serum-Amylase- und Lipase-Spiegeln bei Mäusen. (F-G) ELISA-Messung der TNF-α- und IL-6-Serumspiegel bei Mäusen. H) Bewertung des PCT-Niveaus. Die Daten werden als Mittelwerte ± SEM ausgedrückt, n = 4. "ns" bedeutet nicht signifikant, *P < 0,05, ****P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Apoptose des Pankreasgewebes bei Mäusen. (A) Repräsentative Bilder der TUNEL-Färbung wurden aus Pankreasparaffinschnitten von Mäusen und Bildern mit vergrößerter Fläche erhalten. (400x, Maßstabsbalken 50 μm, bräunlich-gelb ist positive Zelle). (B,C) Quantitative Analyse des Grauwerts pro Flächeneinheit von TUNEL-gefärbten Schnitten von Pankreasgewebe von Mäusen und des Prozentsatzes positiv gefärbter toter Zellen. (D) Das Expressionsniveau von Caspase-3 im Pankreasgewebe wurde mittels Western Blot nachgewiesen. (E) Quantifizierung der Caspase-3-Expression im Pankreasgewebe. (F) Die Durchflusszytometrie wurde eingesetzt, um das Ausmaß des Zelltods in Pankreas-Azinuszellen von Mäusen zu bewerten. (G) Zählung von toten Zellen im späten Stadium in Pankreas-Azinuszellen der Maus. Die Daten werden als Mittelwerte ± SEM ausgedrückt, n = 4. "ns" bedeutet nicht signifikant, *P < 0,05, ****P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Die HMGB-1-Expression im Pankreasgewebe von Mäusen. (A) Repräsentative Bilder und vergrößerte Bilder (x400, Maßstabsbalken 50 μm) der immunhistochemischen Färbung von HMGB-1 in Pankreasschnitten. Die bräunlich-gelbe Farbe zeigt positive Zellen an (n = 4). (B) Der Prozentsatz der HMGB-1-positiven Zellen in Pankreasgewebeschnitten (n = 24). (C) Der Gehalt an HMGB-1 im Mausserum (n = 4). (D,E) Ein Western Blot wurde durchgeführt, um das Expressionsniveau von HMGB-1 im Pankreasgewebe zu bestimmen und die Quantifizierungsergebnisse (n = 4) zu erhalten. Die Daten werden als Mittelwerte ± SEM ausgedrückt, "ns" bedeutet nicht signifikant, *P < 0,05, ****P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Multiorganschädigung im Modell der PI V-Gruppe. (A) Repräsentative Bilder von histologischen Veränderungen im Pankreas-, Lungen-, Leber- und Nierengewebe, die von Mäusen der CON- und PI V-Gruppe gesammelt wurden, wurden mittels H&E-Färbung (200-fache Vergrößerung, Maßstabsbalken 50 μm) analysiert. Pathologische Veränderungen, die mit einer Azinuszellnekrose verbunden sind, sind durch schwarze Pfeile gekennzeichnet. Gelbe Pfeile zeigen pathologische Veränderungen an, die durch interstitielle Blutungen und Ödeme in den Lungenbläschen gekennzeichnet sind. Hepatozytenödeme und -nekrosen sind durch grüne Pfeile gekennzeichnet. Glomeruläre blutungsbedingte pathologische Veränderungen sind durch rote Pfeile gekennzeichnet. (B) Die Berechnung der histologischen Scores wurde an Pankreas-, Lungen-, Leber- und Nierengewebe durchgeführt, die von Mäusen der CON-Gruppe und der PI V-Gruppe gewonnen wurden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 1: Intraperitoneales Injektionsprotokoll. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 2: Pathologische Scoring-Kriterien für den Schweregrad der Pankreatitis. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Derzeit fehlt es an wirksamen Mitteln, um die hohe Sterblichkeitsrate bei Patienten mit schwerer akuter Pankreatitis zu verbessern. Es ist von entscheidender Bedeutung, die Wirksamkeit von Medikamenten bei der Verbesserung der Immunstabilitätsmechanismen zu untersuchen. Es besteht ein dringender Bedarf an einem idealen Tiermodell für eine schwere akute Pankreatitis. Mäuse mit einem genetischen Hintergrund von C57BL/6J werden häufig in der biomedizinischen Forschung eingesetzt, einschließlich Studien zur SAP-Pathophysiologie. Über 70 Jahre genetischer Differenzierung in B6J-Mäusen haben zur spontanen Deletion mehrerer Exons geführt15, was zu einer verminderten Empfindlichkeit gegenüber Caerulein-induzierten Pankreasschäden führte16. Darüber hinaus weisen bestehende Tiermodelle der akuten Pankreatitis Einschränkungen auf, wie z. B. chirurgische Traumata oder die Anwendbarkeit nur auf größere Tiere, was wissenschaftliche Untersuchungen mit diesen Modellen erschwert. Daher ist es sehr wertvoll, ein stabiles, effizientes und geeignetes Tiermodell mit diesem spezifischen Genstamm zu etablieren.
Caerulein ist ein Analogon von Cholecystokinin, das eine Schädigung des Pankreasgewebes induziert, indem es eine relative Obstruktion der Verdauungsflüssigkeit der Bauchspeicheldrüse und der Enzymsekretion durch hochfrequente Injektionen innerhalb eines kurzen Zeitraums verursacht, wenn Mäuse nüchtern waren und ausreichende Mengen an Verdauungsflüssigkeit gespeichert haben17. LPS ist der Hauptbestandteil in bakteriellen Zellwänden und kann bei Mäusen MODS und SIRS verursachen18. Eine frühere Studie zeigte, dass die Kombination von Caerulein-Injektionen in unterschiedlichen Häufigkeiten mit unterschiedlichen Dosen von LPS, die über intraperitoneale Injektion verabreicht wurden, ähnliche pathologische Veränderungen hervorrief, die bei humanem SAP beobachtet wurden19,20. In dieser Studie wurde ein nicht-invasiver Ansatz verwendet, um unterschiedliche Grade von Pankreasschäden zu induzieren, indem unterschiedliche Häufigkeiten von Caerulein-Injektionen mit unterschiedlichen Dosen von LPS kombiniert wurden, die intraperitoneal an Mäuse verabreicht wurden. Die Sicherstellung einer gleichmäßigen Resorption durch das Peritoneum war bei der Entwicklung des Protokolls von entscheidender Bedeutung. Um diese Anforderung zu erfüllen, ist es entscheidend, die Schritte der intraperitonealen Injektion strikt einzuhalten, um eine genaue Kontrolle über jede Arzneimittelverabreichung zu gewährleisten. Darüber hinaus ist für eine gleichmäßige Verteilung der Medikation in der Bauchhöhle durch sanftes Reiben und entsprechender Druck mit einem sterilen Wattestäbchen nach jeder Medikamenteninjektion mit einem sterilen Wattestäbchen unerlässlich. Darüber hinaus ist eine genaue und präzise Platzierung des Stecknadelkopfes in der Bauchhöhle von größter Bedeutung, wobei die Nadel in den zentralen Bereich des Oberbauchs zeigt. Es sollte eine vorherige Schulung durchgeführt werden, damit der Bediener beim Einführen der Nadel in die Bauchhöhle das Fehlen eines Widerstands genau wahrnehmen kann. Die Verwendung einer mikroquantitativen Infusionspumpe anstelle des manuellen Betriebs könnte möglicherweise die Qualität der Arzneimittelinjektion verbessern. Leider wurde dies in dieser Studie nicht umgesetzt. Nichtsdestotrotz induzierten wir durch die Anwendung unterschiedlicher Injektionsschemata unterschiedliche Grade der Pankreasschädigung und beobachteten effektiv Unterschiede in der Pankreasschädigung, die durch unterschiedliche Häufigkeiten und Dosen unter identischen technischen Bedingungen verursacht wurden, die durch Caerulein in Kombination mit LPS-Injektionen induziert wurden. Dies liefert wertvolle Erkenntnisse für den zukünftigen Einsatz von Caerulein in nicht-invasiven Tiermodellen zur Induktion schwerer akuter Pankreatitis.
Die Kombination von Caerulein und LPS führte zu signifikant erhöhten Amylase- und Lipasespiegeln im Serum, erhöhtem Pankreasgewicht und histologischen Veränderungen, einschließlich umfangreicher Infiltration von Entzündungszellen, Pankreas-Azinuszellödemen, Nekrose und Blutung, wie durch Hämatoxylin- und Eosin (HE)-Färbung gezeigt wurde. Darüber hinaus wurden mit zunehmender LPS-Dosis die pathologischen Veränderungen in der Bauchspeicheldrüse ausgeprägter. Bemerkenswert ist jedoch, dass es keine erkennbaren Unterschiede in den Werten der Pankreaspathologie zwischen der PI IV- und der PI V-Gruppe gab, während das Ausmaß der Nekrose der Pankreasgewebezellen in der PI III-Gruppe im Vergleich zur PI IV-Gruppe ausgeprägter war. Diese Beobachtung deutet darauf hin, dass die Dosierungshäufigkeit von Caerulein als primärer Faktor für die Pankreasschädigung dienen kann, während LPS deren Fortschreiten verschlimmert und zu systemischen Entzündungsschäden führt18,21. HMGB-1 ist ein Protein, das abhängig von seiner Position22 funktioniert. Extrazelluläres HMGB-1 fungiert als Protein, das an den Warnsignalen von Entzündungen beteiligt ist und eng mit dem Schweregrad der akuten Pankreatitis verbundenist 23,24,25. In dieser Studie waren die Serum-HMGB-1-Spiegel bei Mäusen aus allen Versuchsgruppen im Vergleich zur Kontrollgruppe signifikant höher, wobei die PI V-Gruppe den signifikantesten Anstieg zeigte. Immunhistochemische und Proteinelektrophorese-Experimente bestätigten ebenfalls die hohe Expression von HMGB-1 im Pankreasgewebe. Dieses wichtige Protein kann als therapeutisches Ziel zur Hemmung des Entzündungssturms bei schwerer akuter Pankreatitis dienen.
Zusammenfassend lässt sich sagen, dass es von entscheidender Bedeutung ist, ein nicht-invasives, einfaches und leicht durchzuführendes SAP-Modell bei Mäusen zu entwickeln. In diesem Versuchsprotokoll ist die Induktion einer Pankreasschädigung mit Caerulein in Kombination mit LPS zuverlässig und effektiv. Durch die intraperitoneale Verabreichung von Caerulein an zehn aufeinanderfolgenden Tagen in einer Dosis von 50 μg/kg, gefolgt von einer einmaligen intraperitonealen Injektion von 15 mg/kg LPS, kann ein stabiles, zuverlässiges, kostengünstiges und effizientes Tiermodell von SAP etabliert werden.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Studie wurde unterstützt von Research Projects in Health and Medical Science in der Stadt Huainan (Nr. HNWJ2023005); Kommunales Leitprogramm für Wissenschafts- und Technologiepläne in der Stadt Huainan (Nr. 2023151); Schulungsprogramm für Studenten des Anhui Provincial College für Innovation und Unternehmertum (Nr. S202310361254); Die neunte Charge der "50· Stars of Science and Technology" in der Stadt Huainan und dem Key Clinical Specialty Construction Project der Provinz Anhui. Wir möchten uns bei der Laborabteilung des ersten angeschlossenen Krankenhauses der Anhui University of Science and Technology für die Bereitstellung der relevanten Testdaten bedanken.
Materialien
| Name | Company | Catalog Number | Comments |
| 20× Citric Acid Antigen Repair Solution (pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1202-250 ml | |
| Amylase | Mindray,China | ||
| Annexin V-FITC/PI | Wuhan servicebio Technology Co.,Ltd, China | G1511 | diluted at 1:20 |
| Anti-HMGB1 Rabbit pAB | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1800 |
| BCA protein quantitative detection kit | Wuhan servicebio Technology Co.,Ltd, China | G2026-200T | |
| BD FACSCanto II Flow Cytometer | BD Life Sciences, San Jose, CA, 95131, USA | BD FACSCanto II | |
| BSA | Wuhan servicebio Technology Co.,Ltd, China | GC305010-100g | |
| C57BL/6J | Cavion Experimental Animal Co., Changzhou, China | license number SCXY (Su) 2011–0003 | |
| Ceruletide | MCE, New Jersey, USA | 17650-98-5 | 50 µg/kg |
| Chemiluminescence imager | Cytiva CO.,LTD.;USA | ||
| Citric acid antigen repair Solution (Dry powder pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1201-5 L | |
| Collagenase IV | Wuhan servicebio Technology Co.,Ltd, China | GC305014 | 0.5 mg/mL |
| DAB (SA-HRP) Tunel Cell Apoptosis Detection Kit | Wuhan servicebio Technology Co.,Ltd, China | G1507-100 T | |
| Dimension EXL with LM Integrated Chemistry System | Siemens Healthcare Diagnostics Inc.Brookfield,USA | YZB/USA 8311-2014 | |
| ECL developer | Wuhan servicebio Technology Co.,Ltd, China | ||
| Eosin dye (alcohol soluble) | Wuhan servicebio Technology Co.,Ltd, China | G1001-100 ml | |
| EthoVision XT | Noldus, Netherlands | ||
| FITC-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB22303 | diluted at 1:50 |
| Fully automatic blood cell analyzer | Zybio Inc. China | Zybio-Z3 CRP | |
| GapDH | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1500 |
| Hematoxylin blue return solution | Wuhan servicebio Technology Co.,Ltd, China | G1040-500 ml | |
| Hematoxylin differentiation solution | Wuhan servicebio Technology Co.,Ltd, China | G1039-500 ml | |
| Hematoxylin dye | Wuhan servicebio Technology Co.,Ltd, China | G1004-100 ml | |
| HMGB-1 ELISA kits | njjcbio Co., Ltd, China | ||
| HOMOGENIZER | Wuhan servicebio Technology Co.,Ltd, China | KZ-III-F;IC111150 100222 | |
| HRP-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB23303 | diluted at 1:1500 |
| IL-6 ELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0001 | |
| Lipase | Mindray,China | ||
| Lipopolysaccharide | Wuhan servicebio Technology Co.,Ltd, China | GC205009 | 15 mg/kg |
| Low temperature high speed centrifuge | Changsha Pingfan Apparatus&Instrument Co.,Ltd.,China | TGL-20M | |
| Membrane breaking liquid | Wuhan servicebio Technology Co.,Ltd, China | G1204 | |
| microtome | Jinhua Craftek Instrument Co., Ltd.;China | CR-601ST | |
| Nylon mesh | Wuhan servicebio Technology Co.,Ltd, China | 200-mesh | |
| One-step TUNEL cell apoptosis detection kit (DAB staining method) | Wuhan servicebio Technology Co.,Ltd, China | G1507-100T | |
| Paraffin tissue embedding machine | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PBM-A | |
| Pathological tissue drying apparatus | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PHY-III | |
| Phosphate-buffered saline | Wuhan servicebio Technology Co.,Ltd, China | G4202-100ML | |
| PMSF | Wuhan servicebio Technology Co.,Ltd, China | G2008-1 ml | |
| Positive fluorescence microscope | Olympus Corporation,Tokyo, Japan | BX53 | |
| Pro Calcitonin | Mindray,China | ||
| PVDF membrane | Millipore, USA | 0.22 µm | |
| RIPA | Wuhan servicebio Technology Co.,Ltd, China | G2002-100 ml | |
| SDS-PAGE | Beyotime Biotechnology,China | P0012A | |
| TNF-αELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0004 | |
| Ultrasonic water bath | DONGGUAN KQAO ULTRASONIC EQUIPMENT CO.,LTD.;China | KQ-200KDE | |
| Western Blot | Bio-Rad Laboratories, Inc.,USA | ||
| Western blot imaging System | Global Life Sciences IP Holdco LLC, JAPAN | Amersham ImageQuant 800 | |
| Whirlpool mixer | SCILOGEX;USA |
Referenzen
- Gliem, N., Ammer-Herrmenau, C., Ellenrieder, V., Neesse, A. Management of severe acute pancreatitis: An update. Digestion. 102 (4), 503-507 (2021).
- Duan, F., et al. GDF11 ameliorates severe acute pancreatitis through modulating macrophage M1 and M2 polarization by targeting the TGFbetaR1/SMAD-2 pathway. Int Immunopharmacol. 108, 108777 (2022).
- Zhang, X. P., et al. Preparation method of an ideal model of multiple organ injury of rat with severe acute pancreatitis. World J Gastroenterol. 13 (34), 4566-4573 (2007).
- Bluth, M. H., Patel, S. A., Dieckgraefe, B. K., Okamoto, H., Zenilman, M. E. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 12 (28), 4511-4516 (2006).
- Qiu, F., Lu, X. S., Huang, Y. K. Effect of low molecular weight heparin on pancreatic micro-circulation in severe acute pancreatitis in a rodent model. Chin Med J (Engl). 120 (24), 2260-2263 (2007).
- Lombardi, B., Estes, L. W., Longnecker, D. S. Acute hemorrhagic pancreatitis (massive necrosis) with fat necrosis induced in mice by DL-ethionine fed with a choline-deficient diet. Am J Pathol. 79 (3), 465-480 (1975).
- Liu, Y., et al. Deletion of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-kappaB activity. Cell Death Dis. 8 (3), e2685 (2017).
- Niederau, C., Ferrell, L. D., Grendell, J. H. Caerulein-induced acute necrotizing pancreatitis in mice: Protective effects of proglumide, benzotript, and secretin. Gastroenterology. 88, 1192-1204 (1985).
- Zhou, X., et al. DPP4 inhibitor attenuates severe acute pancreatitis-associated intestinal inflammation via Nrf2 signaling. Oxid Med Cell Longev. 2019, 6181754 (2019).
- Yang, J., et al. Heparin protects severe acute pancreatitis by inhibiting HMGB-1 active secretion from macrophages. Polymers (Basel). 14 (12), 2470 (2022).
- Kong, L., et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury. Cell Death Dis. 12 (10), 928 (2021).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Schmidt, J., et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 215 (1), 44-56 (1992).
- Luo, C., et al. Abdominal paracentesis drainage attenuates severe acute pancreatitis by enhancing cell apoptosis via PI3K/AKT signaling pathway. Apoptosis. 25 (3-4), 290-303 (2020).
- Fontaine, D. A., Davis, D. B. Attention to background strain is essential for metabolic research: C57BL/6 and the international knockout mouse consortium. Diabetes. 65 (1), 25-33 (2016).
- Wan, J., et al. Pancreas-specific CHRM3 activation causes pancreatitis in mice. JCI Insight. 6 (17), e132585 (2021).
- Sah, R. P., et al. Cerulein-induced chronic pancreatitis does not require intra-acinar activation of trypsinogen in mice. Gastroenterology. 144 (5), 1076-1085 (2013).
- Wang, K., et al. Activation of AMPK ameliorates acute severe pancreatitis by suppressing pancreatic acinar cell necroptosis in obese mice models. Cell Death Discov. 9 (1), 363 (2023).
- Jin, C., Li, J. C. Establishment of a severe acute pancreatitis model in mice induced by combined Rain Frog Peptide and lipopolysaccharide and exploration of its mechanism. Acta Exp Bio Sinica. 36 (2), 91-96 (2003).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Roy, R. V., et al. Pancreatic Ubap2 deletion regulates glucose tolerance, inflammation, and protection from Caerulein-induced pancreatitis. Cancer Lett. 578, 216455 (2023).
- Chen, R., Kang, R., Tang, D. The mechanism of HMGB1 secretion and release. Exp Mol Med. 54 (2), 91-102 (2022).
- Murao, A., Aziz, M., Wang, H., Brenner, M., Wang, P. Release mechanisms of major DAMPs. Apoptosis. 26 (3-4), 152-162 (2021).
- Liu, T., et al. Accuracy of circulating histones in predicting persistent organ failure and mortality in patients with acute pancreatitis. Br J Surg. 104 (9), 1215-1225 (2017).
- Li, N., Wang, B. M., Cai, S., Liu, P. L. The role of serum high mobility Group Box 1 and Interleukin-6 levels in acute pancreatitis: A meta-analysis. J Cell Biochem. 119 (1), 616-624 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten