Method Article
تحضير نموذج الفئران لالتهاب البنكرياس الحاد الوخيم عن طريق مزيج من حقن القيرولين وعديس السكاريد الشحمي داخل الصفاق
* These authors contributed equally
In This Article
Summary
إدارة الدواء داخل الصفاق هو نهج غير جراحي آمن وفعال للحث على إصابة البنكرياس. قارنت هذه الدراسة خمسة بروتوكولات متميزة للحقن داخل الصفاق على الفئران للحث على درجات متفاوتة من إصابة البنكرياس وأنشأت نموذجا لإصابة البنكرياس الشديدة للتحقيق في التغيرات المرضية واستراتيجيات العلاج لالتهاب البنكرياس الحاد الوخيم (SAP).
Abstract
يشكل علاج التهاب البنكرياس الحاد الوخيم (SAP) ، مع ارتفاع معدلات الوفيات ، تحديا سريريا كبيرا. يمكن أن يساعد التحقيق في التغيرات المرضية المرتبطة ب SAP باستخدام النماذج الحيوانية في تحديد الأهداف العلاجية المحتملة واستكشاف طرق العلاج الجديدة. الدراسات السابقة تسببت في المقام الأول في إصابة البنكرياس من خلال حقن القناة الصفراوية إلى الوراء من taviaurocholate الصوديوم ، ولكن تأثير الضرر الجراحي على جودة النموذج الحيواني لا يزال غير واضح. في هذه الدراسة ، استخدمنا ترددات مختلفة من حقن Caerulein داخل الصفاق جنبا إلى جنب مع جرعات مختلفة من LPS للحث على إصابة البنكرياس في الفئران C57BL / 6J وقارنا مدى الإصابة عبر خمسة بروتوكولات حقن داخل الصفاق. فيما يتعلق بإحداث التهاب البنكرياس الحاد في الفئران ، يقترح بروتوكول الحقن داخل الصفاق الذي يؤدي إلى معدل وفيات يصل إلى 80٪ في غضون 5 أيام. على وجه التحديد ، تلقت الفئران عشر حقن يومية داخل الصفاق من Caerulein (50 ميكروغرام / كجم) ، تليها حقنة LPS (15 مجم / كجم) بعد ساعة واحدة من آخر إعطاء Caerulein. من خلال ضبط وتيرة وجرعة الأدوية المحقونة ، يمكن للمرء أن يتلاعب بشدة إصابة البنكرياس بشكل فعال. يظهر هذا النموذج قدرة تحكم قوية وله دورة نسخ متماثل قصيرة ، مما يجعله ممكنا لإكماله من قبل باحث واحد دون الحاجة إلى معدات باهظة الثمن. إنه يحاكي بشكل ملائم ودقيق خصائص المرض الرئيسية التي لوحظت في SAP البشري مع إظهار درجة عالية من التكاثر.
Introduction
يتميز التهاب البنكرياس الحاد الوخيم ببداية سريعة وتطور سريع ومعدلات وفيات عالية في مجال أمراض الجهاز الهضمي1. لطالما كان معدل الوفيات المرتفع محورا بارزا للبحوث السريرية. نظرا للتغيرات غير المتوقعة في الظروف السريرية ، وعدم تجانس مظاهر المرض ، ومحدودية توافر العينات البشرية ، أصبح إنشاء نماذج حيوانية أمرا بالغ الأهمية بشكل متزايد لأبحاث الأمراض.
يشيع استخدام الحقن الرجعي لتوروكولات الصوديوم في القناة الصفراوية المشتركة لإنشاء نموذج فئران من SAP2. من خلال محاكاة انسداد البنكرياس الصفراوي وإحداث ارتجاع الصفراء والسائل البنكرياسي ، تظهر تقنية النمذجة هذه معدل نجاح مرتفع في تكرار نماذج SAP الحيوانية. ومع ذلك ، تجدر الإشارة إلى أن الجراحة الغازية لها تأثير على النموذج الحيواني نفسه. علاوة على ذلك ، تقتصر هذه الطريقة على الكبيرة ، مثل الجرذان ، والتي تستخدم في المقام الأول كمواضيع تجريبية. كثيرا ما تستخدم التقنيات البديلة ، بما في ذلك التنبيب الاثني عشر3 ، وثقب الاثني عشر المباشر4 ، والبزل المباشر للقناة الصفراويةوالبنكرياس 5 ، لأغراض النمذجة.
يوفر الحقن داخل الصفاق وطرق النمذجة الغذائية مزايا غير جراحية يمكن تطبيقها على من أي حجم. نموذج الفأر من SAP الناجم عن تغذية نقص الكولين الإيثيونين (CDE)6 يقدم بعض المضاعفات, مثل ارتفاع السكر في الدم لا يمكن السيطرة عليه ونقص كلس الدم, مما يجعلها غير مناسبة لتقييم الأساليب التشخيصية والعلاجية الجديدة. من ناحية أخرى ، يمثل الحقن داخل الصفاق من Caerulein جنبا إلى جنب مع L-arginine7 الطريقة الأكثر استخداما لإحداث التهاب البنكرياس الحاد في الفئران. على وجه التحديد ، يوفر الإعطاء المتكرر داخل الصفاق ل Caerulein - وهو نظير cholecystokinin - نهجا مناسبا للغاية للتحقيق في الجوانب المختلفة المتعلقة بهذا المرض المدمر ، بما في ذلك عمليات التسبب في المرض والالتهاب والتجديد. نظرا لتشابهه الهيكلي مع كوليسيستوكينين (CCK) ، يحفز Caerulein بشكل فعال تقلص المرارة وإفراز إنزيم البنكرياس ، مما يؤدي إلى خلل في إفراز الإنزيم يليه تدمير ذاتي لاحق8. عديد السكاريد الشحمي (LPS) ، الذي يتم نشره في كل مكان ودراسته على نطاق واسع كجزيء نمط جزيئي مرتبط بمسببات الأمراض ، يمكن دمجه مع Caerulein عن طريق الحقن داخل الصفاق لإنشاء نموذج فئران فعال ل SAP. يؤدي هذا المزيج بسرعة إلى إطلاق عدد كبير من السيتوكينات الالتهابية وإطلاقه ، مما يؤدي إلى التهاب موضعي وجهازي مفرط. أبلغت العديد من الدراسات عن تحريض نماذج SAP في الفئران من خلال الحقن داخل الصفاق من Caerulein جنبا إلى جنب مع LPS. قد يعزى ذلك إلى حقيقة أن الحقن داخل الصفاق من Caerulein يمكن أن يسبب وذمة البنكرياس ونزيف في الفئران ، في حين أن إضافة LPS يمكن أن تحفز على الفور نخر البنكرياس وتفاقم الاستجابة الالتهابية الجهازية والإنتان وحتى فشل الأعضاء. حاليا ، هناك اختلاف في جرعة وتواتر حقن Caerulein داخل الصفاق وكذلك عدم الاتساق في جرعة LPS الإضافية. يمثل تحقيق الاتساق في نماذج SAP للماوس تحديا9،10،11،12 ؛ لذلك ، من الضروري إنشاء بروتوكول موحد للحصول على نموذج مثالي. في هذه المقالة ، وصفنا بروتوكولا للحقن داخل الصفاق في الفئران والتحقيق في تردد الحقن الأمثل والجرعة الإضافية من LPS.
Protocol
تمت مراجعة هذا البروتوكول والموافقة عليه من قبل لجنة الأخلاقيات في أول مستشفى تابع لجامعة آنهوي للعلوم والتكنولوجيا (هواينان ، الصين) (رمز الأخلاقيات: 2023-KY-905-001). اتبعت الدراسة إرشادات المعاهد الوطنية للصحة لرعاية واستخدام القوارض البحثية في جميع الإجراءات الحيوانية. تم استخدام الفئران البالغة C57BL / 6J التي تزن 20-30 جم في هذه الدراسة. تم إيواء الفئران في مختبر للحيوانات لمدة أسبوع واحد في ظل ظروف خاضعة للرقابة (حوالي 21 درجة مئوية مع دورة 12 ساعة بالتناوب ليلا ونهارا). كان لدى الفئران إمكانية الوصول إلى الطعام والماء طوال الوقت. يتم سرد تفاصيل الكواشف والمعدات المستخدمة في الدراسة في جدول المواد.
1. إعداد
- قم بتعيين 84 فأرا سليما C57BL / 6J إلى ست مجموعات ، بما في ذلك المجموعة الضابطة ، إصابة البنكرياس (PI) I ، PI II ، PI III ، PI IV ، و PI V.
- قبل البدء في إجراء النمذجة ، قم بتسمية كل مجموعة من الفئران بشقوق الأذن واسمح لها بالصيام لمدة 12 ساعة.
2. إعداد مخفف المخدرات المستحثة
- يذوب القيرولين (1 ملغ) في 1 مل من برنامج تلفزيوني ويوضع في الثلاجة عند -20 درجة مئوية.
- قياس وتسجيل وزن الفئران التجريبية 1 ساعة قبل الحقن داخل الصفاق للدواء.
- استخرج الكتلة الكلية من Caerulein المطلوبة بنسبة 50 ميكروغرام / كجم ، بناء على الوزن الإجمالي لجميع الفئران.
- تمييع المخدرات Caerulein التي تم الحصول عليها مع برنامج تلفزيوني مرة أخرى.
ملاحظة: يجب أن يكون الحجم الكلي لتخفيف PBS معادلا ل 5 أضعاف قيمة الوزن الإجمالية لجميع الفئران. تم استخدام نفس طريقة التخفيف للحصول على مخفف LPS.
3. الحقن داخل الصفاق
ملاحظة: تم إعطاء الحقن داخل الصفاق لكل مجموعة من الفئران وفقا للبروتوكول المبين في الجدول التكميلي 1 للحث على النموذج. تم تجميع 10 فئران إضافية ومعالجتها مع مراعاة معدلات البقاء على قيد الحياة لمدة 7 أيام.
- أمسك الفئران وامسكها بطريقة تجعل بطن الفئران متجها لأعلى ويتم وضع الرأس أسفل الذيل لمنع تلف الأعضاء عند إدخال المحقنة.
- تطهير بطن الفئران باستخدام كرات قطنية كحولية بنسبة 75٪.
- امسك المحقنة في اليد اليمنى (باستخدام إبرة قياس ≤0.5 / ≥0.3) وأدخل الإبرة في الجلد تحت الجلد على الجانب الأيسر من الخط الأبيض البطني.
ملاحظة: التغيير إلى الجانب الأيمن للحقن التالي. - بمجرد وصول الإبرة إلى الطبقة تحت الجلد ، حركها للأمام حوالي 3-5 مم ، ثم أدخل إبرة المحقنة في تجويف البطن بزاوية 45 درجة. في هذه المرحلة ، ينبغي للمرء أن يشعر ببعض المقاومة.
- حافظ على ثبات الإبرة وحقن المادة ببطء.
ملاحظة: لا تتجاوز 5 أضعاف قيمة وزن الفئران كحجم حقنة واحدة داخل الصفاق. - بعد الحقن ، اسحب الإبرة وقم بالتدليك برفق واضغط على موقع الحقن بقطعة قطن معقمة لنشر الدواء بالكامل في تجويف البطن للفئران.
- استخدم حقنة جديدة لتكرارها مع الفئران التجريبية التالية.
4. اختبار القدرة السلوكية في المجال المفتوح
ملاحظة: بعد 12 ساعة من الحقن الأخير داخل الصفاق ، تم إجراء اختبار القدرة السلوكية في المجال المفتوح لتقييم مسافة النشاط الإجمالية ووقت الجمود للفئران.
- ضع أربعة مربعات بيضاء متطابقة أسفل الكاميرا مباشرة.
- قم بتوصيل الكاميرا بالكمبيوتر باستخدام كبل فيديو.
- تأكد من أن الصندوق التجريبي نظيف وخالي من أي روائح قبل بدء التجربة.
- ضع في منتصف الشبكة ، مواجها بعيدا عن المجرب ، واتركه يتكيف مع البيئة لمدة 10 دقائق.
- ابدأ تشغيل برنامج تتبع الفيديو وانقر على قائمة "ملف " لإنشاء تجربة جديدة.
- قم بإعداد المراقبة لأربعة مجالات عرض متزامنة.
- حدد طول وعرض الكائن التجريبي الذي يمكن أن يتحرك داخل الصندوق في شاشة المراقبة في الوقت الفعلي (30 سم × 30 سم).
- بمجرد اكتمال الإعداد ، ابدأ المراقبة بالفيديو والتسجيل.
- سجل نشاط الفئران لمدة 15 دقيقة.
- بعد الاختبار ، أخرج من الشبكة وأعده إلى قفصه. قم بتنظيف الشبكة جيدا باستخدام معقم يحتوي على ثاني أكسيد الكلور.
5. جمع واختبار الدم المحيطي للفئران
- القتل الرحيم للفئران (باتباع البروتوكول المعتمد مؤسسيا).
- أداء القتل الرحيم على الفئران التجريبية 36 ساعة بعد الحقن داخل الصفاق. قياس وتسجيل وزن الجسم للفئران قبل القتل الرحيم.
ملاحظة: يتم تطبيق 0.18 مل من 10٪ كلورال هيدرات داخل الصفاق، مع ضمان عدم وجود رد فعل لتحفيز إصبع القدم أو الذيل. - باليد اليسرى ، قم بتأمين الفئران ، وباليد اليمنى ، أمسك المقص لتقليم الشعيرات على جانب واحد من الفئران.
- اضغطي برفق على الجلد حول العين للحث على احتقان وبروز مقلة العين.
- استخدم ملقط منحني للإمساك بمقلة العين وإزالتها بسرعة ، وجمع الدم المحيطي في أنبوب طرد مركزي دقيق.
ملاحظة: تم استخدام نوعين مختلفين من أنابيب الطرد المركزي الدقيقة ، أحدهما يحتوي على مضادات التخثر والآخر بدونها. - في الوقت نفسه ، اضغط برفق على منطقة قلب الفئران بالإصبع الأوسط من اليد اليسرى لزيادة سرعة ضخ القلب.
- أداء القتل الرحيم على الفئران التجريبية 36 ساعة بعد الحقن داخل الصفاق. قياس وتسجيل وزن الجسم للفئران قبل القتل الرحيم.
- اترك الدم المحيطي بدون مضادات التخثر في درجة حرارة الغرفة لمدة 30 دقيقة.
- قياس تركيزات الأميليز في الدم (إيمي) والليباز (الشفاه) باستخدام محلل كيميائي حيوي آلي من خلال طريقة معدل الإنزيم وطريقة دوران الإنزيم (باتباع تعليمات الشركة المصنعة).
- تحديد مستويات المؤشرات الالتهابية مثل Pro Calcitonin (PCT) في البلازما باستخدام طريقة التلألؤ الكيميائي باستخدام جهاز تصوير التلألؤ الكيميائي التجاري (باتباع تعليمات الشركة المصنعة).
- استخدم مجموعات ELISA لقياس مستويات HMGB-1 و IL-6 و TNF-α في مصل الفئران (باتباع تعليمات الشركة المصنعة).
- تحليل الدم المحيطي المعالج بمضادات التخثر باستخدام محلل خلايا الدم الأوتوماتيكي بالكامل لتقييم المعلمات ذات الصلة.
6. جمع أنسجة البنكرياس وإعداد قسم البارافين
- ضع الفئران في وضع ضعيف وقم بتثبيتها على طبق رغوي.
- حلق المنطقة وعهرها ، ثم قم بعمل شق متوسط في البطن واقلب أنبوب الأمعاء الدقيقة إلى اليمين لكشف البنكرياس بالكامل.
- افصل الاثني عشر وقناة البواب وحدد مكان الأمعاء الدقيقة أسفل البنكرياس. حرر أنسجة البنكرياس بالكامل على طول القناة المعوية.
- استخدم ملقط بلا أسنان لربط الطحال وسحبه برفق لأعلى.
ملاحظة: لا تلمس أنسجة البنكرياس مباشرة ، وتجنب استخدام القوة المفرطة أثناء عملية التفكك بأكملها. - تشريح أنسجة رباط البنكرياس الخلفي بحدة حتى رأس البنكرياس وفصل القناة الصفراوية والأوعية الدموية.
- قم بإزالة أنسجة البنكرياس ، واتركها تجف رطوبة السطح بورق ماص ، وقم بوزنها وتسجيلها.
- ثبت نصف أنسجة البنكرياس بنسبة 4٪ بارافورمالدهيد وقم بتخزين النصف الآخر في الثلاجة عند -80 درجة مئوية.
- تحضير أقسام البارافين البنكرياس باتباع الخطوات أدناه.
- نظف أنسجة البنكرياس الثابتة بنسبة 75٪ كحول وقم بقصها إلى حجم 0.5 سم × 0.5 سم تقريبا.
- اغمر الأنسجة في 70٪ إيثانول لمدة 20 دقيقة ، و 80٪ إيثانول لمدة 20 دقيقة أخرى ، و 90٪ إيثانول لمدة 15 دقيقة.
- عالج الأنسجة مرتين بالإيثانول بنسبة 95٪ لمدة 15 دقيقة في كل مرة ثم مرتين بإيثانول 100٪ لمدة 5 دقائق في كل مرة.
- قم بإخضاع الأنسجة لجولتين من 12 دقيقة و 5 دقائق من العلاج بمحلول الزيلين للشفافية.
- نقع الأنسجة الشفافة في خزان الشمع على حرارة 65 درجة مئوية لمدة 1 ساعة.
- قم بتضمين المنديل في البارافين المذاب واتركه ليبرد. الحصول على أقسام البارافين البنكرياس مع القطاعة (سمك: 5 ميكرومتر).
- قم بتسطيح شرائح البارافين التي تم الحصول عليها في ماء 45 درجة مئوية ، وقم بتركيبها وتجفيفها (ظروف الخبز: 40 درجة مئوية لمدة 14-16 ساعة).
7. تلطيخ الهيماتوكسيلين واليوسين (H&E & E)
- ضع أقسام البارافين البنكرياسية في الزيلين الأول والثاني لمدة 30 دقيقة ، ثم في اللامائية ، 95٪ ، 85٪ ، و 75٪ كحول لمدة 5 دقائق لكل منهما ، وماء عالي النقاء لمدة 5 دقائق.
- تلطيخ نواة الخلية مع الهيماتوكسيلين لمدة 160 ثانية ، ثم شطف بالماء الجاري ببطء.
- ضع محلول تمايز كحول حمض الهيدروكلوريك لمدة 5-10 ثوان ، ثم اشطفه بالماء الجاري بسرعة.
- عالج الأقسام بالكحول اللامائي لمدة 5 دقائق.
- احتضان السيتوبلازم مع يوزين لمدة 30 ثانية ، ثم شطف بالماء الجاري.
- اغمر الأقسام في 75٪ و 85٪ و 95٪ و 100٪ إيثانول لمدة 10 ثوان لكل منها ، ثم عالج بالزيلين لمدة 5 دقائق حتى يجف.
- أخيرا ، أغلق الأقسام براتنج محايد وراقبها تحت المجهر.
- أداء التهديف المرضي والمعايير13.
ملاحظة: تحديد شدة التهاب البنكرياس بناء على مؤشرات مثل الوذمة ، نخر العنيبات ، النزيف ، النزف ونخر الدهون ، والالتهاب الالتهابي وحول الأوعية. استخدم إرشادات التنفيذ المنشورة مسبقا لتسجيل13.
8. تلطيخ مناعي كيميائي
- قم بإزالة الشمع من الأجزاء المضمنة في البارافين من أنسجة البنكرياس في الزيلين ثم أعد ترطيبها في تدرج من محاليل الإيثانول.
- قم بإجراء حجب الإنزيم الداخلي باستخدام 3٪ H2O2 لمدة 20 دقيقة بعد تمزق الغشاء لمدة 30 دقيقة.
- سد الجسم المضاد مع مصل الأبقار 5٪ في درجة حرارة الغرفة لمدة 30 دقيقة ، ثم احتضان طوال الليل عند 4 درجات مئوية مع تخفيف 1: 1500 من الأرانب المضادة HMGB1.
- شطف المقاطع مع برنامج تلفزيوني ، ثم احتضانها في الأجسام المضادة الثانوية المقابلة لمدة 30 دقيقة عند 37 درجة مئوية. بعد ذلك ، قم بإجراء تطوير لون DAB ، وتلطيخ الهيماتوكسيلين ، وختمه بصمغ محايد.
9. طريقة TUNEL للكشف عن موت الخلايا المبرمج في أقسام البنكرياس
- قم بإزالة الشمع من أقسام البارافين البنكرياسية في الزيلين لمدة 5 دقائق ، كرر مرتين واغسلها بالإيثانول المتدرج (100٪ لمدة 5 دقائق ، 90٪ لمدة دقيقتين ، 70٪ لمدة دقيقتين ، والماء المقطر لمدة دقيقتين).
- اغسل السائل الزائد المحيط بأقسام البارافين باستخدام برنامج تلفزيوني. عالج كل عينة ب 100 ميكرولتر من Proteinase K ، مما يضمن تغطية كاملة للأنسجة. احتضان العينات على حرارة 37 درجة مئوية لمدة 20 دقيقة. بعد ذلك ، نقع العينات في برنامج تلفزيوني 3 مرات ، في كل مرة لمدة 5 دقائق.
ملاحظة: تم تحضير محلول Proteinase K عن طريق تخفيف محلول Proteinase K الأصلي (200 ميكروغرام / مل) مع PBS بنسبة 1: 9 (حجم) ، مما أدى إلى تركيز نهائي قدره 20 ميكروغرام / مل ، باستثناء DNase. يعد الغسيل الشامل ل Proteinase K ضروريا لتجنب التداخل مع تفاعلات وضع العلامات اللاحقة. - أضف كمية مناسبة من 3٪ H2O2 (مخففة بواسطة PBS) على الأنسجة للتسلل إليها بالكامل واحتضانها لمدة 20 دقيقة. شطف الأنسجة مع برنامج تلفزيوني 3 مرات لمدة 5 دقائق لكل منهما.
ملاحظة: يجب أن تبقى أقسام البارافين رطبة. لتعطيل البيروكسيديز الداخلي في الأنسجة ، يجب ألا يكون وقت الحضانة طويلا جدا لمنع الإيجابيات الكاذبة بسبب كسر الحمض النووي الناجم عن 3٪ H2O2. - قم بتغطية كامل مساحة العينة المراد اختبارها ب 50 ميكرولتر من محلول التوازن واحتضانها لمدة 10 دقائق.
- قم بإزالة أكبر قدر ممكن من المخزن المؤقت للتوازن. ثم أضف 56 ميكرولتر من المخزن المؤقت لحضانة TdT إلى كل عينة من الأنسجة واحتضانها لمدة 1 ساعة (في درجة حرارة الغرفة).
ملاحظة: يجب عدم ترك الشريحة تجف ، ويجب تجنب التعرض للضوء. تم تحضير المخزن المؤقت لحضانة TdT وفقا لتعليمات الشركة الصانعة (إنزيم TdT المؤتلف: مزيج وضع العلامات Biotin-dUTP: Equilibration Buffer = 1 μL: 5 μL: 50 μL). - اغسل عينات الأنسجة باستخدام برنامج تلفزيوني على الفور. شطفها 4 مرات لمدة 5 دقائق لكل منهما. قم بإزالة أي محلول PBS زائد برفق حول العينات باستخدام ورق الترشيح.
- أضف 100 ميكرولتر من محلول تفاعل Streptavidin-HRP المخفف مسبقا (Streptavidin-HRP: TBST = 1: 300) إلى كل عينة نسيج لتفاعل Streptavidin-HRP. احتضان لمدة 30 دقيقة. ثم اغسل العينات باستخدام برنامج تلفزيوني واشطفها 3 مرات لمدة 5 دقائق لكل منها.
- قم بإجراء تلطيخ DAB بإضافة 50 ميكرولتر من DAB إلى كل قسم من البارافين. مراقبة تلطيخ تحت المجهر في الوقت الحقيقي. بعد ظهور تلطيخ إيجابي ، ضع الشرائح على الفور في صندوق رطب. أوقف التفاعل عن طريق غسله بالماء النقي.
- اغمر الشرائح في محلول تلطيخ الهيماتوكسيلين لمدة 3-5 دقائق ، ثم اشطفها بالماء النقي.
- التفريق في محلول تمايز الهيماتوكسيلين لحوالي 2 ثانية ، يليه الشطف الفوري بالماء النقي.
- تحقيق اللون الأزرق باستخدام محلول rebluing الهيماتوكسيلين لبضع ثوان ، وشطف الشرائح نظيفة بالماء النقي.
ملاحظة: إجراء الفحص المجهري بعد تلطيخ النووي. إذا كان التلوين مظلما جدا ، فأعد الشرائح إلى محلول التمايز. إذا كان التلوين خفيفا جدا ، فأعد تشغيل عملية التلوين من خطوة التلوين النووي. - جفف العينات ب 4 جولات من الإيثانول اللامائي الطازج لمدة 5 دقائق لكل منها. ثم انقعها في البيوتانول لمدة 5 دقائق وفي الزيلين لمدة 5 دقائق. أخيرا ، استخدم الزيلين الطازج لمدة 5 دقائق أخرى.
- قم بتركيب الشرائح باستخدام اللثة المحايدة. اتركها تجف في الهواء بشكل طبيعي أو جففها في فرن على حرارة 60 درجة مئوية.
- إجراء الفحص النسيجي باستخدام مجهر الضوء الأبيض. سوف تظهر نوى موت الخلايا المبرمج باللون البني.
- حساب مؤشر موت الخلايا المبرمج المقابلة (الذكاء الاصطناعي).
ملاحظة: راقب الشرائح بطريقة مزدوجة التعمية. في الشرائح الموجبة ل TUNEL ، حدد عشوائيا 5 مناطق موجبة تحت التكبير العالي (400x) ، واحسب ما لا يقل عن 100 خلية أسينار في كل منطقة لتحديد النسبة المئوية للخلايا الموجبة. الذكاء الاصطناعي = (إجمالي عدد الخلايا المبرمج / إجمالي عدد الخلايا) × 100٪.
10. قياس التدفق الخلوي
- الحصول على أنسجة البنكرياس الطازجة وغسلها جيدا بعد تعطير مع برنامج تلفزيوني.
- تحضير محلول هضم كولاجيناز IV 0.5٪ واستخدام مقص الأنسجة المعقمة لهضم أنسجة البنكرياس بشكل كاف.
- أضف محلول إنهاء الهضم BSA بنسبة 5٪ اعتمادا على حالة شظايا البنكرياس والعكارة السائلة ، وطرد الخليط في درجة حرارة منخفضة لمدة 5 دقائق (~ 300 × جم ، 4 درجات مئوية).
- تخلص من المادة الطافية لإنهاء عملية الهضم.
- تحضير وسط زراعة الخلايا الذي يحتوي على فلوريد فينيل ميثان سلفونيل (PMSF) و 2.5٪ معلق لخلايا مصل الأبقار الجنينية لإعادة تعليق خلايا البنكرياس.
- قم بتصفية معلقات الخلايا العنيبية البنكرياسية من خلال شبكة نايلون مكونة من 200 شبكة للحصول على معلقات الخلايا من خلال ترشيح الخلايا.
- أجهزة الطرد المركزي تعليق خلية acinar البنكرياس في درجة حرارة منخفضة (اتبع الشروط كما هو مذكور في الخطوة 10.3).
- تخلص من المادة الطافية.
- اغسل الخلايا باستخدام برنامج تلفزيوني مبرد مسبقا.
- أعد تعليق الخلايا برفق في مخزن مؤقت ربط 1x مبرد مسبقا من خلال تعليق الطرد المركزي.
- قم بتسمية خلايا acinar البنكرياسية ب Annexin V-FITC / PI وفقا لتعليمات الشركة المصنعة بعد ضبط تركيز الخلية.
- استخدم قياس التدفق الخلوي في غضون 1 ساعة للكشف عن موت الخلايا المبرمج في خلايا أسينار البنكرياس.
11. الكشف عن اللطخة الغربية ل Caspase-3 و HMGB-1
- استخراج بروتين البنكرياس.
- استخراج 50 ملغ من أنسجة البنكرياس وقطعها إلى شظايا صغيرة.
- أضف 1 مل من محلول تحلل RIPA (يحتوي على PMSF ومثبط الأنزيم البروتيني المفسفر).
- تجانس أنسجة البنكرياس على الثلج لمدة 5 دقائق باستخدام مطحنة كهربائية.
- احتضان الأنسجة المتجانسة على الجليد مع هز لطيف لمدة 2 ساعة.
- جهاز طرد مركزي متجانس عند 4 درجات مئوية لمدة 10 دقائق عند 4500 × جم.
- اجمع المحلول الطافي واحفظه في درجة حرارة -80 درجة مئوية.
- أداء كمية البروتين.
- خفف حجما معينا من عينة BSA القياسية (25 مجم / مل) إلى تركيز 0.5 مجم / مل.
- قم بإعداد كمية محددة من محلول عمل BCA عن طريق خلط 50 مجلدا من محلول BCA A مع حجم 1 من محلول BCA B ، مما يضمن خلطا شاملا ومتساويا.
- ضع عينة BSA القياسية في فتحات العينة القياسية على لوحة 96 بئرا بترتيب 0 و 1 و 2 و 4 و 8 و 12 و 16 و 20 ميكرولتر. وازن حجم كل ثقب بالماء المقطر ، مما ينتج عنه حجم إجمالي يبلغ 20 ميكرولتر.
- أضف 2 ميكرولتر من العينات إلى فتحات العينة ، ثم أضف بالتتابع 18 ميكرولتر من الماء المقطر للتخفيف (1: 9).
- املأ كل بئر ب 200 ميكرولتر من محلول عمل BCA واتركه يقف عند 37 درجة مئوية لمدة 20-30 دقيقة تقريبا.
- قم بقياس الامتصاص بطول موجي 562 نانومتر. احسب تركيز البروتين للعينات بناء على المنحنى القياسي.
- أضف حجما محددا من محلول تكسير RIPA ومخفف المخزن المؤقت لتخفيف العينات حتى يصل التركيز إلى 5-10 ميكروغرام / ميكرولتر ، وهو ما يعتبر مناسبا.
- قم بتخزين العينات في درجة حرارة -20 درجة مئوية بعد تمسخ البروتين (100 درجة مئوية ؛ 10 دقائق).
- أداء النشاف الغربي.
- قم بالاستعدادات ل SDS-PAGE.
- قم بتركيب قوالب صنع الغراء وفحص أداء الختم.
- أضف TEMED إلى لاصق الفصل بنسبة 10٪ واخلطه بالتساوي.
- حقن الخليط في القالب ، وهو ما يمثل ما يقرب من ثلثي الحجم ، مع تجنب الفقاعات.
- أضف الأيزوبروبانول إلى القالب واضغط على المادة اللاصقة لمدة 40 دقيقة تقريبا.
- استخدم نفس البرنامج لتكوين المادة اللاصقة المركزة بنسبة 5٪.
- اسكب الأيزوبروبانول وأضف المادة اللاصقة على الفور.
- ضع المشط عموديا حتى يتبلمر الغراء تماما.
- إجراء عملية الكهربائي.
- أضف العينة المراد اختبارها بترتيب التحكم التجريبي المتوقع ، بترتيب عكسي ، في فتحات أخذ العينات للمادة اللاصقة SDS-PAGE.
- أضف علامة البروتين في نفس الوقت لتحديد موقع البروتين المستهدف والبروتين المرجعي الداخلي.
- ضع العينة في خزان الرحلان الكهربائي بعد اكتمال إضافة العينة.
- في البداية ، قم بتشغيل 80 فولت لمدة 30 دقيقة ، متبوعا بتشغيل الجل لفصل البروتين عند 100 فولت لمدة 60 دقيقة.
ملاحظة: يجب الانتباه إلى موضع البروموفينول الأزرق لتجنب الرحلان الكهربائي المفرط.
- إجراء نقل البروتين.
- قص فيلم PVDF في الزاوية اليمنى العليا ليكون بمثابة علامة.
- ضع فيلم PVDF في محلول ميثانول لمدة 5-10 ثوان للتنشيط.
- انقع فيلم PVDF في محلول كهربائي لمدة 15 دقيقة تقريبا.
- قم بإزالة الجل بعناية بعد الرحلان الكهربائي وقم بقص الجل الزائد ، مع ضمان بقاء الجل رطبا طوال العملية.
- قم بتجميع الجبيرة بالترتيب التالي: لوحة سالبة → إسفنجة → ثلاث طبقات من ورق الترشيح → هلام → فيلم PVDF → ثلاث طبقات من ورق الترشيح → الإسفنج → اللوحة الموجبة.
ملاحظة: تأكد من عدم وجود فقاعات بين الجل وفيلم PVDF. - ضع المشبك المجمع في الأخدود الدوار الرطب (أسود إلى أسود) مع وضع مكعبات الثلج حوله.
- قم بتشغيل الطاقة وابدأ نقل الفيلم عند 400 مللي أمبير لمدة 100 دقيقة.
- أداء ختم فيلم PVDF ، وحضانة الأجسام المضادة الأولية والثانوية.
- قم بإزالة فيلم PVDF برفق بعد النقل واشطفه باستخدام TBST لمدة 10 دقائق ، كرر العملية 3-5 مرات.
- أغلق فيلم PVDF في 5٪ حليب خالي الدسم لمدة 2 ساعة.
- قم بإزالة فيلم PVDF واشطفه باستخدام TBST لمدة 10 دقائق ، كرر العملية 4 مرات.
- ضع فيلم PVDF والجسم المضاد الأولي المخفف معا في الثلاجة على حرارة 4 درجات مئوية مع رج لطيف واحتضانه طوال الليل.
- قم بإزالة فيلم PVDF في اليوم التالي واشطفه باستخدام TBST لمدة 10 دقائق ، وكرر العملية 4 مرات.
- احتضان فيلم PVDF في مخفف الأجسام المضادة الثانوية المسمى HRP لمدة 2 ساعة تقريبا.
- شطف فيلم PVDF مع TBST لمدة 10 دقائق ، كرر العملية 4 مرات.
- فضح الفيلم وتحليله.
- ضع محلول ECL المحضر على الفيلم بالتساوي.
- قم بتعريض الفيلم في غرفة مظلمة باستخدام مقياس التعرض لمدة 2-3 دقائق تقريبا ثم قم بتخزينه.
- قم بإجراء التحليل باستخدام برنامج image J.
- قم بالاستعدادات ل SDS-PAGE.
النتائج
يوضح الشكل 1 عملية النمذجة التجريبية للفأر. بعد 12 ساعة من اكتمال الحقن ، تم استخدام مسجل فيديو مفتوح المجال لمراقبة مسافة الحركة ومدة الجمود لمجموعات تجريبية مختلفة من الفئران لمدة 5 دورات (الشكل 2 أ). خلال الدورات الخمس ، حافظت الفئران في مجموعة PI V على مستوى منخفض من مسافة الحركة في غضون 3 دقائق ، بينما زادت نسبة الجمود في غضون 3 دقائق مع كل دورة لاحقة (الشكل 2B ، C). بالإضافة إلى ذلك ، تم إجراء تحليل إحصائي على مسافة الحركة الإجمالية للفئران من مجموعات تجريبية مختلفة خلال 5 دورات. أظهرت مجموعة PI V أصغر مسافة حركة إجمالية مقارنة بالمجموعات التجريبية الأخرى ، وكان الفرق ذا دلالة إحصائية (p < 0.001) (الشكل 2D ، E). باستثناء المجموعة الضابطة ومجموعة PI I ، أظهرت الفئران في المجموعات التجريبية الأخرى نموا سلبيا في وزن D-Value. من بينها ، أظهرت مجموعة PI V أكبر تغيير في الوزن ، وكان الفرق في تغير الوزن مقارنة بالمجموعات التجريبية الأخرى ذا دلالة إحصائية (الشكل 2F). بعد تقييم معدل البقاء على قيد الحياة ل 10 فئران إضافية في كل مجموعة تجريبية ، أظهرت النتائج أن معدل وفيات الفئران في المجموعة PI V وصل إلى 80٪في اليوم الخامس. ومع ذلك ، لم يكن هناك فرق ذو دلالة إحصائية في معدل الوفيات بين المجموعات التجريبية الأربع الأخرى وفئران المجموعة الضابطة (الشكل 2G).
باستخدام مجهر عالي الطاقة ، لوحظ تورم خلوي كبير ونخر وتسلل الخلايا الالتهابية في مجموعات PI IV و PI V من الفئران (الشكل 3A ، B). باستخدام معايير التصنيف على النحو المنصوص عليه في الجدول التكميلي 2 ، تم تقييم أمراض البنكرياس لمجموعات تجريبية مختلفة من الفئران ، ولاحظت اختلافات كبيرة في درجة أمراض البنكرياس مقارنة بفئران المجموعة الضابطة (p < 0.001) (الشكل 3C ؛ الشكل 3C). الشكل التكميلي 1). بالإضافة إلى ذلك ، بالمقارنة مع المجموعة الضابطة ، كانت مستويات الأميليز المصلي والليباز في الفئران المقاسة أعلى بشكل ملحوظ في المجموعات التجريبية PI II إلى PI V ، وكانت الاختلافات ذات دلالة إحصائية. ومن المثير للاهتمام ، لم يكن هناك فرق ذو دلالة إحصائية في فئران مجموعة PI I (الشكل 3D ، E). تم استخدام طريقة ELISA لتقييم مستويات علامات الالتهاب14 ، بما في ذلك TNF-α و IL-6 ، في مصل الفئران. كشفت النتائج أن مستويات TNF-α و IL-6 في فئران مجموعة PI V كانت أعلى بكثير من تلك الموجودة في المجموعات التجريبية الأخرى ، وكانت الاختلافات ذات دلالة إحصائية (الشكل 3F ، G). وبالمقارنة مع المجموعة الضابطة، زادت مستويات معاهدة التعاون بشأن البراءات في جميع المجموعات التجريبية الأربع، ولكن الفرق في مجموعة PI V فقط كان ذا دلالة إحصائية (p < 0.05) (الشكل 3H).
حالة موت الخلايا المبرمج لأنسجة البنكرياس في مجموعات تجريبية مختلفة من الفئران
من خلال إجراء تلطيخ TUNEL على أنسجة البنكرياس لكل مجموعة من الفئران ، لوحظت حالة النخر الخلوي في أنسجة البنكرياس لمجموعات تجريبية مختلفة (الشكل 4 أ). تم تحليل قيم التدرج الرمادي (OD) لكل وحدة مساحة من أقسام أنسجة البنكرياس والمعدل الإيجابي للنخر الخلوي بشكل شبه كمي باستخدام برنامج Image J. أظهرت النتائج أنه بالمقارنة مع المجموعات التجريبية الأخرى ، زاد مستوى نخر الخلايا في أنسجة البنكرياس لمجموعة PI V من الفئران بشكل ملحوظ ، وكان الفرق ذا دلالة إحصائية (p < 0.001) (الشكل 4B ، C). تم إجراء تجارب النشاف المناعي للبروتين لتقييم مستويات التعبير عن بروتين سيستينيل أسبارتات محدد -3 (Caspase-3) ، وهو علامة نخر خلوي ، في أنسجة البنكرياس للفئران من مجموعات تجريبية مختلفة (الشكل 4 د). أظهر القياس الكمي لتعبير caspase-3 أن مستوى التعبير عن بروتين caspase-3 في أنسجة البنكرياس لمجموعة PI V قد زاد بشكل كبير ، وكان الفرق ذا دلالة إحصائية (p < 0.001). تم تحديد مستويات تعبير البروتين وتطبيعها وفقا للرقابة الداخلية GapDH (الشكل 4E). بالإضافة إلى ذلك ، تم تمييز معلقات الخلايا العنيبية البنكرياسية الجديدة ب Annexin V-FITC / PI وتم تحليلها بواسطة قياس التدفق الخلوي. وجد أنه بالمقارنة مع المجموعات التجريبية الأخرى من الفئران ، كان لدى مجموعة PI V معدل إيجابي أعلى بكثير لموت الخلايا ، والذي كان ذا دلالة إحصائية (p < 0.001) (الشكل 4F ، G).
محتوى HMGB-1 في المصل المحيطي ومستوى التعبير عن HMGB-1 في أنسجة البنكرياس
من أجل التحقيق في العلاقة بين بروتين HMGB-1 وإصابة البنكرياس ، تم إجراء تلطيخ كيميائي مناعي وتحديد كمي على أنسجة البنكرياس للفئران في كل مجموعة تجريبية. كان هناك فرق ذو دلالة إحصائية بين المجموعات التجريبية والضابطة (p < 0.001) (الشكل 5 أ ، ب). تم استخدام ELISA لقياس مستويات HMGB-1 في مصل الفئران من مجموعات تجريبية مختلفة. أظهرت النتائج أنه بالمقارنة مع المجموعة الضابطة ، كانت مستويات مصل HMGB-1 أعلى بشكل ملحوظ في جميع المجموعات التجريبية ، مع أعلى مستوى لوحظ في مجموعة PI V ، وكان الفرق ذا دلالة إحصائية (p < 0.001) (الشكل 5C). علاوة على ذلك ، كشف تحليل اللطخة الغربية عن تعبير مرتفع لبروتين HMGB-1 في أنسجة البنكرياس للفئران في جميع المجموعات التجريبية ، مع وجود فروق ذات دلالة إحصائية مقارنة بالمجموعة الضابطة (p < 0.001) (الشكل 5D ، E).

الشكل 1: مخطط انسيابي تجريبي. اليوم 2 واليوم 3: الحقن داخل الصفاق. اليوم 4: بدأت تجربة المجال المفتوح بعد 12 ساعة من آخر حقنة داخل الصفاق. يوم 5: القتل الرحيم بعد 36 ساعة من الحقن داخل الصفاق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التغيرات العيانية في نموذج الفئران PI. (أ) مخطط مسار الحركة في الوقت الحقيقي للفئران. ب: المسافة الكلية للحركة خلال كل فترة رصد لمجموعات التجارب المختلفة من الفئران. (ج) النسبة المئوية لوقت الجمود خلال كل فترة رصد لمجموعات التجارب المختلفة من الفئران. (د، ه) تم تحليل المسافة الكلية للحركة ونسبة زمن الجمود خلال 15 دقيقة للفئران في مجموعات تجريبية مختلفة. (F) يتم عرض القيمة D التي تمثل وزن الفئران قبل وبعد عملية النمذجة. (ز) لوحظ بقاء 10 فئران في كل مجموعة لمدة 7 أيام بعد الحقن داخل الصفاق. يتم التعبير عن البيانات كوسيلة ± SEM ، n = 4. تشير كلمة "ns" إلى أنها ليست مهمة ، * P < 0.05 ، **** P < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
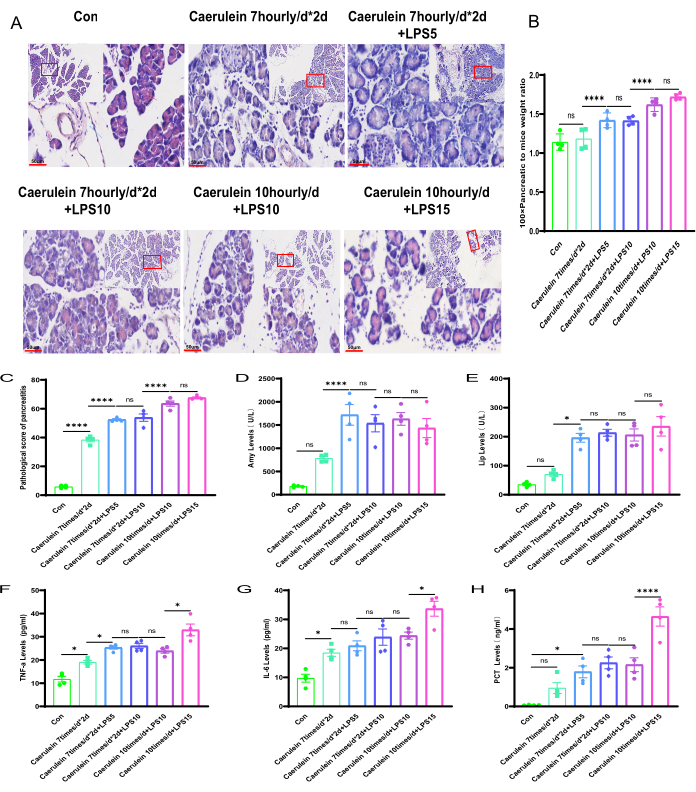
الشكل 3: التغيرات المرضية في التهاب البنكرياس لدى الفئران بين المجموعات التجريبية المختلفة. (أ) المقاطع النسيجية الملطخة ب H& E لأنسجة البنكرياس للفئران في مجموعات تجريبية مختلفة (أقسام أنسجة البنكرياس المضمنة بالبارافين الملطخة بالهيماتوكسيلين واليوزين، تكبير 100 أضعاف وقضبان المقياس 200 ميكرومتر، و400 أضعاف وقضبان المقياس 50 ميكرومتر، على التوالي. تشير الأسهم الطويلة الصفراء إلى الجزر الصغيرة ؛ تشير الأسهم الطويلة الحمراء إلى الخلايا العنيبية ؛ تشير الأسهم الطويلة البنية إلى الأوعية الدموية. تشير الأسهم الطويلة الزرقاء إلى القنوات). ب: حساب نسبة وزن البنكرياس إلى وزن الجسم في الفئران. ج: التهديف المرضي لبنكرياس الفئران. (د، ه) الكشف عن مستويات الأميليز والليباز في الدم. (ف-ز) قياس ELISA لمستويات TNF-α و IL-6 في المصل في الفئران. (ح) تقييم مستوى معاهدة التعاون بشأن البراءات. يتم التعبير عن البيانات كوسيلة ± SEM ، n = 4. تشير كلمة "ns" إلى عدم وجود أهمية ، * P < 0.05 ، **** P < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: موت الخلايا المبرمج لأنسجة البنكرياس في الفئران. (أ) تم الحصول على صور تمثيلية لتلطيخ TUNEL من مقاطع البارافين البنكرياسية للفئران وصور المنطقة الموسعة. (400x ، شريط مقياس 50 ميكرومتر ، الأصفر البني هو خلايا موجبة). (ب، ج) التحليل الكمي لقيمة التدرج الرمادي لكل وحدة مساحة من المقاطع الملطخة ب TUNEL لأنسجة البنكرياس للفئران والنسبة المئوية للخلايا الميتة الملطخة إيجابيا. (د) تم الكشف عن مستوى التعبير عن Caspase-3 في أنسجة البنكرياس بواسطة اللطخة الغربية. ه: القياس الكمي لتعبير Caspase-3 في أنسجة البنكرياس. (F) تم استخدام قياس التدفق الخلوي لتقييم مدى موت الخلايا في خلايا أسينار البنكرياس الفئران. (ز) تعداد الخلايا الميتة في المرحلة المتأخرة في الخلايا العنيبية البنكرياسية للفأر. يتم التعبير عن البيانات كوسيلة ± SEM ، n = 4. تشير كلمة "ns" إلى أنها ليست مهمة ، * P < 0.05 ، **** P < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تعبير HMGB-1 في أنسجة البنكرياس في الفئران. (أ) صور تمثيلية وصور مكبرة (x400 ، شريط مقياس 50 ميكرومتر) للتلطيخ الكيميائي المناعي ل HMGB-1 على أقسام البنكرياس. يشير اللون الأصفر البني إلى الخلايا الإيجابية (n = 4). (ب) النسبة المئوية للخلايا الإيجابية HMGB-1 في أقسام أنسجة البنكرياس (ن = 24). (ج) مستوى HMGB-1 في مصل الفأر (ن = 4). (د، ه) تم إجراء لطخة غربية للكشف عن مستوى التعبير عن HMGB-1 في أنسجة البنكرياس والحصول على نتائج القياس الكمي (n = 4). يتم التعبير عن البيانات كوسيلة ± SEM ، "ns" تدل على عدم وجود أهمية ، * P < 0.05 ، **** P < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: إصابة أعضاء متعددة في نموذج فئران مجموعة PI V. (أ) تم تحليل الصور التمثيلية للتغيرات النسيجية في أنسجة البنكرياس والرئة والكبد والكلى التي تم جمعها من فئران المجموعة CON و PI V باستخدام تلطيخ H&E (تكبير 200x ، شريط مقياس 50 ميكرومتر). يشار إلى التغيرات المرضية المرتبطة بنخر الخلايا الأسينية بواسطة الأسهم السوداء. تشير الأسهم الصفراء إلى التغيرات المرضية التي تتميز بنزيف خلالي وذمة في الحويصلات الهوائية. يشار إلى وذمة خلايا الكبد والنخر بالسهام الخضراء. تتميز التغيرات المرضية المرتبطة بالنزف الكبيبي بأسهم حمراء. (ب) تم إجراء حساب الدرجات النسيجية على أنسجة البنكرياس والرئة والكبد والكلى التي تم الحصول عليها من مجموعة CON وفئران مجموعة PI V. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي 1: بروتوكول الحقن داخل الصفاق. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي 2: معايير التسجيل المرضية لشدة التهاب البنكرياس. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
حاليا ، هناك نقص في الوسائل الفعالة لتحسين معدل الوفيات المرتفع في المرضى الذين يعانون من التهاب البنكرياس الحاد الوخيم. من الأهمية بمكان التحقيق في فعالية الأدوية في تعزيز آليات الاستقرار المناعي. توجد حاجة ملحة لنموذج حيواني مثالي لالتهاب البنكرياس الحاد الشديد. تستخدم الفئران ذات الخلفية الجينية C57BL / 6J على نطاق واسع في الأبحاث الطبية الحيوية ، بما في ذلك الدراسات حول الفيزيولوجيا المرضية SAP. أدى أكثر من 70 عاما من التمايز الجيني في الفئران B6J إلى الحذف التلقائي للعديد من exons15 ، مما أدى إلى انخفاض الحساسية لإصابة البنكرياس التي يسببها Caerulein16. بالإضافة إلى ذلك ، فإن النماذج الحيوانية الحالية لالتهاب البنكرياس الحاد لها قيود مثل الصدمة الجراحية أو قابلية التطبيق فقط على الأكبر حجما ، مما يعيق التحقيقات العلمية باستخدام هذه النماذج. لذلك ، من المفيد للغاية إنشاء نموذج حيواني مستقر وفعال ومريح باستخدام هذه السلالة الجينية المحددة.
Caerulein هو نظير للكوليسيستوكينين الذي يؤدي إلى تلف أنسجة البنكرياس عن طريق التسبب في انسداد نسبي للسائل الهضمي للبنكرياس وإفراز الإنزيم من خلال الحقن عالية التردد في غضون فترة قصيرة عندما تصوم الفئران وتخزن كميات كافية من السائل الهضمي17. LPS هو المكون الرئيسي الموجود في جدران الخلايا البكتيرية ويمكن أن يسبب MODS و SIRS في الفئران18. أظهرت دراسة سابقة أن الجمع بين حقن Caerulein على ترددات مختلفة مع جرعات متفاوتة من LPS تدار عن طريق الحقن داخل الصفاق تسبب تغيرات مرضية مماثلة لوحظت في SAP19,20 البشري. استخدمت هذه الدراسة نهجا غير جراحي للحث على درجات متفاوتة من إصابة البنكرياس من خلال الجمع بين ترددات مختلفة من حقن Caerulein مع جرعات مختلفة من LPS تدار داخل الصفاق في الفئران. كان ضمان الامتصاص المنتظم بواسطة الصفاق أمرا بالغ الأهمية أثناء تطوير البروتوكول. للوفاء بهذا المطلب ، من الأهمية بمكان الالتزام الصارم بخطوات الحقن داخل الصفاق من أجل ضمان التحكم الدقيق في كل إدارة دواء. بالإضافة إلى ذلك ، فإن الفرك اللطيف وتطبيق الضغط المناسب على موقع الحقن باستخدام قطعة قطن معقمة بعد كل حقنة دواء ضروريان للتوزيع الموحد للدواء في جميع أنحاء التجويف البريتوني. علاوة على ذلك ، فإن وضع رأس الدبوس بدقة ودقة في التجويف البريتوني ، مع توجيه الإبرة نحو المنطقة المركزية من الجزء العلوي من البطن ، له أهمية قصوى. يجب إجراء تدريب مسبق لتمكين المشغلين من إدراك أي غياب للمقاومة بدقة عند إدخال الإبرة في تجويف البطن. ومن شأن استخدام مضخة التسريب الكمي الجزئي بدلا من التشغيل اليدوي أن يعزز نوعية حقن المخدرات؛ لسوء الحظ ، لم يتم تنفيذ هذا في هذه الدراسة. ومع ذلك ، من خلال استخدام مخططات حقن مختلفة ، قمنا بإحداث درجات متفاوتة من إصابة البنكرياس ولاحظنا بشكل فعال الاختلافات في إصابة البنكرياس الناجمة عن الترددات والجرعات المختلفة في ظل ظروف تقنية متطابقة يسببها Caerulein جنبا إلى جنب مع حقن LPS. يوفر هذا رؤى قيمة للاستخدام المستقبلي للكايرولين في النماذج الحيوانية غير الغازية لتحريض التهاب البنكرياس الحاد الوخيم.
أدى الجمع بين Caerulein و LPS إلى ارتفاع كبير في مستويات الأميليز والليباز في المصل ، وزيادة وزن البنكرياس ، والتغيرات النسيجية ، بما في ذلك التسلل الواسع للخلايا الالتهابية ، وذمة خلايا البنكرياس العنيبية ، والنخر ، والنزيف ، كما يتضح من تلطيخ الهيماتوكسيلين ويوزين (HE). علاوة على ذلك ، مع زيادة جرعة LPS ، أصبحت التغيرات المرضية في البنكرياس أكثر وضوحا. ومع ذلك ، من الجدير بالذكر أنه لم تكن هناك اختلافات ملحوظة في درجات أمراض البنكرياس بين مجموعات PI IV و PI V ، في حين كان مدى نخر خلايا أنسجة البنكرياس أكثر وضوحا في مجموعة PI III مقارنة بمجموعة PI IV. تشير هذه الملاحظة إلى أن تواتر جرعات Caerulein قد يكون بمثابة عامل أساسي يساهم في إصابة البنكرياس ، بينما يؤدي LPS إلى تفاقم تقدمه ، مما يؤدي إلى تلف التهابي جهازي18,21. HMGB-1 هو بروتين يعمل اعتمادا على موقعه22. يعمل HMGB-1 خارج الخلية كبروتين يشارك في إشارات التحذير من الالتهاب ويرتبط ارتباطا وثيقا بشدة التهاب البنكرياس الحاد23،24،25. في هذه الدراسة ، كانت مستويات HMGB-1 في مصل الدم في الفئران من جميع المجموعات التجريبية أعلى بكثير مقارنة بالمجموعة الضابطة ، حيث أظهرت مجموعة PI V الزيادة الأكثر أهمية. كما أكدت تجارب الرحلان الكهربائي المناعي الكيميائي والبروتيني التعبير العالي ل HMGB-1 في أنسجة البنكرياس. قد يكون هذا البروتين المهم بمثابة هدف علاجي لتثبيط العاصفة الالتهابية في التهاب البنكرياس الحاد الشديد.
باختصار ، من الأهمية بمكان تطوير نموذج SAP غير جراحي وبسيط وسهل الأداء في الفئران. في هذا البروتوكول التجريبي ، يكون تحريض إصابة البنكرياس باستخدام Caerulein جنبا إلى جنب مع LPS موثوقا وفعالا. من خلال إعطاء Caerulein داخل الصفاق لمدة عشرة أيام متتالية بجرعة 50 ميكروغرام / كجم ، تليها حقنة واحدة داخل الصفاق من 15 ملغ / كغ من LPS ، يمكن إنشاء نموذج حيواني مستقر وموثوق وفعال من حيث التكلفة من SAP.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذه الدراسة من خلال مشاريع بحثية في مجال الصحة والعلوم الطبية في مدينة هواينان (No. HNWJ2023005) ؛ برنامج خطة العلوم والتكنولوجيا التوجيهية البلدية في مدينة هواينان (رقم 2023151) ؛ برنامج التدريب على الابتكار وريادة الأعمال لطلاب كلية مقاطعة آنهوي (رقم S202310361254) ؛ الدفعة التاسعة من "50· نجوم العلوم والتكنولوجيا" فرق الابتكار في مدينة هواينان ومشروع البناء التخصصي السريري الرئيسي في مقاطعة آنهوي. نود أن نعرب عن امتناننا لقسم المختبرات في المستشفى التابع الأول لجامعة آنهوي للعلوم والتكنولوجيا لتوفير بيانات الاختبار ذات الصلة.
Materials
| Name | Company | Catalog Number | Comments |
| 20× Citric Acid Antigen Repair Solution (pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1202-250 ml | |
| Amylase | Mindray,China | ||
| Annexin V-FITC/PI | Wuhan servicebio Technology Co.,Ltd, China | G1511 | diluted at 1:20 |
| Anti-HMGB1 Rabbit pAB | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1800 |
| BCA protein quantitative detection kit | Wuhan servicebio Technology Co.,Ltd, China | G2026-200T | |
| BD FACSCanto II Flow Cytometer | BD Life Sciences, San Jose, CA, 95131, USA | BD FACSCanto II | |
| BSA | Wuhan servicebio Technology Co.,Ltd, China | GC305010-100g | |
| C57BL/6J | Cavion Experimental Animal Co., Changzhou, China | license number SCXY (Su) 2011–0003 | |
| Ceruletide | MCE, New Jersey, USA | 17650-98-5 | 50 µg/kg |
| Chemiluminescence imager | Cytiva CO.,LTD.;USA | ||
| Citric acid antigen repair Solution (Dry powder pH 6.0) | Wuhan servicebio Technology Co.,Ltd, China | G1201-5 L | |
| Collagenase IV | Wuhan servicebio Technology Co.,Ltd, China | GC305014 | 0.5 mg/mL |
| DAB (SA-HRP) Tunel Cell Apoptosis Detection Kit | Wuhan servicebio Technology Co.,Ltd, China | G1507-100 T | |
| Dimension EXL with LM Integrated Chemistry System | Siemens Healthcare Diagnostics Inc.Brookfield,USA | YZB/USA 8311-2014 | |
| ECL developer | Wuhan servicebio Technology Co.,Ltd, China | ||
| Eosin dye (alcohol soluble) | Wuhan servicebio Technology Co.,Ltd, China | G1001-100 ml | |
| EthoVision XT | Noldus, Netherlands | ||
| FITC-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB22303 | diluted at 1:50 |
| Fully automatic blood cell analyzer | Zybio Inc. China | Zybio-Z3 CRP | |
| GapDH | Wuhan servicebio Technology Co.,Ltd, China | GB11103 | diluted at 1:1500 |
| Hematoxylin blue return solution | Wuhan servicebio Technology Co.,Ltd, China | G1040-500 ml | |
| Hematoxylin differentiation solution | Wuhan servicebio Technology Co.,Ltd, China | G1039-500 ml | |
| Hematoxylin dye | Wuhan servicebio Technology Co.,Ltd, China | G1004-100 ml | |
| HMGB-1 ELISA kits | njjcbio Co., Ltd, China | ||
| HOMOGENIZER | Wuhan servicebio Technology Co.,Ltd, China | KZ-III-F;IC111150 100222 | |
| HRP-labeled goat anti-rabbit IgG | Wuhan servicebio Technology Co.,Ltd, China | GB23303 | diluted at 1:1500 |
| IL-6 ELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0001 | |
| Lipase | Mindray,China | ||
| Lipopolysaccharide | Wuhan servicebio Technology Co.,Ltd, China | GC205009 | 15 mg/kg |
| Low temperature high speed centrifuge | Changsha Pingfan Apparatus&Instrument Co.,Ltd.,China | TGL-20M | |
| Membrane breaking liquid | Wuhan servicebio Technology Co.,Ltd, China | G1204 | |
| microtome | Jinhua Craftek Instrument Co., Ltd.;China | CR-601ST | |
| Nylon mesh | Wuhan servicebio Technology Co.,Ltd, China | 200-mesh | |
| One-step TUNEL cell apoptosis detection kit (DAB staining method) | Wuhan servicebio Technology Co.,Ltd, China | G1507-100T | |
| Paraffin tissue embedding machine | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PBM-A | |
| Pathological tissue drying apparatus | PRECISION MEDICAL INSTRUMENTS CO.,LTD;Changzhou,China | PHY-III | |
| Phosphate-buffered saline | Wuhan servicebio Technology Co.,Ltd, China | G4202-100ML | |
| PMSF | Wuhan servicebio Technology Co.,Ltd, China | G2008-1 ml | |
| Positive fluorescence microscope | Olympus Corporation,Tokyo, Japan | BX53 | |
| Pro Calcitonin | Mindray,China | ||
| PVDF membrane | Millipore, USA | 0.22 µm | |
| RIPA | Wuhan servicebio Technology Co.,Ltd, China | G2002-100 ml | |
| SDS-PAGE | Beyotime Biotechnology,China | P0012A | |
| TNF-αELISA kits | Wuhan servicebio Technology Co.,Ltd, China | GEM0004 | |
| Ultrasonic water bath | DONGGUAN KQAO ULTRASONIC EQUIPMENT CO.,LTD.;China | KQ-200KDE | |
| Western Blot | Bio-Rad Laboratories, Inc.,USA | ||
| Western blot imaging System | Global Life Sciences IP Holdco LLC, JAPAN | Amersham ImageQuant 800 | |
| Whirlpool mixer | SCILOGEX;USA |
References
- Gliem, N., Ammer-Herrmenau, C., Ellenrieder, V., Neesse, A. Management of severe acute pancreatitis: An update. Digestion. 102 (4), 503-507 (2021).
- Duan, F., et al. GDF11 ameliorates severe acute pancreatitis through modulating macrophage M1 and M2 polarization by targeting the TGFbetaR1/SMAD-2 pathway. Int Immunopharmacol. 108, 108777 (2022).
- Zhang, X. P., et al. Preparation method of an ideal model of multiple organ injury of rat with severe acute pancreatitis. World J Gastroenterol. 13 (34), 4566-4573 (2007).
- Bluth, M. H., Patel, S. A., Dieckgraefe, B. K., Okamoto, H., Zenilman, M. E. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 12 (28), 4511-4516 (2006).
- Qiu, F., Lu, X. S., Huang, Y. K. Effect of low molecular weight heparin on pancreatic micro-circulation in severe acute pancreatitis in a rodent model. Chin Med J (Engl). 120 (24), 2260-2263 (2007).
- Lombardi, B., Estes, L. W., Longnecker, D. S. Acute hemorrhagic pancreatitis (massive necrosis) with fat necrosis induced in mice by DL-ethionine fed with a choline-deficient diet. Am J Pathol. 79 (3), 465-480 (1975).
- Liu, Y., et al. Deletion of XIAP reduces the severity of acute pancreatitis via regulation of cell death and nuclear factor-kappaB activity. Cell Death Dis. 8 (3), e2685 (2017).
- Niederau, C., Ferrell, L. D., Grendell, J. H. Caerulein-induced acute necrotizing pancreatitis in mice: Protective effects of proglumide, benzotript, and secretin. Gastroenterology. 88, 1192-1204 (1985).
- Zhou, X., et al. DPP4 inhibitor attenuates severe acute pancreatitis-associated intestinal inflammation via Nrf2 signaling. Oxid Med Cell Longev. 2019, 6181754 (2019).
- Yang, J., et al. Heparin protects severe acute pancreatitis by inhibiting HMGB-1 active secretion from macrophages. Polymers (Basel). 14 (12), 2470 (2022).
- Kong, L., et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury. Cell Death Dis. 12 (10), 928 (2021).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Schmidt, J., et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 215 (1), 44-56 (1992).
- Luo, C., et al. Abdominal paracentesis drainage attenuates severe acute pancreatitis by enhancing cell apoptosis via PI3K/AKT signaling pathway. Apoptosis. 25 (3-4), 290-303 (2020).
- Fontaine, D. A., Davis, D. B. Attention to background strain is essential for metabolic research: C57BL/6 and the international knockout mouse consortium. Diabetes. 65 (1), 25-33 (2016).
- Wan, J., et al. Pancreas-specific CHRM3 activation causes pancreatitis in mice. JCI Insight. 6 (17), e132585 (2021).
- Sah, R. P., et al. Cerulein-induced chronic pancreatitis does not require intra-acinar activation of trypsinogen in mice. Gastroenterology. 144 (5), 1076-1085 (2013).
- Wang, K., et al. Activation of AMPK ameliorates acute severe pancreatitis by suppressing pancreatic acinar cell necroptosis in obese mice models. Cell Death Discov. 9 (1), 363 (2023).
- Jin, C., Li, J. C. Establishment of a severe acute pancreatitis model in mice induced by combined Rain Frog Peptide and lipopolysaccharide and exploration of its mechanism. Acta Exp Bio Sinica. 36 (2), 91-96 (2003).
- Tan, J. H., et al. ATF6 aggravates acinar cell apoptosis and injury by regulating p53/AIFM2 transcription in severe acute pancreatitis. Theranostics. 10 (18), 8298-8314 (2020).
- Roy, R. V., et al. Pancreatic Ubap2 deletion regulates glucose tolerance, inflammation, and protection from Caerulein-induced pancreatitis. Cancer Lett. 578, 216455 (2023).
- Chen, R., Kang, R., Tang, D. The mechanism of HMGB1 secretion and release. Exp Mol Med. 54 (2), 91-102 (2022).
- Murao, A., Aziz, M., Wang, H., Brenner, M., Wang, P. Release mechanisms of major DAMPs. Apoptosis. 26 (3-4), 152-162 (2021).
- Liu, T., et al. Accuracy of circulating histones in predicting persistent organ failure and mortality in patients with acute pancreatitis. Br J Surg. 104 (9), 1215-1225 (2017).
- Li, N., Wang, B. M., Cai, S., Liu, P. L. The role of serum high mobility Group Box 1 and Interleukin-6 levels in acute pancreatitis: A meta-analysis. J Cell Biochem. 119 (1), 616-624 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved