细胞死亡测定:细胞毒性能力的铬释放测定
Overview
资料来源:弗朗西斯·萨亚斯塔德1,2,惠特尼·斯旺森2,3和托马斯·格里菲斯1,2,3,4
1明尼苏达大学明尼阿波利斯分校微生物学、免疫学和癌症生物学研究生课程,MN 55455
2明尼苏达大学明尼阿波利斯分校免疫学中心,MN 55455
3明尼苏达大学泌尿科,明尼阿波利斯,MN 55455
4共济会癌症中心,明尼苏达大学明尼阿波利斯分校,MN 55455
免疫系统细胞的主要功能之一是去除已经感染病毒或已经转化为肿瘤细胞的目标细胞。多年来,用于测量免疫细胞细胞毒性能力的体外检测一直是实验室的主食。这些测定用于确定T细胞、NK细胞或任何其他免疫细胞以抗原特异性或非特异性方式杀死目标细胞的能力。由效应细胞表达的死亡配体(例如,Fas配体或TRAIL)、细胞因子(如IFNg或TNF)或细胞毒性颗粒(即穿孔素/颗粒B)是诱导靶细胞死亡的一些方法。随着近年来肿瘤免疫治疗研究的爆炸式增长,人们越来越有兴趣寻找增加免疫细胞细胞细胞毒性活性的制剂,以改善患者的疗效。相反,一些疾病的特点是免疫细胞细胞毒性活性过度,导致努力识别抑制这些反应的病原体。因此,通过测定,用户可以轻松地将任意数量的不同效应细胞、靶细胞和/或响应修饰剂集成到实验设计中,可以作为快速评估效应细胞细胞的细胞毒性和/或目标单元格的响应能力。
这些体外检测涉及混合不同的细胞群,以及使用相对较少的效应细胞和目标细胞。因此,检测的一个必要条件是以易于检测和定量的方式标记目标细胞,允许用户确定由效应细胞介导的"百分比特异性莱沙"。放射性 - 特别是,铬51(51Cr)的形式Na251CrO4- 是一种廉价的方式,快速和非具体标记细胞蛋白在目标细胞 (1)。短标记和总测定时间降低了目标细胞的数量和/或表型发生重大变化的可能性,这可能会影响测定结果。当由于效应细胞的细胞毒性活性而使目标细胞的膜完整性丧失时,目标细胞内的51个Cr标记细胞蛋白被释放到培养上清液中,可用于定量。与任何在体外检查免疫细胞功能的测定一样,需要考虑提高实验性能。其中一个最关键的特征是使用健康效应器(用于最大的细胞毒性活性)和目标(用于最大响应性和最小自发死亡/51Cr释放)细胞。需要效应器和目标细胞接触(导致普遍使用圆底96孔板来鼓励细胞-细胞接触) (2)。最后,数据分析取决于纳入正负对照细胞群。
以下协议将概述执行标准51Cr 释放测定以测量效应细胞群的细胞毒性能力的步骤,尽管最近开发了使用 Europium 的非放射性版本。51Cr 是一个强大的 -辐射发射器。因此,使用这种检测需要适当的辐射安全培训、专用的实验室空间、伽马计数器和放射性样品的处置。
此测定中的事件总序列为:1) 准备51个 Cr 标记的目标;2) 在目标细胞标记时制备效应细胞并添加到板中;3) 将标记的目标添加到板中;4)孵育板;5) 收获超生物;6) 在计数器上运行样本后分析数据。样品通常以三联,然后平均,以解释任何细微的移液差异。
适当的 PPE 对于此测定非常重要。具体来说,用户应穿着实验室外套和手套。根据实验室或机构,可能需要安全眼镜。所有步骤都应有足够的铅屏蔽,以便安全存储和使用51Cr。最后,应留出专用实验室空间和设备,以便使用51Cr,包括所有适当的标牌,以指示存放51Cr 的样品的位置,以及配备伽马探测器的盖革计数器,以便尽可能测量空间污染。
在本实验练习中,我们将确定人类外周血单核细胞(PBMC)、(CpG刺激与未刺激)杀死黑色素瘤细胞的能力,使用人类黑色素瘤细胞系WM793作为模型和铬释放测定。
Procedure
过程概述
用于测量细胞死亡的典型51Cr 释放测定涉及以下步骤:
- 首先,目标细胞标有Na2=51Cr_O4。这使它们与测定中的效应细胞区分开来。
- 当目标细胞进行标记时,收集效应细胞,并使用串行稀释技术,在圆底96孔测定板中生成效应细胞的滴定。
- 在靶细胞标记的末尾,首先对细胞进行清洗,然后将固定数量的细胞添加到已经含有一系列效应细胞稀释的测定板中。
- 接下来,目标效应细胞组合在规定的时间段内孵育,以允许与目标细胞进行足够的细胞交互,以调解细胞莱沙。
- 最后,将培养超生物收获并收集到管中。51Cr 量使用伽玛计数器进行定量。
- 最后,收集数据并用于计算目标细胞的"百分比特定细胞莱沙"。
1. 用51Cr 标记目标细胞
- 首先,将目标细胞(此处-人类黑色素瘤细胞系WM793)制备成单个细胞悬浮液。
- 为此,首先从组织培养瓶中取出介质。
- 然后,用 5 mL 的 1X PBS 清洗细胞。
- 通过在板中加入1 mL的胰蛋白酶,使细胞分氨酸2分钟。
- 轻轻敲击烧瓶,将细胞从烧瓶表面松开。
- 将 5 mL 的 RPMI 介质添加到烧瓶中,并上下移液介质以分离电池。
- 将细胞悬浮液收集到15 mL锥形管中,并在1200 rpm转速下将细胞悬浮液离心5分钟。去上清。
- 向颗粒中加入 10 mL 的介质,并轻轻上下移液介质,使电池悬浮。
- 使用血细胞计确定细胞浓度。
- 将 1x106细胞转移到新的 15 mL 锥形管中。
- 在 1200 rpm 转速下将细胞悬浮液离心 5 分钟,并排出上清液。
- 短暂涡旋管,在留下的小体积中重新悬浮细胞颗粒。
- 将 100 μCi的 51Cr 直接添加到 WM793 目标细胞悬架中。
注意:应该有一个专用的实验室空间,为特定的放射性设置。此外,在所有步骤中,应有足够的铅屏蔽,以便安全储存和使用51Cr,并配备适当的标牌,以指示存放51Cr 的样品的位置。盖革计数器也配有煎饼探头,用于测量空间是否可能存在污染。 - 在管子里加一小块放射性胶带,表明管子现在具有放射性。
- 将管子置于带有铅屏蔽的37°C培养箱中,孵育1小时。
- 潜伏期后,用5 mL的FBS清洗目标细胞,以去除任何多余的51克。
- 在1200rpm下将细胞离心5分钟,将放射性FBS洗入适当的废物容器。
- 用 FBS 重新悬浮颗粒并第二次清洗。使用盖革计数器检查颗粒中有有未包含的放射性。
- 将颗粒重新悬浮在10 mL完整培养基中,达到105细胞/mL的细胞浓度。
注意:出于安全考虑,此处省略了51Cr 标签后的细胞计数步骤。可以假定WM793细胞浓度与51Cr标签之前相同。
2. 制备效应细胞
- 可以使用各种效应细胞,例如人或小鼠 T 细胞和 NK 细胞。在此示例中,使用通过标准密度梯度离心(浓度为5x106)从全血中分离出来的PBMC。
- 首先,将100μL的组织培养基添加到96孔圆底板的一行(此处为A行,见表1)的每一口井中。在这里,没有添加效应细胞,它们将作为"空白",用于确定目标细胞中的"最小/自发51Cr释放"。
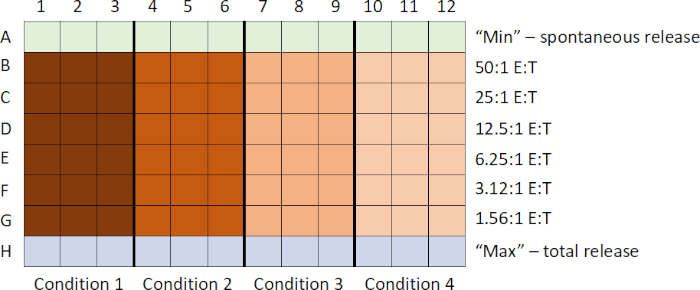
表1:51Cr释放测定布局:A行-目标细胞(104个细胞/100μL)仅用介质孵育(生成"空白"以确定"最小/自发51Cr释放")。 B 行到 C-孔包含不同的效应器:目标单元 (E:T) 比率,范围从 50:1 到 1.5:1。行H-靶细胞 (104细胞/100 μL) 孵育与 1% NP-40 (NP-40 解压目标细胞, 产生"最大或总51Cr 释放")。每个E:T比在每个实验条件下都以三倍率进行测试。列1-3-未刺激的 PBMC 和列4-6- CpG 刺激的 PBMC。
- 接下来,生成 PBMC 的 2 倍串行细胞稀释(针对每个实验条件的三倍),以获得从 5x105到 15,625 个细胞/100 μL 介质(此处为 B 到 G 行)的效果细胞浓度。
注意:在此示例中,起始效应器:目标单元格 (E: T) 比率为 50:1。但是,此比率可以根据实验细节进行调整。 - 通过不向这些井中添加任何效应单元,将最后一行留空(此处为第 H 行)。(此行将用于生成"总计数/分钟,或(c.p.m)"或"最大51Cr 释放")。
- 将板放入 37°C 培养箱中,直到目标细胞准备好添加。
3. 将51 个Cr 标记 WM793 目标细胞添加到 Assay
- 孵育期后,从培养箱中取出目标细胞,用5mL的FBS清洗,以去除任何多余的51Cr。
- 使用指定的离心机在 1200 rpm 下将细胞离心 5 分钟。
- 将 FBS 洗涤液(放射性上清液)放入适当的废物容器中。
- 将颗粒重新悬浮在 FBS 的新鲜 5 mL 中,重复洗涤步骤。
- 在 1200 rpm 转速下再次离心,等待 5 分钟。
- 最后,将颗粒重新悬浮在10 mL的完整介质中。
- 将51Cr 标记的 WM793 细胞悬架 (105细胞/mL) 倒入一次性试剂罐中。
- 然后,使用多通道移液器,将这些标记的目标细胞的100μL添加到96孔效应器细胞板的每个孔中。
- 接下来,在没有任何效应细胞的井中加入 100 μL 的 1% NP-40(在水中)(此处为 H 行)。1% NP-40 将解压目标细胞,因此这些井将作为控制,以确定"总计数/分钟,或(c. p.m)"或最大51Cr 释放。
- 在板的两侧添加一小块透气胶带,并在盖子上放置一块放射性胶带,以指示其包含51Cr,从而将盖子固定到板上。
- 简单地说,在 1200 rpm 转速下将板离心。如果只使用一个实验板,向离心机添加平衡板。
注意:使用标有放射性样品的离心机非常重要。 - 从离心机中取出板。
- 将板放在 37°C 的培养箱中,在板上放一小块铅屏蔽,以保障安全性。孵育16小时,以允许目标细胞解说。
注意:潜伏期可能从4小时到18小时不等,这取决于所使用的效应细胞和潜在的杀灭机制。
4. 收获超级动物
- 在孵育期结束时,小心地取下板边缘周围的胶带并取下盖子。
- 接下来,将收获框架放在板上,确保确认每个棉塞的小滤盘都已到位。这将确保收集无细胞上清液。
- 现在,慢慢地轻轻地将棉塞压入井中。
- 大约 10 秒后,释放棉塞上的压力,然后将棉塞转移到管条上。
- 将每个管子放入辅助 FACS 管中。
- 最后,将FACS管加载到伽玛计数器上,并运行样品,以定量每种条件下释放的51克。样品通常测量 1 分钟,便于确定"计数/分钟"。
- 仔细记录管子被装入柜台的顺序。
5. 数据分析
- 在这里,未刺激的PBMC被添加到前三列,CpG刺激的PBMC(CpG ODN,(1微克/千米)24小时)被添加到列4-6。见表2。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| A | 1251 | 1157 | 1086 | 917 | 1118 | 1140 | ||
| B | 1832 | 1986 | 1971 | 7629 | 7913 | 8180 | ||
| C | 1677 | 1739 | 1428 | 5454 | 5055 | 5268 | ||
| D | 1638 | 1552 | 1734 | 4239 | 3582 | 3786 | ||
| E | 1658 | 1580 | 1339 | 2818 | 2623 | 2750 | ||
| F | 1579 | 1472 | 1483 | 2028 | 1779 | 1769 | ||
| G | 1326 | 1325 | 1184 | 1801 | 1654 | 1565 | ||
| H | 9220 | 9367 | 8067 | 8774 | 9647 | 8236 | ||
| Ⅰ | A1,A2,A3 -> | 1164.67 | 自发的 c.p.m | 1058.33 | ||||
| J | B1,B2,B3 -> | 1929.67 | 9.91% | 7907.33 | 87.50% | 50:1 | ||
| K | C1,C2,C3 -> | 1614.67 | 5.83% | 5259 | 53.67% | 25:1 | ||
| 我 | D1,D2,D3 -> | 1641.33 | 6.17% | 3869 | 35.91% | 12.5:1 | ||
| M | E1,E2,E3 -> | 1525.67 | 4.68% | 2730.33 | 21.36% | 6.25:1 | ||
| N | F1、F2、F3 -> | 1511.33 | 4.49% | 1858.67 | 10.22% | 3.12:1 | ||
| O | G1,G2,G3 -> | 1278.33 | 1.47% | 1673.33 | 7.86% | 1.56:1 | ||
| P | H1,H2,H3 -> | 8884.67 | 最高 c.p.m | 8885.67 | ||||
| 无斯 PBMC | CpG-stim PBMC | E:T 比率 | ||||||
表2:51Cr 释放测定数据:"每分钟计数"/"c.p.m"数据值、平均 c. p. m 值以及计算特定莱沙值的百分比。
- 收集的数据(每分钟计数,即 c.p.m)以与原始板中样本布局相同的方式输入电子表格的单元格。
- 首先,计算了三元数的平均值。表2 - 细胞I3至P3,用于未刺激的PBMC和细胞I6到P6,用于CpG刺激的PBMC。
- 一旦确定平均值,则使用以下公式计算每个条件的特定莱沙百分比-

- 具体莱沙百分比针对每种情况计算(表 2 - 细胞 J4 到 O4,用于未刺激的 PBMC,J7 到 O7,对于未刺激的 PBMC)。
Results
在此示例中,随着效应细胞与目标细胞的比例增加,用CpG(图1,黑圈)刺激的效应细胞更有效地杀死目标细胞。这种增加在未刺激的PBMC(白圈)中未观察到,表明CpG刺激对于观察到的目标细胞解白的增加是必要的。
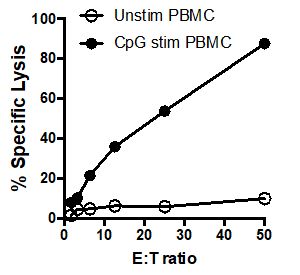
图1:51Cr测定散射图:人类PBMC、未刺激(白圈)和CpG(黑圈)刺激后,在不同效应器下测试:靶细胞比(E:T)比(从.50:1 到 1.5:1)。
Application and Summary
此处描述的测定具有相当大的灵活性,因为可根据所问问题使用各种效应器和目标细胞。例如,效应细胞特异性可以通过使用不同的靶细胞来确定,或者使用缺乏特定蛋白质的细胞或使用蛋白质特异性抑制剂来确定效应细胞杀死机制。51Cr释放测定的一个主要问题是目标细胞的自发释放率可能很高。当单独培养(无效应细胞)时,目标细胞自发释放的51Cr理想情况下不应超过目标细胞立即解释的总释放量的30%("最大")。自发释放率较高可能是由于使用不健康的目标细胞,或者由于健康不佳(例如,细胞系的扩展培养)或标签周期过长。
References
- Brunner, K. T., Mauel, J., Cerottini, J. C. and Chapuis. B. Quantitative assay of the lytic action of immune lymphoid cells on 51Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology, 14 (2):181-196, (1968).
- Kemp, T. J., B. D. Elzey, and T. S. Griffith. Plasmacytoid dendritic cell-derived IFN-alpha induces TNF-related apoptosis-inducing ligand/Apo-2L-mediated antitumor activity by human monocytes following CpG oligodeoxynucleotide stimulation. The Journal of Immunology, 171 (1): 212-218, (2003).
Tags
跳至...
此集合中的视频:

Now Playing
细胞死亡测定:细胞毒性能力的铬释放测定
Immunology
151.4K Views

流细胞学和荧光活化细胞分拣(FACS):血性B淋巴细胞的分离
Immunology
92.8K Views

磁性活细胞分拣 (MACS): 胸腺 T 淋巴细胞的分离
Immunology
22.8K Views

ELISA Asas :间接、三明治和竞争
Immunology
237.8K Views

ELISPOT 分析:检测 IFN-- 分泌性细胞
Immunology
28.4K Views

免疫组织化学和免疫细胞化学:通过光显微镜进行组织成像
Immunology
78.7K Views

抗体生成:使用杂交瘤生产单克隆抗体
Immunology
43.5K Views

免疫荧光显微镜:石蜡内嵌组织部分的免疫荧光染色
Immunology
53.8K Views

共聚焦荧光显微镜:确定小鼠纤维细胞中蛋白质定位的技术
Immunology
43.1K Views

基于免疫沉淀的技术:使用阿加玫瑰珠纯化内源性蛋白质
Immunology
87.6K Views

细胞周期分析:使用CFSE染色和流细胞测定法评估刺激后CD4和CD8 T细胞增殖
Immunology
24.1K Views

收养细胞转移:将供体小鼠孢子细胞引入宿主小鼠,并通过FACS评估成功
Immunology
22.3K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。