二茂铁结构
Overview
资料来源: 德克萨斯州 #38 大学化学系
在 1951年, Kealy 和 Pauson 向自然报告了一种新的金属有机化合物-二茂铁的合成。1在他们的原始报告中, Pauson 建议了一种二茂铁的结构, 其中的铁质是单个键 (西格玛键) 到每个烯配体的一个碳原子 (图 1, 结构 I)。1,2,3此初始报告导致对二茂铁结构的广泛兴趣, 许多顶尖科学家参与了这个有趣的新分子的结构阐明。威尔金森和伍德沃德很快提出了一个替代公式化, 其中铁是 "夹" 之间的两个烯配体, 对所有10碳原子的同等约束力 (图 1, 结构 II)。4在这里, 我们将合成二茂铁, 并根据实验数据 (IR 和1H NMR) 来确定这些结构的观测值。此外, 我们还将通过收集循环伏安来研究二茂铁的电化学。在实验过程中, 我们引入了18电子规则, 讨论了过渡金属络合物的价电子计数。
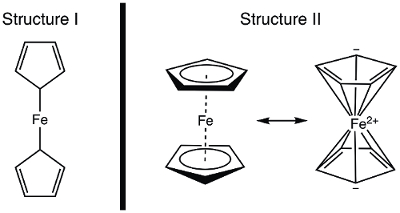
图 1.二茂铁的两个提议的结构。
Principles
18-电子规则和总价电子计数:
当绘制刘易斯点结构时, 重要的是要记住八隅体规则, 它指出主群元素的原子在其价壳中有8电子。但是, 八隅子规则不包含过渡金属, 它有九价轨道 (一个s, 三个p和五d轨道), 因此可以容纳多达18电子。因此, 一个18电子规则适用于过渡金属配合物。与八隅体规则一样, 18 电子规则也有例外, 但一般而言, 过渡金属络合物与18价电子被认为是高度稳定的化合物。
有两种方法可用于确定过渡金属络合物的总价电子计数: 离子 (带电) 模型和共价键 (中性) 模型。5任何一种方法的适当应用都应引起相同的总电子计数。这两种模型使用三配体分类称为 X, l-, 和 Z 类型。每个配体类型贡献一个不同数量的电子到总电子计数并且取决于使用的方法。X 型配体包括阴离子基团, 如卤化物、氢氧化物和醇。l-型配体包括胺和膦等孤对捐献者。最后, Z 型配体是电子对受体;因此, Z 型配体是中性的路易斯酸, 如 BR3。我们将考虑分子 Co (NH3)3Cl3 , 以演示两种方法 (图 2)。

图 2.电子计数示例, Co (NH3)3Cl3.
离子模型:
首先, 考虑由中央原子贡献的电子的数量。Co 在周期表的9组中, 因此有9价电子。在离子模型中, 需要考虑金属的氧化状态。由于 co 的氧化状态 (NH3)3Cl3是 + 3, 金属在离子模型中贡献的总价电子的总数是 6 e− (表 1)。在离子模型中, X 型和 L 型配体都将 2 e− 捐给总电子计数, 而 Z 类型配基不贡献任何电子。对于示例 Co (NH3)3Cl3, 存在两种配体类型。Cl 是一种 X 型配体, NH3是 L 型配体。使用离子模型, 总电子计数是 18 e− (表 1)。
表 1.e− 计数 Co (NH3)3Cl3使用离子和共价键模型
| 配体/中心原子 | 配体类型 | e−贡献
(离子模型) |
e−贡献
(共价键模型) |
| 有限公司 | n/a | 6 e− | 9 e− |
| 3 NH3 | 我 | 3 x (2 e−) | 3 x (2 e−) |
| 3厘 | x | 3 x (2 e−) | 3 x (1 e−) |
| 离子电荷 | n/a * | − (0) | |
| 合计e− count | 18 e− | 18 e− | |
* 含金属离子的电荷不包括在使用离子模型的总电子计数中。电荷在金属的氧化状态 (由中央原子贡献的电子) 中得到解释。
共价模型:
对于共价模型, e− 从中央原子的贡献等于价的总数e− 为中性原子 (在本例中为 9 e−)。X 型配体捐献 1 e−, L 型配体捐赠 2 e−, Z 型配体捐赠 0 e−。最后, 如果分子是离子的, 包含金属中心的离子的电荷需要从金属加上配体电子中减去。使用共价模型, Co (NH3)3Cl3的总电子计数也是 18 e− (表 1)。
二茂铁和 Ferrocenium 阳离子的电子计数:
使用共价模型, Fe 有 8 e−。如果我们把二茂铁的键合看作是结构 I, 烯 (Cp) 配体是 X 型的捐献者, 因此每一个贡献1电子 (表 2)。因此, 我们将有10价电子。然而, 在结构 II, 每个 Cp 圆环捐赠5电子 (L2X 类型配体), 我们有二个双键 (每个是2电子, l 类型施主) 和一个 X 类型施主 (根本)。这总共提供了18电子 (表 2)。
表2。用共价模型对二茂铁 (fc) 和 ferrocenium (fc+) 进行电子计数
| 配体/中心原子 | 结构 I | 结构二 | ||||
| 配体类型 | fc | Fc+ | 配体类型 | fc | Fc+ | |
| 铁 | -- | 8 e− | 8 e− | -- | 8 e− | 8 e− |
| cp | x | 2 x (1 e−) | 2 x (1 e−) | L2X | 2 x (5 e−) | 2 x (5 e−) |
| 离子电荷 | − (0) | − (+ 1) | 离子电荷 | − (0) | − (+ 1) | |
| 总电子计数 | 10 e− | 9 e− | 总电子计数 | 18 e− | 17 e− | |
二茂铁容易经历 1 e−氧化产生 ferrocenium 阳离子 (方程式 1)。
 (1)
(1)
让我们来考虑结构的 ferrocenium 阳离子和 II. 的结果电子计数在 1 e− 氧化, 二茂铁变成离子。因此, 需要从价电子 (表 2) 中减去 ferrocenium 阳离子的电荷 (+ 1)。分别对结构 I 和结构 II 的 9 e− 和 17 e− 的总电子计数中减去电荷的结果。
二茂铁的结构是正确的?
如果结构 I 是正确的, 只有10价电子, 二茂铁将是高度被动的在 Fe。在这种情况下, 氧化产生的 ferrocenium 阳离子将是相当具有挑战性的, 因为二茂铁结构 I 是电子缺陷。另一方面, 二茂铁的结构 II 遵循18电子规则, 因此是一致的, 以茂铁是一个稳定的化合物。在这种情况下, 氧化二茂铁到 ferrocenium 阳离子将产生一个 17 e− 物种。在电子计数的基础上, 可以预测二茂铁展品结构 II。让我们来考虑如何证明正确的结构光谱。
在公布结构数据之前, 从其磁性和光谱性质以及反应性出发, 推导了二茂铁的结构。让我们来考虑一下红外光谱, 我们将预测这两种结构。结构 I 显示两个化学等价的质子, 因此应该在红外光谱中产生超过一个 C H 拉伸模式。相比之下, 结构 II 显示单一类型的 c h 键, 因此应该显示一个单一的 c h 拉伸。核磁共振光谱学在1950代就很容易得到, 这也会提供一个线索: 结构 i 的1H 谱中的两个共振, 以及一个结构 II 的共振将被预测。在本实验中, 我们将合成二茂铁, 并利用光谱数据为其结构提供证据。
Procedure
1. 裂解烯二聚体 (图 3)
烯经历一个翅果-桤木反应与本身给二。这种反应是可逆的, 所以开裂是利用 La Châtelier 的原理, 以推动反向反应通过蒸馏烯单体 (血压42° c) 远离二二聚体 (血压170° c)。二反应是缓慢的, 当烯保持冷, 但它必须是新鲜的准备成功地合成二茂铁。
- 25毫升的圆底烧瓶, 加入搅拌棒和10毫升的二二聚体。
注意: 小心使用二和烯, 因为它们都是恶臭化学品。 - 将圆底烧瓶附加到分数蒸馏装置上 (参见 "有机化学精要" 系列中的 "分数蒸馏" 模块), 并将油浴放置在搅拌热板上。一定要在冰浴中收集烧瓶。将仪器夹紧到位。
- 将热板设置为160° c, 并轻轻搅拌溶液。
- 分数蒸馏5毫升的 Cp 单体从二聚体 (39-42 ° c)。

图 3。开裂的二。
2. 二茂铁的合成 (图 4)
- 100毫升的 Schlenk 烧瓶, 添加一个轰动酒吧和15克的精细地面 KOH。
警告: KOH 是非常有腐蚀性和吸湿!KOH 应在通风良好的遮光罩地面, 并在准备后立即使用。 - 搅拌时, 在烧瓶中加入30毫升的 12-乙烷。
- 将烧瓶与氮气连接, 并在烧瓶的颈部放置一个橡皮隔膜。
- 在氮气搅拌下, 通过注射器添加2.75 毫升的烯。允许在加入铁之前至少搅拌10分钟。
- 当反应是搅拌, 添加一个轰动酒吧, 3.25 克地面 FeCl2· 4H2O, 和12.5 毫升的亚砜到一个单独的50毫升 Schlenk 瓶。在颈部放置一个隔膜, 在氮气下搅拌, 直到所有的铁都溶解。
- 套管在氮气滴30分钟的过程中将铁溶液转移到环戊二烯溶液中。有关更详细的程序, 请查阅本无机化学系列中的 "用 Schlenk 线技术合成一钛 (III) 茂金属" 视频。
- 一旦加法是完整的, 搅拌额外的30分钟。
- 同时, 在一个烧杯冷却45毫升的6米 HCl 通过添加粉碎冰 (50 克) 直接到解决方案。
- 一旦反应完成, 将混合物倒入泥浆中, 搅拌几分钟。橙色晶体应该形成。
- 收集 chner 漏斗上的晶体 (装有滤纸), 用清水冲洗沉淀物。
- 让固体在空气中干燥。

图 4。二茂铁的合成。
3. 提纯二茂铁。通过升华净化产品 (更详细的程序, 请参阅 "升华二茂铁提纯" 视频)。
4. 二茂铁的表征
- 准备和收集一个1H 二茂铁核磁共振波谱。
- 收集红外光谱的二茂铁。
- 收集一个循环伏安的二茂铁 (参见 "循环伏安" 的视频在分析化学要点系列)。
Results
二茂铁特性:
1H 核磁共振 (氯仿-d, 300 兆赫, δ, ppm): 4.15 (s)。
二茂铁的1H 核磁共振谱清楚地显示出单一共振, 与结构 II. 一致
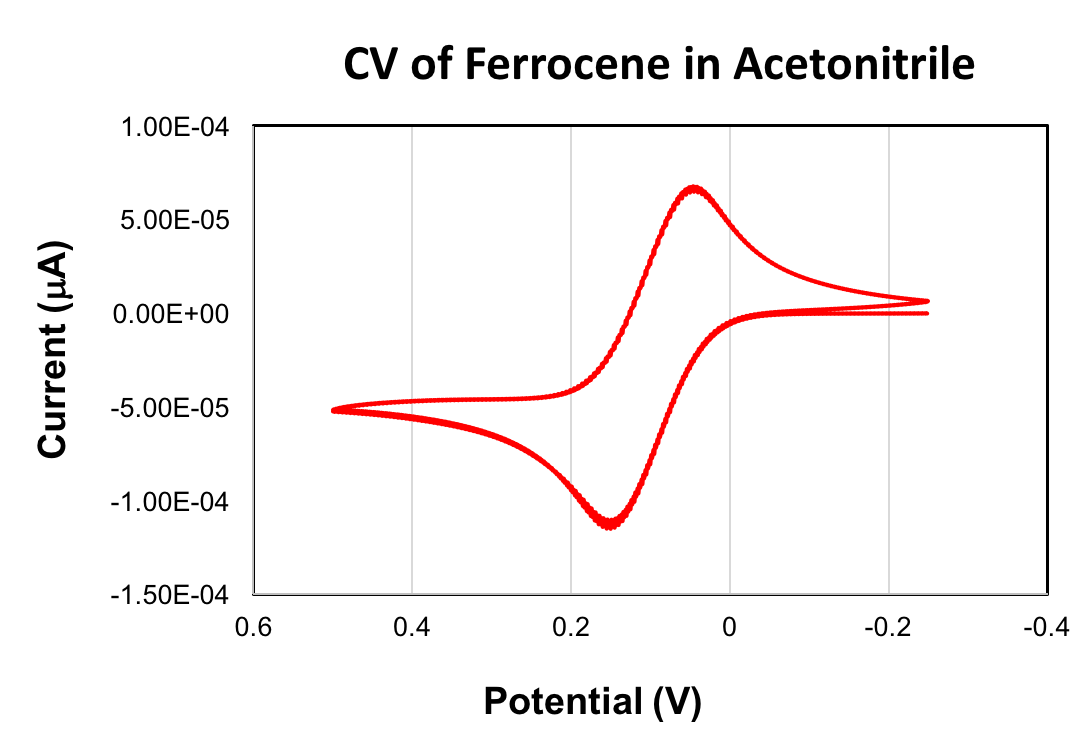
下面给出一份二茂铁的 CV。为二茂铁氧化所获得的E1/2值为 +90 毫伏 (乙腈、扫描率100毫伏/秒、0.1 M (Bu4N) PF6、玻碳工作电极)。二茂铁/ferrocenium 氧化还原偶常作为循环伏安法的参考。当用作参考时, 二茂铁的E1/2值设置为等于 0 v。
Application and Summary
在这段视频中, 我们讨论了二茂铁及其在金属有机化学发展中所起的作用。用1H 核磁共振和红外光谱法合成了二茂铁。这两种光谱都是一致的 18 e− 结构 ii, 那里的铁是 "夹" 在两个烯配体之间, 具有同等约束力的所有10碳原子 (图 1, 结构 ii)。电化学观察了二茂铁对 ferrocenium 阳离子的氧化反应。
在 1973年, 继二茂铁的结构表征, 威尔金森是两个化学家之一荣获诺贝尔化学奖 "为他的开创性工作..。6他的工作极大地影响和扩大了金属有机化学的新兴领域。尽管第一个金属有机化合物是在1849年制备的, 但只有在1950的时候, 才取得了重大进展, 以了解金属如何能与碳原子结合。今天, 金属有机化学的领域, 或化合物的化学组成的碳键, 是许多应用的中心。这包括: 能源, 染料敏化太阳能电池, 催化, 聚合, 药物发现和合成, 无机系统, 有机发光二极管 (oled)。7
二茂铁本身在金属有机化学领域也起着积极的作用。二茂铁容易参与亲芳香替代;事实上, 在这些反应中, 反应比苯要多10万倍。二茂铁在有机金属催化中被广泛应用为齿配体的结构成分。例如, 11 双 (膦) 二茂铁 (dppf) 是一种螯合配体, 用于均匀催化。配体 dppf 螯合物 1st, 2nd, 和 3rd行过渡金属, 包括镍、钯和 Pt. [11 ' 双 (膦) 二茂铁] 钯 (II) 是一个例子的钯交叉催化剂的 c-c 和C-杂键形成 (图 5)。8在 "过渡金属络合物的 MO 理论" 的视频中, 我们将合成两个具有 dppf 的金属配合物。

图 5.[11 双 (膦) 二茂铁] 二氯化钯是一种交叉催化剂, 用于 c 和 c-X 键形成。
References
1. Kealy, T. J., Pauson, P. L. A New Type of Organo-Iron Compound. Nature. 168 (4285), 1039-1040 (1951).
2. Pauson, P. L. Ferrocene—how it all began. J Organomet Chem. 637, 3-6 (2001).
3. Seeman, J. I., Cantrill, S. Wrong but seminal. Nat Chem. 8 (3), 193-200 (2016).
4. Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. The Structure of Iron Bis-cyclopentadienyl. 74, 2125-2126 (1952).
5. Green, M. L. H., Parkin, G. Application of the Covalent Bond Classification Method for the Teaching of Inorganic Chemistry. J Chem Educ. 91 (6), 807-816 (2014).
6. Press Release. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1973/press.html.
7. Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 6th ed. John Wiley & Sons. Hoboken. 2014.
8. Gildner, P. G., Colacot, T. J. Reactions of the 21st Century: Two Decades of Innovative Catalyst Design for Palladium-Catalyzed Cross-Couplings. Organometallics. 34, 5497-5508 (2015).
Tags
跳至...
此集合中的视频:

Now Playing
二茂铁结构
Inorganic Chemistry
79.4K Views

用 Schlenk 线技术合成钛 (III) 茂金属
Inorganic Chemistry
31.6K Views

手套和杂质传感器
Inorganic Chemistry
18.6K Views

二茂铁的升华纯化
Inorganic Chemistry
54.5K Views

埃文斯方法
Inorganic Chemistry
68.4K Views

单晶和粉末 X 射线衍射
Inorganic Chemistry
104.4K Views

电子顺磁共振 (EPR) 光谱学
Inorganic Chemistry
25.4K Views

尔光谱学
Inorganic Chemistry
22.0K Views

路易斯酸碱交互作用在 Ph 值3P BH3
Inorganic Chemistry
38.8K Views

群论在红外光谱分析中的应用
Inorganic Chemistry
45.2K Views

分子轨道 (MO) 理论
Inorganic Chemistry
35.3K Views

异体金属-金属粘结 Paddlewheels
Inorganic Chemistry
15.3K Views

染料敏化太阳能电池
Inorganic Chemistry
15.8K Views

载氧钴 (II.) 络合物的合成
Inorganic Chemistry
51.6K Views

自由基聚合反应的光化学引发
Inorganic Chemistry
16.7K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。