Method Article
استخدام الأكسجين عالي الضغط لتحسين الحساسية الإشعاعية لخلايا الورم الدبقي البشري U251
In This Article
Summary
يوضح هذا البروتوكول أن الأكسجين عالي الضغط يمكن أن يعزز تثبيط التكاثر وموت الخلايا المبرمج لخلايا الورم الدبقي U251 المعالجة بالأشعة السينية عن طريق منع الخلايا في مرحلة G2 / M. هذا يحسن الحساسية الإشعاعية لخطوط خلايا الورم الدبقي البشري.
Abstract
كان الهدف من هذه الدراسة هو استكشاف استخدام الأكسجين عالي الضغط لتعزيز الحساسية الإشعاعية لخلايا الورم الدبقي البشري. تم تقسيم خلايا الورم الدبقي البشري U251 المزروعة بشكل عشوائي إلى أربع مجموعات: مجموعة تحكم غير معالجة ، والخلايا المعالجة بالأكسجين عالي الضغط (HBO) فقط ، والخلايا المعالجة بالأشعة السينية (الأشعة السينية) فقط ، والخلايا المعالجة بكل من HBO والأشعة السينية. لوحظ مورفولوجيا الخلايا ونشاط تكاثر الخلايا وتوزيع دورة الخلية وموت الخلايا المبرمج في هذه المجموعات لتقييم دور HBO في تحسين الحساسية الإشعاعية لخلايا الورم الدبقي. مع الزيادة في جرعات الأشعة السينية (0 Gy ، 2 Gy ، 4 Gy ، 6 Gy ، 8 Gy) ، انخفض جزء البقاء على قيد الحياة (SF) لخلايا الورم الدبقي تدريجيا.
لوحظ انخفاض ملحوظ في SF للخلايا المعالجة ب HBO والأشعة السينية معا مقارنة بمجموعة الأشعة السينية لكل جرعة (كل P < 0.05). كان تثبيط الانتشار أعلى بشكل ملحوظ في HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعة الأشعة السينية لكل جرعة (كل P < 0.05) لخط الخلايا U251. كانت النسبة المئوية لخلايا الطور G2 / M أعلى بشكل ملحوظ في مجموعة HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) (26.70٪ ± 2.46٪) ومجموعة HBO (22.36٪ ± 0.91٪) مقارنة بالمجموعة الضابطة (11.56٪ ± 2.01٪) ومجموعة الأشعة السينية (2 Gy) (10.35٪ ± 2.69٪) (كل P < 0.05٪). كان موت الخلايا المبرمج لخلايا U251 أعلى بكثير في HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) مقارنة بمجموعة HBO ، ومجموعة الأشعة السينية (2 Gy) ، والمجموعة الضابطة (كل P < 0.05). نستنتج أن HBO يمكن أن يعزز تثبيط التكاثر وموت الخلايا المبرمج لخلايا الورم الدبقي U251 عن طريق منع خلايا الورم الدبقي في مرحلة G2 / M وتحسين الحساسية الإشعاعية لخلايا الورم الدبقي U251.
Introduction
الورم الدبقي هو ورم أساسي داخل الجمجمة ينشأ من الخلايا الدبقية في الجهاز العصبي المركزي1. استراتيجية العلاج الحالية للورم الدبقي هي الجراحة جنبا إلى جنب مع العلاج الإشعاعي والعلاج الكيميائي. يمكن أن يوفر العلاج الإشعاعي بعد الجراحة للورم الدبقي فوائد البقاء على قيد الحياة (دليل الدرجة الأولى) ، ويمكن للعلاج الإشعاعي المبكر بعد الجراحة أن يطيل بقاء المريض على قيد الحياة بشكل فعال (دليل من الدرجة الثانية)2. بالنسبة للأورام الدبقية عالية الدرجة (الدرجة الثالثة أو الرابعة)، وخاصة الورم الأرومي الدبقي شديد الخبيث والغازي (أدلة الدرجة الثالثة)3، يجب إجراء العلاج الإشعاعي بعد الجراحة في أقرب وقت ممكن (<6 أسابيع). ومع ذلك ، على الرغم من التدخل المبكر ، لا يزال الورم الدبقي يعاني من معدل تكرار مرتفع وتشخيص ضعيف بعد العلاج الشامل. ترتبط هذه النتائج بشكل أساسي بانخفاض الحساسية الإشعاعية للورم الدبقي. تشمل العوامل المتعلقة بالحساسية الإشعاعية للورم الحساسية الإشعاعية المتأصلة في الخلايا السرطانية ، والخلايا السرطانية الناقصة أو غير الناقصة للأكسجين ، ونسبة الخلايا السرطانية الناقصة للأكسجين ، وقدرة الأنسجة المحيطة بالورم على إصلاح الضرر الإشعاعي4.
من بين هذه العوامل ، الخلايا السرطانية الناقصة أو غير الناقصة للأكسجين ونسبة الخلايا السرطانية الناقصة للأكسجين لها تأثيرات مهمة على الحساسية الإشعاعية للورم. يمكن للأكسجين عالي الضغط (HBO) تحسين تخزين الأكسجين في الأنسجة عن طريق زيادة توتر الأكسجين في الأنسجة وانتشار الأكسجين في الدم. قد تنتج HBO أيضا سلسلة من التأثيرات الكيميائية الحيوية والخلوية والفسيولوجيةالمفيدة 5. على سبيل المثال ، HBO له تأثير تعويضي ملحوظ على الضرر الإشعاعي الناجم عن العلاج الإشعاعي. على الرغم من أن HBO جنبا إلى جنب مع العلاج الإشعاعي أو العلاج الكيميائي يحسن الفعالية السريرية للعلاج الإشعاعي أو العلاج الكيميائي للورم الدبقي6 ، إلا أن هناك ججلا كبيرا حول كيفية تأثير HBO وحده على نمو الورم الدبقي الخبيث. أظهر كل من Ding et al.7 و Wang et al.8 أن HBO يعزز نمو الورم الدبقي في الموقع في الفئران عبر الآليات التي تنطوي على تثبيط موت الخلايا المبرمج وتعزيز تكوين الأوعية الدموية. في ظل الظروف الفسيولوجية ، تم الإبلاغ عن أن HBO يعزز تكوين الأوعية الدموية للورم عن طريق إحداث الإجهاد التأكسدي9.
ومع ذلك ، أشارت إحدى الدراسات إلى أن التعرض قصير المدى ل HBO يعزز تكاثر الخلايا السرطانية ، في حين أن التعرض المطول ل HBO يعزز موت الخلايا المبرمج ويمنع التكاثر10. لذلك ، هناك حاجة إلى مزيد من الدراسات لاستكشاف ما إذا كان HBO يعزز أو يثبط نمو الورم الدبقي وكيف يمكن أن يؤدي HBO جنبا إلى جنب مع العلاج الإشعاعي أو العلاج الكيميائي إلى تحفيز الحساسية العلاجية. على وجه الخصوص ، هناك حاجة إلى تفاصيل ميكانيكية حول كيفية تحسين HBO للحساسية الإشعاعية للورم الدبقي. لاستكشاف كيفية تحسين HBO للحساسية الإشعاعية لخلايا الورم الدبقي U251 البشرية في هذه الدراسة ، استخدمنا HBO جنبا إلى جنب مع تشعيع الأشعة السينية على تكاثر خلايا الورم الدبقي ولاحظنا التأثيرات على توزيع دورة الخلية وموت الخلايا المبرمج.
Protocol
تمت الموافقة على جميع طرق الدراسة من قبل مجلس المراجعة المؤسسية ولجنة الأخلاقيات في المستشفى الثاني التابع لجامعة لانتشو وتم إجراؤها وفقا للإرشادات واللوائح ذات الصلة.
1. علاج خلايا الورم الدبقي
ملاحظة: تم استخدام خط خلايا الورم الدبقي U251 في هذه التجربة.
- زراعة الخلايا U251
- زرع خلايا U251 في أطباق متعددة مع DMEM يحتوي على 10٪ مصل بقري جنيني (FBS) وزراعتها عند 37 درجة مئوية مع 5٪ ثاني أكسيدالكربون 2.
- عند الوصول إلى التقاء 50٪ -60٪ ، قم بفصل الخلايا باستخدام محلول التربسين-EDTA (0.25٪ ، بدون الفينول الأحمر) ثم اسمح لها بالنمو إلى 80٪ من التقاء.
- تشعيع الأشعة السينية
- قم بتغطية ألواح الثقافة أو القوارير بمعوض أنسجة مكافئ يصل سمكه إلى 1 سم. بعد ذلك ، قم بتعريض الخلايا لإشعاع الأشعة السينية الذي يتم توصيله من مسرع خطي 6 ميجافولت بمسافة خلية مصدر تبلغ 100 سم ، يتم ضبطها بالنقر فوق زر التدوير على لوحة التحكم عن بعد.
- اطلب من الفيزيائي قياس جرعة الإشعاع وتصحيح التوهين. كعنصر تحكم ، ضع قوارير تحتوي على وسائط في كاشف قبل تشعيع الأشعة السينية.
- الأكسجين عالي الضغط (HBO)
- قم بتطهير غرفة HBO عن طريق تشغيل الأشعة فوق البنفسجية لمدة 15 دقيقة ثم إغراقها ب 0.02 ميجا باسكال من الأكسجين النقي لمدة 5 دقائق.
- بعد وضع الخلايا في ألواح أو قوارير مزرعة في الغرفة ، انقر فوق زر منظم الضغط على لوحة التحكم خارج الغرفة لزيادة ضغط HBO في الغرفة إلى 0.2 ميجا باسكال (2.0 ATA) في غضون 30 دقيقة من التشعيع.
- بعد ثلاثين دقيقة ، انقر فوق زر منظم الضغط لتقليل ضغط HBO إلى مستوى الضغط السابق (0.1 ميجا باسكال). بعد ذلك ، عالج زجاجات أو أطباق الاستزراع باستخدام HBO 1x يوميا لمدة 3 أيام متتالية.
2. خلايا الورم الدبقي U251 في مجموعات مختلفة
- قم بتعيين مجموعة تحكم ، ومجموعة الأشعة السينية (2 Gy) ، و HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) لحساب منحنيات نمو الخلية.
- قم بإعداد معلقات أحادية الخلية من خلايا الورم الدبقي U251 التي تظهر معدلات النمو القصوى (انظر الخطوة 1.1.2). اضبط كثافة الخلية على 1 × 106 / مل عن طريق عد الخلايا باستخدام شريحة مقياس الدم. بعد ذلك ، أضف 1 مل من تعليق الخلية إلى زجاجة مزرعة (كثافة الخلية: 1 × 106 / زجاجة) مع ثلاث زجاجات منفصلة لكل مجموعة.
- قم بتقييم مورفولوجيا الخلية عند تكبير 100x باستخدام مجهر المجال الساطع لتعداد الخلايا الملتصقة في 24 ساعة و 48 ساعة و 72 ساعة من الزراعة.
3. الحساسية الإشعاعية لخلايا الورم الدبقي U251 (مقايسة تكوين الاستنساخ) في غضون 30 دقيقة بعد HBO
- قم بزرع معلق U251 أحادي الخلية في جميع أنحاء الآبار عند 5 × 102 خلية / مل في ألواح 6 آبار ثم تعريضها للجرعة المحددة من تشعيع الأشعة السينية (0 Gy و 2 Gy و 4 Gy و 6 Gy و 8 Gy) ، مع فحص ثلاث عينات متوازية لكل جرعة من الأشعة السينية.
- بالنسبة لمجموعة HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) ، قم بتعريض الخلايا للإشعاع بالأشعة السينية في غضون 30 دقيقة من علاج HBO. بعد العلاج ، قم بزراعة الخلايا عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 لمدة 14 يوما.
- بعد أن تظهر المستنسخة ، قم بإزالة الوسيط واغسل المستنسخة 2x باستخدام PBS.
- ثبت الخلايا في 1 مل من الميثانول بنسبة 10٪ لمدة 15 دقيقة قبل تلطيخها ب 1 مل من البنفسجي البلوري 0.1٪ لمدة 20 دقيقة.
- بعد التلوين ، اغسل الخلايا ب 6 مل من الماء المقطر باستخدام ماصة ، ثم استنشق محلول البنفسجي البلوري. اترك الخلايا تجف في الهواء.
- احسب المستنسخة التي يتراوح قطرها بين 0.3 مم و 1.0 مم تحت المجهر للتأكد من وجود >50 خلية لكل استنساخ.
- احسب كسر البقاء (SF) باستخدام المعادلة (1):
SF = × 100٪ (1)
× 100٪ (1) - باستخدام البرمجيات الإحصائية، قم بإنشاء منحنى بقاء جرعة الإشعاع بناء على نموذج الضربة الواحدة متعددة الأهداف (SHMT) باستخدام المعادلة (2):
ق = 1 - (1 -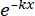 )ن (2)
)ن (2)
حيث S = احتمال البقاء على قيد الحياة ؛ k = متوسط الجرعة المميتة (الجرعة التي تسبب متوسط ضربة واحدة لكل خلية) ؛ x = عدد الزيارات لكل خلية ؛ N = عدد الأهداف (عدد الضربات لموت الخلية). - احسب المعلمات الإشعاعية البيولوجية ، بما في ذلك متوسط الجرعة المميتة (D0) ، والجرعة شبه العتبة (Dq) ، ورقم الاستقراء (N) ، وجزء البقاء على قيد الحياة بجرعة تشعيع تبلغ 2 Gy (SF2) ، ونسبة تعزيز التحسس (D0) (SER = D0 في المجموعة الضابطة / D0 في المجموعة التجريبية) ، و SER (Dq) (SER = Dq في المجموعة الضابطة / Dq في المجموعة التجريبية) لتقييم تأثير HBO على الحساسية الإشعاعية لخلايا الورم الدبقي U251.
حيث D0 = القيمة المتبادلة لمنحدر الجزء الخطي من منحنى البقاء على قيد الحياة (الجرعة التي تقلل معدل البقاء على قيد الحياة بنسبة 63٪)
N = قيمة نقطة التقاطع التي تشكلت عن طريق استقراء الجزء الخطي لتلبية الإحداثي (مما يعكس القدرة الخلوية على إصلاح الضرر الناجم عن الإشعاع)
Dq = قيمة نقطة التقاطع الإسقاطية على الابسيسا والتقاطع المتكون عن طريق رسم خط من خلال 1.0 عند الإحداثي والموازي للخراج لتلبية خط الاستقراء.
4. مقايسة عد الخلايا لتقييم تكاثر خلايا الورم الدبقي U251
- قم بتعيين مجموعة تحكم ومجموعة HBO ومجموعات معالجة بالأشعة السينية (0 Gy ، 2 Gy ، 4 Gy ، 6 Gy ، 8 Gy) بمفردها أو جنبا إلى جنب مع HBO.
- اضبط كثافة الخلية على 1 × 104 خلايا / مل باستخدام خلايا U251 في معلقات أحادية الخلية.
- قم بزرع معلقات الخلية (100 ميكرولتر ، الكثافة: 1 × 103 / بئر) في ألواح 96 بئرا (خمسة آبار لكل مجموعة). قم بإجراء مقايسة عد الخلايا (انظر جدول المواد) ، ثم حدد الكثافة الضوئية (OD) عند 450 نانومتر باستخدام قارئ صفيحة دقيقة بعد 48 ساعة من الثقافة مع الكاشف.
- احسب معدل تثبيط تكاثر الخلايا (IR) وفقا للمعادلة (3):
الأشعة تحت الحمراء = × 100٪ (3)
× 100٪ (3)
5. الكشف عن موت الخلايا المبرمج لخلايا الورم الدبقي U251
- اضبط التحكم و HBO والأشعة السينية (2 Gy) و HBO جنبا إلى جنب مع مجموعات الأشعة السينية (2 Gy).
- قم بإزالة الوسيط بعد الثقافة وغسل الخلايا باستخدام 1x PBS.
- افصل الخلايا باستخدام التربسين ثم قم بإلغاء تنشيط التربسين عن طريق إضافة DMEM عند ملاحظة مورفولوجيا الخلية المستديرة تحت المجهر.
- انقل الخلايا إلى أنبوب الطرد المركزي وجهاز الطرد المركزي لمدة 5 دقائق عند 200 × جم.
- تخلص من المادة الطافية ، وأضف 3 مل من 1x PBS إلى الحبيبات ، وقم بالماصة برفق لإعادة تعليق الخلايا.
- الطرد المركزي للخلايا مرة أخرى عند 200 × جم لمدة 5 دقائق. بعد ذلك ، قم بشفط PBS الطافي واغسل الخلايا 2x قبل تعليقها بسحب لطيف في 50 ميكرولتر من Binding Buffer.
- أضف 5 ميكرولتر من الملحق V-FITC إلى الخلايا عند 4 درجات مئوية واحتضان الخلايا في الظلام عند 4 درجات مئوية لمدة 15 دقيقة قبل إضافة 400 ميكرولتر من المخزن المؤقت للربط. انقل الخليط إلى أنبوب قياس التدفق الخلوي الذي يحتوي على 5 ميكرولتر من محلول صبغة يوديد البروبيديوم (PI) (10 مجم / مل). اكتشف الخلايا المبرمجة بعد 5 دقائق عن طريق قياس التدفقالخلوي 11.
- سجل التألق الأحمر عند موجة الإثارة 488 نانومتر ، وأدخلها في جهاز كمبيوتر لتحليل النسبة المئوية لكل دورة خلية في 5000 خلية ، ثم اطبع قمم الخلايا المبرمجة.
- اجمع التألق الأحمر والأخضر عن طريق وضع العلامات المزدوجة على الملحق V و PI ، وأدخلها في الكمبيوتر لتحليلها ، ثم اطبع المخطط النقطي.
6. الكشف عن توزيع دورة خلية الورم الدبقي U251
- اغسل الخلايا المذكورة أعلاه 2x مع 1 مل من PBS قبل معالجتها بالتربسين.
- عندما يتم الكشف عن مورفولوجيا الخلية المستديرة بواسطة الفحص المجهري الضوئي ، أضف DMEM الذي يحتوي على 10٪ FBS.
- الطرد المركزي للخلايا لمدة 5 دقائق عند 200 × جم في درجة حرارة الغرفة.
- قم بإزالة المادة الطافية وأعد تعليق هذه الخلايا في 1 مل من PBS قبل إضافة محلول الإيثانول المبرد مسبقا بنسبة 75٪.
- احتضان الخليط لمدة 4 ساعات على الأقل أو طوال الليل عند -20 درجة مئوية.
- اغسل الخلايا 2x باستخدام PBS المثلج و 180 ميكرولتر من EDTA (0.1 ملي مولار ، 3.7 مجم من EDTA + 100 مل من PBS) ، 20 ميكرولتر من RNase A (10 مجم / مل) ، 35 ميكرولتر من Triton X-100 (2٪ ، 2 مل من Triton + 98 مل من FBS) ، و 96.5 ميكرولتر من PBS. ثم أضف 17.5 ميكرولتر من محلول PI (1 مجم / مل).
- احتضن الخليط على حرارة 4 درجات مئوية في الظلام لمدة 10 دقائق.
- اغسل الخلايا في 200 ميكرولتر من PBS ، ثم ضعها في مقياس التدفق الخلوي لتقييم توزيع دورة الخلية ، كما هو موضحسابقا 12.
- قم بتشغيل مقياس التدفق الخلوي في وضع الإثارة بالليزر المزدوج ، والفضاء ثلاثي الأبعاد ، مع حجم بقعة 22 ميكرومتر × 66 ميكرومتر و 13 ميكرومتر × 66 ميكرومتر. استخدم غرفة تدفق تبلغ 430 ميكرومتر × 180 ميكرومتر ، وطيف 300-1,100 نانومتر ، وقابلية اكتشاف ≤100 MESF ، ودقة CV <2٪. بعد ذلك ، قم بتعريض الخلايا لضوء الإثارة 488 نانومتر واكتشاف وقياس إشارات التألق باستخدام برنامج أداة لتحديد توزيع دورة الخلية13.
- حدد محتوى الحمض النووي ، ثم وفقا لمحتوى الحمض النووي ، قم بتحليل دورة الخلية.
7. التحليل الإحصائي
- إجراء التحليلات الإحصائية.
- اعرض البيانات كمتوسط ± انحراف معياري.
- استخدم اختبار t الخاص بالطالب لمقارنة المجموعات ، مع تعيين الدلالة الإحصائية على أنها P < 0.05.
النتائج
مزرعة خلايا الورم الدبقي U251
كان لخلايا الورم الدبقي U251 شكل مغزلي بعد 24 ساعة إلى 48 ساعة من الزراعة في DMEM وكانت ملتزمة. تم استخدام هذه الخلايا لمزيد من الدراسة (الشكل 1).
مورفولوجيا خلايا الورم الدبقي وعددها
كان عدد الخلايا لخلايا الورم الدبقي U251 في HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) أقل بكثير من تلك الخاصة بمجموعة الأشعة السينية (2 Gy) بعد 24 ساعة و 48 ساعة و 72 ساعة من زراعة الخلايا (كل P < 0.05) (الجدول 1). عند استزراعها لمدة 24 ساعة ، نمت خلايا U251 غير المعالجة في المجموعة الضابطة بشكل جيد مع مورفولوجيا طويلة على شكل مغزل. في مجموعة الأشعة السينية (2 Gy) ، انخفضت كثافة خلايا U251 ، مع ظهور عدد قليل من الخلايا الميتة العالقة. في HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) ، انخفضت كثافة الخلايا ، وكان هناك المزيد من الخلايا الميتة العالقة. عند استزراعها لمدة 48 ساعة ، انخفضت كثافة الخلايا باستمرار في الأشعة السينية (2 غراي) و HBO جنبا إلى جنب مع مجموعات الأشعة السينية (2 غراي) ، بينما زادت الكثافة للمجموعة الضابطة. عند استزراعها لمدة 72 ساعة ، انخفضت كثافة الخلايا بشكل أكبر في مجموعة الأشعة السينية (2 Gy) ، وخاصة HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) (الشكل 2).
آثار علاج HBO على الحساسية الإشعاعية لخلايا الورم الدبقي U251
انخفض SF الجرعة اعتمادا على زيادة جرعة الإشعاع (0 Gy و 2 Gy و 4 Gy و 6 Gy و 8 Gy) في الأشعة السينية و HBO جنبا إلى جنب مع مجموعات الأشعة السينية. كان SF أقل بشكل ملحوظ في HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعة الأشعة السينية لجميع جرعات الإشعاع المختبرة (جميع P < 0.05) (الجدول 2). تظهر هذه النتائج معا أن علاج HBO زاد من الحساسية الإشعاعية لخلايا الورم الدبقي U251.
ارتبطت D0 و Dq و N و SF2 عكسيا بالحساسية الإشعاعية وكانت أقل في HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعة الأشعة السينية لخلايا U251. توضح هذه النتائج أن HBO زاد من الحساسية الإشعاعية لخلايا الورم الدبقي U251 (الجدول 3).
آثار علاج HBO على التثبيط الناجم عن الإشعاع لتكاثر خلايا الورم الدبقي U251
مع زيادة جرعة الإشعاع (0 Gy و 2 Gy و 4 Gy و 6 Gy و 8 Gy) ، زاد تثبيط تكاثر الخلايا تدريجيا لكل من مجموعات الأشعة السينية وتلك التي تلقت HBO جنبا إلى جنب مع الأشعة السينية. تم تثبيط معدل الانتشار بشكل كبير بالنسبة ل HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعة الأشعة السينية فقط في جميع جرعات الإشعاع المختبرة (كل P < 0.05). تشير هذه النتائج إلى أن HBO عزز التأثير المثبط لإشعاع الأشعة السينية على تكاثر خلايا الورم الدبقي U251 (الجدول 4).
تأثير HBO على توزيع دورة خلايا الورم الدبقي U251 وموت الخلايا المبرمج
كانت النسبة المئوية للخلايا في مرحلة G2 / M من دورة الخلية أعلى بشكل ملحوظ بالنسبة ل HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) (26.70٪ ± 2.46٪) ومجموعة HBO (22.36٪ ± 0.91٪) مقارنة بالمجموعة الضابطة (11.56٪ ± 2.01٪) ومجموعة الأشعة السينية (2 Gy) (10.35٪ ± 2.69٪) (كل P < 0.05). ومع ذلك ، لم تكن هناك فروق ذات دلالة إحصائية في النسبة المئوية لخلايا الطور G2 / M بين المجموعة الضابطة ومجموعة الأشعة السينية (2 Gy) فقط أو بين مجموعة HBO و HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) (كل P > 0.05) (الجدول 5 ، الشكل 3 ، والشكل 4). وبالتالي ، من المحتمل أن تكون HBO قد ألقت القبض على خلايا الورم الدبقي U251 في مرحلة G2 / M لتعزيز تزامن دورة خلية الورم الدبقي U251.
كان عدد خلايا موت الخلايا المبرمج U251 أعلى بكثير في مجموعات HBO والأشعة السينية (2 Gy) من المجموعة الضابطة (كل P < 0.05) وفي HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) مقارنة بمجموعات HBO والأشعة السينية (2 Gy) ومجموعات التحكم (جميع P < 0.05) (الشكل 5 والجدول 5). من النتائج المذكورة أعلاه ، بدا أن كلا من HBO والأشعة السينية تحفز موت الخلايا المبرمج لخلايا U251 ، لكن قدرة HBO جنبا إلى جنب مع الأشعة السينية على إحداث موت الخلايا المبرمج لخلايا U251 كانت أكثر وضوحا.

الشكل 1: مورفولوجيا خلية الورم الدبقي U251. (أ) خلايا U251 (20x) ؛ (ب) خلايا الورم الدبقي U251 (100x). شريط المقياس = 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: مورفولوجيا الخلايا في المجموعات المختلفة بعد 24 ساعة و 48 ساعة و 72 ساعة بعد زراعة الخلايا. المجموعة الضابطة ، 20x ؛ HBO جنبا إلى جنب مع الأشعة السينية ، 20x ؛ الأشعة السينية (2 غراي) ، 20x ؛ مجموعة HBO ، 100x. الاختصارات: HBO = الأكسجين عالي الضغط. شريط المقياس = 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
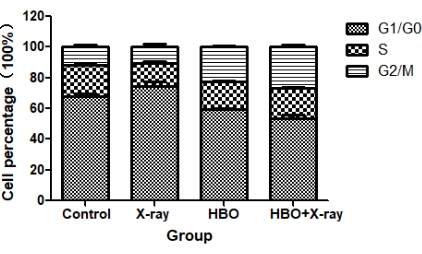
الشكل 3: توزيع دورة خلية الورم الدبقي U251 في كل مجموعة (ن = 3). اختصار: HBO = الأكسجين عالي الضغط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: توزيع دورة خلية الورم الدبقي U251 في كل مجموعة (ن = 3). (أ) مجموعة HBO. (ب) مجموعة الأشعة السينية (2 غراي)؛ (ج) HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) ؛ (د) المجموعة الضابطة. الاختصارات: HBO = الأكسجين عالي الضغط ؛ PE-A = منطقة ذروة phycoerythrin. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: موت الخلايا المبرمج لخلايا الورم الدبقي U251 في كل مجموعة (ن = 3). (أ) مجموعة الأشعة السينية (2 غراي) ؛ (ب) المجموعة الضابطة؛ (ج) HBO جنبا إلى جنب مع مجموعة الأشعة السينية (2 Gy) ؛ (د) مجموعة HBO. الاختصارات: HBO = الأكسجين عالي الضغط ؛ PE-A = منطقة ذروة phycoerythrin; FITC-A = منطقة ذروة الفلورسينات إيزوثيوسيانات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| (× ̄ ± ق) (ن = 3) × 106 | |||
| المجموعات | 24 ساعة | 48 ساعة | 72 ساعة |
| المجموعة الضابطة | 2.03±0.17 | 3.27±0.21 | 5.94±0.16 |
| HBO مدمجة مع الأشعة السينية | 1.04±0.13 | 0.36±0.06 | 0.08±0.04 |
| الأشعة السينية | 1.94±0.09 | 0.79±0.09 | 0.43±0.10 |
| التعليم المهني العالي | 2.34±0.10 | 3.50±0.12 | 6.00±0.15 |
| P | 0.017 | 0.03 | 0.013 |
الجدول 1: عدد خلايا U251 لكل مجموعة. عدد الخلايا هو 1 × 106. P مخصص ل HBO جنبا إلى جنب مع الأشعة السينية (2 غراي) مقابل الأشعة السينية (2 غراي). اختصار: HBO = الأكسجين عالي الضغط.
| (× ̄ ± ق) (ن = 3) | |||||
| المجموعات | 0 غراي | 2 غراي | 4 غراي | 6 غراي | 8 غراي |
| الأشعة السينية | 1 | 0.66 | 0.424 | 0.301 | 0.075 |
| HBO مدمجة مع الأشعة السينية | 0.75 | 0.319 | 0.235 | 0.109 | 0.019 |
| P | 0.019 | 0.019 | 0.031 | 0.04 | 0.036 |
الجدول 2: جزء بقاء الخلية U251 لكل مجموعة. اختصار: HBO = الأكسجين عالي الضغط.
| (ن = 3) | ||||||
| العناصر | د0 (جي) | دي كيو (جي) | N | SF2 | SER (D0) | SER (Dq) |
| المجموعات | ||||||
| الأشعة السينية | 4.01 | 2.305 | 1.314 | 0.66 | ---- ---- | ---- ---- |
| HBO مدمجة مع الأشعة السينية | 2.64 | 1.143 | 0.436 | 0.319 | 1.52 | 2.02 |
الجدول 3: المعلمات البيولوجية الإشعاعية لخلايا U251 في الأشعة السينية و HBO جنبا إلى جنب مع مجموعات الأشعة السينية. ن = 3. الاختصارات: HBO = الأكسجين عالي الضغط ؛ D0 = متوسط الجرعة المميتة; Dq = جرعة شبه عتبة ؛ N = رقم الاستقراء ؛ SF2 = جزء البقاء على قيد الحياة بجرعة تشعيع قدرها 2 غراي. SER = نسبة تعزيز التحسية؛ SER (D0) = D0 في المجموعة الضابطة / D0 في المجموعة التجريبية ؛ SER (Dq) = Dq في المجموعة الضابطة / Dq في المجموعة التجريبية.
| (ن = 5) | |||||
| المجموعات | 0 غراي | 2 غراي | 4 غراي | 6 غراي | 8 غراي |
| الأشعة السينية | 0 | 0.1026 | 0.153 | 0.2157 | 0.2327 |
| HBO مدمجة مع الأشعة السينية | 0.0189 | 0.2039 | 0.2622 | 0.3143 | 0.336 |
| P | 0.045 | 0.018 | 0.026 | 0.02 | 0.015 |
الجدول 4: تثبيط تكاثر خلايا الورم الدبقي U251 في كل مجموعة. ن = 5. اختصار: HBO = الأكسجين عالي الضغط.
| دورات | ز1 / ز0 | S | G2 / م | موت الخلايا المبرمج |
| المجموعات | ||||
| التعليم المهني العالي | 59.23±1.46 | 18.41±0.54 | 22.36±0.91* # | 10.25±4.48*& |
| الأشعة السينية | 74.77±4.14 | 14.89±1.45* | 10.35±2.69 | 12.31±5.39*& |
| HBO مدمجة مع الأشعة السينية | 53.60±3.23 | 19.72±0.76 | 26.70±2.46* # | 28.89±8.78* |
| تحكم | 67.96±2.41 | 20.49±0.40 | 11.56±2.01 | 5.21±2.03& |
الجدول 5: توزيع دورة الخلية وموت الخلايا المبرمج لخلايا U251 في كل مجموعة. ن = 3 ، ٪. الاختصارات: HBO = الأكسجين عالي الضغط. * يشير إلى P < 0.05 مقارنة بالمجموعة الضابطة. # يشير إلى P < 0.05 مقارنة بمجموعة الأشعة السينية. & يشير إلى P < 0.05 مقارنة ب HBO جنبا إلى جنب مع الأشعة السينية.
Discussion
يعد خط خلايا الورم الدبقي U251 أحد أكثر خطوط خلايا الورم الدبقي البشري كلاسيكيا ويستخدم على نطاق واسع كنموذج للورم الدبقي في العديد من الدراسات.
آثار HBO على تكاثر خلايا الورم الدبقي U251
يشير HBO عادة إلى استنشاق الأكسجين النقي (تركيز الأكسجين بنسبة 100٪) في غرفة محكمة الغلق بضغط أعلى بمقدار 1.5-3 أضعاف من الضغط الجوي العادي ، مما قد يزيد من محتوى الأكسجين في بلازما الأوعية الدموية الدقيقة14. بالنسبة للمرضى الذين يعانون من الورم الدبقي ، تم الإبلاغ عن الجمع بين العلاج الإشعاعي أو العلاج الكيميائي مع HBO لزيادة الفعالية السريرية لهذه العلاجات. في الأطفال أو الشباب المصابين بأورام الجهاز العصبي المركزي ، يمكن أن يؤدي HBO جنبا إلى جنب مع العلاج الإشعاعي إلى تحسين الأعراض السريرية ونتائج تصوير الورم. على الرغم من أن تطبيق HBO آمن6 ، إلا أن هناك ججلا كبيرا حول تأثيرات HBO وحدها على نمو الورم الدبقي الخبيث. أظهر Ding et al.7 أن HBO يثبط موت الخلايا المبرمج ويزيد من كثافة الأوعية الدموية الدقيقة في أنسجة الورم من خلال تعزيز التعبير عن عامل النمو البطاني الوعائي والعامل المحفز لنقص الأكسجة -1a ، مما يشير إلى أن HBO النقي لن يكون مفيدا لعلاج الورم الدبقي. تم الإبلاغ عن أن HBO يعزز نمو خلايا الورم الدبقي في نموذج الفئران من الورم الدبقي8 ويعزز تكوين الأوعية الدموية للورم عن طريق إحداث الإجهاد التأكسدي في ظل الظروف الفسيولوجية9. يعزز التعرض قصير المدى ل HBO تكاثر الخلايا السرطانية ، بينما يمنع التعرض المطول تكاثر الخلايا السرطانية10. يمنع HBO موت الخلايا المبرمج ويقلل من كثافة الأوعية الدموية الدقيقة للورم في الأورام الدبقية المزروعة تحت الجلد. ومع ذلك ، لا تظهر هذه التأثيرات في الورم الدبقي المزروع داخل الجمجمة15،16. أظهرت هذه الدراسة أن تثبيط معدل تكاثر الخلايا كان أعلى بشكل ملحوظ بالنسبة ل HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعة الأشعة السينية في كل جرعة (كل P < 0.05) ، وكذلك لمجموعة HBO مقارنة بالمجموعة الضابطة (P < 0.05). تشير هذه النتيجة إلى أن HBO يمكن أن يعزز التأثير المثبط للأشعة السينية على تكاثر خلايا الورم الدبقي U251 وأن HBO وحده لا يعزز تكاثر خلايا الورم الدبقي هذه. قد يرتبط تأثير HBO على نمو الورم بمجموعة متنوعة من العوامل ، مثل موقع الورم وحالة التمايز ، بالإضافة إلى ضغط HBO ومدة HBO. في هذه الدراسة ، تم استخدام HBO عند 0.2 ميجا باسكال (2.0 ATA) لمدة 90 دقيقة ، وتكرر علاج HBO ثلاث مرات. ستتطلب العلاقات بين مدة HBO وتواترها وضغطها مع تكاثر خلايا الورم الدبقي U251 مزيدا من التحقيق. أشارت هذه النتائج إلى أنه مع زيادة جرعة الإشعاع (0 Gy و 2 Gy و 4 Gy و 6 Gy و 8 Gy) ، زاد تثبيط تكاثر الخلايا تدريجيا في مجموعات الأشعة السينية و HBO جنبا إلى جنب مع مجموعات الأشعة السينية ، وكان معدل الانتشار أقل بشكل ملحوظ بالنسبة ل HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعة الأشعة السينية لكل جرعة إشعاعية. توضح هذه النتيجة أن HBO يمكن أن يعزز التأثير المثبط للأشعة السينية على تكاثر خلايا الورم الدبقي U251.
يمكن أن ينتج العلاج الإشعاعي أنواع الأكسجين التفاعلية (ROS) التي تسبب تلف الحمض النووي في الخلايا السرطانية. ومع ذلك ، فإن نقص الأكسجة في أنسجة الورم يقلل بشكل مباشر من إنتاج أنواع الأكسجين التفاعلية ، مما قد يقلل من التأثير العلاجي للعلاج الإشعاعي على الخلايا السرطانية. في البيئة المكروية لفقدان الأكسجين ، من المحتمل أن ترتبط الخلايا السرطانية بذرات الهيدروجين من مركبات السلفهيدريل ، وهذا الارتباط يحيد الجذور الحرة الناتجة عن الإشعاع المؤين ويقلل من إصابة الحمض النووي للخلايا السرطانية. ومع ذلك ، في بيئة غنية بالأكسجين ، تتأكسد الجذور الحرة الناتجة عن الإشعاع المؤين بسرعة وقادرة على إتلاف الحمض النووي للخلايا السرطانية. قد تكون هذه هي الآلية المحتملة التي يمكن من خلالها ل HBO تعزيز التأثير المثبط للأشعة السينية على تكاثر خلايا الورم الدبقي U251.
تأثير HBO على الحساسية الإشعاعية لخلايا الورم الدبقي U251
مقايسة تكوين الاستنساخ بسيطة ومناسبة للخلايا الملتصقة. يعد تحضير معلقات الخلايا وكثافة التلقيح أمرا مهما لهذا الفحص. يجب أن تكون الخلايا مشتتة جيدا بدون مجموعات الخلايا ، ويجب ألا تكون كثافة التلقيح عالية جدا. يتمثل الحد من مقايسة تكوين الاستنساخ هذه في أنه يمكن فحص الخلايا الملتصقة فقط لتأثيرات HBO على الانتشار.
في هذه الدراسة ، كان SF أقل بكثير لمجموعة HBO (0.750 ± 0.023) من المجموعة الضابطة (1.000 ± 0.000) (P = 0.019) ، مما يدل على أن HBO لا يعزز نمو خلايا الورم الدبقي U251. تتوافق هذه النتيجة مع تلك الخاصة بفحص عد الخلايا. مع زيادة جرعة الإشعاع (0 Gy و 2 Gy و 4 Gy و 6 Gy و 8 Gy) ، انخفض SF تدريجيا وكان أقل بكثير ل HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعة الأشعة السينية في كل جرعة إشعاع (كل P < 0.05) ، مما يدل على أن الحساسية الإشعاعية لخلايا الورم الدبقي U251 زادت بعد علاج HBO. بالإضافة إلى ذلك ، أشارت منحنيات البقاء على قيد الحياة لخلايا الورم الدبقي U251 ، بالإضافة إلى جميع المعلمات البيولوجية الإشعاعية ، إلى أن SF2 و D0 و Dq كانت أقل بكثير بالنسبة ل HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعة الأشعة السينية ، مما يشير إلى أن HBO يمكن أن يحسن الحساسية الإشعاعية لخلايا الورم الدبقي. يقال إن SF2 يرتبط ارتباطا وثيقا بمعدل بقاء الورم بعد العلاج الإشعاعي لمدة عامين ، ومعدل التحكم المحلي ، ومعدل التكرار17،18،19.
آثار HBO على دورة خلايا الورم الدبقي U251 وموت الخلايا المبرمج
تختلف خصائص الحمض النووي بين مراحل دورة الخلية. على سبيل المثال ، الحمض النووي الخلوي هو 2N في مرحلة G0 / G1 و 4N في مرحلة G2 / M. يمكن أن يرتبط يوديد البروبيديوم (PI) بالحمض النووي ، وتعكس شدة التألق للمركب بشكل مباشر حالة الحمض النووي داخل الخلايا. لذلك ، يمكن استخدام قياس التدفق الخلوي وتلوين PI للكشف عن دورة الخلية. مفتاح هذه التقنية التجريبية هو زيادة نفاذية الأغشية الخلوية التي تقلل من التصاق الخلايا. في الخلايا المعالجة بالإيثانول و Triton X-100 و EDTA ، يجب أن يصل التركيز النهائي ل PI إلى 50 ميكروغرام / مل للسماح بالكشف الدقيق عن توزيع دورة الخلية.
تتكون دورة الخلية من مراحل G0 / G1 و S و G2 / M ، والتي تلعب دورا مهما في تنظيم نمو الخلايا السرطانية. المرحلة G0 / G1 هي المرحلة التحضيرية لتخليق الحمض النووي أو المرحلة الأولى من تكاثر الخلايا ، في حين أن المرحلة S هي المرحلة النشطة من تكاثر الخلايا التي يكتمل فيها تكرار الحمض النووي. مرحلة G2 / M هي المرحلة التي يتم فيها توزيع المادة الوراثية وتشكل خلايا ابنة جديدة. يمكن لأي عامل يمنع مرحلة معينة من دورة الخلية أن يحفز التزامن الخلوي ، وبالتالي زيادة نسبية في نسبة الخلايا في مرحلةمعينة 20. الخلايا في مراحل دورة الخلية المختلفة لها حساسية إشعاعية مختلفة. على سبيل المثال ، تظهر الخلايا في المرحلة المبكرة G1 عداء إشعاعي ، في حين أن الخلايا في مرحلة G1 / S لديها حساسية إشعاعية مرتفعة قليلا. تتمتع الخلايا في المرحلة S بارتفاع معتدل من الحساسية الإشعاعية ، وتتمتع خلايا الطور G2 / M بأعلى حساسية إشعاعية. أظهرت هذه الدراسة أن النسبة المئوية لخلايا الطور G2 / M كانت أعلى بشكل ملحوظ في HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعات الأشعة السينية والتحكم فيها. ومع ذلك ، لم يكن هناك فرق كبير في النسبة المئوية لخلايا الطور G2 / M بين HBO و HBO جنبا إلى جنب مع مجموعات الأشعة السينية ، مما يشير إلى أن HBO يمكن أن يتسبب في توقف خلايا الورم الدبقي U251 في مرحلة G2 / M. يتوافق هذا الاستنتاج مع النتائج التي أبلغ عنها Kalns و Piepmeier21. لذلك ، فإن تزامن دورة الخلية في مرحلة G2 / M لا يمنع تكاثر الخلايا السرطانية فحسب ، بل يزيد أيضا من حساسية الخلايا السرطانية للعلاج الإشعاعي.
يلعب موت الخلايا المبرمج دورا مهما في نمو الأجنة البشرية وإصلاح الأنسجة واستقرار البيئة الداخلية. أظهرت هذه الدراسة أن موت الخلايا المبرمج لخلايا U251 كان أعلى بشكل ملحوظ لمجموعات HBO والأشعة السينية من المجموعة الضابطة ، وكذلك بالنسبة ل HBO جنبا إلى جنب مع مجموعة الأشعة السينية مقارنة بمجموعات HBO والأشعة السينية والتحكم ، مما يشير إلى أن HBO والأشعة السينية معا قد يحفزان موت الخلايا المبرمج لخلايا U251 وأن HBO يمكن أن يعزز موت الخلايا المبرمج الناجم عن الأشعة السينية. يرتبط موت الخلايا المبرمج ارتباطا وثيقا بنمو الورم وتطوره. تم الإبلاغ عن كل من الأشعة السينية و HBO للحث على موت الخلايا المبرمج للخلاياالسرطانية 10،15،16 ، وهو ما يتوافق مع نتائج هذه الدراسة. قد يعزز HBO موت الخلايا المبرمج عن طريق تنظيم التعبير عن الجينات المرتبطة بموت الخلايا المبرمج مثل هيدرولاز بروتين الأسبارتات (كاسباز) ، وسرطان الغدد الليمفاوية للخلايا البائية -2 (Bcl-2) ، وسرطان الغدد الليمفاوية B (Bax) 22. تلعب بروتينات عائلة الجينات Bcl-2 دورا مهما في تنظيم الحساسية الإشعاعية للورم. على سبيل المثال ، يمكن أن يؤدي التعبير الجيني المتزايد ل Bcl-2 إلى معاداة موت الخلايا المبرمج الناجم عن الإشعاع ، بينما يمكن أن يؤدي الإفراط في التعبير عن جين Bax إلى تعزيز الحساسية الإشعاعية للورم23،24. يمكن ل HBO تحسين الحساسية الإشعاعية للورم عن طريق تقليل تنظيم تعبير Bcl-2 و Bcl-xl مع تنظيم تعبير Bax25،26.
باختصار ، يمكن استخدام HBO لعلاج الورم الدبقي لأنه يمكن أن يعزز موت الخلايا المبرمج وتثبيط الانتشار والحساسية الإشعاعية لخلايا الورم الدبقي U251 عن طريق منع الخلايا في مرحلة G2 / M. ومع ذلك ، هناك حاجة إلى مزيد من الدراسة لتوصيف الآليات الجزيئية المتضمنة في قدرة HBO على تعزيز الحساسية الإشعاعية لخلايا الورم الدبقي والحث على موت الخلايا المبرمج.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
اي.
Materials
| Name | Company | Catalog Number | Comments |
| Binding Buffer | Dickinson and Company | RH10 9RR | |
| CCK-8 test kit | DOJINDO | NJ | Cell counting assay |
| CELL FIT | cell cycle analysis (DNA content) | ||
| CELLQUEST | apoptotic cell analysis | ||
| DMEM and Annexin V-FITC | Gibco BRL | ||
| flow cytometer | Dickinson | ||
| Glioma U251 and U87 cell line | Shanghai Institute of Cell Biology | ||
| hyperbaric oxygen chamber | Hongyuan Institute | ||
| medical linear accelerator | Elekta Limited Company | ||
| microplate reader | |||
| MOD FITLT formac v1.01 | cell analysis--cell cycle phase | ||
| trypsin | Hyclone Laboratories Inc |
References
- Louis, D. N., et al. The 2016 World Health Organization Classification the Central Nervous System: A summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Sun, M. Z., et al. Survival impact of time to initiation of chemoradiotherapy after resection of newly diagnosed glioblastoma. Journal of Neurosurgery. 122 (5), 1144-1150 (2015).
- Hegi, M. E., et al. MGMT gene silencing and benefit from temoozolomide in glioblastoma. New England Journal of Medicine. 352 (10), 997-1003 (2005).
- Zhu, Y., et al. Involvement of decreased hypoxia-inducible factor 1 activity and resultant G1-S cell cycle transition in radioresistance of perinecrotic tumor cells. Oncogene. 32 (16), 2058-2068 (2013).
- Kohshi, K., et al. Potential roles of hyperbaric oxygenation in the treatments of brain tumors. Undersea and Hyperbaric Medicine. 40 (4), 351-362 (2013).
- Aghajan, Y., Grover, I., Gorsi, H., Tumblin, M., Crawford, J. R. Use of hyperbaric oxygen therapy in pediatric neuro-oncology: a single institutional experience. Journal Neurooncology. 141 (1), 151-158 (2019).
- Ding, J. B., Chen, J. R., Xu, H. Z., Qin, Z. Y. Effect of hyperbaric oxygen on the growth of intracranial glioma in rats. Chinese Medical Journal. 128 (23), 3197-3203 (2015).
- Wang, Y. G., et al. Hyperbaric oxygen promotes malignant glioma cell growth and inhibits cell apoptosis. Oncology Letters. 10 (1), 189-195 (2015).
- Milovanova, T. N., et al. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. Journal of Applied Physiology. 106 (2), 711-728 (2009).
- Conconi, M. T., et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line. Journal of Investigative Medicine. 51 (4), 227-232 (2003).
- Vermes, I., Haanen, C., Steffiens-Nakken, H., Reutellingsperger, C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. Journal of Immunological Methods. 184 (1), 39-51 (1995).
- Cui, W., Niu, F. -. L., He, L. -. Y., W, S. -. R. Comparison of two softwares for analysing apoptosis with flow cytometry. Journal of Beijing University of Traditional Chinese Medicine. 24 (6), 45-47 (2001).
- Cecchini, M. J., Amiri, M., Dick, F. A. Analysis of cell cycle position in mammalian cells. Journal of Visualized Experiments. (59), e3491 (2012).
- Resanovic, I., et al. Effects of hyperbaric oxygen on inducible nitric oxide synthase activity/expression in lymphocytes of type 1 diabetes patients: A prospective pilot study. International Journal of Endocrinology. 2019, 2328505 (2019).
- Stuhr, L. E., et al. Hyperoxia retards growth and induces apoptosis, changes in vascular density and gene expression in transplanted gliomas in nude rats. Journal of Neuro-Oncology. 85 (2), 191-202 (2007).
- Biollaz, G., et al. Site-specific anti-tumor immunity: differences in DC function, TGF-beta production and numbers of intratumoral Foxp3+ Treg. European Journal of Immunology. 39 (5), 1323-1333 (2009).
- McKenna, F. W., Ahmad, S. Fitting techniques of cell survival curves in high-dose region for use in stereotactic body radiation therapy. Physics in Medicine and Biology. 54 (6), 1593-1608 (2009).
- Malaise, E. P., Lambin, P., Joiner, M. C. Radiosensitivity of human cell lines to small doses. Are there some clinical implications. Radiation Research. 138, S25-S27 (1994).
- Björk-Eriksson, T., West, C., Karlsson, E., Mercke, C. Tumor radiosensitivity (SF2) is a prognostic factor for local control in head and neck cancers. International Journal of Radiation Oncology Biology Physics. 46 (1), 13-19 (2000).
- Bromfield, G. P., Meng, A., Warde, P., Bristow, R. G. Cell death in irradiated prostate epithelial cells: Role of apoptotic and clonogenic cell kill. Prostate Cancer and Prostatic Diseases. 6 (1), 73-85 (2003).
- Kalns, J. E., Piepmeier, E. H. Exposure to hyperbaric oxygen induces cell cycle perturbation in prostate cancer cells. In Vitro Cellular & Developmental Biology - Animal. 35 (2), 98-101 (1999).
- Lakka, S. S., et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene. 23 (27), 4681-4689 (2004).
- Li, S., Shi, D., Zhang, L., Yang, F., Cheng, G. Oridonin enhances the radiosensitivity of lung cancer cells by upregulating Bax and downregulating Bcl-2. Experimental and Therapeutic Medicine. 16 (6), 4859-4864 (2018).
- Campbell, K. J., Tait, S. W. G. Targeting BCL-2 regulated apoptosis in cancer. Open Biology. 8 (5), 180002 (2018).
- Rengarajan, T., et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB. Asian Pacific Journal of Cancer Prevention. 15 (4), 1757-1762 (2014).
- Shinagawa, A., et al. The potent peptide antagonist to angiogenesis, C16Y and cisplatin act synergistically in the down-regulation of the Bcl-2/Bax ratio and the induction of apoptosis in human ovarian cancer cells. International Journal of Radiation Oncology Biology Physics. 39 (6), 135-164 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved