Method Article
Karaciğer Tümöründe İpek İplik Kılavuzluğunda Laparoskopik Segmentektomi ile Üç Boyutlu Konum Yaklaşımı
Bu Makalede
Özet
Karaciğer rezeksiyonları için preoperatif planlamada 3D rekonstrüksiyon ve sanal simülasyonların kullanılması, cerrahi onkolojide önemli bir ilerlemeyi temsil etmektedir. Ekibimizin 3D-LAST (ipek iplikle üç boyutlu konum yaklaşımı) tekniği, pratik intraoperatif navigasyon ile güvenli, verimli, hassas tümör çıkarılması sağlar ve geniş tıbbi benimseme vaat eder.
Özet
Karaciğer tümörlerini tedavi etmek için hepatektomi yapılırken, rezeksiyon sınırının doğru belirlenmesi ve rezidüel karaciğer parankiminin yeterliliğinin sağlanması son derece önemlidir. Günümüzde intraoperatif ultrason ve indosiyanin yeşili floresan navigasyon sıklıkla kullanılan yöntemlerdir. Bununla birlikte, bazı teknik kısıtlamalar, kapsamlı uygulamalarını engellemektedir. Hassas karaciğer tümörü rezeksiyonu için 3D-LAST tekniğini geliştirdik. Bu teknik, bilgisayarlı tomografi (BT) taramalarından özellikleri çıkarmak ve hacimsel görüntüler oluşturmak için üç boyutlu (3D) görselleştirmeler oluşturmak için bilgisayar son işlemeyi kullanır. Bu, karmaşık iç anatomik yapıları sezgisel ve stereoskopik bir şekilde canlı bir şekilde görüntüleyebildiği için klinik karar verme için değerli bir kaynak sağlar. Bu çalışmada, tek karaciğer tümörü olan hastalarda anatomik işaretleri belirlemek ve rezeksiyon aralığını hesaplamak için ameliyat öncesi 3 boyutlu konumlandırma yapıldı. Cerrahi işlem sırasında, ameliyat öncesi 3D yazılım ile hesaplanan uzunluklarda kenar çizgileri oluşturuldu ve kenarları işaretlemek için ipek iplik kullanıldı. Bu yaklaşım, optimum kesme düzlemini belirlemek için zaman kazandıran ve doğru bir yol sunar. Bu makalenin amacı, karaciğer tümörleri için laparoskopik segmentektomide 3D-LAST uygulamasının uygulanabilirliğini göstermektir. Araştırmanın sonuçları, 3D-LAST'ın intraoperatif karaciğer navigasyonu için güvenli, etkili ve pratik yeni bir yöntem olduğunu ve geniş çaplı tanıtım için büyük bir potansiyele sahip olduğunu göstermektedir.
Giriş
Hepatektomi, karaciğer tümörleri için temel bir tedavi olmaya devam etmektedir. Son yıllarda, cerrahi yaklaşımlar, intraoperatif ultrason (IOUS) ve indosiyanin yeşili (ICG) floresan görüntüleme gibi yardımcı teknolojilerdeki ilerlemeler tarafından yönlendirilen düzensiz rezeksiyonlardan hassas anatomik rezeksiyonlara doğru evrimleşmiştir 1,2. Bu yeniliklere rağmen, yeterli fonksiyonel karaciğer hacmini korurken optimal rezeksiyon sınırlarına ulaşmak kritik bir zorluk olmaya devam etmektedir. Önerdiğimiz 3D-LAST (ipek iplikle üç boyutlu konum yaklaşımı) tekniğimizin genel amacı, karaciğer tümörü rezeksiyonu için hassas, uygun maliyetli ve evrensel olarak erişilebilir bir intraoperatif navigasyon yöntemi sağlamak ve uzamsal doğruluğu artırırken özel ekipmana olan bağımlılığı en aza indirmektir.
3D-LAST'ı geliştirmenin mantığı, mevcut tekniklerin sınırlamalarından kaynaklanmaktadır. IOUS, gerçek zamanlı tümör lokalizasyonu için değerli olsa da, görüntü yorumlama için yetenekli sonografi uzmanları gerektirir ve iki boyutlu (2D) uzamsal görselleştirme ile mücadele eder, bu da genellikle ameliyat süresini uzatır 3,4. ICG floresan navigasyonu, yüzeysel tümörler için etkili olmasına rağmen, sınırlı doku penetrasyon derinliği (5-10 mm) ile sınırlıdır ve bu da onu daha derin lezyonlar için güvenilmez hale getirir 5,6. Her iki yöntem de maliyetli, özel donanıma bağlıdır ve kaynakların kısıtlı olduğu ortamlarda benimsenmelerini sınırlar.
3D-LAST'ın mevcut tekniklere göre avantajları çok yönlüdür. Ameliyat öncesi bilgisayarlı tomografi (BT) rekonstrüksiyonlarından türetilen üç boyutlu görselleştirme, stereoskopik anatomik rehberlik sağlayarak 2D görüntülemenin uzamsal belirsizliğinin üstesinden gelir. Derinlik çözünürlüğü olmayan ICG'den farklı olarak, 3D-LAST, pozitif sınırlar veya aşırı parankimal kayıp riskini azaltarak hassas hacimsel rezeksiyon planlamasına olanak tanır. Ayrıca, intraoperatif işaretleme için ipek ipliğin kullanılması, gerçek zamanlı görüntüleme cihazlarına olan ihtiyacı ortadan kaldırarak iş akışını kolaylaştırır ve maliyetleri düşürür.
3D-LAST, özellikle gelişmiş görüntüleme altyapısına veya karmaşık intraoperatif navigasyon konusunda uzmanlığa sahip olmayan merkezler için uygundur. Preoperatif BT'de anatomik işaretlerin tanımlanabildiği ve prosedürel karmaşıklığın en aza indirilmesine öncelik verilen tek tümör rezeksiyonları için idealdir. Mevcut yöntemlerin sınırlamalarını ele alarak ve doğrulanmış 3D teknolojilerinden yararlanarak, 3D-LAST, geniş klinik uyarlanabilirliğe sahip hassas karaciğer cerrahisine ulaşmada pragmatik bir ilerlemeyi temsil eder.
Olgu Sunumu:
Üst karın rahatsızlığı olan 59 yaşında erkek hastaya sağ karaciğerde 2.7 cm x 1.6 cm boyutlarında karaciğer tümörü tanısı konuldu. Hastaya daha önce mide adenokarsinomu tanısı konuldu ve mide kanseri nedeniyle radikal gastrektomi yapıldı, ardından rutin kemoterapi uygulandı. Preoperatif kontrastlı BT taramasında ekstrahepatik metastaz saptanmadı. CA19-9, CA15-3, CA72-4, AFP ve CEA normaldi.
Protokol
Çalışma, Sichuan Üniversitesi Batı Çin Hastanesi'nin inceleme komitesi tarafından onaylandı. Ameliyat öncesi hastadan bilgilendirilmiş onam alındı.
1. Ameliyat öncesi hazırlık
- Hasta karaciğerinin DICOM formatında yüksek çözünürlüklü BT taramalarını elde edin (Şekil 1A).
- Mimics yazılımını başlatın, yeni bir proje oluşturun ve tüm görüntü verilerinin 3B yeniden yapılandırma ve analiz için doğru şekilde yüklendiğinden emin olmak için DICOM dosyalarını içe aktarın.
- Karaciğerin, damarların ve tümörün üç boyutlu yapısını yeniden yapılandırın. Karaciğeri pembe, portal veni mavi, arteri kırmızı, hepatik ven ve inferior vena kavayı mavi ve tümörü sarı ile işaretleyin (Şekil 1B).
- 3D karaciğer modeline üç küçük sanal çubuk yerleştirin ve karaciğer yüzeyinde dört anahtar nokta (S1, S2, S3, S4) elde edin (Şekil 2A-B).
- Bu sanal çubuklar, cerraha amaçlanan kesimin kesin konumunu ve yönünü belirlemede rehberlik eden dijital yer işaretleri görevi görür. Rezeksiyon noktasının sanal çubuk işaretini tümör kenarından 1 cm uzağa ve safra kesesinin altındaki karaciğer kenarının orta noktasına yerleştirin.
NOT: Cerrahlar, bu kilit noktaları işaretleyerek ameliyat sırasında hedef alana odaklanmalarını sağlayarak gereksiz doku hasarı riskini en aza indirebilirler.
- Bu sanal çubuklar, cerraha amaçlanan kesimin kesin konumunu ve yönünü belirlemede rehberlik eden dijital yer işaretleri görevi görür. Rezeksiyon noktasının sanal çubuk işaretini tümör kenarından 1 cm uzağa ve safra kesesinin altındaki karaciğer kenarının orta noktasına yerleştirin.
- Dört anahtar noktayı karaciğer yüzeyindeki çizgilerle birleştirin ve uzunluklarını ölçün (S1-S2 = 9.8 cm, S1-S3 = 7.2 cm, S2-S3 = 10.4 cm, S4-S2 = 8.2 cm, S4-S3 = 6.5 cm) Şekil 2C-D'de gösterildiği gibi. Bu çizgiler, rezeksiyon sonrası karaciğerin şeklini ve konturunu görselleştirmede cerraha rehberlik eden önerilen rezeksiyon yolunu temsil eder.
- Doğruluk ve tutarlılığı sağlamak için her satırın uzunluğunu titizlikle ölçün. Bu ölçüm, cerrahların karaciğer kesimini yönlendirmek için intraoperatif olarak kullanılacak olan aynı uzunlukta ipek iplikler hazırlamasına izin verdiği için çok önemlidir.
2. Operatif prosedür
- Hastayı sırtüstü, bacakları açık ve sağa eğimli olarak yatırın (Şekil 3A). Trakeal entübasyon ve kontrollü ventilasyon dahil olmak üzere standart genel anestezi uygulayın.
- Meme uçları arası bağlantı, simfiz pubis, sağ orta aksiller ve sol orta klaviküler çizgiler alanında% 0.5 iyot bazlı ovma 3x ile cildi dezenfekte edin.
- Cerrah sağda ve asistan solda olacak şekilde cerrahi ekibi düzenleyin. Kamerayı, kamera tutucusu da ortada duracak şekilde trokar bölgeleri arasında merkezi bir şekilde konumlandırın.
- Laparoskopik delik olarak göbek altından 12 mm'lik bir kesi (H1), ana ameliyat delikleri olarak 12 mm ve 5 mm'lik kavisli bir kesi (H2 ve H3), yardımcı ameliyat delikleri olarak 12 mm ve 5 mm'lik bir kesi (H4 ve H5) yapın (Şekil 3B).
- Şekil 3B'de gösterildiği gibi kesilere beş trokar (12 mm, 12 mm, 12 mm, 5 mm ve 5 mm) yerleştirin. Pnömoperitoneum sistemini açın ve pnömoperitoneumu yaklaşık 12 mmHg'lik bir basınçta tutmak için trokardan% 100 karbondioksit gazı enjekte edin.
- Herhangi bir asit, siroz ve metastaz varlığını tespit etmek için sol epigastriumdan başlayıp sağa doğru hipogastriuma doğru hareket eden karın boşluğunun keşif muayenesini yapın.
- Abdominal yapışıklıkları serbest bırakın, karaciğerin yuvarlak bağını çıkarın, sağ hepatik ligament ve yapışıklıkları serbest bırakın ve ultrasonik bir bıçak kullanarak karaciğer segmenti V'yi tamamen açığa çıkarın.
- Safra kesesi üçgenini incelemek için ultrasonik bir bıçak kullanın, safra kesesi kanalını ve arteri ortaya çıkarın. Daha sonra, safra kesesini çıkarmadan önce bu yapıları küçük hemo-kilit klipsleri ile bağlayın.
- Sırasıyla S1-S2 = 9,8 cm, S1-S3 = 7,2 cm ve S2-S3 = 10,4 cm uzunluğunda üç ipek iplik hazırlayın. S4 noktası safra kesesinin boynunda bulunur, bu nedenle S4-S2 = 8,2 cm ve S4-S3 = 6,5 cm için ipek iplik hazırlamayın.
- Üç ipek ipliği, Şekil 4'te gösterildiği gibi, ameliyat öncesi planlanan rezeksiyon yoluna karşılık gelen karaciğer yüzeyindeki anatomik pozisyona yerleştirin. Cerrahlar, ipek iplikleri fiziksel bir kılavuz olarak kullanarak, ameliyat sırasında planlanan rezeksiyon yolunu daha hassas bir şekilde görselleştirebilir ve takip edebilir.
NOT: Bu adım, sanal planlama ile gerçek cerrahi prosedür arasındaki boşluğu doldurur. - Karaciğerin yüzeyindeki ipek iplik boyunca işaretleyiciler keserek karaciğeri koterize etmek için elektrikli bir bıçak kullanın (Şekil 4D) ve çekiş için karaciğere bir lastik bant dikin (Şekil 5A).
- Karaciğer parankimini işaretleyici çizgiler boyunca kesmek için ultrasonik bir bıçak kullanın. Home-o-lock kırpma ile karşılaşılan damarları kesin, kanı emmek için bir aspiratör kullanın ve kanamayı durdurmak için bipolar forseps kullanın (Şekil 5B).
- Numuneyi bir torbaya koyun ve numuneyi çıkarmak için üst karın bölgesinde neşter ile 4 cm'lik bir kesi yapın. Karın boşluğunda aktif kanama olmadığını doğrulayın, karaciğer transeksiyon yüzeyine hemostatik materyaller yerleştirin ve sağ alt karın bölgesinden çıkan bir drenaj tüpü yerleştirin.
- Trokar ve dikiş kesilerini 3-0 emilebilir dikişlerle katman katman çıkarın. Tümör kapsülünün bütünlüğünü doğrulamak ve tümörün boyutunu ölçmek için numuneyi inceleyin (Şekil 5C-D).
3. Hepatektomi sonrası yönetim
- Anesteziden başarılı bir şekilde iyileştikten sonra hastayı servise transfer edin ve ameliyattan sonraki ilk 24 saatlik iyileşme süresi boyunca kesintisiz kardiyak monitörizasyon kullanarak hastanın hayati belirtilerini gözlemleyin.
- Potansiyel septik komplikasyonları azaltmak için postoperatif 1. gün boyunca intravenöz infüzyon ile profilaktik antimikrobiyal tedavi uygulayın.
- İşlemden 24 saat sonra üriner kateterizasyonu çıkarın. Ameliyattan 72 saat sonra düz bir bilgisayarlı tomografi taraması yapın (Şekil 6). Ameliyattan 4 gün sonra masif asit ve safra kaçağı olmadan cerrahi drenleri boşaltın.
Sonuçlar
Toplam ameliyat süresi 150 dakika olup, kan transfüzyonu gerektirmeyen 50 mL kan kaybı oldu. İntraoperatif idrar hacmi 500 mL, intraoperatif infüzyon hacmi 800 mL idi. Ameliyattan sonraki 1. günde , kan testi sonuçları transaminaz seviyelerinde hafif bir artış gösterdi. Karın BT taraması, ameliyattan 3 gün sonra karaciğer tümörünün tam rezeksiyonunu gösterdi ve önemli bir asit yoktu. Dren ameliyat sonrası 4. günde çıkarıldı. Ameliyat sonrası sorunsuz geçen hasta ameliyat sonrası 5. günde taburcu edildi. Postoperatif brüt patolojik spesimende tümör boyutu 1.5 cm x 1.5 cm olarak görüldü ve Tablo 1'de gösterildiği gibi R0 rezeksiyonu doğrulandı.

Şekil 1: Karaciğer ve kitlenin kütlesini ve 3D rekonstrüksiyonunu gösteren BT. (A) Sağ karaciğerde bulunan tümörü gösteren BT taraması (kitleyi gösteren siyah ok). (B) Karaciğer, damar ve kütlenin 3D rekonstrüksiyonu (kütleyi gösteren siyah ok). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: 3D model üzerinde rezeksiyon çizgisini işaretleyin. (AD) İntrahepatik kanal yapısını ve tümörü 3D olarak yeniden yapılandırın ve kesici kenarın kilit noktalarını (S1, S2, S3, S4) küçük bir çubukla işaretleyin. Sanal karaciğer modelinin yüzeyindeki kilit noktalar boyunca karaciğer çizgileri çizin ve her çizginin uzunluğunu ölçün (S1-S2 = 9.8 cm, S1-S3 = 7.2 cm, S2-S3 = 10.4 cm, S4-S2 = 8.2 cm, S4-S3 = 6.5 cm). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Cerrahın, hastanın ve trokar yerleşiminin intraoperatif yerleşimi. (A) Ameliyat eden cerrah sağda, asistan solda ve kameraman bacakların arasında. (B) Laparoskopik hepatektomi prosedürü beş portlu bir teknik kullanılarak gerçekleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Rezeksiyon çizgisini işaretleyen ipek iplik. (A-D) Karaciğer ameliyatı sırasında, kesici kenarı işaretlemek için ipek iplik kullanın, aynı uzunlukta ipek iplikler hazırlayın ve bunları karaciğer yüzeyindeki anatomik pozisyonlarına yerleştirin. İpek ipliğin çevrelediği şekil, karaciğer için kesme çizgisidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Karaciğer rezeksiyonu ve örnek. (A) Çekiş için karaciğere bir lastik bant dikin. (B) Karaciğer rezeksiyon düzleminde orta hepatik veni ortaya çıkarın (orta hepatik veni gösteren siyah ok). (C-D) Karaciğer kitlesinin tam rezeksiyonu (siyah ok), tümör sınırını gösteren kesit görünümü sağlam ve ameliyat öncesi planlanan sınırla eşleşiyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
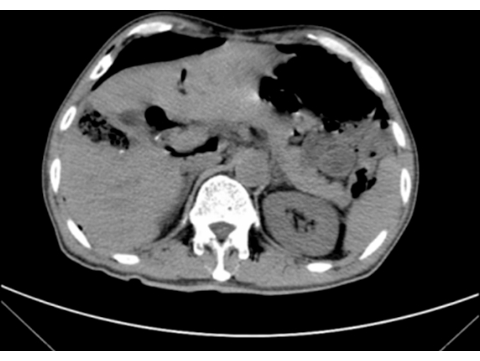
Şekil 6: Ameliyat sonrası BT taraması. Bilgisayarlı tomografi, postoperatif 3. günde perihepatik sıvı birikimi olmadan tümörün başarılı bir şekilde çıkarıldığını gösterdi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Parametre | Sonuç -ları |
| Ameliyat süresi | 150 dk |
| Kan kaybı | 50 mL |
| Ameliyat sonrası karaciğer fonksiyonu | ALT 222 IU/L, AST 217 IU/L |
| Ameliyat sonrası BT yeniden incelemesi | BÖLME 3 |
| Drenaj borusunun hareketi | BÖLME 4 |
| Taburcu olma günü | BÖLME 5 |
| Tümör boyutu | 1,5 cm x 1,5 cm |
| Patolojik tip | Adenokarsinom |
Tablo 1: Hastanın cerrahi sonuçları. Kısaltmalar: ALT = Alanin Aminotransferaz; AST = Aspartat Aminotransferaz; POD = Ameliyat Sonrası Gün.
Tartışmalar
Teknolojinin gelişmesi ve tecrübe birikimi ile laparoskopik karaciğer rezeksiyonu giderek daha sık görülmeye başlanmıştır ve endikasyonları neredeyse açık cerrahininkiler kadar geniştir. Laparotomi ile karşılaştırıldığında, laparoskopik karaciğer rezeksiyonunun daha az ağrı, daha az perioperatif komplikasyon ve daha hızlı iyileşme gibi birçok avantajı vardır 7,8,9. Bununla birlikte, laparoskopik karaciğer rezeksiyonu da bazı doğal zorluklarla karşı karşıyadır. Dokunma ve derinlik algısının olmaması, sınırlı çalışma alanı ve kısıtlı görme alanı, yaygın kullanımı için zorluklar yaratmaktadır 10,11,12. Bu sorunları ele almak için, IOUS ve ICG floresan görüntüleme son yıllarda gerçek zamanlı navigasyon araçları olarak kullanılmıştır. IOUS, doğrudan karaciğer yüzeyine uygulandığında, lezyon tespiti ve lokalizasyonunun doğruluğunu artırabilir13,14.
Bununla birlikte, genellikle sonografi uzmanları tarafından ameliyat edildiğinden, cerrahların genellikle onları beklemek için ameliyatı duraklatması gerekir, bu da sadece ameliyat süresini uzatmakla kalmaz, aynı zamanda ultrason teknolojisine olan bağımlılığı da artırır. Ek olarak, sirotik karaciğerlerde, IOUS rejeneratif nodülleri tümör olarak yanlış yorumlayabilir ve bu da aşırı tanıya yol açabilir 15,16,17. Zararsız, suda çözünür yakın kızılötesi bir floresan ajan olan ICG, özel dürbünler aracılığıyla operasyon sırasında anatomik yapıların görselleştirilmesine yardımcı olabilir. Yüksek hassasiyeti ve net kontrastı, onu çeşitli karaciğer ameliyatlarında cerrahi navigasyon için popüler bir araç haline getirir. Bununla birlikte, yakın kızılötesi ışığın (10 mm'ye kadar) sınırlı doku penetrasyonu nedeniyle, derin yerleşimli karaciğer lezyonlarını tespit etmedeki uygulaması sınırlıdır. Ayrıca, aşırı dozda ICG yanlış pozitif sonuçlara neden olabilir ve tümör boyamanın başarısı kan temini, karaciğer sirozu ve nekroz gibi faktörlerle ilişkilidir 18,19,20. Bu nedenle, derin yerleşimli karaciğer tümörlerini lokalize etmek için yenilikçi, verimli ve doğru bir yöntem geliştirmek büyük klinik öneme sahiptir.
Bu çalışmada, soliter karaciğer tümörü olan hastalarda anatomik işaretleri belirlemek ve rezeksiyon alanını hesaplamak için preoperatif 3D pozisyonlama kullanıldı. Ameliyat sırasında, ameliyat öncesi 3D yazılım ile hesaplanan uzunluklarda kenar çizgileri düzenlendi ve kenarları işaretlemek için ipek iplik kullanıldı. Bu yöntem, optimum kesme düzleminde21 gezinmek için zaman açısından verimli ve doğru bir yol sağlar. Çalışmamızdaki ameliyat süresi, IOUS ve ICG kılavuzluğunda hepatektomi kullanılan çalışmalarda bildirilenden anlamlı olarak daha kısaydı. Bu yaklaşım, IOUS'a olan bağımlılığı azaltır, cerrahi zamandan tasarruf sağlar ve teknik ve koşullu gereksinimleri azaltır. Tümörün boyutuna ve derinliğine bakılmaksızın çeşitli karaciğer tümörü navigasyon durumlarına uygulanabilir.
Avantajlarına rağmen, bu yaklaşımın sınırlamaları vardır. İlk olarak, doğruluğu ameliyat öncesi görüntüleme kalitesine bağlıdır; Hareket artefaktları veya düşük çözünürlüklü taramalar, 3B model aslına uygunluğunu tehlikeye atabilir. İkincisi, teknik statik karaciğer anatomisini varsayarken, solunum hareketleri veya cerrahi manipülasyon tümör pozisyonlarını değiştirebilir ve gerçek zamanlı ayarlamalar gerektirebilir. Üçüncüsü, 3B yazılım işlemi ve intraoperatif uzamsal çeviri için öğrenme eğrisi, özel eğitim olmadan cerrahide benimsemeyi sınırlayabilir. Ek olarak, bu çalışmanın örneklem büyüklüğü nispeten küçüktür ve bu yöntemin etkinliğini daha fazla doğrulamak için gelecekteki büyük ölçekli prospektif çalışmalara ihtiyaç vardır. Basit ve yaygın olarak uygulanabilir bir 3D rekonstrüksiyon programı geliştirmek de gelecekteki araştırmalar için önemli bir hedeftir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması bildirmemektedir.
Teşekkürler
Bu çalışma, Guizhou İl Sağlık Komisyonu Bilim ve Teknoloji Fonu Projesi (gzwkj2025-300), Guizhou İl Bilim ve Teknoloji Departmanı Projesi (Qian Ke He Cheng Guo, LC[2024]109) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BiClamp LAP | ERBE Company | No.20195-132 | |
| Laparoscopic system | Olympus | VISERA OTV-S400 | |
| Ultrasonic knife | Johnson and Johnson MedTech | ETHICON HARMONIC |
Referanslar
- Fan, S. T., et al. Continuous improvement of survival outcomes of resection of hepatocellular carcinoma: a 20-year experience. Ann Surg. 253 (5), 745-758 (2011).
- Torzilli, G., et al. "Radical but conservative" is the main goal for ultrasonography-guided liver resection: prospective validation of this approach. J Am Coll Surg. 201 (5), 517-528 (2005).
- Torzilli, G., et al. Contrast-enhanced intraoperative ultrasonography during surgery for hepatocellular carcinoma in liver cirrhosis: is it useful or useless? A prospective cohort study of our experience. Ann Surg Oncol. 14 (4), 1347-1355 (2007).
- Leen, E., et al. Potential value of contrast-enhanced intraoperative ultrasonography during partial hepatectomy for metastases: an essential investigation before resection. Ann Surg. 243 (2), 236-240 (2006).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancer. 115 (12), 2491-2504 (2009).
- Gotoh, K., et al. A novel image-guided surgery of hepatocellular carcinoma by indocyanine green fluorescence imaging navigation. J Surg Oncol. 100 (7), 75-79 (2009).
- Nguyen, K. T., Gamblin, T. C., Geller, D. A. World review of laparoscopic liver resection-2,804 patients. Ann Surg. 250 (5), 831-841 (2009).
- Abu Hilal, M., et al. The Southampton Consensus Guidelines for laparoscopic liver surgery: from indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Ciria, R., Cherqui, D., Geller, D. A., Briceno, J., Wakabayashi, G. Comparative short-term benefits of laparoscopic liver resection: 9000 cases and climbing. Ann Surg. 263 (4), 761-777 (2016).
- Schneider, C., et al. Comparison of manual and semi-automatic registration in augmented reality image-guided liver surgery: a clinical feasibility study. Surg Endosc. 34 (10), 4702-4711 (2020).
- Lwin, T. Z., Sicklick, J. K., Hoffman, R. M., Bouvet, M. Fluorescence-guided laparoscopic hepatectomy. Ann Laparosc Endosc Surg. 1, 10(2016).
- Ziogas, I. A., Tsoulfas, G. Advances and challenges in laparoscopic surgery in the management of hepatocellular carcinoma. World J Gastrointest Surg. 9 (12), 233-245 (2017).
- Cai, X., et al. Does using indocyanine green fluorescence imaging for tumors help in determining the safe surgical margin in real-time navigation of laparoscopic hepatectomy? A retrospective study. Ann Surg Oncol. 30 (6), 1981-1987 (2023).
- Nishino, H., et al. Real-time navigation for liver surgery using projection mapping with indocyanine green fluorescence: development of the novel medical imaging projection system. Ann Surg. 267 (6), 1134-1140 (2018).
- Ishizawa, T., et al. Impact of intraoperative ultrasonography on surgical strategy and prognosis after hepatic resection for hepatocellular carcinoma. Ann Surg Oncol. 15 (13), 3665-3673 (2008).
- Solbiati, L., et al. Percutaneous sono-guided radio-frequency ablation of liver metastases: a multi-centre study. Eur Radiol. 11 (10), 1947-1954 (2001).
- Yang, T., et al. The role of intraoperative ultrasonography in laparoscopic liver resection for hepatocellular carcinoma: a propensity score-matched analysis. Surg Endosc. 34 (5), 2137-2144 (2020).
- van Manen, L., et al. A practical guide for the use of indocyanine green and methylene blue in fluorescence-guided abdominal surgery. J Surg Oncol. 118 (2), 283-300 (2018).
- Yoo, K. Y., et al. Intravenously administered indocyanine green may cause falsely high near-infrared cerebral oximetry readings. Anesthesiology. 120 (6), 1374-1379 (2014).
- Kimura, F., et al. Clinical impact of indocyanine green fluorescence imaging for liver tumor surgery: a single-center experience. Surgery. 161 (2), 475-481 (2017).
- Zhang, Z. H., Feng, Q. B., Jiang, C., Huang, J. W., Li, J. X. Three-dimensional location approach with silk thread guided hepatectomy for liver tumor. World J Gastroenterol. 31 (8), 10262(2025).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır