Method Article
Akciğer Retinoid İçeren Hücrelerin Hücre Ayıklama ile İzolasyonu
Bu Makalede
Özet
Aşağıda açıklanan protokol, spesifik retinoid otofloresan kullanarak ve floresanla aktive edilen hücre sınıflandırması kullanarak retinoid içeren hücreleri oldukça heterojen akciğer hücresi popülasyonlarından izole etmenin basit ve etkili bir yoludur.
Özet
Retinoidler (A vitamini ve metabolitleri), alveolar mikroçevrenin önemli bir lipid bileşenidir ve gelişmekte olan ve yetişkin akciğerlerin fonksiyonel sağlığını korumak için hücre tipine özgü retinoid metabolizması gereklidir. Akciğer hücreleri, dolaşımdaki retinoidlerin kandan retinol (ROH) olarak verimli bir şekilde alınmasına izin veren spesifik yollar kullanır, ardından ROH'nin hücre içi kademeli olarak transkripsiyonel olarak aktif retinoid türlerine, all-trans-retinoik aside (ATRA) dönüştürülmesine izin verir. ATRA aracılı (veya retinoid aracılı) sinyalizasyon, akciğer alveolarizasyonunu, yüzey aktif madde üretimini, anjiyogenezini, geçirgenliğini ve bağışıklığını düzenlemek için çok önemlidir. Daha da önemlisi, fibroblastlar da dahil olmak üzere spesifik akciğer hücreleri, gerektiğinde komşu hücrelere transfer edilmek üzere ROH olarak depolanabilen veya daha fazla mobilize edilebilen retinil esterler (RE) şeklinde retinoidler biriktirebilir. Akciğer retinoid içeren hücreler, retinoid otofloresan (350 nm'de uyarılma üzerine 455 nm'de emisyon) ve floresanla aktive edilen hücre sınıflandırması (FACS) kullanılarak sindirilmiş akciğerlerin tek hücreli süspansiyonundan izole edilebilir ve toplanabilir. Akciğer hücrelerinin kırmızı floresan proteini ile hücreye özgü ek in vivo etiketlemesi, spesifik retinoid içeren akciğer hücresi popülasyonlarının izole edilmesine ve toplanmasına izin verir. Toplanan hücreler, hücre morfolojisi, gen ekspresyonu ve farmakolojik manipülasyonlara yanıt verme konusunda daha ileri analizler için doğrudan analiz edilebilir veya kültürlenebilir. Bu izolasyon ve uygulama tekniği, akciğerlerdeki retinoid metabolizmasının hücresel yönleri ve lipid aracılı hücresel iletişim hakkında daha derin bir bilgi edinmek için akciğer sağlığı ve akciğer hasarının hayvan modeli çalışmaları için önemlidir.
Giriş
Retinoidler (A vitamini ve metabolitleri), alveolar mikroçevrenin önemli bir lipid bileşenidir ve gelişmekte olan ve yetişkin akciğerinin fonksiyonel sağlığını korumak için hücre tipine özgü retinoid metabolizması ve sinyalizasyonu gereklidir 1,2,3,4,5,6,7,8,9,10,11 ,12,13,14. Akciğer hücreleri, dolaşımdaki diyetten türetilmiş retinoidlerin kandan retinol (ROH)15,16,17,18,19 olarak verimli bir şekilde alınmasına izin veren spesifik yollar kullanır, ardından ROH'nin hücre içi aşamalı olarak transkripsiyonel olarak aktif retinoid türlerine, all-trans-retinoik aside (ATRA) dönüştürülmesine izin verir.20. ATRA aracılı (veya retinoid aracılı) sinyalizasyon, ATRA'nın üç farklı akraba nükleer hormon reseptörü, retinoik asit reseptörleri (RARα, RARβ ve RARγ 21,22) ile etkileşimi yoluyla elde edilir ve akciğer alveolarizasyonunu düzenlemek için çok önemlidir 23,24,25,26,27,28,29, yüzey aktif madde üretimi 30,31,32,33,34,35, anjiyogenez36, geçirgenlik37 ve bağışıklık 38,39,40. Daha da önemlisi, spesifik akciğer hücreleri, özellikle akciğer fibroblastları, gerektiğinde komşu hücrelere transfer edilmek üzere ROH olarak depolanabilen veya daha fazla mobilize edilebilen retinil esterler (RE) şeklinde retinoidler biriktirebilir1.
Retinoid metabolizmasının ve sinyalizasyonunun karmaşıklığının yanı sıra akciğerin hücresel karmaşıklığı, akciğerdeki retinoid metabolizmasını in vivo olarak keşfetmeyi amaçlayan çalışmaları zorlaştırır. Spesifik retinoid otofloresan (350 nm'de uyarılma üzerine 455 nm'de emisyon) kullanarak ve floresanla aktive edilen hücre sınıflandırması (FACS) kullanarak retinoid içeren hücreleri (Şekil 1) oldukça heterojen akciğer hücre popülasyonlarından izole etmek için basit ve sağlam bir protokol belirledik. Çalışmanın amacı, retinoidleri depolama yeteneklerine dayalı olarak birincil canlı akciğer hücrelerini izole etmek ve karakterize etmekse, protokol canlılık boyaması dışında ek hücre etiketlemesi gerektirmez. Bu, hücre sınıflandırması için hazırlık süresini önemli ölçüde azaltır, ek boyama ihtiyacını ortadan kaldırır ve canlı birincil hücrelerin yüksek verimlerinin izole edilmesine izin verir. Bununla birlikte, çalışmanın amacı spesifik akciğer hücresi popülasyonlarını (fibroblastlar, endotelyal, epitel veya bağışıklık hücreleri) izole etmek ve karakterize etmekse, sıralanan retinoid içeren hücreleri hücreye özgü antikorlarla etiketledikten sonra ek hücre sınıflandırması yapılabilir.
Retinoid otofloresan, retinoid içeren hücrelerin kimliklerini belirlemek ve / veya bu hücrelerin karaciğer 41,42,43,44, pankreas45,46, böbrekler 41,47 ve akciğer 41'deki bolluğunu ölçmek için yayınlanmış çalışmalarda kullanılmıştır. Ayrıca, birkaç araştırma grubu, FACS ile izole etmek ve karaciğer 44,48,49,50,51,52,53 ve akciğer 1 dahil olmak üzere canlı dokulardan birincil retinoid içeren hücreleri incelemek için retinoid floresan kullanıldığını bildirmiştir. Mevcut protokolde, tdTomato (kırmızı floresan proteini) kullanarak retinoid içeren hücreleri izole etmeden önce spesifik hücre popülasyonlarının in vivo olarak nasıl etiketlenebileceğini gösteriyoruz. tdTomato'nun spektral özellikleri (554 nm54'te uyarıldığında 581 nm'de emisyon) ve parlaklık, retinoid otofloresansına müdahale etmez ve bu nedenle, sıralama sırasında hücre özgüllüğünün elde edilmesini kolaylaştırır. Normal alveolar mikroçevre1 içinde tavizsiz retinoid metabolizmasının ve sinyalizasyonunun kritik rolü göz önüne alındığında, tarif edilen akciğer hücresi izolasyonu tekniği, akciğerlerdeki retinoid metabolizmasının hücresel yönleri ve in vivo lipid aracılı hücresel iletişim hakkında daha derin bir bilgi edinmek için akciğer sağlığı ve hastalığının hayvan modeli çalışmalarında yararlı bir araçtır.
Protokol
Farelerle ilgili açıklanan tüm prosedürler ve deneyler, Ulusal Bilimler Akademisi55 tarafından hazırlanan Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'nda belirtilen kriterlere göre Rutgers Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin (IACUC ID: PROTO202200111) onayı ile gerçekleştirilmiştir.
1. Deney için dikkat edilmesi gereken hususlar ve hazırlıklar
- Hayvancılık ve manipülasyonlar
NOT: Çalışmalarda üç aylık (10-12 haftalık) erkek ve dişi fareler kullanılabilir. Lesitin: Retinol asiltransferaz eksikliği olan fareler (Lrat eksikliği, Lrat-/- fareler56) C57BL / 6J genetik arka plan üzerinde ve yaşa uygun littermatlar (vahşi tip, Lrat +/+ fareler) açıklanan deneylerde kullanıldı. Fibroblastlarda tdTomato genini eksprese eden fareler (F-tdT fareleri), bir tdTomato raportör kaseti (B6. Cg-Gt (ROSA) 26Sortm14 (CAG-tdTomato) Hze / J, Jackson Lab suşu # 007914) Col1a2-CreER fareleri (B6. Cg-Tg(Col1a2-Cre/ERT,-ALPP)7Cpd/2J, Jackson Lab suşu #029567).- Hedef hücre popülasyonunu in vivo olarak etiketlemek için mevcut birçok seçenekten biri olan Cre eksprese eden fare modelini kullanın.
NOT: Hedef hücrenin seçimine, Cre ekspresyonuna, Cre aracılı rekombinasyonun verimliliğine ve hücre özgüllüğüne bağlı olarak, araştırmacılar herhangi bir güvenilir Cre eksprese eden fare modelini kullanabilirler. - Col1a2 + fibroblastları etiketlemek için tdTomato transgen ekspresyonunu (aşağıda tarif edildiği gibi tamoksifen tedavisi üzerine) kullanın, ardından aşağıda tarif edildiği gibi sindirilmiş akciğerin tek hücreli süspansiyonlarından izolasyonlarını yapın.
- Hedef hücre popülasyonunu in vivo olarak etiketlemek için mevcut birçok seçenekten biri olan Cre eksprese eden fare modelini kullanın.
- Kre-aracılı rekombinasyon ve transgen aktivasyonu in vivo
- F-tdT farelerinde toplam 5 ardışık gün boyunca her 24 saatte bir 2 mg tamoksifen intraperitoneal (IP) enjeksiyonu yoluyla Cre ekspresyonunu indükleyin.
- Enjeksiyondan önce enjeksiyon bölgesini %70 etanol ile sterilize edin. Son tamoksifen enjeksiyonundan 1 ay sonra fareleri deneyler için kullanın.
- Sıralama deneylerinden önce Cre-rekombinasyonun etkinliğini kontrol edin. Anti-Pdgfrα manyetik boncuklar ve manyetik aktive hücre sınıflandırması (MACS) kullanarak tamoksifen ile tedavi edilmiş F-tdT farelerinden akciğer fibroblastlarının hedef hücre popülasyonunu izole ederek etkili Cre rekombinasyonunu ve tdTomato ekspresyonunu onaylayın.
- Çözeltilerin, plastik ve cam eşyaların hazırlanması
NOT: Aşağıda açıklanan prosedürler için aseptik teknikler izlenmelidir. Solüsyon preparatları, doku sindirimi ve hücre izolasyonunu içeren işlemler laminer başlık altında yapılmalıdır. Çözeltiler 0.2 μm'lik bir filtre kullanılarak süzülerek sterilize edilmelidir; Cerrahi aletler ve laboratuvar gereçleri otoklavlama ile sterilize edilmelidir.- Laminer kaputun altında, Hanks'in kalsiyum ve magnezyum içermeyen dengeli tuz çözeltisini (HBSS) hazırlayın (Ca2 + / Mg2 +, 5.3 mM KCl, 0.4 mM KH2PO4, 4.2 mM NaHCO3, 137.9 mM NaCl, 0.3 mM Na2HPO4, 5.6 mM D-Glikoz) akciğer perfüzyonu için (fare başına 5 mL). Solüsyonu 0,2 μm'lik bir filtre kullanarak sterilize edin ve şırıngayı solüsyonla doldurun.
- Laminer kaputun altında, Hanks'in kalsiyum ve magnezyum içeren dengeli tuz çözeltisini hazırlayın (Ca2 + / Mg2 + ile HBSS, 1.3 mM CaCl2, 0.5 MgCl2 ·6H2O, 0.4 mM MgSO4·7H2O, 5.3 mM KCl, 0.4 mM KH2PO4, 4.2 mM NaHCO3, 137.9 mM NaCl, 0.3 mM Na2HPO4, 5.6 mM D-Glikoz), 0.3 mg / mL tip IV kollajenaz ve akciğer perfüzyonu için 1 mg / mL dispas (fare başına 10 mL). Solüsyonu 0,2 μm'lik bir filtre kullanarak sterilize edin ve şırıngayı solüsyonla doldurun.
- Laminer kaputun altında, akciğer sindirimi için 0.3 mg / mL tip IV kollajenaz, 1 mg / mL dispas ve 5 mg / mL DNaz I içeren Ca 2+ / Mg2 + ile HBSS'yi hazırlayın (fare başına 10 mL). Solüsyonu 0,2 μm'lik bir filtre kullanarak sterilize edin ve şırıngayı solüsyonla doldurun.
- Laminer kaputun altında, bir hücre kültürü kabını (35 mm 10 mm, bir fareden toplanan akciğer başına bir tabak) Ca2 + / Mg2 + ile 2 mL steril HBSS ile doldurun. Ca2+/Mg2+ ile HBSS içeren tabak(lar)ı buzun üzerine yerleştirin.
2. Akciğer perfüzyonu, sindirimi ve tek hücreli süspansiyonun toplanması
- IP enjeksiyonu yoluyla vücut ağırlığı 0.01 mL / g dozunda 10 mg / mL ketamin ve 2 mg / mL ksilazin içeren bir anestezi kokteyli uygulayarak fareyi uyuşturun.
- Ayak parmağını kıstırma tepkisini değerlendirerek farenin derin bir bilinç kaybı durumunda olduğundan emin olun. Ameliyat bölgesindeki gevşek saçları ve görünür kiri/kalıntıları temizleyin, dezenfeksiyon için %70 alkol kullanarak ameliyat bölgesini klipsleyin ve silerek temizleyin.
- Steril cerrahi aletler kullanarak karın ve göğüs boşluklarını açın. Akciğerleri ve kalbi ortaya çıkarmak için kaburgaları ve diyaframı kesin.
NOT: Bu, fare uyuşturulurken torakotomi solunumun durmasına neden olacağından ani bir ölümü garanti edecektir; Düzgün bir şekilde gerçekleştirilirse, prosedürün bu kısmı, prosedürün başlangıcından torakotomiye kadar 3 dakika kadar sürecektir ve ardından hayvanın ölümü devam edecektir. - İnferior vena kava'yı kesin ve salınan kanı emmek için emici bir ped uygulayın.
- Ca2 + / Mg2 + olmayan 5 mL steril HBSS ile doldurulmuş 25 G X 1 "iğne ile 10 mL'lik bir şırınga kullanarak kalbin sağ ventrikülünden akciğerleri yerinde perfüze edin. Perfüzyon başarılı olursa, akciğer dokusu beyazlaşır.
- Tip IV kollajenaz (0.3 mg / mL) ve dispas (1 mg / mL) içeren Ca2 + / Mg2 + ile 10 mL steril HBSS ile doldurulmuş 25 G X 1 "iğne ile 10 mL'lik bir şırınga kullanarak akciğerleri yerinde perfüze edin.
- Akciğerleri çıkarın ve bunları Ca2 + / Mg2 + ile 2 mL steril HBSS ile bir hücre kültürü kabına (35 mm X 10 mm) aktarın.
- Laminer kaputun altında, akciğerleri durulayın ve steril bir cerrahi bıçak kullanarak küçük parçalar halinde doğrayın (#20, tutamak #4'e uyar). Kıyılmış akciğeri, 0.3 mg / mL tip IV kollajenaz, 1 mg / mL dispas ve 5 mg / mL DNaz I içeren Ca2 + / Mg2 + ile ilk 5 mL HBSS'yi ekleyerek 15 mL'lik bir tüpe aktarın ve kıyılmış dokuya aktarın ve 10 mL'lik bir serolojik pipet kullanarak aktarın. Kalan kıyılmış doku kalıntılarını, 0.3 mg / mL tip IV kollajenaz, 1 mg / mL dispaz ve 5 mg / mL DNaz I içeren Ca2 + / Mg2 + ile kalan 5 mL HBSS ile yıkayarak toplayın ve aktarın.
- Kıyılmış akciğer dokusunu HBSS'de 0.3 mg / mL tip IV kollajenaz, 1 mg / mL dispaz ve 5 mg / mL DNaz I içeren Ca 2+ / Mg2 + ile 37 ° C'de tutulan döner bir çalkalayıcı üzerinde inkübe edin 45 dakika. 15 dakikalık üç aralığın her birinde, laminer başlığın altında, hücreleri daha iyi ayırmak için kıyılmış dokuyu 10 mL'lik bir serolojik pipetten 10 kez geçirin.
- Elde edilen hücre süspansiyonunu 100 μm'lik bir süzgeçten geçirin ve tek hücreleri 20 mL soğuk canlı hücre görüntüleme solüsyonu (20 mM HEPES içeren fizyolojik salin, pH 7.4) içeren 50 mL'lik bir tüpe toplayın. Hücreleri 4 ° C'de 10 dakika boyunca 500 g'da santrifüjleme ile toplayın.
- Süpernatanı aspire edin ve hücre peletini 1 mL kırmızı kan hücresi parçalama tamponunda yeniden süspanse edin ve eritrositleri ortadan kaldırmak için tüpü oda sıcaklığında (RT) 5 dakika bekletin. % 5'ten daha az FBS içeren 20 mL soğuk canlı hücre görüntüleme çözeltisi ekleyin. Hücreleri 4 ° C'de 10 dakika boyunca 500 g'da santrifüjleme ile toplayın.
- Süpernatanı aspire edin ve hücre peletini %5'ten daha az FBS içeren 20 mL soğuk canlı hücre görüntüleme solüsyonunda yeniden süspanse edin. Elde edilen hücre süspansiyonunu 40 μm'lik bir süzgeçten geçirin ve tek hücreleri %5'ten daha az FBS içeren 20 mL soğuk canlı hücre görüntüleme solüsyonu içeren 50 mL'lik bir tüpe toplayın. Hücreleri 4 ° C'de 10 dakika boyunca 500 g'da santrifüjleme ile toplayın.
- Süpernatanı aspire edin ve% 5'ten daha az FBS içeren 10 mL soğuk canlı hücre görüntüleme çözeltisinde hücre peletini yeniden süspanse edin. Hücreleri sayın ve hücre konsantrasyonunu ~ 5-10 x 106 hücre / mL olarak ayarlayın.
3. Floresan Aktif Hücre Sıralama (FACS) kullanılarak retinoid içeren akciğer hücrelerinin izolasyonu
- Bir hücre süspansiyonu alikotu alın ve lekesiz bir geçit kontrolü olarak kullanılmak üzere bir kenara koyun. Kalan hücre süspansiyonuna canlılık boyası SYTOX Green ekleyin (1:1000 seyreltme, nihai konsantrasyon 30 nM).
- Hücre süspansiyonlarını polistiren 5 mL (12 x 75 mm) toplama tüpüne bağlı filtreden geçirin.
- Canlı, bireysel retinoid içeren hücreleri 455 nm'deki emisyonlarına göre sıralayarak FACS hücre izolasyonuna devam edin. İleri saçılma için bir çizim kullanarak sıralı tekli ayrım yapın (ileri saçılma yüksekliği/FSC-H'ye karşı ileri saçılma alanı/FSC-A). Ölü hücreleri saçılma özellikleri (yan saçılma) ve SYTOX Green ile boyama ile hariç tutun.
- 350 nm'de uyarılma üzerine 455 nm'de emisyon kullanarak tek, canlı, retinoid içeren hücreleri kapılayın, sıralayın ve toplayın.
NOT: Açıklanan prosedürü kullanarak, bir fare akciğerinden yaklaşık 5·105 retinoid içeren akciğer hücresi toplanabilir. - Akış sitometrisi yazılımını kullanarak FACS veri analizi gerçekleştirin.
Sonuçlar
Akciğer retinoid içeren hücrelerin izolasyonu
Fare akciğerleri ( Lrat+/+ ve Lrat-/-'den) fareler enzimatik olarak sindirildi ve tek hücreli süspansiyonlar hazırlandı ve yukarıda belirtilen prosedüre göre FACS'ye tabi tutuldu. Hücre sıralama ve veri toplama, 100 μm nozul ve 15 psi basınç kullanılarak SpectroFlo CS yazılım sürümü 1.3.0 tarafından çalıştırılan bir Cytek Aurora™ Hücre Sıralayıcı Sisteminde gerçekleştirildi. İlk olarak, tek hücreleri (singletler) seçmek ve geçit etmek için ileri saçılma grafiği (ileri saçılma yüksekliği/FSC-H'ye karşı ileri saçılma alanı/FSC-A) uygulandı, ardından yan saçılma ve SYTOX Yeşil boyama kullanılarak ölü hücre ayrımı yapıldı (Şekil 2). Son olarak, retinoid içeren hücrelerin hedef popülasyonunu sıralamak için, λ = 455 nm'de yüksek otofloresansa sahip farklı bir canlı tek hücre popülasyonu seçildi (Şekil 2A). Uygulanan yürüyüşün ve genel yaklaşımın özgüllüğünü doğrulamak için, retinoid otofloresan kapısını ayarlamak için negatif bir kontrol olarak Lrat-/- farelerden akciğer hücresi süspansiyonu kullanıldı. Lrat-/- fareler RE'leri sentezleyemez ve akciğerlerinde retinoid biriktiremezler1. Özellikle, aynı FACS geçit stratejisi kullanılarak, λ = 455 nm'de yüksek otofloresansa sahip farklı bir hücre popülasyonu, Lrat-/- akciğerlerinden gelen tek hücre süspansiyonunda tespit edilemez (Şekil 2B).
Toplandıktan sonra, birincil akciğer retinoid içeren hücreler, retinoid konsantrasyonları, hücre morfolojisi, gen ekspresyonu ve farmakolojik manipülasyonlara yanıt verme ile ilgili daha ileri analizler için doğrudan analiz edilebilir veya kültürlenebilir (Şekil 1).
Bu prosedürü kullanarak, akciğer retinoid içeren hücreler arasında farklı hücre popülasyonlarının mevcut olduğunu daha önce gösterebildik1. Spesifik olarak, FACS tarafından toplanan retinoid içeren hücrelerin tek hücreli RNA dizilimini gerçekleştirerek, bu hücreler arasında stromal hücre grubunun (toplam toplanan hücrelerin %83'ü) en bol olduğunu, bunu endotelyal (toplam toplanan hücrelerin %7'si), epitel (toplam toplanan hücrelerin %5'i) ve miyeloid hücrelerin (toplam toplanan hücrelerin yaklaşık %5'i) izlediğini gösterdik1. İzole edilmiş retinoid içeren akciğer hücrelerinin heterojenliği hakkındaki veriler, tarif edilen prosedürün özgüllüğünü azaltmaz; Daha ziyade, bu veriler, fenotipik olarak çeşitli hücreleri ve geniş retinoid aracılı hücresel iletişimi içeren yetişkin akciğerindeki retinoid metabolizmasının daha önce şüphelenilmeyen karmaşıklığını vurgulamaktadır.
Akciğer Col1a2+ retinoid içeren hücrelerin izolasyonu
İzole edilmiş retinoid içeren hücreler arasında heterojen hücre popülasyonlarının varlığı göz önüne alındığında, araştırmacılar retinoid metabolizmasında yer alan belirli bir akciğer hücresi tipini incelemeye odaklanmak isteyebilirler. Bu amaçla, hedef hücre popülasyonunun ek in vivo hücreye özgü etiketlemesi yapılabilir.
Oldukça heterojen akciğer hücresi popülasyonları arasında, pulmoner lipid interstisyel hücreler veya akciğer lipofibroblastları olarak adlandırılan fibroblastik özelliklere sahip akciğer mezenkimal stromal hücrelerinin bir alt popülasyonu, retinoidleri biriktirebilen baskın hücre tipidir 1,57,58. Akciğer fibroblastlarının bir alt popülasyonunu in vivo olarak etiketlemek için, fibroblastlarda tdTomato genini eksprese eden fareler (F-tdT fareleri), Col1a2-CreER fareleri ile bir tdTomato raportör kaseti barındıran farelerin çaprazlanmasıyla üretildi. F-tdT farelerinde Cre ekspresyonu, art arda toplam 5 gün boyunca her 24 saatte bir 2 mg tamoksifen ip enjeksiyonu ile indüklendi; Son tamoksifen enjeksiyonundan bir ay sonra, fareler deneyler için kullanıldı. Bu yaklaşım, Col1a2 + fibroblastlarının tdTomato proteini ile etiketlenmesine ve yukarıda açıklanan bir prosedür kullanılarak sindirilmiş akciğerin tek hücreli süspansiyonlarından izole edilmesine izin verdi. Yaklaşım, canlı (SYTOX Green negatif), tek tdTomato+ hücrelerinin yakalanmasına izin verir (Şekil 3). Daha sonra, retinoid içeren hücrelerin bir alt popülasyonu, yukarıda tarif edildiği gibi retinoid otofloresansa (Şekil 3) dayalı bir geçit stratejisi kullanılarak yakalanan tüm tdTomato+ hücrelerinden ayrılabilir. Ek olarak, bu prosedür, retinoid floresan sinyalinin yoğunluğuna bağlı olarak tdTomato+ hücrelerinin farklı popülasyonlarının yüksek, orta ve düşük retinoid içeren hücre alt popülasyonlarına daha sonra sıralanmasına ve ayrı toplanmasına izin verir.
Etkili Cre rekombinasyonu ve tdTomato ekspresyonu, tamoksifen ile tedavi edilen F-tdT farelerinden akciğer fibroblastlarının hedef hücre popülasyonunun, anti-Pdgfrα manyetik boncuklar ve manyetik aktive hücre sınıflandırması (MACS) kullanılarak izole edilmesiyle doğrulandı. Ek olarak, sıralanan retinoid içeren hücrelerde retinoidlerin varlığını doğrulamak için HPLC analizi yapılmıştır (Şekil 4B).
Toplandıktan sonra, primer akciğer retinoid içeren fibroblastlar, retinoid konsantrasyonu, hücre morfolojisi, gen ekspresyonu ve farmakolojik manipülasyonlara yanıt verme ile ilgili daha ileri analizler için doğrudan analiz edilebilir veya kültürlenebilir. Örneğin, yabani tip (Lrat+/+) bir hayvandan izole edilen akciğer retinoid içeren fibroblastların karakteristik özelliklerinden biri, standart immünositokimya teknikleri kullanılarak kültürlenmiş hücrelerde görüntülenebilen lipid damlacıklarının varlığıdır (Şekil 4C).

Şekil 1: Açıklanan deneysel iş akışının şematik bir gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
(Biorender.com ile oluşturuldu)

Şekil 2: Akciğer retinoid içeren hücrelerin FACS izolasyonu. (A) Vahşi tip bir C57Bl6/J (Lrat+/+) fareden izole edilen akciğer hücresi süspansiyonlarından λ = 350 nm'de uyarılma üzerine λ = 455 nm'de emisyon kullanarak tek, canlı, retinoid içeren hücreleri (kapalı alan tarafından tanımlanır) sıralamak için bir geçit stratejisi. (B) Bir Lrat-/- fareden izole edilen akciğer hücresi süspansiyonlarına uygulanan λ = 350 nm'de uyarılma üzerine λ = 455 nm'de emisyon kullanarak tek, canlı, retinoid içeren hücreleri sıralamak için bir geçit stratejisi; kapalı alan, Lrat-/- akciğerlerinde tespit edilmiş retinoid içeren hücreler olmadığını gösterir; Sayılar, kapılı hücrelerin yüzdesini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
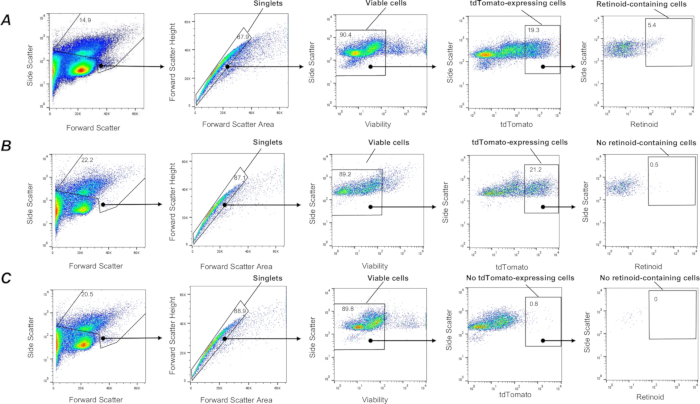
Şekil 3: Akciğer retinoid içeren Col1a2+ fibroblastlarının FACS izolasyonu. (A) Vahşi tip (C57Bl6/J) genetik arka plana sahip bir F-TdTom faresinden izole edilen akciğer hücresi süspansiyonlarından λ = 350 nm'de uyarılma üzerine λ = 455 nm'de emisyon kullanarak tek, canlı, tdTomato+ retinoid içeren hücreleri (kapalı alan tarafından tanımlanır) sıralamak için bir geçit stratejisi. Panel (B) Lrat-/- (C57Bl6/J) arka planında bir F-TdTom faresinden izole edilen akciğer hücresi süspansiyonlarına uygulanan λ = 350 nm'de uyarılma üzerine λ = 455 nm'de emisyon kullanarak tek, canlı, tdTomato+ retinoid içeren hücreleri (kapalı alan tarafından tanımlanır) sıralamak için bir geçit stratejisi; kapalı alan, bir Lrat-/- arka plan üzerinde F-TdTom farelerinden akciğerlerde tespit edilen retinoid içeren hücreleri göstermez. (C) Bir tdTomato-fareden izole edilen akciğer hücresi süspansiyonlarına uygulanan λ = 350 nm'de uyarılma üzerine λ = 455 nm'de emisyon kullanarak tek, canlı, tdTomato+ retinoid içeren hücreleri (kapalı alan tarafından tanımlanır) sıralamak için bir geçit stratejisi; kapalı alan tespit edilen tdTomato+'yı göstermez; Sayılar, kapılı hücrelerin yüzdesini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Retinoid içeren Col1a2+ / tdTomato+ fibroblastlar. (A) Kültürde MACS izole edilmiş vahşi tip (Lrat+/+) Col1a2+ / tdTomato+ akciğer hücrelerinin temsili bir mikrofotoğrafı; karakteristik tdTomato floresansına sahip kültürlenmiş hücreler, TX Red filtresi ve 20x büyütme kullanılarak yakalandı; ölçek çubuğu 150 μm'dir. (B) 1·105 sıralanmış retinoid içeren hücrelerden ekstrakte edilen retinoid türlerinin (retinol ve retinil esterler) karakteristik tepe noktalarını ve alıkonma sürelerini gösteren bir HPLC profili (eklenmiş büyütme ile). (C) Lipid damlacığı ile ilişkili adipoz farklılaşması ile ilişkili protein (Adrp / Perilipin 2) için boyanmış kültürde FACS izole edilmiş vahşi tip (Lrat+/+) Col1a2 + / tdTomato+ akciğer hücrelerinin temsili bir mikrofotoğrafı; lekeli hücreler GFP filtresi ve 40x büyütme kullanılarak yakalandı; Ölçek çubuğu 75 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İnsan ve hayvan dokularında A vitamini tespiti ve floresan mikroskobu kullanılarak histolojik görselleştirme yeteneği ilk olarak 1940'lar59,60 gibi erken bir tarihte rapor edilmiştir. Retinoid otofloresan fenomeni daha sonra in vitro61 dokularda yüksek konsantrasyonlarda A vitamini bulmayı ve floresan mikroskobu kullanarak hayvan embriyonik dokularının62 morfogenezini karakterize etmeyi amaçlayan çalışmalara başarıyla uygulandı. Daha sonra, hücresel retinoidlerin ayırt edici otofloresansının (λ = 455 nm'de karakteristik mavi-yeşil emisyon ile λ = 350 nm'de uyarma) spesifik hücre tipleri ile ilişkili olduğu ve bu nedenle bu hücreleri izole etmek ve karakterize etmek için uygulanabileceği deneysel olarak gözlemlendi ve doğrulandı 63,64,65.
Retinoid otofloresan, retinoid içeren hücrelerin kimliklerini belirlemek ve / veya bu hücrelerin karaciğer 41,42,43,44, pankreas45,46, böbrekler 41,47 ve akciğer 41'deki bolluğunu ölçmek için yayınlanmış çalışmalarda kullanılmıştır. Ayrıca, birkaç araştırma grubu, FACS ile izole etmek ve karaciğer 44,48,49,50,51,52,53 ve akciğer 1 dahil olmak üzere canlı dokulardan birincil retinoid içeren hücreleri incelemek için retinoid floresan kullanıldığını bildirmiştir.
Burada, retinoid otofloresansın FACS kullanarak akciğer retinoid içeren hücreleri tanımlamak ve sıralamak için birincil özellik olarak kullanılabileceği protokolü açıklıyoruz. Tespit edilen floresan retinoidler arasında sadece retinol ve retinil esterler bulunur. Bu nedenle, yalnızca bu A vitamini türevlerini (öncelikle retinil esterler) içeren hücreler sıralanabilir. Ek olarak, araştırmacıların hücre özgüllüğünü daraltmak için hücreye özgü ek etiketleme yaklaşımları kullanabilecekleri protokolün ek ilerlemesini sağlıyoruz. Bu, akciğer retinoid içeren hücrelerin florokrom konjuge antikorlar ve ek sıralama1 ile işaretlenmesiyle elde edilebilir. Alternatif olarak, akciğer hücrelerinin ek hücreye özgü etiketlemesi, Cre ekspresyon verimliliğinin ve hücre özgüllüğünün doğrulanmasını takiben hücreye özgü Cre-rekombinaz eksprese eden hayvan modelleri kullanılarak raportör floresan proteinlerinin eksprese edilmesiyle in vivo olarak elde edilebilir. Burada tarif edilen protokol, bu yaklaşımın birçok seçeneğinden biri olarak akciğer fibroblastlarında Co1a2 güdümlü tdTomato proteini ekspresyonunun kullanımını vurgulamaktadır. Bununla birlikte, bu yaklaşım, uygun bir Cre ekspresyon modeli kullanıldığında endotelyal, epitel ve miyeloid hücreler dahil olmak üzere diğer akciğer hücre tiplerine uygulanabilir.
Açıklanan protokol, yaralı (iltihaplı, fibrotik vb.) akciğerlerden hücre izolasyonlarına da uygulanabilir; Ancak bu durumda bazı sınırlamalar göz önünde bulundurulmalıdır. Akciğer yaralanmaları, retinoid konsantrasyonlarında1 ilerleyici bir azalma ile ilişkilidir, bu nedenle bu protokolün uygulanmasını sınırlayabilir ve hücre verimini azaltabilir. Öte yandan, akciğer yaralanmaları fibroblast aktivasyonu ve Col1a2 dahil olmak üzere hücre dışı matriks proteinlerinin yüksek ekspresyonu ile ilişkilidir. Cre ekspresyonunun Col1a2 promotörü tarafından yönlendirildiği göz önüne alındığında, tdTomato ekspresyonu geliştirilebilir, böylece tdTomato eksprese eden hücre sayısını ve çalışmamızda kullanılan F-tdT farelerinin akciğerlerindeki tdTomato sinyalinin yoğunluğunu etkileyebilir.
Birlikte ele alındığında, burada açıklanan protokol, akciğerlerdeki retinoid metabolizmasının hücresel yönleri ve in vivo lipid aracılı hücresel iletişim hakkında daha derin bir bilgi edinmek için spesifik ve güçlü bir araç sağlar.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri / Ulusal Kalp, Akciğer ve Kan Enstitüsü (NIH / NHLBI) R01 HL171112 (IS'ye), Ulusal Sağlık Enstitüleri / Ulusal Çevre Sağlığı Bilimleri Enstitüsü (NIH / NIEHS) P30 ES005022 tarafından finanse edilen Rutgers Çevresel Maruziyetler ve Hastalıklar Merkezi'nden bir kariyer geliştirme ödülü (IS'ye) ile finanse edilmiştir. ve Rutgers, New Jersey Eyalet Üniversitesi'nden (I.S.'ye) başlangıç fonları. Yazarlar, Rutgers Kanser Enstitüsü'ndeki Bağışıklık İzleme ve Akış Sitometrisi Ortak Kaynağı personeline (kısmen NCI-CCSG P30CA072770-5920) sağlanan fonlarla desteklenmektedir) bu makalede sunulan çalışmaya katkılarından dolayı teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 mL serological pipette | Avantor/VWR | 76452-284 | |
| 100 µm strainer | Greiner Bio-One | 542000 | |
| 15 mL falcon tube | Corning | 352099 | |
| 40 µm strainer | Greiner Bio-One | 542040 | |
| 50 mL falcon tube | Corning | 352070 | |
| Cell culture dish, 35 mm ´ 10 mm | Corning | 430165 | |
| Cell sorting media | Gibco | A59688DJ | |
| Collagenase type IV | Worthington Biochemical Corporation | LS004188 | |
| Cytek Aurora Cell Sorter System | Cytek Biosciences | ||
| Dispase II | Sigma-Aldrich | D4693 | |
| DNase I | Sigma-Aldrich | DN25 | |
| Falcon brand 5-ml polypropylene round bottom tube, 12 mm ´ 75 mm | Corning | 352063 | |
| Falcon brand 5-ml polystyrene round-bottom tube with cell-strainer cap, 12 mm ´ 75 mm | Corning | 352235 | |
| FlowJo software | Becton Dickinson | flow cytometry software | |
| HBSS with Ca2+/Mg2+ | Gibco | 14925-092 | |
| HBSS without Ca2+/Mg2+ | Gibco | 14175-095 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters | ThermoFisher | 595-3320 | |
| Red Cell lysis buffer | Sigma-Aldrich | R7757 | |
| SpectroFlo CS software | Cytek Biosciences | Version 1.3.0 | |
| Surgical Design Royaltek Stainless Steel Surgical Scalpel Blades | Fisher Scientific | 22-079-683 | |
| SYTOX Green dead cell stain | Invitrogen | S34860 | |
| Tamoxifen | Sigma-Aldrich | T2859 |
Referanslar
- Shmarakov, I. O., et al. Retinoids stored locally in the lung are required to attenuate the severity of acute lung injury in male mice. Nat Commun. 14 (1), 851 (2023).
- Bogue, C. W., Jacobs, H. C., Dynia, D. W., Wilson, C. M., Gross, I. Retinoic acid increases surfactant protein mRNA in fetal rat lung in culture. Am J Physiol Lung Cell Mol Physiol. 271 (5), L862-L868 (1996).
- Ng-Blichfeldt, J. -. P., et al. Retinoic acid signaling balances adult distal lung epithelial progenitor cell growth and differentiation. EBioMedicine. 36, 461-474 (2018).
- Chen, F., et al. Prenatal retinoid deficiency leads to airway hyperresponsiveness in adult mice. J Clin Invest. 124 (2), 801-811 (2014).
- Esteban-Pretel, G., Marin, M. P., Renau-Piqueras, J., Barber, T., Timoneda, J. Vitamin A deficiency alters rat lung alveolar basement membrane: reversibility by retinoic acid. J Nutr Biochem. 21 (3), 227-236 (2010).
- Massaro, G. D., Massaro, D. Postnatal treatment with retinoic acid increases the number of pulmonary alveoli in rats. Am J Physiol. 270 (2 Pt 1), L305-L310 (1996).
- Hind, M., Maden, M. Retinoic acid induces alveolar regeneration in the adult mouse lung. Eur Respir J. 23 (1), 20-27 (2004).
- Belloni, P. N., Garvin, L., Mao, C. P., Bailey-Healy, I., Leaffer, D. Effects of all-trans-retinoic acid in promoting alveolar repair. Chest. 117 (5 Suppl 1), 235S-241S (2000).
- Veness-Meehan, K. A., Bottone, F. G., Stiles, A. D. Effects of retinoic acid on airspace development and lung collagen in hyperoxia-exposed newborn rats. Pediatr Res. 48 (4), 434-444 (2000).
- Cho, S. J., George, C. L., Snyder, J. M., Acarregui, M. J. Retinoic acid and erythropoietin maintain alveolar development in mice treated with an angiogenesis inhibitor. Am J Respir Cell Mol Biol. 33 (6), 622-628 (2005).
- Massaro, G. D., Massaro, D. Retinoic acid treatment abrogates elastase-induced pulmonary emphysema in rats. Nat Med. 3 (6), 675-677 (1997).
- Stinchcombe, S. V., Maden, M. Retinoic acid induced alveolar regeneration: critical differences in strain sensitivity. Am J Respir Cell Mol Biol. 38 (2), 185-191 (2008).
- Fraslon, C., Bourbon, J. R. Retinoids control surfactant phospholipid biosynthesis in fetal rat lung. Am J Physiol. 266 (6 Pt 1), L705-L712 (1994).
- Zachman, R. D. Role of vitamin A in lung development. J Nutr. 125 (6 Suppl), 1634s-1638s (1995).
- van Bennekum, A. M., et al. Lipoprotein lipase expression level influences tissue clearance of chylomicron retinyl ester. J Lipid Res. 40 (3), 565-574 (1999).
- Blaner, W. S., et al. Lipoprotein lipase hydrolysis of retinyl ester: possible implications for retinoid uptake by cells. J Biol Chem. 269 (24), 16559-16565 (1994).
- Trites, M. J., Febbraio, M., Clugston, R. D. Absence of CD36 alters systemic vitamin A homeostasis. Sci Rep. 10 (1), 20386 (2020).
- Wassef, L., Quadro, L. Uptake of dietary retinoids at the maternal-fetal barrier: in vivo evidence for the role of lipoprotein lipase and alternative pathways. J Biol Chem. 286 (37), 32198-32207 (2011).
- Spiegler, E., Kim, Y. -. K., Wassef, L., Shete, V., Quadro, L. Maternal-fetal transfer and metabolism of vitamin A and its precursor β-carotene in the developing tissues. Biochim Biophys Acta Mol Cell Biol Lipids. 1821 (1), 88-98 (2012).
- Kedishvili, N. Y. Enzymology of retinoic acid biosynthesis and degradation. J Lipid Res. 54 (7), 1744-1760 (2013).
- Channabasappa, S., Caldwell, S., Kanthan, R., Singh, B. Retinoid receptors are expressed in mouse and human lungs. Anat Rec. 305 (9), 2281-2289 (2022).
- Kimura, Y., et al. Retinoid receptors in the developing human lung. Clin Sci (Lond). 103 (6), 613-621 (2002).
- Yang, L., Naltner, A., Yan, C. Overexpression of dominant negative retinoic acid receptor alpha causes alveolar abnormality in transgenic neonatal lungs. Endocrinology. 144 (7), 3004-3011 (2003).
- Snyder, J. M., et al. Alveolarization in retinoic acid receptor-beta-deficient mice. Pediatr Res. 57 (3), 384-391 (2005).
- Gao, R. -. w., et al. Retinoic acid promotes primary fetal alveolar epithelial type II cell proliferation and differentiation to alveolar epithelial type I cells. In Vitro Cell Dev Biol Anim. 51 (5), 479-487 (2015).
- Dirami, G., et al. Lung retinol storing cells synthesize and secrete retinoic acid, an inducer of alveolus formation. Am J Physiol Lung Cell Mol Physiol. 286 (2), L249-L256 (2004).
- Massaro, G. D., Massaro, D., Chambon, P. Retinoic acid receptor-alpha regulates pulmonary alveolus formation in mice after, but not during, perinatal period. Am J Physiol Lung Cell Mol Physiol. 284 (2), L431-L433 (2003).
- Massaro, G. D., et al. Retinoic acid receptor-beta: an endogenous inhibitor of the perinatal formation of pulmonary alveoli. Physiol Genomics. 4 (1), 51-57 (2000).
- McGowan, S., et al. Mice bearing deletions of retinoic acid receptors demonstrate reduced lung elastin and alveolar numbers. Am J Respir Cell Mol Biol. 23 (2), 162-167 (2000).
- Yan, C., et al. Retinoic acid-receptor activation of SP-B gene transcription in respiratory epithelial cells. Am J Physiol Lung Cell Mol Physiol. 275 (2), L239-L246 (1998).
- Ghaffari, M., Whitsett, J. A., Yan, C. Inhibition of hSP-B promoter in respiratory epithelial cells by a dominant negative retinoic acid receptor. Am J Physiol Lung Cell Mol Physiol. 276 (3), L398-L404 (1999).
- Yang, L., et al. Synergy between signal transducer and activator of transcription 3 and retinoic acid receptor-α in regulation of the surfactant protein b gene in the lung. Mol Endocrinol. 18 (6), 1520-1532 (2004).
- Metzler, M. D., Snyder, J. M. Retinoic acid differentially regulates expression of surfactant-associated proteins in human fetal lung. Endocrinology. 133 (5), 1990-1998 (1993).
- George, T. N., Snyder, J. M. Regulation of surfactant protein gene expression by retinoic acid metabolites. Pediatr Res. 41 (5), 692-701 (1997).
- Naltner, A., Ghaffari, M., Whitsett, J. A., Yan, C. Retinoic acid stimulation of the human surfactant protein B promoter is thyroid transcription factor 1 site-dependent. J Biol Chem. 275 (1), 56-62 (2000).
- Ng-Blichfeldt, J. P., et al. Deficient retinoid-driven angiogenesis may contribute to failure of adult human lung regeneration in emphysema. Thorax. 72 (6), 510-521 (2017).
- Lochbaum, R., et al. Retinoic acid signalling adjusts tight junction permeability in response to air-liquid interface conditions. Cell Signal. 65, 109421 (2020).
- Mamidi, S., Hofer, T. P., Hoffmann, R., Ziegler-Heitbrock, L., Frankenberger, M. All-trans retinoic acid up-regulates prostaglandin-e synthase expression in human macrophages. Immunobiology. 217 (6), 593-600 (2012).
- Hashimoto, S., et al. Retinoic acid differentially regulates interleukin-1beta and interleukin-1 receptor antagonist production by human alveolar macrophages. Leuk Res. 22 (11), 1057-1061 (1998).
- Li, S., Lei, Y., Lei, J., Li, H. Alltrans retinoic acid promotes macrophage phagocytosis and decreases inflammation via inhibiting CD14/TLR4 in acute lung injury. Mol Med Rep. 24 (6), (2021).
- Nagy, N. E., et al. Storage of vitamin A in extrahepatic stellate cells in normal rats. J Lipid Res. 38 (4), 645-658 (1997).
- Thompson, K. C., et al. Primary rat and mouse hepatic stellate cells express the macrophage inhibitor cytokine interleukin-10 during the course of activation in vitro. Hepatology. 28 (6), 1518-1524 (1998).
- Zhang, X. Y., Sun, C. K., Wheatley, A. M. A novel approach to the quantification of hepatic stellate cells in intravital fluorescence microscopy of the liver using a computerized image analysis system. Microvasc Res. 60 (3), 232-240 (2000).
- D'Ambrosio, D. N., et al. Distinct populations of hepatic stellate cells in the mouse liver have different capacities for retinoid and lipid storage. PLoS One. 6 (9), e24993 (2011).
- Apte, M. V., et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 43 (1), 128-133 (1998).
- Kim, N., et al. Formation of vitamin A lipid droplets in pancreatic stellate cells requires albumin. Gut. 58 (10), 1382-1390 (2009).
- Kida, Y., et al. Characterization of vitamin A-storing cells in mouse fibrous kidneys using Cygb/STAP as a marker of activated stellate cells. Arch Histol Cytol. 70 (2), 95-106 (2007).
- Ogawa, T., et al. Identification of vitamin A-free cells in a stellate cell-enriched fraction of normal rat liver as myofibroblasts. Histochem Cell Biol. 127 (2), 161-174 (2007).
- Tacke, F., Weiskirchen, R. Update on hepatic stellate cells: pathogenic role in liver fibrosis and novel isolation techniques. Expert Rev Gastroenterol Hepatol. 6 (1), 67-80 (2012).
- Bartneck, M., et al. Isolation and time lapse microscopy of highly pure hepatic stellate cells. Anal Cell Pathol (Amst). , (2015).
- Balaphas, A., et al. Optimized isolation and characterization of C57BL/6 mouse hepatic stellate cells. Cells. 11 (9), (2022).
- Kubota, H., Yao, H. L., Reid, L. M. Identification and characterization of vitamin A-storing cells in fetal liver: implications for functional importance of hepatic stellate cells in liver development and hematopoiesis. Stem Cells. 25 (9), 2339-2349 (2007).
- Larsen, A. K., et al. Autofluorescence in freshly isolated adult human liver sinusoidal cells. Eur J Histochem. 65 (4), (2021).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120 (24), 4247-4260 (2007).
- National Research Council. . Guide for the Care and Use of Laboratory Animals. , (2011).
- O'Byrne, S. M., et al. Retinoid absorption and storage is impaired in mice lacking lecithin: retinol acyltransferase (LRAT). J Biol Chem. 280 (42), 35647-35657 (2005).
- McGowan, S. E., Torday, J. S. The pulmonary lipofibroblast (lipid interstitial cell) and its contributions to alveolar development. Annu Rev Physiol. 59, 43-62 (1997).
- McGowan, S. E. The lipofibroblast: more than a lipid-storage depot. Am J Physiol Lung Cell Mol Physiol. 316 (5), L869-L871 (2019).
- Meyer, K. A., Popper, H., Ragins, A. B. Histologic distribution of vitamin A in biopsy specimens of the liver. Arch Surg. 43 (3), 376-385 (1941).
- Popper, H. L. Histological demonstration of vitamin A in rats by means of fluorescence microscopy. Proc Soc Exp Biol Med. 43, 133-136 (1940).
- Van Exan, R. J., Hardy, M. H. Localization of vitamin A by autofluorescence during induced metaplastic changes in cultures of skin. In Vitro. 15 (8), 631-640 (1979).
- Schweigert, F. J., Siegling, C., Tzimas, G., Seeger, J., Nau, H. Distribution of endogenous retinoids, retinoid binding proteins (RBP, CRABPI) and nuclear retinoid X receptor beta (RXRbeta) in the porcine embryo. Reprod Nutr Dev. 42 (4), 285-294 (2002).
- Wake, K. Perisinusoidal stellate cells (fat-storing cells, interstitial cells, lipocytes), their related structure in and around the liver sinusoids, and vitamin A-storing cells in extrahepatic organs. Int Rev Cytol. 66, 303-353 (1980).
- Senoo, H., Kojima, N., Sato, M. Vitamin A-storing cells (stellate cells). Vitam Horm. 75, 131-159 (2007).
- Senoo, H., et al. Hepatic stellate cell (vitamin A-storing cell) and its relative--past, present and future. Cell Biol Int. 34 (12), 1247-1272 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır