Method Article
Konfokal Taramalı Lazer Oftalmoskopi ile Uyarlanmış Adeno-İlişkili Virüs Serotiplerine Sahip Retina Hücrelerinin Boyuna İn Vivo Görüntülenmesi
Bu Makalede
Özet
Bu protokol, hücreye özgü etiketleme ve konfokal taramalı lazer oftalmoskop (CSLO) kullanılarak in vivo görüntüleme için adeno-ilişkili virüs (AAV) vektörlerinin kullanımını açıklar. Bu yöntem, farklı retina hücre tiplerinin ve bunların retina fonksiyon ve hastalığına katkılarının araştırılmasını sağlar.
Özet
Retinal hücresel süreçlerin dinamik doğası, oküler hastalıkların anlaşılmasını ve tedavisini geliştirmek için gen iletimi ve canlı izleme tekniklerinde ilerlemeler gerektirmektedir. Bu çalışma, retinal ganglion hücreleri (RGC'ler) ve Müller glia dahil olmak üzere hedeflenen retina hücrelerinde optimal transfeksiyon verimliliği elde etmek için spesifik serotipler ve promotörler kullanan optimize edilmiş bir adeno-ilişkili virüs (AAV) yaklaşımını tanıtmaktadır. Konfokal taramalı lazer oftalmoskopinin (CSLO) hassasiyetinden yararlanan bu çalışma, AAV aracılı yeşil floresan proteinin (GFP) uzunlamasına ekspresyonunu yakalayan in vivo görüntüleme için invaziv olmayan bir yöntem sunmaktadır. Bu yaklaşım, gözlemin sürekliliğini ve konunun refahını koruyarak terminal prosedürlere olan ihtiyacı ortadan kaldırır. Ayrıca, GFP sinyali, AAV ile enfekte RGC'lerde superior colliculus (SC) ve lateral genikülat çekirdeğe (LGN) giden görsel yol boyunca izlenebilir ve bu da doğrudan görsel yol haritalama potansiyelini mümkün kılar. Bu bulgular ayrıntılı bir protokol sağlar ve retina hücresi davranışı, hastalık patogenezi ve gen tedavisi müdahalelerinin etkinliği ile ilgili gerçek zamanlı çalışmalar için bu güçlü aracın uygulanmasını gösterir ve canlı retina ve bağlantıları hakkında değerli bilgiler sunar.
Giriş
Merkezi sinir sisteminin optik olarak erişilebilir tek parçası olan retina, sinirbilim araştırmaları için değerli bir model olarak hizmet eder1. Görsel bilgiyi beyne ileten retinanın çıkış nöronları olan retina ganglion hücreleri (RGC'ler), görsel işlevde çok önemli bir rol oynar. Bunların kaybı veya işlev bozukluğu, glokom ve diğer optik nöropatilerde görüldüğü gibi görme bozukluğuna ve geri dönüşü olmayan körlüğe yol açar2. Retinadaki ana glial hücreler olan Müller glia, retina homeostazını korumak, nöronlara yapısal ve metabolik destek sağlamak, nörotransmitter seviyelerini düzenlemek ve retina onarımına ve yenilenmesine katkıda bulunmak için gereklidir3. İşlev bozuklukları, diyabetik retinopati4, yaşa bağlı makula dejenerasyonu5 ve oküler iskemik sendrom6 dahil olmak üzere çeşitli retina hastalıklarında rol oynar. RGC'ler ve Müller glia, yakın etkileşimler ve karşılıklı bağımlılık sergiler; Müller glia, RGC'lere temel destek sağlarken, RGC aktivitesi Müller glia fonksiyonunu etkileyebilir 3,7. Hem RGC'leri hem de Müller glia'yı incelemek, retina fonksiyonunu anlamak ve çoklu retina hastalıkları için etkili tedaviler geliştirmek için çok önemlidir.
Retina araştırmalarındaki güncel değerlendirmeler, öncelikle retina sinir lifi tabakasının kalınlığını veya akson demetlerinin yörüngelerini ölçmek için optik koherens tomografi (OCT) gibi teknikleri kullanır 8,9. Bu yöntemler RGC kaybını tespit etmek için paha biçilmez olsa da, sınırlı çözünürlük nedeniyle RGC morfolojisi ve glial hücrelerin ayrıntılı bir görünümünü sağlamazlar. Benzer şekilde, adaptif optik taramalı lazer oftalmoskopi (AO-SLO) gibi gelişmiş teknikler, yaşayan insan retinasındaki RGC'lerin, fotoreseptörlerin ve glial hücrelerin hücresel düzeyde görüntülenmesini sağlasada 10, teknik karmaşıklıkları ve sınırlı erişilebilirlikleri, kullanımlarını öncelikle özel araştırma ortamlarıyla sınırlandırmaktadır. Bu kısıtlamalar göz önüne alındığında, in vivo olarak spesifik retina hücre popülasyonlarının derinlemesine incelenmesi için daha erişilebilir ve güvenilir yöntemler geliştirmeye devam eden bir ihtiyaç vardır.
Bu doğrultuda, bu protokol retina hücrelerinde araştırma uygulamalarına uygun alternatif bir görüntüleme yaklaşımı sunmayı amaçlamaktadır. AAV aracılı hücre tipine özgü etiketlemenin gücünü, CSLO görüntülemenin invaziv olmayan doğasıyla birleştirir. Adeno-ilişkili virüsler (AAV'ler), düşük immünojenisiteleri ve hem bölünen hem de bölünmeyen hücreler dahil olmak üzere çok çeşitli hücre tiplerini transdüksiyon yetenekleri ile bilinen çok yönlü gen dağıtım vektörleridir11. Bu, onları karmaşık retina ortamındaki belirli hücre popülasyonlarını hedeflemek için ideal araçlar haline getirir. Dikkatle seçilmiş serotipler ve promotörler ile AAV vektörleri kullanılarak, RGC'ler ve Müller glia gibi birden fazla hücre tipinde floresan proteinlerin seçici ekspresyonu elde edilebilir. Örneğin, AAV2, RGC'lerde(12,13) daha yüksek transdüksiyon verimliliği ile bilinirken, AAV8, fotoreseptörleri14 hedeflemede belirgin şekilde etkilidir ve AAV9, Müller glia15'te güçlü transfeksiyon yetenekleri gösterir ve çeşitli retina hücre katmanlarında geniş verimlilik gösterir. AAV'nin etkinliğinin sadece serotip seçimine değil, aynı zamanda transgen ekspresyonunun yoğunluğunu ve hücre özgüllüğünü belirleyen promotörlere de dayandığını ve optimal transdüksiyonu elde etmek için dikkatli seçimin önemini vurguladığını belirtmek önemlidir.
RGC etiketlemesi için bu protokol, insan sinapsin (hSyn) promotörü ile AAV2 kullanır. AAV2, intravitreal enjeksiyonu13 takiben RGC'lerin verimli transdüksiyonunu sergiler ve her yerde bulunan bir nöronal promotör olan hSyn promotörü, bu hücreler16 içinde güçlü ve spesifik transgen ekspresyonunu yönlendirir. Müller glia için protokol, bu hücrelerde15 güçlü transgen ekspresyonu gösteren GfaABC1D promotörü17 tarafından yönlendirilen AAV9 vektörlerini kullanır. Bu hedefli etiketleme yaklaşımı, araştırmacıların bu hücreleri çevredeki retina dokusundan ayırt etmelerini ve zaman içinde izlemelerini sağlayarak, retina hücrelerinin in vivo sürveyansı ve biyo-çevresel değişikliklere tepkileri için bir temel sağlar.
Konfokal taramalı lazer oftalmoskopi (CSLO), canlı retinanın yüksek çözünürlüklü görüntülerini sağlayan ve floresan etiketli retina hücre popülasyonlarının gerçek zamanlı görselleştirilmesini sağlayan, invaziv olmayan bir görüntüleme tekniğidir 18,19,20. Odaklanmış bir lazer ışını retinayı tarayarak odak dışı sinyalleri ortadan kaldırmak için bir iğne deliğinden geçen yayılan ışığı yakalar ve gelişmiş kontrasta sahip daha keskin görüntüler sağlar. Bu protokol, transgenik etiketli RGC'ler21,22 ve mikroglia23'ü görselleştiren çalışmalar da dahil olmak üzere, canlı hayvanlarda retina hücresi görüntüleme için yaygın olarak kullanılan bir Heidelberg Spectralis CSLO sistemini kullanır. Araştırmacılar, 488 nm lazer ve uygun filtrelerle HRA CSLO ünitesini kullanarak, floresan raportör genleri taşıyan AAV vektörlerinin intravitreal enjeksiyonunu takiben canlı hayvanlarda floresan etiketli RGC'leri veya Müller glia'yı görüntüleyebilirler. Hem merkezi hem de periferik retinayı kapsayan haftalık seanslarla uzunlamasına görüntüleme protokolü, zaman içindeki değişiklikleri izler. Protokol, hayvan refahına öncelik vermek için HRA CSLO ünitesinin otomatik göz izleme sistemini (ART) kullanır ve genel anestezi veya kontakt lenslere ihtiyaç duymadan hassas görüntü elde edilmesini sağlar.
Bu protokol, belirli retinal hücre tiplerinin in vivo olarak uzunlamasına izlenmesini sağlamak için AAV ve CSLO'nun birleşik gücünden yararlanır. AAV aracılı etiketlemenin hücre tipi özgüllüğünü CSLO'nun invaziv olmayan, yüksek çözünürlüklü görüntüleme yetenekleriyle eşleştirerek, bu yöntem araştırmacıların çeşitli uyaranlara veya müdahalelere yanıt olarak RGC'lerdeki ve Müller gliasındaki dinamik değişiklikleri incelemelerine olanak tanır. Bu bilgiler, retina hastalıkları için yeni tanı ve tedavi stratejilerinin geliştirilmesini bilgilendirmek için önemli bir potansiyele sahiptir.
Protokol
Tüm deneyler, Oftalmik ve Görme Araştırmalarında Hayvanların Kullanımı için ARVO Beyanı'na uygun olarak yürütüldü ve Pekin Başkent Tıp Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylandı. Dört haftalık yetişkin erkek C57BL / 6J fareleri (15-20 g ağırlığında) tüm deneyler için kullanıldı ve 12/12 saatlik aydınlık / karanlık döngüsüne sahip sıcaklık kontrollü odalara yerleştirildi. Standart kemirgen yemeği ve su ad libitum olarak mevcuttu. Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. AAV aracılı retina hücre transfeksiyonu
NOT: RGC'lerin hedefli iletimi için bu protokol, gelişmiş GFP'nin sağlam ifadesini sağlamak için hSyn promotörünü içeren AAV2-hSyn-eGFP'yi kullanır. Müller glia, AAV9-GfaABC1D-eGFP kullanılarak hedeflenmiştir. Optimum transdüksiyon verimliliği ve sağlam transgen ekspresyonu elde etmek için, farelerde13 intravitreal enjeksiyonlar için minimum 1 x 1012 viral genom (vg) / mL'lik bir AAV titresi önerilir.
- Kazara maruz kalmayı önlemek ve güvenli bir çalışma ortamı sağlamak için AAV aracılı retina hücresi transfeksiyon prosedürlerini yürütürken sıkı güvenlik protokollerine uyun.
- Viral vektörleri içeren tüm prosedürleri sertifikalı bir biyogüvenlik kabini (BSC) içinde gerçekleştirin. Prosedür süresince personeli laboratuvar önlükleri, eldivenler ve göz koruması dahil olmak üzere uygun kişisel koruyucu ekipman (KKD) ile donatın.
- Uyumluluğu sürdürmek ve tüm laboratuvar personelini korumak için tüm kesici aletleri ve biyolojik tehlike malzemelerini kurumsal güvenlik protokollerine uygun olarak uygun şekilde atın.
2. Viral vektörlerin ve hayvanların hazırlanması
- -80 °C'de saklanan AAV2-hSyn-eGFP veya AAV9-GfaABC1D-eGFP vektörlerini elde edin. Viral bütünlüğü korumak için vektörleri kullanmadan hemen önce buz üzerinde çözdürün.
- Fareleri 50 mg / kg'lık bir dozda intraperitoneal pentobarbital sodyum enjeksiyonu ile uyuşturun. Daha fazla işlem yapmadan önce arka ayak reflekslerini test ederek anestezi derinliğini onaylayın.
- İşlem sırasında cerrahi alana müdahale etmesini önlemek için bıyıkları kesin. Yörüngeyi 2 saniye boyunca% 20 Povidon-iyot çözeltisi ile dezenfekte edin, ardından steril normal tuzlu su ile iyice durulayın.
- Rahatsızlığı en aza indirmek ve istemsiz göz hareketlerini önlemek için topikal olarak% 0.5 proparakain damlası uygulayın.
3. Viral vektörlerin taşınması ve intravitreal enjeksiyonu
- Viral aktiviteyi etkileyebilecek sıcaklık dalgalanmalarını önlemek için 1 μL seçilmiş AAV solüsyonunu (AAV2-hSyn-eGFP veya AAV9-GfaABC1D-eGFP) temiz, önceden soğutulmuş bir parafin film parçasına aktarın.
- Oftalmik cerrahi mikroskop altında 33 G eğimli iğneli bir Hamilton cam şırınga kullanarak AAV solüsyonunu aspire edin.
- Fareyi mikroskop altında ventral yaslanma pozisyonuna yerleştirin. Enjeksiyona yönelik oküler tarafı yükseltmek için başınızı hafifçe eğin. Fare yörüngesinin üst bölgesini net bir şekilde tanımlamak için mikroskobun büyütme oranını ayarlayın ve optimize edin.
- İğneyi gözün üst skleral kenarındaki limbusun 1-2 mm arkasına, vitreus boşluğuna sokun. Geri akış veya basınç kaynaklı hasarı önlemek için AAV çözeltilerini yavaşça enjekte edin.
NOT: Enjeksiyon yeri konumu: Enjeksiyonu gözün üst temporal kadranında, limmusun yaklaşık 1 mm gerisinde gerçekleştirin. Büyük kan damarlarından kaçınmak ve lens hasarı riskini en aza indirmek için bu konumu seçin. İris penetrasyonunu veya lens aşınmasını önlemek için limbusa çok yakın enjeksiyon bölgelerinden kaçının. Damar sisteminden kaçınmak: Enjeksiyondan önce görünür kan damarları için planlanan enjeksiyon bölgesini dikkatlice incelemek için bir ameliyat mikroskobu kullanın. Gemiler varsa, bunlardan kaçınmak için giriş noktasını hafifçe ayarlayın. Vasküler hasar riskini daha da azaltmak için iğneyi irise paralel olarak sığ bir açıyla yerleştirin. Subretinal kanama riskini azaltmak için aynı bölgeye tekrarlanan enjeksiyonlardan kaçının. - Vektörlerin vitreus odası içinde dağılmasına ve retina yüzeyine yerleşmesine izin vermek için iğneyi 30 saniye boyunca yerinde tutun, böylece başarılı transdüksiyon şansını en üst düzeye çıkarın.
- Vitreus geri akış riskini en aza indirmek için iğneyi yavaşça geri çekin.
- Enjeksiyondan hemen sonra enjeksiyon bölgesine topikal bir antibiyotik merhem sürün. Merhemin oküler yüzeyi tamamen kaplamak, oküler enfeksiyonu ve iltihabı önlemek için eşit şekilde uygulandığından emin olun.
NOT: Antibiyotik merhem 1 mg / g Deksametazon, 3500 IU / g Neomisin Sülfat ve 6000 IU / g Polimiksin B Sülfat içerir. - Anesteziden iyileşme sırasında vücut ısısını korumak için fareyi bir ısıtma yastığının üzerine yerleştirin ve herhangi bir sıkıntı veya anormallik belirtisi için yakından izleyin. Tamamen iyileştikten ve herhangi bir komplikasyon göstermedikten sonra, normal yiyecek ve suya erişimleri olan kafeslerine geri koyun.
4. CSLO ile in vivo görüntüleme
- Hayvan hazırlama
- 4 haftalık intravitreal enjeksiyondan sonra AAV2-hSyn-eGFP veya AAV9-GfaABC1D-eGFP ile enfekte olmuş fareyi seçin. Göz yüzeyine% 0.5 tropikamid ve% 0.5 fenilefrin içeren bir göz solüsyonu uygulayın ve göz bebeğini yaklaşık 2 mm çapındagenişletin 22.
NOT: İntravitreal enjeksiyon sonrası optimal retina hücreleri floresan etiketleme için en az 4 haftalık AAV transdüksiyon zaman aralığı önerilir13. Ek olarak, optik sinir ezilme (ONC) deneylerimizde, retinalar enfeksiyondan 4 hafta sonra ve ezilme yaralanmasını takip eden 7. ve 14. günlerde görüntülendi. Bu zaman noktaları, hem ilk AAV ekspresyonunu hem de ONC sonrası retina değişikliklerinin ilerlemesini yakalamak için seçildi. - İşlem işlemi sırasında hayvan dışkısının olası kontaminasyonunu önlemek için görüntüleme platformunu temiz pedin bir parçasıyla örtün.
NOT: Özel olarak oluşturulmuş görüntüleme platformu, hayvanın yüzüstü yatması için geniş alan sağlayarak stabilite sağlar ve optimum görüntü elde etmek için manuel kısıtlama sırasında hareketi en aza indirir. - Fareyi dikkatli bir şekilde görüntüleme platformuna aktarın ve stresi en aza indirmek ve görüntüleme ortamına adaptasyonu kolaylaştırmak için görüntülemeden önce 2-5 dakikalık bir iklimlendirme süresine izin verin.
- İkinci bir teknisyenin yardımıyla, prosedür boyunca bilinçli bir durumu korurken hayvanı nazikçe dizginleyin. Göz kırpmaya izin vermek ve kornea nemini korumak için 15 saniyelik görüntülemeden sonra 10 saniyelik bir dinlenme aralığı sağlayın.
NOT: Spontan göz kapağı kaldırmaya neden olmak için kafa derisini nazikçe ovalayın, zorla göz kapağı kısıtlaması veya klips gibi ek cihazların kullanılmasından kaçının, böylece göz yaralanması riskini azaltın. Genel anestezi, geçici lens opaklığını şiddetlendirme potansiyeline sahip olduğundan, uzun görüntüleme seansları sırasında optik netliği korumak için kullanılmaz. Prosedür boyunca yüksek kaliteli görüntü alımını hayvan konforu ve güvenliği ile dengeleyin. Hayvanların refahını sağlamak ve görüntüleme kalitesini korumak için tüm prosedürü 5 dakika içinde tamamlayın. - Odak düğmesini (Şekil 1B) ve mikro manipülatörü (Şekil 1C) sonraki in vivo görüntüleme için ilgilenilen bölgeyi (ROI) hedefleyecek şekilde ince ayar yaparak baş duruşunu ayarlayın ve kamera merceğini hizalayın.
- 4 haftalık intravitreal enjeksiyondan sonra AAV2-hSyn-eGFP veya AAV9-GfaABC1D-eGFP ile enfekte olmuş fareyi seçin. Göz yüzeyine% 0.5 tropikamid ve% 0.5 fenilefrin içeren bir göz solüsyonu uygulayın ve göz bebeğini yaklaşık 2 mm çapındagenişletin 22.
- Sistem yapılandırması
- Fundus alanının görüş alanını genişletmek için kameraya temassız 55° geniş açılı bir lens takın.
- Kızılötesi (IR) ve floresan anjiyografi (FA) görüntüleme modunun alınmasını sağlamak için filtre çarkını A (anjiyografi) konumuna getirin (Şekil 1A). CSLO görüntüleme sistemini etkinleştirmek için lazeri ve güç kaynağını açın.
- Heidelberg Eye Explorer yazılımını açın ve menü çubuğunun üst kısmındaki Yeni Hasta simgesine tıklayarak yeni bir muayene oluşturun. İlgili hayvan bilgilerini girin ve açılır pencerede 7,7 mm'lik varsayılan kornea eğriliğini kabul edin.
- Canlı görüntüleme modunu başlatmak için kontrol paneli ekranındaki sarı Başlat düğmesini (Şekil 1E) seçin.
- İn vivo CSLO görüntüleme
- Kontrol panelinde 1 nm uyarma dalga boyunda otofloresan ile IR modunu (Şekil 820G) seçin. Yüksek çözünürlüklü görüntüleme elde etmek için, Yüksek Çözünürlük. (HR) modu, pencere arayüzü veya manuel kontrol paneli aracılığıyla etkinleştirilir (Şekil 1F).
NOT: Kızılötesi yansıma (IR) görüntüleme, tipik olarak, temel bir görünüm sağlamak için floresein anjiyografiden (FA) önce elde edilen CLSO oftalmik görüntülemenin ilk adımıdır. Aydınlatma, minimum artefaktlar ve büyük retina damarlarına keskin odaklanma bile, z düzlemi odaklamanın güvenilirliği ve yüksek kaliteli IR görüntülerinin elde edilmesi için çok önemlidir. - İnce ayar için XYZ mikromanipülatörlü joystick'i kullanarak lensi fare gözüne doğru hareket ettirin. Optik şeffaflığı inceleyin ve fundus görüntüsünün parlaklığını %1-40'a düşürmek için hassasiyet düğmesini (Şekil 60D) saat yönünün tersine çevirin, böylece fundusun aşırı pozlanmasını önleyin ve retina ayrıntılarının görselleştirilmesini iyileştirin.
- Optik disk ve retina damarları fundus üzerinde açık bir şekilde tanımlanana kadar odak düğmesini ve mikromanipülatörü ayarlayın.
NOT: Optimal odak düzleminin kriterleri: (1) Karanlık köşeler olmadan eşit şekilde aydınlatılmış fundus görünümü. (2) Odak karanlık noktalar veya bozulma olmadan optik diski çevreleyen üniformalı aydınlatma. (3) Kan akışının görünür hareketi ile büyük retina damarlarının açık lümen şekli. - 1 nm'lik bir uyarma dalga boyunda katı hal mavi lazer ve 488 nm'de bir bariyer filtresi ile FA moduna (Şekil 500H) geçin. Hedeflenen retina alanını aydınlatmak için fundus görüntüsünün parlaklığını %50-107'ye çıkarmak için hassasiyet düğmesini (Şekil 1D) saat yönünde çevirin.
- Sinyal-gürültü oranını artırmak için ART ortalama değerini (yazılım arayüzünün sol alt köşesindeki mavi çubuk) en az 15'e ayarlayın. Bu işlev, aynı konumda elde edilen bir dizi B taramasının ortalamasını alarak görüntü kalitesini artırır.
NOT: Daha yüksek bir ART ortalama değeri genellikle ortalama alma yoluyla görüntü kalitesini artırırken, tarama süresini de uzatır. Bu uzun süre, özellikle uyanık hayvan görüntülemede dikkatle değerlendirilmesi gereken faktörler olan kornea dehidrasyonu ve hayvan yorgunluğu riskini potansiyel olarak artırabilir. - Retinanın iç düzlemine yeniden hizalayın, özellikle GFP eksprese eden RGC'leri veya Müller glial hücrelerini hedefleyin. RGC soma ve aksonlar veya Müller hücre gövdesi gibi istenen hücre popülasyonunun keskin bir şekilde aydınlatılmasını sağlamak için ince ayarlamalar yapılır. Görüntüleme hassasiyeti, optimum görselleştirme elde etmek ve GFP pozitif hücrelerin aşırı doygunluğunu önlemek için dengelenmiştir.
NOT: GFP sinyalinin karşılaştırılabilir netlik ve parlaklığına sahip görüntüleri elde etmek için, deneydeki tüm fareler için hassasiyet edinimi sabit olmalıdır. - Çevrimiçi canlı bir ortalama görüntü oluşturan ART modunu başlatmak için hassasiyet düğmesine (Şekil 1D) basın. Yazılım arayüzünün sol alt kısmındaki mavi çubuk (ART Ortalama değerini temsil eder) ayarlanan ART değerine (≥ 20 kare) ulaşana kadar bekleyin ve fundus görüntülerini yakalamak için kontrol arayüzündeki Edinim düğmesine dokunun.
NOT: ART modu için, in vivo görüntüleme sırasında küçük göz hareketlerini otomatik olarak telafi etmek için göz izleme dahil edilmiştir ve seçilen retinal odak düzlemine tutarlı odaklanma sağlar. - İstenen görüntüleri elde ettikten sonra, dokunmatik paneldeki hassasiyet düğmesine basarak ART modundan çıkın.
NOT: Kornea kurumasını önlemek ve kendiliğinden göz kırpmaya izin vermek için, görüntüleme işlemi sırasında her 15 saniyede bir 10 saniye ara verildi. - Nazal ve temporal retina bölgelerinde gezinmek için, ekrandaki canlı görüntüyü gözlemlerken kamera kafasını yatay olarak hareket ettirin. Hedef bölgeye ulaşıldığında, odakta ince ayar yapın ve 2.3.1-2.3.8 adımlarında açıklandığı gibi görüntüleme işlemini başlatın.
NOT: Fundusun tutarlı ve parlak bir şekilde aydınlatılmasını sağlarken yavaş ve kontrollü kamera hareketlerini sürdürün. Karanlık alanlar belirirse, kamera konumunu dikey olarak ayarlamak ve retinayı yeniden ortalamak için mikromanipülatörü kullanın. - Üst retinayı görüntülemek için, fare kafasının duruşunu nazikçe yüzü yukarı bakacak şekilde ayarlayın. Üst retina bölgesiyle hizalamak için kamera kafasını orta derecede yukarı doğru eğin. Odağı gerektiği gibi yeniden ayarlayın ve görüntülemeye devam edin.
- Görüntüleme tamamlandıktan sonra, istenen tüm retina bölgeleri, çekim penceresinden çıkar ve görüntüler otomatik olarak kaydedilir. Kornea hidrasyonunu korumak için görüntülenen göze topikal kayganlaştırıcı uygulayın.
- Kontralateral gözün muayenesini başlatmak için, hayvanı platformun karşı tarafına yeniden konumlandırın ve 2.3.1-2.3.11 adımlarını tekrarlayın.
- Kontrol panelinde 1 nm uyarma dalga boyunda otofloresan ile IR modunu (Şekil 820G) seçin. Yüksek çözünürlüklü görüntüleme elde etmek için, Yüksek Çözünürlük. (HR) modu, pencere arayüzü veya manuel kontrol paneli aracılığıyla etkinleştirilir (Şekil 1F).
5. Görüntü işleme ve analizi
- Görüntü dışa aktarma ve hazırlama
- Heidelberg Eye Explorer yazılımını açın ve istediğiniz CSLO görüntüleme oturumunu iyi kalitede seçin. Zaman içinde tutarlı hassasiyet ayarlarıyla aynı retina konumunun tek veya ardışık görüntülerini seçin.
- Odak veya kornea netliği zayıf olan bulanık görüntüleri hariç tutun ve analiz için yalnızca retina yapılarının net bir şekilde görselleştirildiği görüntülerin kullanıldığından emin olun. Daha fazla işlem için bu görüntüleri TIFF formatında dışa aktarın.
- Görüntü hizalama ve kırpma
- Görüntüleri fare gözü başına aynı retina bölgesine göre gruplandırın.
NOT: CSLO sisteminden alınan orijinal görüntüler şu biçimde kaydedilir: TIFF, 1536 x 1536 piksel boyutunda, 5,69 um/piksel çözünürlükte ve ≥15 ART değerinde. - Takip incelemeleri için, görüntüleri uygun görüntü işleme yazılımına aktarın. Görüntüleri, satır taban çizgisi görüntüsünün yönlendirmesiyle eşleşmesi için gerektiği gibi döndürün ve hizalayın. İşlenen görüntüleri kaydederken veya dışa aktarırken, olası sıkıştırma kusurlarını en aza indirmek için mümkün olan en yüksek görüntü kalitesini koruyan ayarları kullanın.
- Aynı gözün bir zaman serisinden CSLO görüntülerini, yer işaretleri olarak damar sistemi ve optik diski kullanarak ilgili temel görüntüyle eşleşecek şekilde döndürerek hizalayın.
NOT: Hizalanmış her görüntüyü dikkatlice inceleyin ve kırpmaya devam etmeden önce aşağıdaki kriterleri karşıladıklarından emin olun: (1) Tam retina bölgesi yakalama: Görüntü, optik disk ve ana kan damarları gibi önemli yer işaretleri de dahil olmak üzere, amaçlanan retina bölgesini tam olarak kapsamalıdır; (2) Hareket artefaktlarının olmaması: Görüntü, görüntüleme sırasında göz hareketinin neden olduğu yapıların bulanıklaşması, çizgilenmesi veya tekrarlanmasından arındırılmış olmalıdır; (3) Minimum bozulma: Görüntü, görüntüleme açılarından veya lens etkilerinden kaynaklanabilecek bükülme, gerilme veya sıkıştırma artefaktları olmadan retina yapısını doğru bir şekilde temsil etmelidir. (4) Görüntü kalitesi ölçümlerinin dengesi: Arka plan gürültü seviyelerinin değerlendirilmesi (Yapı içermeyen alanlarda piksel yoğunluklarının standart sapması < 5 (0-255 ölçek)); sinyal-gürültü oranı (SNR >20), aydınlatma tutarlılığı (Altı görüntü çeyreği arasındaki varyasyon katsayısı <%10) ve görüntü bütünlüğü (Homojen bölgelerdeki varyasyon katsayısı <%15). - Döndürülen görüntüyü seçin ve TIFF formatında dışa aktarın. Her zaman noktası için, kalite onaylı görüntülerden GFP pozitif hücreler içeren 5-10 alanı (her biri 300 x 300 piksel) rastgele seçmek ve kırpmak için kırpma aracını kullanın. Daha fazla analiz için kırpılan her görüntüyü ayrı ayrı TIFF formatında dışa aktarın.
- Görüntüleri fare gözü başına aynı retina bölgesine göre gruplandırın.
- Floresan yoğunluk ölçümü
- Kırpılmış CSLO görüntülerini (8 bit gri tonlamalı, 300 x 300 piksel) ImageJ/Fiji'de açın.
- Floresan sinyallerindeki genel değişiklikleri incelemek için Analiz Et > Ölç (veya Ctrl + M) kullanarak kırpılan görüntü başına toplam floresan yoğunluğunu ölçün. Kırpılan görüntünün tamamının ortalama GFP floresan yoğunluğunu temsil eden "Ortalama" değerini kaydedin.
- RGC miktar tayini
- ImageJ/Fiji'de, tek tek beyaz soma cisimlerinin siyah arka plana karşı en iyi şekilde görselleştirilmesini sağlamak için Görüntü > Parlaklığı/Kontrastı Ayarla > kırpılan CSLO görüntülerinin yoğunluk eşiğini ayarlayın.
NOT: Kırpılmış görüntü grubunu inceledikten sonra kişiselleştirilmiş bir eşik belirleyin veya tutarlı bir eşik algoritması uygulayın (örneğin, ImageJ/Fiji'de Huang'ın yöntemi5 ). Huang'ın yöntemi için: (1) Görüntüleri 8 bit gri tonlamaya dönüştürün (Görüntü > 8 bit > yazın). (2) Eşikleme aracına erişin (Resim > > Eşiğini Ayarlayın). (3) Eşikleme yöntemi olarak Huang'ı seçin. (4) Segmentasyonu önizleyin ve Uygula'ya tıklayın. Eşik otomatik olarak hesaplanacak ve görüntü histogramında görüntülenecektir. - Hücre Sayacı eklentisini etkinleştirin ve saymak için her GFP pozitif RGC soma'ya tıklayın. Analiz edilen bölgede işaretlenen toplam hücre sayısını kaydedin. Her takip zaman noktasından kırpılan tüm görüntüler için bu işlemi tekrarlayın.
- ImageJ/Fiji'de, tek tek beyaz soma cisimlerinin siyah arka plana karşı en iyi şekilde görselleştirilmesini sağlamak için Görüntü > Parlaklığı/Kontrastı Ayarla > kırpılan CSLO görüntülerinin yoğunluk eşiğini ayarlayın.
- Veri analizi
- Hücre sayısı ve floresan yoğunluğu verilerini bir elektronik tabloya veya istatistiksel yazılıma (ör. GraphPad Prism) aktarın.
- İlgili deney tasarımına ve hipotezlere dayalı olarak uygun istatistiksel testler yapın. Sonuçları yorumlayın ve sonuçlandırın.
Sonuçlar
Sunulan protokolü takiben, farklı retina hücreleri, AAV aracılı gen iletimi ve CSLO'nun bir kombinasyonu kullanılarak in vivo olarak başarılı bir şekilde görüntülendi ve izlendi. AAV2-hSyn-eGFP, RGC'leri etkili bir şekilde transdüksiyona uğrattı, bu da CSLO ile onaylandığı gibi retina boyunca sağlam eGFP ekspresyonu ile sonuçlandı ve RGC'ye özgü belirteç, özellikle ganglion hücre tabakasında bulunan çoklu uçbirleştirme ile RNA bağlayıcı protein (RBPMS) ile kolokalizasyon ile sonuçlandı (Şekil 2 ve Şekil 3). Protokol ayrıca AAV9-GfaABC1D-eGFP kullanarak Müller glia'yı hedefleme yeteneğini de doğruladı. CSLO görselleştirmesi, Müller glia'nın bilinen ana dağılım segmenti ile tutarlı olarak, özellikle iç retinal tabakalarda yaygın eGFP ekspresyonunu ortaya çıkardı. GFP pozitif sinyali ayrıca Müller glia markörü glutamin sentetaz (GS) ile yüksek oranda kolokalize olmuş ve bu yaklaşımın özgüllüğünü daha da doğrulamıştır (Şekil 2E, F ve Şekil 3B). Bu bulgular, farklı retina hücre tiplerini incelemek için AAV destekli gen iletiminin çok yönlülüğünü yeniden doğruladı. Müller glia'yı hedefleme yeteneğini doğrulamak için AAV9-GfaABC1D-eGFP kullanıldı. CSLO görüntüleme, Müller glia'nın bilinen dağılımı ile tutarlı olarak, özellikle iç retinal tabakalarda yaygın eGFP ekspresyonu ortaya çıkardı (Şekil 2E,F). Bu seçici ekspresyon modeli, GFP sinyali ile Müller glia markörü glutamin sentetaz (GS) arasında gözlenen yüksek derecede kolokalizasyon ile daha da doğrulanmıştır (Şekil 3B).
Hem RGC'ler hem de Müller glia için viral hedefleme yaklaşımının özgüllüğünü ve etkinliğini ölçmek için, GFP floresansını standart hücre tipi belirteçlerle karşılaştırmak için bir kolokalizasyon analizi yapıldı (Şekil 3B, D). Toplam 6 fare gözü analiz edildi. AAV2-hSyn-GFP ile hedeflenen RGC'ler için transdüksiyon verimliliği %64 ± %3 iken, transdüksiyon özgüllüğü %68 ± %3 idi. AAV9-GfaABC1D-GFP ile hedeflenen Müller glia için transdüksiyon verimliliği %58 ± %2 ve transdüksiyon özgüllüğü %71 ± %2 idi. Bu sonuçlar, bu AAV aracılı gen iletim yaklaşımının, retinadaki hücresel ve moleküler süreçleri incelemek için çok yönlülüğünü vurgulayarak, farklı retina hücre tiplerinin seçici olarak etiketlenmesini sağladığını göstermektedir.
Retinal hücre bozulmalarının uzunlamasına izlenmesi için CSLO'nun uygunluğunu değerlendirmek için, AAV2-hSyn-eGFP ile enfekte farelerde geçici bir ONC modeli gerçekleştirildi. İki hafta boyunca eGFP sinyalinde ve RGC sayılarında ilerleyici bir düşüş gözlendi (Şekil 4). RGC sağkalımı üç metrikle ölçüldü: CSLO floresan yoğunluğu, CSLO görüntüleri için in vivo hücre sayıları ve RBPMS pozitif hücrelerin ex vivo RGC sayıları. Adım 4'te açıklandığı gibi görüntü işlemeden sonra, her retinadan (toplam 6 göz) en az 10 ilgi alanı (ROI) kırpıldı, böylece her bir ROI'nin aynı retina konumunu kapsaması ve her zaman noktasında net hücre sinyalleri sergilemesi sağlandı. CSLO floresan yoğunluğu daha sonra her bir zaman noktasında kırpılan her bir ROI içindeki ortalama yoğunluk ölçülerek ölçüldü. İn vivo olarak, hücre sayımları, her bir zaman noktasında aynı kırpılmış ROI içinde tek tek GFP pozitif RGC'lerin manuel olarak sayılmasıyla elde edildi. Son olarak, RBPMS immün boyama için retinalar hasat edildi ve RBPMS pozitif hücreler, her retina için retina sektörü başına görüntülenen 24 tanımlanmış alan içinde sayıldı. Üç RGC sağkalım metriğinin tümü (CSLO floresan yoğunluğu, in vivo hücre sayıları ve ex vivo RBPMS-pozitif hücre sayımları) ile ONC sonrası zaman (p < herkes için 0.001, Şekil 4C) arasında anlamlı negatif korelasyonlar bulundu, bu da ilerleyici RGC kaybı ve dejenerasyonunu gösteriyor. Daha da önemlisi, farklı deney grupları arasında başlangıçtaki RGC yoğunluğu veya düşüş oranı açısından önemli bir fark gözlenmedi, bu da ONC modelinde ve görüntüleme yaklaşımında brüt bir tutarlılık olduğunu gösteriyor. Bu bulgular, ONC sonrası RGC hasarı ile ilgili önceki çalışmalarla tutarlıdır ve bu CSLO tabanlı protokolün RGC sağlığını izlemek için non-invaziv ve güvenilir bir araç olarak etkinliğini doğrulamaktadır.
Görsel yol içindeki RGC aksonal projeksiyonlarını daha fazla araştırmak için, AAV aracılı eGFP etiketlemesinin anterograd izleyici kolera toksin alt birimi B (CTB) 24 ile kombinasyonu ile çift etiketleme yaklaşımı kullanıldı. Farelere intravitreal CTB enjeksiyonu yapıldı ve 2 gün sonra histolojik analiz için sakrifiye edildi. Optik sinirlerde eGFP ve CTB sinyallerinin kolokalizasyonu, RGC aksonlarının pozitif izlenmesini doğruladı (Şekil 5A). Aksonal yaralanma sonrası sinyallerdeki değişiklikleri daha fazla incelemek için, fareler akut RGC hasarının bir modeli olan tek taraflı optik sinir ezilmesine (ONC) maruz bırakıldı25. Kısaca, fareler uyuşturuldu ve bir optik sinir açığa çıkarıldı ve 5 saniye boyunca ince forseps kullanılarak dünyanın yaklaşık 1 mm gerisinde ezildi, bu da önemli RGC aksotomisine ve ardından dejenerasyona neden oldu. ONC yaralanmasını takiben, hem eGFP hem de CTB yoğunluğunda belirgin bir azalma gözlendi, bu da önemli sinir lifi kaybı ve aksonal transport bozukluğuna işaret etti. Beyin bölümlerinin daha ileri analizi, sensorimotor entegrasyon ve göz hareketlerinde yer alan bir orta beyin yapısı olan Superior Colliculus'a (SC) ve görsel kortekse görsel bilgi için birincil röle merkezi olan Lateral Genikülat Çekirdeğe (LGN) RGC projeksiyonlarını ortaya çıkardı. ONC'den sonra, yaralanmanın karşı tarafında azalmış bir GFP yoğunluğu ortaya çıktı (Şekil 5B-E). Bu bulgular, bu yöntemin RGC aksonal dejenerasyonunu incelemek ve projeksiyon modellerini in vivo olarak haritalamak için faydasını göstermekte ve geleneksel invaziv izleme yöntemlerine potansiyel bir alternatif sunmaktadır.
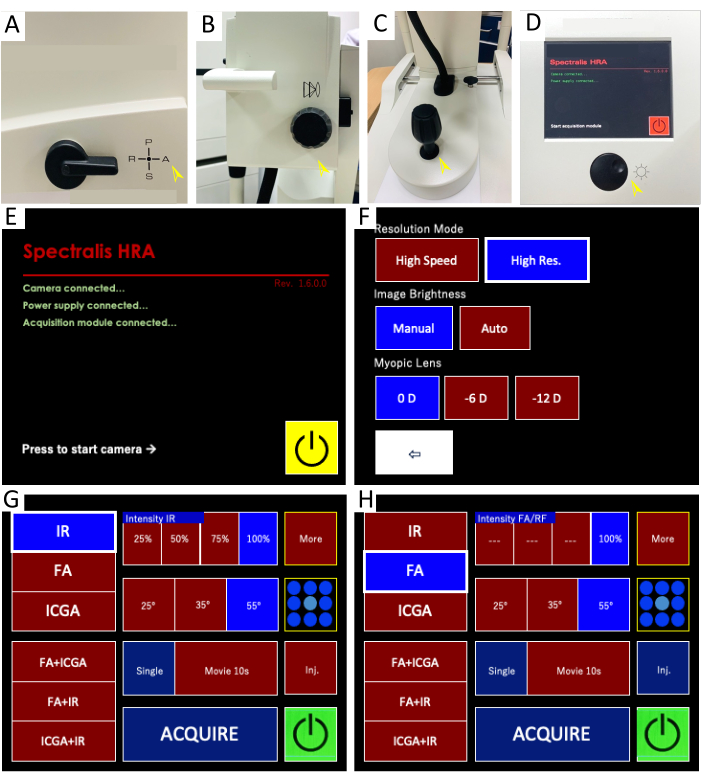
Şekil 1: Canlı retina görüntüleme için konfokal taramalı lazer oftalmoskop (CSLO) görüntüleme sistemi ve kontrol paneli arayüzü. (A-D) Görüntüleme sistemi bileşenleri: Bu görüntüler, HRA CSLO cihazının temel bileşenlerini göstermektedir. (A) Filtre kolu, kombine kızılötesi yansıma (IR) ve floresein anjiyografi (FA) görüntüleme için "A" konumuna ayarlanmıştır. (B) Netleme düğmesi, objektif merceğin ince odağını ayarlar. (C) Mikromanipülatör, çoklu serbestlik dereceleri (örneğin, X, Y, Z eksenleri) ve döndürme yoluyla ışık huzmesinin retinaya hassas bir şekilde konumlandırılmasına, hizalanmasına ve aydınlatılmasına izin verir. (D) Hassasiyet düğmesi, algılanan ışık sinyalinin amplifikasyonunu ayarlayarak hem IR hem de FA görüntülerinin parlaklığını kontrol eder. Düğmeye basmak, gürültüyü azaltmak ve sinyal-gürültü oranını artırmak için birden fazla kareyi birleştiren görüntü ortalamasını başlatır. (E-H) Kontrol paneli arayüzü: Ekran görüntüleri, canlı görüntü alma ve görselleştirme için kullanılan ayarlarla birlikte CSLO kontrol panelini görüntüler. (E) Alım kontrol paneli başlatılır. (F) Optimum görüntü kalitesi için yüksek çözünürlük modu önerilir. (G) IR görüntüleme ayarları vurgulanarak retina yapılarının ve kan damarlarının görüntülenmesine olanak tanır. (H) FA görüntüleme ayarları, hem tek noktalı hem de çok noktalı floresan görüntüleme seçeneklerini görüntüleyerek retina hücreleri içindeki floresan sinyallerin algılanmasını sağlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
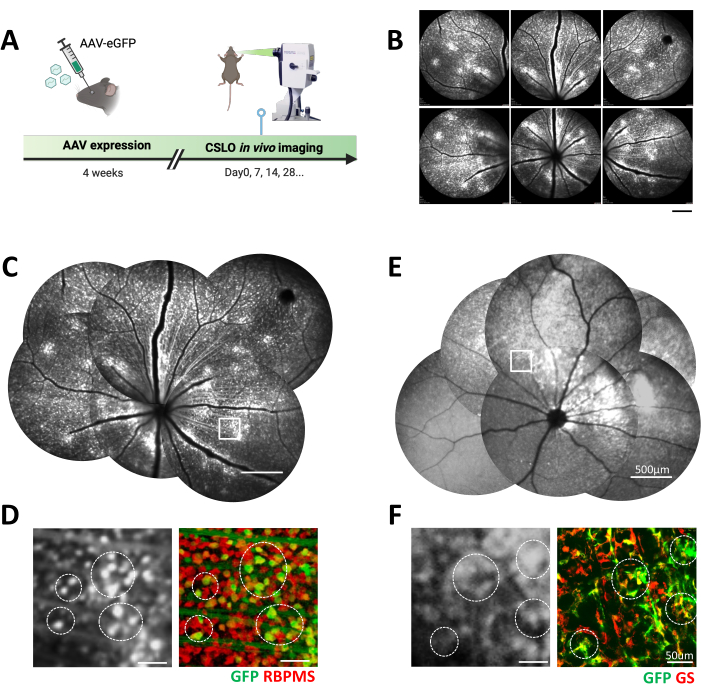
Şekil 2: C57 farelerinde AAV transfeksiyonunu takiben floresan olarak işaretlenmiş retina hücrelerinin in vivo CSLO görüntülemesi. (A) Fare gözünde AAV transfeksiyonundan sonra CSLO destekli uzunlamasına görüntülemenin deneysel zaman çizelgesi. (B) 4 haftalık AAV2-hSyn-eGFP ekspresyonundan sonra bir C57 fare retinasının üst ve merkezi bölgelerinin temsili CSLO görüntüleri. Ölçek çubuğu: 500 μm. (C) (B)'den manuel olarak dikilmiş bir retina montajı, eGFP eksprese eden retina hücrelerinin dağılımını gösterir. Ölçek çubuğu: 500 μm. (D) (C)'deki kutulu alanın büyütülmüş bir CSLO görüntüsü ve bir retinal düz montajın karşılık gelen konfokal mikroskopi görüntüsü. eGFP'nin (yeşil) RGC markörü RBPMS (kırmızı) ile kolokalizasyonu, retinal ganglion hücrelerinde AAV aracılı ekspresyonu doğrular (örnekler daire içine alınmıştır). Ölçek çubuğu: 50 μm. (E) Enjeksiyondan 4 hafta sonra AAV9-GfaABC1D-eGFP ile bir C57 fare retinasının manuel olarak dikilmiş bir montajı, Müller glia'ya özgü eGFP ekspresyonunu gösterir. Ölçek çubuğu: 500 μm. (F) (E)'deki kutulu alanın büyütülmüş bir CSLO görüntüsü ve bir retinal düz montajın karşılık gelen konfokal mikroskopi görüntüsü. eGFP'nin (yeşil) Müller glia markörü glutamin sentetaz (GS, kırmızı) ile kolokalizasyonu, Müller glial hücrelerinde AAV aracılı ekspresyonu doğrular (örnekler daire içine alınmıştır). Ölçek çubuğu: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Fare retinasında AAV aracılı gen iletiminin hücre tipi özgüllüğü. (A) AAV2-hSyn-eGFP enfeksiyonundan 4 haftalık sonra C57 farelerinden retina kesiti ve düz montajın immünohistokimyası. GFP'nin (yeşil) RBPMS (kırmızı) ile kolokalizasyonu, RGC'ye özgü ifadeyi doğrular. Ölçek çubuğu: 50 μm. (B) RGC'lerde AAV2-hSyn-GFP iletim verimliliğinin ve özgüllüğünün ölçülmesi. Verimlilik, retinal düz montajda GFP'yi de eksprese eden RBPMS pozitif RGC'lerin yüzdesi olarak temsil edilir. Özgüllük, retina bölümünde RBPMS için de pozitif olan GFP pozitif hücrelerin yüzdesi olarak temsil edilir (4 fareden n = 6 göz). (C) AAV9-GfaABC1D-eGFP enfeksiyonundan 4 haftalık sonra C57 farelerinden bir retina bölümünün ve düz montajın immünofloresan boyaması. GFP'nin (yeşil) GS (kırmızı) ile kolokalizasyonu, Müller glia'ya özgü ekspresyonunu doğrular. Ölçek çubuğu: 50 μm. (D) Müller glia'da AAV9-GfaABC1D-GFP iletim verimliliğinin ve özgüllüğünün ölçülmesi. Verimlilik, retinal düz montajda GFP'yi de eksprese eden GS pozitif Müller glia'nın yüzdesi olarak temsil edilir. Özgüllük, retina bölümünde GS için de pozitif olan GFP pozitif hücrelerin yüzdesi olarak temsil edilir (n = 3 fareden 6 göz). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
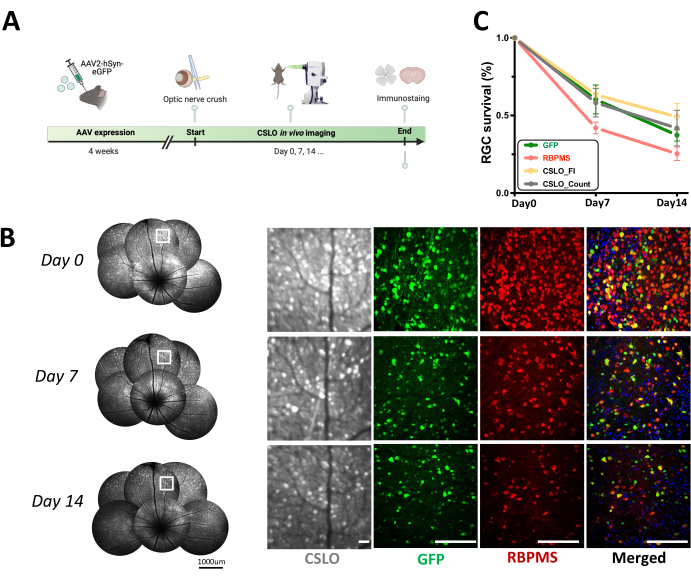
Şekil 4: AAV2-hSyn-eGFP farelerinde akut optik sinir ezilmesini (ONC) takiben RGC sağkalımının uzunlamasına CSLO izlemesi. (A) AAV enfeksiyonu sonrası akut optik sinir yaralanmasının deneysel zaman çizelgesinin şematik bir diyagramı. (B) Başlangıçta, ONC'den 2 gün ve 7 gün sonra bir AAV14-hSyn-eGFP faresinde aynı retinanın uzunlamasına CSLO görüntülemesi, GFP sinyallerini ifade eden RGC'leri görselleştirir. Kutulu alanların büyütülmüş görüntüleri, RGC morfolojisini ve dağılımını gösteren retinal düz montajların temsili konfokal mikroskopi görüntülerinin yanı sıra sağda gösterilmektedir. Ölçek çubukları: 100 μm. (C) ONC'den sonraki iki hafta boyunca RGC sağkalımının nicelleştirilmesi, taban çizgisine göre hem hücre sayısı hem de CSLO floresan yoğunluğundaki yüzde değişimin (ortalama ± SEM) ölçülmesiyle değerlendirildi. Her zaman noktasında gruplar arasında anlamlı bir fark gözlenmedi (tek yönlü ANOVA). Doğrusal regresyon analizi, GFP floresan (r² = 0.945, p < 0.001), RBPMS boyama (r² = 0.888, p < 0.001), CSLO hücre sayısı (r² = 0.511, p < 0.001) ve CSLO floresan yoğunluğu (r² = 0.7486, p < 0.001) temelinde yaralanma sonrası zaman ile RGC sağkalım ölçümleri arasında anlamlı negatif korelasyonlar olduğunu ortaya koydu. n = 6 fare/grup/zaman noktası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Görsel yol boyunca RGC aksonal projeksiyonlarının AAV destekli haritalanması. (A) Bir AAV2-hSyn-eGFP faresinden alınan bir çift optik sinirin temsili floresan mikroskobu görüntüleri, GFP etiketli RGC aksonları (yeşil) ve anterograd aksonal izleyici kolera toksini B (CTB, macenta) ile kolokalizasyonu gösterir. Üst panel, tüm optik sinirlere genel bir bakış sağlarken (ölçek çubuğu: 1000 μm), alt panel kutulu bölgelerin büyütülmüş görünümlerini sunar (ölçek çubuğu: 100 μm). ONC yaralanmasından iki hafta sonra, hem GFP hem de CTB sinyalleri, optik sinir (sol taraf) boyunca belirgin bir azalma gösterir, bu da RGC aksonal kaybını ve görme yolu boyunca bozulmayı gösterir. (B) Superior colliculus'a (SC) RGC aksonal projeksiyonları. ONC'den 2 hafta sonra bir AAV2-hSyn-eGFP faresinden alınan koronal beyin kesitleri, SC içinde GFP etiketli RGC aksonlarını (yeşil) ve CTB boyamasını (macenta) vurgular. Sol (L): kontralateral SC; Sağ ( R ): ipsilateral SC (ONC ile yaralanan taraf). Ölçek çubuğu: 1000 μm. (C) (B)'deki kutulu bölgenin büyütülmüş bir görünümü, GFP ve CTB sinyallerinin (birleştirilmiş görüntü) kolokalizasyonunu gösterir ve RGC aksonal demetlerini ve SC içindeki projeksiyon modellerini vurgular. Ölçek çubuğu: 100 μm. (D) ONC'yi takiben lateral genikülat çekirdeğe (LGN) RGC aksonal projeksiyonları, LGN içinde GFP etiketli RGC aksonları (yeşil) ve CTB boyamasını (macenta) ortaya çıkarır. Sol (L): kontralateral LGN; Sağ ( R ): ipsilateral LGN (ONC ile yaralanan taraf). Ölçek çubuğu: 1000 μm. (E) (D)'deki kutulu bölgenin büyütülmüş bir görünümü, RGC aksonal demetlerini ve bunların LGN içindeki projeksiyon modellerini vurgular. Ölçek çubuğu: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Sunulan protokol, hem AAV aracılı gen iletiminin hem de CSLO görüntülemenin gücünden yararlanarak, belirli retina hücre popülasyonlarının in vivo sürveyansı için sağlam ve erişilebilir bir yöntemi detaylandırmaktadır. Bu yaklaşım, retina hücre dinamiklerinin ve fizyolojik veya patolojik koşullar altında yaralanma veya hastalığa verdikleri yanıtların uzunlamasına çalışmalarını kolaylaştırarak geleneksel yöntemlere göre çeşitli avantajlar sunar.
Bu yöntemin başarısı birkaç kritik adıma bağlıdır. İlk olarak, optimum AAV transdüksiyon verimliliğinin elde edilmesi, hedef hücre popülasyonundaki floresan raportörün sağlam ve spesifik ekspresyonu için çok önemlidir. Bu, AAV serotip seçimi, viral titre ve enjeksiyon tekniği 13,15,16 gibi faktörlerden etkilenebilir. İkinci olarak, CSLO görüntüleme sırasında hayvanların uygun şekilde ele alınması ve kısıtlanması, hareket artefaktlarını en aza indirmek ve görüntü kalitesini korumak için çok önemlidir. Özel olarak oluşturulmuş bir görüntüleme platformu kullanmak ve genel anesteziden kaçınmak, retina yapılarının net ve tutarlı bir şekilde görüntülenmesine katkıda bulunur. Üçüncüsü, minimum gürültü ve optimum sinyal-gürültü oranı26 ile yüksek çözünürlüklü görüntüler elde etmek için odak, hassasiyet ve ortalama ayarları dahil olmak üzere CSLO görüntüleme parametrelerinin dikkatli bir şekilde optimizasyonu gereklidir. Son olarak, potansiyel sınırlamaları ele almak ve veri güvenilirliğini sağlamak için, çalışma tasarımımızda sıkı görüntü kalitesi kontrol önlemleri uyguladık ve hayvan sayılarını artırdık.
Spectralis HRA CSLO sistemi, klinik boylamsal görüntülemeyi geliştiren otomatik göz izleme özelliğine sahiptir. Otomatik Gerçek Zamanlı (ART) izleme işlevi, görüntüleme sırasında belirli bir retina alanına kilitlenerek hareket artefaktlarını azaltabilir. İnsan klinik görüntülemesi için, sistem aynı anatomik retinal konumun uzun süreli izlenmesi için bir algoritma da içerir27. Bununla birlikte, insan ve kemirgen gözleri arasındaki önemli anatomik farklılıklar nedeniyle bu teknolojiler kemirgen çalışmaları için optimize edilmemiştir. Kemirgen gözleri çok daha küçüktür (insanlarda 24 mm'ye kıyasla 3-4 mm çaptadır) ve makula gibi belirli yer işaretlerinden yoksundur, bu da otomatik izleme için benzersiz zorluklar sunar28. Sonuç olarak, kemirgen modellerini inceleyen araştırmacılar, belirli retina bölgelerini bulmak ve13,22. oturumlar boyunca tutarlı görüntüleme düzlemlerini korumak için damar desenleri ve optik sinir başı gibi anatomik yer işaretlerini kullanarak öncelikle manuel yöntemlere güvenirler. Bu yaklaşım, yalnızca kemirgen gözlerindeki sınırlı yer işaretleri nedeniyle değil, aynı zamanda bu spesifik zorluklar için tasarlanmamış otomatik sistemleri karıştırabilecek deneysel manipülasyonların neden olduğu potansiyel önemli retina değişiklikleri nedeniyle de gereklidir. Bu nedenle, kemirgen retinal görüntüleme için özel göz izleme ve hizalama algoritmaları geliştirmek, gelecekte çok önemli bir yönü temsil etmektedir. Özellikle, küçük hayvan kullanımı için uzun vadeli izleme algoritmalarının uyarlanması, boylamsal çalışmaların hassasiyetini ve tekrarlanabilirliğini önemli ölçüde artırabilir.
Geleneksel histolojik teknikler hayvan kurban edilmesini gerektirir ve uzunlamasına çalışmaları engellerken, bu AAV destekli CSLO görüntüleme yöntemi, retina hücre dinamiklerini in vivo izlemek için invaziv olmayan bir yaklaşım sunar. Bu yaklaşım, özellikle transgenik floresan protein etiketlemesi 19,21,22,29 kullanan hayvan modellerinde, yaralanma sonrası spesifik retina hücrelerindeki uzunlamasına değişiklikleri izlemek için cSLO görüntülemenin faydasını gösteren önceki çalışmalara dayanmaktadır. Bu çalışmalar, CSLO'nun hücre ölümü, hayatta kalma ve hatta potansiyel olarak göç veya süreç büyümesi dahil olmak üzere bir dizi retinal hücre olayını in vivo olarak görselleştirme yeteneğini vurgulamıştır. Bu protokol, bu tekniğin uygulamasını, spesifik retina hücre popülasyonlarının AAV aracılı transdüksiyonunu incelemek için genişleterek, retina içindeki AAV iletiminin ve transgen ekspresyonunun uzun vadeli etkilerini izlememize ve retina hastalıklarının ilerlemesi ve terapötik müdahalelerin etkinliği hakkında önemli bilgiler sağlamamıza olanak tanır. OCT kullanan mevcut klinik değerlendirmeler öncelikle retina sinir lifi tabakası kalınlığı9'u ölçerek RGC akson kaybına odaklanmaktadır, ancak bireysel RGC morfolojisini veya glial hücre tutulumunu değerlendirmek için çözünürlükten yoksundurlar. AO-SLO, yaşayan insan retinasında10 hücresel düzeyde görüntülemeyi mümkün kılsa da, karmaşıklığı ve sınırlı kullanılabilirliği, esas olarak araştırma ortamlarında kullanımını kısıtlar. Ek olarak, AO-SLO içinde glial hücre tiplerini ayırt etmek genellikle ek etiketleme yöntemleri gerektirir30. Bu yöntem, zaman içinde bireysel RGC'leri ve diğer floresan etiketli retinal hücre popülasyonlarını görselleştirmek ve izlemek için daha kapsamlı ve erişilebilir bir yaklaşım sağlayarak bu sınırlamaların üstesinden gelir. Bu, çeşitli koşullar altında hücresel yanıtları araştırmak için yollar açar ve hedefe yönelik tedavilerin geliştirilmesine yardımcı olur. Ayrıca, AAV destekli CSLO görüntülemeyi optogenetik31 veya kalsiyum görüntüleme32 ile birleştirmek, retina hücre fonksiyonunun ve görsel işleme, devre geliştirme ve rejenerasyondaki rollerinin anlaşılmasını daha da derinleştirebilir.
Bu yaklaşımın gücüne rağmen, bazı sınırlamalar ve olası sorun giderme hususları kabul edilmelidir. AAV transdüksiyon verimliliğinde değişkenlik meydana gelebilir, bu da belirli hücre tipleri veya deneysel koşullar için enjeksiyon parametrelerinin veya viral titrenin optimizasyonunu gerektirir. CSLO görüntüleme, kornea opasiteleri, gözyaşı filmi instabilitesi ve göz hareketleri gibi faktörlerden etkilenebilir ve görüntü elde etme sırasında dikkatli izleme ve ayarlamalar gerektirir. Ek olarak, CSLO'nun sınırlı penetrasyon derinliği, görselleştirmeyi iç retina katmanlarıyla sınırlar ve potansiyel olarak fotoreseptörler gibi daha derin yapıları dışlar33. Spectralis cSLO sistemi, retina34 içindeki farklı hücresel özelliklerin ve desenlerin net bir şekilde görselleştirilmesini sağlar. Bu görüntüleme yöntemi, seyrek olarak etiketlenmiş Thy1-YFP farelerinde22 bireysel RGC'leri görselleştiren önceki bir çalışmada gösterildiği gibi, belirli koşullar altında tek hücreli gözlemi kolaylaştırabilirken, yoğun etiketli senaryolarda tek tek hücrelerin ölçülmesi için zorluklar doğurabilir. Örneğin, bu çalışmada, AAV aracılı retina enfeksiyonunu takiben RGC'lerin eGFP ile toplu olarak etiketlenmesi, bazen, özellikle ekspresyon seviyelerinde ve hücre örtüşmesinde farklılıklar olan alanlarda, tek tek hücrelerin net bir şekilde görselleştirilmesini engelleyebilir. Müller glia'nın tüm retina kalınlığını35 kapsayan uzun morfolojileri, cSLO kullanarak tek bir odak düzlemi içinde tek bir hücreyi yakalamayı zorlaştırdığından, bu zorluk daha da artar. Bu nedenle, AAV9 aracılı Müller glia enfeksiyonu etkinliğinin değerlendirilmesi, öncelikle CSLO görüntüleme kullanılarak genel transdüksiyon paternlerinin ve dağılımının değerlendirilmesine dayanır.
Ayrıca, HRA sistemindeki ART ortalaması görüntü kalitesini artırırken, artan tarama süresi, özellikle uyanık hayvan görüntülemede pratik sınırlamalar sunar. Seçilen ART ortalama değeri olan 15, görüntü kalitesini tarama süresiyle dengelemek ve makul bir tarama süresini korurken yeterli gürültü azaltma sağlamak içindir. Hayvan rahatsızlığını ve stresini en aza indirmek için, görüntüleme prosedürlerinin verimlilik için optimize edilmesi, uyanık hayvanları işleme ve görüntüleme konusunda yetenekli eğitimli personel istihdam edilmesi ve görüntüleme seansları boyunca rahatsızlık veya kornea kuruluğu belirtileri açısından hayvanların özenle izlenmesi gerekir. Bu önlemler, hem veri kalitesini hem de hayvan refahını sağlamak için çok önemliydi ve uyanık hayvan modellerinde in vivo retinal görüntüleme için ART ortalaması kullanılırken her iki faktörün de dikkate alınmasının önemini vurguladı.
Araştırmacılar, bu sınırlamaları ve potansiyel değişkenlik kaynaklarını kabul ederek, görüntüleme protokollerini optimize etmek, artefaktları en aza indirmek ve verilerinin güvenilirliğini ve tekrarlanabilirliğini sağlamak için uygun adımları atabilir.
Genel olarak, bu erişilebilir ve kolayca uygulanabilir yöntem, özellikle yaralanma veya hastalığa yanıt olarak, RGC'ler ve Müller glia arasındaki karmaşık etkileşimi araştırmak için güçlü bir araç sunar. Bu yaklaşım, araştırmacıların bu dinamik etkileşimleri görselleştirmelerini ve ölçmelerini sağlayarak, retina patolojilerinin altında yatan yeni hücresel ve moleküler mekanizmaların keşfedilmesini kolaylaştırır. Bu da, hedefe yönelik terapötik stratejilerin geliştirilmesine ve hastalığa karşı önlemlerin iyileştirilmesine ışık tutmaktadır.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı'ndan (82130029) bir hibe ile desteklenmiştir. Şekil 2A ve Şekil 4A, BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 33 Gauge Needle | Hamilton Corp., Reno, NV, USA | 7803-05 | For intravitreal injection |
| 0.5% proparacaine | Santen Pharmaceutical Co., Ltd. | Topical Aneasthetics | |
| AAV2-hSyn-eGFP | OBiO Technology Corp., China | Virus titer: 2.7 x 1012 viral genomes (vg)/mL | |
| AAV9-GfaABC1D-eGFP | WZ Biosciences Inc., China | Virus titer: 4.5 x 1012 viral genomes (vg)/mL | |
| Betadine | Healthy medical company | 001651 | Topical Antiseptics |
| Corneal scelar forceps (toothed) | Mingren Eye Instruments, China | MR-F301A | For eyelid secure during intravitreal injection |
| Dumont 05# forceps | FST | 51-AGT5385 | For optic nerve crush |
| Graphpad prism | GraphPad Prism, USA | Graph drawing and statistical analysis | |
| HRA Spectralis | Heidelberg Engineering, GmbH, Dossenheim, Germany | "IR" and "FA" mode for CSLO imaging | |
| Image J/Fiji | National Institutes of Health, USA | Image processing | |
| Maxitrol antibiotic ointment | Alcon Laboratories, INC. USA | 0065-0631 | Topical antibiotics |
| Microliter Syringe | Hamilton Corp., Reno, NV, USA | 7633-01 | For intravitreal injection |
| Mydrin-P Ophthalmic solution | Santen Pharmaceutical Co.,Ltd, Japan | Pupil dilation | |
| Ophthalmic surgical microscope | Leica AG, Heerbrugg, Switzerland | M220 | For surgical operations |
| Pentorbarbitol Sodium | Sigma Aldrich, USA | 57-33-0 | Genereal Aneasthetics |
| Powerpoint | Microsoft Corporation, USA | Image alignment and cropping | |
| VISCOTEARS Liquid Gel (Carbomer) | Dr. Gerhard Mann, Chem.-Pharm. Fabrik, Germany | Topical lubricant |
Referanslar
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog Retin Eye Res. 57, 89-107 (2017).
- Ju, W. K., et al. Glaucomatous optic neuropathy: Mitochondrial dynamics, dysfunction and protection in retinal ganglion cells. Prog Retin Eye Res. 95, 101136 (2023).
- Vecino, E., Rodriguez, F. D., Ruzafa, N., Pereiro, X., Sharma, S. C. Glia-neuron interactions in the mammalian retina. Prog Retin Eye Res. 51, 1-40 (2016).
- Llorián-Salvador, M., Cabeza-Fernández, S., Gomez-Sanchez, J. A., De La Fuente, A. G. Glial cell alterations in diabetes-induced neurodegeneration. Cell Mol Life Sci. 81 (1), 47 (2024).
- Zhao, N., Hao, X. N., Huang, J. M., Song, Z. M., Tao, Y. Crosstalk between microglia and müller glia in the age-related macular degeneration: Role and therapeutic value of neuroinflammation. Aging Dis. 15 (3), 1132-1154 (2023).
- Minhas, G., Sharma, J., Khan, N. Cellular stress response and immune signaling in retinal ischemia-reperfusion injury. Front Immunol. 7, 444 (2016).
- Miao, Y., Zhao, G. L., Cheng, S., Wang, Z., Yang, X. L. Activation of retinal glial cells contributes to the degeneration of ganglion cells in experimental glaucoma. Prog Retin Eye Res. 93, 101169 (2023).
- Leung, C. K. S., et al. Diagnostic assessment of glaucoma and non-glaucomatous optic neuropathies via optical texture analysis of the retinal nerve fibre layer. Nat Biomed Eng. 6 (5), 593-604 (2022).
- Hood, D. C., et al. Detecting glaucoma with only OCT: Implications for the clinic, research, screening, and AI development. Prog Retin Eye Res. 90, 101052 (2022).
- Burns, S. A., Elsner, A. E., Sapoznik, K. A., Warner, R. L., Gast, T. J. Adaptive optics imaging of the human retina. Prog Retin Eye Res. 68, 1-30 (2019).
- Dinculescu, A., Glushakova, L., Min, S. H., Hauswirth, W. W. Adeno-associated virus-vectored gene therapy for retinal disease. Hum Gene Ther. 16 (6), 649-663 (2005).
- Nickells, R. W., Schmitt, H. M., Maes, M. E., Schlamp, C. L. AAV2-mediated transduction of the mouse retina after optic nerve injury. Invest Ophthalmol Vis Sci. 58 (14), 6091-6104 (2017).
- Cao, X., Yung, J., Mak, H., Leung, C. K. S. Factors governing the transduction efficiency of adeno-associated virus in the retinal ganglion cells following intravitreal injection. Gene Ther. 26 (3-4), 109-120 (2019).
- Vandenberghe, L. H., et al. Dosage thresholds for AAV2 and AAV8 photoreceptor gene therapy in monkey. Sci Transl Med. 3 (88), 88ra54 (2011).
- Gao, Y., et al. Develop an efficient and specific AAV-based labeling system for Muller glia in mice. Sci Rep. 12 (1), 22410 (2022).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: Comparison of five promoters. Gene Ther. 30 (6), 503-519 (2023).
- Kawabata, H., et al. Improving cell-specific recombination using AAV vectors in the murine CNS by capsid and expression cassette optimization. Mol Ther Methods Clin Dev. 32 (1), 101185 (2024).
- Smith, C. A., Chauhan, B. C. In vivo imaging of adeno-associated viral vector labelled retinal ganglion cells. Sci Rep. 8 (1), 1490 (2018).
- Smith, C. A., Chauhan, B. C. Imaging retinal ganglion cells: Enabling experimental technology for clinical application. Prog Retin Eye Res. 44, 1-14 (2015).
- Leung, C. K. S., et al. Longitudinal profile of retinal ganglion cell damage after optic nerve crush with blue-light confocal scanning laser ophthalmoscopy. Invest Ophthalmol Vis Sci. 49 (11), 4898 (2008).
- Leung, C. K. S., et al. In vivo imaging of murine retinal ganglion cells. J Neurosci Methods. 168 (2), 475-478 (2008).
- Mak, H. K., Ng, S. H., Ren, T., Ye, C., Leung, C. K. S. Impact of PTEN/SOCS3 deletion on amelioration of dendritic shrinkage of retinal ganglion cells after optic nerve injury. Exp Eye Res. 192, 107938 (2020).
- Kokona, D., Jovanovic, J., Ebneter, A., Zinkernagel, M. S. In Vivo imaging of Cx3CR1GFP/GFP reporter mice with spectral-domain optical coherence tomography and scanning laser ophthalmoscopy. J Vis Exp. (129), e55984 (2017).
- Abbott, C. J., et al. Imaging axonal transport in the rat visual pathway. Biomed Opt Express. 4 (2), 364-386 (2013).
- Levkovitch-Verbin, H., et al. RGC death in mice after optic nerve crush injury: Oxidative stress and neuroprotection. Invest Ophthalmol Vis Sci. 41 (13), 4169-4174 (2000).
- LaRocca, F., et al. Optimization of confocal scanning laser ophthalmoscope design. J Biomed Opt. 18 (7), 076015 (2013).
- Vienola, K. V., et al. Real-time eye motion compensation for OCT imaging with tracking SLO. Biomed Opt Express. 3 (11), 2950-2963 (2012).
- Geng, Y., et al. Optical properties of the mouse eye. Biomed Opt Express. 2 (4), 717-738 (2011).
- Bosco, A., Romero, C. O., Ambati, B. K., Vetter, M. L. In vivo dynamics of retinal microglial activation during neurodegeneration: Confocal ophthalmoscopic imaging and cell morphometry in mouse glaucoma. J Vis Exp. (99), e52731 (2015).
- Joseph, A., Power, D., Schallek, J. Imaging the dynamics of individual processes of microglia in the living retina in vivo. Biomed Opt Express. 12 (10), 6157-6170 (2021).
- Chaffiol, A., et al. A new promoter allows optogenetic vision restoration with enhanced sensitivity in macaque retina. Mol Ther. 25 (11), 2546-2560 (2017).
- Li, L., et al. Longitudinal in vivo Ca2+ imaging reveals dynamic activity changes of diseased retinal ganglion cells at the single-cell level. Proc Natl Acad Sci U S A. 119 (48), e2206829119 (2022).
- Aumann, S., Donner, S., Fischer, J., Müller, F., Bille, J. F. Optical Coherence Tomography (OCT): Principle and technical realization. High-resolution imaging in microscopy and ophthalmology: New Frontiers in Biomedical Optics. , 59-85 (2019).
- Spaide, R. F., et al. Lateral resolution of a commercial optical coherence tomography instrument. Transl Vis Sci Technol. 11 (1), 28 (2022).
- Franze, K., et al. Muller cells are living optical fibers in the vertebrate retina. Proc Natl Acad Sci U S A. 104 (20), 8287-8292 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır