11.13 : Hal Diyagramları
Bir faz diyagramı, bir maddenin sıvı-gaz, katı-sıvı ve katı-gaz faz geçiş dengesi için basınç ve sıcaklık grafiklerini birleştirir. Bu diyagramlar, belirli basınç ve sıcaklık koşulları altında var olan fiziksel durumları gösterir ve ayrıca faz geçiş sıcaklıklarının (erime noktaları, süblimleşme noktaları, kaynama noktaları) basınca bağımlılığını sağlar. Katı, sıvı ve gaz olarak etiketlenen bölgeler veya alanlar tek fazları temsil ederken, çizgiler veya eğriler dengede (veya faz değişim noktalarında) birlikte var olan iki fazı temsil eder. Üçlü nokta, üç fazın hepsinin bir arada bulunduğu basınç ve sıcaklık koşullarını gösterir. Buna karşılık, kritik bir nokta, üzerinde tek bir fazın (ki bunların fiziksel özellikleri gaz ve sıvı haller arasında orta düzeydedir) var olan sıcaklığı ve basıncı gösterir.
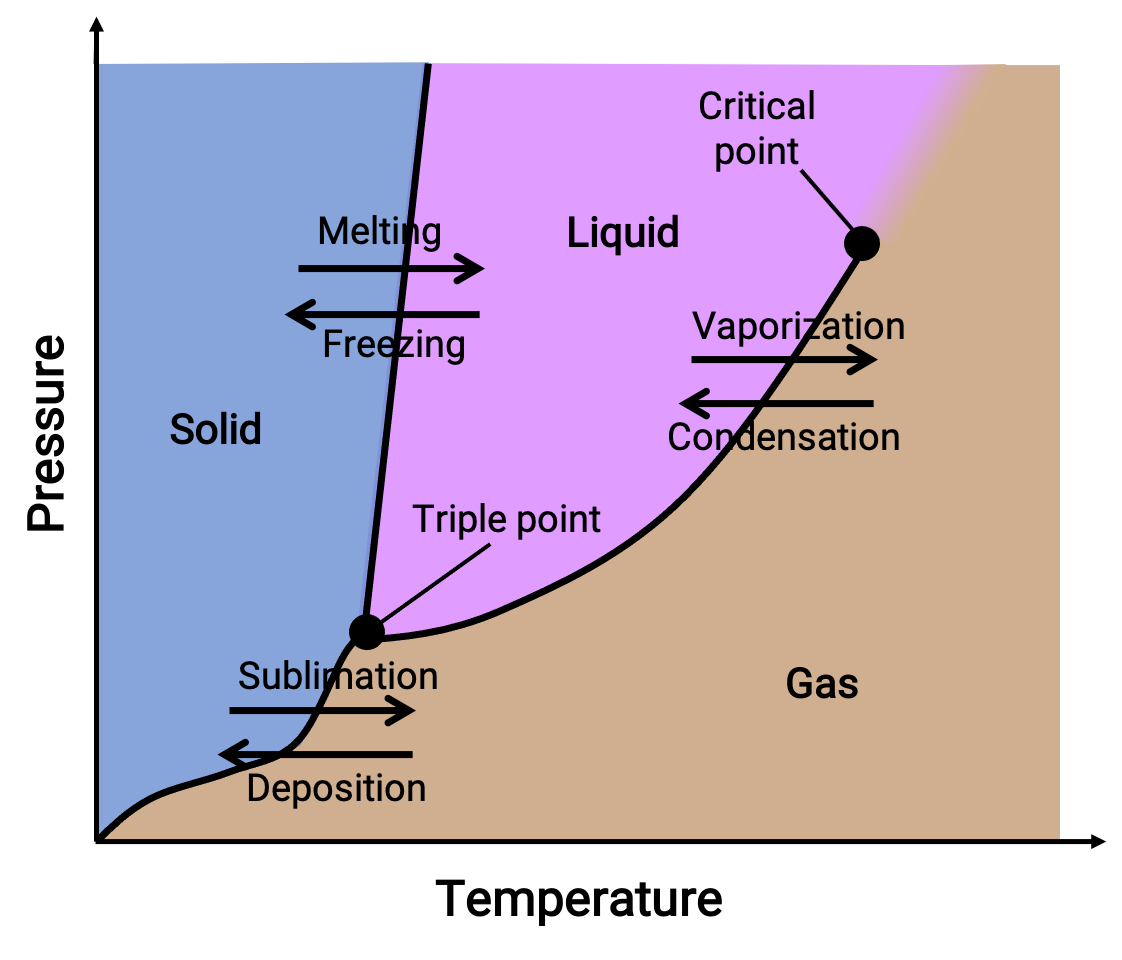
Figure 1. Tipik bir faz diyagramı
Faz diyagramı, belirli basınç ve sıcaklık koşulları altında bir maddenin fiziksel durumunu tanımlar. Bu grafiklerin faydasını göstermek için aşağıda gösterilen su faz diyagramını düşünün.
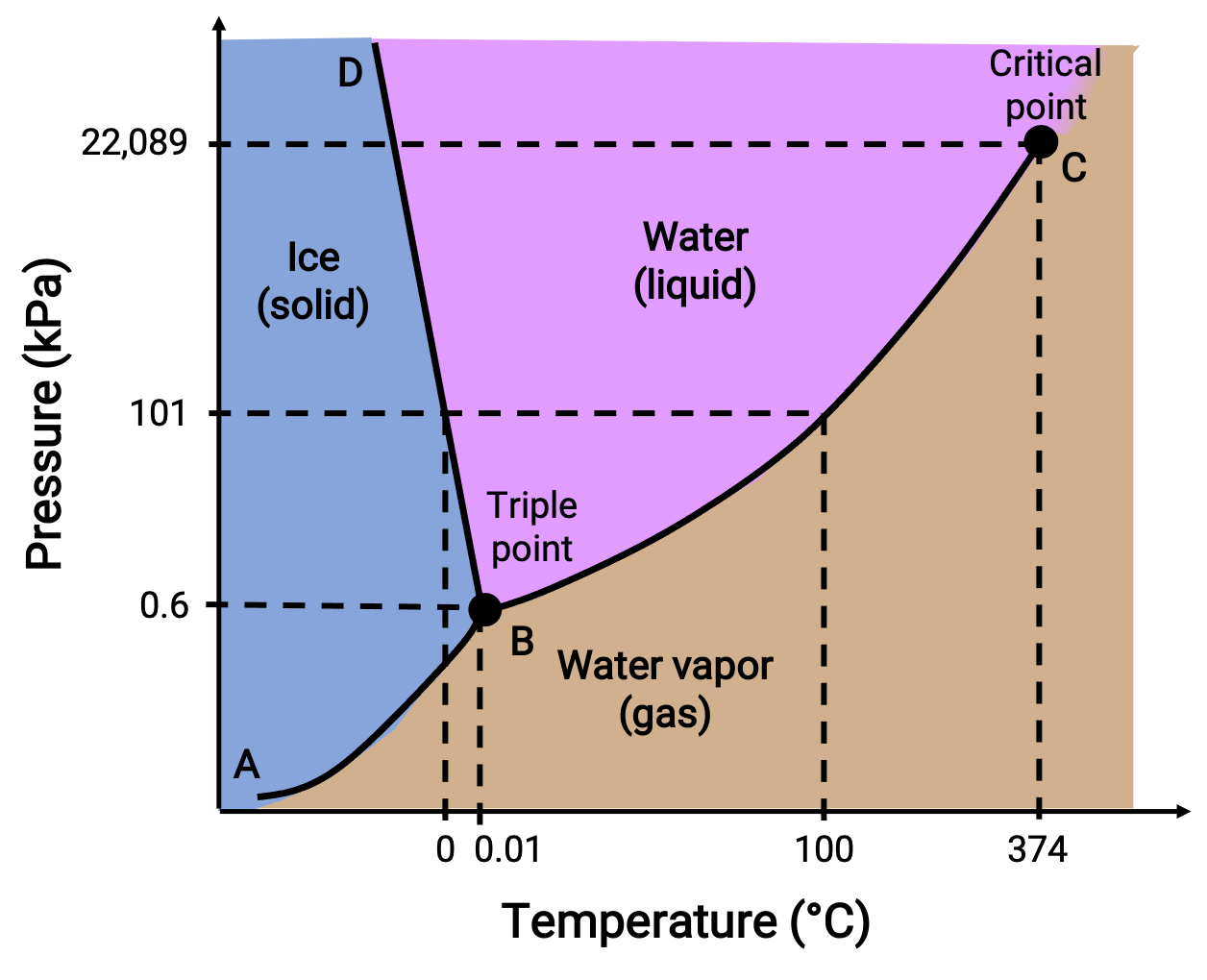
Figure 2. Suyun faz diyagramı.
50 kPa'lık bir basınç ve −10 °C'lik bir sıcaklık, diyagramın “buz.” etiketli bölgesine karşılık gelir. Bu koşullar altında su yalnızca katı halde bulunur. 50 kPa'lık bir basınç ve 50 °C'lik bir sıcaklık, suyun yalnızca sıvı olarak var olduğu bölgeye karşılık gelir. 25 kPa ve 200 °C'de su yalnızca gaz halinde bulunur. Eğri BC, faz diyagramının sıvı ve gazlı bölgelerini ayıran sıvı-buhar eğrisidir ve herhangi bir basınçta suyun kaynama noktasını sağlar. Örneğin 1 atm'de kaynama noktası 100 °C'dir. Sıvı-buhar eğrisinin 374 °C sıcaklıkta ve 218 atm basınçta sona erdiğine dikkat edin, bu da basınçtan bağımsız olarak suyun bu sıcaklığın üzerinde sıvı olarak var olamayacağını gösterir. Suyun bu koşullar altındaki fiziksel özellikleri, sıvı ve gaz halindekilerinki arasındadır. Maddenin bu eşsiz durumuna süper kritik akışkan denir. AB etiketli katı buhar eğrisi, buz ve su buharının dengede olduğu sıcaklıkları ve basınçları gösterir. Bu sıcaklık-basınç veri çiftleri, su için süblimleşme veya birikme noktalarına karşılık gelir.
BD etiketli katı-sıvı eğrisi, suyun erime / donma noktalarını temsil eden, buz ve sıvı suyun dengede olduğu sıcaklıkları ve basınçları gösterir. Bu eğrinin hafif bir negatif eğim gösterdiğine dikkat edin, bu da su için erime noktasının basınç arttıkça hafifçe azaldığını gösterir. Çoğu madde artan basınçla erime noktasında bir artış sergilediğinden, su bu açıdan alışılmadık bir maddedir. Üç eğrinin kesişme noktası - B olarak etiketlenmiştir - üç fazın da dengede bir arada var olduğu üçlü su noktasıdır. Üç noktadan daha düşük basınçlarda su, sıcaklıktan bağımsız olarak sıvı olarak var olamaz.
Başka bir örnek olarak karbondioksit için faz diyagramını düşünün.
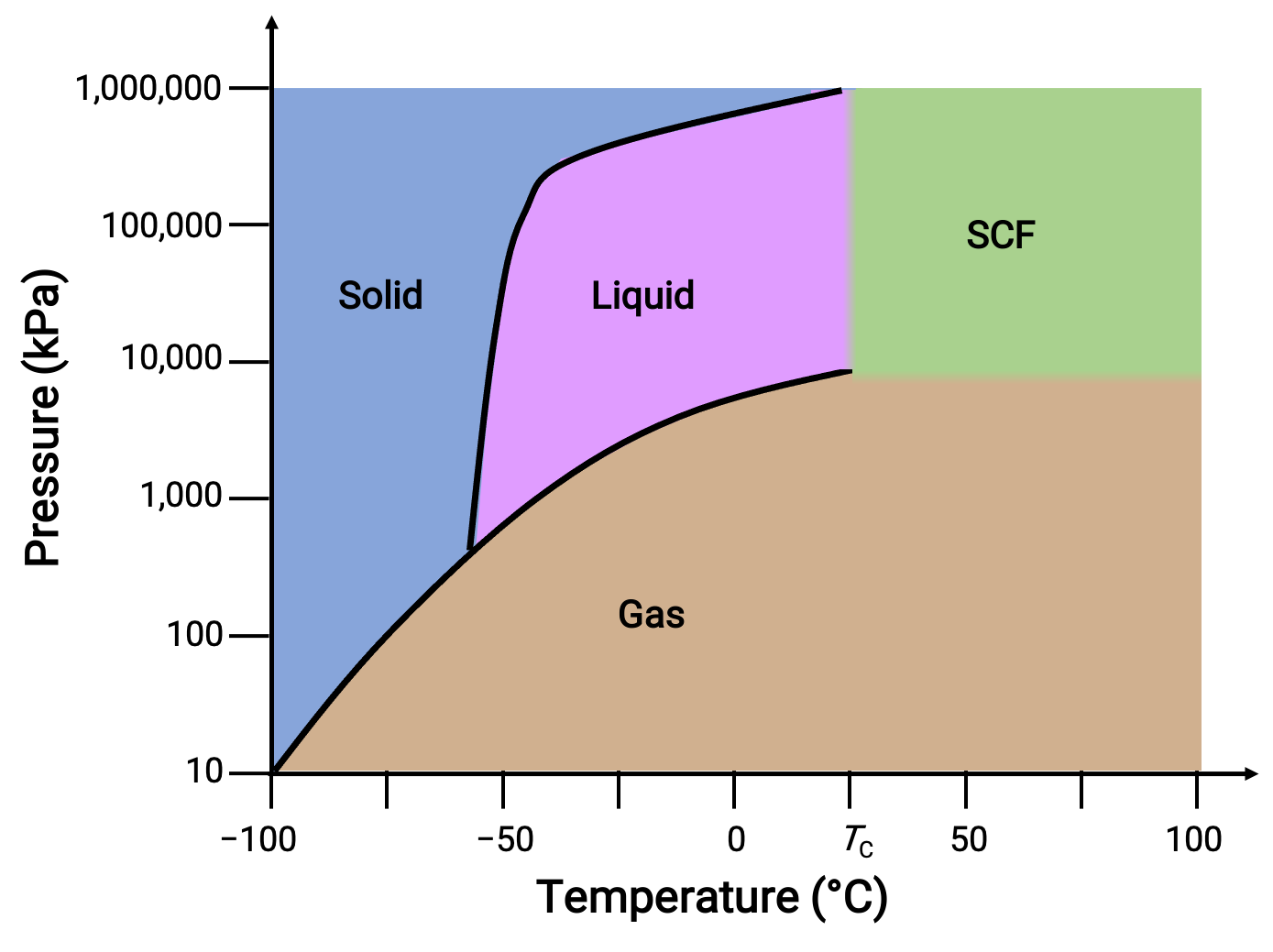
Figure 3. Karbon dioksitin faz diyagramı
Katı-sıvı eğrisi, çoğu maddede olduğu gibi CO2 için erime noktasının basınçla arttığını gösteren pozitif bir eğim sergiler. Üçlü noktanın 1 atm'nin oldukça üzerinde olduğuna dikkat edin, bu da karbondioksitin ortam basıncı koşullarında sıvı olarak var olamayacağını gösterir. Bunun yerine, 1 atm'de gaz halindeki karbondioksitin soğutulması, katı halde birikmesine neden olur. Aynı şekilde, katı karbondioksit 1 atm basınçta erimez, bunun yerine süblimleşerek gaz halindeki CO2 verir. Son olarak, karbondioksit için kritik nokta, suya kıyasla nispeten mütevazı bir sıcaklık ve basınçta gözlenir.
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 10.4: Phase Diagrams.
Bölümden 11:

Now Playing
11.13 : Hal Diyagramları
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
39.5K Görüntüleme Sayısı

11.1 : Gazların, Sıvıların ve Katıların Moleküler Karşılaştırması
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
40.4K Görüntüleme Sayısı

11.2 : Moleküller Arası ve Molekül İçi Kuvvetler
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
86.4K Görüntüleme Sayısı

11.3 : Moleküller Arası Kuvvetler
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
57.5K Görüntüleme Sayısı

11.4 : Moleküller Arası Kuvvetlerin Karşılaştırılması: Erime Noktası, Kaynama Noktası ve Karışabilirlik
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
43.8K Görüntüleme Sayısı

11.5 : Yüzey Gerilimi, Kapiller Etkiler, ve Vizkosite
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
27.4K Görüntüleme Sayısı

11.6 : Hal Değişimi (Faz Geçişi)
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
18.7K Görüntüleme Sayısı

11.7 : Hal Değişimleri: Buharlaşma ve Katılaşma
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
17.2K Görüntüleme Sayısı

11.8 : Gaz Basıncı
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
34.2K Görüntüleme Sayısı

11.9 : Clausius-Clapeyron Denklemi
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
55.7K Görüntüleme Sayısı

11.10 : Hal Değişimleri: Erime ve Donma
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
12.3K Görüntüleme Sayısı

11.11 : Hal Değişmleri: Süblimleşme ve Kırağılaşma
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
16.7K Görüntüleme Sayısı

11.12 : Isınma ve Soğuma Eğrileri
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
22.4K Görüntüleme Sayısı

11.14 : Katıların Yapısı
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
13.9K Görüntüleme Sayısı

11.15 : Moleküler ve İyonik Katılar
Sıvılar, Katılar ve Moleküller Arası Kuvvetler
16.8K Görüntüleme Sayısı
See More
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır