Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изготовление и маркировка микропузырьков с помощью флуоресцентных и радиоактивных индикаторов
В этой статье
Резюме
В этом протоколе описывается изготовление липидных микропузырьков и совместимый метод радиоактивного мечения микропузырьков с эффективностью мечения без очистки >95% и сохранением физико-химических свойств микропузырьков. Этот метод эффективен для различных составов липидных микропузырьков и может быть адаптирован для создания радиоактивных и/или флуоресцентных микропузырьков.
Аннотация
Микропузырьки — это заполненные газом частицы в липидной оболочке, которые превратились из сосудистых ультразвуковых контрастных веществ в революционные платформы для лечения рака. В сочетании с терапевтическим сфокусированным ультразвуком (FUS) они могут безопасно и локально преодолевать физиологические барьеры (например, гематоэнцефалический барьер), доставлять лекарства к недоступным иначе видам рака (например, глиобластоме и раку поджелудочной железы) и лечить нейродегенеративные заболевания. Терапевтический арсенал микропузырьковой ФУС развивается в новых направлениях, включая синергетическую комбинированную лучевую терапию, мультимодальную визуализацию, а также комплексную загрузку и доставку лекарств из оболочек микропузырьков.
Мечение микропузырьков радиоиндикаторами является ключом к созданию этих расширенных тераностических возможностей. Тем не менее, существующие стратегии радиоактивного мечения микропузырьков основаны на методологиях очистки, которые, как известно, нарушают физико-химические свойства микропузырьков, используют короткоживущие радиоизотопы и не всегда приводят к стабильному хелатированию. В совокупности это создает неопределенность в отношении точности микропузырьковой радиовизуализации и эффективности доставки радиоизотопов опухолей.
В этом протоколе описывается новая методология мечения микропузырьков в одном котле, не требующая очистки, которая сохраняет физико-химические свойства микропузырьков при достижении эффективности хелатирования радиоизотопов >95%. Он универсален и может успешно применяться в специализированных и коммерческих микропузырьковых составах с различной длиной ацильной липидной цепи, зарядом и составом хелатора/зонда (порфирин, DTPA, DiI). Его можно адаптивно применять при изготовлении микропузырьков и к готовым рецептурам микропузырьков с модульной настраиваемостью флуоресценции и мультимодальных флуоресцентных/радиоактивных свойств. Соответственно, этот гибкий метод позволяет производить специализированные, отслеживаемые (радио, флуоресцентные или радио/флуоресцентные активные) мультимодальные микропузырьки, которые полезны для совершенствования механистических, визуализирующих и терапевтических микропузырьковых применений-FUS.
Введение
Микропузырьки представляют собой надмолекулярные тераностики микронного размера с газовым ядром, стабилизированным белком, полимером или, в большинстве случаев, липидной оболочкой (рис. 1А). При введении в кровоток микропузырьки сохраняют границы раздела газ/жидкость, которые обнаруживаются ультразвуком в течение нескольких минут до растворения их газовых ядер 1,2. Следовательно, первое клиническое использование микропузырьков было в качестве контрастных веществ для ультразвуковой визуализации в реальном времени3. Изобретение терапевтического сфокусированного ультразвука (FUS) расширило клинические возможности микропузырьков. При стимуляции низкочастотным FUS микропузырьки колеблются и генерируют целевые, настраиваемые механические силы в диапазоне от транзиторной проницаемости сосудов до фокальной абляции тканей 4,5. В результате, за последние 20 лет микропузырьковый FUS был исследован для открытия гематоэнцефалического барьера (ГЭБ), доставки лекарств и зондов для визуализации, терапии нейродегенеративных заболеваний и абляции рака 6,7,8,9,10,11.
Тераностический арсенал микропузырьков продолжает развиваться в новых и захватывающих направлениях. Традиционные приложения для доставки микропузырьков FUS основаны на совместном введении терапевтического или визуализирующего груза вместе с коммерческими микропузырьками. Растет интерес к расширению возможностей доставки микропузырьков-FUS за счет понимания взаимодействия оболочки микропузырька с биологией, изучения индивидуальных некоммерческих составов микропузырьков и создания тераностических микропузырьков «все в одном» с грузом, загруженным непосредственно на оболочку микропузырька 12,13,14. На самом деле, примерно в 40% исследований доставки лекарств с помощью липидных микропузырьков используются такие микропузырьки, наполненные оболочкой. Помимо визуализации и доставки лекарств, микропузырьковый FUS также показал многообещающие результаты в улучшении лучевой терапии рака16 и активации противоопухолевых эффектов доброкачественных агентов, нагруженных оболочкой, с помощью сонодинамической терапии17,18.
Эти традиционные и расширенные направления в применении микропузырькового рака могут быть более стратегически продвинуты путем маркировки оболочек микропузырьков радиоактивными индикаторами. В области микропузырьков, нагруженных грузом «все в одном», такая радиоактивная маркировка 1) способствует количественной оценке золотого стандарта биораспределения этих нагруженных оболочек микропузырьков на мишени и вне их, 2) выводит фармакокинетические взаимосвязи между структурой и активностью, которые информируют об оптимальном выборе композиций микропузырьков для максимизации доставки к мишени, и 3) определяет стратегические и надлежащие методы применения и планирования лечения под визуальным контролем (например, типы тканевых мишеней, дозиметрия, выбор лекарств для смягчения нецелевых проблем безопасности, полезность по сравнению с традиционными парадигмами совместного лечения) систем «все в одном» с грузом15,19. На доклинической стадии такое понимание судьбы оболочки микропузырька может также пролить свет на более широкие механизмы действия микропузырьков-FUS. Например, было показано, что перенос липидов из оболочек микропузырьков в клетки-мишени влияет на сонопорацию с поддержкой FUS12,20. Таким образом, понимание и оптимизация такого переноса могут быть использованы для доклинической и клинической микропузырьковой FUS-терапии, в которой участвует сонопорация (трансфекция in vitro, доставка лекарств, абляция опухоли, лучевая сенсибилизация и сонодинамическая терапия) 20,21,22,23,24,25). Двойные ультразвуковые и радиовизуальные установки также позволили бы осуществлять мониторинг вскрытия сосудов FUS и лечения (например, кинетика открытия ГЭБ) с помощью одного агента, а не обычных конструкций с двумя агентами26. Аналогичным образом, липидное микропузырьковое радиомечение может служить в качестве универсальной альтернативы платформам совместной доставки микропузырьковых микропузырьков/лучевой терапии с использованием одного агента microbubble-FUS + радиофармацевтических препаратов27.
Хрупкость микропузырьков является нетривиальной проблемой для такой маркировки. Все существующие стратегии радиоактивного мечения ограничены методами очистки, которые, как известно, нарушают стабильность и размер микропузырьков, в то время как некоторые из них также характеризуются неэффективным и нестабильным радиоактивным мечением 28,29,30,31,32. Требования к очистке также приводят к более длительным протоколам. В сочетании с использованием короткоживущих радиоизотопов (например, 18F t1/2 1,8 ч, 28,29 99mTct 1/2 6 ч, 3268Ga t1/2 1 ч31) это создает неэффективность, связанную с распадом радиоизотопов, и ограничивает временные рамки радиовизуализации и планирования лечения. В совокупности эти ограничения чреваты получением сокращенной и нерепрезентативной радиовизуализации, неточными фармакокинетическими данными и неэффективной доставкой радиоизотопов опухолей.
В данном отчете эти ограничения преодолеваются за счет использования сильных и стабильных хелатных свойств порфирина. Порфирины представляют собой органические, гетероциклические макромолекулы с высококонъюгированным планарным кольцом и центральным координационным сайтом, который может вмещать различные металлы. К ним относятся радиоизотопы с более длительным сроком действия, такие как медь-64 (t1/2 12,7 ч), радиофармпрепарат с позитронно-эмиссионной томографией (ПЭТ) и возможности подсчета γ33. При конъюгации с липидным остовом порфирины могут быть легко включены в супрамолекулярные структуры и впоследствии мечены медью-64 с быстротой, высокой эффективностью хелатирования и стабильностью сыворотки, сохраняя при этом свойства родительских немеченых частиц33,34. Кроме того, порфирины флуоресцентно активны с модульным самогашением в нано- и микрочастицах, которое восстанавливается при разрушении частиц; дополнительное считывание к ПЭТ и подсчету γ, которое облегчает как объемный, так и микроскопический анализ судьбы раковины (рис. 1A)15.
Используя порфирин-липид в качестве хелатора, эти свойства были использованы для создания новой методологии микропузырькового радиомечения с использованием одного горшка без очистки (рис. 1B, C), которая преодолевает ограничения, связанные с существующими методами микропузырькового радиомечения. Этот протокол обеспечивает эффективность хелатирования меди-64 на >95%, не требует очистки после маркировки и сохраняет физико-химические свойства микропузырьков. Он может быть легко интегрирован в «измельченное» производство липидных микропузырьков до их активации (Рисунок 1B). Он универсален и может успешно применяться в специализированных и коммерческих микропузырьковых составах с различной длиной ациллипидной цепи (от C16 до C22), зарядом (нейтральным и анионным) и порфирин-липидными композициями (1 моль, 10 моль, 30 моль), генерируя микропузырьки с радио- и флуоресцентной активностью. Его приспособляемость также может выходить за рамки порфирина. Протокол one-pot может быть модифицирован для использования альтернативных коммерчески доступных хелаторов (например, диэтилентриамина пентаацетата (DTPA)-липида) и флуорофоров (например, DiI). Его также можно модифицировать для маркировки готовых составов микропузырьков с помощью «спайкового» подхода. Соответственно, этот метод позволяет получать специализированные, отслеживаемые (радио, флуоресцентные или двойные радио/флуоресцентные активные) микропузырьки, полезные для совершенствования механистических, визуализирующих и терапевтических микропузырьков-FUS. В приведенном ниже протоколе описывается изготовление липидных микропузырьков, применение протокола однореакторного радиоактивного мечения, необходимая радиоактивная маркировка и физико-химическая характеристика свойств, а также возможные модификации.

Рисунок 1: Протокол изготовления микропузырьков и радиоактивного мечения. (A) Порфирин-липид в форме пирофеофорбида-а-липида служит мультимодальным хелатором в рамках этого протокола. Будучи мономером, хелатированным до меди-64 (i), он обладает возможностями ПЭТ и визуализации. Его флуоресценция гасится в форме частиц (микропузырьков (ii) и их нанопотомства после растворения (iii)) и не гасится с разрушением частиц (iv). (B) Протокол гидратации/активации липидной пленки, описанный в этом отчете, для получения липидных микропузырьков из измельченного и (C) интеграция одноточечного радиоактивного мечения между образованием липидной суспензии и активацией микропузырьков. Этот рисунок был адаптирован с разрешения Rajora et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
1. Препараты реагентов
- Приготовьте буфер из ацетата аммония (0,1 М, pH 5,5)
- С помощью аналитических весов извесьте 770,8 мг ацетата аммония на бумаге для взвешивания. Переложите взвешенное количество в чистую стеклянную стакан объемом 250 мл.
- Добавьте в стакан 90 мл воды двойной дистилляции (ddH2O), измеренной с помощью градуированной пипетки. Добавьте мешалку и поместите стакан на магнитную пластину для перемешивания, чтобы растворить ацетат аммония. Перемешивайте со скоростью, создающей легкий вихрь, но без разбрызгивания раствора.
- Откалибруйте pH-метр в соответствии с инструкциями прибора с использованием стандартов pH 4 и 7. После калибровки вставьте датчик pH в буфер из ацетата аммония.
- Добавьте в раствор 104 мкл уксусной кислоты, перемешайте до растворения и измерьте pH.
ПРИМЕЧАНИЕ: На этом этапе pH должен быть близок к 5,5. - Отрегулируйте pH буфера, добавив 10 Н гидроксида натрия (или соляную кислоту, если буфер становится слишком основным) с шагом 5-10 мкл с помощью микропипетки. Перемешайте, измерьте pH и повторите по мере необходимости. Обратите внимание на объем добавленного основания/кислоты.
- Добавьте достаточный объем ddH2O, чтобы создать в общей сложности 100 мл буфера.
ПРИМЕЧАНИЕ: Например, если во время коррекции pH использовать 45 мкл 10 Н гидроксида натрия, то в стакан будет добавлено 9,851 мл ddH2O (100 мл [целевой объем] - 90 мл [шаг 1.1.2] - 0,104 мл [шаг 1.1.4] - 0,045 мл [шаг 1.1.5] = 9,851 мл). - Тщательно перемешайте буфер в последний раз, прежде чем переложить его в контейнер для хранения с крышкой.
- Очистите pH-метр в соответствии с инструкциями прибора.
ВНИМАНИЕ: Концентрированный водный гидроксид натрия и соляная кислота могут вызвать кожные реакции, поэтому с ними следует обращаться в перчатках.
- Приготовьте гидратационный буфер (PGG)
- Аспиратуйте фосфатно-солевой буфер (PBS) в шприц и оснастите конец полиэфирсульфоновым фильтром размером пор 0,2 мкм. Отфильтруйте PBS в чистую пластиковую центрифужную пробирку с крышкой.
ПРИМЕЧАНИЕ: Можно использовать пористые шприцевые фильтры размером 0,2 мкм из альтернативных мембранных материалов (например, поливинилиденфторида) при условии, что мембрана совместима с PBS и ацетатом аммония. - Смешайте отфильтрованный PBS, пропиленгликоль и глицерин с помощью микропипетки в объемном соотношении 8:1:1, чтобы получить гидратационный буфер (также называемый PGG). При добавлении пропиленгликоля и глицерина отсадите и сотрите все остаточные капли пропиленгликоля или глицерина с поверхности наконечника пипетки, прежде чем медленно дозировать реагент в PBS. В PBS будет наблюдаться четкая вязкая мутность, похожая на струну.
ПРИМЕЧАНИЕ: Рекомендуется использовать микропипетку p1000 для добавления PBS в центрифужную пробирку, а затем пропиленгликоля и глицерина, поскольку последние два реагента являются вязкими. Таким образом, их следует медленно отсасывать через микропипетку до тех пор, пока движение жидкости в наконечнике пипетки не исчезнет и таким образом, чтобы воздух не всасывался при извлечении наконечника пипетки из реагента. Наконечники для микропипеток с объемной маркировкой в идеале следует использовать для выбора объемов реагентов, которые соответствуют такой маркировке (например, делая 1 мл или 5 мл PGG, и соответственно используя маркировку 0,1 мл или 0,5 мл на наконечнике микропипетки для визуализации полной аспирации пропиленгликоля и глицерина). Протирая поверхность наконечника микропипетки, не протирайте отверстие наконечника, а только по бокам. - Проводите пипетку вверх и вниз кончиком пипетки в растворе до тех пор, пока реагенты не растворятся однородно. Будьте осторожны, чтобы не ввести в раствор пузырьки воздуха.
- Чтобы еще больше обеспечить полную смесь гидратационного буфера, закройте пробирку центрифуги и медленно вращайте вверх и вниз. Не делайте вихрей.
- Вращайте трубку при давлении менее 1000 x g в течение 20-30 с (минимальная температура 4 °C, максимальная RT), чтобы удалить незаметные пузырьки воздуха.
- Аспиратуйте фосфатно-солевой буфер (PBS) в шприц и оснастите конец полиэфирсульфоновым фильтром размером пор 0,2 мкм. Отфильтруйте PBS в чистую пластиковую центрифужную пробирку с крышкой.
- Подготовка буфера для гидратации/радиоактивного мечения (AA-PGG)
- Шприцевой фильтр 0,1 М, буфер из ацетата аммония pH 5,5 (с шага 1.1) и PBS в отдельные пробирки в соответствии с шагом 1.2.1.
- Смешайте отфильтрованный буфер из ацетата аммония, отфильтрованный PBS, пропиленгликоль и глицерин с помощью микропипетки p1000 в центрифужной пробирке в буфере из ацетата аммония 5:3:1:1: PBS: пропиленгликоль: объемное соотношение глицерина в указанном порядке. Следуйте инструкциям по аспирации, смешиванию и центрифугированию в соответствии с шагами 1.2.2-1.2.5, чтобы получить AA-PGG.
- Элюент тонкослойной хроматографии мгновенного действия (iTLC)
- Взвесьте до 0,1 г этилендиаминтетрауксусной кислоты (ЭДТА) и переложите в закрытый флакон. Растворите в ddH2O таким образом, чтобы образовался 2% w/v раствор ЭДТА (например, для 50 мг ЭДТА добавьте 2,5 мл ddH2O).
- Соедините 2% w/v раствор ЭДТА с буфером ацетата аммония из шага 1.1 в соотношении 9:1 об/в (90% раствор ЭДТА, 10% буфер ацетата аммония). Закройте крышкой и храните полученный элюент iTLC.
2. Образование липидных пленок
ПРИМЕЧАНИЕ: Эта процедура описывает образование липидной пленки с композициями, имитирующими коммерческий микропузырь Definity®, с порфирин-липидом, замещающим липид хозяина и составляющим 30 мол.% от общего липида. Тем не менее, протокол радиоактивного мечения может быть применен к различным липидным составам (длины цепей C16, C18, C22, нейтральный или анионный заряд, различные молярные составы порфирин-липидов). К письму прилагается дополнительная таблица (Supplementary File 1), в которой представлены расчеты, составы, массы и объемы запасов для описываемой и других рецептур. Коммерчески доступны все липиды за исключением порфирин-липидного, пирофеофорбид-а-липида (пиро-липид), синтез которого ранее был подробно описан35,36.
- Используя дополнительный файл 1, определите общую необходимую массу для каждого липида в зависимости от количества необходимых пленок.
- Взвесьте пустой стеклянный флакон 0,5 драма на аналитических весах.
ПРИМЕЧАНИЕ: Пыль препятствует успешному образованию микропузырьков. Таким образом, вдувайте воздух под давлением в флакон, чтобы удалить пыль / твердые частицы при хранении без крышки. - Взвесьте 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (ДППК) на бумаге для взвешивания.
ПРИМЕЧАНИЕ: Взвешенная масса должна быть получена на этапе 2.1 плюс дополнительные 0,5-1 мг для учета любых потерь при работе с пробой на последующих этапах. - Переложите DPPC в взвешенный стеклянный флакон и повторно взвесьте его, чтобы определить липидную массу во флаконе. Этот процесс обеспечивает более легкий перенос липидов в стеклянный флакон, снижение потерь/разлива липидного порошка и более точное измерение липидной массы.
- Повторите шаги с 2.2 по 2.4 с другими липидами: 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-5000] (DPPE-mPEG), 1,2-дипальмитоил-sn-глицеро-3-фосфат (DPPA) и пиролипид C16.
Примечание: Если пиролипид доступен не в виде весового порошка, а в виде пленки или аликвоты в неизвестном количестве, его можно растворить в хлороформе с образованием исходного материала, концентрация которого может быть рассчитана с помощью измерений поглощения УФ-ВИД в метаноле с использованием закона Бера-Ламберта,как описано ранее. - В стеклянных пробирках с помощью микропипеток или стеклянных шприцев приготовьте следующие органические растворители и растворы: 1) хлороформ, 2) 9:1 об/в хлороформа: метанол и 3) 65:35:8 хлороформ: метанол: ddH2O. Для последнего пипеткой пипетируйте компоненты и смешивайте их в следующем порядке: ddH2O, метанол, затем хлороформ.
ВНИМАНИЕ: Метанол и хлороформ опасны для здоровья, легковоспламеняющиеся и летучие. Наденьте защитные очки, перчатки и лабораторный халат, а также используйте вытяжной шкаф. - Используйте Дополнительный файл 1 для расчета объема органического растворителя/раствора, необходимого для изготовления липидных запасов, и выберите стеклянные шприцы соответствующего объема.
ПРИМЕЧАНИЕ: Этот объем должен давать исходные концентрации, соответствующие 15-100 мкл исходных аликвот на пленку, которые можно легко измерить с помощью стеклянных микролитровых шприцев объемом 25-100 мкл. - Стеклянные шприцы трижды промыть хлороформом. Прокачивайте поршень вперед и назад, чтобы высушить шприц.
- Измерьте и добавьте органический растворитель/растворы с помощью шприца из очищенного стекла в отдельные липидные флаконы в соответствии с расчетами в таблице на шаге 2.7, чтобы сформировать запасы липидов. Растворите пиролипид в хлороформе (если он уже не растворен в соответствии с примечанием к шагу 2.5), DPPC и DPPE-mPEG в 9:1 v/v хлороформ: метанол и DPPA в 65:35:8 хлороформ:метанол:ddH2O. Если для всех добавок используется один и тот же стеклянный шприц, промойте и высушите между каждым липидом.
ПРИМЕЧАНИЕ: Если выбранный состав не содержит DPPA или его вариант с длиной цепи C18, то пиролипид, липид PC-хозяина и липид PEG могут быть растворены в хлороформе. - Закупорьте флаконы и вортекс.
- Добавьте рассчитанные объемы исходных липидных растворов в новый 0,5-драмовый стеклянный флакон (пленочный флакон) через стеклянный микролитровый шприц. Для первого липидного бульона вставьте кончик иглы в нижний центр флакона и медленно погружайте, чтобы избежать разбрызгивания стенок флакона. При последующих добавлениях поместите кончик иглы непосредственно над уровнем жидкости и коснитесь боковой стороны флакона, чтобы удалить все последние капли таким образом, чтобы не подвергать иглу воздействию жидкости, находящейся ниже.
ПРИМЕЧАНИЕ: Промойте и высушите стеклянный шприц между добавлением липидов при возникновении загрязнения. При изготовлении нескольких пленок закрывайте колбусы как пленкой, так и пробирками между добавлениями, чтобы свести к минимуму испарение растворителя. - Осторожно перемешайте флакон вручную в вертикальном положении, чтобы перемешать содержимое. Избегайте разбрызгивания раствора на стенки флакона.
- Откупорьте (сохраните крышку) и вставьте азотную линию в свободное пространство флакона. Отрегулируйте поток азота так, чтобы вызвать небольшое видимое возмущение на поверхности жидкости, но без воронки или разбрызгивания.
- Сделайте вихревой пробирку сразу после введения азотной линии. Начинают с небольшой скорости, достаточной для образования воронки с растворителем, поднимающейся не выше 1 см от дна флакона. Избегайте разбрызгивания растворителя. По мере испарения растворителя медленно и без паузы увеличивайте скорость вихря, сохраняя высоту растворителя до тех пор, пока вся жидкость не испарится. В результате на нижнюю треть флакона будет нанесена тонкая пленка.
- Поместите флакон в вакуумный эксикатор и продолжайте сушить пленку под вакуумом в течение 8-72 часов. Накройте флакон (кроме отверстия) или влагопоглотитель алюминиевой фольгой.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен здесь. Следующие шаги могут быть выполнены после высыхания пленки или пленки могут храниться под аргоном, запечатанным парапленкой, в морозильной камере при температуре -20 °C до 1 месяца, и дольше, если хранить их в сухом состоянии.
3. Увлажнение липидной пленки
ПРИМЕЧАНИЕ: Если микропузырьки используются in vitro или in vivo, используйте стерильные наконечники для микропипеток, пробирки, шприцы и иглы для этапов с 3.3 по 5.4, если не указано иное.
- Снимите пленку с пылесоса или, если она хранится в морозильной камере, дайте ей нагреться до температуры температуры.
- Наполните стакан объемом 250 мл водой и нагрейте воду до 70-80 °C.
- Нагрейте ультразвуковую баню на водяной бане до 69 °C.
- Нанесите микропипеткой 1 мл AA-PGG (шаг 1.3) по краям флакона с липидной пленкой, чтобы избежать образования пузырьков.
ПРИМЕЧАНИЕ: При изготовлении нехелатированных контрольных микропузырьков или микропузырьков, содержащих только флуоресцентные лампы, используйте PGG (шаг 1.2) вместо AA-PGG. - Частично закройте отверстие флакона крышкой, оставив достаточно места для вставки линии перфторпропана (PFP). Подайте PFP в свободное пространство флакона на 20 с над жидкостью таким образом, чтобы жидкость была заметно нарушена, но не разбрызгивалась. Не подавайте PFP непосредственно в суспензию. Закройте флакон крышкой.
ПРИМЕЧАНИЕ: Если поток достаточен по силе и времени, флакон начнет остывать на ощупь. - Погрузите нижнюю половину флакона в водяную баню при температуре 70-80 °C на 1 минуту. Затем обрабатывайте ультразвуком в течение не менее 30 с в ультразвуковом аппарате для ванны при температуре 69 °C или до тех пор, пока липидная пленка равномерно не диспергируется в AA-PGG. Избегайте образования пузырьков или преждевременной активации микропузырьков (преждевременная активация будет проявляться в виде молочных/мутных участков липидной суспензии). При необходимости протрите поверхность флакона, чтобы лучше определить, остались ли невзвешенные липиды.
ПРИМЕЧАНИЕ: Если липидная пленка не увлажняется в течение 1 минуты после ультразвуковой обработки, повторно нагрейте в ванне при температуре 70-80 °C и повторно произведите ультразвуковую обработку. - После того, как липидная пленка станет однородно взвешенной, нагрейте в последний раз в течение 1 минуты и обработайте ультразвуком еще 30 секунд.
- Протрите флакон и дайте ему пассивно остыть до RT (~5-10 минут).
- Наполните свободное пространство флакона PFP в соответствии с шагом 3.5, закройте крышку и запечатайте края крышки парапленкой.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен здесь и возобновлен не позднее, чем через 8 часов.
4. Радиоактивное мечение
ПРИМЕЧАНИЕ: Для нехелатных контрольных микропузырьков или микропузырьков, содержащих только флуоресцентные лампы, перейдите к разделу 5 протокола.
ВНИМАНИЕ: Выполняйте шаги 4.4-4.6 настоящего протокола в радиоактивной лаборатории, если не указано иное. 64CuCl2 представляет собой радиологическую опасность с риском мультисистемной токсичности при воздействии на кожу, вдыхании или проглатывании. По возможности обрабатывайте его в вытяжном шкафу непрямым способом с помощью щипцов с резиновыми наконечниками. При работе с ним надевайте защитный лабораторный халат, персональное кольцо и дозиметр для бейджа, а также двойную перчатку. Убедитесь, что 64CuCl2 работает с 2-дюймовым свинцовым экранированием. При необходимости транспортируйте его в контейнере со свинцовой обшивкой. Защитите контейнеры для отходов и проведите эксплуатационное обследование на предмет загрязнения после использования.
- Приготовьте водяную баню с температурой 60 °C в стеклянном стакане или большой кристаллизующей чашке с магнитной мешалкой. Используйте нагревательную пластину с регулируемой температурой, оснащенную термозондом, вставленным в воду, настроенным на перемешивание со скоростью, которая дает слабую, но заметную воронку.
- Перенесите герметичный флакон, содержащий 64CuCl2 в 0,1 Н HCl, в калибратор дозы с помощью щипцов с резиновыми наконечниками.
ПРИМЕЧАНИЕ: При заказе 64CuCl2 попросите растворить его в 5-20 мкл 0,1 Н HCl. Меньший объем имеет решающее значение для сохранения выхода микропузырьков. - Обратите внимание на активность меди-64, измеренную на калибраторе дозы, и время. Извлеките флакон с помощью щипцов и поместите его в контейнер со свинцом.
- Разделите отмеченную активность на объем, зарегистрированный для 64CuCl2, чтобы получить значение MBq·mL-1.
- Снимите липидную суспензию с шага 3.9 и закрепите ее в держателе флакона.
- Откупорьте флакон 64CuCl2 и зафиксируйте его щипцами.
- Микропипеткой объем раствора 64CuCl2 , соответствующий 40-250 МБк активности, и перенос в липидную суспензию. Убедитесь, что наконечник пипетки погружен в суспензию. Погрузите, а затем проведите пипеткой вверх и вниз, чтобы полностью передать 64CuCl2.
ПРИМЕЧАНИЕ: Количество добавляемого 64CuCl2 будет зависеть от предполагаемого применения микропузырьков, меченных радиоактивными веществами, и чувствительности калибратора дозы. Для продольного (до 48 ч после инъекции) отбора ПЭТ и забора крови in vivo у мышей рекомендуется минимум 220 МБк и 50 МБк соответственно. - Крышка как липидной суспензии, так и 64флакона CuCl2 .
- С помощью плоских щипцов с резиновыми наконечниками вручную поворачивайте радиоактивную липидную суспензию вверх и вниз не менее 5 раз, чтобы аккуратно перемешать 64CuCl2 через суспензию. Не трясите и не роняйте флакон, а также избегайте образования пузырьков.
- Когда вы находитесь правой стороной вверх, осторожно щёлкните крышку флакона, удерживая суспензию в неподвижном положении. Это поможет любой жидкости, попавшей в колпачок, притягиваться к дну флакона. Осторожно частично откупорьте флакон и вставьте в него игольчатую линию PFP 18 G. Заполните свободное пространство флакона PFP на 20 с, как указано на шаге 3.5. Закройте флакон крышкой и запечатайте парапленкой.
- Измерьте активность флакона на калибраторе дозы и запишите время.
ПРИМЕЧАНИЕ: Если адекватная активность не была перенесена во флакон, повторите шаги 4.5-4.11, добавив соответствующий дополнительный объем 64CuCl2. - Поместите флакон в держатель флакона из пенопласта и протолкните внутрь, чтобы нижняя половина флакона подвергалась воздействию тепла. Поместите держатель на водяную баню при температуре 60 °C и нагревайте в течение 1 часа.
- Пока происходит реакция хелирования, подготовьте планшеты iTLC. Надев свежие перчатки, разрежьте стеклянную бумагу для хроматографии из микрофибры на полоски размером 1 см х 8 см. Нагрейте полоски в стеклянной сушильной печи при температуре 80 °C.
ПРИМЕЧАНИЕ: Этот этап может быть выполнен в нерадиоактивной лаборатории. - Через 1 ч снимите флакон на шаге 4.12 с огня и протрите края салфеткой.
- Вращайте флакон вверх и вниз вручную с помощью щипцов с резиновыми наконечниками, чтобы конденсировать конденсат на стенках флакона в липидную суспензию.
- Когда флакон находится в вертикальном положении, задерните крышку, стабилизируя пробирку. Снимите парапленку и протрите колпачок, чтобы удалить попавшую воду из ванны.
- Осторожно откройте флакон и аспирируйте 1-2 мкл липидной суспензии. Найдите суспензию на расстоянии 1 см от центра нижней части полоски iTLC и снова закройте флакон. Дайте пятну высохнуть.
ПРИМЕЧАНИЕ: В идеале минимум 2 iTLC должны быть обнаружены на одну реакционную смесь и разработаны на каждую меченую липидную суспензию для уверенности. - Микропипетка 200 мкл элюента iTLC (полученного на этапе 1.4) на дно пробирки объемом 10 мл. Поместите пробирку в свинцовый контейнер. Добавьте пятнистый iTLC в пробирку и дайте полоске проявиться, пока элюент не окажется примерно в 1 см от верхнего края полоски.
- Снимите разработанные полоски iTLC с помощью щипцов. Держите полоску вертикально и разрежьте на три части над круглыми пластиковыми трубками объемом 5 мл объемом 5 мл с γ счетчиком и крышками так, чтобы каждая треть полоски попадала прямо в отдельную треть. Вставьте нажимные колпачки в три пробирки.
- Измерьте количество трубок, содержащих полоски, и пустую/закрытую контрольную трубку на счетчике γ на предмет активности меди-64 и запишите соответствующее количество очков в минуту (cpm). Вычтите активность контрольной трубки из других показаний, чтобы скорректировать фоновую активность.
ПРИМЕЧАНИЕ: Скорректированные показания нижней трети полоски (часть 1) связаны с хелатированными до липидных взвешенными частицами меди-64. Средний срез (часть 2) содержит полосу свободных хелатов меди-64 и 64Cu-пиролипидов в несупрамолекулярной форме. Верхняя секция (часть 3) содержит преимущественно свободную медь-64. - Рассчитайте радиохимическую чистоту с помощью уравнения 1.
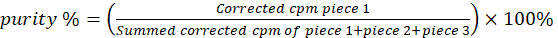 (Уравнение 1)
(Уравнение 1)
ПРИМЕЧАНИЕ: если cpm для части 1 кажется необоснованно низкой (например, ниже или эквивалентна для части 2 или 3) или если какие-либо показания превышают порог нелинейности/насыщения счетчика γ, обратите внимание на меньший объем или разбавленную аликвоту (1-2 мкл) меченой радиоактивной суспензии для iTLC. - Убедитесь, что радиохимическая чистота, полученная из обеих полосок iTLC на липидную суспензию, составляет ≥ 94%. Если нет, продолжайте нагревать липидную суспензию до 60 °C и контролируйте хелатирование с интервалом в 30 минут с помощью iTLC.
- Разкупорьте флакон с липидной суспензией с радиоактивной меткой и микропипеткой 8,89 мкл 1 N NaOH в суспензию, пипетируя вверх и вниз для полного переноса основания и нейтрализации суспензии. Закройте флакон, поверните вручную щипцами, чтобы перевернуть/вернуть, а затем осторожно постучите по крышке флакона.
- Заполните свободное пространство PFP в соответствии с шагом 4.10, закройте крышкой и запечатайте парапленкой.
5. Активация и изоляция микропузырьков
- Активируйте липидную суспензию с помощью механического вибратора в течение 45 с при 4530 об/мин, чтобы получить молочную микропузырьковую суспензию. Дайте флакону пассивно остыть до состояния RT в течение примерно 10 минут. Полученная молочная суспензия со временем разделится на два слоя.
ПРИМЕЧАНИЕ: Содержимое флакона должно выглядеть молочным после активации. Более четкая приостановка после активации указывает на неудачную активацию, участники которой будут рассмотрены в следующих разделах. - Оказавшись на RT, аккуратно переверните флакон, чтобы снова суспендировать микропузырьковую суспензию. Установите флакон на плоскую поверхность и подождите 2 минуты перед сцеживанием, чтобы получить желаемую популяцию микропузырьков следующим образом:
- Вооружите пластиковый шприц объемом 1 мл иглой 18 G и продуйте шприц/иглу путем аспирации и втягивания воздуха. На отметке 2 минуты быстро откупорьте флакон, сломав пломбу Parafilm одним движением.
- Наберите 400-550 мкл из нижней части флакона (целевой микропузырьковой популяции), избегая аспирации верхнего пенистого слоя более крупных нежелательных микропузырьков.
ПРИМЕЧАНИЕ: При необходимости наклоните флакон в одну сторону, чтобы собрать концевые объемы в шприц, чтобы избежать аспирации пенистого/более легкого слоя.
- Тщательно протрите края иглы, чтобы удалить любые пенистые загрязнения, и перенесите выделенную микропузырьковую суспензию в микроцентрифужную пробирку. Аккуратно закройте колпачок (не открывайте или не закрывайте его резко). Это окончательная рабочая суспензия радиоактивно меченых микропузырьков.
- Измерьте активность конечного продукта микропузырьков на калибраторе дозы и запишите время. Разделите это значение на объем суспензии, сцеженной на шаге 5.2, чтобы получить значение MBq·mL-1 для расчета объемов впрыска в зависимости от интересующего приложения.
ПРИМЕЧАНИЕ: Микропузырьки с радиоактивной меткой теперь готовы к использованию. Раздел 6 может быть выполнен через 24 часа. Для получения информации о том, как эти меченые радиоактивными метками микропузырьки могут быть введены и отслежены in vivo с помощью мультимодальной (ультразвук, ПЭТ, флуоресцентная) визуализации, см. Rajora et al.15.
6. Валидация эффективности радиоактивного мечения
- Суспендируйте суспензию микропузырьков с помощью щадящего пипетирования или инверсии флакона.
ПРИМЕЧАНИЕ: Никогда не нагнетайте на рабочий продукт микропузырьков. Вихревой процесс дестабилизирует микропузырьковые взвеси. - Добавьте 10-200 мкл меченой радиоактивной суспензии в центрифужный фильтр объемом 0,5 мл 30 000 молекулярных отсечек (MWCO). При использовании объемов <200 мкл добавьте ddH2O в фильтрующий блок, чтобы получить общий объем 200 мкл. Поместите фильтрующий блок в совместимую микроцентрифужную трубку и крышку.
ПРИМЕЧАНИЕ: Для обеспечения успешного завершения протокола рекомендуется проводить тест на радиоактивное мечение до и отдельно от любого примененного in vitro или in vivo использования радиоактивных меченых микропузырьков. В этом случае на этом этапе можно использовать больший объем (например, 200 мкл). Когда протокол впоследствии используется для сеанса лечения, сначала подготовьте объемы лечения/инъекции, а затем как можно раньше проведите секцию 6 с оставшейся меченой радиоактивными метками суспензией микропузырьков. - Центрифуга в течение 10 мин при 12 000 x g при RT.
ПРИМЕЧАНИЕ: микроцентрифуга должна быть окружена свинцовым экраном. - Ножницами разрежьте соединение между микроцентрифужной пробиркой и ее крышкой.
- Поместите колпачок в сцинтилляционный флакон объемом 20 мл с надписью «caps». Перенесите фильтрующий блок в новую микроцентрифужную трубку (трубка 2).
- Поместите первую микроцентрифужную пробирку с инфранатантом в сцинтилляционный флакон объемом 20 мл с надписью «пробирка 1». Добавьте 200 мкл ddH2O в фильтрующий блок в пробирке 2.
- Центрифугируйте фильтрующий блок в пробирке 2 при давлении 12 000 x g при RT.
- Повторите шаги 6.4 и 6.5. Добавьте тюбик 2 колпачка в "колпачки" сцинтилляционного флакона, укрывающего пробирку 1 колпачком. Поместите пробирку 2 в новый сцинтилляционный флакон объемом 20 мл.
- Разрежьте крышку третьей микроцентрифужной пробирки и поместите во флакон «крышки» в соответствии с шагом 6.4. Переложите фильтрующий блок в новый сцинтилляционный флакон объемом 20 мл с маркировкой «единица», следя за тем, чтобы инфранатант оставался в пробирке 3 и не переносился в пробирку «единица». Если на краях фильтрующего блока видны капли, верните его в пробирку 3, крышку, и поверните вниз в течение 10 с. Поместите пробирку 3 в новый стеклянный сцинтилляционный флакон объемом 20 мл.
- Закройте крышками 5 сцинтилляционных флаконов (пробирка 1, пробирка 2, пробирка 3, крышки и единица). Приготовьте один пустой и закрытый флакон со сцинтилляцией объемом 20 мл в качестве пустого контроля.
- Измерьте шесть сцинтилляционных флаконов на γ-счетчике на предмет активности меди-64. Вычтите активность пустого флакона из активности других флаконов. Рассчитайте эффективность радиоактивного мечения/хелатирования с помощью уравнения 2.
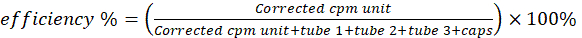 (Уравнение 2)
(Уравнение 2)
ПРИМЕЧАНИЕ: Если единичный cpm необоснованно низок (например, ниже или эквивалентен пробиркам) или если какие-либо показания превышают порог нелинейности/насыщения счетчика γ, храните сцинтилляционные флаконы в свинцовых контейнерах до 4 дней, чтобы позволить активности снизиться до тех пор, пока значения не станут ниже порогового значения, и повторите измерение.
7. Физико-химическая характеристика микропузырьков
ПРИМЕЧАНИЕ: Если в лаборатории нет специального оборудования для обработки радиоактивных образцов, физико-химическое определение микропузырьков должно проводиться с использованием нерадиоактивных, «холодных» образцов с хелированной медью. Такая «холодная» маркировка облегчает оценку выхода микропузырьков, что жизненно важно для оценки дозы микропузырьков, используемых для предполагаемого применения. Кроме того, он позволяет сравнивать их с контрольными нехелатированными микропузырьками, чтобы гарантировать, что процесс радиоактивного мечения не нарушает свойства микропузырьков. Это «холодное» мечение и связанная с ним физико-химическая характеристика должны быть выполнены до нанесения микропузырьков с радиоактивным мечением и могут быть использованы в качестве обратной связи, если требуются модификации радиоактивного мечения (см. Обсуждение).
- «Холодная» маркировка медными микропузырьками
- Используя объем раствора 64CuCl2 , добавленного в липидную суспензию на этапе 4.7, молярный состав порфирина в липидных пленках и специфическую активность, указанную в описании продукта 64CuCl2 , рассчитать приблизительное молярное соотношение металл:порфирин, полученное при радиоактивном мечении. Примеры расчетов можно найти в дополнительном файле 1.
- Следуйте разделам 1-3 текущего протокола.
- Приготовьте 0,1 мг·мл-1 раствора CuCl2 в 0,1 Н HCl.
- Нанесите микропипетку соответствующего объема этого раствора CuCl2 в липидную суспензию, рассчитанную на основании шага 7.1.1, и закупорьте флакон.
- Поверните флакон, чтобы смешать CuCl2 с липидной суспензией, заполните свободное пространство PFP, запечатайте и нагрейте в соответствии с шагами 4.9, 4.10 и 4.12. Резиновые щипцы не нужны для работы с флаконами.
- Через 1 ч снимите флакон с огня и протрите его снаружи до полного высыхания. Дайте флакону остыть до состояния RT.
- Нейтрализуйте липидную суспензию, перемешайте, заполните свободное пространство PFP и запечатайте в соответствии с шагами 4.23 и 4.24.
- Активируйте микропузырьковую суспензию и сцедите ее для получения рабочего продукта в соответствии с шагами 5.1-5.3.
- Микропузырьковый размер
ПРИМЕЧАНИЕ: Определение размера микропузырьков следует проводить сразу после активации. При оценке устойчивости рабочей суспензии повторите пробоподготовку и измерения с интервалом в 30 минут. Как правило, окно в 1-2 часа является репрезентативным для периода времени, в течение которого рабочая суспензия микропузырьков будет использоваться/вводиться после активации. Цель измерений стабильности состоит в том, чтобы обеспечить сохранение размера и выхода микропузырьков в течение этого периода времени, чтобы все обработки, проводимые из рабочего раствора, содержали аналогичные популяции микропузырьков.- Включите счетчик сошников (CC) и установите следующие параметры с помощью инструмента Редактировать СОП : апертура 30 мкм, диапазон размеров 0,6-18 мкм, ток апертуры 400-600 мкА, коэффициент усиления предусилителя 4-8, 400 обводров, промывка до и после каждого прогона, объемный анализ, объем образца 5 мкл.
- Отфильтруйте электролит CC через установку вакуумной фильтрации фильтрующего материала 0,2 мкм. Заполните емкость с электролитом и отдельную емкость для пробоподготовки.
- Фоновое измерение: Заполните одноразовую кювету объемом 10 мл отфильтрованным электролитом объемом 10 мл и выполните базовое измерение. Убедитесь, что их количество меньше 400. Если нет, промойте прибор.
- Измерение образца
- Добавьте 10 мл отфильтрованного электролита в новую кювету. Восстановите суспензию микропузырьков путем ручного инвертирования/возврата. Микропипетка 5 μл от центра дна флакона. Протрите края наконечника пипетки (кроме отверстия) и погрузите образец непосредственно в подготовленный электролит.
- Проводите пипеткой вверх и вниз, чтобы полностью перенести суспензию. С помощью наконечника пипетки осторожно поворачивайте электролит до тех пор, пока «огоньки» микропузырьковой суспензии не рассеются.
- Измерьте образец на КК (два прогона на анализируемый материал).
ПРИМЕЧАНИЕ: Объем образца размером 5 мкл обычно подходит для образцов, содержащих концентрации 1-5 x 109 микропузырьков·мл-1 . Этот объем образца может потребоваться скорректировать в зависимости от конкретной настройки прибора CC и от того, выходит ли выход микропузырьков образца за пределы указанного выше диапазона.
- Конфокальная визуализация
ПРИМЕЧАНИЕ: Проводите конфокальную визуализацию сразу после определения размера микропузырьков и в течение периода сохранения стабильности микропузырьков, как указано в шаге 7.2.- Снова суспензируйте микропузырьковую суспензию и перенесите 1-5 мкл в центр предметного стекла микроскопа. Осторожно наденьте крышку на каплю микропузырьковой суспензии, избегая попадания пузырьков воздуха. Суспензия растечется под чехлом покрытия.
- Визуализируйте микропузырьки с 60-кратным увеличением с помощью масляного иммерсионного объектива. Получение изображений в светлом поле и при возбуждении 633 нм/640-765 нм. Наложите светлопольные и флуоресцентные изображения.
ПРИМЕЧАНИЕ: Флуоресцентный сигнал должен перекрываться по всей оболочке всех видимых частиц, когда зонд однородно встроен в оболочку микропузырьков.
- Спектрофлуориметрия
ПРИМЕЧАНИЕ: Спектрофлуориметрические измерения могут быть проведены в течение 24 часов после активации микропузырьков.- Приготовьте 1% Тритон Х-100 как описано ранее35.
- Включите спектрофлуориметр за 15-30 минут до первого измерения.
- Измерьте спектры флуоресценции 1% Triton X-100 с использованием волнения 410 нм и диапазона излучения 600-800 нм в кварцевой кювете. Выберите опцию нормализации сигнала по сигналу опорного детектора (часто обозначаемому как S1/R1).
ПРИМЕЧАНИЕ: Triton X-100 легко пузырится при пипетировании. Таким образом, при переносе в кювету погружайтесь только до первого упора микропипетки. - Промойте кювету метанолом и высушите сжатым воздухом между образцами.
- Перелейте 6 мл 1% Triton X-100 в центрифужную пробирку объемом 15 мл. Суспендируйте суспензию микропузырьков и аспирируйте 1 мкл с помощью микропипетки. Протрите края наконечника пипетки, кроме отверстия, и переложите образец в подготовленный 1% Triton X-100, пипетируя вверх и вниз до завершения переноса. Сделайте раствор вихревым и переложите его на кварцевую кювету.
ПРИМЕЧАНИЕ: Отрегулируйте соотношение выборки: 1% Triton X-100 в соответствии с чувствительностью прибора и порогом нелинейного насыщения. - Измерьте этот образец, используя параметры, описанные на шаге 7.4.3. Это измерение соответствует «разрушенным» частицам.
- Повторите шаги 7.4.3-7.4.6 с использованием PBS. Это измерение соответствует «неповрежденным» частицам.
- Коррекция спектров поврежденных и неповрежденных образцов с использованием 1% измерений Triton X-100 и PBS соответственно.
- Рассчитайте эффективность гашения (QE) с помощью уравнения 3 с использованием интегрированного скорректированного на базовую линию флуоресцентного сигнала неповрежденного образца в PBS (FPBS) и в 1% Triton X-100 (FTx):
 (Уравнение 3)
(Уравнение 3)
- УФ-ВИД спектроскопия
ПРИМЕЧАНИЕ: Спектроскопические измерения могут быть проведены в течение 72 часов после активации микропузырьков.- Ультразвуком окуните аликвоту микропузырьковой суспензии в микроцентрифужную пробирку с помощью ультразвуковой ванны при РТ до тех пор, пока суспензия не станет прозрачной. Это уменьшает эффекты рассеяния во время спектроскопии.
- Включите спектрофотометр за 10 минут до первого измерения. Выберите интервал сканирования 0,25 нм и диапазон захвата 200-800 нм. Включите базовое вычитание.
- Для измерений используйте кварцевую кювету длиной 1 см. Между измерениями промойте кювету метанолом и высушите сжатым воздухом.
- Получите исходное измерение метанола.
- Сделайте вихревую промозглую прозрачную микропузырьковую суспензию и перенесите 10-50 μL в микроцентрифужную пробирку, содержащую 200-1000 μL метанола. Убедитесь, что объем метанола измерен и добавлен в пробирку с помощью чистого стеклянного микролитрового шприца. Вихревой раствор для получения «нарушенного» образца.
ПРИМЕЧАНИЕ: Разведение образца будет зависеть от эффективности загрузки порфирина и молярного состава. 20-кратное разведение подходит для 30-мольной пиро-липидной микропузырьковой композиции. - Сбор УФ-ВИД спектра.
- Повторите шаги с 7.5.4 по 7.5.6, используя PBS вместо метанола.
ПРИМЕЧАНИЕ: Для измерения объемов PBS можно использовать микропипетку вместо стеклянного микролитрового шприца.
8. Внесение изменений в протокол
- Альтернативный хелатор
- Получить липидные пленки в соответствии с разделом 2, заменив пиролипид на альтернативный липид-сопряженный медный хелатор (например, 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-диэтилентриаминпентауксусная кислота (соль аммония), далее именуемая DTPA-липид). Используйте Дополнительный файл 1 для расчета требуемой массы и объемов запасов.
ПРИМЕЧАНИЕ: Вероятно, потребуется тестирование различных молярных составов альтернативного хелатора для определения верхнего предела, за которым стабильные микропузырьки с высоким выходом не могут быть сгенерированы. - Следуйте разделам с 3 по 6 для создания и определения характеристик микропузырьков, помеченных радиоактивными метками.
- Выполните шаги с 7.1 по 7.3, чтобы охарактеризовать «холодные» микропузырьки в хелатной меди. Для оценки морфологии частиц требуется только получение изображений с помощью светлопольной конфокальной микроскопии. Если альтернативный хелатор является флуоресцентным, проведите конфокальную микроскопию с соответствующими длинами волн возбуждения и излучения в дополнение к шагам 7.4 и 7.5.
- Получить липидные пленки в соответствии с разделом 2, заменив пиролипид на альтернативный липид-сопряженный медный хелатор (например, 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-диэтилентриаминпентауксусная кислота (соль аммония), далее именуемая DTPA-липид). Используйте Дополнительный файл 1 для расчета требуемой массы и объемов запасов.
- Альтернативный флуорофор
- Готовят липидные пленки в соответствии с разделом 2, заменяя пиролипид на альтернативный липид-конъюгированный или интеркалирующий флуорофор (например, DiI). Используйте дополнительный файл 1 для расчета требуемой массы и объемов запасов.
ПРИМЕЧАНИЕ: Вероятно, потребуется тестирование различных молярных составов альтернативного флуорофора, чтобы определить верхний предел, за которым стабильные микропузырьки с высоким выходом не могут генерироваться. - Следуйте разделу 3, используя PGG вместо AA-PGG.
- Выполните шаги с 5.1 по 5.3 и шаги с 7.2 по 7.5.
- Готовят липидные пленки в соответствии с разделом 2, заменяя пиролипид на альтернативный липид-конъюгированный или интеркалирующий флуорофор (например, DiI). Используйте дополнительный файл 1 для расчета требуемой массы и объемов запасов.
- «Спайкинговый» подход: маркировка предварительно сформированных микропузырьковых липидных суспензий
- Создайте порфирин-липидную пленку в соответствии с разделом 2, используя только пиролипид без других липидных компонентов. Количество пиролипидов см. в дополнительном файле 1 .
- Гидратируйте пиролипидную пленку в соответствии с разделом 3, используя 100-200 мкл AA-PGG (или PGG, если радиоактивное мечение не требуется) вместо 1 мл гидратационного буфера.
- Переложите всю пиро-липидную суспензию в заранее изготовленную липидную микропузырьковую суспензию.
- Заполните свободное пространство PFP, нагрейте и произведите ультразвуковую обработку суспензии и уплотнения под PFP в соответствии с шагами с 3.4 по 3.9. Следите за диспергированием пиролипидной суспензии в готовой липидной микропузырьковой суспензии и проводите циклы нагрева/ультразвука до полного диспергирования.
ПРИМЕЧАНИЕ: При использовании коммерческого флакона с микропузырьками с запайкой перегородки пиролипидная суспензия может быть введена во флакон через шприц/иглу без повторного наполнения пробирки PFP. - Проведите радиоактивное мечение (см. шаг 8.3.5.1 ниже), активацию, изоляцию (см. ПРИМЕЧАНИЕ ниже) и связанную с этим характеристику в соответствии с разделами 4–7.
- Альтернативный подход заключается в том, чтобы сначала радиоактивно пометить гидратированную пиро-липидную суспензию, контролировать радиохимическую чистоту >94%, нейтрализовать 1 N NaOH (изменить объем в соответствии с объемом AA-PGG, используемым для гидратации пиролипидной пленки), а затем ввести меченую радиоактивной пиро-липидную суспензию в предварительно изготовленную микропузырьковую липидную суспензию в соответствии с шагом 8.3.3.
ПРИМЕЧАНИЕ: Этот модифицированный подход следует использовать для создания флуоресцентных или мультимодальных микропузырьков, меченных радиоактивными метками, только если следует процессу выделения, который удаляет субмикронные многослойные везикулы, образующиеся во время гидратации липидов, но не входящие в состав микропузырьков. Для получения более подробной информации см. Обсуждение.
- Альтернативный подход заключается в том, чтобы сначала радиоактивно пометить гидратированную пиро-липидную суспензию, контролировать радиохимическую чистоту >94%, нейтрализовать 1 N NaOH (изменить объем в соответствии с объемом AA-PGG, используемым для гидратации пиролипидной пленки), а затем ввести меченую радиоактивной пиро-липидную суспензию в предварительно изготовленную микропузырьковую липидную суспензию в соответствии с шагом 8.3.3.
Результаты
Ключевыми количественными результатами при изготовлении микропузырьков с радиоактивной меткой являются радиохимическая чистота и эффективность радиоактивного мечения. В этом протоколе используется iTLC и валидированная центробежная процедура, соответственно, для ...
Обсуждение
Текущий протокол радиоактивного мечения липидных микропузырьков обеспечивает радиохимическую чистоту >95%, эффективность хелатирования >95% и сохранение физико-химических свойств микропузырьков без необходимости какой-либо очистки после мечения. Эти достижения пред...
Раскрытие информации
Авторы не сообщают о конфликте интересов.
Благодарности
Мы благодарим Дебору Сколлард и Тишу Комал (программа Университетской сети здравоохранения по пространственно-временному таргетированию и усилению радиационного ответа (STTARR), Торонто, Онтарио) за их технические услуги и руководство. Мы также благодарим Марка Чжэна и доктора Алекса Даливала за их техническую помощь во время конфокальной микроскопии и Advanced Optical Microscopy Facility (Торонто, Онтарио) за предоставление соответствующего оборудования. Мы выражаем признательность нашим источникам финансирования: Канадские институты исследований в области здравоохранения, Научно-исследовательский институт Терри Фокса, Совет по естественным наукам и инженерным исследованиям Канады, Канадский фонд инноваций, Фонд принцессы Маргарет по борьбе с раком, Канадская программа исследовательских кафедр, Центр Маклафлина, Стипендиальная программа Ванье, Программа стипендий для аспирантов Онтарио, Канада по раку предстательной железы и Благотворительный фонд Питерборо имени К. М. Хантера.
Материалы
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
Ссылки
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены