Lei dos gases ideais
Visão Geral
Fonte: Laboratório do Dr. Andreas Züttel - Laboratórios Federais Suíços de Ciência e Tecnologia de Materiais
A lei ideal do gás descreve o comportamento dos gases mais comuns em condições quase ambientais e a tendência de toda matéria química no limite de diluição. É uma relação fundamental entre três variáveis do sistema macroscópico mensurável (pressão, temperatura e volume) e o número de moléculas de gás no sistema, e é, portanto, um elo essencial entre os universos microscópico e macroscópico.
A história da lei ideal do gás data de meados do séculoXVII, quando a relação entre a pressão e o volume de ar foi considerada inversamente proporcional, expressão confirmada por Robert Boyle e que agora nos referimos como lei de Boyle(Equação 1).
P  V-1 (Equação 1)
V-1 (Equação 1)
Trabalho inédito de Jacques Charles na década de 1780, que foi estendido a numerosos gases e vapores por Joseph Louis Gay-Lussac e relatado em 1802, estabeleceu a relação diretamente proporcional entre a temperatura absoluta e o volume de um gás. Essa relação é chamada de lei de Carlos (Equação 2).
V  T (Equação 2)
T (Equação 2)
Guillaume Amontons é tipicamente creditado pela primeira vez descobrindo a relação entre a temperatura e a pressão do ar dentro de um volume fixo na virada do séculoXVIII. Esta lei também foi estendida a inúmeros outros gases por Joseph Louis Gay-Lussac no início do séculoXIX e, portanto, é referida como lei de Amontons ou lei de Gay-Lussac, declarada como mostrado na Equação 3.
P  T (Equação 3)
T (Equação 3)
Juntos, esses três relacionamentos podem ser combinados para dar a relação na Equação 4.
V  T (Equação 4)
T (Equação 4)
Finalmente, em 1811, foi proposto por Amedeo Avogadro que qualquer dois gases, mantidos no mesmo volume e na mesma temperatura e pressão, contenham o mesmo número de moléculas. Isso levou à conclusão de que todos os gases podem ser descritos por uma constante comum, a constante de gás ideal R, que é independente da natureza do gás. Isso é conhecido como a lei do gás ideal (Equação 5). 1,2
PV  T (Equação 5)
T (Equação 5)
Princípios
A lei ideal do gás, e, portanto, sua característica constante R, também pode ser eloquentemente derivada da teoria dos primeiros princípios de inúmeras maneiras, onde as importantes suposições simplificadoras são de que as moléculas não têm volume inerente e não interagem. Essas suposições são válidas no limite da matéria diluída, onde o volume de espaço vazio ocupado por cada molécula ( porexemplo, ~10-23 L em condições ambientais) é muito maior do que a molécula em si (~10-26 L), e onde as interações são improváveis. Pode, portanto, ser facilmente demonstrado de várias maneiras usando equipamentos de laboratório comuns à temperatura ambiente, e pode ser medido com precisão usando uma variedade de gases a pressões de até 10 bar(Figura 1). No entanto, a lei ideal do gás não pode explicar com precisão as propriedades de gases mais densos em condições quase ambientais (por exemplo,propano) ou para condensação, fenômenos que surgem como resultado de interações intermoleculares. Por essa razão, inúmeras equações mais detalhadas de Estado têm sucedido a lei ideal do gás nos anos desde sua descoberta, tipicamente reduzindo à lei ideal do gás no limite da matéria diluída. 1,2
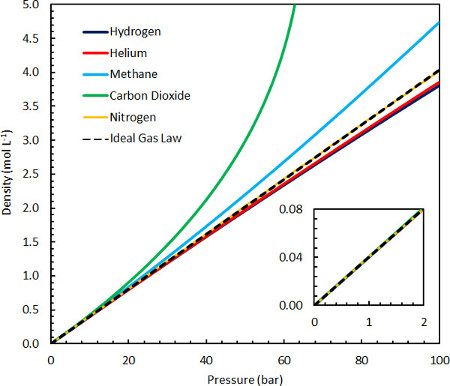
Figura 1. Comparação da densidade ideal da lei do gás com vários outros gases comuns a 25 °C e entre 0-100 bar.
Neste tutorial, mediremos cuidadosamente a densidade do gás hidrogênio em pressões e temperaturas aumentadas dentro de um volume fixo, pesando uma amostra sólida suspensa de volume conhecido: um bloco de alumínio precisamente usinado. A mudança de peso da amostra está diretamente relacionada à mudança na densidade do fluido, na qual ela está flutuando, pelo princípio de Arquimedes. Também demonstraremos as deficiências do uso de um gás menos ideal (como o dióxido de carbono) em altas pressões. Finalmente, demonstraremos visualmente e confirmaremos qualitativamente a lei ideal do gás realizando um simples experimento de bancada onde a mudança no volume do sistema devido à liberação de hidrogênio por um material de armazenamento de hidrogênio é medida. Usando qualquer um desses experimentos, podemos determinar a constante universal que descreve a relação entre pressão, temperatura e volume para uma determinada quantidade de gás – a constante de gás ideal, R.
Procedimento
1. Medindo o volume da amostra
- Limpe a amostra cuidadosamente e seque-a.
- Encha um cilindro graduado de alta resolução com água destilada suficiente para cobrir a amostra. Observe o volume inicial
- Deixe a amostra na água e observe a mudança de volume. Este é o volume da amostra, V.
- Retire a amostra e seque-a. Nota: alternativamente, mediu o comprimento lateral da amostra e calculei seu volume utilizando geometria.
2. Carregar a amostra no saldo
- Pendure a amostra no equilíbrio da suspensão magnética.
- Instale a câmara de pressão/temperatura ao redor da amostra.
- Evacuar o ambiente da amostra e reabastecer com gás hidrogênio, para 1 bar.
- Meça o peso amostral em 1 bar e temperatura ambiente, w00.
3. Meça o peso da amostra em função da pressão à temperatura ambiente
- Aumente ou diminua a pressão no ambiente amostral para Pi0.
- Permita que o ambiente da amostra se equilibre.
- Meça o peso da amostra, wi0.
- Repita 3.1-3.3 inúmeras vezes.
4. Meça o peso da amostra em função da pressão em várias temperaturas
- Coloque a temperatura em Tj e deixe equilibrar.
- Coloque a pressão do gás hidrogênio em 1 bar.
- Meça o peso amostral em 1 bar e Tj, w0j.
- Aumente ou diminua a pressão para Pij e permita que ele se equilibre.
- Meça o peso da amostra, wij.
- Repita 4.4-4.5 inúmeras vezes.
- Repita 4.1-4.6 conforme desejado.
5. Calcule a constante do gás ideal
- Tabular os valores medidos {Tj, Pij, e wij} onde P0j é sempre 1 bar e T0 é a temperatura ambiente medida.
- Calcular e tabular as diferenças Δwij e ΔPij a cada temperatura Tj usando a Equação 6 e Equação 7.
Δwij = wij - w0j (Equação 6)
Δwij = Pij - P0j = Pij - 1 barra(Equação 7) - CalculeR ij para cada medição, e média sobre todos os valores para determinar a constante de gás ideal, R. Alternativamente, plote o produto de ΔPij e V em função do produto de Δwij (dividido pelo peso molecular, MW) e Tj, e realize uma análise de regressão linear para determinar a inclinação, R. (Equações 8 e 9) Para hidrogênio, MW = 2,016 g/mol.
ΔP V = Δ nRT (Equação 8)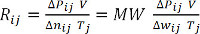 (Equação 9)
(Equação 9)
Resultados
A lei ideal do gás é uma descrição válida das propriedades reais do gás de numerosos gases comuns em condições próximas ao ambiente(Figura 1 inset) e, portanto, é útil no contexto de muitas aplicações. As limitações da lei ideal do gás na descrição de sistemas sob condições de altas pressões ou baixas temperaturas podem ser explicadas pela crescente importância das interações moleculares e/ou do tamanho finito das moléculas de gás que contribuem para as propriedades do sistema. Portanto, gases com interações intermoleculares fortes e atraentes (decorrentes de interações dipolo-dipolo, incluindo ligação de hidrogênio, interações íon-dipolo ou interações van der Waals) apresentarão densidades maiores do que o gás ideal. Todos os gases também terão um componente repulsivo em altas densidades devido ao fato de que mais de uma molécula não pode ocupar o mesmo local, emprestando uma diminuição da densidade sobre o gás ideal. Gases como hidrogênio e hélio mostram uma contribuição mais significativa da força repulsiva devido ao tamanho molecular finito, e, portanto, têm densidades ligeiramente menores em altas pressões. Metano e dióxido de carbono mostram contribuições muito mais significativas para suas propriedades a partir de interações atraentes, emprestando-lhes densidades mais altas do que o gás ideal até pressões muito altas, onde o termo repulsivo domina (a muito mais de 100 bar a 25 °C).

Figura 2. Isoterm de absorção de adsorção de equilíbrio de CO2 em área de superfície alta, carbono superativado MSC-30, a 25 °C.
Aplicação e Resumo
A lei ideal do gás é uma equação tão fundamental das ciências químicas que tem uma infinidade de usos tanto em atividades laboratoriais cotidianas como em cálculos e modelagem de sistemas até mesmo altamente complexos, pelo menos para a primeira aproximação. Sua aplicabilidade é limitada apenas pelas aproximações inerentes à própria lei; em pressões e temperaturas quase ambiente, onde a lei ideal do gás é bem válida para muitos gases comuns, é amplamente empregada na interpretação de sistemas e processos baseados em gás. Dois exemplos de dispositivos que operam com princípios, que podem ser conciliados pelo uso da lei do gás ideal, são o termômetro de gás e o motor Stirling.
Uma aplicação específica é medir a quantidade de adsorção de gás (fissionação) na superfície de um material sólido. Adsorção é o fenômeno físico pelo qual moléculas de gás deixam a fase gasosa e entram em uma fase densificada perto da superfície de um sólido (ou talvez um líquido) devido a interações intermoleculares atraentes (forças de dispersão) entre o sólido e o gás. O papel da adsorção pode ser negligenciado para muitos materiais a granel (como vidro e inoxidável) aço em condições ambientais, mas torna-se muito importante para materiais porosos com uma grande área de superfície acessível, especialmente em baixas temperaturas. 3 O método volumétrico de Sieverts e o método gravimétrico de quantificação da adsorção física dependem de conhecer a equação do estado do gás no sistema. Com baixas pressões e temperatura ambiente, a lei ideal do gás é válida para muitos gases, e pode ser usada para determinar com precisão a quantidade adsorvida de gás de forma semelhante como descrito no protocolo para determinar R acima. Por exemplo, em medidas gravimétricas da flutuação de um sorbent de área de alta superfície em condições onde a lei do gás ideal é de fato válida,a diferença entre o Δwreal medido e oideal Δw calculado usando a equação ideal de estado pode ser atribuída à mudança de peso da fase adsorvida. (Equação 10) Os isotherms de adsorção de gás de equilíbrio podem, assim, ser medidos tabulando esse desvio,anúnciosde Δw , em função da pressão a uma temperatura fixa (ver Figura 2), um procedimento padrão na caracterização de materiais porosos.
Δwanúncios = Δwreal - Δwideal (Equação 10)
Referências
- Zumdahl, S.S., Chemical Principles. Houghton Mifflin, New York, NY. (2002).
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Rouquerol, F., Rouquerol, J., Sing, K.S.W., Llewellyn, P., Maurin, G. Adsorption by Powders and Porous Solids: Principles, Methodology and Applications.Academic Press, San Diego, CA. (2014).
Pular para...
Vídeos desta coleção:

Now Playing
Lei dos gases ideais
General Chemistry
79.4K Visualizações

Vidraria de laboratório comuns e seus usos
General Chemistry
658.9K Visualizações

Soluções e Concentrações
General Chemistry
275.3K Visualizações

Determinando a densidade de um sólido e um líquido
General Chemistry
556.9K Visualizações

Determinação de composição percentual em massa em uma solução aquosa
General Chemistry
383.8K Visualizações

Determinação da Fórmula Empírica
General Chemistry
183.8K Visualizações

Determinação das Regras de Solubilidade de Compostos Iônicos
General Chemistry
141.6K Visualizações

Usando um medidor de pH
General Chemistry
346.9K Visualizações

Introdução à Titulação
General Chemistry
425.7K Visualizações

Determinação espectrofotométrica de uma constante de equilíbrio
General Chemistry
158.8K Visualizações

Princípio de Le Châtelier
General Chemistry
265.8K Visualizações

Depressão do ponto de congelamento para determinar um composto desconhecido
General Chemistry
160.8K Visualizações

Determinação das Leis de Velocidade e da Ordem de Reação
General Chemistry
196.4K Visualizações

Uso de Calorimetria de Varredura Diferencial para Medir Mudanças na Entalpia
General Chemistry
44.8K Visualizações

Complexos de Química de Coordenação
General Chemistry
91.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados