Legge dei gas perfetti
Panoramica
Fonte: Laboratorio del Dr. Andreas Züttel - Laboratori federali svizzeri per la scienza e la tecnologia dei materiali
La legge dei gas ideali descrive il comportamento dei gas più comuni in condizioni quasi ambientali e la tendenza di tutta la materia chimica nel limite diluito. È una relazione fondamentale tra tre variabili di sistema macroscopiche misurabili (pressione, temperatura e volume) e il numero di molecole di gas nel sistema, ed è quindi un collegamento essenziale tra l'universo microscopico e quello macroscopico.
La storia della legge del gas ideale risale alla metà del 17 ° secolo quando la relazione trala pressione e il volume dell'aria è risultata inversamente proporzionale, un'espressione confermata da Robert Boyle e che ora chiamiamo legge di Boyle (Equazione 1).
P  V-1 (Equazione 1)
V-1 (Equazione 1)
Il lavoro inedito di Jacques Charles nel 1780, che fu esteso a numerosi gas e vapori da Joseph Louis Gay-Lussac e riportato nel 1802, stabilì la relazione direttamente proporzionale tra la temperatura assoluta e il volume di un gas. Questa relazione è chiamata legge di Charles (Equazione 2).
V  T (Equazione 2)
T (Equazione 2)
Guillaume Amontons è in genere accreditato di aver scoperto per la prima volta la relazione tra la temperatura e la pressione dell'aria all'interno di un volume fisso all'inizio del 18° secolo. Questa legge fu estesa anche a numerosi altri gas da Joseph Louis Gay-Lussac all'inizio del 19° secolo ed è quindi indicata come legge di Amontons o legge di Gay-Lussac, dichiarata come mostrato nell'equazione 3.
P  T (Equazione 3)
T (Equazione 3)
Insieme, queste tre relazioni possono essere combinate per dare la relazione nell'equazione 4.
V  T (Equazione 4)
T (Equazione 4)
Infine, nel 1811, fu proposto da Amedeo Avogadro che due gas qualsiasi, tenuti nello stesso volume e alla stessa temperatura e pressione, contenevano lo stesso numero di molecole. Ciò ha portato alla conclusione che tutti i gas possono essere descritti da una costante comune, la costante di gas ideale R, che è indipendente dalla natura del gas. Questa è nota come legge del gas ideale (Equazione 5). 1,2
Fotovoltaico  T (Equazione 5)
T (Equazione 5)
Principi
La legge del gas ideale, e quindi la sua costante caratteristica R, può anche essere eloquentemente derivata dalla teoria dei principi primi in numerosi modi, dove le ipotesi importanti semplificanti sono che le molecole non hanno volume intrinseco e non interagiscono. Queste ipotesi sono valide nel limite della materia diluita, dove il volume di spazio vuoto occupato da ciascuna molecola(ad esempio ~10-23 L in condizioni ambientali) è molto più grande della molecola stessa (~10-26 L), e dove le interazioni sono improbabili. Può quindi essere facilmente dimostrato in diversi modi utilizzando le comuni apparecchiature di laboratorio a temperatura ambiente e può essere misurato con precisione utilizzando una varietà di gas a pressioni fino a 10 bar (Figura 1). Tuttavia, la legge del gas ideale non può spiegare con precisione le proprietà dei gas più densi in condizioni quasi ambientali(ad esempio,propano) o per condensazione, fenomeni che sorgono come risultato di interazioni intermolecolari. Per questo motivo, numerose equazioni di stato più dettagliate sono succedute alla legge del gas ideale negli anni successivi alla sua scoperta, tipicamente riducendo alla legge del gas ideale nel limite della materia diluita. 1,2
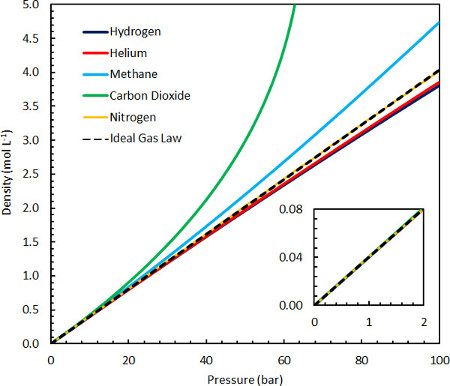
Figura 1. Confronto della densità ideale della legge del gas con vari altri gas comuni a 25 °C e tra 0-100 bar.
In questo tutorial, misureremo attentamente la densità dell'idrogeno gassoso a pressioni e temperature maggiori all'interno di un volume fisso pesando un campione solido sospeso di volume noto: un blocco di alluminio lavorato con precisione. La variazione di peso del campione è direttamente correlata alla variazione della densità del fluido, in cui galleggia, secondo il principio di Archimede. Dimostreremo anche le carenze dell'uso di un gas meno ideale (come l'anidride carbonica) ad alte pressioni. Infine, dimostreremo visivamente e confermeremo qualitativamente la legge del gas ideale eseguendo un semplice esperimento da banco in cui viene misurata la variazione di volume del sistema dovuta al rilascio di idrogeno da parte di un materiale di stoccaggio dell'idrogeno. Usando uno qualsiasi di questi esperimenti, possiamo determinare la costante universale che descrive la relazione tra pressione, temperatura e volume per una data quantità di gas – la costante di gas ideale, R.
Procedura
1. Misurazione del volume del campione
- Pulire accuratamente il campione e asciugarlo.
- Riempire un cilindro graduato ad alta risoluzione con acqua distillata sufficiente per coprire il campione. Prendere nota del volume iniziale
- Lascia cadere il campione nell'acqua e nota il cambiamento di volume. Questo è il volume del campione, V.
- Rimuovere il campione e asciugarlo. Nota: in alternativa, misurare la lunghezza o le lunghezze laterali del campione e calcolarne il volume utilizzando la geometria.
2. Carica il campione nella bilancia
- Appendere il campione nella bilancia a sospensione magnetica.
- Installare la camera di pressione/temperatura attorno al campione.
- Evacuare l'ambiente campione e riempire con idrogeno gassoso, a 1 bar.
- Misurare il peso del campione a 1 bar e temperatura ambiente, w00.
3. Misurare il peso del campione in funzione della pressione a temperatura ambiente
- Aumentare o diminuire la pressione nell'ambiente campione a Pi0.
- Consentire all'ambiente campione di equilibrarsi.
- Misurare il peso del campione, wi0.
- Ripeti 3.1-3.3 numerose volte.
4. Misurare il peso del campione in funzione della pressione a varie temperature
- Impostare la temperatura su Tj e lasciarla equilibrare.
- Impostare la pressione dell'idrogeno gassoso su 1 bar.
- Misurare il peso del campione a 1 bar e Tj, w0j.
- Aumentare o diminuire la pressione a Pij e permettergli di equilibrarsi.
- Misurare il peso del campione, wij.
- Ripeti 4,4-4,5 numerose volte.
- Ripetere 4.1-4.6 come desiderato.
5. Calcola la costante del gas ideale
- Tabulare i valori misurati {Tj, Pije wij} dove P0j è sempre 1 bar e T0 è la temperatura ambiente misurata.
- Calcola e tabula le differenze Δwij e ΔPij ad ogni temperatura Tj usando l'equazione 6 e l'equazione 7.
Δwij = wij - w0j (Equazione 6)
Δwij = Pij - P0j = Pij - 1 bar (Equazione 7) - Calcolare Rij per ogni misurazione e mediare su tutti i valori per determinare la costante di gas ideale, R. In alternativa, tracciare il prodotto di ΔPij e V in funzione del prodotto di Δwij (diviso per il peso molecolare, MW) e Tjed eseguire un'analisi di regressione lineare per determinare la pendenza, R. (Equazioni 8 e 9) Per l'idrogeno, MW = 2,016 g/mol.
ΔP V = Δ nRT (Equazione 8)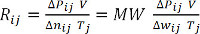 (Equazione 9)
(Equazione 9)
Risultati
La legge del gas ideale è una valida descrizione delle effettive proprietà del gas di numerosi gas comuni in condizioni vicine all'ambiente(figura 1 inset) ed è quindi utile nel contesto di molte applicazioni. I limiti della legge del gas ideale nel descrivere i sistemi in condizioni di alte pressioni o basse temperature possono essere spiegati dalla crescente importanza delle interazioni molecolari e/o dalla dimensione finita delle molecole di gas che contribuiscono alle proprietà del sistema. Pertanto, i gas con interazioni intermolecolari forti e attraenti (derivanti da interazioni dipolo-dipolo, tra cui legame idrogeno, interazioni ione-dipolo o interazioni di van der Waals) mostreranno densità più elevate rispetto al gas ideale. Tutti i gas avranno anche una componente repulsiva ad alta densità a causa del fatto che più di una molecola non può occupare la stessa posizione, prestando una diminuzione della densità rispetto al gas ideale. Gas come l'idrogeno e l'elio mostrano un contributo più significativo dalla forza repulsiva a causa delle dimensioni molecolari finite, e quindi hanno densità leggermente inferiori ad alte pressioni. Il metano e l'anidride carbonica mostrano contributi molto più significativi alle loro proprietà da interazioni attraenti, conferendo loro densità più elevate rispetto al gas ideale fino a pressioni molto elevate, dove domina il termine repulsivo (a molto più alto di 100 bar a 25 ° C).

Figura 2. Isoterma di assorbimento dell'adsorbimento di equilibrio di CO2 su un'area superficiale elevata, carbonio iperattivato MSC-30, a 25 °C.
Applicazione e Riepilogo
La legge del gas ideale è un'equazione così fondamentale delle scienze chimiche che ha una pletora di usi sia nelle attività quotidiane di laboratorio che nei calcoli e nella modellazione di sistemi anche altamente complessi, almeno alla prima approssimazione. La sua applicabilità è limitata solo dalle approssimazioni inerenti alla legge stessa; a pressioni e temperature vicine all'ambiente, dove la legge del gas ideale è ben valida per molti gas comuni, è ampiamente utilizzata nell'interpretazione di sistemi e processi basati su gas. Due esempi di dispositivi che funzionano secondo principi, che possono essere riconciliati utilizzando la legge del gas ideale, sono il termometro a gas e il motore Stirling.
Un'applicazione specifica è nella misurazione della quantità di adsorbimento di gas (fisisorbimento) sulla superficie di un materiale solido. L'adsorbimento è il fenomeno fisico per cui le molecole di gas lasciano la fase gassosa ed entrano in una fase densificata vicino alla superficie di un solido (o forse di un liquido) a causa di interazioni intermolecolari attraenti (forze di dispersione) tra il solido e il gas. Il ruolo dell'adsorbimento può essere trascurato per molti materiali sfusi (come vetro e acciaio inossidabile) in condizioni ambientali, ma diventa molto importante per materiali porosi con un'ampia superficie accessibile, specialmente a basse temperature. 3 Il metodo volumetrico di Sieverts e il metodo gravimetrico di quantificazione dell'adsorbimento fisico si basano sulla conoscenza dell'equazione di stato del gas nel sistema. A basse pressioni e temperatura ambiente, la legge del gas ideale è valida per molti gas e può essere utilizzata per determinare con precisione la quantità adsorbita di gas in modo simile a quanto descritto nel protocollo per determinare R sopra. Ad esempio, nelle misure gravimetriche della galleggiabilità di un assorbente ad alta superficie in condizioni in cui la legge del gas ideale è effettivamente valida, la differenza tra il Δweffettivo misurato e l'ideale Δw calcolato utilizzando l'equazione ideale di stato può essere attribuita alla variazione di peso della fase adsorbita. (Equazione 10) Le isoterme di adsorbimento dei gas di equilibrio possono quindi essere misurate tabulando questa deviazione, Δwads, in funzione della pressione a temperatura fissa (vedi Figura 2), una procedura standard nella caratterizzazione dei materiali porosi.
Δwads = Δwactual - Δwideal (Equazione 10)
Vai a...
Video da questa raccolta:

Now Playing
Legge dei gas perfetti
General Chemistry
79.5K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
659.5K Visualizzazioni

Soluzioni e concentrazioni
General Chemistry
275.6K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
557.1K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
383.9K Visualizzazioni

Determinazione della formula empirica (minima)
General Chemistry
183.9K Visualizzazioni

Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.6K Visualizzazioni

Uso del pH-metro
General Chemistry
347.0K Visualizzazioni

Introduzione alla titolazione
General Chemistry
425.8K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.9K Visualizzazioni

Principio di Le Châtelier
General Chemistry
265.9K Visualizzazioni

Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
160.9K Visualizzazioni

Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
196.5K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.8K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.8K Visualizzazioni