É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Hellgrammite como um biomonitor não convencional para avaliação de águas superficiais e saúde ambiental
Neste Artigo
Resumo
Este protocolo descreve o uso de biomarcadores para a detecção precoce de impactos deletérios em ecossistemas aquáticos. Os biomarcadores estão intimamente relacionados aos traços sentinela e suas alterações auxiliam na detecção de danos de alerta precoce.
Resumo
As larvas de moscas dobsonflies do gênero Corydalus, comumente conhecidas como Hellgrammites, são caracterizadas por seu tamanho notável, extensa gama de ocorrência e longo período de imaturidade, que pode durar até um ano. Hellgrammites são claramente conhecidos por exibir sensibilidade à poluição e aos impactos da estrutura do habitat. Dadas essas características únicas, o uso de larvas de Corydalus texanus é altamente adequado como agentes de biomonitoramento confiáveis para avaliar a integridade ecológica dos ecossistemas aquáticos. Este protocolo tem como objetivo fornecer as ferramentas necessárias para a avaliação de C. texanus e demonstrar sua eficácia por meio de um estudo de caso. Os resultados da pesquisa têm implicações práticas, indicando que as larvas de C. texanus exibem respostas de alerta precoce à poluição da mineração, bioacumulando grandes quantidades de metais pesados como Zn, Fe e Al. A presença ou ausência de populações de C. texanus pode servir como um indicador útil para identificar possíveis problemas relacionados à saúde do ecossistema. A abordagem não convencional mostrou alertas precoces de poluição em locais afetados pela mineração, destacando a necessidade de ações oportunas para proteger o meio ambiente. Dadas suas características únicas, o uso de larvas de C. texanus é altamente sugerido como um bioindicador não convencional confiável.
Introdução
Hellgramites são larvas de insetos da ordem Megaloptera (Latreille, 1802), denominadas dobsonflies ou fishflies em sua fase adulta. Uma baixa diversidade, mas generalizada, caracteriza este grupo de larvas de insetos predadores de topo de ecossistemas aquáticos1. As espécies de Hellgramite ocorrem em regiões biogeográficas bem definidas; portanto, é relativamente fácil identificar espécies sem um alto conhecimento taxonômico. Notavelmente, as larvas de Corydalidae possuem as espécies mais proeminentes da ordem Megaloptera (20-90 mm de comprimento do corpo)2, tornando o hellgramite visível a olho nu.
Hellgrammites desempenham um papel crucial nos ecossistemas aquáticos como predadores, com uma presença poderosa devido a grandes mastigações que denotam sua impressionante forma predatória. Um corpo achatado dorsoventralmente também se junta a 7-8 pares de brânquias de filamento ao longo do corpo, e uma cápsula da cabeça com seis stemmata de cada lado torna os hellgrammites organismos fascinantes para entomologistas e fãs3. Os adultos de Corydalidae surpreendem e criam uma imagem de impressão para as pessoas devido ao seu tamanho proeminente; no entanto, eles são totalmente inofensivos. Vale ressaltar que os hellgrammites têm a capacidade de persistir em ambientes aquáticos em seu estágio larval por um período significativo.
As características fenotípicas das hellgrammites permitem uma chance particular de destacar seu papel nos ecossistemas aquáticos; No entanto, seu potencial indicador é a característica mais desejada pelos ecologistas aquáticos. O vasto conhecimento de seu potencial bioindicador é destacado nos ecossistemas aquáticos, pois sua ocorrência está relacionada às boas condições de saúde em seus habitats devido à sua intolerância à poluição orgânica nas águas superficiais 4,5,6,7,8.
A maioria dos Corydalidae megalopterans vive em águas correntes de alta velocidade como corredeiras e substratos predominados por paralelepípedos e seixos, mas hellgrammites também ocorrem em riachos de baixo gradiente com protuberâncias e substratos de areia, bem como em habitats lênticos, como lagos 3,9,10. Sua ampla gama de ocorrência reflete as características críticas de um predador de topo e sua capacidade de colonizar vários habitats visados por suas estratégias eficazes de história de vida11. Hellgramites ligou suas características à dinâmica dos ecossistemas aquáticos; assim, estratégias como a adaptação à respiração aérea pelos espiráculos (além de seus tufos ventrais de brânquias traqueais) são próprias das estratégias de Corydalidae10.
Hellgrammites habitam ecossistemas específicos e exibem respostas rápidas a desvios dos padrões estabelecidos, servindo assim como um sistema de alerta precoce7. As reações desses organismos selvagens podem ser empregadas como uma ferramenta valiosa para avaliar o impacto da poluição nos ecossistemas aquáticos, particularmente no caso de misturas de poluentes não visados. Alguns efeitos deletérios sobre os organismos vivos foram reconhecidos nos ecossistemas devido à toxicidade individual dos produtos químicos, mas o efeito das misturas de poluentes deve ser identificado. As respostas de alerta precoce dos hellgrammites podem permitir identificar efeitos deletérios, dando uma referência aos impactos de uma mistura de poluentes ou mesmo quando os efeitos individuais dos poluentes reconhecem a Concentração de Nenhum Efeito Observável (NOEC)12.
Vários organismos modelo foram usados para testes experimentais agudos e crônicos; no entanto, eles são cultivados e mantidos sob condições controladas13. Condições controladas os tornam incapazes de identificar os efeitos não-alvo de vários poluentes aos quais estão expostos. Além disso, a NOEC é frequentemente reconhecida devido à complexidade da mistura do poluente. Por essa razão, nas últimas décadas, espécies nativas não-modelo com efeitos não-alvo foram reconhecidas para sistemas de triagem, que são essenciais para a realização de pesquisas ecotoxicológicas14. Consequentemente, os hellgrammites parecem capazes de avaliar os efeitos deletérios da poluição nos ecossistemas aquáticos. Características como biologia, genética e fisiologia, entre outras, tornam os organismos não modelo adequados para avaliação de impacto em ecossistemas14.
Este protocolo visa estabelecer uma nova ferramenta de biomonitoramento usando um organismo não modelo que possa detectar sinais de alerta precoce em resposta a misturas de poluição não-alvo. Para alcançar os melhores resultados, as características exibidas pelas larvas da espécie modelo, C. texanus, foram amplamente consideradas e integradas à análise15.
Protocolo
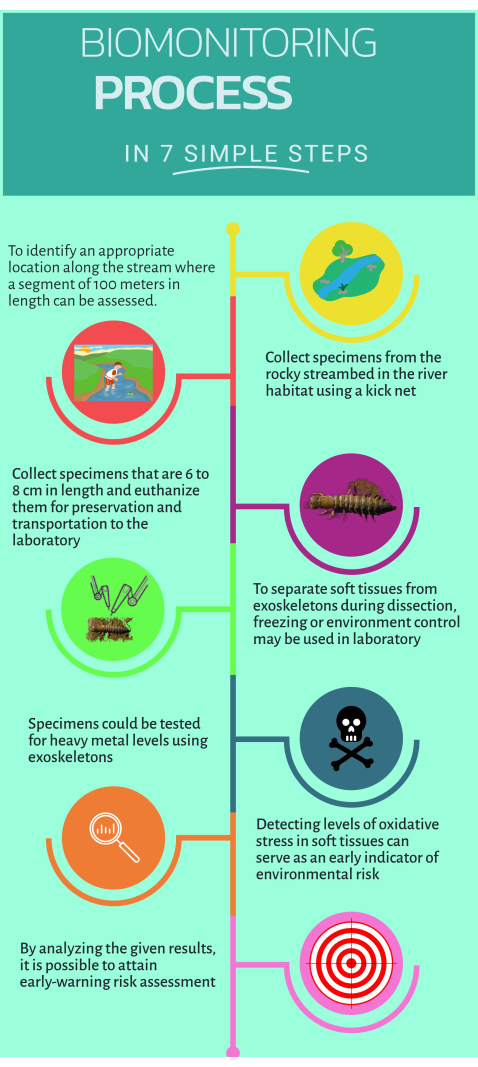
Figura 1: Guia passo a passo rápido sobre como usar o biomonitor não convencional Corydalus texanus para implementação em ecossistemas aquáticos. Clique aqui para ver uma versão maior desta figura.
1. Trabalho de campo
- Identifique os locais de estudo localizados a montante e a jusante da fonte de poluição onde são reconhecidos impactos suspeitos ou evidentes (ou seja, emissões pontuais ou difusas).
NOTA: O presente protocolo incluiu 15 locais de estudo em quatro rios principais: 1) Rio Extoraz (locais PB, EZ, RQ, BC); 2) Rio Escanela-Jalpan (ES, EN, AH, JL, PI, PA); 3) Rio Ayutla (AY); e 4) Rio Santa María (SM, AT). - Pesquise e localize pelo menos um local de referência (um local sob menor ou ausência de impactos) e defina-o como um local de estudo.
NOTA: Para os locais de estudo atuais, BC, ES, SM, AY e AT foram considerados como locais de referência. - Reconhecer certos atributos de habitats que aumentam a probabilidade de encontrar indivíduos de C. texanus. Isso inclui substrato de cascalho, habitats rochosos com gradientes mais íngremes, fluxos de alta velocidade, águas bem oxigenadas, alta densidade de dossel e habitats em terras altas e baixas.
- Incluir uma seção de 100 m do riacho para identificar habitats apropriados para biomonitoramento16.
- Entre no riacho para coletar amostras.
- Amostrar pelo menos seis indivíduos de C. texanus em habitats como corredeiras, seixos, águas límpidas e detritos utilizando uma rede de pontapé com malhagem de 500 μm.
- Remova as pedras na direção do fluxo de água e transfira as larvas para a rede.
- Manuseie a rede de chute com larvas amostradas e transfira-as para garrafas designadas para alojamento temporário. Manuseie a rede com cuidado e dobre as bordas para o interior para evitar qualquer perda de larvas.
- Medir a largura da cabeça das larvas amostradas utilizando um paquímetro para identificar os instares IX a XI (no intervalo de 6 mm a 10 mm).
- Purgue as larvas mergulhando-as em uma garrafa contendo água do riacho por 30 min.
- Coloque as amostras em garrafas plásticas com rotulagem clara e, em seguida, eutanasia-as por imersão em nitrogênio líquido (-75 °C) em um tanque criogênico.
- Transporte e armazene as amostras de forma segura a -45 °C no ultracongelador do laboratório.
- Usando um frasco de polietileno, pegue uma amostra de água de 200 mL, adicione 1 mL de ácido nítrico e armazene a amostra a 4 ° C para posterior quantificação de metais pesados em laboratório.
2. Dissecção das larvas amostradas e separação dos tecidos
- Coloque a bandeja de dissecção de plástico no gelo e espere até atingir 4 °C, usando um termômetro para verificar.
- Pegue amostras do ultrafreezer e coloque-as na bandeja de dissecação para começar a dissecar.
- Selecione os tecidos-alvo: músculo, ramos, tubo neural e exoesqueleto.
- Use uma faca de cerâmica para remover a cabeça e separe os tecidos com cuidado. Abra o corpo longitudinalmente e remova as brânquias de cada lado.
- Separe os exoesqueletos usando uma faca de cerâmica menor e limpe o excesso de tecido. Coloque os exoesqueletos em um forno e seque-os a 80 °C por 48 h.
- Após o tempo, armazene exoesqueletos secos para análise posterior.
- Mantenha a limpeza dos tecidos moles em condições frias para análise posterior por microensaios.
- Use uma pequena faca de cerâmica para extrair tecidos moles da gordura. Separe e agrupe cada tecido-alvo de indivíduos do mesmo ponto de amostragem.
- Armazene cada tipo de tecido em um microtubo de 2 mL, mantendo as condições de frio durante todo o processo.
- Para preparar cada tecido-alvo, pesar 100 mg do tecido e adicionar 1 mL de solução de PBS com pH de 7,4. Use um rasgo de tecido com uma mão para homogeneizar cada tecido. Normalmente, os tecidos moles requerem três ciclos de 10 s cada.
- Centrifugue a amostra a 1.000 x g por 5 min a 4 °C. Transfira o sobrenadante para um microtubo de 1 mL.
- Realize microensaios de biomarcadores.
3. Quantificação de metais pesados
- Pesar 250 mg de exoesqueletos secos de, pelo menos, seis espécimes na fase de desenvolvimento especificada, utilizando uma balança analítica.
- Moa exoesqueletos em um pilão de vidro até que fiquem finamente pulverizados. Adicione 250 mL de ácido nítrico ultrapuro aos recipientes de reação do pó.
- Para digerir as amostras, transfira-as para um micro-ondas de digestão a 180 °C por 30-45 min.
NOTA: Use o recipiente seguro para micro-ondas certo para a marca de micro-ondas para aquecer as amostras com segurança e eficácia. O tempo de digestão para amostras de tecido varia de acordo com a marca do micro-ondas, levando de 30 a 45 minutos. Algumas marcas oferecem métodos padronizados. - Execute um método de digestão por microondas para amostras de água seguindo o método EPA3015A, usando 45 mL da amostra de água e adicionando 5 mL de ácido nítrico.
- Meça metais pesados e metalóides em amostras digeridas (água e tecidos) usando espectroscopia de emissão óptica com plasma indutivamente acoplado (ICP-OES), incluindo Hg,, Pb, Zn, Fe, Cr, Cd, Mn, Ba e As.
NOTA: Use argônio grau 5 e soluções padrão de cada metal e metalóide para construir uma curva de calibração.
4. Microensaios para avaliação do estresse oxidativo e biomarcadores
- Preparação de reagentes
- Misture 6 g de NaH2PO4 com 1000 mL de água ultrapura para fazer um tampão fosfato monobásico de 50 mM. Conservar num balão a 2-8 °C indefinidamente.
- Para fazer 8,1% de SDS, dissolva 450 mg de dodecil sulfato de sódio (SDS) em 5 mL de água ultrapura. Prepare imediatamente antes de usar.
- Diluir 2 mL de ácido tricloroetanóico (TCA) em 8 mL de água ultrapura (preparar reagente fresco quando necessário).
- Dissolva 100 mg de tetrabutilamônio (TBA) em 10 mL de água ultrapura (prepare um novo reagente quando necessário).
- Para fazer 50 mM PBS pH 7,8, dissolva 97 mg de Na2HPO4 e 59 mg de NaH2PO4 em 10 mL de água ultrapura. Em seguida, ajuste o pH para 7,8 usando NaOH para aumentar ou HCl para diminuir.
- Fazer uma solução de catalase bovina a 200 μg/ml dissolvendo 8 mg em 40 μl de água ultrapura (preparar reagente fresco quando necessário).
- Para fazer uma solução de 50 mM de TRIS/5 mM de ácido etilenodiaminotetracético (EDTA), adicione 6,05 g de tris (hidroximetil)aminometano (TRIS) e 0,073 g de EDTA a 45 mL de água ultrapura. Ajustar o pH para 7,6 com HCl e conservar a 4 °C até à utilização.
- Para glutationa 0,1 M reduzida (GSH) (para 45 amostras duplicadas), pesar 0,0184 g de GSH e dissolvê-lo em 600 μL de HCl 10 mM.
- Para preparar 10 mM de HCl, adicione 0,5 μL de HCl concentrado a 599,5 μL de água ultrapura.
- Adicione 28,5 μL de glutationa redutase a 1,4 mL de 0,1 M TRIS/HCl 0,5 mM EDTA pH 8,0.
- Misture 1,211 g de TRIS e 0,0146 g de EDTA com 90 mL de água ultrapura para preparar uma solução de TRIS/HCl 0,1 M e EDTA 0,5 mM em pH 8,0. Adicione HCl para ajustar o pH, se necessário. A solução pode ser conservada indefinidamente a 2-8 °C.
- Pese 0,075 g de NADPH e adicione-o a 2,25 mL de NaHCO a 1%3 1 mM EDTA.
- Misture 1 g de NaHCO3 e 0,0282 g de EDTA em 100 mL de água ultrapura para preparar uma solução de NaHCO3 a 1% e EDTA a 1 mM. Conservar a solução a 4-8 °C durante um tempo indeterminado.
- Misture 2 μL de hidroperóxido de t-butila com 2 mL de água ultrapura para fazer uma solução de 7 mM. Misture imediatamente antes de usar.
- Misture 1 g de albumina de soro bovino (BSA) com 1 mL de água ultrapura para criar uma solução estoque de 1 μg / μL.
- Substâncias reativas ao ácido tiobarbitúrico (TBARS) (peroxidação lipídica, LPO)17
- Adicione 5 μL de sobrenadante de tecido a um microtubo de 1 mL. Adicionar 45 μL de PBS a 50 mM (solução fresca e conservada).
- Adicione 12,5 μL de SDS a 8,1% (recém-preparado). Adicione 93,5 μL de 20% de TCA pH 3,5 (recém-preparado).
- Adicione 93,5 μL de 1% de TBA (recém-preparado). Complete o volume adicionando 50,5 μL de água ultrapura. Feche a tampa do tubo e bata por 30 s.
- Perfure a tampa do microtubo com uma agulha e incube em água fervente por 10 min.
- Resfrie o tubo à temperatura ambiente (RT) e centrifugue-o a 1000 x g por 10 min.
- Adicione 150 μL de sobrenadante a um poço em uma microplaca de 96 poços e meça a absorbância a 530 nm usando um espectrofotômetro de microplacas.
- Para quantificar os peróxidos lipídicos, crie uma curva de calibração TBARS de 8 pontos (0-160 μM) usando malondialdeído bis (dimetilacetal) conforme descrito na Tabela 1. Ajuste a curva de malondialdeído (MDA) de acordo com o tipo de tecido ou nível de dano suspeito.
- Expresse os resultados como proteína nmol MDA eq·mg−1 .
- Microensaio enzimático antioxidante (SOD) da superóxido dismutase18
- Use uma placa de 96 poços. Adicione 147 μL de 1 M TRIS/5 mM HCl EDTA pH 8 em dois poços como brancos. Adicione 144 μL de 1 M TRIS/5 mM HCl EDTA pH 8 em outros poços por duplicata.
- Retirar 3 μL do sobrenadante e adicioná-los aos alvéolos de amostra. Misture delicadamente o conteúdo no prato várias vezes.
- Adicione 3 μL de ácido pirogálico 10 mM a cada poço dentro de 30 s. Misture delicadamente imediatamente.
- Medir a absorvância a T0 (tempo = 0 s) e T10 (tempo = 10 s), a 420 nm e 25 °C.
- Determinar a SOD calculando a percentagem de inibição do pirogalol na amostra utilizando a seguinte equação:

Onde
x% = percentagem de oxidação do pirogalol pela SOD na amostra; portanto, a oxidação do pirogalol é igual a 100 - x%
NOTA: O cálculo da atividade da SOD considerando 1 UI é o volume que inibe 50% da oxidação do pirogalol conforme descrito abaixo:

Onde
y = volume da amostra em mililitro (inibe 50% do pirogalão)
50% = porcentagem de inibição de pirogalol é igual a 1U de SOD
0,003 = volume em mililitros da amostra
100 - x% = inibição do pirogalol em percentagem pela amostra - Finalmente, determine a atividade do SOD com a equação:

SOD = atividade da SOD em unidades internacionais por micrograma de proteína
Y = volume da amostra que inibe 50% do pirogalol
100 = fator de conversão de decilitro para mililitro.
proteína = concentração de proteína obtida a partir da quantificação de Bradford é expressa em microgramas por mililitro; é necessário dividir por 10 para converter em gramas por decilitro
- Microensaio da enzima antioxidante catalase (CAT)19,20
- Use uma microplaca de 96 poços. Adicionar 20 μL de sobrenadante de amostra aos alvéolos (por duplicado).
- Adicionar 20 μL de catalase fresca (200 μg/ml) nos alvéolos como padrão (por duplicado). Adicione 100 μL de PBS 50 mM pH 7,8 à amostra e aos poços em branco.
- Adicione 100 μL de 90 mM (30%) H2O2 nos poços para iniciar a reação. Depois de adicionar H2O2, leia absorbância a cada 15 s por 2.5 min a 240 nm.
- Calcule a atividade usando a equação:


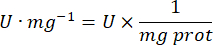

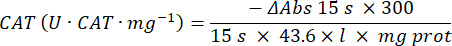
- Microensaio da enzima glutationa peroxidase (GPx)21
- Use uma microplaca de 96 poços.
- Misture 240 μL de solução de GSH 0,1 M, 1.200 μL de solução de GSH-Rd 10 U/mL e 1.200 μL de NADPH 4 mM. Mantenha a solução no gelo.
- Adicione aos alvéolos 100 μL de 50 mM TRIS/HCl 5 mM EDTA pH 7,6. Adicionar 1 μL de amostra sobrenadante em duplicado. Bata na microplaca e misture delicadamente.
- Adicionar 50 μl da solução de mistura (passo 4.5.2) e misturar suavemente.
- Adicione 20 μL da solução de hidroperóxido de t-butila 7 mM nos alvéolos para iniciar a reação (leva aproximadamente 15 s para iniciar a reação em 16 amostras duplicadas). Misture rapidamente a microplaca.
- Monitore a absorbância a cada intervalo de 1 minuto por 5 minutos a 25 ° C a 340 nm.
- Calcule a atividade GPx com a equação:
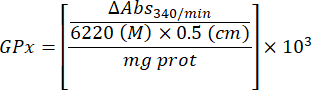
Onde
GPx = atividade em milimolares por minuto por micrograma de proteína
ΔAbs340/min= Absorbância média em delta
103 = conversão molar para milimolar
- mg prot = concentração de proteínas da determinação de Bradford, expressa em microgramas por microlitro
- Quantificação de proteínas pela análise de Bradford22
- Efectuar uma curva padrão a partir de soluções de albumina de soro bovino (BSA), ajustada a partir de 1 μg/μL de solução-mãe, conforme indicado no quadro 2.
- Use uma microplaca de 96 poços. Adicione 190 μL de reagente de Bradford na amostra e nos poços padrão.
- Adicione 10 μL de BSA em poços padrão por duplicata. Adicionar 10 μL de sobrenadante aos alvéolos de amostra por duplicado.
- Misture suavemente com a ponta da pipeta.
- Leia a absorbância a 595 nm. Quantificar a concentração de proteínas com a curva padrão.
Resultados
Os resultados do estudo revelam que os metais pesados, especificamente alumínio (Al), ferro (Fe) e zinco (Zn), têm um impacto prejudicial no meio ambiente, conforme evidenciado pela Figura 2. A detecção de altos níveis de metais pesados em amostras de tecido e água coletadas de todos os locais levou a um resultado desfavorável. Foram detectados outliers, com um Fator de Bioacumulação (BAF) de 600, notadamente em áreas intensivas em mineração, com...
Discussão
Embora o uso de C. texanus seja ideal para avaliação, é necessário considerar vários aspectos de seu uso e coleta. Os locais de estudo escolhidos são desafiadores, devido a vários fatores, como condições climáticas desfavoráveis, inacessibilidade geográfica, altos níveis de aridez ou protocolos de segurança insuficientes em regiões selecionadas. As restrições e limitações declaradas muitas vezes podem apresentar desafios ao conduzir o trabalho de campo. Ao ava...
Divulgações
Os autores não revelaram conflitos de interesse presentes em seus trabalhos.
Agradecimentos
Os autores gostariam de expressar sua sincera gratidão ao CONAHCyT por fornecer a bolsa FONINS P 1931, que facilitou muito seus esforços de pesquisa. Eles também agradecem à Secretaria de Investigação e Pós-Graduação do Instituto Politécnico Nacional pelo inestimável apoio fornecido por meio da bolsa do projeto SIP (20200577). Além disso, o primeiro autor deseja reconhecer a generosa bolsa de pós-graduação concedida pelo CONAHCyT, que permitiu à equipe realizar viagens de campo e coletar dados essenciais. Por fim, os autores gostariam de expressar seu agradecimento pela inestimável ajuda de María Teresa García Camacho no laboratório, sem a qual este projeto não teria sido possível.
Materiais
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
Referências
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados