Method Article
Tomografia de Coerência Óptica Guiada por Imagem para Avaliar Alterações Estruturais em Retinas de Roedores
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O protocolo aqui apresentado detalha os procedimentos de coleta e análise de dados para tomografia de coerência óptica (OCT) guiada por imagem e demonstra sua aplicação em múltiplos modelos de roedores de doenças oculares.
Resumo
Doenças oculares, como degeneração macular relacionada à idade, glaucoma, retinite pigmentosa e uveíte, são sempre acompanhadas por alterações estruturais da retina. Essas doenças que afetam o fundo sempre exibem anormalidades típicas em certos tipos de células da retina, incluindo células fotorreceptoras, células ganglionares da retina, células nos vasos sanguíneos da retina e células nas células vasculares da coroide. Técnicas de imagem não invasivas, altamente eficientes e adaptáveis são necessárias tanto para a prática clínica quanto para a pesquisa básica. A tomografia de coerência óptica (OCT) guiada por imagem atende a esses requisitos porque combina fotografia de fundo de olho e OCT de alta resolução, fornecendo um diagnóstico preciso de pequenas lesões, bem como alterações importantes na arquitetura da retina. Este estudo detalha os procedimentos de coleta e análise de dados para OCT guiada por imagem e demonstra sua aplicação em modelos de roedores de neovascularização de coróide (CNV), esmagamento do nervo óptico (ONC), degeneração retiniana induzida por luz e uveíte autoimune experimental (EAU). Essa técnica ajuda os pesquisadores no campo ocular a identificar alterações estruturais da retina de roedores de maneira conveniente, confiável e tratável.
Introdução
As doenças oculares que acometem o fundo de olho sempre apresentam anormalidades típicas em certos tipos de células da retina, como células fotorreceptoras, células ganglionares da retina, células dos vasos sanguíneos da retina e células dos vasos sanguíneos da coroide, que podem influenciar posteriormente a acuidade visual dos pacientes1. Para evitar deficiência visual irreversível, diagnósticos oportunos e tratamentos adequados são necessários1. A tomografia de coerência óptica (OCT) tem sido amplamente utilizada na clínica para avaliar uma série de doenças oculares, incluindo degeneração macular relacionada à idade, retinite pigmentosa, glaucoma, uveíte e descolamento de retina, entre outras 2,3,4. Esse tipo de técnica de imagem não invasiva, altamente eficiente e adaptável também é necessária para a avaliação oportuna das condições da doença em animais experimentais 5,6,7,8,9,10.
A tomografia de coerência óptica guiada por imagem (OCT) usa interferometria para produzir imagens transversais de retinas de animais com resolução longitudinal de 1,8 μm e resolução axial de 2 μm. Apresenta pelo menos três vantagens na investigação de alterações arquiteturais da retina2,3,4,5,6,7,8,9,10. Primeiro, é uma técnica não invasiva que permite aos pesquisadores acompanhar dinamicamente a localização de interesse na retina do mesmo animal 5,6,7,8,9,10. Em segundo lugar, essa característica reduz substancialmente o tamanho da amostra para cada experimento3. Enquanto isso, economiza tempo e esforço consideráveis em projetos de pesquisa 2,3,4,5,6,7,8,9,10. Em terceiro lugar, a OCT guiada por imagem adquire imagens coloridas do fundo do olho enquanto captura imagens da OCT, fornecendo resultados precisos e confiáveis para os usuários.
Este manuscrito descreve os procedimentos de coleta de imagens e análise de dados para OCT guiada por imagem e elabora sua aplicação em modelos de camundongos e ratos de neovascularização de coróide (CNV)11,12, esmagamento do nervo óptico (ONC)13,14,15,16, degeneração retiniana induzida porluz17,18,19,20,21e uveíte autoimune experimental (EAU)22,23. Com essa técnica versátil, os pesquisadores podem capturar imagens de OCT de alta resolução, bem como imagens de fundo de olho de maneira conveniente e eficiente.
Protocolo
Todos os procedimentos em animais estavam em conformidade com a declaração da Associação de Pesquisa em Visão e Oftalmologia sobre o Uso de Animais em Pesquisa Oftálmica e da Visão e foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade Médica de Wenzhou (WMU). Os ratos e camundongos tiveram acesso livre a água e comida com uma intensidade de luz ambiental de 18 lux em um ciclo escuro/claro de 12 horas.
1. Preparação dos modelos oculares animais
- Modelo de neovascularização coroidal (CNV) induzida por laser de camundongo11,12
- Anestesiar camundongos fêmeas de 4 semanas (fundo C57BL / 6J) com cetamina e xilazina e dilatar as pupilas com colírio de fenilefrina tropicamida seguindo o passo 3.2. Considere o mouse devidamente anestesiado quando nenhum movimento for detectado após beliscar o dedo do pé.
- Acione a caixa da fonte de luz, o software e a caixa do laser (comprimento de onda: 532 nm), com a energia de saída ajustada para 100 mW e a duração para 100 ms.
- Coloque o mouse na plataforma experimental e ajuste a posição do mouse e da plataforma até que a visão do fundo do mouse esteja clara.
- Pressione o botão Laser ON na tela da caixa do laser e ajuste o foco do ponto de referência do laser vermelho. Mova o ponto de referência do laser e ajuste-o para um a dois diâmetros papilares longe do disco óptico. Opere o pedal para causar danos ao laser.
- Realize uma verificação imediata para determinar se ocorreu uma bolha de vaporização imediatamente após o impacto, o que é um sinal de dano bem-sucedido ao laser. Gere de três a cinco pontos de laser para cada olho.
- Esmagamento do nervo óptico do camundongo (ONC) modelo 13,14,15,16
- Anestesiar camundongos fêmeas (fundo C57BL / 6J) no dia pós-natal (P) 21 a P35 seguindo a etapa 3.2. Considere o mouse devidamente anestesiado quando nenhum movimento for detectado após beliscar o dedo do pé.
- Coloque o mouse sob um microscópio cirúrgico e faça uma incisão na conjuntiva de um olho usando uma tesoura de mola, garantindo que o tamanho da incisão da conjuntiva seja de aproximadamente 1 mm.
- Exponha o nervo óptico intraorbital e esmague com pinça fina por 5 s a 0,5 mm de distância do disco óptico. Ao fazer isso, desvie suavemente os músculos orbitais e os outros tecidos e coloque-os de lado. Evite danos a quaisquer vasos sanguíneos no olho cirúrgico.
NOTA: Tenha cuidado, pois o globo ocular balançará ao tocar ou arrancar o nervo óptico branco. - Aplique pomada oftálmica no pós-operatório para evitar o ressecamento da córnea.
- Modelo de degeneração retiniana induzida por luz de camundongo (LIRD) 17,18,19,20,21
- Preparativos antes do experimento: Envolva as gaiolas de camundongos (30 cm x 18 cm x 13 cm) com papel alumínio e uma cobertura de malha de ferro. Coloque cada gaiola em uma caixa de papel (52 cm x 35 cm x 30 cm) com uma luz branca na parte superior.
- Adapte camundongos machos de 6 semanas de idade (BALB/c) durante a noite na sala escura e, em seguida, dilate os olhos usando colírio de fenilefrina tropicamida em cada olho. Dilate totalmente a pupila até que 3/4 da área da córnea não seja coberta pela íris; Isso geralmente não leva mais de 3 minutos.
- Ilumine os ratos com luz branca de 10.000 lux por 2 h. Mantenha os camundongos no escuro durante a noite no pós-operatório e depois retorne aos ambientes normais de luz escura. Para garantir um estímulo de luz eficaz, mantenha um rato na gaiola o tempo todo.
- Modelo de uveíte autoimune experimental (EAU) de rato
- Preparações antes do experimento: Emulsionar 2,5 mg de hIRBP161-180 em adjuvante completo de Freund (1:1 peso/volume) com 2,5 mg/mL de Mycobacterium tuberculosis H37Ra22,23.
- Injetar 100 μL de emulsão por via subcutânea na pata esquerda de cada rato macho Lewis (cerca de 180 g).
2. Configuração do módulo OCT
- Conecte a fibra óptica e o cabo de controle da OCT entre o cabeçote de varredura da OCT e o mecanismo da OCT (Figura 1A). Alinhe o entalhe na fibra com uma ranhura no conector e insira suavemente a ponta até que esteja encaixada (Figura 1B).
NOTA: Antes de conectar o cabo de controle, desligue o interruptor de alimentação do motor OCT. A fibra óptica é muito frágil, portanto, evite as duas extremidades da ponta da fibra (Figura 1C). A montagem e desmontagem do cabeçote de varredura OCT e da fibra/cabo devem ser evitadas se este módulo estiver sob uso frequente. - Passe a lente objetiva OCT de camundongo ou rato na frente do corpo da máquina (Figura 1A). Coloque a cabeça de varredura OCT na lente OCT, com o indicador de foco MR voltado para longe do corpo da máquina (Figura 1A).
- Prenda a cabeça de digitalização OCT com dois parafusos de aperto manual: um na lente e outro no corpo da câmera. Fixe bem a cabeça de digitalização.
- Ligue o interruptor de alimentação principal, seguido pela luz da câmera e, em seguida, o software OCT.
NOTA: A câmera precisa de algum tempo para inicializar para que o computador a encontre.
3. Preparação animal para experiências com PTU
- Aos 10 minutos antes dos experimentos de OCT, instilar colírio de fenilefrina tropicamida nos olhos do animal e limpar o excesso de colírio com uma toalha limpa.
- Aos 5 minutos antes do experimento, injete 200 μL da solução anestésica no camundongo e injete 2,0 mL no rato por via intraperitoneal. Considere o camundongo/rato devidamente anestesiado quando nenhum movimento for detectado após beliscar o dedo do pé.
NOTA: As soluções anestésicas foram compostas por cetamina (12 mg/mL) e xilazina (1 mg/mL para o camundongo e 2 mg/mL para o rato) em soro fisiológico; normalmente, são aplicados 10 μL de solução anestésica por 1 g de massa corporal animal. As soluções foram conservadas a 4 °C durante um máximo de 2 semanas. - Uma vez administrada a anestesia, lubrifique a córnea com pomada em gel para evitar o ressecamento da superfície ocular.
4. Imagem OCT guiada por imagem
NOTA: A interface do software foi dividida em três partes: imagem de campo claro, guias de controle de OCT e exibição de OCT (Figura 2).
- Ao olhar para a imagem de campo claro, digite a anotação das informações do animal, se necessário.
- Ative ou desative os controles de posição do feixe usando a caixa de seleção para capturar uma imagem de campo claro com ou sem a sobreposição de linha na imagem.
- Para posicionar o feixe de varredura com mais precisão, use as setas de Deslocamento de posição para controle preciso para direcioná-lo para cima, para baixo, para a esquerda ou para a direita. Escolha os valores de espessura e cor e escolha um ângulo para a viga visando o local de interesse (por exemplo, grosso, preto e 0). Arraste o valor de ganho para 14 db.
- Vá para as guias de controle da OCT. No menu, selecione Arquivo/File_Settings e crie um caminho para onde as imagens de OCT e fundo de olho serão salvas.
- Especifique o tipo de varredura, tamanho e animal (rato ou camundongo); escolha Olho, esquerdo ou direito e Detecção de imagem.
NOTA: A OCT pode capturar tipos de varredura de volume, círculo e linha 3D nos tamanhos completo, meio, quarto e oitavo. - Defina os controles de imagem. Ajuste os valores: 60 para o contraste, 100 para a gama e 0 para o brilho.
- Coloque o mouse na plataforma experimental e ajuste a posição do mouse e da plataforma até que a visão do fundo do mouse esteja clara. Ajuste a posição com precisão para localizar o disco óptico no centro.
- Ajuste o braço de referência para 850 para camundongos e 830 para ratos no início e, em seguida, ajuste a posição clicando nos botões <-1 ou +1>. Ajuste a imagem OCT horizontalmente e, em seguida, mova a imagem OCT para o 1/3 superior da visualização completa.
- Mova o controle deslizante de polarização para ajustar o brilho do sinal através da retina, se necessário.
- Depois de observar uma imagem OCT clara e estável, bem como a imagem do fundo do olho, defina o número de quadros (geralmente 20, 50, 80 ou 100) e pressione Média.
NOTA: Leva vários segundos para capturar as imagens da OCT. Um número maior de quadros significa que a captura de imagem leva mais tempo para ser concluída, mas produz uma imagem capturada de maior qualidade. - Pressione Salvar para salvar as imagens de OCT e fundo de olho e clique em Reiniciar para capturar outra amostra.
NOTA: Os animais foram autorizados a se recuperar em uma placa de aquecimento a 37 ° C antes de acordar. Os animais não foram deixados sozinhos até que recuperassem a consciência suficiente para manter a decúbito esternal. Os animais que foram submetidos ao tratamento não foram devolvidos ao sistema de criação de outros animais até que estivessem totalmente recuperados.
5. Medição de espessura e análise quantitativa
NOTA: Esta OCT possui software de análise integrado. As imagens de OCT podem ser segmentadas e analisadas usando este software (Figura 3).
- Abra o software de análise e abra uma imagem OCT que precisa ser analisada.
- Escolha o número de camadas e pressione Obter camadas iniciais (Figura 3A). O software desenhará as camadas automaticamente.
- Clique no ícone Lápis e mova os pontos na camada de destino para ajustar a camada com precisão (Figura 3A, B). Modifique todas as camadas cuidadosamente, uma a uma.
NOTA: Adicionar mais camadas é possível. Clique no ícone Mais, desenhe vários pontos sobre a imagem OCT e pressione o ícone Tick. Uma nova camada será criada. - Uma vez concluídos os ajustes finos das camadas, exporte os valores detalhados (formato CSV) e os diferentes tipos de imagem da OCT segmentada (Figura 3A).
NOTA: É possível exportar diferentes tipos de imagem, incluindo camadas, espessura, mapa de espessura, camadas sem OCT e capturas de tela. O valor no meio que se sobrepõe ao nervo óptico de cada imagem precisa ser abandonado e definido como zero, pois não há camada retiniana lá.
Resultados
A OCT guiada por imagem pode ser usada para monitorar o desenvolvimento do ponto de laser na neovascularização coroidal induzida por laser (CNV) em camundongos. Conforme mostrado na Figura 1, os vasos sanguíneos do recém-nascido passaram pela membrana de Bruch, bem como pela camada do epitélio pigmentar da retina (EPR) e formaram uma cicatriz fibrótica após lesão por laser11,12. Este ponto de lesão pode ser capturado em varredura de tamanho normal (Figura 4A) ou varredura de meio tamanho (Figura 4B). A varredura de meio tamanho é recomendada porque fornece imagens ampliadas e torna a observação mais focada no ponto de laser. Obviamente, monitorar uma janela de tempo mais ampla, incluindo 0 dias, 3 dias, 7 dias e 14 dias, é possível, se necessário para o estudo.
No modelo de esmagamento do nervo óptico de camundongo (ONC), foram medidas mudanças dinâmicas na espessura do complexo de células ganglionares (GCC), que é composto pela camada de fibras nervosas da retina (RNFL), camada de células ganglionares (GCL) e camada plexiforme interna (IPL). Usando o tipo de varredura circular (Figura 5A), uma característica degenerativa das células ganglionares foi observada nas imagens OCT (Figura 5B, C). A espessura do GCC foi de aproximadamente 69-74 μm na retina de camundongo controle não tratada, enquanto a espessura diminuiu para 50-57 μm aos 7 dias após o esmagamento (dpc) e para 43-49 μm a 14 dpc ( Figura 5C ).
Este tipo de análise da espessura da camada também é aplicável à retina externa. Um exemplo é medir as espessuras da retina externa do camundongo no modelo de degeneração retiniana induzida por luz (LIRD) por OCT usando varredura em tamanho real (Figura 6). Antes do dano por luz, a retina externa exibia camadas claras, incluindo a camada plexiforme externa (OPL), a camada nuclear externa (ONL), o segmento interno do fotorreceptor (IS) e o segmento externo do fotorreceptor (OS; Figura 6A). No entanto, 1 dia após o dano à luz, um resultado borrado foi observado na retina externa da imagem da OCT, que pode ter sido causado pela resposta imune e morte celular 19,20. A essa altura, a retina externa ainda era mais espessa que a retina interna (composta pelo GCC e pela camada nuclear interna; Figura 6B). Com o tempo, tornou-se mais fino que a retina interna no dia 5 e no dia 7, e sua cor reverteu de vermelho para azul (indicado pela escala do mapa de calor; Figura 6B).
Em um modelo experimental de uveíte autoimune (EAU) em ratos, foram pesquisadas as características inflamatórias da retina e do vítreo. A OCT guiada por imagem pode produzir uma imagem de fundo de olho e a estrutura da retina e do vítreo (Figura 7) simultaneamente, proporcionando uma maneira fácil de avaliar a gravidade da doença. Em comparação com os ratos controle (Figura 7A), os ratos EAU (Figura 7B) exibiram vasculite grave, presença de células vítreas, edema do disco óptico e dobras retinianas.

Figura 1: O hardware do módulo OCT. (A) Conexão da fibra óptica e do cabo de controle OCT entre o cabeçote de varredura OCT e o mecanismo OCT. B) Ligação da fibra óptica à cabeça de varrimento da OCT. (C) Fibra óptica. Clique aqui para ver uma versão maior desta figura.
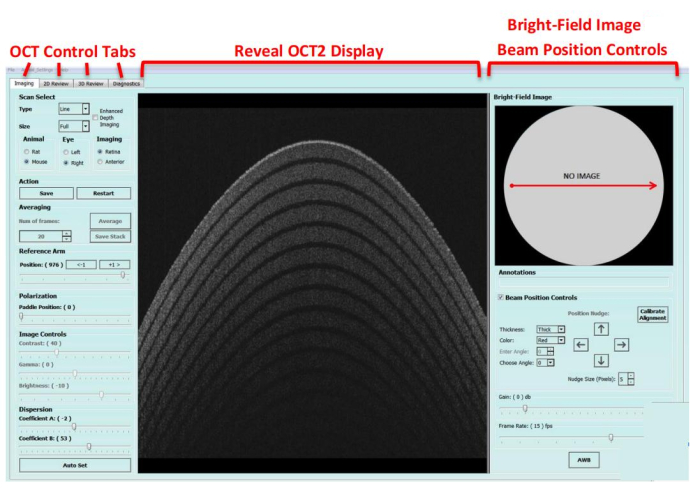
Figura 2: O software de imagem da OCT guiada por imagem. A interface do software é dividida em três partes: imagem de campo claro, guias de controle OCT e exibição OCT. Clique aqui para ver uma versão maior desta figura.

Figura 3: O software para segmentação de camada OCT guiada por imagem. (A) Barra de ferramentas exibida no software.  Ícone de lápis;
Ícone de lápis;  + ícone;
+ ícone;  ícone de carrapato;
ícone de carrapato;  ícone de exportação. (B) Ajuste fino das camadas recém-adicionadas na imagem OCT. Clique aqui para ver uma versão maior desta figura.
ícone de exportação. (B) Ajuste fino das camadas recém-adicionadas na imagem OCT. Clique aqui para ver uma versão maior desta figura.
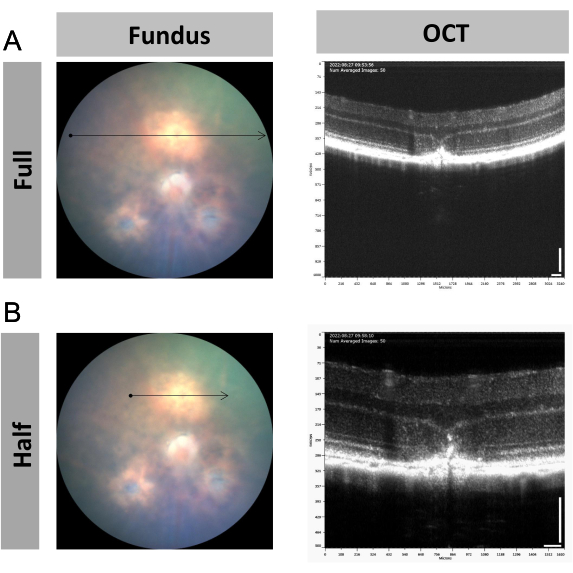
Figura 4: Figuras representativas das alterações estruturais da retina no modelo de neovascularização coroidal (CNV) induzida por laser de camundongo. (A, B) Imagens representativas de fundo de olho e OCT do local de interesse com CNV usando (A) varredura em tamanho real e (B) meio tamanho 7 dias após a lesão a laser. Barra de escala = 100 μm; n = 1. Clique aqui para ver uma versão maior desta figura.
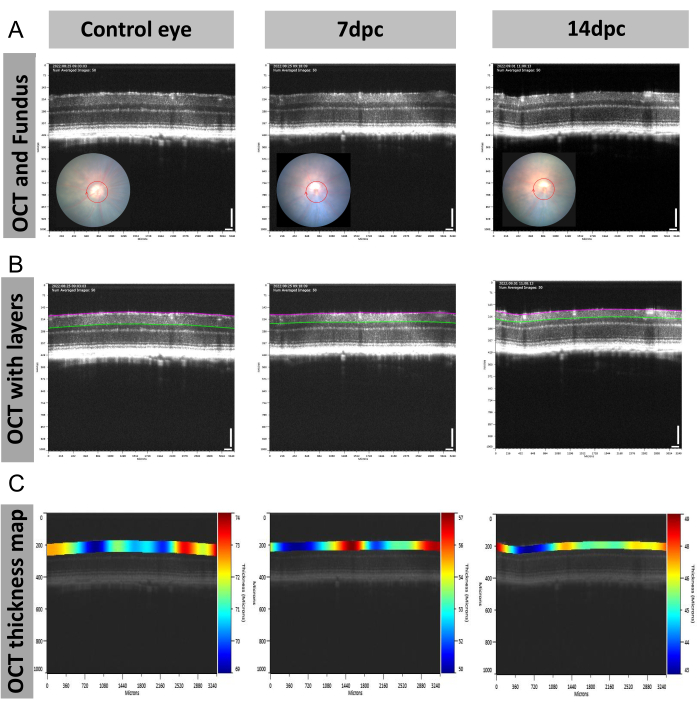
Figura 5: Figuras representativas das mudanças estruturais da retina no modelo de esmagamento do nervo óptico de camundongo (ONC). (AC) Imagens representativas de (A) OCT (tipo de varredura: círculo) e fundo, (B) OCT com camadas e (C) mapas de espessura de OCT no dia 7 e no dia 14 pós-esmagamento. Abreviação: dpc = dias após o esmagamento. Barra de escala = 100 μm; n = 1. Clique aqui para ver uma versão maior desta figura.
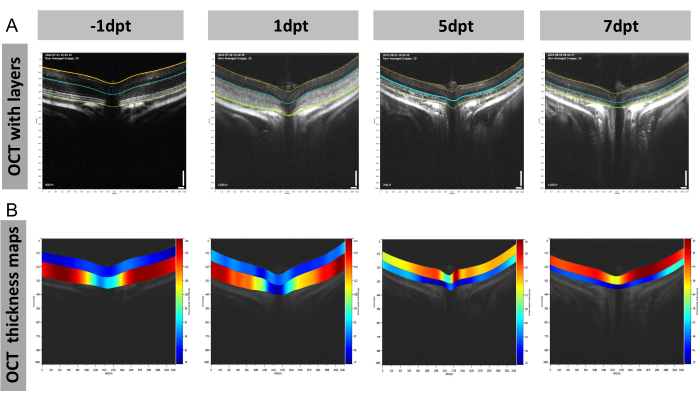
Figura 6: Figuras representativas das mudanças estruturais da retina no modelo de degeneração retiniana induzida por luz de camundongo (LIRD). (A, B) Imagens representativas de OCT com (A) camadas e (B) mapas de espessura de OCT no dia -1, dia 1, dia 5 e dia 7 após danos causados pela luz. Abreviaturas: dpt = dias pós-tratamento. Barra de escala = 100 μm; n = 3. Clique aqui para ver uma versão maior desta figura.

Figura 7: Figuras representativas das alterações estruturais da retina e do sinal no vítreo no modelo experimental de uveíte autoimune (EAU) em ratos. (A, B) Imagens representativas de fundo de olho e OCT do (A) controle e (B) modelo EAU usando varredura em tamanho real 11 dias após o tratamento. Barra de escala = 100 μm; n = 1. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo fornece instruções para a coleta de imagens e medição de espessura da OCT guiada por imagem. Ao demonstrar os quatro modelos de roedores mais populares de doenças oculares, os pesquisadores descobriram que a OCT guiada por imagem proporcionou excelente desempenho no exame de alterações estruturais drásticas da retina. De fato, com imagens de alta resolução, pequenas lesões também podem ser encontradas facilmente em imagens OCT. Com o auxílio da OCT guiada por imagem, um grupo no laboratório também encontrou pontos de hiperrefletividade anormais dentro do OPL em um modelo de camundongo em microgravidade e em um modelo de camundongo mutante Cacna1f24,25. Além disso, é possível determinar as outras pequenas alterações estruturais do vítreo para a coróide 26,27,28,29. Em resumo, a OCT de alta resolução pode fornecer um diagnóstico preciso de lesões minúsculas, bem como alterações importantes na arquitetura da retina 5,6,7,8,9,10.
Em comparação com a OCT comercial não guiada por imagem e a OCT autoconstruída, a OCT guiada por imagem tem alguns pontos fortes. Por exemplo, possui um software de análise integrado, que permite aos usuários analisar diretamente a espessura das retinas. Como a OCT é uma máquina guiada por imagem de fundo de olho, o alinhamento de posição é muito mais fácil e simples, e pesquisadores e estudantes no laboratório não gastam tempo excessivo aprendendo operações práticas. A aquisição de imagens de alta qualidade requer o uso de anestesia apropriada e técnicas especializadas. Ao usar OCT guiada por imagem, a anestesia inadequada pode levar a uma qualidade de imagem abaixo da média. A utilização da OCT de óptica adaptativa, no entanto, pode abordar com competência questões de anestesia e movimento inadequados durante a imagem de camundongos 30,31. Além disso, a OCT guiada por imagem produz imagens coloridas de fundo de olho e imagens de OCT de alta resolução simultaneamente, o que não é uma configuração padrão para OCT comercial e OCT autoconstruída. Essa funcionalidade ajuda os usuários a realizar duas tarefas de maneira mais fácil. Além disso, a OCT guiada por imagem pode ser combinada com um laser guiado por imagem, ERG guiado por imagem ou lâmpada de fenda em um único instrumento, maximizando assim o espaço do laboratório.
Obviamente, a alta integração pode ter vantagens e desvantagens. Se o número de usuários aumentar para dezenas ou centenas, o módulo OCT guiado por imagem deve ser administrado separadamente. Os usuários devem ter cuidado ao montar e desmontar os elementos da máquina. Ao contrário da OCT autoconstruída, a máquina comercial mostra fraquezas no desenvolvimento e expansão de funções. É importante notar que os pesquisadores descobriram que houve uma diminuição acentuada na qualidade das imagens OCT com OCT guiada por imagem quando o meio de refração do olho do animal experimental era ruim. Em contrapartida, os PTU comerciais mostraram uma grande tolerância em relação a esta questão. Ao todo, a OCT versátil guiada por imagem ajuda os pesquisadores no campo ocular a examinar as alterações estruturais da retina de roedores de maneira conveniente, confiável e tratável 5,6,7,8,9,10.
Divulgações
Nenhum dos autores tem conflitos de interesse a divulgar.
Agradecimentos
Os autores agradecem aos membros do State Key Laboratory of Ophthalmology, Optometry, and Vision Science pelo apoio técnico e comentários úteis sobre o manuscrito. Este trabalho foi apoiado por doações da Fundação Nacional de Ciências Naturais da China (82101169, 81800857, 81870690), da Fundação Provincial de Ciências Naturais de Zhejiang da China (LGD22H120001, LTGD23H120001, LTGC23H120001), do Programa do Departamento de Ciência e Tecnologia de Wenzhou da China (Y20211159), do Projeto de Apoio à Ciência e Tecnologia de Guizhou (Qiankehezhicheng [2020] 4Y146) e do Projeto do Laboratório Estadual de Oftalmologia, Optometria e Ciência da Visão (No. K03-20220205).
Materiais
| Name | Company | Catalog Number | Comments |
| BALB/c mouse | Beijing Vital River Laboratory Animal Technology Co., Ltd | Animal model preparations | |
| C57BL/6JNifdc mouse | Beijing Vital River Laboratory Animal Technology Co., Ltd | Animal model preparations | |
| Carbomer Eye Gel | Fabrik GmbH Subsidiary of Bausch & Lomb | Moisten the cornea | |
| Complete Freund’s adjuvant | Sigma | F5881 | EAU experiment |
| Experimental platform | Phoenix Technology Group | Animal model preparations | |
| hIRBP161-180 | Shanghai Sangon Biological Engineering Technology & Services Co., Ltd. | EAU experiment | |
| Ketamine | Ceva Sante Animale | General anesthesia | |
| Laser box | Haag-Streit Group | Merilas 532α | Animal model preparations |
| Lewis rat | Beijing Vital River Laboratory Animal Technology Co., Ltd | Animal model preparations | |
| Mycobacterium Tuberculosis H37RA | Sigma | 344289 | EAU experiment |
| Phoneix Micron IV with image-guided OCT and image-guided laser | Phoenix Technology Group | Animal model preparations | |
| Tissue forceps | Suzhou Mingren Medical Instrument Co., Ltd | MR-F101A-5 | Animal model preparations |
| Tropicamide Phenylephrine Eye Drops | SANTEN OY, Japan | Eye dilatation | |
| Vannas scissors | Suzhou Mingren Medical Instrument Co., Ltd | MR-S121A | Animal model preparations |
| Xylazine | Ceva Sante Animale | General anesthesia |
Referências
- Cen, L. -. P., et al. Automatic detection of 39 fundus diseases and conditions in retinal photographs using deep neural networks. Nature Communications. 12, 4828 (2021).
- Kashani, A. H., et al. Optical coherence tomography angiography: A comprehensive review of current methods and clinical applications. Progress in Retinal and Eye Research. 60, 66-100 (2017).
- Cheng, D., et al. Inner retinal microvasculature damage correlates with outer retinal disruption during remission in Behçet's posterior uveitis by optical coherence tomography angiography. Investigative Ophthalmology & Visual Science. 59 (3), 1295-1304 (2018).
- Lin, R., et al. Relationship between cone loss and microvasculature change in retinitis pigmentosa. Investigative Ophthalmology & Visual Science. 60 (14), 4520-4531 (2019).
- Dietrich, M., et al. Using optical coherence tomography and optokinetic response as structural and functional visual system readouts in mice and rats. Journal of Visualized Experiments. (143), e58571 (2019).
- Jagodzinska, J., et al. Optical coherence tomography: Imaging mouse retinal ganglion cells in vivo. Journal of Visualized Experiments. (127), e55865 (2017).
- Ye, Q., et al. In vivo methods to assess retinal ganglion cell and optic nerve function and structure in large animals. Journal of Visualized Experiments. (180), e62879 (2022).
- Mai, X., Huang, S., Chen, W., Ng, T. K., Chen, H. Application of optical coherence tomography to a mouse model of retinopathy. Journal of Visualized Experiments. (179), e63421 (2022).
- Allen, R. S., Bales, K., Feola, A., Pardue, M. T. In vivo structural assessments of ocular disease in rodent models using optical coherence tomography. Journal of Visualized Experiments. (161), e61588 (2020).
- Kokona, D., Jovanovic, J., Ebneter, A., Zinkernagel, M. S. In vivo imaging of Cx3cr1gfp/gfp reporter mice with spectral-domain optical coherence tomography and scanning laser ophthalmoscopy. Journal of Visualized Experiments. (129), e55984 (2017).
- Yan, M., Li, J., Yan, L., Li, X., Chen, J. -. G. Transcription factor Foxp1 is essential for the induction of choroidal neovascularization. Eye and Vision. 9 (1), 10 (2022).
- Wolf, A., Herb, M., Schramm, M., Langmann, T. The TSPO-NOX1 axis controls phagocyte-triggered pathological angiogenesis in the eye. Nature Communications. 11, 2709 (2020).
- Li, L., et al. Longitudinal morphological and functional assessment of RGC neurodegeneration after optic nerve crush in mouse. Frontiers in Cellular Neuroscience. 14, 109 (2020).
- Zhang, Y., et al. Elevating growth factor responsiveness and axon regeneration by modulating presynaptic inputs. Neuron. 103 (1), 39-51 (2019).
- Wang, J., et al. Robust myelination of regenerated axons induced by combined manipulations of GPR17 and microglia. Neuron. 108 (5), 876-886 (2020).
- Tian, F., et al. Core transcription programs controlling injury-induced neurodegeneration of retinal ganglion cells. Neuron. 110 (16), 2607-2624 (2022).
- Wu, K. -. C., et al. Deletion of miR-182 leads to retinal dysfunction in mice. Investigative Ophthalmology & Visual Science. 60 (4), 1265-1274 (2019).
- Rattner, A., Nathans, J. The genomic response to retinal disease and injury: Evidence for endothelin signaling from photoreceptors to glia. Journal of Neuroscience. 25 (18), 4540-4549 (2005).
- Rattner, A., Toulabi, L., Williams, J., Yu, H., Nathans, J. The genomic response of the retinal pigment epithelium to light damage and retinal detachment. Journal of Neuroscience. 28 (39), 9880-9889 (2008).
- Hahn, P., et al. Deficiency of Bax and Bak protects photoreceptors from light damage in vivo. Cell Death & Differentiation. 11 (11), 1192-1197 (2004).
- Fan, J., et al. Maturation arrest in early postnatal sensory receptors by deletion of the miR-183/96/182 cluster in mouse. Proceedings of the National Academy of Sciences of the United States of America. 114 (21), 4271-4280 (2017).
- Zhou, J., et al. A combination of inhibiting microglia activity and remodeling gut microenvironment suppresses the development and progression of experimental autoimmune uveitis. Biochemical Pharmacology. 180, 114108 (2020).
- Okunuki, Y., et al. Retinal microglia initiate neuroinflammation in ocular autoimmunity. Proceedings of the National Academy of Sciences of the United States of America. 116 (20), 9989-9998 (2019).
- Dai, X., et al. Rodent retinal microcirculation and visual electrophysiology following simulated microgravity. Experimental Eye Research. 194, 108023 (2020).
- Dai, X., et al. Photoreceptor degeneration in a new Cacna1f mutant mouse model. Experimental Eye Research. 179, 106-114 (2019).
- Liu, Y., et al. Mouse models of X-linked juvenile retinoschisis have an early onset phenotype, the severity of which varies with genotype. Human Molecular Genetics. 28 (18), 3072-3090 (2019).
- Ou, J., et al. Synaptic pathology and therapeutic repair in adult retinoschisis mouse by AAV-RS1 transfer. Journal of Clinic Investigation. 125 (7), 2891-2903 (2015).
- Xiang, L., et al. Depletion of miR-96 delays, but does not arrest, photoreceptor development in mice. Investigative Ophthalmology & Visual Science. 63 (4), 24 (2022).
- Huang, X. -. F., et al. Functional characterization of CEP250 variant identified in nonsyndromic retinitis pigmentosa. Human Mutation. 40 (8), 1039-1045 (2019).
- Jonnal, R. S., et al. A review of adaptive optics optical coherence tomography: Technical advances, scientific applications, and the future. Investigative Ophthalmology & Visual Science. 57 (9), 51 (2016).
- Dong, Z. M., Wollstein, G., Wang, B., Schuman, J. S. Adaptive optics optical coherence tomography in glaucoma. Progress in Retinal and Eye Research. 57, 76-88 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados