Method Article
Microscopia intravital para estudar as interações plaquetário-leucocitário-endotelial no fígado de camundongo
Neste Artigo
Resumo
A microscopia intravital é uma ferramenta poderosa que fornece informações sobre as relações temporais e espaciais de processos rápidos e/ou sequenciais. Descrevemos um protocolo para avaliar as interações proteína-proteína e as interações plaqueta-neutrófilo-endotelial em sinusóides hepáticos em um modelo murino de sepse experimental (endotoxemia).
Resumo
Inflamação e trombose são processos complexos que ocorrem principalmente na microcirculação. Embora a histologia padrão possa fornecer informações sobre a via final da inflamação e da trombose, ela não é capaz de mostrar as mudanças temporais que ocorrem ao longo do curso de tempo desses processos. A microscopia intravital (IVM) é o uso de imagens de animais vivos para obter informações temporais sobre os processos fisiológicos in vivo. Este método é particularmente poderoso ao avaliar as interações celulares e proteicas dentro da circulação devido aos eventos rápidos e sequenciais que muitas vezes são necessários para que essas interações ocorram. Embora o IVM seja uma metodologia de imagem extremamente poderosa, capaz de visualizar processos complexos in vivo, há uma série de fatores metodológicos que são importantes a serem considerados ao planejar um estudo de IVM. Este artigo descreve o processo de realização de imagens intravitais do fígado, identificando considerações importantes e possíveis armadilhas que podem surgir. Assim, este artigo descreve o uso da MIV para estudar as interações plaquetas-leucócitos-endoteliais em sinusóides hepáticos para estudar as contribuições relativas de cada um em diferentes modelos de lesão hepática aguda.
Introdução
Inflamação e trombose são processos complexos que ocorrem principalmente na microcirculação. Este protocolo descreve a preparação cirúrgica que permite a imagem da microvasculatura hepática in vivo. Embora a histologia padrão possa fornecer informações sobre as vias finais da inflamação e da trombose, ela não pode mostrar as mudanças temporais que ocorrem ao longo do processo. Além disso, este método é particularmente poderoso ao avaliar as interações celulares e proteicas transitórias que ocorrem dentro da circulação microvascular devido à sua capacidade de capturar, via videomicroscopia, as interações muitas vezes rápidas e sequenciais que ocorrem dentro de sistemas biológicos. Este artigo descreve o uso da microscopia intravital para estudar as interações plaquetário-leucocitário-endotelial em sinusóides hepáticos para estudar a contribuição relativa de cada um em diferentes modelos de lesão hepática aguda.
Embora essa preparação cirúrgica e a modalidade de imagem tenham o potencial de serem adaptadas a uma série de modelos inflamatórios e patológicos, dois modelos de inflamação vascular são descritos aqui: um modelo de endotoxemia de sepse murina e lesão hepática induzida por paracetamol (APAP). A injeção de endotoxina (lipopolissacarídeo; LPS) para induzir um modelo experimental de sepse murina começou já na década de 1930 com seu isolamento e subsequente exploração como uma molécula-chave na progressão da sepse1. Embora este modelo seja limitado porque o LPS é apenas um único componente das bactérias Gram-negativas, este é um método amplamente aceito e utilizado que é relativamente simples e rápido de executar. Além disso, replica com rapidez e precisão as manifestações fisiológicas da sepse1. Dado o papel que a absorção de endotoxinas intestinais desempenha no desenvolvimento de doenças hepáticas e inflamações2, este é um excelente modelo para estudar as interações plaquetas-leucócitos-endoteliais no fígado de camundongos.
Além de um modelo LPS de sepse, a overdose de APAP fornece um excelente modelo para o estudo de interações patológicas célula-célula no fígado. A superdosagem de APAP pode levar à insuficiência hepática aguda, marcada por trombocitopenia e acúmulo de plaquetas no fígado, bloqueando subsequentemente a recuperação hepática mediada por leucócitos3. Embora a preparação cirúrgica e a metodologia de imagem para este modelo possam ser adaptadas para uma série de questões biológicas e para estudar vários processos patológicos, tanto o modelo LPS de sepse quanto a lesão hepática induzida por APAP são excelentes modelos para o estudo das interações plaqueta-leucócitos-endotelial in vivo.
O IVM tem algumas vantagens inerentes às técnicas histológicas padrão. Embora os métodos histológicos padrão permitam o estudo de amostras de tecido inteiro ou seccionado e a apreciação de proteínas e arquitetura de tecido, essas metodologias apresentam limitações. Por design, esses processos requerem processamento de tecidos, que tem o potencial de distorcer ou mascarar o que é encontrado no sistema vivo. O tecido deve ser fixado durante o preparo histológico, introduzindo o potencial para artefatos de fixação ou autofluorescência aprimorada. A fixação também pode levar a alterações intracelulares no tecido, e o potencial de fixação inadequada pode levar à degradação do tecido. Além disso, os métodos histológicos não têm o potencial de estudar diretamente os aspectos temporais das interações proteicas ou celulares e têm o potencial de perder interações efêmeras ou pouco frequentes.
Por outro lado, a microscopia intravital de fluorescência permite evitar muitas das complicações e limitações inerentes à histologia padrão. A MIV evita a fixação e, portanto, os artefatos ou degradação tecidual que podem ocorrer durante o preparo histológico. Por design, também permite a imagem de tecidos dentro do sistema biológico vivo e, como tal, o isolamento e o seccionamento do tecido não são necessários. Além disso, permite a imagem e o estudo de processos transitórios ou pouco frequentes, que podem ser difíceis ou impossíveis de capturar usando histologia. Esse método de MIV também pode ser usado para capturar e identificar processos sequenciais (por exemplo, interações iniciadas por plaquetas ou leucócitos, resultando em agregados plaquetários-leucócitos ligados ao endotélio vascular). Finalmente, este método pode ser adaptado a uma série de sistemas de imagem. Dependendo das necessidades do estudo e do conjunto de dados desejado, após a preparação cirúrgica, o fígado externalizado pode ser colocado em quase qualquer sistema de imagem desejado. Aplicamos com sucesso este protocolo a imagens usando microscopia de fluorescência de campo amplo, microscopia de disco giratório, microscopia confocal de varredura a laser usando um scanner de cabeça de ressonância, bem como microscopia de dois fótons. No entanto, não há razão para acreditar que esse método deva ser limitado aos sistemas de microscopia acima mencionados.
Este artigo de métodos descreve um protocolo para IVM, que foi usado anteriormente para estudar as interações plaqueta-leucócitos-endotelial no fígado de camundongo. Esse protocolo tem sido utilizado para comparar a adesão plaquetária-endotelial temporal de plaquetas, marcadas com anticorpos conjugados fluorescentes ou geneticamente modificadas para fluorescência endógena4. Este protocolo tem sido usado para avaliar as interações transitórias plaquetas-leucócitos-endoteliais nos sinusóides hepáticos em um modelo endotoxêmico de inflamação hepática e para co-localizar a P-selectina e a proteína recombinante. Além disso, esse protocolo possibilitou determinar se as diferenças observadas na densidade de neutrófilos usando histologia padrão eram resultado de diferenças nas velocidades dos glóbulos vermelhos (como substituto da taxa de fluxo volumétrico)5. Finalmente, esse método tem sido usado para avaliar o recrutamento de plaquetas pelas células de Kupffer nos sinusóides hepáticos em um modelo agudo de lesão hepática induzida por APAP6. Este corpo de trabalho não teria sido possível usando métodos histológicos padrão. Como afirmado, este protocolo pode ser adaptado para uma variedade de sistemas de imagem e, com preparação cirúrgica adequada, escolha de anticorpos fluorescentes e configurações de imagem, este protocolo é altamente confiável e reprodutível para o estudo da patologia hepática.
Protocolo
Todos os protocolos de animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Baylor College of Medicine e pelo Comitê de Pesquisa e Desenvolvimento do Michael E. DeBakey Veterans Affairs Medical Center. Todos os experimentos são terminais, com a eutanásia realizada no final sob um plano cirúrgico de anestesia. Consulte a Tabela de Materiais para obter detalhes relacionados a todos os materiais, reagentes e equipamentos usados neste protocolo.
1. Preparação de anticorpos e corantes
- Seleção de anticorpos e corantes
NOTA: O número de cores simultâneas observadas dependerá da configuração específica do microscópio. No sistema usado aqui, quatro comprimentos de onda diferentes podem ser visualizados simultaneamente.- Visualizando embarcações:
- Com base no desenho experimental, marque a vasculatura com um anticorpo específico do endotélio (por exemplo, CD31) e/ou uma molécula uniformemente distribuída no plasma (por exemplo, dextrana ou albumina).
NOTA: Este artigo descreve o uso de dextrano rotulado com Texas Red (150 kDa; 250 μg/camundongo). O benefício desta proteína de grande peso molecular está em sua capacidade de permanecer dentro da vasculatura durante a inflamação aguda. Deve-se ter cuidado ao usar a marcação de anticorpos para evitar anticorpos que tenham o potencial de interferir na função endotelial.
- Com base no desenho experimental, marque a vasculatura com um anticorpo específico do endotélio (por exemplo, CD31) e/ou uma molécula uniformemente distribuída no plasma (por exemplo, dextrana ou albumina).
- Visualizando plaquetas:
- Para identificar plaquetas, use camundongos geneticamente modificados (por exemplo, R26R-EYFPf / f / PF4-Cre) ou anticorpos específicos para plaquetas (por exemplo, anti-GPIbβ) para IVM. Para obter informações detalhadas sobre o uso da marcação fluorescente de plaquetas, consulte uma publicação anterior4.
NOTA: Aqui, são usados anticorpos anti-GPIbβ marcados com DyLight488 (X488; 6 μg/camundongo). Deve-se ter cuidado ao usar a marcação de anticorpos para evitar interferência na função ou adesão plaquetária.
- Para identificar plaquetas, use camundongos geneticamente modificados (por exemplo, R26R-EYFPf / f / PF4-Cre) ou anticorpos específicos para plaquetas (por exemplo, anti-GPIbβ) para IVM. Para obter informações detalhadas sobre o uso da marcação fluorescente de plaquetas, consulte uma publicação anterior4.
- Visualizando leucócitos:
- Semelhante às plaquetas de imagem, visualize os leucócitos de interesse com camundongos geneticamente modificados (por exemplo, LysM-EGFP para granulócitos) ou anticorpos específicos para leucócitos (por exemplo, Ly6G para neutrófilos murinos). Para seguir este protocolo, use anticorpos anti-Ly6G marcados com Brilliant Violet 421 (BV421) (3 μg/camundongo). Em experimentos agudos (<6 h), marque neutrófilos com 3 μg de anti-Ly6G (clone 1A8) por animal.
NOTA: Ao usar o anticorpo anti-Ly6G (clone 1A8), deve-se notar que este anticorpo tem sido usado para esgotar neutrófilos (0,05-1 mg de anticorpo/camundongo)7-9 após pelo menos 24 h e/ou com injeções repetidas. Os anticorpos anti-Ly6G (1A8) também foram relatados para afetar a adesão e a transmigração de neutrófilos em altas (mas não baixas) tensões de cisalhamento em certas, mas não em todas as situações 9,10. Portanto, a dosagem de anticorpos deve ser escolhida cuidadosamente para cada caso.
- Semelhante às plaquetas de imagem, visualize os leucócitos de interesse com camundongos geneticamente modificados (por exemplo, LysM-EGFP para granulócitos) ou anticorpos específicos para leucócitos (por exemplo, Ly6G para neutrófilos murinos). Para seguir este protocolo, use anticorpos anti-Ly6G marcados com Brilliant Violet 421 (BV421) (3 μg/camundongo). Em experimentos agudos (<6 h), marque neutrófilos com 3 μg de anti-Ly6G (clone 1A8) por animal.
- Proteínas adicionais:
- Dependendo do número de lasers e conjuntos de filtros/detectores disponíveis em um determinado sistema de imagem, adicione mais comprimentos de onda para identificar mais objetos simultaneamente, tomando cuidado para evitar sobreposição espectral.
NOTA: Este protocolo descreve a imagem de um 4º objeto, P-selectina (clone Psel.KO2.3), usando um anticorpo anti-P-selectina marcado com PerCP-eFluor 710 (4 μg/camundongo). Embora a maioria das descrições e imagens neste artigo sejam para lesão hepática aguda induzida por LPS, outros modelos de lesão podem ser de interesse e podem exigir rótulos alternativos. Consulte a discussão para obter uma descrição dos anticorpos usados para lesões induzidas por APAP6.
- Dependendo do número de lasers e conjuntos de filtros/detectores disponíveis em um determinado sistema de imagem, adicione mais comprimentos de onda para identificar mais objetos simultaneamente, tomando cuidado para evitar sobreposição espectral.
- Visualizando embarcações:
- Remoção de conservantes e esterilização
NOTA: Embora existam anticorpos e corantes disponíveis comercialmente prontos para injeção em animais, a maioria deles terá transportadores ou conservantes (por exemplo, azida de sódio) que podem ser prejudiciais aos animais ou adicionar variáveis de confusão. Anticorpos e corantes contendo carreadores ou conservantes devem ser dialisados contra solução salina tamponada com fosfato de Dulbecco sem cálcio ou magnésio (DPBS-/-; ou outros tampões fisiológicos).- Despeje 500 mL de DPBS-/- (~ 1.000 vezes o volume do anticorpo/corante a ser dialisado) em um béquer com uma barra de agitação magnética. Conecte um de 7.000 MWCO a uma bóia flutuante e coloque-o no tampão de diálise por pelo menos 5 min para pré-condicionar a membrana. Remova o e seque as bordas de plástico com um lenço de papel sem fiapos. Evite tocar na membrana de diálise.
- Injete o anticorpo/corante no através de uma das quatro portas usando uma agulha de 18-20 G. Coloque o com o anticorpo/corante no tampão de diálise. Colocar o copo sobre um agitador magnético e dialisar durante pelo menos 1 h a 4 °C. Troque o tampão de diálise.
- Repita a diálise e a troca do tampão de diálise na etapa 1.2.2 por no mínimo mais duas vezes (pelo menos três trocas).
- Remova o e seque as bordas de plástico com um lenço de papel sem fiapos. Evite tocar na membrana de diálise. Aspire o anticorpo/corante do através de uma porta não utilizada usando uma agulha de 18-20 G.
- Numa capa de cultura de tecidos, esterilizar as preparações utilizando um filtro de 0,2 μm antes da utilização em animais. Conservar as porções não utilizadas em tubos estéreis a 4 °C.
- Controles
- Embora os controles exatos necessários para cada experimento variem dependendo do desenho do estudo, certifique-se de incluir coortes simuladas adequadas, grupos tratados com e não tratados com veículo, bem como controles de isotipo para excluir rotulagem não específica e efeitos biológicos ao analisar os resultados do estudo.
2. Injeção intraperitoneal de endotoxina
NOTA: Para avaliar as interações plaqueta-neutrófilo-endotelial nos sinusóides hepáticos em um modelo experimental de sepse murina, a injeção de endotoxina pode ser usada.
- Pese os camundongos para determinar a quantidade de endotoxina a ser injetada (5 mg / kg; Escherichia coli sorotipo O111:B4; teor de endotoxina 1 x 106 UE/mg).
NOTA: A potência e o efeito da endotoxina dependem da espécie e da cepa e podem variar de lote para lote11. Portanto, para maximizar a consistência dos resultados, os experimentos devem ser conduzidos com o mesmo lote de endotoxina12. - Retire a endotoxina diluída com solução salina normal (cloreto de sódio a 0,9%) em uma seringa com uma agulha de 27 G acoplada. Na mão não dominante, segure o mouse pela nuca usando o polegar e o indicador. Usando a outra mão, coloque tração na cauda para expor o abdômen e coloque a cauda entre o quinto dedo e a palma da mão não dominante.
- Limpe o abdômen com etanol 70%. Insira a agulha no abdômen inferior esquerdo (ou direito) e injete a endotoxina.
NOTA: Deve-se tomar cuidado para evitar inserir a agulha muito profundamente, pois existe o risco de lesão de órgãos que pode confundir os experimentos (por exemplo, lesões nos intestinos, intestinos, rins, etc.). - Execute as etapas 2.1-2.3 em animais de controle usando solução salina normal (ou veículo).
NOTA: A lesão hepática induzida por APAP pode ser realizada usando uma metodologia semelhante à acima, usando APAP em vez de endotoxina6. Consulte a discussão para obter detalhes relacionados ao modelo de lesão hepática induzida por APAP.
3. Indução e manutenção da anestesia dos animais e eutanásia
- Coloque os animais sob um plano cirúrgico de anestesia. Mantenha a anestesia usando isoflurano inalado por meio de um nariz ou tubo de traqueostomia. Avalie e ajuste o nível de anestesia monitorando o movimento após uma pitada no dedo do pé.
- Realizar a eutanásia no final de todos os experimentos por exsanguinação sob um plano cirúrgico de anestesia seguido de pneumotórax bilateral.
4. Cateterismo da veia jugular e traqueia
- Realize uma traqueostomia para facilitar a respiração e a colocação de cateteres vasculares para a injeção de anticorpos/corantes marcados.
NOTA: Um microscópio de dissecção cirúrgica ou lupas são úteis no cateterismo. - Raspe o pelo do pescoço e abdômen; Remova o excesso de pelos. Coloque o animal em uma almofada de aquecimento para manter a temperatura corporal a 37 °C, usando uma sonda retal para monitorar a temperatura central. Esfregue o pescoço com betadina seguida de etanol a 70%.
- Faça uma incisão vertical na linha média do pescoço e exponha a traqueia usando dissecção romba.
- Traqueostomia
- Prepare um tubo de traqueostomia PE90 com uma agulha romba de 21 G inserida (Figura 1A).
NOTA: Adicionar um chanfro de ~45° à extremidade do tubo de traqueostomia pode ajudar a facilitar sua inserção na traqueia. Alternativamente, um cateter intravenoso periférico de 18-20 G também pode ser substituído pelo tubo PE90. - Uma vez que a pele e a fáscia são incisadas, reflita as glândulas salivares para longe do centro.
- Usando dissecção romba, separe o músculo esternotireóideo para dar melhor acesso à traqueia.
NOTA: Tome cuidado para evitar os vasos fornecedores e as artérias carótidas adjacentes à traqueia. - Faça uma pequena incisão horizontal (~ 1-2 mm) entre os anéis traqueais no lado ventral / anterior da traqueia (Figura 1B).
NOTA: O uso de tesouras Vannas facilitará a dissecção adequada. Certifique-se de que apenas a face anterior da traqueia esteja incisada; A transecção completa da traqueia dificultará a canulação da traqueia e corre o risco de danificar as estruturas vasculares próximas. - Passe um tubo de traqueostomia no orifício. Certifique-se de que a ponta do tubo não seja inserida além da carina.
- Prenda o tubo de traqueostomia dentro da traqueia amarrando uma sutura de seda # 4-0 ao redor da traqueia e do tubo, usando os anéis traqueais como suporte (Figura 1C).
- Prepare um tubo de traqueostomia PE90 com uma agulha romba de 21 G inserida (Figura 1A).
- Canulação jugular externa
- Prepare um cateter jugular (Figura 2) usando tubo PE50 (OD 0,97 mm, ID 0,58 mm) com tubo PE10 (OD 0,61 mm, ID 0,28 mm) inserido em uma extremidade (Figura 2 inserção) e uma agulha romba 22 G ou 23 G inserida na outra. Use adesivo para garantir que a tubulação não escorregue ou vaze. Conecte uma seringa cheia de solução salina normal estéril para lavar o cateter.
- Exponha a veia jugular externa (EJV) após a reflexão das glândulas salivares. Usando dissecção romba, libere o EJV do tecido conjuntivo circundante (Figura 3A).
- Usando suturas de seda # 4-0, ligue a extremidade cranial do EJV visualizado e coloque uma alça solta ao redor da extremidade caudal do EJV (Figura 3B). Prenda as extremidades de cada sutura com hemostáticos e retraia suavemente os dois hemostáticos um do outro para ajudar a expor o EJV.
NOTA: A região ideal para canular é entre os ramos da veia jugular anterior cranialmente e a veia jugular interna caudalmente. Para facilitar a colocação da sutura, dobre um pedaço (~15 cm) de sutura ao meio e passe a extremidade dobrada por baixo do EJV com um par de pinças enquanto levanta o EJV com um par de pinças separado para evitar o rolamento do vaso. Em seguida, corte a sutura para fazer dois comprimentos separados. - Usando uma tesoura Vannas, faça uma pequena incisão (~1 mm) na superfície anterior do EJV. Insira uma agulha romba de 30 G dobrada (aumentada com um pino minucienal de 0,15 mm limado sem corte e inserido na ponta da agulha) no EJV através da incisão e levante-o suavemente para facilitar a passagem do cateter contendo solução salina normal para o EJV.
NOTA: Certifique-se de que o cateter e o hub não tenham bolhas de ar antes de inserir e lavar no mouse. Um êmbolo de ar pode ser letal para o animal. - Quando o cateter estiver dentro do EJV, afrouxe a alça caudal apenas o suficiente para permitir a passagem do cateter mais profundamente na veia. Verifique a colocação do cateter aspirando sangue e lavando o cateter para verificar se há vazamentos (Figura 3C).
- Usando a alça caudal, prenda o cateter dentro do EJV. Usando a sutura craniana, prenda o cateter na extremidade cranial da VEJ para minimizar a decanulação acidental (Figura 3D).
- Feche a incisão da pele do pescoço com sutura de seda # 4-0.
- Traqueostomia
5. Exteriorização do fígado
- Limpe o abdômen com um esfoliante betadine seguido de etanol a 70%.
- Faça uma incisão vertical de ~ 1 cm na pele do abdômen superior, começando na base do esterno. Usando dissecção romba, separe a pele dos músculos abdominais. Cauterize os grandes vasos de alimentação da pele e dos músculos para minimizar o sangramento durante as etapas a seguir (Figura 4A).
- Faça uma incisão horizontal de ~ 1-2 cm da pele seguida pelo músculo abdominal, dividindo a incisão vertical na etapa 5.2 aproximadamente no topo do fígado visível; usar uma ferramenta de cauterização para auxiliar na hemostasia da pele (Figura 4B).
NOTA: O tamanho da incisão do abdômen é fundamental para a imagem ideal do fígado. Se a abertura for muito pequena, existe o risco de isquemia hepática devido ao alongamento excessivo ou impacto da artéria hepática e/ou veia porta. Se a abertura for muito grande, outros órgãos, como os intestinos, também podem ser exteriorizados e interferir na imagem. - Corte um círculo de aproximadamente 1 cm no centro de uma gaze de 2 pol x 2 pol e umedeça-o com solução salina normal morna. Posicione a gaze de forma que a abertura fique centralizada sobre a incisão. Separe suavemente as bordas da incisão e aplique uma leve pressão para cima no abdômen para exteriorizar o fígado de modo que o fígado fique facilmente apoiado sobre a gaze umedecida ( Figura 4C ).
- Coloque o mouse na bandeja de imagem em decúbito ventral, com o fígado centralizado sobre a lamínula (Figura 4D).
NOTA: Em um animal de controle, o fígado deve parecer marrom. Um microscópio confocal de varredura a laser invertido com um scanner de cabeça de ressonância bidirecional é usado para IVM neste protocolo. Portanto, uma impressora 3D foi usada para criar uma bandeja IVM personalizada (Figura 5). Os arquivos .stl criados para impressão 3D são fornecidos (Arquivo Suplementar 1); ajustes podem ser necessários para atender às necessidades dos indivíduos. - Transfira o animal para o microscópio invertido.
6. Imagem de microscopia intravital do fígado
NOTA: Este protocolo usa um microscópio confocal de varredura a laser com um scanner de cabeça de ressonância bidirecional para microscopia intravital. Para estabilizar a frequência da cabeça de ressonância, ligue o sistema por pelo menos 30 minutos antes da imagem. Sistemas diferentes podem ter recursos diferentes. A discussão sobre isso está fora do escopo deste artigo. Entre em contato com os representantes do equipamento para obter detalhes técnicos de sistemas específicos.
- Para manter um plano cirúrgico de anestesia, conecte o animal ao sistema de liberação de isoflurano.
NOTA: Dependendo do protocolo experimental, pode ser necessária ventilação mecânica (vs. ventilação espontânea). - Coloque uma almofada de aquecimento radiante sobre o animal, usando a sonda retal para manter uma temperatura central de 37 °C.
NOTA: Neste protocolo, um pedaço retangular de espuma que se encaixa ao redor da bandeja IVM atua como um isolante e um espaçador para colocar a almofada de aquecimento radiante (Figura 4D). - Defina a torre da objetiva para a ampliação desejada, aplicando óleo de imersão conforme necessário. Para seguir este protocolo, use a objetiva de óleo de silicone 60x/NA1.30 com zoom óptico de 1x.
- Uma vez identificado o plano focal, identifique ≥10 campos de visão aleatórios, evitando as áreas próximas às bordas do fígado.
NOTA: Como o fígado exibe autofluorescência no canal de isotiocianato de fluoresceína (FITC), use a epifluorescência para identificar rapidamente o plano focal geral.- Dependendo do sistema, identifique as bordas do fígado visível usando epifluorescência no canal FITC e registre as coordenadas do estágio (x,y).
- Use os limites (x,y) do fígado e um gerador de números aleatórios para identificar coordenadas aleatórias (x,y). Para um campo de visão aceitável, procure (a) a presença de vasos dispersos por todo o campo de visão; b) ≥80% dos vasos no mesmo plano focal; e (c) ≥1 campo de visão longe de quaisquer bordas do fígado (exemplo na Figura 6). Se o foco da análise da imagem estiver nas interações plaquetas-leucócitos-endoteliais nos sinusóides hepáticos, exclua campos com vasos cujos diâmetros sejam ≥15 μm (os sinusóides murinos geralmente têm ≤10 μm de diâmetro).
7. Análise de imagem
NOTA: ImageJ/FIJI foi usado para processar todas as imagens deste artigo. FIJI (fiji.sc) é uma versão de código aberto do Image J (imagej.nih.gov) que tem mais funcionalidade por meio do uso de plug-ins e macros adicionais13.
- Abra os arquivos multicanal com lapso de tempo no ImageJ/FIJI.
NOTA: Dependendo da plataforma, podem ser necessários programas/plug-ins adicionais. O ImageJ/FIJI possui um importador de bioformatos que pode abrir vários tipos diferentes de arquivos, como os arquivos .oir da Olympus. Aqui, os arquivos foram convertidos para .tif porque é um formato mais usado. - Certifique-se de que a escala correta esteja definida; Procure a proporção de pixel/μm e o intervalo de tempo nos metadados/propriedades.
- Use filtros diferentes para remover o ruído de fundo (por exemplo, um filtro mediano com um raio de 2 pixels usado neste protocolo). Certifique-se de que o processamento seja semelhante entre todas as imagens para minimizar a variação no pós-processamento. À medida que as contagens e comprimentos estão sendo comparados nesses experimentos, em vez da intensidade média de fluorescência, filtre para melhorar a clareza e a identificação e medição das interações célula-célula.
NOTA: O uso e a magnitude dos filtros dependerão do tamanho do(s) alvo(s) de interesse e da relação sinal-ruído nas imagens. - Como há heterogeneidade entre os campos de visão na densidade vascular, medir a área vascular total em cada campo usando o pincel de seleção (Figura 7).
- Clique com o botão direito do mouse na ferramenta de seleção oval e escolha a ferramenta pincel de seleção .
- Ajuste o tamanho do pincel clicando duas vezes no ícone da ferramenta pincel de seleção .
- Trace os vasos para destacá-los/selecioná-los. Para excluir partes da seleção, use o botão esquerdo do mouse [alt] e adicione partes usando o botão esquerdo [shift].
- Pressione [M] para medir a área selecionada.
NOTA: Se a escala da imagem tiver sido definida corretamente, a saída deve estar em μm2, que é convertida em mm2.
- Conte o número de plaquetas e leucócitos no campo. Considere as células como células aderidas se elas se moveram <1 corpo celular por mais de 30 s. Calcule o número de células (plaquetas e/ou leucócitos) por mm2.
- Para estimar o fluxo sanguíneo relativo dentro de cada vaso, meça a velocidade média dos glóbulos vermelhos (RBC) como um substituto usando o plug-in MTrackJ no ImageJ / FIJI (imagescience.org/meijering/ software / mtrackj) 14, conforme descrito anteriormente5. Identifique as hemácias como defeitos de enchimento redondos ou em forma de disco no canal de dextrano. Salve as faixas para manutenção de registros, análise assíncrona e verificação.
NOTA: Um exemplo disso é mostrado na Figura 8 e no Vídeo Suplementar S1.
Resultados
Avaliação do efeito do domínio do bastonete de vimentina na adesão de leucócitos ao endotélio inflamado
A ligação do ligante-1 da glicoproteína P-selectina leucocitária (PSGL-1) à P-selectina endotelial e plaquetária ocorre durante a fase aguda da inflamação da lesão hepática induzida por sepse. No entanto, o domínio de bastonetes humanos recombinantes da vimentina (rhRod) demonstrou se ligar à P-selectina e bloquear a adesão de leucócitos ao endotélio e às plaquetas. Este protocolo foi utilizado em um modelo de sepse em camundongos para visualizar o efeito em tempo real do rhRod na adesão leucocitária dependente de PSGL-1 no fígado. Verificou-se que o rhRod co-localiza com a P-selectina nos sinusóides hepáticos e, de fato, diminui a adesão leucocitária no fígado5.
Recrutamento hepático de plaquetas na lesão hepática induzida por paracetamol
O acúmulo de plaquetas no fígado contribui para a lesão hepática induzida por APAP. Este protocolo foi utilizado para avaliar a contribuição da Quitinase 3-like-1 (Chi3l1) no recrutamento de plaquetas dentro dos sinusóides hepáticos. A aplicação desse protocolo permitiu a visualização do recrutamento plaquetário na fase aguda da lesão hepática induzida por APAP, onde foi constatado que a administração de APAP resulta em aumento de Chi3l1 e acúmulo de plaquetas no fígado, que foi atenuado em camundongos Chi3l1-/- 6.
Validação da marcação fluorescente de plaquetas para microscopia intravital
Para utilizar este protocolo para a avaliação das interações plaquetárias in vivo, foi necessário que o método de marcação fluorescente utilizado para a visualização das plaquetas fosse completamente validado. Originalmente, avaliamos duas fontes diferentes de fluorescência: plaquetas marcadas com anticorpos X488 e camundongos contendo fluorescência plaquetária endógena. Usando este protocolo, verificou-se que ambas as abordagens atingem fluorescência específica de plaquetas, e níveis semelhantes de agregação e adesão plaquetária foram encontrados em camundongos com fluorescência plaquetária endógena e seus irmãos de ninhada. No entanto, camundongos com fluorescência plaquetária endógena exibiram agregação e adesão plaquetária significativamente maiores quando comparados a camundongos C57BL/6 com plaquetas marcadas com X488. Como tal, a marcação de plaquetas com anticorpos X488 foi preferida às plaquetas endogenamente fluorescentes para a avaliação funcional intravital de plaquetas em camundongos4.
Atenuação do movimento hepático durante a imagem intravital
A janela de visualização ideal é aquela em que há um movimento mínimo do fígado. No entanto, o fígado pode se mover devido à sua adjacência ao diafragma (Vídeo Suplementar S2). Vários fatores podem influenciar o grau em que o fígado se move, como o tamanho do animal em comparação com a geometria do estágio de imagem. Se o estágio for muito plano, o fígado pode ser pressionado contra a lamínula e ter áreas de isquemia devido ao excesso de pressão e/ou impacto dos vasos no fígado (ou seja, artéria hepática e/ou veia porta). Em nosso estágio personalizado, incorporamos uma concavidade para minimizar a pressão externa no fígado. Métodos adicionais de minimizar o movimento incluem ajustar o tamanho da incisão abdominal para permitir que o fígado fique mais longe do diafragma. Deve-se tomar cuidado para evitar que outros órgãos internos (por exemplo, intestinos e rins) caiam e obscureçam a visão. Para reduzir ainda mais o movimento, alguns grupos utilizam um pequeno pedaço de filme plástico sobre o lobo do fígado e a bandeja de imagem15,16. Além disso, o ligamento falciforme pode ser cortado para isolar ainda mais o fígado do movimento abdominal17,18. Finalmente, se o movimento do fígado ainda estiver presente, a estabilização de software (também conhecida como registro; exemplos no Vídeo Suplementar S3) pode ser usada para estabilizar a imagem para análise. Deve-se estar ciente de que este pode ser um processo computacionalmente desgastante e pode não ser necessário, dependendo do resultado desejado. Se os vídeos contiverem ruído indesejado, os filtros medianos são recomendados. Exemplos de vídeos com filtro mediano podem ser vistos em Vídeo Suplementar S4 e Vídeo Suplementar S5.
Identificação de vasos e interação plaqueta-Kupffer-endotélio
O Vídeo Suplementar S6 e o Vídeo Suplementar S7 dão exemplos de veias maiores que podem ser visualizadas com esta técnica. Usando esta metodologia de MIV hepática, também podemos avaliar as interações plaquetas-Kupffer-endotelial após lesão hepática aguda induzida por APAP (Vídeo Suplementar S8). Para comparar as células aderentes entre os grupos experimentais, a área vascular é medida primeiro (etapa 7.4). Em seguida, as células aderentes podem ser contadas e (etapa 7.5) normalizadas para densidade vascular (Figura 7).
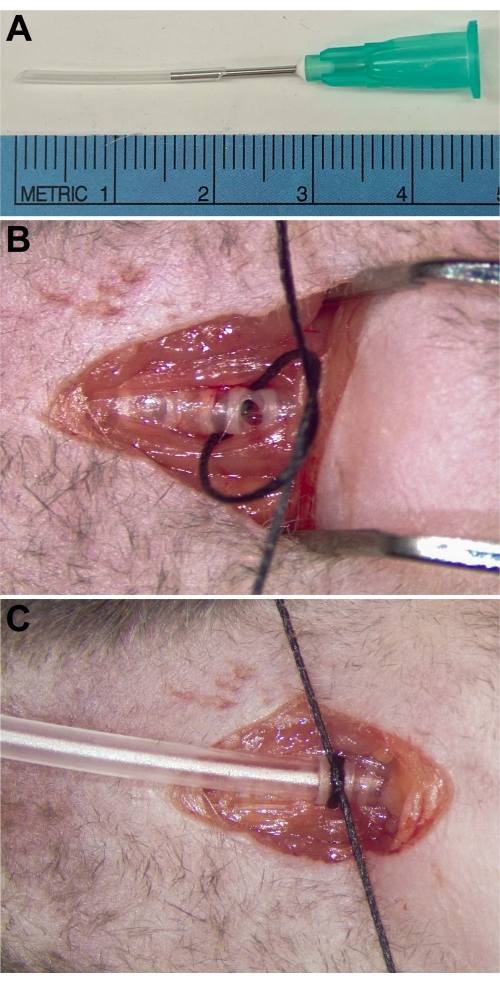
Figura 1: Colocação do tubo de traqueostomia. (A) O tubo de traqueostomia consiste em um tubo PE90 com uma agulha romba de 21 G inserida para permitir a conexão a um ventilador. (B) A superfície anterior da traqueia é cortada caudal à laringe. Uma sutura é passada por baixo para prender o tubo de traqueostomia após sua inserção. (C) Tubo de traqueostomia inserido e preso dentro da traqueia. Clique aqui para ver uma versão maior desta figura.

Figura 2: Cateter vascular. Tubo PE50 com uma agulha romba de 23 G inserida em uma extremidade e tubo PE10 inserido na outra. (Inserção) Vista ampliada da tubulação PE10 dentro da tubulação PE90. Cola adesiva pode ser necessária para evitar o deslocamento da tubulação PE10 e/ou vazamento. Clique aqui para ver uma versão maior desta figura.

Figura 3: Identificação e canulação da veia jugular externa. (A) O EJV (cabeça de seta) deve ser visível após a colocação do tubo de traqueostomia se as glândulas salivares forem refletidas para longe da linha média. (B) A extremidade cranial do EJV exposto é ligada. Uma alça solta de sutura é colocada ao redor da extremidade caudal do EJV exposto. (C) Após o isolamento do EJV, é feita uma pequena incisão e o cateter é inserido no vaso, após a sutura caudal. (D) Depois que a colocação do cateter é confirmada por aspiração de sangue, ele é lavado com solução salina e fixado ao vaso. Abreviatura: EJV = veia jugular externa. Clique aqui para ver uma versão maior desta figura.
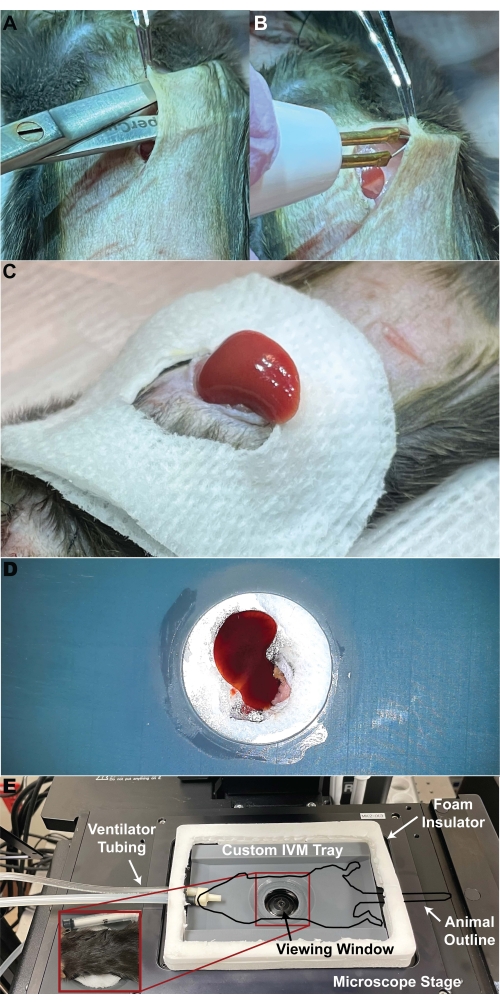
Figura 4: Exteriorização do fígado. (A) Uma pequena incisão vertical é feita no centro do abdome superior. A dissecção romba é usada para separar a pele do músculo. (B) Um cautério é usado para cauterizar os vasos de alimentação da pele e do músculo para evitar sangramento com dissecção. (C) Após a cauterização, é feita uma incisão horizontal, dividindo a incisão vertical. A pressão abdominal leve permite que o fígado seja exteriorizado em um pedaço de gaze úmida. (D) Uma visão do fígado externalizado abaixo da bandeja personalizada de IVM do fígado. (E) A bandeja personalizada de IVM de fígado é mostrada sem um animal, destacando o tubo do ventilador, o isolamento de espuma e a janela de visualização. (Inserção) O mouse é colocado em decúbito dorsal no estágio personalizado. Abreviatura: IVM = microscopia intravital. Clique aqui para ver uma versão maior desta figura.
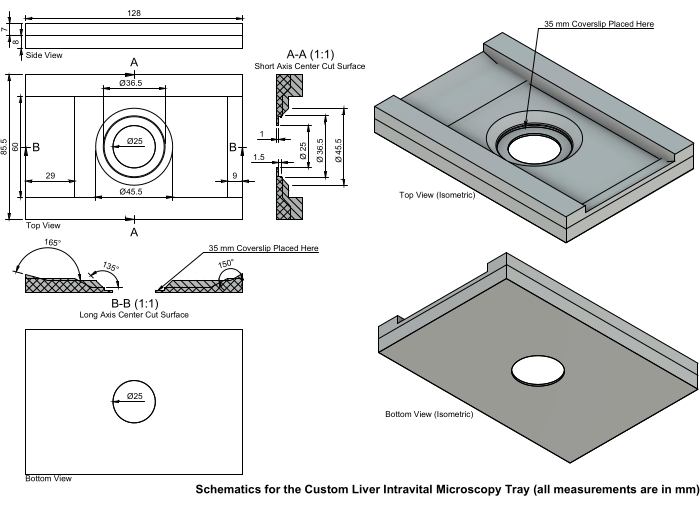
Figura 5: Esquemas para a bandeja personalizada de IVM de fígado. A bandeja IVM é impressa com um centro rebaixado para minimizar a pressão no fígado. Uma lamínula de 35 mm #1 ou #1.5 é colocada no centro e presa com esmalte transparente. Esta bandeja foi projetada para a platina do microscópio e as dimensões individuais podem variar dependendo do equipamento do investigador. Abreviatura: IVM = microscopia intravital. Clique aqui para ver uma versão maior desta figura.

Figura 6: Borda do fígado. A seta aponta para a borda do fígado, que não deve ser usada para análise de imagens. Barra de escala = 50 μm. Clique aqui para ver uma versão ampliada desta figura.

Figura 7: Medição da densidade do vaso e cálculo do PMN/mm2. Os vasos foram destacados com a ferramenta pincel de seleção com (A) todos os canais e (B) apenas os PMNs e canais de dextrana selecionados. (C) Os PMNs podem ser mais facilmente identificados com o canal de dextrano removido. Os PMNs que estavam firmemente aderidos foram marcados (cruzes amarelas). Esses cálculos podem então ser usados para medir a área vascular e PMN/mm2 no campo de visão. Abreviatura: PMN = neutrófilo polimorfonuclear. Clique aqui para ver uma versão maior desta figura.

Figura 8: Usando o MTrackJ para medir a velocidade dos glóbulos vermelhos como uma estimativa do fluxo sanguíneo. O plugin MTrackJ no ImageJ/FIJI foi usado para selecionar e seguir os RBCs para medir a velocidade dos RBCs. Depois de selecionar um RBC, a pilha avança automaticamente para permitir que o usuário selecione a nova posição do RBC selecionado. Uma vez que as faixas são selecionadas, a velocidade média de cada faixa pode ser determinada. Abreviatura: RBC = glóbulo vermelho. Clique aqui para ver uma versão maior desta figura.
Vídeo Suplementar S1: Vídeo de rastreamento de hemácias usando MTrackJ. Vídeo das trilhas do RBC em tempo real. Abreviatura: RBC = glóbulo vermelho. Clique aqui para baixar este arquivo.
Vídeo Suplementar S2: Campo de visão da MIV hepática com movimento devido ao movimento do diafragma com a respiração. Abreviatura: IVM = microscopia intravital. Clique aqui para baixar este arquivo.
Vídeo suplementar S3: Estabilização de imagem usando ImageJ/FIJI. Campo de IVM de fígado estabilizado por imagem usando o plug-in de registro baseado em descritor. Abreviatura: IVM = microscopia intravital. Clique aqui para baixar este arquivo.
Vídeo Suplementar S4: Vídeo de montagem de sinusóides hepáticos em um camundongo controle (solução salina normal). Em camundongos controle, há relativamente poucos neutrófilos aderentes (ciano) e plaquetas (verde). A P-selectina (magenta) reveste os sinusóides (cinza). Clique aqui para baixar este arquivo.
Vídeo Suplementar S5: Vídeo de montagem de sinusóides hepáticos em um camundongo endotoxêmico. Em comparação com o camundongo controle, os camundongos endotoxêmicos têm mais neutrófilos aderentes (ciano) e plaquetas (verde) nos sinusóides hepáticos (cinza). A P-selectina (magenta) é observada revestindo os sinusóides. Clique aqui para baixar este arquivo.
Vídeo Suplementar S6: Vídeo de montagem de sinusóides hepáticos drenando para uma veia central em um camundongo controle. Este é um exemplo de um campo de visão contendo uma embarcação maior que pode ou não ser do interesse de um investigador. É importante observar que há diminuição da coloração de P-selectina (magenta) na veia central maior em comparação com os sinusóides. As outras cores indicam neutrófilos (ciano), plaquetas (verde) e espaço intravascular (cinza). Clique aqui para baixar este arquivo.
Vídeo Suplementar S7: Vídeo de montagem de um ramo da veia porta dando origem aos sinusóides hepáticos em um camundongo endotoxêmico. Nesse campo de visão, um ramo da veia porta é visto dando origem aos sinusóides. Observe o aumento do número de neutrófilos aderidos (ciano) e plaquetas (verde). Há também expressão de P-selectina (magenta) no vaso maior. O espaço intravascular é marcado com TRITC-dextrano (cinza). Abreviatura: TRITC = tetrametilrodamina. Clique aqui para baixar este arquivo.
Vídeo Suplementar S8: Vídeo de lesão hepática aguda em um modelo de lesão hepática induzida por paracetamol. Este é um exemplo de uso de MIV hepática para estudar as interações plaqueta-Kupffer-endotelial em um modelo agudo de lesão hepática induzida por APAP. (Esquerda) Existem várias células de Kupffer (ciano) e plaquetas (brancas) observadas nos sinusóides hepáticos (vermelho) 150 minutos após a overdose de APAP. (Direita) Usando a mesma objetiva (60x), realizamos um zoom de 3x na célula de Kupffer superior para avaliar as interações Kupffer-plaquetas. Abreviaturas: MIV = microscopia intravital; APAP = paracetamol. Clique aqui para baixar este arquivo.
Arquivo suplementar 1: arquivo .stl para a bandeja de microscopia de IVM hepática personalizada. Dependendo do microscópio usado, pode ser necessária a alteração do arquivo .stl para adaptar a bandeja ao sistema de microscopia específico do investigador. Clique aqui para baixar este arquivo.
Discussão
O objetivo deste artigo de métodos é delinear as etapas necessárias para capturar de forma confiável imagens e vídeos intravitais de alta resolução do fígado de camundongo sob condições homeostáticas e após a administração de endotoxina ou APAP. Embora esse protocolo tenha permitido a produção consistente de dados sobre as interações plaqueta-leucócitos-endotélio no fígado, há uma série de etapas críticas necessárias para o sucesso, bem como possíveis armadilhas que são importantes evitar ao usar esse paradigma de imagem. O sucesso com este protocolo requer um planejamento minucioso e extenso durante a seleção de anticorpos para evitar interferir na função celular/proteica, técnica cirúrgica adequada para evitar danos teciduais e preservar a hemodinâmica homeostática, cuidados durante a externalização hepática para evitar isquemia hepática ou externalização de órgãos adicionais e configurações de imagem adequadas para evitar danos teciduais induzidos por luz/corante.
Com a prática, este protocolo permite imagens reprodutíveis e de alta qualidade da microvasculatura hepática in vivo e tem benefícios significativos quando comparado aos métodos de estudo existentes e alternativos. Embora dois modelos de patologia hepática sejam descritos aqui, a endotoxina e a lesão hepática induzida por APAP, a base deste protocolo tem o potencial de ser aplicada a uma miríade de modelos de lesões adicionais. Além disso, embora anticorpos e técnicas de análise tenham sido delineados para o estudo das interações plaqueta-leucócitos-endotelial, com planejamento adequado e seleção de anticorpos, este protocolo pode ser adaptado para o estudo de células/proteínas adicionais de interesse. Por exemplo, para lesão induzida por APAP6, os seguintes anticorpos podem ser usados: anticorpo F4/80 marcado com BV421 (0,75 μg/camundongo); Albumina sérica bovina marcada com TRITC (500 μg/camundongo); e anticorpo anti-GPIbβ marcado com DyLight649 (3 μg/camundongo). Existem alguns clones de anticorpos P-selectina com capacidade de bloqueio/neutralização (por exemplo, clones RB40.3 e AK-420). O clone de anticorpo P-selectina que usamos é Psel.KO2.3. Até onde sabemos, este clone não possui capacidade de bloqueio. A lesão hepática induzida por APAP pode ser realizada usando uma metodologia semelhante à acima, usando APAP em vez de endotoxina6. Os animais devem ser jejuados durante a noite21, e há uma diferença de sexo observada na resposta22. Uma dose de 210 mg / kg de APAP é administrada aos homens e 325 mg / kg às mulheres. A administração deve ser realizada da mesma maneira que as etapas 2.1-2.3 do protocolo. A imagem ocorre 2-3 h após a injeção para lesão aguda e 24 h após a injeção para lesão tardia.
A maioria dos estudos envolvendo imagens de fluorescência do tecido hepático utiliza a prática histológica padrão. Como mencionado anteriormente, embora isso tenha o potencial de produzir dados precisos e de alta qualidade, há uma série de suposições e limitações inerentes ao processo. A fixação por si só pode levar ao aumento da autofluorescência (uma questão particularmente relevante para o fígado, pois mesmo o tecido hepático recém-isolado tem autofluorescência significativa23), bem como encolhimento e distorção do tecido. Deve-se ter cuidado ao estudar o fígado usando práticas histológicas padrão para garantir que o que é capturado seja semelhante ao que é visto in vivo. A remoção de tecido também vem com suas próprias considerações, especialmente quando se estuda células hemopoiéticas e endotélio vascular. O processo de dissecção do tecido é por si só uma lesão e tem o potencial de introduzir artefatos não encontrados in vivo. Também deve ser considerado ao estudar a vasculatura que a remoção do tecido resulta na perda de pressão fisiológica dentro dos vasos e no colapso do vaso que o acompanha. A fixação por perfusão também elimina a maioria das células da vasculatura.
A modalidade de imagem intravital descrita neste artigo evita completamente o potencial de artefatos de fixação ou degradação tecidual e mantém a integridade do tecido, pois o fígado é meramente externalizado e não removido do sistema vivo. Embora isso seja por si só uma vantagem notável sobre os métodos histológicos padrão, a imagem intravital também permite a imagem e a identificação de processos sequenciais (por exemplo, processos iniciados por plaquetas versus leucócitos), bem como processos efêmeros e transitórios. Enquanto os métodos histológicos permitem apenas um único instantâneo do tecido no momento da fixação, o IVM oferece ao investigador a possibilidade de videomicroscopia do sistema vivo e uma apreciação temporal das funções biológicas. Por exemplo, usando moléculas fluorescentes de tamanho apropriado, como TRITC-dextrana ou TRITC-albumina, pode-se estudar os aspectos temporais e espaciais da permeabilidade vascular e vazamento. Deve-se notar, no entanto, que a profundidade do tecido que pode ser efetivamente visualizada depende do sistema de imagem que está sendo usado e da intensidade máxima do feixe permitida antes que ocorra dano tecidual induzido por luz/corante. A este respeito, a secção de tecido nas práticas histológicas padrão permite a aquisição de imagens em qualquer profundidade dentro do fígado, embora com perda de temporalidade.
Embora a MIV hepática seja uma ferramenta poderosa, existem limitações que devem ser consideradas ao planejar experimentos. Em primeiro lugar, este protocolo não permite medições repetidas; em vez disso, os experimentos são todos terminais. Embora seja esse o caso, existem métodos para permitir a repetição de imagens ao longo de uma série de dias ou semanas, como o uso de janelas de imagem abdominal implantadas24. Outra limitação está no movimento do fígado. Isso se deve ao órgão diretamente adjacente ao diafragma, que empurra o fígado caudalmente a cada respiração. Isso pode ser mitigado com o posicionamento e o uso de gaze úmida para manter o fígado no lugar na lâmina, mas nem sempre é possível. Dependendo do objetivo da imagem, o movimento do fígado ainda pode permitir a análise se o campo de visão retornar ao local original. Por exemplo, ao usar a rede vascular como um mapa para identificar campos únicos, uma vez que estamos avaliando células aderentes, a primeira e a última imagens com lapso de tempo podem ser comparadas para determinar se uma célula se moveu ou não. Para objetos em movimento rápido, como o movimento do fígado pode dificultar a análise de dados, a estabilização de imagem (também conhecida como registro no ImageJ) pode ser necessária. É importante notar que esse processo geralmente é computacionalmente desgastante e pode não funcionar se o movimento não for rítmico. Ao examinar o fígado quanto à epifluorescência, é imperativo que o microscopista esteja cego para o grupo experimental ao qual cada animal é designado. Isso diminuirá o viés do observador na seleção dos campos de visão. Além disso, escolher coordenadas aleatórias (x,y) também reduzirá o viés de confirmação e seleção. Esta e outras dicas para melhorar o rigor na microscopia são revisadas por Jost e Waters25.
A taxa de aquisição e a duração da imagem dependerão em grande parte do alvo de interesse do usuário final. Em nossos estudos, estudamos as interações plaquetário-leucócito-endotelial na circulação. Esses estudos usaram uma taxa de aquisição de 30 quadros por segundo (fps), o que permite que este sistema capture uma imagem de 512 pixels x 512 pixels usando o scanner de ressonância. O scanner de ressonância do sistema (Olympus FV3000) é capaz de gerar imagens de até quatro cores simultâneas em um padrão de ida e volta (da esquerda para a direita em uma linha e depois da direita para a esquerda na próxima linha). Isso permite que um tamanho de varredura de 512 pixels x 512 pixels seja visualizado em 33,3 ms (~0,063 ms por linha). Isso tem sido adequado para avaliar a velocidade dos eritrócitos e a adesão e/ou rolamento de plaquetas e leucócitos nas paredes dos vasos. Para investigadores interessados em processos mais rápidos ou efêmeros, taxas de aquisição mais altas podem ser necessárias. Neste sistema, podemos capturar mais rapidamente se estreitarmos a área de digitalização. Para nossos propósitos, como queríamos uma área vascular maior para analisar, usamos uma captura full-frame a 30 fps. Da mesma forma, a duração da aquisição da imagem também dependerá do endpoint do usuário final. Para todos os estudos, usamos durações de captura padronizadas. Embora uma duração mais longa possa fornecer mais dados, a principal medida de balanceamento é o tamanho do arquivo, que pode ser bastante grande com imagens multicanal com lapso de tempo. Estamos interessados em leucócitos e/ou plaquetas firmemente aderentes em vasos que fluem e a priori definimos um leucócito firmemente aderido como aquele que se move <1 corpo celular por pelo menos 30 s. Para investigadores interessados em processos mais lentos, como o rastreamento de leucócitos, pode ser necessário um período de tempo mais longo. Por fim, com sistemas mais sofisticados, também é possível combinar várias dimensões para visualizar determinados processos. Por exemplo, plataformas sincronizadas podem ser usadas para capturar pilhas 3D de forma lapsada no tempo. Esses tipos de estudos exigirão mais preparação, mas podem fornecer mais informações sobre certos mecanismos fisiológicos.
O IVM é uma ferramenta incrivelmente poderosa no estudo da vasculatura hepática em condições homeostáticas e patológicas. Ele permite visualizar as interações célula-célula e célula-molécula à medida que ocorrem no sistema biológico e, como tal, sua aplicação potencial no estudo da patogênese hepática não pode ser exagerada. Os exames de imagem podem ocorrer antes do início dos modelos patológicos, durante a fase aguda da patologia ou a qualquer momento para o estudo de sintomas crônicos ou insultos secundários. Embora estudemos as interações plaquetas-leucócitos-endotelial, este protocolo tem um potencial incrível de adaptação para atender às necessidades dos investigadores. Deve-se notar que quaisquer variações do protocolo aqui descrito exigem uma verificação completa de que os anticorpos / soluções fluorescentes não resultam em perda de função ou alteração das células/moléculas alvo. Isso pode ser verificado por meio de estudos preliminares usando os novos anticorpos em condições homeostáticas e patológicas, usando controles adequados e com uma compreensão completa das interações célula-célula ou célula-molécula típicas que estão sendo estudadas. Embora a técnica cirúrgica adequada, a consideração de anticorpos e as configurações de imagem sejam fundamentais para o sucesso dessa modalidade de imagem, uma vez alcançada a proficiência, essa técnica permite imagens repetíveis e de alta qualidade do fígado como ele existe in vivo. Esperamos que o uso deste protocolo para estudos futuros leve a uma maior compreensão da biologia e patogênese do fígado e, ao fazê-lo, nos aproxime do objetivo de produzir novas terapias para aqueles que sofrem de lesão hepática primária ou secundária.
Divulgações
Os autores não têm conflitos de interesse a divulgar. Os financiadores não tiveram nenhum papel no desenho do estudo, coleta e análise de dados, decisão de publicação ou preparação do manuscrito. O conteúdo não representa as opiniões do Departamento de Assuntos de Veteranos dos EUA ou do Governo dos Estados Unidos.
Agradecimentos
Este trabalho foi apoiado pelo NIH / NIGMS GM-123261 (FWL) e NIH / NHLBI HL139425 (JC). O apoio à pesquisa também foi financiado pelo NIH / NHLBI HL116524.
Materiais
| Name | Company | Catalog Number | Comments |
| Surgical Supplies | |||
| 2" x 2" non-woven sponges | McKesson Med. Surg | 92242000 | For liver isolation |
| #4-0 silk braided suture with needle | SOFSILK | N/A | 4-0 Softsilk coated braided black, nonabsorbable: C-1 cutting needle |
| #4-0 silk braided suture without needle | Ethicon | N/A | 4-0 Black braided silk, nonabsorbable |
| 21 G blunt needle (0.5 inch) | SAI Infusion Technologies | B21-50 | This is used to attach to the end of the tracheostomy tube to allow for connection to the ventilator. An alternative source is Instech |
| 23 G blunt needle (0.5 inch) | SAI Infusion Technologies | B23-50 | This is used for the vascular catheter to allow for connection to a syringe. An alternative source is Instech |
| Dissecting Scissors (Pointed Tip) | Kent Scientific | INS600393-G | Micro Dissecting Scissors; Carbide Blades; Straight; Sharp Points; 24 mm Blade Length; 4 1/2" Overall Length |
| McPherson-Vannas Micro Scissors (Vannas) | Kent Scientific | INS600124 | These are useful for creating the openings in the trachea and vessels |
| Polyethylene tubing 10 | Instech | BTPE-10 | This is used to make the intravascular portion of the catheter. An alternative source is BD Intramedic |
| Polyethylene tubing 50 | Instech | BTPE-50 | This is used to make the extravascular portion of the catheter. An alternative source is BD Intramedic |
| Polyethylene tubing 90 | Instech | BTPE-90 | This is used to make the tracheostomy tube. An alternative source is BD Intramedic |
| USP grade sterile normal saline | Coviden | 8881570121 | Hospira 0.0% Sodium Chloride Injection, USP |
| Microscopy Supplies | |||
| Isoflurane delivery system and ventilator | Kent Scientific | Somnosuite | Combination rodent ventilator and volatile anesthetic delivery system |
| Foam spacer for warming pad during microscopy | N/A | N/A | This spacer should be cut from high quality foam, should fit around the liver microscope tray and specific height dimensions are dependent upon the microscope system |
| Laser scanning confocal microscope system with resonance head scanner | Olympus | FV3000 | Although we describe the use of an Olympus FV3000 using a resonance head scanner, this protocol with work with most imaging systems |
| Liver Microscope Tray | N/A | N/A | The liver microscope tray was designed for an inverted microscope |
| Antibodies & Related Reagents | |||
| Brilliant Violet 421/anti-mouse Ly6G antibody | BioLegend | 127628 | 3 µg/mouse. To label neutrophils |
| BV421/F4/80 antibody | BioLegend | 123132 | 0.75 mg/kg. To label Kupffer cells |
| Dulbecco's phosphate buffered saline w/o calcium or magnesium | Gibco/ThermoFisher Scientific | 14190144 | Used as dialysate to remove sodium azide from antibodies |
| DyLight649/anti-GPIbβ antibody | emfret Analytics | X649 | 3 µg/mouse. To label platelets |
| DyLight488/anti-mouse GPIbβ antibody | emfret Analytics | X488 | 6 µg/mouse. To label platelets |
| Endotoxin from Escherichia coli serotype O111:B4 | Sigma-Aldrich | L3024 | 5 mg/kg; Potency of endotoxin may vary from lot to lot. Therefore, the same lot should be used for a series of experiments to minimize variation due to endotoxin lot |
| PerCP-eFluor 710/anti-mouse P-selectin antibody | Invitrogen | 46-0626-82 | 4 µg/mouse. To label P-selectin |
| Slide-a-Lyzer 7,000 MWCO cassette | Thermo Scientific | 66370 | Used to dialyze antibodies to remove sodium azide |
| Texas Red-labeled dextran | Sigma-Aldrich | T1287 | ~150 kDa; 250 µg/mouse |
| TRITC/bovine serum albumin | Sigma-Aldrich | A2289 | 500 µg/mouse. Dilute to a stock concentration of 50 mg/mL (5%) in normal saline. Used to label the vasculature. It may leak into the interstitial space more readily than high molecular weight dextran during inflammation |
Referências
- Deitch, E. A. Rodent models of intra-abdominal infection. Shock. 24, 19-23 (2005).
- Nolan, J. P. The role of intestinal endotoxin in liver injury: A long and evolving history. Hepatology. 52 (5), 1829-1835 (2010).
- Miyakawa, K., et al. Platelets and protease-activated receptor-4 contribute to acetaminophen-induced liver injury in mice. Blood. 126 (15), 1835-1843 (2015).
- Da, Q., Derry, P. J., Lam, F. W., Rumbaut, R. E. Fluorescent labeling of endogenous platelets for intravital microscopy: Effects on platelet function. Microcirculation. 25 (6), 12457 (2018).
- Lam, F. W., et al. The vimentin rod domain blocks P-selectin-P-selectin glycoprotein ligand 1 interactions to attenuate leukocyte adhesion to inflamed endothelium. PLoS One. 15 (10), 0240164 (2020).
- Shan, Z., et al. Chitinase 3-like-1 contributes to acetaminophen-induced liver injury by promoting hepatic platelet recruitment. eLife. 10, 68571 (2021).
- Daley, J. M., Thomay, A. A., Connolly, M. D., Reichner, J. S., Albina, J. E. Use of Ly6G-specific monoclonal antibody to deplete neutrophils in mice. Journal of Leukocyte Biology. 83 (1), 64-70 (2008).
- Pollenus, E., et al. Limitations of neutrophil depletion by anti-Ly6G antibodies in two heterogenic immunological models. Immunology Letters. 212, 30-36 (2019).
- Wang, J. X., et al. Ly6G ligation blocks recruitment of neutrophils via a β2-integrin-dependent mechanism. Blood. 120 (7), 1489-1498 (2012).
- Cunin, P., et al. Differential attenuation of β2 integrin-dependent and -independent neutrophil migration by Ly6G ligation. Blood Advances. 3 (3), 256-267 (2019).
- Weary, M. E., Donohue, G., Pearson, F. C., Story, K. Relative potencies of four reference endotoxin standards as measured by the Limulus amoebocyte lysate and USP rabbit pyrogen tests. Applied and Environmental Microbiology. 40 (6), 1148-1151 (1980).
- Kiers, D., et al. Comparison of different lots of endotoxin and evaluation of in vivo potency over time in the experimental human endotoxemia model. Innate Immunity. 25 (1), 34-45 (2019).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Meijering, E., Dzyubachyk, O., Smal, I. Methods for cell and particle tracking. Methods in Enzymology. 504, 183-200 (2012).
- Sierro, F., et al. A liver capsular network of monocyte-derived macrophages restricts hepatic dissemination of intraperitoneal bacteria by neutrophil recruitment. Immunity. 47 (2), 374-388 (2017).
- Guidotti, L. G., et al. Immunosurveillance of the liver by intravascular effector CD8+ T cells. Cell. 161 (3), 486-500 (2015).
- Davis, R. P., et al. Optimization of in vivo imaging provides a first look at mouse model of non-alcoholic fatty liver disease (NAFLD) using intravital microscopy. Frontiers in Immunology. 10, 2988 (2020).
- Reif, R., et al. In vivo imaging of systemic transport and elimination of xenobiotics and endogenous molecules in mice. Archives of Toxicology. 91 (3), 1335-1352 (2017).
- Sloboda, D. D., Brooks, S. V. Treatment with selectin blocking antibodies after lengthening contractions of mouse muscle blunts neutrophil accumulation but does not reduce damage. Physiological Reports. 4 (1), 12667 (2016).
- Lam, F. W., Da, Q., Guillory, B., Cruz, M. A. Recombinant human vimentin binds to P-selectin and blocks neutrophil capture and rolling on platelets and endothelium. Journal of Immunology. 200 (5), 1718-1726 (2018).
- Mossanen, J. C., Tacke, F. Acetaminophen-induced acute liver injury in mice. Laboratory Animals. 49, 30-36 (2015).
- Guerrero Munoz, F., Fearon, Z. Sex related differences in acetaminophen toxicity in the mouse. Journal of Toxicology. Clinical Toxicology. 22 (2), 149-156 (1984).
- Larsen, A. K., et al. Autofluorescence in freshly isolated adult human liver sinusoidal cells. European Journal of Histochemistry. 65 (4), 3337 (2021).
- Ritsma, L., et al. Intravital microscopy through an abdominal imaging window reveals a pre-micrometastasis stage during liver metastasis. Science Translational Medicine. 4 (158), (2012).
- Jost, A. P., Waters, J. C. Designing a rigorous microscopy experiment: Validating methods and avoiding bias. Journal of Cell Biology. 218 (5), 1452-1466 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados