Method Article
Investigando os efeitos aliviadores da administração de Bacillus cereus na colite por meio da modulação da microbiota intestinal
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para estabelecer o modelo de camundongo com colite induzida por sódio com sulfato de dextrano livre de germes induzido por antibióticos para investigar o papel da microbiota intestinal na regulação dos efeitos positivos do Bacillus cereus na colite.
Resumo
Acredita-se que a disbiose da microbiota intestinal exerça um papel na progressão da colite. No entanto, os padrões precisos para a administração de probióticos no alívio da colite permanecem indefinidos. A maioria dos métodos de análise depende da diversidade e abundância limitadas de microrganismos intestinais. Portanto, estudos observacionais não podem estabelecer causalidade. Neste estudo, aplicamos camundongos pseudo-livres de germes induzidos por antibióticos para investigar o papel da microbiota intestinal na regulação dos efeitos probióticos de Bacillus cereus (B. cereus) na colite induzida por sulfato de dextrano sódico (DSS) em camundongos. Esse processo permite avaliar o efeito regulador bidirecional da suplementação de B. cereus na saúde e fornece resultados estáveis e reprodutíveis. Aqui, são fornecidos os protocolos detalhados para cultivo de B. cereus , operação de gavagem, coleta de fezes e tratamento de eliminação de antibióticos em camundongos com colite. Os métodos de otimização também são aplicáveis para outros distúrbios inflamatórios crônicos associados. Os resultados mostraram que a administração de B. cereus diminuiu a perda de peso corporal, o encurtamento do comprimento do cólon, o índice de atividade da doença e os escores histopatológicos. No entanto, o tratamento com antibióticos suprimiu o efeito positivo do B. cereus na colite. Esses resultados indicam que a microbiota intestinal é necessária para aliviar os efeitos do B. cereus na colite. Portanto, explorar os efeitos benéficos dos probióticos nesta pesquisa é uma abordagem promissora para o desenvolvimento de novas estratégias de tratamento para aliviar os sintomas de distúrbios inflamatórios crônicos associados.
Introdução
As doenças inflamatórias intestinais (DII) são distúrbios inflamatórios gastrointestinais crônicos comuns, incluindo a doença de Crohn e a colite ulcerativa ()1. As vias terapêuticas atuais para a colite inflamatória são 5-aminosalicilatos, corticosteróides, azatioprina e antibióticos2. Além disso, esses medicamentos têm efeitos colaterais consideráveis3. Portanto, devemos prestar mais atenção ao efeito dos probióticos no tratamento da colite.
Abordagens terapêuticas alternativas incluem a administração de probióticos, que tem sido usada em modelos animais e ensaios clínicos. Estudos anteriores indicaram que diferentes administrações de probióticos, como Bacillus cereus ou Bifidobacterium infantis, poderiam aliviar a colite 4,5. Em estudos pré-clínicos, a eficácia e a segurança dos probióticos devem ser investigadas em modelos animais.
Modelos de camundongos para colite com sulfato de dextrano sódico (DSS) podem ajudar a explorar os mecanismos da colite e avaliar os efeitos positivos dos probióticos. A indução de DSS resulta em erosões da mucosa intestinal, disfunção da barreira intestinal e aumento da permeabilidade epitelial intestinal6. A maioria dos modelos de camundongos para probióticos destacou principalmente os efeitos biológicos. No entanto, o mecanismo por trás da administração desse probiótico é difícil de explorar, dada a limitação em verificar ainda mais a relação causal entre os probióticos e o alívio da colite. Assim, há a necessidade de desenvolver um método padronizado para investigar o mecanismo dos probióticos.
Tradicionalmente, esses estudos exigem a inoculação de certos probióticos em camundongos livres de germes7. No entanto, existem algumas limitações laboratoriais no uso de camundongos livres de germes como receptores de probióticos, como a baixa capacidade imunológica e instalações caras livres de germes8. Para evitar essas limitações, um modelo alternativo de colite induzida por DSS foi estabelecido usando camundongos pseudo-livres de germes. O modelo de camundongo pseudo-livre de germes foi estabelecido pela aplicação de antibióticos conforme descrito anteriormente 9,10.
Neste artigo, estabelecemos camundongos pseudo-livres de germes com um coquetel de antibióticos. Também descrevemos em detalhes a metodologia para estabelecer e avaliar modelos de colite em camundongos e investigamos os efeitos dos probióticos no alívio dos sintomas da colite. O protocolo abaixo também fornece os métodos de entrega de probióticos por gavagem.
Protocolo
Todos os procedimentos foram realizados de acordo com as Diretrizes para Cuidados e Uso de Animais de Laboratório da Universidade de Anhui, China, e todos os procedimentos foram aprovados pelo Comitê de Ética Animal da Universidade de Anhui, China (No. IACUC(AHU)-2020-014).
1. Administração de antibióticos
- Prepare um coquetel de antibióticos dissolvendo ampicilina (1 g/L), sulfato de neomicina (1 g/L), metronidazol (0,5 g/L) e vancomicina (0,5 g/L) em 1 L de água potável5.
- Após a dissolução completa, conservar as soluções a 4 °C.
- Coloque as soluções de coquetel de antibióticos em uma garrafa de água. Coloque a garrafa em cima da gaiola do rato.
NOTA: Certifique-se de usar frascos marrons ou embrulhe os frascos com papel alumínio para proteger as soluções antibióticas da luz. - Substitua o coquetel de antibióticos por soluções frescas 2x por semana.
- Deixe os camundongos beberem as soluções de coquetel de antibióticos livremente por 4 semanas.
2. Preparação de água potável DSS e indução de colite
- Para fazer uma solução de sulfato de dextrano sódico (DSS) a 2,5%, dissolva 2,5 g de DSS em 100 mL de água destilada11.
- Substitua a água potável pela solução DSS a 2,5% no grupo de camundongos modelo de colite. Certifique-se de que os camundongos do grupo da colite não tenham acesso a outra água potável. Enquanto isso, trate os camundongos de controle com água destilada sem DSS.
- Camundongos C57BL/6J machos domésticos (peso corporal médio, 20 g ± 2 g; com 7 semanas de idade) em condições livres de patógenos com livre acesso a alimentos e água padrão.
NOTA: Alojar um total de cinco camundongos por gaiola em condições livres de patógenos. - Desenho experimental
NOTA: Os experimentos com animais foram projetados em duas etapas. Cinco camundongos foram incluídos para cada grupo.- Primeira etapa: Para avaliar o efeito positivo de B. cereus no alívio da colite, atribua aleatoriamente os camundongos aos três grupos a seguir: grupo controle (controle), modelo de colite induzida por DSS (DSS), suplementação probiótica de B. cereus para camundongos induzidos por DSS (B. cereus).
- Segunda etapa: Para explorar o papel da microbiota intestinal na regulação dos efeitos probióticos de B. cereus na colite induzida por DSS, classifique aleatoriamente os camundongos nos três grupos a seguir: ABX (controle), ABX (DSS) e ABX (B. cereus + DSS).
- Trate os camundongos do grupo ABX (controle) com solução salina fisiológica.
- Após o tratamento com soluções de coquetel de antibióticos por 4 semanas, deixe os camundongos do grupo ABX (DSS) receberem água contendo 2,5% de DSS por 1 semana e soro fisiológico normal por 2 semanas.
- Após o tratamento com soluções de coquetel antibiótico e água DSS, trate os camundongos do grupo ABX (B. cereus + DSS) diariamente com B. cereus (2 x 108 células) em 200 μL de solução salina fisiológica usando uma cânula intragástrica por 2 semanas.
- Após a administração do coquetel de antibióticos, trate imediatamente os camundongos C57BL / 6 machos com solução de DSS a 2,5% em água potável por 7 dias.
- Registre o peso corporal dos camundongos antes da intervenção DSS como o peso inicial.
3. Quantificação de B. cereus
- Prepare oito tubos de microcentrífuga de 1,5 mL cheios de 900 μL de solução salina normal estéril.
- Pipetar 100 μL de crescimento logarítmico de B. cereus e dissolver em 900 μL de solução salina normal estéril.
- Diluir B . cereus em série usando tubos.
- Colocar 40 μL de cada diluição na respectiva placa de ágar LB marcada com a razão de diluição. Repetir 3x para cada razão de diluição.
- Cultivar as placas numa incubadora a 37 °C a temperatura constante durante 16 h.
- Selecione as placas com ~ 20-70 colônias para contagem. Calcular a concentração bacteriana média de acordo com o múltiplo de diluição das placas seleccionadas.
4. Preparação de B. cereus para gavagem
- Após a quantificação de B. cereus, coletar 1 mL de meio B. cereus contendo 1 x 109 UFC e centrifugar a 8.000 x g por 10 min. Em seguida, lave as células bacterianas 2x com água estéril por centrifugação a 8.000 x g por 10 min e remova o sobrenadante.
- Diluir o B. cereus concentrado com solução salina normal estéril até uma concentração final de 2 x 108 UFC/200 μL4.
- Pipetar repetidamente a diluição para cima e para baixo para obter uma suspensão dispersa de B. cereus .
- Efectuar a quantificação da concentração de B. cereus pela técnica de contagem de placas antes de terminar o método de gavagem.
5. Aplicação de suplementos de B. cereus por gavagem
- Administre as intervenções (probióticos 2 x 108 UFC em 200 μL de solução salina normal) nos camundongos por meio de gavagem oral em um tempo fixo.
- Para administrar B. cereus, conecte uma agulha de gavagem (tamanho da agulha de alimentação: 20 G, 38 mm) a uma seringa de 1 mL. Limpe a parte externa da agulha de gavagem com etanol 70% entre os camundongos e mantenha a aplicação da dose adequada.
- Para conter os ratos, pegue-os pela cauda e segure a pele solta das costas com firmeza com a ponta da cauda fixada entre os dois últimos dedos do manipulador.
- Mantenha os ratos na posição vertical. Em seguida, insira a agulha de gavagem com cuidado e suavemente pela boca no esôfago. Se nenhuma resistência for encontrada nesta etapa, empurre suavemente a agulha para dentro do estômago.
NOTA: Confirme a respiração regular e desimpedida dos camundongos antes da administração do medicamento. - Avance lentamente a agulha e administre a solução de B. cereus . Retire a agulha suavemente após a conclusão da sonda da sonda gás. Solte o mouse e devolva-o à sua gaiola.
6. Determinação do índice de atividade da doença
NOTA: O índice de atividade da doença (DAI) foi calculado diariamente pela perda de peso corporal dos camundongos, sangue oculto nas fezes e consistência das fezes.
- Meça o peso corporal dos camundongos diariamente. Atribua uma pontuação de 0 a 4 a cada camundongo com base na porcentagem de perda de peso corporal (0: 0%, 1: 1% -5%, 2: 6% -10%, 3: 11% -18% e 4: >18%).
- Colete amostras frescas de fezes de cada camundongo. Use um cotonete para estimular a contração do ânus para promover a defecação. Em seguida, colete as amostras de fezes imediatamente após a defecação em um tubo de centrífuga esterilizado.
- Determine o sangue oculto nas fezes pelo papel de teste de sangue oculto nas fezes. Colete 10 mg de amostra de fezes em um aplicador.
- Coloque a amostra no cartão de teste e aplique uma esfregaço fino no cartão. Abra a aba traseira e aplique o revelador sobre o esfregaço.
- Em seguida, marque sangue oculto usando papel de teste de sangue oculto nas fezes dentro de 120 s.
NOTA: Qualquer traço de azul na borda ou na borda do esfregaço é positivo para sangue oculto. Os escores ocultos fecais foram os seguintes: 0: Nenhum, 1: Hemoccult positivo, 2: Leve, 3: Traços de sangue nas fezes e 4: Sangramento macroscópico. - Identifique a consistência das fezes detectando a amostra de fezes11. Atribua uma pontuação de 0 a 4 (0: Normal, 1: Fezes moles, 2: Fezes semiformadas, 3: Fezes líquidas e 4: Diarréia).
7. Coleta de tecidos
- Anestesiar os camundongos injetando 10% de hidrato de cloral (10 mg/kg) no final da primeira e segunda etapas do experimento. Avalie a profundidade da anestesia em camundongos pelo reflexo de retirada da pinça.
- Em seguida, eutanasiar os camundongos por luxação cervical.
- Fixe os camundongos em decúbito dorsal na mesa de operação e abra a cavidade peritoneal.
- Separe todo o cólon cirurgicamente e meça o comprimento com uma régua.
- Em seguida, lave suavemente o cólon com uma seringa de 5 mL cheia de PBS pré-resfriado.
8. Avaliação do dano histológico
- Corte o tecido do cólon em pequenos fragmentos, fixe-os em paraformaldeído a 4% e incorpore-os em parafina usando uma máquina de incorporação de tecidos.
- Em seguida, corte os tecidos embebidos em parafina com um micrótomo para preparar seções de tecido colônico de 4 μm de espessura. Desparafine e desidrate as seções do cólon. Em seguida, core as seções do cólon com hematoxilina e eosina (H & E).
NOTA: As amostras de cólon coradas são avaliadas pelo investigador com um sistema para as seguintes medidas: grau de infiltração de células inflamatórias (Nenhum: 0, Leve: 1, Moderado: 2, Grave: 3), dano à mucosa (Nenhum: 0, Camada mucosa: 1, Submucosa: 2, Muscular e serosa: 3), dano à cripta (Nenhum: 0, 1/3: 1, 2/3: 2, inteiro: 3, total + perda de epitélio: 4), amplitude das lesões (%) (0%: 0, 1%-25%: 1, 26%-50%: 2, 51%-75%: 3, 76%-100%: 4). O escore total de dano histológico é calculado para cada escore individual das medidas acima5. - Deixe dois experimentadores independentes avaliarem (cegos) os escores histológicos da amostra sob um microscópio óptico.
Resultados
Suplementação de B. cereus e colite
O modelo de colite aguda experimental foi induzido pela intervenção DSS na água potável. A Figura 1A mostra o protocolo experimental para administração de B. cereus no modelo de camundongo com colite. A indução do DSS obviamente diminuiu o peso corporal (Figura 1B) e o comprimento do cólon. O efeito aliviador de B. cereus por meio de gavagem oral foi investigado nos camundongos modelo de colite. Em comparação com camundongos com colite induzida por DSS, a perda de peso corporal e o encurtamento do comprimento do cólon (Figura 1C) foram inibidos no grupo de camundongos tratados com B. cereus.
Os escores do DAI são amplamente utilizados para avaliar a progressão da colite. A intervenção DSS aumentou acentuadamente os escores do DAI nos camundongos modelo de colite. No entanto, os escores do DAI no grupo B. cereus foram menores (Figura 1D). Esses dados demonstram que a suplementação de B. cereus melhorou a colite induzida por SDS.
B. cereus e lesão da mucosa colônica
A coloração H&E foi usada para avaliar o dano histopatológico do tecido do cólon (Figura 2A). O tecido do cólon dos camundongos modelo de colite apresentou perda de cripta, dano às células caliciformes, infiltração de células inflamatórias e perda de epitélio. O tratamento com B. cereus melhorou os danos histopatológicos induzidos por DSS.
Além disso, a gravidade da colite foi avaliada quantitativamente de acordo com os escores histopatológicos (Figura 2B). Os escores histopatológicos dos camundongos com colite foram significativamente maiores do que no grupo controle. No entanto, os escores histopatológicos no grupo B. cereus foram significativamente menores do que nos camundongos com colite.
Microbiota intestinal em relação à colite e administração de B. cereus
O papel de B. cereus no alívio da colite foi avaliado usando um modelo de camundongo pseudo-livre de germes, que evitou a interferência de microbiota intestinal complexa e fatores ambientais. Para testar se a microbiota intestinal desempenha um papel no efeito aliviador do B. cereus na colite, o modelo de camundongo pseudo-livre de germes foi desenvolvido administrando antibióticos por 4 semanas antes da intervenção do DSS. Em seguida, B. cereus foi translocado para o intestino de camundongos pseudo-livres de germes por 2 semanas.
Conforme mostrado na Figura 3A, os camundongos foram divididos aleatoriamente em três grupos: o grupo ABX (controle), o grupo ABX (DSS) e o grupo ABX (B. cereus + DSS). Os presentes resultados indicam que a perda de peso corporal, os escores DAI e histopatológicos foram maiores e o comprimento do cólon foi menor no grupo ABX (DSS) em comparação com os camundongos no grupo ABX (controle). A perda de peso corporal (Figura 3B), o comprimento do cólon (Figura 3C), os escores DAI (Figura 3D) e os escores histopatológicos (Figura 3E) não foram estatisticamente diferentes entre os grupos ABX (DSS) e ABX (B. cereus + DSS). Os presentes resultados sugerem indiretamente que a microbiota intestinal desempenha um papel fundamental nos efeitos positivos do B. cereus na colite.

Figura 1: A administração de B. cereus aliviou a colite induzida por sulfato de dextrano sódico (DSS). (A) Diagrama esquemático do procedimento experimental. Os camundongos dos grupos DSS e B. cereus receberam soluções de DSS a 2,5% do dia 1 ao dia 7. O grupo modelo de colite DSS e o grupo B. cereus foram tratados com solução salina normal e 2 x 108 UFC B. cereus em 200 μL de solução salina normal por 14 dias. (B) Mudanças no peso corporal do camundongo. (C) Fotografias representativas dos dois pontos (esquerda) e a quantificação do comprimento dos dois pontos (direita). (D) As pontuações do índice de atividade da doença (DAI) após a administração do DSS. Dados consistentes foram obtidos de três experimentos biologicamente independentes. Os dados são expressos como média ± desvio padrão. *P < 0,05; **P < 0,01; P < 0,001. Clique aqui para ver uma versão maior desta figura.

Figura 2: O tratamento com B. cereus aliviou a lesão do cólon. (A) Cortes histológicos representativos de hematoxilina e eosina (aumento de 200x). (B) Análise histopatológica do escore de cada incidência. Clique aqui para ver uma versão maior desta figura.
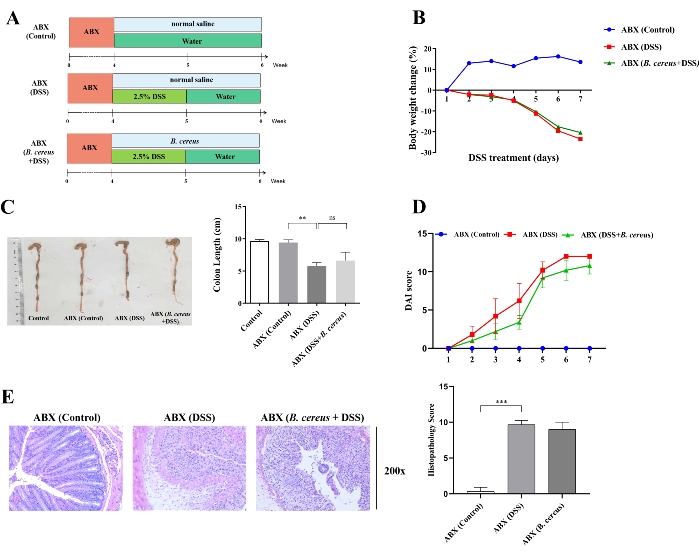
Figura 3: Os efeitos de alívio de B. cereus na colite foram suprimidos após o tratamento com antibióticos. (A) Os camundongos foram induzidos com antibióticos por 4 semanas para limpar a microbiota intestinal antes da intervenção do DSS. Em seguida, os camundongos dos grupos ABX (DSS) e ABX (B. cereus + DSS) foram administrados com solução salina normal e 2 x 108 UFC de células vivas de B. cereus em solução salina normal por 2 semanas, respectivamente. (B) Mudança de peso corporal durante o tratamento com DSS. (C) Morfologia representativa do cólon (esquerda) e comprimento do cólon (direita) em camundongos tratados com ABX. (D) Pontuações do índice de atividade da doença em camundongos tratados com ABX. (E) Imagens coradas com H & E (esquerda) e pontuação histopatológica (direita) em camundongos tratados com ABX. Os dados são apresentados como média ± desvio padrão. *P < 0,05; **P < 0,01; P < 0,001 (testes t não pareados, teste de Kruskal-Wallis e análise de variância de uma via, seguida de um teste post hoc). Clique aqui para ver uma versão maior desta figura.
Discussão
Para usar probióticos em estudos clínicos, é necessário avaliar a eficácia e segurança dos probióticos em modelos animais. Os protocolos fornecidos foram previamente otimizados para avaliar a gravidade da colite. Camundongos tratados com DSS é um modelo de inflamação intestinal, que mimetiza as características clínicas e histológicas características da colite ulcerativa12. Os camundongos modelo de colite aguda são caracterizados por perda de peso corporal, diarréia, sangramento fecal e infiltração de células inflamatórias13. O sistema de pontuação do índice de atividade da doença (DAI) é empregado para avaliação qualitativa do desempenho do modelo de colite. Os escores do DAI são calculados de acordo com o escore de perda de peso corporal, escore de consistência fecal e escore de sangue fecal14. A indução de DSS diminuiu o peso corporal e o comprimento do cólon dos camundongos e aumentou os escores do DAI. No entanto, a perda de peso corporal, o encurtamento do comprimento do cólon e os escores DAI diminuíram significativamente em camundongos com colite tratados com B. cereus. Usando esses métodos experimentais, observou-se que a administração de B. cereus aliviou os sintomas da colite induzida por DSS.
A gravidade da colite dos camundongos também foi avaliada neste estudo de acordo com as mudanças no comprimento do cólon. No final do experimento, os camundongos foram sacrificados e o cólon foi excisado. O comprimento do cólon foi medido do ânus ao ceco. Os tecidos do cólon foram coletados e tratados em formol tamponado a 10%; Em seguida, o sistema de pontuação histopatológica também foi usado para avaliar a gravidade da colite. O escore histopatológico da lesão do cólon foi realizado com base no escore de inflamação, escore de dano da mucosa, escore de dano da cripta e escore de amplitude de lesões15.
Camundongos com colite induzida por DSS apresentaram lesão da mucosa colônica, evidenciada pela depleção de células caliciformes, erosão epitelial e infiltração de células inflamatórias16. Além disso, esses danos histológicos em camundongos com colite foram associados a características clínicas, como perda de peso corporal, encurtamento do cólon e sangramento retal. No entanto, a aparência histológica do cólon foi melhorada obviamente pela administração de B. cereus .
Em seguida, os protocolos experimentais para administração oral de antibióticos em camundongos foram aplicados para avaliar o papel da microbiota intestinal na melhora da colite. A depleção da microbiota intestinal mediada por antibióticos em animais é uma alternativa aos camundongos livres de germes para investigar os efeitos dependentes da microbiota intestinal17. Os camundongos pseudo-livres de germes oferecem um modelo de camundongo mais receptivo e econômico para estudar o mecanismo. O protocolo do coquetel de antibióticos incluiu ampicilina, vancomicina, neomicina e metronidazol, que fornecem atividade bactericida contra um espectro completo de bactérias9. Nossos resultados indicaram que o papel aliviador de B. cereus contra a colite dependia da microbiota intestinal, conforme comprovado pelo tratamento com antibióticos.
Em resumo, descrevemos protocolos em detalhes para analisar o dano tecidual durante a colite por DSS e o tratamento antibiótico oral de camundongos para avaliar o papel dos probióticos na melhora da colite. As evidências obtidas de experimentos com camundongos com colite induzida por DSS apóiam o estabelecimento da exploração dos efeitos protetores dos probióticos. Além disso, camundongos pseudo-livres de germes são econômicos e confiáveis para manipular a microbiota intestinal e investigar o papel dos microbióticos intestinais na colite. É importante enfatizar que esses protocolos experimentais precisam ser otimizados e podem ser ajustados dependendo dos diferentes propósitos experimentais.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este estudo foi apoiado, pelo menos em parte, pela Fundação Nacional de Ciências Naturais da China (KS, concessão nº 32000081), a Fundação de Ciências Naturais da Província de Anhui (KS, concessão nº 1908085QC120), o Programa de Projeto Aberto do Laboratório Estadual de Ciência e Tecnologia de Alimentos, Universidade de Jiangnan (KS, concessão nº SKLF-KF-201920), a Fundação de Ciências Naturais das Instituições de Ensino Superior de Anhui da China (KS, conceder nº. KJ2019A0040), a Fundação de Pesquisa Científica de Doutorado da Universidade de Anhui (KS, concessão nº J01003316), a Fundação Nacional de Ciências Naturais da China (YW, concessão nº 31770066, 31470218), o Fundo Aberto para Construção de Disciplinas, Instituto de Ciências Físicas e Tecnologia da Informação da Universidade de Anhui (YW) e o Programa de Talentos Excepcionais da Universidade de Anhui, China (YW).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.01 M PBS (powder, pH7.2–7.4) | Solarbio | P1010-2L | |
| Absolute ethyl alcohol | Hushi | 64-17-5 | |
| Acid alcohol fsat differentiation solution | Beyotime | No.C0163S | |
| Agar | Sangon Biotech | 9002-18-0 | |
| Ampicillin | Solarbio | 69-53-4 | Store at 2–8 °C |
| Anaerobic incubator | Long Yue | LA1-3T | |
| Dextran sulfate sodium salt colitis grade | MP Biomedicals | 160110 | |
| Electrothermal incubator | SANFA | HP-050A | |
| General purpose tissue fixator | biosharp | BL539A | |
| Glycerinum | Hushi | 56-81-5 | |
| Hematoxylin and eosin staining kit | Beyotime | No.C0105 | |
| Kisser's Mounting Medium | Beyotime | No.C0181 | |
| Metronidazole | Solarbio | 443-48-1 | Store at 2–8 °C |
| Neomyein sulfate | Solarbio | 1405-10-3 | Store at 2–8 °C |
| Oscillating incubator | Shanghai Zhichu | ZQLY-180S | |
| Sodium chloride | Sangon Biotech | 7647-14-5 | |
| Stool occult blood test paper | Baso | BA2020B | |
| Tryptone | OXOID | 2285856 | |
| Vancomycin | Solarbio | 1404-93-9 | Store at 2–8 °C |
| Xylene | Hushi | 1330-20-7 | |
| Yeast extract | Sangon Biotech | 8013-01-2 |
Referências
- Pittayanon, R., et al. Differences in gut microbiota in patients with vs without inflammatory bowel diseases: A systematic review. Gastroenterology. 158 (4), 960-946 (2020).
- Kuehn, F., Hodin, R. A. Impact of modern drug therapy on surgery: Ulcerative colitis. Visceral Medicine. 34 (6), 426-431 (2018).
- Harmand, P. -. O., Solassol, J. Thiopurine drugs in the treatment of ulcerative colitis: Identification of a novel deleterious mutation in TPMT. Genes. 11 (10), 1212 (2020).
- Sheng, K., et al. Synbiotic supplementation containing Bifidobacterium infantis and xylooligosaccharides alleviates dextran sulfate sodium-induced ulcerative colitis. Food & Function. 11 (5), 3964-3974 (2020).
- Sheng, K., et al. Probiotic Bacillus cereus alleviates dextran sulfate sodium-induced colitis in mice through improvement of the intestinal barrier function, anti-inflammation, and gut microbiota modulation. Journal of Agricultural and Food Chemistry. 69 (49), 14810-14823 (2021).
- Wei, L., et al. PRKAR2A deficiency protects mice from experimental colitis by increasing IFN-stimulated gene expression and modulating the intestinal microbiota. Mucosal Immunology. 14 (6), 1282-1294 (2021).
- Souza, E. L. S., et al. Beneficial effects resulting from oral administration of Escherichia coli Nissle 1917 on a chronic colitis model. Beneficial Microbes. 11 (8), 779-790 (2020).
- Trinder, M., Daisley, B. A., Dube, J. S., Reid, G. Drosophila melanogaster as a high-throughput model for host-microbiota interactions. Frontiers in Microbiology. 8, 751 (2017).
- Liang, W., et al. Colonization potential to reconstitute a microbe community in pseudo germ-free mice after fecal microbe transplant from equol producer. Frontiers in Microbiology. 11, 1221 (2020).
- Hernandez-Chirlaque, C., et al. Germ-free and antibiotic-treated mice are highly susceptible to epithelial injury in DSS colitis. Journal of Crohns & Colitis. 10 (11), 1324-1335 (2016).
- Sheng, K., et al. Grape seed proanthocyanidin extract ameliorates dextran sulfate sodium-induced colitis through intestinal barrier improvement, oxidative stress reduction, and inflammatory cytokines and gut microbiota modulation. Food & Function. 11 (9), 7817-7829 (2020).
- Xu, X., et al. Histological and ultrastructural changes of the colon in dextran sodium sulfate-induced mouse colitis. Experimental and Therapeutic Medicine. 20 (3), 1987-1994 (2020).
- Zheng, L., et al. Jianpi Qingchang decoction alleviates ulcerative colitis by inhibiting nuclear factor-kappa B activation. World Journal of Gastroenterology. 23 (7), 1180-1188 (2017).
- Gao, X., et al. Symptoms of anxiety/depression is associated with more aggressive inflammatory bowel disease. Scientific Reports. 11, 1440 (2021).
- Thippeswamy, B. S., et al. Protective effect of embelin against acetic acid induced ulcerative colitis in rats. European Journal of Pharmacology. 654 (1), 100-105 (2011).
- Sakai, S., et al. Astaxanthin, a xanthophyll carotenoid, prevents development of dextran sulphate sodium-induced murine colitis. Journal of Clinical Biochemistry and Nutrition. 64 (1), 66-72 (2019).
- Li, S., et al. Role of gut microbiota in the anti-colitic effects of anthocyanin-containing potatoes. Molecular Nutrition & Food Research. 65 (24), 2100152 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados