16.6 : Cálculos de Titulação: Ácido Forte - Base Forte
Cálculo do pH para Soluções de Titulação: Ácido Forte/Base Forte
É feita uma titulação para 25,00 mL de HCl a 0,100 M (ácido forte) com 0,100 M da base forte NaOH. O pH a diferentes volumes de solução de base adicionada pode ser calculado da seguinte forma:
(a) Volume de titulante = 0 mL. O pH da solução deve-se à ionização ácida do HCl. Como este é um ácido forte, a ionização é completa e a molaridade do ião hidrónio é 0,100 M. O pH da solução é então:

(b) Volume de titulante = 12,50 mL. Uma vez que a amostra de ácido e o titulante básico são ambos monopróticos e igualmente concentrados, esta adição de titulante envolve uma quantidade de base inferior à estequiométrica, sendo assim completamente consumida por reação com o excesso de ácido na amostra. A concentração de ácido restante é calculada subtraindo a quantidade consumida da quantidade inicial e dividindo em seguida pelo volume da solução:

(c) Volume de titulante = 25,00 mL. Esta adição de titulante envolve uma quantidade estequiométrica de base (o ponto de equivalência), pelo que apenas os produtos da reação de neutralização estão em solução (água e NaCl). Nem o catião nem o anião deste sal são submetidos à ionização ácido-base; o único processo que gera iões hidrónio é a autoprotólise da água. A solução é neutra, tendo um pH de 7,00.
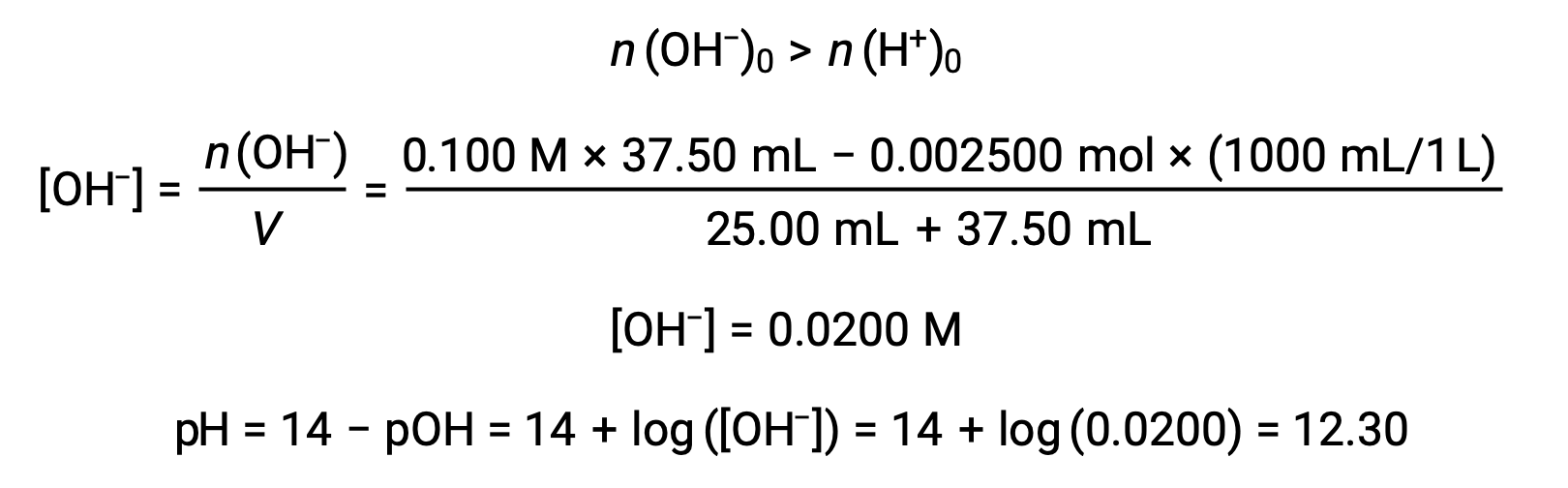
(d) Volume de titulante = 37,50 mL. Isto envolve a adição de titulante em excesso relativo ao ponto de equivalência. O pH da solução é então calculado utilizando a concentração de iões hidróxido:
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.
Do Capítulo 16:

Now Playing
16.6 : Cálculos de Titulação: Ácido Forte - Base Forte
Equilíbrio Ácido-Base e Solubilidade
29.2K Visualizações

16.1 : Efeito de Íon Comum
Equilíbrio Ácido-Base e Solubilidade
41.2K Visualizações

16.2 : Tampões
Equilíbrio Ácido-Base e Solubilidade
163.7K Visualizações

16.3 : Equação de Henderson-Hasselbalch
Equilíbrio Ácido-Base e Solubilidade
68.4K Visualizações

16.4 : Cálculo de Alterações de pH em uma Solução Tampão
Equilíbrio Ácido-Base e Solubilidade
52.9K Visualizações

16.5 : Eficácia dos Tampões
Equilíbrio Ácido-Base e Solubilidade
48.7K Visualizações

16.7 : Cálculos de Titulação: Ácido Fraco - Base Forte
Equilíbrio Ácido-Base e Solubilidade
43.9K Visualizações

16.8 : Indicadores
Equilíbrio Ácido-Base e Solubilidade
48.1K Visualizações

16.9 : Titulação de um Ácido Poliprótico
Equilíbrio Ácido-Base e Solubilidade
95.9K Visualizações

16.10 : Equilíbrio de Solubilidade
Equilíbrio Ácido-Base e Solubilidade
52.2K Visualizações

16.11 : Fatores que Afetam a Solubilidade
Equilíbrio Ácido-Base e Solubilidade
33.2K Visualizações

16.12 : Formação de Íons Complexos
Equilíbrio Ácido-Base e Solubilidade
23.4K Visualizações

16.13 : Precipitação de Íons
Equilíbrio Ácido-Base e Solubilidade
27.7K Visualizações

16.14 : Análise Qualitativa
Equilíbrio Ácido-Base e Solubilidade
22.0K Visualizações

16.15 : Curvas de Titulação Ácido-Base
Equilíbrio Ácido-Base e Solubilidade
126.9K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados