Method Article
돼지의 요추 척추 카테터 삽입을 위한 수술 기법으로 터미널 설정에서 종골낭에 지속적으로 접근할 수 있습니다.
요약
우리는 말기 연구 프로토콜의 일환으로 3개월 된 덴마크 랜드레이스 돼지에 L4-L5 수준의 요추 척추 카테터를 삽입하여 종골낭에서 지속적인 주입 또는 CSF 샘플링을 가능하게 하는 기술을 제시합니다.
초록
돼지는 돼지와 인간의 중추신경계(CNS) 사이의 해부학적, 생리학적 유사성으로 인해 약리학적 중추신경계 연구를 위한 대형 동물 모델로 점점 더 많이 사용되고 있습니다. 그러나 기존의 요추 천자 기술로 대형 돼지 품종에서 뇌척수액(CSF)에 접근하는 것은 척추돌기의 비스듬한 방향과 제한된 층간 공간으로 인해 어려울 수 있습니다. 따라서, 돼지에서 L4/L5 수준의 지속적인 CSF 샘플링을 위해 요추 척추 카테터를 삽입하는 개복 수술 절차가 이 연구에서 자세히 설명되어 있습니다. 돼지의 위치를 잡고 해부학적 랜드마크를 확인한 후, 가시돌기를 노출시키기 위해 등쪽 정중선 수술을 절개합니다. 내측 바늘을 전진시킴으로써, 척추 카테터는 척추의 뼈 구조는 그대로 유지하면서 척추관의 종골낭 내부에 삽입됩니다. 이 방법을 사용하면 출혈 또는 CSF 누출을 최소화하면서 돼지 낭으로 지속적으로 주입하거나 시료를 채취할 수 있습니다. 이 절차는 간단하고 시간 효율적이며 다양한 실험 설정에서 재현 가능하여 약동학 연구, 수술 교육 및 척수 손상 모델을 포함한 다양한 전임상 연구에 상당한 잠재력을 제공합니다.
서문
동물 모델은 윤리적 또는 실제적 한계로 인해 질병을 조사하거나 수술 방법을 테스트하기 위해 인간 피험자를 사용할 수 없을 때 필수적입니다. 설치류는 저렴한 비용으로 인해 일반적으로 사용되지만, 인간과의 상당한 차이로 인해 번역 관련성이 제한됩니다1. 그러나 돼지는 설치류에 비해 인간과 해부학적, 생리학적으로 유사하다는 점을 포함하여 몇 가지 이점을 제공합니다 - 특히 CNS 연구의 맥락에서그렇습니다 1,2. 개 모델은 역사적으로 중추신경계 연구를 위한 실험 모델로 사용되었지만, 최근 몇 년 동안 윤리적 고려로 인해 개 사용이 제한되었습니다3. 더욱이, 돼지 장기는 인간과 비슷한 크기로 인해 외과 연구 및 시술 훈련에 대한 활용도가 높아진다4. 돼지 중추신경계와 척추는 인간의 것과 매우 유사하며, 뇌와 척수 구조 및 기능에서 유사성이 있습니다 1,5,6. 중요한 것은, 돼지의 척추와 척추관의 치수는 외과적 절차적 훈련(surgical procedural training)9,10, 약물 침투(drug penetration)11,12,13, 척수 손상(spinal cord injury)14을 포함한 다양한 전임상 연구(7,8)에 적합하다는 것이다.
돼지 모델에서 CSF에 대한 액세스는 많은 실험 설정에서 매우 중요합니다. 요추 천자는 단일 CSF 샘플링 또는 척추내 약물 투여를 위한 방법을 제공하지만, 반복적인 요추 천자는 실용적이지 않습니다. 그들은 척추 내 혈종, 신경 손상 및 혈액에 의한 CSF 오염의 잠재적 위험을 제기합니다. 인간 환자의 경우, 척추 마이크로카테터는 동맥류성 지주막하 출혈 시 지속적인 요추 CSF 배액에 일반적으로 사용되며, 크기 유사성으로 인해 돼지의 연속 CSF 샘플링에도 동일하게 적합해야 합니다. 그러나 돼지의 종별 해부학적 차이로 인해 CSF 접근에 고유한 문제가 있습니다. 예를 들어, 겹치는 층판(laminae), 골화된 인대(ossified ligaments), 풍부한 경막외 지방 조직(epidous adipose tissue)의 존재로 인해 기존의 경피적 요추 천자 기법의 신뢰성이 떨어진다15. 괴팅겐 미니피그에서는 최소 침습적 경피적 방법이 사용되어 연속 CSF 샘플링이 가능합니다16. 이 방법은 요추 추간 공간의 수동 식별에 의존하며, 카테터 삽입 자체는 도입자의 시각화 없이 수행됩니다. 그러나 이 기법은 척추 크기, 가시돌기, 경막외 지방 조직의 양에 대한 해부학적 변화로 인해 경피외 카테터 삽입이 더 어렵기 때문에 몸집이 큰 돼지에게는 적합하지 않다15. 따라서 신뢰할 수 있는 카테터 배치를 보장하기 위해 더 큰 돼지 모델에서 척추 노출을 포함하는 보다 침습적인 방법이 필요할 수 있습니다.
이 원고의 목적은 L4/L5 수준에서 척추 카테터를 돼지 상쇄낭에 삽입하는 수술 절차를 설명하는 것입니다. 이 절차에는 피험자의 위치 지정, 해부학적 랜드마크를 기반으로 수술 절개 계획, 카테터 삽입 전에 척추의 뒤쪽 뼈 구조에 접근하는 것이 포함됩니다.
프로토콜
피험자는 덴마크 동물실험검사국(면허 번호 2020-15-0201-00401)의 승인 하에 현지 규정에 따라 수용되었습니다. 주제 정보: 국내 돼지, 암컷, 약 40kg, 생후 3개월.
1. 피험자 주거 및 수술 전 금식
- 적절한 적응을 보장하고 스트레스를 줄이기 위해 절차 전 최소 14일 동안 승인된 주거 펜에서 12시간 명/어두움 주기로 그룹별로 피험자를 수용17.
- 피험자가 역류의 위험을 줄이기 위해 계획된 마취 전 12시간 동안 음식 금단 요법을 받았는지 확인하십시오. 피험자의 식단에 알팔파 또는 다른 종류의 건초가 포함되어 있는 경우, 위 배출 시간을 더 지연시킬 수 있으므로 시술 2-3일 전에 식단에서 제외해야 한다18.
2. 마취 및 모니터링
- 케타민 6.25mg/mL, 졸라제팜 6.25mg/mL, 틸레타민 6.25mg/mL, 부토르판올 1.25mg/mL 및 자일라진 6.25mg/mL(Zoletil)의 혼합물을 2mL/10kg 체중의 근육 주사로 피험자를 마취합니다.
- 체온 조절을 돕기 위해 피험자를 가열 담요 위에 누운 자세로 놓습니다.
- 6.5 튜브19 크기로 피험자를 삽관하고, 비가습 공기, 8-10 mL/kg의 일회 호흡량, 6.0 kPa의 호기말 CO2 농도에 따라 16-22 호흡/분의 호흡수로 기계적으로 환기시킨다<.
알림: CO2 판독값은 튜브의 올바른 기관 내 위치를 확인합니다. - 3%-4% 기화된 세보플루란을 흡입하여 마취를 유지한다18.
- 마취 중 건조를 피하기 위해 안과 연고를 양측으로 조심스럽게 바르십시오.
- 10분마다 근육 이완과 손바닥 움직임의 부재를 확인하여 충분한 마취 정도를 확인하십시오18.
- 체온계가 있는 방광 카테터를 요도19 를 통해 피험자의 방광에 삽입하여 체온을 모니터링하고 적절한 카테터 백에 소변을 수집합니다.
- 경피적 천자에 의해 적절한 표재성 귀 정맥에 말초 정맥 카테터를 삽입하고 연속 식염수(NaCl, 0.9%) 주입, 약물 주입 및 연구 종료 시 안락사에 사용합니다.
- 경피적 천자를 통해 오른쪽 대퇴동맥에 대퇴동맥 카테터(6 Fr 시트)를 삽입합니다. 지속적인 침습적 혈압 모니터링을 위해 이 액세스를 사용합니다.
- 시술 내내 5분마다 피험자의 활력 징후를 모니터링합니다.
참고: 활력 징후에는 맥박, 지속적인 침습성 동맥 혈압, 방광 내 온도 및 호기말 CO2 농도가 포함됩니다.
3. 동물 포지셔닝
- 피험자를 수술대 중앙에 엎드린 자세로 놓습니다. 척추측만증을 피하기 위해 피험자의 척추가 곧게 펴지도록 하십시오.
- 척추의 요추 부분 아래에 모래 주머니를 놓아 얇은 판 사이의 각도를 증가시킵니다.
- 트리머로 수술 부위의 수염을 면도합니다.
- 요오드 용액을 원심 패턴으로 수술 부위에 도포합니다. 수술 부위 전체가 덮일 때까지 이 과정을 반복합니다.
- 피사체를 약간 기울여 똑바로 세웁니다.
4. 수술 장비의 준비
- 재료표에 나열된 수술 장비를 준비합니다.
5. 주요 해부학적 랜드마크 식별
- 피험자의 요추 양쪽에 있는 장골능을 확인하고 천골이 식별될 때까지 윤곽을 내측으로 따라갑니다(그림 1).
- 천골의 두개골 측면과 L6의 가시돌기 사이의 정중선에서 추간 공간을 확인합니다.
- L6, L5 및 L4의 가시돌기를 식별합니다(그림 1, 그림 2).
6. 가시돌기 노출시키기
- 24번 메스를 사용하여 L4-L6의 가시돌기를 따라 정중선을 절개하여 피부와 피하 부위를 절개합니다.
- 단극성을 사용하여 표재성 정맥과 세동맥에서 발생하는 작은 출혈을 소작합니다.
- 외과 늪으로 피를 닦아내고 활동성 출혈을 확인하십시오. 그에 따라 모노폴라를 사용하십시오.
참고: 혈종을 피하기 위해 경미한 출혈이라도 멈추는 것이 중요합니다. - 수술용 견인기를 삽입하고 개구부를 확장합니다.
- 척추돌기에 대한 등쪽 상척추 인대를 확인합니다.
- 약 1cm의 가시돌기가 보일 때까지 가시돌기의 측면을 따라 단극을 사용하여 절개 부위를 점차적으로 확장합니다(그림 3).
참고: 시술을 하는 사람이 오른손잡이인 경우, 나중에 도입자의 삽입을 용이하게 하기 위해 가시돌기의 피험자의 오른쪽 측면 측면을 따르는 것을 고려해야 합니다. - L4/L5 사이의 척추간 인대를 확인합니다(그림 3).
- 활성 출혈을 확인하고 그에 따라 소작을 위해 단극을 적용합니다.
7. 테칼 주머니에 대한 접근
- 수동 촉진을 통해 가시돌기의 얇은 판 사이의 L4/L5 추간 공간을 확인합니다.
- L4/L5 층내 공간을 향해 기울어진 두개골 방향으로 비스듬히 베벨과 내강이 있는 도입기를 배치합니다(그림 2, 그림 4, 그림 5).
- 도입기가 30° 수평 및 45° 두개골 경사로 유지되는지 확인합니다(그림 5).
알림: L4/L5 사이의 층내 공간을 조준합니다. - 부드러운 저항이 느껴질 때까지 점차적으로 도입자를 전진시킵니다. 이것은 flavum의 인대를 나타냅니다.
참고: 무딘 저항의 감각은 도입자가 가시 돌기에 의해 멈췄다는 것을 나타냅니다. 이 경우 도입기를 1cm 후퇴시키고 약간 다른 경사로 다시 전진합니다. - 단단하면서도 매우 조심스럽게 압력을 가하고 갑작스런 저항 손실이 느껴질 때까지 플라범 인대를 통해 도입부를 밀리미터 단위로 전진시킵니다.
주석: 피험자가 요추 근육 조직이나 뒷다리에서 운동 반사 신경을 보인다면, 이는 신경근에 직접 접촉했기 때문이지 마취가 불충분하기 때문이 아니다. - 눈에 보이는 CSF 흐름을 확인하기 위해 투관침을 제거하여 주입자의 각 진행을 따릅니다.
- 주입자가 인대(ligamentum flavum)를 통과한 후 내폐물(CSF)의 흐름을 육안으로 확인하여 척추관 내 내도입자의 올바른 위치를 확인합니다.
참고: CSF의 자발적 흐름은 느릴 수 있습니다. 주입자에 멸균 식염수를 채우고 맥동을 관찰하여 신속하게 확인할 수 있습니다. - 카테터를 준비하는 동안 CSF의 과도한 손실을 방지하기 위해 투관침을 주입기에 다시 삽입합니다.
8. 종골낭에 카테터 삽입
- 가이드와이어를 카테터에 삽입합니다.
- 도입기에서 투관침을 제거합니다.
- 부드러운 저항이 느껴질 때까지 가이드와이어가 포함된 카테터를 도입기에 삽입합니다.
- 도입부에서 원위 방향으로 5cm를 측정하고 수술 마커로 표시를 설정합니다.
- 카테터가 종골낭 안으로 전진할 때 이전에 측정된 표시가 도입기에 도달할 때까지 부드럽지만 단단한 압력을 가합니다.
주석: 골수 반사 작용으로 인해, 피험자는 충분히 마취되었음에도 불구하고 경련을 일으키거나 움직일 수 있다. - 카테터를 제자리에 유지하면서 주입기를 조심스럽게 집어넣습니다.
알림: 유도체가 제거될 때 잘못된 위치를 방지하기 위해 피부 위에서 카테터가 보이는 즉시 카테터를 단단히 잡으십시오. - 피부 수준에서 카테터를 단단히 잡은 상태에서 가이드와이어를 제거합니다(그림 6).
- 2mL 일회용 플라스틱 주사기를 카테터에 부착합니다.
- 카테터에서 흡인 CSF로 척추관 내 위치를 확인합니다.
- 주사기에 CSF가 없는 경우 카테터를 몇 밀리미터 부드럽게 집어넣어 개통성을 회복합니다.
- 척추 카테터를 수술용 견인기에 고정하고 테이프로 피부를 고정하여 잘못된 배치를 방지합니다.
9. 지질다당류의 투여
- 400μg의 대장균 지질다당류(LPS)(OH:143)를 중심 정맥판에 투여합니다.
- 타이머를 시작합니다.
10. CSF 샘플링
- 다음 24시간 동안 매시간 CSF 샘플을 채취하여 총 백혈구 수, CSF-알부민 및 CSF IgG를 측정합니다. 각 샘플에서 최대 0.5mL의 CSF를 추출합니다.
11. 안락사
- 말초 정맥 카테터를 통해 펜토바르비탈(50mg/kg) 볼루스를 투여합니다.
- 심장 마비를 확인하기 위해 호흡기에서 맥박, 혈압 및 호기말 CO2 농도 곡선을 평평하게 관찰합니다.
결과
돼지의 엎드린 자세는 요추에 대한 외과적 접근을 최적화합니다. 지지하는 모래주머니를 사용하면 인접한 요추돌기 사이의 각도가 증가하여 척추관에 대한 접근이 향상됩니다.
본 연구는 E. coli 지질다당류를 뇌실내 접종한 후 CSF 구획 내 염증 반응을 조사하는 것을 목표로 했습니다. 총 10마리의 돼지가 이 시술을 받았고, 후속 CSF 분석에서 평균 총 CSF 백혈구가 0시간에 30 x 106/L(범위 17-39)에서 12시간에 19,720 x 106/L(11,353-30,546)로 증가하고, CSF 알부민 0.05g/L(0.03-0.07)이 0h에서 0.15g/L(0.14-0.17)로 증가하여 뇌 염증이 확인되고 모든 척추 카테터가 올바르게 배치되었음을 확인했습니다. 제시된 기술(그림 7). 본 연구에서는 주요 해부학적 랜드마크, 특히 장골능, 천골 및 L4, L5 및 L6의 가시돌기를 사용하여 절개 전에 척추 정중선을 정확하게 찾았습니다(그림 1). 피부와 피하 조직을 절개한 후 척추상 인대와 L4, L5, L6의 가시돌기를 노출시켜 해부학적 정중선을 확인했습니다(그림 2). 가시돌기의 얇은 판을 지속적으로 해부하고 노출시킴으로써 수동 촉진으로 L4/L5, L5/L6 및 L6/S1 사이의 추간 공간을 식별할 수 있었습니다. 이러한 공간은 아래에 있는 척추관과 가깝기 때문에 해부학적 랜드마크로 특히 적합했습니다(그림 3).
30° 수평 및 45° 두개골 경사에서 주입자를 점진적으로 삽입하면 뇌척수액의 눈에 보이는 자발적 흐름으로 확인되어 종골낭에 성공적으로 진입할 수 있었습니다. 도입자의 경사가 두개골을 향하도록 하면 카테터 삽입 후 부드러운 카테터 삽입이 가능했습니다. 가이드와이어가 제거되면 CSF의 흡인에 의해 카테터의 적절한 배치가 검증되었습니다. 시술의 전반적인 성공 여부는 (a) 절개 부위 중 큰 출혈이 발생하지 않았는지, (b) 주입자가 척추관에 들어갔을 때 혈액이 없었는지, (c) 수술 부위에서 CSF 누출이 없었는지, (d) 카테터에서 CSF를 반복적으로 흡인할 수 있었는지에 따라 결정되었습니다.
절개 초기 단계에서는 혈관이 잘 형성된 조직의 특성으로 인해 경미한 출혈이 예상되어야 합니다. 더 작은 동맥이 자주 발견되어 소작의 필요성이 강조되었습니다. 수술용 견인기는 또한 압력을 가하고 지혈을 달성하는 데 사용되었습니다. 더 깊은 절개 부위에서 작은 추간 정맥이 가끔 발견되었는데, 이는 위치 때문에 제어하기 어려울 수 있습니다. 이 부위에 압력을 가하거나 소작하기 어렵기 때문에 이러한 정맥 출혈을 피하기 위해서는 신중한 수술 기술이 중요합니다. 카테터는 장기간 삽입하기 위한 것이었기 때문에 혈종 형성을 피하기 위해 출혈을 예방하는 것이 필수적이었습니다. 이러한 정맥 출혈이 있는 경우, 국소적인 직접 압력으로 가해지는 솜질체를 통해 지혈이 이루어질 수 있습니다.
척추관의 경막외 공간의 무결성은 카테터를 둘러싼 조직에서 CSF 누출을 검사하여 평가되었습니다. 누출은 조직에 물과 같은 액체가 축적된 것처럼 보일 것입니다. 이 경우, 시술 중 또는 시술 후에 CSF 누출이 관찰되지 않았기 때문에 카테터를 둘러싼 경막이 손상되지 않은 것으로 확인되었습니다(그림 6). 마지막으로, 카테터를 통한 일관된 CSF 흡인은 종골 주머니의 요추 수조 내 올바른 배치를 추가로 검증했습니다.
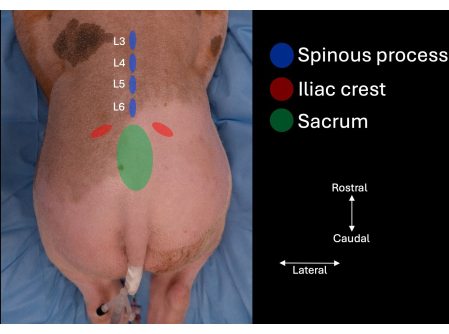
그림 1: 수동 촉진으로 식별된 해부학적 랜드마크가 있는 돼지의 요추 사진. 천골, 장골능, L4, L5, L6의 가시돌기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
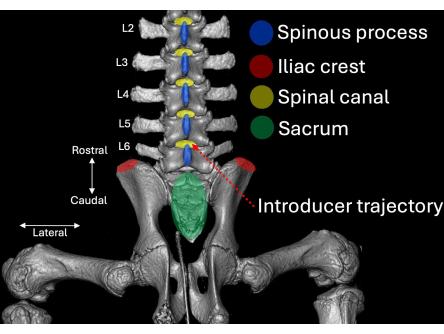
그림 2: 후방 관점에서 시각화한 돼지 척추의 요추 측면에 대한 3차원 컴퓨터 단층 촬영 스캔. 해부학적 랜드마크는 파란색(spinous process), 빨간색(iliac crests) 및 녹색(sacrum)으로 강조 표시되며 척추관(노란색)과의 관계와 함께 표시됩니다. 도입부의 삽입 경로는 빨간색 점선으로 강조 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
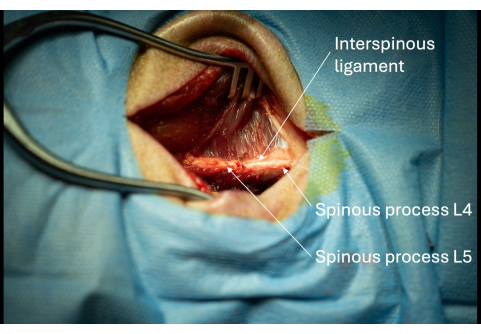
그림 3: 인접한 척추간 인대가 있는 L5 및 L6의 노출된 가시돌기의 그림. 이러한 가시돌기의 존재는 수술 구멍의 정확한 해부학적 위치를 확인합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
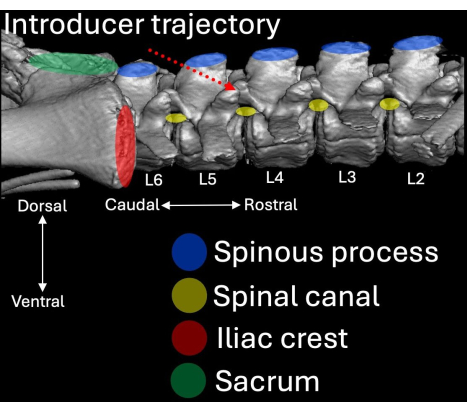
그림 4: 측면 관점에서 시각화된 돼지 척추의 요추 측면에 대한 3차원 컴퓨터 단층 촬영 스캔. 해부학적 랜드마크는 파란색(spinous process), 빨간색(iliac crests) 및 녹색(sacrum)으로 강조 표시되며 척추관(노란색)과의 관계와 함께 표시됩니다. 도입부의 삽입 경로는 빨간색 점선으로 강조 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 후측근에서 본 L4/L5 층간 공간을 향해 기울어진 도입부의 올바른 위치 사진. 도입기는 인대가 관통될 때까지 밀리미터 단위로 점차적으로 전진해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
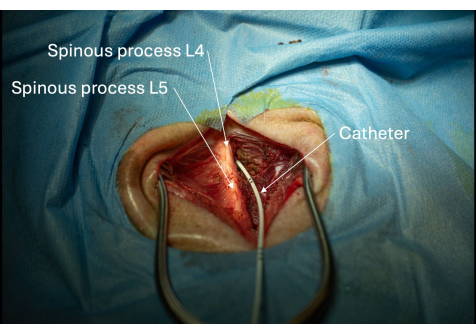
그림 6: L4/L5 층간 공간을 통해 척추관에 삽입된 카테터의 그림. 척추관 내 카테터의 배치는 CSF를 반복적으로 흡인할 수 있는지 확인합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 0시간, 12시간 및 24시간에 측정된 뇌실 내 LPS 접종 후 총 CSF 백혈구 수(주황색) 및 CSF 알부민(파란색)의 시간 농도 그래프. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
돼지에서 지속적인 CSF 샘플링을 위한 요추 카테터 삽입에 대한 입증된 절차에는 몇 가지 중요한 단계가 포함됩니다. 첫째, 성공적인 카테터 삽입을 위한 최적의 조건을 보장하기 위해 올바른 척추 수준이 노출되어야 합니다. 돼지 척수는 인간에 비해 꼬리 방향으로 더 뻗어 S2-S3 레벨15에 도달하며, 이는 L1-L2 레벨20에서 끝나는 인간 원추 수질과 대조됩니다. 결과적으로, CSF 샘플링을 위해 요추 수조에 접근하는 것은 돼지에서 더 까다로운데, 특히 척수가 척수 내 공간을 더 많이 차지하는 요추 수치가 높을 경우 더욱 그렇습니다. 본 연구의 경험에 비추어 볼 때, 척수가 이 분절에서 척추관의 약간 더 작은 부분을 차지하기 때문에 L4/L5 또는 L5/L6 수치는 카테터 삽입에 적합한 절편이다21.
여기에 제시된 수술적 접근법은 괴팅겐 미니피그에서 경피적 요추 천자를 활용한 Bergadano 등이 개발한 최소 침습적 CSF 채취 모델과 같은 덜 침습적인 방법과 대조를 이룬다16. 그들의 기술에서, 요추의 추간 공간은 수동 촉진을 통해 식별되고 45° 수평 경사에서 도입부 삽입을 목표로 합니다. 경막외 공간 내에서 올바른 주입자 배치의 확인은 카테터 삽입 중 저항 손실에 대한 인식에 달려 있습니다. 최소 침습 기법은 조직 손상을 줄이고 회복 시간을 단축하는 이점을 제공하지만, 덴마크 랜드레이스와 같은 대형 돼지 품종에서는 잠재적인 한계가 있습니다. 예를 들어, Pleticha 등은 겹치는 층, 골화된 인대, 큰 돼지의 경막외 지방의 풍부함과 같은 몇 가지 해부학적 특징을 확인했는데, 이는 이미징 안내 없이는 요추 천자를 더 신뢰할 수 없게 만듭니다15. 결과적으로 여러 번의 펑크 시도가 필요할 수 있으며, 이는 CSF 샘플의 출혈, CSF 누출 및 혈액 오염의 위험을 증가시킵니다.
이에 비해, Pleticha 등은 이러한 해부학적 문제를 극복하기 위해 CT 유도 측면 요추 천자 기법을 성공적으로 사용하여 대형 돼지에서 정확한 척추 내 접근을 달성했습니다15. 이미징 지침을 활용하는 이유는 수동 촉진법이 필요한 재현성을 가진 해부학적 랜드마크를 식별할 수 없다는 것입니다. 결과적으로, 정확한 해부학적 식별을 위해 이미지 안내(예: 초음파 또는 형광투시법)가 실제로 필요합니다15,22. Pleticha 등이 제시한 이 측면 방법은 이미징 기능을 갖춘 시설에서 상당한 이점을 제공하지만 CT 장비의 필요성으로 인해 모든 실험실 환경에서 실현 가능하지 않을 수 있습니다. 여기에 설명된 수술 방법은 더 침습적이기는 하지만 CT 영상에 접근하지 않고도 실험실에서 쉽게 구현할 수 있는 실용적인 대안을 제공합니다. 이 접근 방식은 가시돌기와 추간 공간을 노출시킴으로써 요추 수조로 카테터의 진입을 직접 육안으로 확인할 수 있어 반복 시도의 필요성을 줄이고 합병증을 최소화할 수 있습니다.
또 다른 중요한 고려 사항은 모든 개복 수술 접근법과 관련된 조직 손상 및 수술 후 합병증입니다. 여기에 설명된 방법은 척추의 탁월한 시각화와 신뢰할 수 있는 카테터 배치를 제공하지만 최소 침습 기술에 비해 더 많은 조직 파괴를 유발합니다. 이로 인해 근육의 무결성을 보존하고 감염 위험을 줄이는 것이 중요한 생존 연구에서의 적용이 제한될 수 있습니다. 그러나 신중한 수술 기법과 출혈을 조절하기 위한 단극성 소작기를 사용하면 수술 후 합병증의 위험을 최소화할 수 있습니다. 제시된 방법은 10마리의 돼지에서 대장균 지질다당류를 뇌실 내 접종한 후 뇌 염증에 대한 비생존 연구에서 사용되었지만, 배치된 카테터 주위로 근막과 피부를 봉합할 수 있기 때문에 이 방법을 생존 연구에 적용할 수 있다고 생각합니다. 잠재적 생존 연구에서는 수술 후 단계에서 피험자에게 신경학적 결손이나 감염의 징후가 있는지 모니터링하는 것이 중요합니다.
전반적으로 여기에 제시된 수술 방법은 덜 침습적인 기술에 비해 몇 가지 이점을 제공합니다. 이 접근법은 척추의 더 많은 부분을 노출시킴으로써, 첫 번째 시도에서 주입자와 카테터를 정확하게 배치할 수 있게 하여 혈액으로 인한 CSF 오염 위험을 줄이고 일관된 CSF 샘플링을 보장합니다. 경험에 비추어 볼 때, 이 방법을 사용하면 24시간 동안 약 0.5mL/h의 속도로 CSF를 안정적으로 수집할 수 있습니다. CSF 흐름이 감소하면 카테터가 몇 밀리미터 정도 후퇴하면 개통성이 회복되는 경우가 많습니다. 또한 수술 부위를 직접 관찰하여 CSF 누출과 같은 잠재적인 합병증을 감지할 수 있습니다. 이 방법은 또한 여러 카테터 또는 추가 기구의 이식이 필요할 수 있는 향후 연구에 유연성을 제공합니다.
결론적으로, 우리는 제시된 방법이 간단하고 재현 가능한 것으로 간주하며, 돼지 척수와 관련된 다양한 미래 돼지 모델, 특히 돼지 척추관의 광범위한 CSF 샘플링 또는 기기화가 필요한 모델에서 중요한 응용 프로그램이 있습니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
저자는 덴마크 올보르 대학 병원의 생물 의학 연구소 직원들이 공유한 경험에 대해 진심으로 감사를 표하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Adjustable operating table | N/A | N/A | |
| Bair Hugger heater | 3M | B5005241003 | |
| Bair Hugger heating blanket | 3M | B5005241003 | |
| Endotracheal tube size 6.5 | DVMed | DVM-107860 | Cuffed endotracheal tube |
| Euthasol Vet | Dechra Veterinary Products A/S | 380019 | phentobarbital for euthanazia, 400mg/mL |
| Foley Catheter 12F | Becton, Dickinson and Company | D175812E | Catheter with in-built thermosensor |
| Intravenous peripheral catheter | Avantor | BDAM381344 | Size G18 |
| Intravenous sheath | Coris Avanti | Avanti Cordis Femoral Sheath 6F | |
| Monopolar, ForceTriad System | Medtronic | ||
| Plastic Syringe, 2 mL | Becton, Dickinson and Company | 300928 | |
| Primus respirator | Dräger | Respirator with in-built vaporiser for supplementary Sevofluran anesthisa | |
| Self-retaining retractor | World Precission Instruments | 501722 | Weitlander retractor, self-retaining, 14 cm blunt |
| Silicone Lumbar Catheter incl. Introducer | Integra | NL8508330 | |
| Sterile Saline | Fresnius Kabi | 805541 | 1000 mL |
| Sterile surgical swaps | |||
| Surgical scalpel no 24 | Swann Morton | 5.03396E+12 | Swann Morton Sterile Disposable Scalpel No. 24 |
| Zoletil Vet | Virbac | Medical mixture for induction of anesthesia |
참고문헌
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: A model for human infectious diseases. Trends Microbiol. 20 (1), 50-57 (2012).
- Bassols, A., et al. The pig as an animal model for human pathologies: A proteomics perspective. Proteomics Clin Appl. 8 (9-10), 715-731 (2014).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Lunney, J. K., et al. Importance of the pig as a human biomedical model. Sci Transl Med. 13 (621), eabd5758 (2021).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31 (5), 728-751 (2007).
- Hoffe, B., Holahan, M. R. The use of pigs as a translational model for studying neurodegenerative diseases. Front Physiol. 10, 838 (2019).
- Toossi, A., et al. Comparative neuroanatomy of the lumbosacral spinal cord of the rat, cat, pig, monkey, and human. Sci Rep. 11 (1), 1955 (1955).
- Busscher, I., Ploegmakers, J. J. W., Verkerke, G. J., Veldhuizen, A. G. Comparative anatomical dimensions of the complete human and porcine spine. Eur Spine J. 19 (7), 1104-1114 (2010).
- Säteri, T., et al. Ex vivo porcine models are valid for testing and training microsurgical lumbar decompression techniques. World Neurosurg. 155, e64-e74 (2021).
- Yamanouchi, K., et al. Validation of a surgical drill with a haptic interface in spine surgery. Sci Rep. 13 (1), 598 (2023).
- Hanberg, P., Bue, M., Birke Sørensen, H., Søballe, K., Tøttrup, M. Pharmacokinetics of single-dose cefuroxime in porcine intervertebral disc and vertebral cancellous bone determined by microdialysis. Spine J. 16 (3), 432-438 (2016).
- Hvistendahl, M. A., et al. Cefuroxime concentrations in the anterior and posterior column of the lumbar spine - an experimental porcine study. Spine J. 22 (9), 1434-1441 (2022).
- Mariager, T., et al. Continuous evaluation of single-dose moxifloxacin concentrations in brain extracellular fluid, cerebrospinal fluid, and plasma: a novel porcine model. J Antimicrob Chemother. 79 (6), 1313-1319 (2024).
- Thygesen, M. M., et al. A 72-h sedated porcine model of traumatic spinal cord injury. Brain Spine. 4, 102813 (2024).
- Pleticha, J., et al. Pig lumbar spine anatomy and imaging-guided lateral lumbar puncture: A new large animal model for intrathecal drug delivery. J Neurosci Methods. 216 (1), 10-15 (2013).
- Bergadano, A., et al. A minimally-invasive serial cerebrospinal fluid sampling model in conscious Göttingen minipigs. J Biol Methods. 6 (1), e107 (2019).
- Maxwell, A. R., Castell, N. J., Brockhurst, J. K., Hutchinson, E. K., Izzi, J. M. Determination of an acclimation period for swine in biomedical research. J Am Assoc Lab Anim Sci. 63 (6), 651-654 (2024).
- Costea, R., Ene, I., Pavel, R. Pig Sedation and anesthesia for medical research. Animals. 13 (24), 3807 (2023).
- Ettrup, K. S., et al. Basic surgical techniques in the göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. J Vis Exp. 52, e2652 (2011).
- Grogan, J. P., Daniels, D. L., Williams, A. L., Rauschning, W., Haughton, V. M. The normal conus medullaris: CT criteria for recognition. Radiology. 151 (3), 661-664 (1984).
- Bessen, M. A., et al. Characterising spinal cerebrospinal fluid flow in the pig with phase-contrast magnetic resonance imaging. Fluids Barriers CNS. 20 (1), 5 (2023).
- Weber-Levine, C., et al. Porcine model of spinal cord injury: A systematic review. Neurotrauma Rep. 3 (1), 352-368 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유