Method Article
Isolation and Analysis of Aortic Arch and Root Lesions in an Atherosclerotic Mouse Model(죽상경화성 마우스 모델에서 대동맥궁 및 뿌리 병변의 분리 및 분석)
요약
이 프로토콜은 죽상경화증의 메커니즘과 진행에 대한 보다 심층적인 연구를 용이하게 하기 위해 죽상경화성 플라크의 정량적 분석을 위한 포괄적인 방법론을 제공합니다.
초록
심혈관 질환의 주요 원인인 죽상동맥경화증은 병변 발달 및 진행에 대한 상세한 검사가 필요합니다. 이 연구는 널리 사용되는 죽상경화성 마우스 모델인 저밀도 지단백질 수용체 녹아웃(Ldlr-/-) 마우스에서 대동맥궁 및 뿌리 병변의 분리 및 조직학적 분석을 위한 포괄적인 프로토콜을 소개합니다. 대동맥궁과 뿌리는 죽상경화성 병변의 핵심 부위이며, 이들의 검사는 죽상동맥경화증의 발병, 진행 또는 퇴행을 평가하고, 심혈관 질환 위험을 예측하고, 잠재적인 치료 표적을 식별하는 데 매우 중요합니다. 이 프로토콜은 조직 분리, 고정, Oil Red O 염색, 대동맥근 절편, Hematoxylin 및 Eosin(HE) 염색, Verhoeff-Van Gieson(VVG) 염색 및 이미지 분석을 포함하여 대동맥궁 및 뿌리의 죽상경화성 부담을 정량화하는 방법을 설명합니다. 오일 레드 O 염색은 대동맥궁의 플라크 면적을 측정하여 죽상동맥경화증의 중증도를 평가하고, 대동맥근의 HE 염색은 지질핵 및 섬유낭과 같은 플라크 성분을 드러내어 플라크 안정성 및 파열 위험을 쉽게 평가할 수 있습니다. VVG 염색은 조직 내 콜라겐 섬유를 염색할 수 있어 플라크 구성 및 관련 정보에 대한 추가 통찰력을 제공할 수 있습니다. 이 철저한 분석은 병변 발달 메커니즘에 대한 귀중한 통찰력을 제공하며 죽상동맥경화증을 예방하고 치료하기 위한 새로운 치료 전략을 수립하는 데 도움이 될 수 있습니다.
서문
심혈관 질환, 특히 죽상동맥경화증은 전 세계적으로 상당한 건강 부담이자 주요 사망 원인으로 부상하고 있습니다 1,2. 죽상동맥경화증은 지질이 점진적으로 축적되고 동맥벽에 플라크가 형성되는 것을 특징으로 하는 만성 진행성 염증성 질환으로, 궁극적으로 동맥 내강이 좁아지고 잠재적으로 플라크가 파열되어 심근경색 및 뇌졸중과 같은 급성 심혈관 질환을 유발합니다 1,2,3. 인간의 건강에 미치는 지대한 영향을 감안할 때 죽상동맥경화증의 기전을 이해하고 효과적인 치료 전략을 개발해야 할 긴급한 필요성이 있습니다.
최근 몇 년 동안 동물 모델은 죽상동맥경화증에 대한 이해를 증진하는 데 중요한 역할을 했습니다. 다양한 종 중에서 생쥐는 빠른 번식, 낮은 유지 보수 비용 및 고급 유전자 조작 기술의 가용성으로 인해 선호되는 모델로 부상했습니다 4,5. 특히, LDL 수용체 녹아웃(Ldlr-/-) 마우스와 ApoE-/- 마우스는 유사한 병태생리학적 특성을 나타내기 때문에 인간 죽상동맥경화증을 모방하는 데 광범위하게 사용되었습니다 4,5,6,7,8,9.
생쥐의 죽상경화성 병변은 대동맥의 다양한 위치에서 발생할 수 있지만, 특히 대동맥근, 대동맥궁, 상완두질몸통과 같이 혈역학과 밀접하게 관련된 부위에서 발생하기 쉬우며, 하행 대동맥은 상대적으로 영향을 덜 받는다10. 마우스 모델에서 죽상경화성 병변 부담을 정확하게 평가하고, 플라크의 존재, 크기 및 단계를 평가하고, 이를 통해 죽상동맥경화증의 발병, 진행 및 퇴행에 대한 다양한 약물 또는 요인의 영향을 조사하기 위해서는 조직학적 염색 기법과 영상 분석의 조합이 필수적입니다11. 잘 확립된 방법인 오일 레드 O 염색은 특히 중성 지질과 지단백질12을 염색하여 대동맥궁13의 플라크 형성을 직접 시각화합니다. 한편, 대동맥근의 Hematoxylin-Eosin(HE) 염색은 플라크 영역을 묘사할 뿐만 아니라 섬유질 캡 및 지질 괴사 코어와 같은 상세한 구조적 특징을 제공합니다. 이러한 세부 사항은 플라그 안정성을 평가하고 플라크 파열 위험을 예측하는 데 중요합니다11. 이러한 기술을 함께 사용하면 죽상경화성 병변의 중증도와 진행을 종합적으로 평가할 수 있습니다.
이 프로토콜은 C57BL6/J Ldlr-/- 마우스를 예로 들어 대동맥궁의 Oil Red O 염색 및 파라핀 포매 대동맥근 절편의 HE 염색을 사용하여 마우스의 죽상경화성 병변 부담을 평가하기 위한 자세한 단계별 가이드를 제공한 후 이미지 분석을 수행하는 것을 목표로 합니다. 이 프로토콜은 대동맥 분리 및 고정, 파라핀 포매 및 절편, 염색 절차 및 이미지 분석의 모든 측면을 다루며 주요 단계에 대한 운영 세부 정보 및 고려 사항을 통합하여 결과의 재현성과 신뢰성을 보장합니다. 이 프로토콜을 따름으로써 연구자들은 치료 개입의 효능을 정확하고 효율적으로 평가하고 죽상동맥경화증의 기저에 있는 메커니즘에 대한 통찰력을 얻을 수 있습니다.
프로토콜
이 연구에 사용된 모든 동물 프로토콜은 상하이 체육 대학의 동물 실험 윤리 검토 위원회의 승인을 받았습니다.
1. 시약 및 해부 도구의 준비
- 가는 가위, 곧은 집게, 구부러진 집게, 스프링 가위 및 핀을 포함한 해부 도구를 미리 오토클레이브로 소독하십시오.
- 75% 에탄올: 75mL의 무수 에탄올과 25mL의 ddH2O를 혼합합니다.
- 1x 인산염 완충 식염수(PBS): 0.01M PBS 분말을 ddH2O2L에 용해시킵니다.
- 4% 파라포름알데히드(PFA) 용액: 흄 후드의 자석 교반기에서 800mL의 1x PBS를 약 60°C로 가열합니다. 파라포름알데히드 분말 40g을 천천히 넣고 계속 저어줍니다. 완전히 용해될 때까지 1N NaOH로 적정합니다. 실온으로 식히고 PBS 1개로 부피를 1L로 조정하고 필터를 걸러내고 pH를 7.2-7.4로 조정합니다.
주의 : PFA는 신중한 취급과 안전 프로토콜의 엄격한 준수가 필요한 유해 화학 물질입니다. - Oil Red O의 스타킹 용액 : 100 % 이소프로판올 500mL에 Oil Red O 분말 2.5g을 녹여 갈색 병에 밀봉 한 후 4 °C의 냉장고에 보관하여 장기 보관합니다.
주의 : 이소프로판올은 독성이 있고 유해한 화학 물질입니다. 따라서 건강과 안전을 보장하기 위해서는 장갑을 포함하여 필요한 개인 보호 장비(PPE)를 착용하는 것이 필수적입니다. - Oil Red O의 작업 용액 : 스타킹 용액과 멸균 ddH2O를 3 : 2의 비율로 혼합합니다. 사용할 때마다 새로 준비하고 0.22μm 멸균 주사기 필터 또는 대형 여과지로 용액을 여과합니다.
- Victoria Blue'B 염색 용액: 0.5g의 Victoria Blue'B를 70% 에탄올 100mL에 용해시킵니다.
2. 대동맥과 심장의 분리
- 모든 쥐를 온도 조절 환경에서 12시간의 라이트/다크 주기로 케이지당 3-5마리로 사육하고 0.2%의 콜레스테롤과 21.2%의 지방을 함유한 표준 차우 다이어트(차우) 또는 서양식 다이어트(WTD)를 먹입니다. 생후 12주이고 체중이 25g에서 30g 사이인 C57BL6/J LDLr-/- 수컷 마우스를 선택합니다. CO2 챔버에서 마우스를 희생하십시오.
- 해부하기 전에 1-2겹의 흡수지로 덮인 폼 보드에 누운 위치(복부 쪽이 위로)에 있는 마우스를 놓고 핀으로 팔다리를 고정합니다.
- 생쥐의 복부에 75% 에탄올을 뿌려 털을 청소하고 촉촉하게 합니다.
- 집게를 사용하여 생쥐의 복부 피부를 잡고 가는 가위를 사용하여 복부 기저부에서 목 꼭대기까지 피부를 자릅니다.
- 복벽을 연 다음 집게를 사용하여 흉골을 들어 올리고 횡격막과 갈비뼈를 모두 잘라 흉강을 노출시킵니다.
- 식도와 기관을 제거하면 경동맥을 더 쉽게 청소할 수 있습니다. 간, 폐, 비장, 위장관, 췌장을 포함한 장기를 제거하고, 복막 뒤에 위치한 신장과 척추 옆의 복부 대동맥은 보존한다. 장간막 동맥을 절제할 때는 복부 대동맥이 손상되지 않도록 장을 들어 올려 대동맥에서 절개해야 합니다.
- 명확한 관찰 영역을 제공하려면 마우스를 실체 현미경 아래에 놓고 차가운 광원을 해부 영역에 정렬합니다.
- PBS로 채워진 10mL 주사기와 0.45 x 15 (II) RWLB 바늘을 좌심실 정점에 천천히 주입하고 대동맥의 팽창을 관찰합니다.
- 해부 부위의 혈액과 체액을 티슈로 부드럽게 닦아내어 시야를 완전히 노출시킵니다.
- 흉부 대동맥은 노출되기 쉽습니다. 집게를 사용하여 흉부 대동맥 끝에 부착된 횡격막 분절을 잡고 스프링 가위를 사용하여 대동맥과 흉부 근육 벽 사이의 결합 조직을 절단하여 돌파구로 사용하십시오.
- 집게로 심장을 부드럽게 당기고 흉부 대동맥을 들어 올려 대동맥궁의 가지를 관찰하고 대동맥궁과 그 가지를 흉곽 대동맥을 따라 위쪽으로 가지를 해부합니다.
알림: 주의하고, 대동맥을 온전하게 유지하고, 찢어지거나 다치지 않도록 하고, 주변 지방과 결합 조직을 철저히 제거하십시오. 이 단계에서는 능숙한 조작을 위해 반복적인 연습이 필요합니다. - 복부 대동맥과 총장골동맥을 흉부 대동맥을 따라 아래쪽으로 절개합니다.
- 총장골동맥을 분기점 아래 1-2mm 정도 잘라내고, 척추를 따라 대동맥의 작은 가지를 잘라 빼내고, 신장 근처의 신장 동맥을 분리하고, 원위부에서 목에 있는 3개의 분지 혈관을 잘라내고, 마지막으로 심장 근처의 상행 대동맥을 절단합니다.
- 대동맥궁을 절개하기 전에 그 아래의 혈관과 대비가 높은 작고 어두운 색의 개스킷을 놓고 대동맥궁 부위를 촬영합니다.
- 심장 조직을 자르고 심방과 평행한 평면을 따라 심장의 아래쪽 절반을 자릅니다. 트리밍된 심장을 고정합니다(그림 1A).
3. 대동맥궁의 정착 그리고 전처리
- 1.5mL 원심분리 튜브에 4% PFA 용액 1mL를 미리 준비합니다.
- 대동맥을 튜브에 넣고 실온에서 최소 24시간 동안 고정합니다.
참고: 대동맥은 Oil Red O 염색 품질에 영향을 주지 않고 최대 1개월 동안 4% PFA로 보존할 수 있습니다. 정상적인 구성을 유지하려면 고정하기 전에 조직을 고무에 배치하는 것이 적절한 옵션이 될 수 있습니다. - 대동맥이 건조되는 것을 방지하기 위해 PBS가 포함된 페트리 접시로 대동맥을 옮깁니다. 실체현미경으로 집게와 용수철 가위를 사용하여 대동맥 내 플라크의 정량화에 대한 간섭을 줄이기 위해 해부 중에 완전히 제거되지 않은 남아 있는 외래 지방을 조심스럽게 제거합니다.
- 스프링 가위를 사용하여 대동맥의 내부 종축을 따라 대동맥을 조심스럽게 절단한 다음 측면을 따라 대동맥궁의 곡률 수준까지 대동맥궁의 세 가지를 순차적으로 잘라 완전히 퍼지도록 합니다(그림 1C).
- 이 단계에서는 오일 레드 O 염색에 사용하거나 4% PFA에 보관하십시오.
4. 대동맥궁의 오일 레드 O 염색
- 절단된 대동맥을 12웰 플레이트에 놓습니다. 각 웰에 멸균 ddH2O 1mL를 넣고 셰이커에서 5분 동안 세척한 후 2회 반복합니다.
- 제거된 용액이 있는 12웰 플레이트를 흄 후드에 놓고 눈에 띄는 워터마크가 없을 때까지 20분 동안 자연 건조합니다.
- 갓 준비한 오일 레드 O 작업 용액 1mL를 각 웰에 넣고 셰이커에서 20분 동안 흔든 다음 오일 레드 O 작업 용액을 제거합니다.
- 각 웰에 멸균 ddH2O 2mL를 넣고 5분 동안 세척하고 이 단계를 3회 반복합니다. 그 후, 대동맥을 ddH2O에 유지하십시오.
- 대동맥을 슬라이드에 놓고 실체현미경으로 펼칩니다. 대비를 향상시키려면 슬라이드 아래에 검은색 고무 패드를 놓습니다.
- 대비를 더욱 강화하기 위해 흰 종이에 슬라이드를 놓고 그 옆에 자를 놓고 카메라를 사용하여 사진을 찍습니다. 대동맥을 촉촉하게 유지하려면 처리된 대동맥을 1mL의 PBS가 들어 있는 1.5mL 원심분리 튜브에 보관하십시오.
5. 대동맥궁의 이미지 분석
- Image J 소프트웨어가 설치된 컴퓨터에서 캡처한 대동맥 이미지를 엽니다.
- 전체 대동맥을 포함하는 450 픽셀 x 900 픽셀과 같은 사각형 상자가 있는 영역을 선택하고 새 .tiff 그림으로 저장합니다.
- 이미지 J에서 새로 저장된 .tiff 사진을 엽니다. 편집 > 반전을 클릭한 다음 이미지를 선택하고 RGB 스택 유형을 클릭합니다>.
- 이미지로 이동하여 Stacks > Stack to Images를 클릭한 다음 대비가 가장 좋은 녹색을 선택합니다.
- Image(이미지)로 이동하여 Adjust > Brightness/Contrast(밝기/대비 조정)를 클릭합니다. 최소값을 약 200으로 변경하고 각 이미지에 대해 유사한 배경을 유지하면서 배경을 최소화한 다음 적용을 클릭합니다.
- 분석으로 이동하여 측정 설정을 선택합니다. Area(영역), Area Fraction(영역 분수), Limit to Threshold(임계값 제한 ) 및 Display Label(레이블 표시)을 선택한 다음 OK(확인)를 클릭합니다.
- Analyze(분석)로 이동하여 Measurement(측정) 를 선택하고 결과를 스프레드시트에 복사합니다.
- Analyze(분석)로 이동하여 Tool > ROI Manager(ROI 관리자)를 클릭한 다음 직사각형 상자가 있는 대동맥의 아치 부분을 선택합니다. ROI Manager(ROI 관리자)로 이동하여 Add [t]([t] 추가) 를 선택한 다음 Measure(측정)를 선택합니다. 측정된 결과를 스프레드시트에 복사합니다.
- 정규성 테스트를 기반으로 마우스 그룹에서 측정된 면적을 분석합니다. p < 0.05는 차이가 통계적으로 유의하다는 것을 나타냅니다.
참고: 실험 설계에 따라 적절한 통계적 방법을 선택합니다.
6. 심혼의 파라핀 끼워넣기
- 심장의 정점을 제거하고 절개 부위가 곧게 펴지고 판막근 방향과 정렬되도록 합니다(그림 1B).
- 각 심장 샘플을 파라핀 임베딩 상자에 개별적으로 넣고 연필로 상자를 표시합니다.
- 흄 후드에서 티슈가 든 파라핀 내장 카세트를 빈 용기에 넣고 임베딩 박스를 흐르는 물로 3분 동안 헹굽니다.
- 50% 에탄올을 2시간 동안 에탄올, 75% 에탄올을 30분 동안 , 85% 에탄올을 30분 동안 , 95% 에탄올을 30분 동안 그리고 100% 에탄올을 10분 동안 증가시키는 농도 구배로 에탄올을 사용하여 조직 탈수를 수행합니다. 각 단계에서 에탄올을 변경하여 단계를 반복합니다.
- 다음과 같이 자일렌과 함께 조직 투명도를 수행합니다: 자일렌과 에탄올을 1:1로 혼합하여 20분, 자일렌을 15분 동안 혼합하고 자일렌을 변경하여 이 1회를 반복합니다.
- 파라핀 왁스를 60°C의 오븐에서 미리 녹입니다. 자일렌과 파라핀을 혼합하여 샘플을 30분 동안 처리한 다음 파라핀 소프트 왁스를 2시간 동안 처리한 다음 파라핀 하드 왁스를 1시간 동안 처리합니다.
주의 : 에탄올은 가연성 및 휘발성 유기 용제입니다. 자일렌은 적당히 독성이 있으며 사용 시 보호가 필요합니다. - 파라핀 임베딩
- 적절한 크기의 금형을 선택하고 전원을 켠 다음 미리 임베딩 기계를 예열하십시오.
- 용융된 파라핀 왁스를 금형에 첨가한 후 임베딩 카세트에서 조직을 추출하고 미리 가열된 집게를 사용하여 절단면이 아래를 향하도록 금형의 중앙 바닥에 배치합니다.
- 냉동실 테이블에서 금형을 냉각시키고 내부의 파라핀이 응고된 후 표시된 임베딩 카세트 뚜껑을 금형 위에 놓고 필요한 양의 파라핀을 채웁니다.
- 파라핀 왁스가 냉각되고 굳으면 금형에서 블록을 제거하고 4°C의 냉장고에 보관합니다(그림 1D).
7. 대동맥 뿌리의 파라핀 절편
- 임베딩 카세트 뚜껑을 둘러싼 여분의 파라핀을 제거한 다음 파라핀 블록을 cl에 단단히 부착합니다.amp 파라핀 슬라이서 헤드에 있는 시트. 슬라이스를 절단할 위치에서 약간 오프셋된 위치로 블록을 조정하여 파라핀 블록 내의 조직 섹션이 블레이드의 절단면과 평행이 되도록 합니다. 첫 번째 절편에서는 조직 위치를 드러내기 위해 절편 두께를 10μm로 설정합니다.
- 현미경으로 첫 번째 절개 부위를 발견하면 절편 두께를 6μm로 조정하고 연속 절편을 수행합니다. 현미경 아래에서 3개의 온전한 대동맥 판막이 보일 때까지 슬라이서에서 절편을 자르고, 자르고, 골라내며, 이 시점에서 절편 준비가 시작됩니다. 각 마우스에 대해 6μm 간격으로 하나의 슬라이스를 남겨두고 다른 유리 캐리어에 다른 슬라이스 위치를 배치하십시오(예: 섹션 1-11-21-31).
- 37°C의 따뜻한 물이 담긴 스프레더에 절편을 띄워 조직을 평평하게 펴고 슬라이드로 조직을 집습니다. 물이 마를 때까지 기다린 후 42°C로 설정된 토스터에 조각을 올려 밤새 굽니다.
- 이 8개 섹션의 평균 플라크 면적은 각 마우스의 대동맥근 플라크 면적의 값을 나타냅니다. 이 부분을 염색한 후 평균 플라그 면적과 플라그 면적을 측정합니다.
8. Hematoxylin Eosin 염색
- 슬라이스를 60°C의 건조기에 30분 동안 놓습니다. 흄 후드에서 염색 랙을 사용하여 10분 동안 자일렌(이 단계를 한 번 반복, 크실렌 변경), 100% 에탄올을 5분 동안 (이 단계를 반복하여 에탄올 변경), 95% 에탄올을 5분 동안 배치하고, 85% 에탄올을 5분 동안 그리고 75% 에탄올을 5분 동안 순차적으로 배치합니다.
- 흐르는 물로 5분 동안 헹굽니다. 섹션을 헤마톡실린 얼룩에 8분 동안 담그고 흐르는 물에 헹굽니다.
- 1% 염산 알코올로 몇 초 동안 단면을 구별하고 흐르는 물로 헹구고 현미경으로 단면이 청자색으로 변하는 것을 관찰합니다.
- 단면을 에오신 염색 용액에 5분 동안 담그십시오. 섹션을 95% 에탄올에 7회 담근 다음 100% 에탄올에 30초 동안 넣습니다.
- 최소 30초 동안 크실렌에서 투명합니다. 중성 고무를 사용하여 슬라이드를 밀봉하고, 현미경으로 사진을 찍고, 고해상도 이미지를 저장하고, 가급적이면 .tiff 형식으로 저장합니다.
9. Verhoeff-Van Gieson (VVG) 염색
- 파라핀 섹션에서 섹션 8.1 및 8.2에 설명된 것과 동일한 단계에 따라 일상적인 탈왁스 및 재수화를 수행합니다.
- 70% 에탄올로 잠시 헹군 후 Victoria Blue'B 염색 용액에 15분 동안 담그십시오.
- 95% 에탄올에서 몇 초 동안 섹션을 구별합니다. 증류수로 섹션을 2번 씻습니다.
- Ponceau 염색 용액으로 액적 도포로 5분 동안 섹션을 염색합니다. 100% 에탄올을 사용하여 단면을 구별하고 탈수합니다.
알림: Ponceau 염색 후에는 물과의 접촉을 피하십시오. - 최소 30초 동안 크실렌에서 투명합니다. 중성 고무로 슬라이드를 장착하고 현미경으로 사진을 찍습니다.
10. 대동맥근 플라크의 이미지 분석
- Image J 소프트웨어가 설치된 컴퓨터에서 이미지를 엽니다. 명판을 상자에 넣을 상자 도구를 선택하십시오.
- Image(이미지)로 이동하여 Overlay(오버레이) > Add Selection(선택 항목 추가)을 클릭한 다음 Measure(측정 )를 클릭하여 명판의 면적을 측정합니다. 측정된 결과를 스프레드시트에 복사합니다.
- 정규성 테스트를 기반으로 마우스 그룹에서 측정된 면적을 분석합니다. p < 0.05는 차이가 통계적으로 유의하다는 것을 나타냅니다.
결과
대표적인 결과는 죽상경화성 마우스 모델에서 대동맥궁 및 뿌리 병변에 대한 격리 및 분석 기술의 적용을 보여줍니다. 이러한 결과는 죽상경화성 병변을 식별하고 특성화하는 기술의 능력에 대한 명확한 증거를 제공합니다. 예를 들어, 특정 염색(예: Oil Red O)이 있는 조직학적 이미지는 지질 축적을 강조하는 반면, 헤마톡실린 및 에오신(H&E) 염색은 동맥벽의 구조, 지질 코어의 존재 및 괴사 영역을 포함한 죽상경화성 병변의 전반적인 형태를 보여줍니다. H&E 염색 절편을 분석하여 대동맥의 병변 발달 및 구조적 변화 정도를 평가할 수 있으며, 플라크 진행 및 조직 리모델링에 대한 개요를 제공할 수 있습니다.
이 프로토콜에서는 4개월 동안 서양식 식단(WTD)을 먹인 12주 된 C57 Ldlr 녹아웃 마우스와 대조군으로 차우 식단을 먹인 Ldlr-/- 마우스에서 죽상경화성 병변의 정도를 분석했습니다.
12주간의 차우 다이어트와 서양식 다이어트 수유 후, 서양식 다이어트 그룹의 Ldlr 녹아웃 마우스는 대조군에 비해 체중이 크게 증가했습니다. 또한, 서양식 식단 그룹의 지질 수치도 혈장 트리글리세리드(TG) 및 총 콜레스테롤(TC) 수치가 현저히 높아졌으며, 여기서 TG와 TC는 쥐의 꼬리 혈액에서 채취한 효소 결합 면역흡착 분석법(Enzyme-Linked Immunosorbent Assay)에 의해 검출되었습니다(그림 2).
차우(chow) 식단을 섭취한 마우스에 비해 심각한 지질 축적 및 죽상경화성 병변을 보인 서양식 식단을 섭취한 Ldlr 녹아웃 마우스에서 대동맥 오일 레드 O 염색 결과는 동맥에 더 많은 지질 침전물이 더 심각한 죽상경화성 병변에 해당한다는 것을 나타냅니다(그림 3).
대동맥근 절편에서 플라크와 괴사 코어의 면적이 더 넓다는 것은 더 심각한 죽상경화성 병변을 의미합니다. 여기서, 대동맥근 병변 영역과 괴사 코어는 차우(Chow)를 먹인 마우스보다 서양의 다이어트를 먹인 마우스에서 훨씬 더 큰 것으로 나타났습니다(그림 4A). 대동맥 뿌리의 파라핀 절편에 대한 VVG 염색을 수행하여 대동맥 뿌리의 병든 부위를 평가했습니다. 탄성 섬유는 청자색이었고 콜라겐 섬유는 일반적으로 증식하여 섬유질 뚜껑을 형성하고 빨간색으로 나타났습니다. VVG 염색은 염증 또는 병리학적 리모델링의 징후일 수 있는 탄성 섬유의 파괴 또는 감소, 혈관 벽의 두꺼워짐, 비정상적인 콜라겐 섬유의 침착 여부를 확인하는 데 도움이 됩니다. 여기서, 서양 다이어트를 먹인 마우스의 대동맥 뿌리에 있는 섬유캡의 콜라겐 섬유가 증가하는 경향을 차우다이어트를 먹인 마우스와 비교하여 보여주었습니다(그림 4B). 대동맥근 병변 부위와 괴사 부위의 정량화는 서양식 식단이 Ldlr 녹아웃 마우스의 죽상경화성 상태를 악화시킨다는 것을 보여주었습니다(그림 4C).
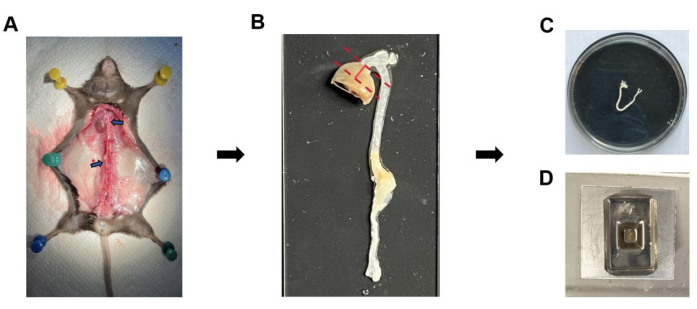
그림 1: 대동맥궁 및 뿌리 병변의 분리 및 분석 단계. (A) 대동맥과 심장의 격리. (B) 대동맥 뿌리의 준비. 두 점선 사이의 심장 조직을 잘라냈습니다. (C) 대동맥궁의 고정 및 전처리.(D) 심장의 파라핀 매립. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 12주 동안 먹이를 준 대조군 마우스와 WTD 그룹 마우스의 체중 및 혈중 지질 수치 변화. (A) CD 및 WTD 먹이의 체중 곡선. (B) 혈장 트리글리세리드(TG). (C) 총 콜레스테롤(TC) (n=4). 결과는 SEM± 평균으로 표시되며, 유의성은 학생 t-test로 평가되었습니다. p < 0.001, **** p < 0.0001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
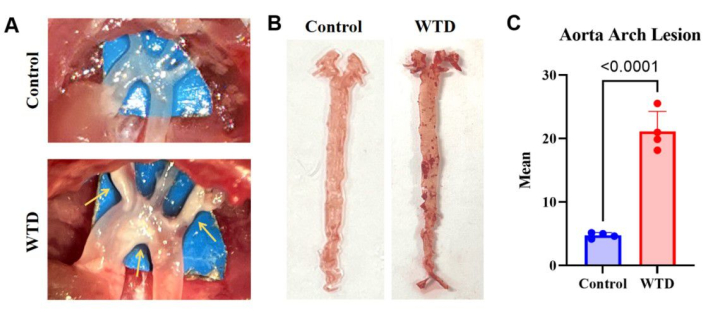
그림 3: 대동맥궁과 그 오일 레드 O 염색 및 분석. (A) 대동맥궁에 있는 죽상경화성 플라크의 대표적인 이미지. 차우 다이어트를 먹인 Ldlr-/- 마우스의 대동맥궁은 눈에 보이는 플라크 없이 현미경으로 관찰된 반면, 서양식 식단을 먹인 Ldlr-/- 마우스의 대동맥궁은 눈에 보이는 플라크와 함께 현미경으로 관찰되었습니다. (B) 대동맥 오일 레드 O 염색의 대표적인 이미지. 지질 축적 없이 차우 다이어트를 먹인 Ldlr-/- 마우스의 전체 대동맥, 4개월 동안 서양식 다이어트를 먹인 Ldlr-/- 마우스의 전체 대동맥은 대동맥궁에 플라크가 보였다. (n=4). (C) 대동맥궁 병변의 평균 수. 결과는 SEM± 평균으로 표시되며 유의성은 Student t-test로 평가되었습니다. p < 0.001, **** p < 0.0001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
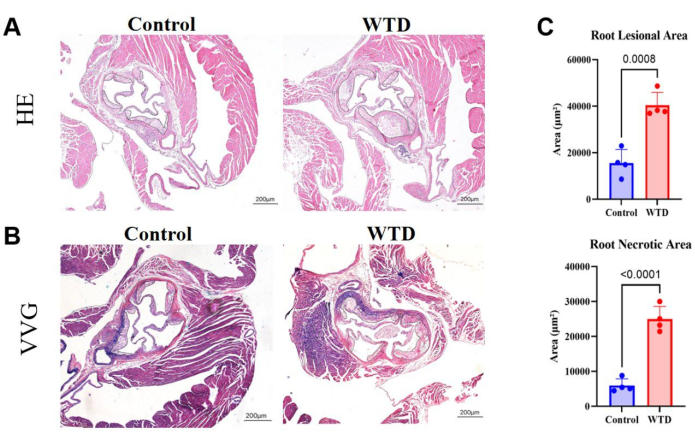
그림 4: HE 및 VVG로 염색된 대동맥근 절편, 플라크 영역과 괴사 영역의 정량화. (A) 대표적인 헤마톡실린 및 에오신 염색 대동맥근 절편. Chow 다이어트와 서양 다이어트 중재를 각각 받은 Ldlr-/- 마우스의 대동맥 뿌리. (B) 대표적인 Verhoeff-Van Gieson으로 염색된 대동맥근 절편. Chow 다이어트와 서양식 다이어트 중재를 받은 Ldlr-/- 마우스의 대동맥 뿌리는 각각 검은색 원으로 표시되어 있으며 마우스의 죽상경화성 병변입니다. (C) 대동맥근 병변 부위 및 괴사 부위의 정량화(n=4). 결과는 SEM± 평균으로 표시되며 유의성은 Student t-test로 평가되었습니다. p < 0.001, **** p < 0.0001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서는 Ldlr 녹아웃 마우스의 대동맥 샘플링 방법과 플라크의 정량 분석에 대한 자세한 정보를 제공합니다.
박리 절차의 정확성은 죽상동맥경화증의 마우스 모델에서 생체 내 대동맥 박리에 대한 가장 큰 기술적 과제입니다. 우리의 경험에 비추어 볼 때, 요점은 다음과 같습니다 : (1) PBS를 사용하여 동맥의 모든 혈액을 씻어 내고 대동맥 아치 가지와 혈관 주위 지방의 비교를 증가시킵니다. (2) 인내심을 가지십시오. 쥐 대동맥의 크기가 작기 때문에 수술은 신체 현미경으로 수행해야 하며 수술 오류를 최소화하기 위해 고품질의 현미경 클리퍼와 집게를 사용해야 합니다. (3) 용기의 절단이나 손상을 방지하기 위해 스트리핑이 정확하고 올바른 방향으로 시작되도록 보장하는 것이 필수적입니다.
생쥐의 대동맥 기름 적색 O 염색과 관련하여, 공식적인 염색 전에 분리된 마우스 대동맥의 말초 지방을 현미경으로 제거해야 하며, 염색 결과에 영향을 미치지 않도록 조직의 무결성을 유지해야 합니다. 오일 레드 염색 공정은 염색 시간에 대한 정밀한 제어가 필요합니다. 지속 시간이 과도하거나 불충분하면 염색 효과가 손상되어 부정확한 결과를 초래할 수 있습니다.
마우스 대동맥 뿌리가 포매될 때, 절편 중 조직 균열을 방지하기 위해 조직의 탈수 시간을 제어해야 합니다. 대동맥근의 절편은 균일한 염색을 보장하기 위해 두께가 균일해야 하며, 너무 얇거나 너무 두꺼운 절편은 관찰을 방해할 수 있습니다. 동시에 현미경으로 볼 때 삼첨판 판막이 어디에 나타나는지 정확하게 결정해야 합니다. hematoxylin eosin 염색 공정에서는 비특이적 염색을 방지하기 위해 염색 시간과 염색 용액의 농도를 정밀하게 제어해야 합니다.
죽상동맥경화증을 평가하는 기존의 우수한 방법과 비교하여, 이 프로토콜은 대동맥궁과 뿌리를 모두 해부하기 위한 단계별 세부 정보를 제공했으며, 이는 죽상경화증 상태를 종합적으로 평가하는 데 도움이 될 수 있습니다11,13 헤마톡실린-에오신 염색과 VVG 염색은 모두 대동맥근 병변 부위를 평가하는 데 도움이 될 수 있으며, 이는 죽상동맥경화증의 정량화 정확도를 높입니다.
그러나 대동맥 오일 레드 O 염색에는 여전히 몇 가지 한계가 있습니다. 예를 들어, 오일 레드 염색은 주로 지질을 검출하는 데 사용되지만 다른 유형의 세포 또는 조직 구성 요소에 대해서는 특이성이 낮아 오분류로 이어질 수 있습니다11. 반면에, 샘플 고정 및 해부 과정은 지질의 손실로 이어질 수 있으며, 이로 인해 염색 결과의 신뢰성에 영향을 미칠 수 있습니다. 대동맥근의 헤마톡실린-에오신 염색은 세포 성분을 구별하는 데 한계가 있어 조직 구조가 복잡한 경우 병변의 특정 부위를 식별하기 어려울 수 있습니다. 정량적 분석을 수행할 때 패치 영역의 통계적 결과도 관찰자의 주관적인 판단에 영향을 받을 수 있습니다. 또한 hematoxylin-eosin 염색은 주로 형태학적 정보를 제공하며 세포 기능이나 분자 특성에 대한 통찰력을 제공하지 않습니다.
표준 오일 레드 염색 및 헤마톡실린-에오신 염색 외에도 죽상경화성 플라크를 분석하기 위한 다른 기술에는 Masson 염색, 다양한 항원에 대한 면역조직화학 염색 및 플라크의 구성 및 치수를 검사하는 데 사용할 수 있는 기타 방법이 포함됩니다. 대동맥근 절편의 오일 레드 O 염색은 대동맥근의 지질 침착을 분석하는 데에도 널리 사용됩니다14. Alizarin Red S 염색은 칼슘 침전물을 감지하는 데 일반적으로 사용되는 염색입니다. 칼슘 이온과 적색 복합체를 형성하여 칼슘 침전물을 시각화하는 데 이상적입니다15. 또한 지질 대사는 고밀도 지단백(HDL), 저밀도 지단백(LDL), 총 콜레스테롤(TC) 및 총 트리아실글리세롤(TG) 수준과 같은 혈청 생화학적 마커에서 추론할 수 있습니다. 죽상동맥경화증의 발병에 기여하는 주요 요인 중 하나는 비정상적인 지질 대사, 특히 죽상동맥경화증과 심혈관 질환(ASCVD) 및 저밀도 지단백 콜레스테롤(LDL) 수치 사이의 관계입니다.
죽상동맥경화증에 대한 연구가 심화됨에 따라 향후 정량적 분석 방법의 개발은 더욱 정확하고 다양해질 것입니다. 첫째, 고해상도 MRI, 광간섭 단층촬영(OCT) 및 초음파 이미징과 같은 고급 이미징 기술의 통합으로 죽상경화증에 대한 정량적 분석이 보다 정확해져 살아있는 마우스의 동적 모니터링이 가능해질 것입니다. 이는 플라크 진행, 안정성 및 치료에 대한 반응을 실시간으로 평가하는 데 도움이 됩니다. 분자 이미징 기술의 발전으로 정량 분석을 통해 플라크 내 염증 반응, 지질 축적 및 세포 성분에 대한 심층 분석이 가능해짐에 따라 죽상동맥경화증의 조기 진단 및 치료를 위한 보다 포괄적인 데이터를 제공할 수 있게 되었습니다16.
공개
선언할 것이 없습니다.
감사의 말
이 연구는 상하이 스포츠 대학의 운동 및 공중 보건 연구 프로그램(0831), 상하이 고등 교육 젊은 교사 훈련 기금 프로그램(A2-0213-22-0058-5), 상하이 시 과학 기술 위원회 상하이 우수 학술 지도자 계획(21XD1403200)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Adhesion microscope slides(25×75mm) | CITOTEST | Cat# 80312-3161 | |
| Embedding cassette | CITOTEST | Cat# 80106-1100-16 | |
| Eosin Staining Solution | Beyotime | Cat# C0109 | |
| Ethanol | Sinopharm Chemical Reagent Co. | Cat# 10009218 | |
| Hematoxylin Staining Solution | Beyotime | Cat# C0107 | |
| Low-profile disposable blades | Leica | Cat# 14035838925 | |
| Microscope cover glass(24×50mm) | CITOTEST | Cat# 10212450C | |
| Neutral Balsam Mounting Medium | Sango Biotech | Cat# E675007-0100 | |
| Oil red o powder | Sigma-Aldrich | Cat# 1320-06-5 | |
| paraffin with ceresin | Sinopharm Chemical Reagent Co. | Cat# 69019461 | |
| Paraformaldehyde | Servicebio | Cat# G1101 | |
| Phosphate Buffered Saline (PBS, Powder) | Servicebio | Cat# G0002-2L | |
| Ponceau S Staining Solution | EveryLab | Cat# FM024 | |
| Victoria Blue’B | Aladdin | Cat# 2580-56-5 | |
| Xylene | Sigma-Aldrich | Cat# 104-81-4 |
참고문헌
- Libby, P., et al. Atherosclerosis. Nat Rev Dis Primers. 5 (1), 56 (2019).
- Herrington, W., Lacey, B., Sherliker, P., Armitage, J., Lewington, S. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease. Circ Res. 118 (4), 535-546 (2016).
- Frostegård, J. Immunity, atherosclerosis and cardiovascular disease. BMC Med. 11, 117 (2013).
- Gisterå, A., Ketelhuth, D. F. J., Malin, S. G., Hansson, G. K. Animal models of atherosclerosis-supportive notes and tricks of the trade. Circ Res. 130 (12), 1869-1887 (2022).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arterioscler Thromb Vasc Biol. 32 (5), 1104-1115 (2012).
- Ilyas, I., et al. Mouse models of atherosclerosis in translational research. Trends Pharmacol Sci. 43 (11), 920-939 (2022).
- Liu, L., Chan, M., Yu, L., Wang, W., Qiang, L. Adipsin deficiency does not impact atherosclerosis development in ldlr(-/-) mice. Am J Physiol Endocrinol Metab. 320 (1), E87-E92 (2021).
- Liu, L., et al. Pparγ deacetylation confers the antiatherogenic effect and improves endothelial function in diabetes treatment. Diabetes. 69 (8), 1793-1803 (2020).
- Zahr, T., et al. Pparγ (peroxisome proliferator-activated receptor γ) deacetylation suppresses aging-associated atherosclerosis and hypercholesterolemia. Arterioscler Thromb Vasc Biol. 43 (1), 30-44 (2023).
- Tang, C., et al. Endothelial ccrl2 induced by disturbed flow promotes atherosclerosis via chemerin-dependent β2 integrin activation in monocytes. Cardiovasc Res. 119 (9), 1811-1824 (2023).
- Andrés-Manzano, M. J., Andrés, V., Dorado, B. Oil red o and hematoxylin and eosin staining for quantification of atherosclerosis burden in mouse aorta and aortic root. Methods Mol Biol. 1339, 85-99 (2015).
- Mehlem, A., Hagberg, C. E., Muhl, L., Eriksson, U., Falkevall, A. Imaging of neutral lipids by oil red o for analyzing the metabolic status in health and disease. Nat Protoc. 8 (6), 1149-1154 (2013).
- Chen, P. Y., Qin, L., Simons, M. Imaging and analysis of oil red o-stained whole aorta lesions in an aneurysm hyperlipidemia mouse model. J Vis Exp. (183), e61277 (2022).
- Lin, Y., et al. Practical assessment of the quantification of atherosclerotic lesions in apoe-/- mice. Mol Med Rep. 12 (4), 5298-5306 (2015).
- Bozycki, L., Łukasiewicz, K., Matryba, P., Pikula, S. Whole-body clearing, staining and screening of calcium deposits in the mdx mouse model of duchenne muscular dystrophy. Skelet Muscle. 8 (1), 21 (2018).
- Glaudemans, A. W., et al. Molecular imaging in atherosclerosis. Eur J Nucl Med Mol Imaging. 37 (12), 2381-2397 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유