Method Article
임플란트 표면의 M1 및 M2 인간 단핵구 유래 대식세포의 분극 및 특성화
요약
여기에서는 현재 프로토콜의 신뢰성과 재현성을 개선하고 추가 연구를 촉진하는 것을 목표로 in vitro 임플란트 표면의 면역 조절 가능성을 평가하기 위한 자세한 프로토콜을 제시합니다. 분비 사이토카인 프로파일, mRNA 발현 및 세포 표면 마커는 혈액 단핵구 유래 대식세포를 사용하여 모니터링하여 티타늄에서 배양된 대식세포 분극을 조사했습니다.
초록
면역 매개 복합 치유 과정인 이물질 반응(FBR)은 임플란트를 신체에 통합하는 데 중요한 역할을 합니다. 대식세포는 면역 체계가 임플란트 표면과 상호 작용하는 첫 번째 라인으로, 염증-재생 균형을 조절하는 데 양방향 역할을 합니다. 임플란트 재료와 면역 반응 간의 반응에 대한 심층적인 이해와 평가를 위해서는 신뢰할 수 있는 체외 방법과 프로토콜이 매우 중요합니다. 다양한 in vitro 모델 중에서 1차 단핵구 유래 대식세포(MDM)는 대식세포-임플란트 상호 작용을 조사하기 위한 훌륭한 모델을 제시합니다. 우리는 임플란트 표면에서 MDM이 M1(고전적으로 활성화된) 및 M2(대안적으로 활성화된) 대식세포로 분극되는 것을 평가하기 위한 실험 프로토콜을 구현했습니다. 건강한 기증자로부터 혈액 단핵구를 분리하고 대식세포 집락자극인자(M-CSF)를 사용하여 대식세포로 분화시켰습니다. 분화된 대식세포를 임플란트 표면에서 배양하고 M1 및 M2 아형으로 편광시켰습니다. M1 분극은 인터페론(IFN)-γ 및 지질다당류(LPS)의 존재 하에서 달성되었으며, M2 분극은 인터류킨(IL)-4 및 IL-13을 함유한 배지에서 수행되었습니다. 분비된 사이토카인, 세포 표면 마커 및 발현 유전자 패널을 기반으로 ELISA(Enzyme-linked Immunosorbent Assay), CLSM(Confocal Laser scanning Microscopy) 및 qRT-PCR(quantitative real-time PCR)을 통해 대식세포 표현형을 평가했습니다. 추출된 RNA는 상보적 DNA(complementary DNA)로 형질전환하고, qRT-PCR을 사용하여 M1 및 M2 대식세포와 관련된 mRNA를 정량화했습니다. 이에 따라, M1 대식세포는 CD209 및 CCL13 수치가 높은 M2 대식세포에 비해 전염증성 종양괴사인자(TNF-α) 사이토카인 및 CCR7 표면 마커의 발현이 더 높은 특징이 있습니다. 결과적으로, CCR7 및 CD209는 CLSM에 의한 면역염색 및 시각화를 통해 M1 및 M2 대식세포 아형의 특이적이고 신뢰할 수 있는 마커로 확인되었습니다. ELISA가 M1에서 TNF-ɑ 수치 상승과 M2 세포에서 CCL13 증가를 감지하여 추가 확인을 달성했습니다. 제안된 마커 및 실험 설정은 임플란트의 면역 조절 가능성을 평가하는 데 효과적으로 사용할 수 있습니다.
서문
이식형 생체 재료는 다양한 인간 질병에 대한 전통적인 솔루션이 되었으며 조직 공학, 약물 전달 시스템 및 임플란트를 포함한 생물 의학 연구에서 큰 역할을 합니다 1,2. 고관절 보철물, 스텐트, 메쉬, 심장 판막 또는 치과 임플란트와 같이 구조와 기능이 다른 다양한 재료로 만든 다양한 임플란트가 있습니다. 이식 시 조직-임플란트 접촉은 면역 반응을 유발하고 해결, 조직 리모델링 및 항상성이 뒤따릅니다. 이러한 공정은 사용되는 생체 재료의 물리적, 화학적, 생체 활성 특성의 영향을 받습니다. 이러한 특성은 전염증 및 항염증 반응의 강도와 스펙트럼, 섬유낭 형성, 조직 분해 및 치유 단계에 영향을 미칠 수 있습니다 3,4. 치유 과정과 장기적인 임플란트 통합을 지원하고 최적화하기 위해 현재 연구의 새로운 측면 중 하나는 임플란트 표면과 면역 세포 간의 상호 작용을 조사하고 중재하는 것입니다.
다른 면역 세포 중에서도 몸 전체에 존재하는 대식세포는 염증과 항병원성 방어, 치유 과정, 조직 항상성 유지에 중요한 역할을 합니다 5,6. 대식세포는 가소성과 국소 조직 미세환경 자극에 따라 뚜렷한 기능적 표현형으로 분극화할 수 있으며, 이는 세포 대사, 세포 기능 및 사이토카인 분비 프로필에서 큰 차이를 보입니다. 고전적으로 활성화된 M1 표현형은 IL-1β, IL-6, TNF-α와 같은 전염증성 사이토카인의 분비에 의해 구별될 수 있으며, 외상 및 외부 생체 물질에 대한 초기 및 만성 염증 반응에 관여합니다. 대조적으로, IL-4 및 IL-13과 같은 사이토카인에 의해 유발되는 활성화된 M2 대식세포는 염증 해소 및 조직 치유 촉진과 같은 특징적인 특징을 가지고 있습니다. M2 편광 대식세포는 CD206과 같은 세포 표면 마커의 발현과 IL-10 및 IL-4와 같은 사이토카인의 생성으로 식별할 수 있습니다7. 마찬가지로, 이미 편광된 대식세포는 새로운 미시환경에서 스스로를 재프로그래밍할 수 있습니다.
세포-생체 재료 상호 작용에 대한 많은 연구는 이식 가능한 생체 재료에 대한 면역학적 반응의 연쇄 반응 및 임플란트 관련 합병증의 치유와 관련된 프로세스를 조율하는 데 있어 대식세포의 중요성을 보여주었습니다 8,9,10. 최근 몇 년 동안 생체공학이 상당한 진전을 이루었지만, 임플란트가 대식세포 행동과 분극을 어떻게 조절하는지 이해하기 위해서는 추가 연구가 필요합니다 11,12,13.
세포 배양에서 단핵구 유래 말초 혈액 단핵 세포(PBMC)는 부착 M0 대식세포로 분화한 후 LPS 및 IFN-γ 또는 IL-4를 각각 사용하여 M1 또는 M2 표현형으로 유도 분극할 수 있습니다. 새로운 생체 재료 표본으로 in vitro 배양 후, M1 및 M2 대식 세포의 다양한 세포 표면 수용체와 사이토카인 프로파일을 활용하여 in vitro14,15 생체 재료의 면역 조절 가능성을 검출할 수 있습니다. 이 연구는 다양한 임플란트 표면에 대한 MDM의 분극을 조사하는 데 사용할 수 있는 체외 프로토콜을 개발하는 것을 목표로 했습니다. 유전자 발현 분석, 현미경 기술 및 ELISA를 사용하여 생체 물질에 의해 조절되는 M1 및 M2 대식세포의 표현형 마커 및 특정 사이토카인 프로파일을 결정할 수 있습니다. 따라서 대식세포와 생체 물질 표면 간의 복잡한 상호 작용을 규명할 수 있으며 대식세포-생체 물질 상호 작용을 더 잘 이해하기 위한 귀중한 정보를 얻을 수 있습니다. 마지막으로, 표준화된 in vitro 프로토콜은 실험 설정의 변동성을 최소화하여 실험 결과의 재현성, 신뢰성 및 비교 가능성을 보장합니다.
프로토콜
인간 말초 혈액은 튀빙겐 대학교 의학부 윤리 위원회에서 승인한 프로토콜(윤리적 승인: 286/2021 BO)에 따라 건강한 헌혈자로부터 얻었습니다. 인간 PBMC는 앞서 설명한 바와 같이 밀도 구배 원심분리(Density Gradient Centrifugation)를 사용하여 분리하였다16. 다음 프로토콜은 24mL의 혈액에서 분리된 PBMC에 대해 요약되어 있습니다. 프로토콜의 개략도는 그림 1에 나와 있습니다.
참고: 혈액량은 사용된 M0 대식세포의 수에 따라 조정해야 합니다.
24mL의 혈액에서 총 3,546± 910만 개의 PBMC를 얻어 1.97± 0.46만 M0 대식세포(n=5)를 얻었습니다. 모든 시약, 소모품 및 장치는 재료 표에 나열되어 있습니다. 버퍼는 표 1에 나열되어 있습니다.
1. 인간 혈액 단핵구와 대식세포의 분화
- 분리된 PBMC를 15mL의 예열된 단핵구 부착 배지에 재현탁시키고 하나의 T75 세포 배양 플라스크로 옮깁니다.
- 접착을 위해 37°C 및 5%CO2 에서 90분 동안 세포를 배양합니다.
- 상층액을 버리고 예열된 완전한 배지로 세포를 부드럽게 기울여 한 번 세척하여 비부착성 또는 느슨하게 부착된 세포를 제거합니다.
참고: 부착된 세포는 단핵구이며, 이는 원래 플라스크에 추가된 총 PBMC의 약 10%를 차지합니다. - 부착 세포에 10ng/mL 대식세포 집락자극인자(M-CSF)를 함유한 완전한 배지 15mL를 첨가하고 분화를 촉진하기 위해 6일 동안 배양합니다.
- 배지를 2일마다 10ng/mL M-CSF를 함유한 신선하고 완전한 배지로 교환합니다.
2. 티타늄 임플란트 표면에서 MDM의 배양 및 분극
참고: 분화 6일차에 M0 대식세포를 완전히 편광된 M1 또는 M2 대식세포를 얻기 위해 48시간 동안 다른 자극으로 생체 재료 표면에 파종했습니다. 검사된 각 표면에 대해 3개의 디스크를 사용하여 M0, M1 및 M2 대식세포를 파종했습니다. 세포 배양 처리된 플라스틱 커버슬립이 대조 표면으로 사용되었습니다.
- T75 플라스크에서 배양 배지를 제거하고 10mL의 PBS로 5분 동안 세포를 세척합니다.
- 부착 세포를 예열된 세포 분리 용액 10mL로 30분 동안 배양하여 부착 세포를 분리합니다.
- 세포를 가볍게 두드려 50mL 튜브에 옮깁니다. PBS 10mL에 나머지 세포를 부드럽게 긁어내어 분리합니다.
- 분리된 세포를 50mL 튜브로 옮기고 300 x g 에서 10분 동안 원심분리합니다.
- 상등액을 버리고 예열된 완전 배지 5mL에 세포를 재현탁합니다.
- 트리판 블루 염색과 혈구계를 사용하여 세포 수와 생존력을 측정하여 세포를 계수합니다.
- 세포 수를 완전한 배지 1mL당 160,000개의 세포로 조정하여 세포 현탁액을 준비합니다.
- 생체 재료 디스크를 70% 에탄올에서 5분 동안 초음파로 세척한 다음 70% 에탄올에서 30분 동안 멸균합니다.
- 티타늄 디스크를 1-2시간 동안 건조시킨 다음 처리되지 않은 24웰 플레이트에 넣고 각 웰에 준비된 세포 현탁액 1mL를 추가합니다.
- M1 편광 대식세포를 얻으려면 IFN-γ와 LPS를 각각 50ng/mL 및 10ng/mL 농도로 첨가합니다. M2 분극의 경우 IL-4 및 IL-13을 각각 20ng/mL 농도로 첨가합니다. M0 세포가 분극제 없이 성장했는지 확인합니다. 분극을 유도하기 위해 37°C 및 5% CO2 에서 48시간 동안 세포를 더 배양합니다.
3. ELISA를 사용한 편광 대식세포의 특성 분석
참고: 편광 2일차에 특성화 분석을 위해 샘플을 준비했습니다. TNF-ɑ 사이토카인 및 CCL13 케모카인을 측정하여 각각 M1 및 M2 편광 대식세포를 특성화했습니다. 분비된 단백질의 농도는 해당 상등액에서 분비된 단백질의 총 농도로 정규화되었습니다.
- 1.5mL 튜브에 상층액을 넣고 300 x g 에서 5분 동안 원심분리합니다. 상등액을 새 튜브로 옮깁니다.
- 추가 실험을 위해 디스크를 새로운 24웰 플레이트로 옮깁니다. 목적은 처리되지 않은 24웰 플레이트에서 죽거나 느슨하게 부착된 세포를 제거하는 것입니다.
참고: 분석을 수행하기 전에 표면에서 세포 생존율을 확인해야 합니다. 세포의 생존율은 살아있는/죽은 세포 생존율 분석을 통해 또는 세포 증식 및 세포 독성 검사를 통해 간접적으로 측정할 수 있습니다. - 사이토카인과 케모카인은 제조업체가 제공한 특정 지침에 따라 측정합니다. 사이토카인을 즉시 측정하거나 향후 측정을 위해 -80°C에서 샘플을 보관하십시오.
참고: 각 유형의 키트에 대해(ELISA 키트의 감도 및 검출 한계 고려) 적절한 샘플 희석을 결정해야 합니다. bicinchoninic acid (BCA) 분석을 위해 샘플을 1 : 5로 희석했습니다. TNF-ɑ에 대한 M1 샘플은 1:10으로 희석되었고, CCL13에 대한 M2 샘플은 1:12로 희석되었습니다. - 제조업체 지침에 따라 표준 곡선을 사용하여 분비된 사이토카인/케모카인의 농도를 계산합니다.
- BCA 단백질 분석 키트를 사용하여 총 단백질 양을 측정하십시오.
- 분비되는 단백질의 농도를 총 단백질의 mg으로 정규화합니다.
4. CLSM을 이용한 편광 대식세포의 특성화
참고: 편광된 대식세포는 CD209 및 CCR7 세포 표면 마커에 대한 항체로 염색하여 추가로 특성화되었습니다. 핵은 DRAQ5로 대조염색되었습니다. CD68 또는 다른 마커를 범대식세포 마커로 사용할 수 있습니다.
- 800μL의 PBS에서 세포를 2x 세척합니다. 400μL의 고정 완충액에서 실온(RT)에서 20분 동안 디스크를 배양합니다.
- 정착 완충액을 제거한 후 400μL의 PBS에서 3회 세척합니다. 샘플을 즉시 염색하거나 4°C의 보관 버퍼 1mL에 보관하십시오.
참고: 이 고정 및 보관 프로토콜을 통해 샘플은 고정 후 1-6주 이내에 성공적으로 염색 및 이미지화되었습니다. - 다음 단계를 진행하기 전에 보관 후 800μL의 PBS로 디스크를 두 번 세척하십시오.
- RT에서 30분 동안 400μL의 차단 버퍼가 있는 디스크를 배양하여 불특이적 결합 부위를 차단합니다.
- 차단 완충액을 버리고 400μL의 염색 완충액에 희석된 1차 항체를 사용하여 RT에서 1시간 동안 디스크를 배양합니다.
- 이중 염색을 사용하여 면역형광 절차를 수행하여 하나의 샘플에서 CCR7 및 CD209의 발현을 검사합니다. 이를 위해 동일한 염색 단계에서 다른 종(마우스 및 토끼)에서 생성된 1차 항체를 결합합니다.
참고: 최소한의 배경으로 강력한 신호를 얻으려면 항체 농도를 최적화하십시오. CCR7 항체는 최종 농도 10μg/mL에서 사용하였고, CD209 항체는 1/400으로 희석하였다.
- 이중 염색을 사용하여 면역형광 절차를 수행하여 하나의 샘플에서 CCR7 및 CD209의 발현을 검사합니다. 이를 위해 동일한 염색 단계에서 다른 종(마우스 및 토끼)에서 생성된 1차 항체를 결합합니다.
- 1차 항체를 제거하고 400μL의 세척 버퍼로 3x 세척합니다.
- 염색 완충액에 희석된 형광단 표지된 2차 항체를 추가하고 어둠 속에서 RT에서 1시간 동안 배양합니다.
참고: 2차 항체의 농도는 최소한의 배경으로 최대 특이적 신호를 얻을 수 있도록 최적화되어야 합니다. 이 연구에서는 염색을 위해 5μg/mL의 농도로 2차 항체를 사용했습니다. - 상층액을 제거한 후 세척 버퍼에서 샘플을 각각 3분씩 3회 세척합니다.
- PBS에 10μM DRAQ5를 추가하고 빛으로부터 보호된 RT에서 15분 동안 배양합니다.
- 상층액을 제거하고 PBS에서 디스크를 한 번 세척합니다.
- 나머지 PBS를 제거하고 장착 매체 1방울을 추가합니다.
- 5분 후 커버 안경을 바르고 샘플을 1시간 동안 건조시킵니다.
- 샘플을 건조시킨 후 투명한 매니큐어로 가장자리를 밀봉하고 이미징할 때까지 어두운 곳에서 4°C에서 보관합니다.
- 세포의 개요를 얻으려면 25배 배율로 샘플을 이미지화합니다. 표면 마커의 구조와 위치 파악을 추가로 확인하려면 63배 배율로 이미지를 획득하십시오.
- ImageJ 소프트웨어를 사용하여 CCR7 및 CD209의 형광 강도를 정량화할 수 있습니다.
참고: 이미지 획득은 아르곤 레이저(488nm), DPSS 레이저(561nm) 및 HeNe 레이저(633nm)가 장착된 CLSM 시스템을 사용하여 광전자 증배관(PMT)으로 수행되었습니다.
5. qRT-PCR을 사용한 편광 대식세포의 특성 분석
참고: RNA 분리를 위해 cDNA 합성을 위한 충분한 RNA를 얻기 위해 샘플당 두 개의 디스크를 사용했습니다.
- 800μL의 PBS로 디스크를 2번 세척합니다.
- 첫 번째 디스크에 350μL의 용해 완충액을 추가하고 위아래로 피펫팅하여 세포를 용해합니다.
- 용해물을 두 번째 디스크로 옮기고 용해 과정을 반복합니다.
- 350μL의 70% 에탄올을 용해물에 첨가하고 균질해질 때까지 위아래로 피펫팅합니다.
- 용해물을 스핀 컬럼으로 옮기고 RNA 분리에 대한 제조업체의 지침을 따릅니다.
- nanodrop 또는 다른 장치를 사용하여 RNA 양을 정량화합니다.
- First-Strand cDNA 합성을 위한 RT-PCR 시스템을 사용하여 다양한 샘플에 대한 RNA 농도를 정규화하고 제조업체의 지침에 따라 cDNA를 합성합니다.
- 제조사의 프로토콜에 따라 350ng의 RNA를 사용하여 cDNA를 합성하고 qRT-PCR 분석이 수행될 때까지 -20°C에서 보관합니다.
참고: 여기서, 350ng의 정제된 RNA를 사용하여 20μL에서 4μL의 RT Mix(5x)를 사용하여 cDNA를 합성했습니다. - 96웰 플레이트 및 개별 15μL 반응(1x Syber Green 마스터 믹스, 0.2μM의 정방향 및 역방향 프라이머, 4.5μL의 1:10 희석된 cDNA)에서 Real-PCR 시스템에서 qRT-PCR을 수행합니다.
참고: PCR 프로그램은 가열된 뚜껑(105°C)으로 시작하여 95°C에서 3분 동안 초기 변성, 95°C에서 15초, 40주기 동안 55°C에서 30초의 세 단계로 진행됩니다. - 다양한 유전자의 발현 수준을 하우스키핑 유전자 GAPDH(또는 β-actin과 같은 다른 하우스키핑 유전자)로 정규화합니다.
- 조직 배양 커버슬립에서 배양된 M0 세포를 기준으로 2-ΔΔCt 방법을 사용하여 상대적 유전자 발현을 계산합니다. 표 2 에는 이 연구에 사용된 모든 프라이머가 나열되어 있습니다.
6. 통계 분석
- 모든 데이터를 SEM± 평균으로 제시합니다.재현성을 보장하기 위해 모든 분석을 반복합니다(이 연구에서는 분석이 5번 반복됨). 일원분산분석법(AN-Way of Disvariance, ANOVA)을 사용한 후 Tukey의 다중 검정을 사용하여 정규 분포를 둔 데이터 간의 통계적으로 유의한 차이를 평가합니다.
- Friedman 검정 및 Dunn의 다중 비교 검정을 사용하여 비모수 데이터 세트를 분석할 수 있습니다. 적절한 데이터 분석 소프트웨어를 사용하여 데이터를 분석하고 통계적 유의성을 0.05 미만의 p-값으로 정의합니다.
결과
이 연구의 결과는 티타늄 표면에서 MDM의 성공적인 분화 및 분극화를 입증한 후 M1 또는 M2 편광 대식세포의 특성화를 보여줍니다. 첫 번째 단계에서는 CLSM을 사용하여 편광 MDM을 특성화했습니다. 예비 연구에 따르면 CD209 및 CCR7은 M1과 M2 편광 MDM을 구별하기 위한 특정 마커로 사용되었습니다. 그림 2A, B에서 볼 수 있듯이 MDM은 M1 및 M2 대식세포로 성공적으로 분극화되었습니다. 티타늄 표면에서 CCR7은 M2 편광 대식세포에서 특이적으로 발현된 CD209보다 M1 편광 대식세포에서 더 강하게 발현되었습니다. 또한, 상대 형광 강도를 정량화하면 M1 또는 M2 하위 유형에 마커를 쉽게 할당할 수 있습니다(그림 2C).
그림 3 은 티타늄 및 커버슬립 표면의 MDM에 대한 대표적인 qRT-PCR 분석을 보여줍니다. 그 결과 M1(CCR7 및 TNF-ɑ) 및 M2(CD209 및 CCL13) 편광 마커의 높은 발현으로 입증된 바와 같이 두 표면의 MDM이 성공적으로 분극화되었음을 보여주었습니다. 이는 M1 및 M2 편광 세포에서 각각 높은 수준의 염증성 TNF-α 사이토카인(그림 4A) 및 IL-13 케모카인(그림 4B)을 관찰하여 단백질 수준에서 추가로 확인되었습니다.
그림 1: 프로토콜의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: CLSM을 사용한 편광 MDM의 특성화. M1 및 M2 편광 대식세포의 농축은 파종 후 2일차에 CCR7 및 CD209 항체를 사용한 특이 항체 염색 및 CLSM 분석을 통해 확인되었습니다. 형광 염색 및 CLSM 분석에 따르면 (A) 25배 배율 및 (B) 63배 배율에 따르면 M1 세포는 M0 또는 M2보다 더 높은 CCR7(녹색)을 발현했습니다. M2 세포는 유의미한 CD209 발현 패턴(녹색)을 보입니다. (C) CCR7 및 CD209의 상대 형광 강도의 정량 분석. 핵은 DRAQ5(자주색)로 염색되었습니다. 결과는 독립적으로 수행된 5개의 유사한 실험을 대표합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
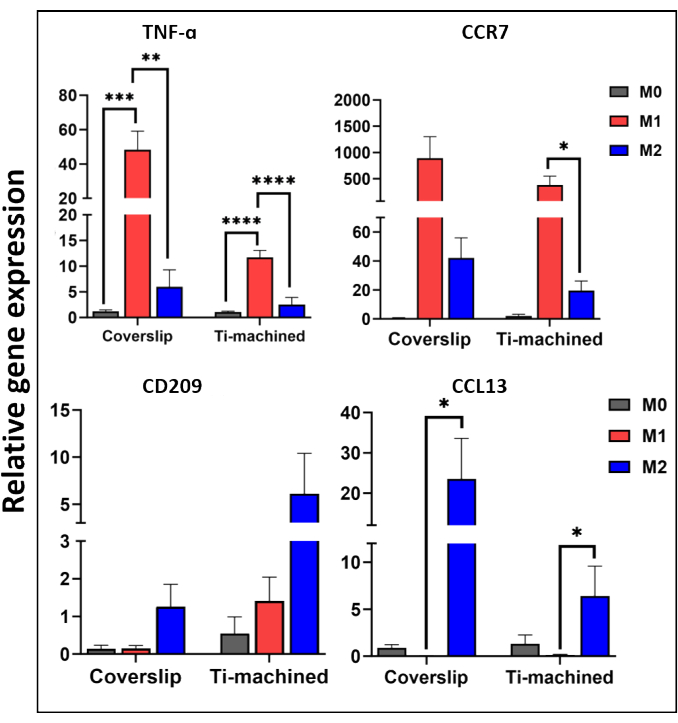
그림 3: 유전자 발현 프로파일을 사용한 편광 MDM의 특성화. M1(CCR7 및 TNF-ɑ) 및 M2(CD209 및 CCL13) 분극과 관련된 다양한 유전자의 mRNA 수준을 연구하기 위해 정량적 역전사 중합효소를 사용했습니다. GAPDH는 하우스키핑 유전자로 사용되었다. 데이터는 평균 ± SEM(n = 5)으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
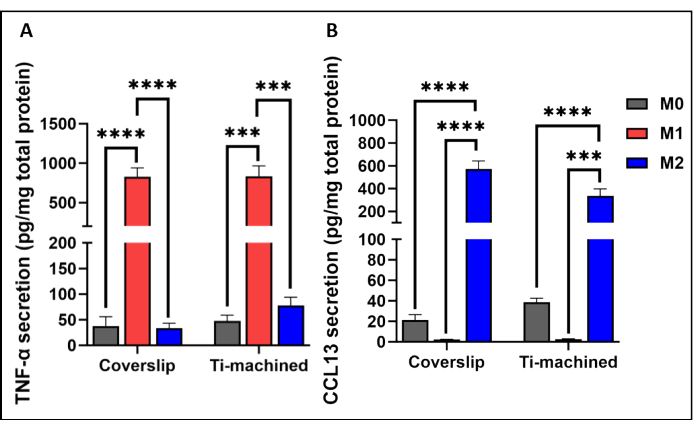
그림 4: 티타늄 및 플라스틱 커버슬립에서 배양된 M0, M1 및 M2 대식세포에 의한 사이토카인 생산. 세포 배양 상등액의 (A) TNF-ɑ 사이토카인 수치 및 (B) CCL13 수치는 ELISA를 사용하여 측정되었습니다. 사이토카인 분비는 BCA 분석법으로 측정된 총 단백질 분비로 정규화하였다. 막대 그래프는 평균 ± SEM(n = 5)을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 버퍼/솔루션 | 콘텐츠 |
| 염색/차단 완충액 | PBS + 1% BSA + 0.1% 트윈 20 |
| 세척 버퍼 | PBS + 0.1% 트윈 20 |
| 정착 완충액 | PBS의 파라포름알데히드(PFA) 3% |
| 스토리지 버퍼 | PBS에 함유된 페니실린과 스트렙토마이신의 1% |
표 1: 버퍼 목록.
| 프라이머 이름 | 포워드 프라이머 염기서열 | 프라이머 염기서열 반전 |
| 갭디(GAPDH) | 5'-GAGTCAACGGATTTGGTCGT-3' | 5'-TTGATTTTGGAGGGATCTCG-3' |
| CCR7 | 5'- TGGTGATCGGCTTTCTGGTC-3' | 5'- CACCTTGATGGCCTTGTTGC-3' |
| CD209 | 5'- GGAGCAGAACTTCCTACAGC-3' | 5'- CAACGTTGTTGGGCTCTCCT-3' |
| CCL13 시리즈 | 5'-ATCTCCTTGCAGAGGCTGAA-3' | 5'-ACTTCTCCTTTGGGTCAGCA-3' |
| TNF-ɑ | 5'- GCTGCACTTTGGAGTGATCG-3' | 5'- TCACTCGGGGTTCGAGAAGA-3' |
표 2. qRT-PCR에 사용되는 프라이머 서열.
토론
대식세포 거동에 대한 철저한 이해는 이식 가능한 물질의 면역 조절 특성을 이해하는 데 필수적입니다. 여러 연구에서 이질적인 마커, 다양한 세포 모델 및 대식세포 분극을 특성화하기 위한 프로토콜이 in vitro 17,18,19,20에 보고되었습니다. 실험 결과의 재현성, 신뢰성 및 비교 가능성을 개선하려면 적절한 세포 모델 및 합의 특성화 마커와 함께 표준화되고 검증된 프로토콜이 필수적입니다. 따라서 임플란트 재료의 면역 조절 특성을 정확하게 시뮬레이션하려면 먼저 적절한 세포 모델이 필요합니다. 다양한 연구에서 분리된 조직 대식세포, 혈액 단핵구에서 유래한 분화된 대식세포, 불멸화된 단핵구 세포주와 같은 광범위한 세포 모델을 활용했습니다. 조직 분리된 대식세포는 생체 내 조건을 더 잘 대표하는 것으로 간주될 수 있지만, 기술적으로나 윤리적으로 도전적입니다21,22. 대식세포는 또한 THP1 세포 23,24,25,26과 같은 확립된 불멸화된 단핵 세포주에서 자주 얻어집니다. 이러한 세포는 비노화 세포의 무제한 공급원으로서 세포 반응에서 더 많은 균질성을 제공할 수 있지만, 일반적으로 혈액 신생물이 있는 환자로부터 얻을 수 있으며 반응은 정상 세포와 크게 다를 수 있습니다. 예를 들어, 단핵구 THP1 세포는 M1 시뮬레이터에 더 잘 반응하고 M1 특성을 나타낼 가능성이 더 높은 것으로 보고되었습니다22. 이 연구의 결과는 예비 연구(여기에 제시되지 않은 데이터)의 결과와 일치합니다.
또한, 혈액 유래 단핵구는 조직 상주 대식세포의 전구체로 간주되고 더 높은 수율로 쉽게 얻을 수 있기 때문에 대식세포에 대한 실현 가능한 대안이 될 수 있습니다 27,28,29. 혈액 단핵구 유래 대식세포를 사용한 연구를 기반으로 우리는 이러한 세포가 티타늄 및 세포 배양 처리된 커버슬립 모두에서 M1 및 M2 자극제에 동등하게 반응한다는 것을 발견했습니다. 또한 그들은 여러 M1 및 M2 합의 마커를 나타냈으며, 그 중 일부는 대표 결과에 나와 있습니다. 그 결과 MDM이 임플란트-대식세포 상호 작용을 시뮬레이션하기 위한 실현 가능한 체외 모델로 활용될 수 있음을 보여주었습니다.
면역조절 연구의 추가적인 발전을 위해서는 지속적이고 특이적인 특성화 마커가 필수적입니다. 연구에 따르면 대식세포 특성화를 위한 다양한 마커가 소개되었는데, 이는 서로 다른 출처의 대식세포뿐만 아니라 동일한 출처의 대식세포 간에도 차이가 있습니다 17,18,19,24. MDM의 특징인 M1 및 M2 마커 패널은 보고된 다양한 마커의 평가를 통해 결정되고 검증되었습니다. 이 문서에는 가장 중요한 키 마커 중 일부가 나와 있습니다.
가장 적절한 감지 방법을 결정하는 것도 평가 프로세스의 중요한 부분입니다. 세포 표면 마커를 평가하는 데 일반적으로 사용되는 분석 기법은 일반적으로 생체 재료에서 세포를 제거해야 합니다. 그러나, 이 과정은 세포의 표면 마커를 손상시키고 분리된 세포의 수를 줄임으로써 세포에 부정적인 영향을 미치는 것으로 관찰되었다(30). 결과적으로, 세포 분리가 필요한 유세포 분석은 임플란트에 단단히 부착된 대식세포를 평가하는 데 적합하지 않습니다. 본 연구에서는 CLSM을 이용하여 세포 표면 마커 검출을 실시하였다. 적절한 마커를 사용하고 염색 과정을 최적화함으로써 M1 및 M2 아형을 서로 비교하고 M0 세포와 비교하여 성공적으로 특성화할 수 있었습니다. 형광 염색은 반정량적이라는 점에 유의하는 것이 중요하며, 이는 한계 중 하나입니다. 이는 유의미한 차이 없이 모든 하위 유형에 걸쳐 발현된 마커를 사용하여 세포를 평가하는 것을 복잡하게 만들 수 있습니다. CCR7 및 CD209는 CLSM을 사용하여 MDM을 특성화하기 위해 서로 다른 마커를 테스트한 후 선택되었습니다. CCR7 및 CD209는 각각 M1 및 M2 아형에서 일관되게 더 높게 발현되었습니다.
이 연구의 한계 내에서, 이 결과는 임플란트 표면의 대식세포를 분극화하고 유전자 발현, 분비 단백질 및 세포 표면 마커 측면에서 대식세포를 정확하게 특성화하는 데 구현된 프로토콜의 유용성과 효과를 강조합니다. 또한, 설명된 마커를 분석한 결과 MDM의 다양한 하위 유형을 구별하는 데 사용할 수 있는 일관되고 구체적인 발현 패턴이 밝혀졌습니다. 그러나 이 in vitro 모델은 인간 대식세포의 표현형 다양성과 가소성을 완전히 반영하지 못합니다. 현재 여러 대식세포 아형(M2a, M2b, M2c, M2d)이 확인되고 있으며, 이는 다양한 생체 재료와 그 특성(예: 물리화학적 특성)이 대식세포 가소성 및 분극에 미치는 영향을 연구하기 위해 보다 다양한 시험관 내 모델이 필요함을 나타냅니다31,32. in vitro 모델을 사용하여 복잡한 in vivo 상황을 반영하는 것은 불가능하지만, 새로운 이식 가능한 생체 재료의 면역 조절 잠재력을 효과적으로 설명하기 위해 제시된 in vitro 프로토콜을 사용하여 많은 결과를 얻을 수 있습니다9. 마지막으로, 복잡한 생리학적 맥락에서 다른 플레이어의 역할을 포함하는 더 복잡한 시험관 내 또는 생체 내 모델에서 대식세포를 특성화하기 위해서는 추가 확립이 필요합니다. 전반적으로 이 연구는 면역 조절 생체 재료의 개발 및 설계에 기여하여 유리한 조직 재생 과정과 성공적인 임플란트 통합을 개선 및 촉진하고 임플란트 관련 만성 염증을 예방할 것입니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
디스크는 독일 Bad-Neuenahr-Ahrweiler에 위치한 Medentis Medical에서 친절하게 제공했습니다. 저자는 구강악안면외과(University Hospital Tuebingen)의 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 24-well plate, not-treated | Corning Incorporated (Kennebunk, USA) | 144530 | |
| Absorbance reader Infinite F50 | TECAN Austria GmbH (Grödig, Austria) | TCAT91000001 | |
| Accutase in DPBS, 0.5 mM EDTA | EMD Millipore Corp. (Burlington, USA) | SCR005 | |
| Anti-Fade Fluorescence Mounting Medium -Aqueous, Fluoroshield | abcam (Cambridge, UK) | ab104135 | |
| Bio-Rad MJ Research PTC-200 Peltier Thermal Cycler | Bio-Rad / MJ Research | 7212 | |
| Bovine serum albumin (BSA) | VWR International bvba (Leuven, Belgium) | 422361V | |
| Centrifuge 5804 R | Eppendorf SE (Hamburg, Germany) | 5804 R | |
| DC-SIGN (D7F5C) XP Rabbit mAb | Cell Signaling Technology | 13193 | |
| Dimethyl sulfoxide | Sigma Aldrich Co. (St.Louis, MO, USA) | D2438-5X10ML | |
| DRAQ5 Staining Solution | Milteny Biotec (Bergisch Gladbach, Germany) | 130-117-344 | |
| Ethanol ≥99.8% for molecularbiology | Carl Roth GmbH + CO. KG (Karlsruhe, Germany) | 1HPH.1 | |
| Goat Anti-Mouse IgG (H&L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | Invitrogen | A32723TR | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Cyanine3 | Invitrogen | A10520 | |
| GraphPad Prism | GraphPad | Version 9.4.1 | |
| Human CCR7 Antibody | R&D Systems | MAB197 | |
| Human IFN-gamma Recombinant | Invitrogen (Rockford, USA) | RIFNG100 | |
| Human IL-13 | Milteny Biotec (Bergisch Gladbach, Germany) | 5230901032 | |
| Human IL-4 | Milteny Biotec (Bergisch Gladbach, Germany) | 130-095-373 | |
| Human M-CSF | Peprotech (Cranbury, USA) | 300-25 | |
| Leica TCS SP5 | Leica Microsystems CMS GmbH (Mannheim, Germany) | https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp5/ | |
| Lipopolysaccharides from Escherichia | Sigma Aldrich Co. (Missouri, USA) | L4391-1MG | |
| Luna Universal qPCR Master Mix | New England Biolabs | NEB #M3003 | |
| LunaScript RT SuperMix Kit | New England Biolabs | E3010L | |
| Lymphocyte Separation Medium 1077 | PromoCell (Heidelberg, Germany) | C-44010 | |
| MCP-4/CCL13 Human ELISA Kit | Invitrogen | EHCCL13 | |
| MicroAmp Fast 96-Well Reaction Plate (0.1 mL) | Applied Biosystems (Waltham, USA) | 4346907 | |
| MicroAmp Optical Adhesive Film | Life Technologies Corporation (Carlsbad, USA) | 4311971 | |
| MicroAmp Splash Free 96-Well Base | Applied Biosystems (Waltham, USA) | 4312063 | |
| Microlitercentrifuge CD-3124R | Phoenix Instrument (Germany) | 9013111121 | |
| Microscope Cover Glasses, 10 mm | Carl Roth GmbH, Karlsruhe, Germany | 4HX4.1 | |
| Monocyte Attachment Medium | PromoCell (Heidelberg, Germany) | C-28051 | |
| Multiply-Pro Gefäß 0.5 mL, PP | Sarstedt AG & CO (Nümbrecht, Germany) | 7,27,35,100 | |
| Nanodrop One | Thermo Scientific (USA) | ND-ONE-W | |
| QuantStudio 3 System | Life Technologies GmbH (St. Leon-Rot, Germany) | A28567 | |
| RNeasy Micro Kit | Qiagen | 74007 | |
| RPMI 1640, 1x, with L-glutamine | Mediatech, Inc. (Manassas, USA) | 10-040-CV | |
| Sterile bench, LaminarAir HB 2472 | Heraeus instruments (Hanau, Germany) | 51012197 | |
| Tissue Culture Coverslips 13 mm (Plastic) | Sarstedt Inc. (Newton, USA) | 83,18,40,002 | |
| Titanium machinied discs 12 cm | Medentis Medical (Bad-Neuenahr-Ahrweiler, Germany) | N/A | |
| TNF alpha Human ELISA Kit | Invitrogen | KHC3011 | |
| Trypan blue solution 0.4% | Carl Roth GmbH + Co. KG (Karlsruhe, Germany) | 1680.1 |
참고문헌
- Othman, Z., Pastor, B. C., van Rijt, S., Habibovic, P. Understanding interactions between biomaterials and biological systems using proteomics. Biomaterials. 167, 191-204 (2018).
- Ikada, Y. Challenges in tissue engineering. J R Soc Interface. 3 (10), 589-601 (2006).
- Aamodt, J. M., Grainger, D. W. Extracellular matrix-based biomaterial scaffolds and the host response. Biomaterials. 86, 68-82 (2016).
- Batool, F., et al. Modulation of immune-inflammatory responses through surface modifications of biomaterials to promote bone healing and regeneration. J Tissue Eng. 12, 20417314211041428 (2021).
- Mantovani, A., Biswas, S. K., Galdiero, M. R., Sica, A., Locati, M. Macrophage plasticity and polarization in tissue repair and remodelling. J Pathol. 229 (2), 176-185 (2013).
- Shrivastava, R., Shukla, N. Attributes of alternatively activated (M2) macrophages. Life Sci. 224, 222-231 (2019).
- Gordon, S., Taylor, P. R. Monocyte and macrophage heterogeneity. Nat Rev Immunol. 5 (12), 953-964 (2005).
- Mosser, D. M., Edwards, J. P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 8 (12), 958-969 (2008).
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41 (1), 14-20 (2014).
- Kzhyshkowska, J., et al. Macrophage responses to implants: prospects for personalized medicine. J Leukoc Biol. 98 (6), 953-962 (2015).
- Browne, S., Pandit, A. Biomaterial-mediated modification of the local inflammatory environment. Front Bioeng Biotechnol. 3, 67 (2015).
- Piatnitskaia, S., et al. Modelling of macrophage responses to biomaterials in vitro: state-of-the-art and the need for the improvement. Front Immunol. 15, 1349461 (2024).
- Rayahin, J. E., Gemeinhart, R. A. Activation of macrophages in response to biomaterials. Results Probl Cell Differ. 62, 317-351 (2017).
- Murray, P. J. Macrophage polarization. Annu Rev Physiol. 79, 541-566 (2017).
- Gordon, S., Pluddemann, A. Tissue macrophages: heterogeneity and functions. BMC Biol. 15 (1), 53 (2017).
- Salma Iqbal, A. K. Characterization of in vitro generated human polarized macrophages. J Clin Cell Immunol. 6, 1-8 (2015).
- Hotchkiss, K. M., et al. Titanium surface characteristics, including topography and wettability, alter macrophage activation. Acta Biomater. 31, 425-434 (2016).
- Wang, Y., Zhang, Y., Sculean, A., Bosshardt, D. D., Miron, R. J. Macrophage behavior and interplay with gingival fibroblasts cultured on six commercially available titanium, zirconium, and titanium-zirconium dental implants. Clin Oral Investig. 23 (8), 3219-3227 (2019).
- Abaricia, J. O., Shah, A. H., Ruzga, M. N., Olivares-Navarrete, R. Surface characteristics on commercial dental implants differentially activate macrophages in vitro and in vivo. Clin Oral Implants Res. 32 (4), 487-497 (2021).
- Lu, W., et al. Improved osseointegration of strontium-modified titanium implants by regulating angiogenesis and macrophage polarization. Biomater Sci. 10 (9), 2198-2214 (2022).
- Murray, P. J., Wynn, T. A. Obstacles and opportunities for understanding macrophage polarization. J Leukoc Biol. 89 (4), 557-563 (2011).
- Nascimento, C. R., Fernandes, N. A. R., Maldonado, L. A. G., Junior, C. R. Comparison of monocytic cell lines U937 and THP-1 as macrophage models for in vitro studies. Biochem Biophys Rep. 32, 101383 (2022).
- Freytes, D. O., Kang, J. W., Marcos-Campos, I., Vunjak-Novakovic, G. Macrophages modulate the viability and growth of human mesenchymal stem cells. J Cell Biochem. 114 (1), 220-229 (2013).
- Zhang, Y., et al. Macrophage type modulates osteogenic differentiation of adipose tissue MSCs. Cell Tissue Res. 369 (2), 273-286 (2017).
- Cerqueira, A., et al. Evaluation of the inflammatory responses to sol-gel coatings with distinct biocompatibility levels. J Biomed Mater Res A. 109 (9), 1539-1548 (2021).
- Zhang, Y., Cheng, X., Jansen, J. A., Yang, F., van den Beucken, J. J. Titanium surfaces characteristics modulate macrophage polarization. Mater Sci Eng C Mater Biol Appl. 95, 143-151 (2019).
- Nobs, S. P., Kopf, M. Tissue-resident macrophages: guardians of organ homeostasis. Trends Immunol. 42 (6), 495-507 (2021).
- Sreejit, G., Fleetwood, A., Murphy, A., Nagareddy, P. Origins and diversity of macrophages in health and disease. Clin Transl Immunology. 9 (12), e1222 (2020).
- Parisi, L., et al. Preparation of human primary macrophages to study the polarization from monocyte-derived macrophages to pro-or anti-inflammatory macrophages at biomaterial interface in vitro. J Dent Sci. 18 (4), 1630-1637 (2023).
- Feuerer, N., et al. Macrophage retrieval from 3D biomaterials: A detailed comparison of common dissociation methods. J Immunol Regen Med. 11, 100035 (2021).
- Shapouri-Moghaddam, A., et al. Macrophage plasticity, polarization, and function in health and disease. J Cell Physiol. 233 (9), 6425-6440 (2018).
- Sridharan, R., Cameron, A. R., Kelly, D. J., Kearney, C. J., O'Brien, F. J. Biomaterial based modulation of macrophage polarization: a review and suggested design principles. Mater Today. 18 (6), 313-325 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유