Method Article
소아 심장학에서 승모판 수술 계획에 3D 심초음파의 사용
요약
소아 심장학에서 승모판막의 3D 심장초음파검사는 수술 관리를 개선하는 데 기여하는 완전한 해부학적 재건을 생성합니다. 여기에서는 소아 심장학에서 승모판막의 3D 수집 및 후처리를 위한 프로토콜에 대해 간략하게 설명합니다.
초록
소아 심장학에서 발생하는 승모판 질환은 복잡하며 환형근, 첨판, 척삭근 건초(chordae tendineae) 및 유두근 이상이 복합적으로 나타날 수 있습니다. 경흉부 2차원 심장초음파(2DE)는 소아 수술 계획에 사용되는 주요 진단 영상 기법으로 남아 있습니다. 그러나 승모판막이 3차원(3D) 구조라는 점을 감안할 때 협착 및/또는 역류의 메커니즘을 더 잘 정의하기 위해 3D 심장초음파(3DE)를 추가하는 것이 유리합니다. 경흉부 3DE 기술은 프로브 기술과 초음파 스캐너의 발전으로 향상되어 우수한 공간 해상도와 적절한 시간 해상도로 이미지를 생성합니다. 특히, 더 높은 주파수와 더 작은 설치 공간을 가진 소아용 3D 트랜스듀서를 추가하면 어린이에게 더 나은 3DE 이미징을 제공할 수 있습니다. 3DE 획득 및 분석의 효율성이 향상되어 승모판 평가에서 초음파 검사자, 심장 전문의 및 외과의가 승모판막의 3D 평가를 보다 쉽게 통합할 수 있습니다. 이러한 개선은 후처리 소프트웨어 최적화를 통해서도 가능했습니다.
이 방법 논문에서는 소아 승모판막의 경흉부 3DE 평가와 소아 승모판 질환의 수술 계획에서의 사용을 설명하는 것을 목표로 합니다. 첫째, 3DE 평가는 올바른 프로브를 선택하고 승모판막에 대한 견해를 얻는 것으로 시작됩니다. 그런 다음 개별 환자에 따라 적절한 데이터 수집 방법을 선택해야 합니다. 다음으로, 공간 및 시간 해상도의 적절한 균형을 맞추기 위해 데이터 세트의 최적화가 중요합니다. 실시간 스캔 중 또는 획득 후 사용자가 무한한 수의 절단 평면 또는 체적 재구성을 빠르게 얻을 수 있는 혁신적인 도구를 사용하여 데이터 세트를 자를 수 있습니다. 심장 전문의와 외과 의사는 승모판막을 정면으로 볼 수 있습니다. 따라서 의료 또는 외과 계획을 지원하기 위해 형태를 정확하게 재구성합니다. 마지막으로, 소아 승모판 관리의 예를 보여주는 몇 가지 임상 적용에 대한 검토를 제안합니다.
서문
승모판 장치는 승모판 고리, 첨판, 척삭 건초 및 좌심실 유두 근육 1,2로 구성된 복잡한 구조입니다. 소아 승모판 질환은 선천성 및 후천성 심장 기형과 관련된 광범위한 형태학적 이상으로 구성되어 있다3. 승모판 질환의 형태와 그 기전에 대한 설명은 수술 계획의 핵심 매개변수이다4. 이를 위해서는 정확한 진단 영상 방식을 사용해야 합니다. 심장초음파검사는 소아 승모판막 질환에 사용되는 주요 진단 기법 중 하나로 확립되어 있다5. 특히, 소아 승모판 질환에서 2차원(2D) 심장초음파는 여전히 가장 널리 사용되는 진단 방법입니다. 그러나 2D 이미징의 특성으로 인해 초음파 검사자, 심장 전문의 및 외과 의사는 병리학적 메커니즘을 결정하기 위해 이 복잡한 3D 구조를 정신적으로 재구성해야 합니다.
해부학적으로 정확한 시야와 무한한 수의 절단면을 생성할 수 있는 기능을 갖춘 3차원(3D) 심장초음파는 승모판 이미징을 향상시킬 수 있습니다. 3D 심장초음파검사의 가치는 환형 형상 및 역학, 소엽 가리비 탈출 및 소엽 접합 영역에 대한 특정 정보를 제공하는 능력에서 나타납니다 6,7. 3D 경식도 심초음파(TEE)가 성인 승모판 병리를 확인하는 데 가장 정확한 초음파 방식인 것으로 나타났지만,8, 3D 경흉부 심초음파(TTE)는 음향 창이 더 우수하기 때문에 소아에서 더 실현 가능하다. 3D TTE는 단순 승모판 병변과 복잡한 승모판 병변을 매우 정확하게 구별하고 외과적 개입의 필요성을 구별하는 데 매우 정확한 것으로 입증되었다9. 또한 3D 체적 데이터 세트를 획득하면 외과의와 심장 전문의가 후처리 과정에서 협업할 수 있어 수술 계획을 더욱 개선할 수 있습니다.
3D TTE 기술은 프로브 기술, 초음파 처리 능력 및 후처리 효율성의 발전으로 지속적으로 개선되어 왔습니다. 현재의 3D 매트릭스 프로브는 이제 초당 약 25볼륨의 볼륨 속도로 전체 볼륨 단일 비트 데이터 세트를 수집할 수 있습니다10. 초당 25볼륨을 초과하는 단일 비트 데이터 세트의 볼륨 속도를 초음파 공급업체, 프로브 기술 및 볼륨 최적화에 따라 추가로 높일 수 있습니다. 그러나 ECG 게이트(하위 볼륨) 전체 볼륨 방법을 사용하는 경우 이 숫자는 두 배 이상 증가하여 어린이에게 필요한 볼륨 속도를 제공할 수 있습니다. 성인에 비해 어린이의 심박수가 높을수록 진단 정확도를 위해 더 높은 시간 3D 해상도가 필요합니다. 또한, 특정 소아용 3D 프로브 기술의 개발로 더 높은 스캐닝 빈도가 가능해졌으며, 이는 승모판막과 그 장치11의 작은 크기와 관련하여 결정적인 더 나은 공간 해상도를 제공할 수 있었다. 이러한 모든 기술적 개선에도 불구하고 공급업체는 최적의 음향 창을 유지하기 위해 어린 아이들의 해부학적 구조에 맞게 조정된 발자국을 가진 프로브를 생산할 수 있었습니다. 마지막으로, 빠른 자르기 도구와 같은 새로운 후처리 기능을 통해 효율적인 후처리가 가능합니다.
이 논문에서는 3D TTE가 적용되는 모든 초음파 시스템에 적용할 수 있는 소아 승모판막의 3D TTE 평가 기술에 대해 설명합니다. 또한 3D 데이터의 사후 처리를 검토하고 수술 계획에서 이점을 얻을 수 있습니다. 마지막으로 어린이에서 3D 이미징의 몇 가지 임상 적용에 대해 논의하고 몇 가지 예를 포함합니다.
프로토콜
이 프로토콜은 우리 기관의 인간 연구 윤리 위원회의 지침을 따릅니다.
알림: 이 프로토콜의 구현을 위해 GE(General Electric) Vivid E95 또는 Philips Epiq 7C 초음파 시스템이 사용됩니다. GE Vivid E95 시스템에서 사용자는 4Vc-D(성인용 프로브) 또는 6Vc-D(소아용 프로브) 중에서 선택할 수 있습니다. 필립스 Epiq 7C에서 사용자는 X5-1(성인용 프로브) 또는 X7-2(소아용 프로브) 중에서 선택할 수 있습니다. 그림 1을 참조하십시오.
1. 환자 설정 및 프로브 선택
- 가능하면 환자를 왼쪽 측면 욕창 위치에 배치합니다. 그림 1, 단계 A를 참조하십시오.
- 환자 크기와 이미징 창 품질에 따라 적절한 3D 매트릭스 프로브(소아 또는 성인)를 선택합니다. 10세 미만의 소아 환자의 대다수는 승모판막이 가깝기 때문에 흉골 주위 영상 창에서 영상을 촬영할 때 고주파(소아) 프로브를 사용할 수 있습니다. 10세 이상은 소아용 프로브를 사용할 수 있지만 나이가 많은 어린이의 경우 이미지 품질이 우수하므로 성인용 프로브가 더 이상적입니다. 그림 1, B단계를 참조하십시오.
참고: 사용자가 성인용 3D 매트릭스 프로브에만 액세스할 수 있는 경우 소아 환자의 경우 최적의 공간 해상도를 위해 스캔 빈도를 높이십시오.
2. 프로브 포지셔닝 및 2D 이미지 최적화
- 선택한 3D 매트릭스 프로브에 충분한 양의 젤을 도포합니다.
참고: 3D 승모판 평가를 위한 최적의 이미징 창은 수정된 저흉골 장축 보기입니다. 이러한 관점에서 볼 때, 승모판 장치는 프로브와 승모판 첨판에 매우 근접하여 초음파 빔에 상대적으로 수직입니다. 또한, 낮은 흉골 주위 장축 보기는 전체 승모판 장치에 대한 완전한 시각화를 제공합니다. 그림 1, C 단계를 참조하십시오. - 수정된 낮은 흉골 장축 보기를 얻으려면 표준 흉골 주위 장축 심초음파에서 프로브를 가슴에 배치합니다.
- 승모판 첨판이 초음파 빔에 더 수직이 되고 2D 이미징 창이 최적화될 때까지 프로브를 가슴에서 측면으로 밉니다(이 위치는 표준 흉골 창과 표준 정점 창 사이에 있음).
참고: 환자가 최적으로 변형된 낮은 흉골 주위 시야를 가지고 있지 않은 경우, 표준 흉골 주위 창과 정점 창을 함께 사용하면 승모판 해부학적 구조를 완전히 시각화할 수 있습니다. - 프로브를 흔들어 초음파 구역의 승모판 중앙에 놓습니다. 프로브를 흔드는 것은 고정된 지점을 따라 프로브의 장축에서 움직임을 포함하면서 공음 각도를 90도에서 멀어지게 변경합니다. 3D 이미징에서는 초음파 부문의 관심 영역을 중앙에 배치하여 볼륨을 좁히고 이를 통해 시간 해상도를 높일 수 있습니다.
- 승모판 첨판이 초음파 빔에 더 수직이 되고 2D 이미징 창이 최적화될 때까지 프로브를 가슴에서 측면으로 밉니다(이 위치는 표준 흉골 창과 표준 정점 창 사이에 있음).
3. 3D 대량 획득 방법
- 초음파 콘솔의 3D 버튼(일부 공급업체에서는 4D로 표기할 수도 있음)을 활성화하여 전체 볼륨 디스플레이로 들어가는 것으로 시작합니다. 전체 볼륨 표시는 실시간 전체 볼륨으로 시작해야 합니다.
참고: 3D Zoom을 사용하여 승모판막의 3D 데이터 세트를 얻을 수도 있지만, 관심 영역이 제한되어 있어 주변 구조를 포함하는 것이 수술 관리에 중요할 수 있으므로 권장되지 않습니다. - 환자가 협조적이고 숨을 참을 수 있는 경우 ECG 게이트 전체 볼륨 획득을 사용합니다( 그림 1, 단계 E 참조). 획득에 사용할 하위 볼륨(heart beats)의 수를 선택합니다. 대부분의 초음파 시스템에서 하위 볼륨의 수는 2-6 사이로 설정할 수 있습니다( 그림 1, H 단계 참조). 획득하는 동안 사용되는 하위 볼륨의 수가 많을수록 볼륨 속도가 높아지지만(시간 해상도 증가) 하위 볼륨이 합쳐질 때 호흡 또는 움직임과 관련된 스티치 아티팩트가 발생할 수 있습니다.
- 환자가 비협조적이거나 숨을 참을 수 없는 경우, 실시간 3D 전체 볼륨 획득을 통해 '스티치' 아티팩트가 발생할 가능성을 제거할 수 있습니다( 그림 1, F 단계 참조). 그러나 감소된 시간 해상도는 어린이에게 이상적이지 않으며 사용자는 보상하기 위해 볼륨 크기(관심 영역) 또는 공간 해상도를 희생해야 합니다(둘 다 다음 단계에서 설명).
4. 3D 부피 최적화( 그림 1, G 단계 참조)
- 가능한 경우 모든 승모판 고리, 척삭, 유두 근육 및 대동맥 판막을 포함하도록 전체 부피 크기를 최적화합니다.
참고: ECG 게이트 획득을 사용하면 하위 볼륨을 통해 달성된 볼륨 속도의 증가로 인해 더 많은 양의 데이터를 수집할 수 있습니다.- 합리적인 프레임 속도를 유지하기 위해 실시간 수집을 위해 더 적은 양의 데이터가 필요합니다. 이를 위해 고도면을 좁히고 흉골 주위 짧은 축으로 이미징하여 승모판 첨판과 고리를 완전히 시각화할 수 있습니다( 그림 2 참조).
- 가능한 경우 초음파 라인 밀도를 증가시켜 3D 신호 대 잡음비(이미지 품질)를 최적화합니다. 초음파 라인 밀도가 증가하면 볼륨 속도가 감소합니다. 공급업체마다 이 함수에 대한 다양한 용어가 있습니다. GE Vivid E95 초음파 시스템에서 Frame Rate 노브를 사용하여 라인 밀도를 최적화합니다. 필립스 Epiq 7C 초음파 시스템에서 이미지 품질 터치 스크린 버튼을 사용하여 라인 밀도를 최적화합니다.
- ECG 게이트 획득을 사용하면 하위 체적을 사용하면 양호한 체적 속도가 유지되므로 3D 체적 라인 밀도를 높일 수 있습니다.
- 실시간 획득을 통해 3D 체적 라인 밀도와 환자의 심박수에 대해 허용 가능한 체적 속도의 균형을 맞출 수 있습니다.
- 승모판 책자의 드롭아웃을 최소화하기 위해 3D 게인 설정을 2D 게인 설정보다 높게 설정합니다. 필요한 경우 크롭된 이미지를 더욱 최적화하기 위해 후처리 중에 게인을 줄일 수 있습니다.
5. 3D 전체 볼륨 획득 저장( 그림 1, 단계 I 참조)
- ECG 게이트 획득을 사용하는 경우 환자에게 숨을 참고 가만히 있으라고 요청하십시오. 그런 다음 선택한 하위 볼륨(심장 박동)의 수를 활성화합니다. Store 를 누르기 전에 선택한 비트 수를 최소한 기다리십시오(더 많은 하위 볼륨을 선택할수록 저장 프로세스가 길어집니다).
- 최종 부피를 저장하기 전에 "스티치" 아티팩트가 없고 전체 승모판막이 3D 부피에서 보이는지 확인하십시오.
- 실시간 수집을 사용하는 경우 모든 최적화가 완료되면 최종 볼륨을 저장합니다.
6. 3D색 도플러 획득
- 컬러 도플러를 추가하고 프로토콜의 3-5단계에 따라 컬러 도플러 3D 볼륨 획득을 별도로 얻습니다. 컬러 도플러 박스 크기를 가능한 한 좁히면서 전체 승모판 고리를 포함합니다. 컬러 도플러 속도 스케일을 60-80cm/s 사이로 설정합니다.
- ECG 게이트 획득을 사용하여 적절한 부피 속도를 유지합니다. 5.1단계에 따라 3D 컬러 도플러 볼륨을 저장합니다.
참고: 3D 볼륨에 컬러 도플러를 추가하면 시간 해상도가 크게 감소하여 어린이에 대한 실현 가능성이 어려워집니다.
7. 승모판막의 후처리 및 자르기
참고: 승모판막의 후처리 및 자르기는 즉각적인 결과를 위해 초음파 시스템에서 직접 수행할 수 있습니다. 그러나 리뷰 스테이션에서 동일한 기능을 제공하는 전용 GE 소프트웨어(EchoPAC) 및 Philips 소프트웨어(QLAB)도 있습니다. 또한 TomTec은 두 공급업체의 3D 데이터 세트를 후처리 및 자르기 위한 범용 소프트웨어를 제공합니다.
- 저장된 승모판의 3D 볼륨을 3패널 다중 평면 디스플레이(2D 측면 평면, 2D 고도 평면 및 3D 재구성)에 로드하고 빠른 자르기 도구를 활성화합니다. 빠른 자르기 도구는 두 번의 클릭이 필요하며 사용자가 모든 평면에서 자를 수 있습니다.
참고: 공급업체마다 빠른 자르기 도구에 대한 다양한 용어가 있습니다. GE Vivid E95 초음파 시스템에서 이 자르기 도구는 "2 Click Crop"이라고 표시되어 있습니다. 필립스 Epiq 7C 초음파 시스템에서 이 자르기 도구는 "Quick Vue"라고 표시되어 있습니다. - 왼쪽 심방에서 보는 승모판막의 정면 보기(외과의의 관점)를 보려면 아래 단계를 따르십시오( 그림 3, E단계 참조).
- 2D 측면 평면(이 프로토콜에서 낮은 흉골 장축)에서 작업하여 승모판 고리 바로 위의 왼쪽 심방 내에 첫 번째 커서를 배치합니다. 첫 번째 위치를 설정한 후 커서를 승모판막을 가로질러 심실 쪽으로 드래그하고 자르기 선을 승모판 고리와 평행하게 정렬합니다. 두 번째 curser를 좌심실 내에 배치하여 승모판 첨판이 작물 라인 내에 포착되도록 하고 이 지점을 설정합니다( 그림 3 단계 B 참조).
- 승모판막의 권장 디스플레이 방향은 앞쪽12입니다. 트랙볼을 사용하여 3D 승모판막을 회전시켜 대동맥 판막을 화면 상단에 배치합니다.
- 좌심실에서 보이는 승모판막의 전면 보기를 얻으려면 이전 단계에서 자른 이미지를 180도 뒤집기만 하면 됩니다(일부 공급업체 시스템에는 이 작업을 빠르게 수행하는 뒤집기 자르기 기능이 있음)( 그림 3, F 단계 참조).
- 승모판막의 컬러 도플러 3D 부피를 7.3단계와 같은 방향으로 자릅니다.
- 척삭근(chordae tendineae) 및 유두근(papillary muscles)을 포함한 승모판막하(mitral valve), 판막하(sub-valvar apparatus)에 대한 견해를 얻습니다.
- 2D 측면 평면(이 프로토콜에서는 낮은 흉골 주위 장축)에서 작업하여 첫 번째 커서를 좌심실 중앙에 배치합니다. 첫 번째 위치를 설정한 후 커서를 좌심실의 후벽 쪽으로 드래그하고 자르기 선을 좌심실의 긴 축과 평행하게 정렬합니다. 두 번째 커서를 뒤쪽 벽 아래에 놓고 이 점을 설정합니다( 그림 4 참조).
- 3D 게인 및 압축 설정을 최적화합니다.
- 3D 게인 설정을 가장 낮은 설정으로 최적화하는 동시에 승모판 첨판 드롭아웃을 최소화하거나 전혀 유지하지 않습니다.
- 3D 압축 설정을 최적화하여 더 넓거나 더 좁은 범위의 색상 음영을 포함할 수 있습니다. 3D 압축은 3D 깊이 인식을 향상시킬 수 있습니다. Philips Epiq 7 시스템에서 압축 노브를 돌려 3D 압축을 조정합니다. GE Vivid E95 시스템에서 3D 압축 조정은 액티브 모드 게인 노브를 돌려 수행됩니다.
- 승모판막의 최적화되고 크롭된 3D 뷰를 별도의 cine loop 클립으로 저장합니다.
결과
소아 심초음파에서 승모판막의 우수한 품질의 3D 데이터 세트는 첨판 움직임을 평가하는 데 적합한 최적의 부피 속도와 우수한 축 분해능을 활용하는 우수한 공간 해상도를 갖습니다. 프로토콜 3D ECG 게이트 획득의 성공 여부를 평가하려면 먼저 중요한 "스티치" 아티팩트가 있는지 여부를 확인합니다. 인공물이 없고 우수한 품질의 2D 저흉골 장축 보기를 사용하여 획득이 이루어진 경우 이 3D 데이터 세트는 전체 승모판 복합체에 대한 진단 정보를 제공합니다.
환자의 호흡 및/또는 움직임으로 인한 심각한 "스티치" 아티팩트로 인해 ECG 게이트 전체 볼륨을 사용할 수 없는 경우 실시간 3D를 사용해야 합니다. 이 방법은 전체 승모판 복합체의 단일 부피를 제공하지 않을 가능성이 높지만, 좁은 부피(고도 평면에서)로 실시간 3D 획득을 활용하면 더 나은 시간 해상도를 얻을 수 있습니다. 실시간 3D 획득을 통해 승모판 고리 및 첨판의 이미징은 흉골 주위 단축 창에서 가장 잘 시각화됩니다. 승모판막, 척삭 건초 및 유두 근육의 이미징은 정점 2개의 챔버 보기에서 가장 잘 시각화됩니다 ( 그림 5, 사례 1C 참조).
컬러 도플러를 승모판막의 3D 전체 볼륨 획득에 추가하면 승모판 역류의 평가를 향상시킬 수 있습니다. 좌심실에서 볼 때 3D 컬러 도플러는 승모판 역류 위치 및 대정맥 수축 영역에 대한 진단 정보를 제공합니다( 그림 3 참조). 그러나 컬러 도플러를 추가하면 시간적 해상도가 크게 감소하여 어린이의 실현 가능성이 어려워진다는 점은 주목할 가치가 있습니다.
무한한 수의 절단면을 얻을 수 있는 기능과 해부학적으로 정확한 재구성을 통해 3D 심초음파검사 데이터 세트의 후처리는 2D 심초음파검사에 비해 이 방법이 갖는 가장 큰 이점 중 하나를 제공합니다13. 승모판막의 대면 3D 뷰를 생성함으로써 승모판 역류에 대한 평가를 강화할 수 있으며, 이는 돌출/도리깨 가리비, 고립된 갈라진 틈 및 비접합 구역에 대한 진정한 해부학적 시각화를 통해 향상될 수 있습니다( 그림 3 참조). 또한 소엽 직경, 소엽 면적, 접합 길이 및 소엽 텐트 높이14를 정량화할 수 있는 후처리 소프트웨어를 사용할 수 있으며, 이 모든 것은 표준 2D 이미징과 함께 제공되지 않습니다. 승모판 협착증 평가에서 3D 심장초음파는 승모판 오리피스 영역13의 직접적인 플리미니메트리를 제공할 수 있습니다. 이 방법은 사용자가 가장 작은 오리피스 영역을 식별하는 절단면을 얻을 수 있으므로 2D 심초음파보다 더 정확합니다. 또한 전용 3D 소프트웨어를 사용하지 않고도 3D 데이터 세트의 직접 평면화가 가능합니다. 또한 승모판 협착증에서 3D 데이터 세트의 후처리를 통해 척삭 건초 길이의 정확한 형태 및 측정을 위해 판막하 장치를 시각화할 수 있습니다. 효율적인 후처리 기술이 지속적으로 발전함에 따라 이제 정확한 3D 재구성을 얻으려면 최소한의 시간 투자가 필요합니다.

그림 1. 3D 승모판 획득 프로토콜. (A) 환자가 좌측 외측 욕창 위치에 위치합니다. (B) 올바른 프로브를 선택하고 가능한 가장 높은 주파수로 스캔합니다. (C) 낮은 흉골 주위 장축이 가장 이상적인 것으로 간주되는 최상의 2D 심장 초음파 창을 선택합니다. (D) 환자가 숨을 참을 수 있고 가만히 있을 수 있는지 확인합니다. (E) 그렇다면 ECG 게이트 전체 볼륨 획득을 선택합니다. (F) 그렇지 않은 경우 실시간 3D 획득을 선택합니다. (G) 두 방법 모두 볼륨 크기, 라인 밀도 및 게인을 조정하여 시간 및 공간 해상도를 최적화합니다. (H) ECG 게이트 획득의 경우 하위 볼륨 수를 선택하고 환자에게 숨을 참고 가만히 있도록 요청합니다. (I) 거래량을 확보합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2. 실시간 3D 획득 parasternal short axis. 실시간 3D 획득 parasternal short axis. 승모판막(A)의 흉골 주위 단축 뷰에서 시작하여 실시간 3D를 활성화하면 고도면(B)과 3D 렌더링 뷰(C)가 표시됩니다. 고도 평면(D)을 좁히는 것은 실시간 획득을 위한 최적의 해상도를 달성하는 데 중요합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
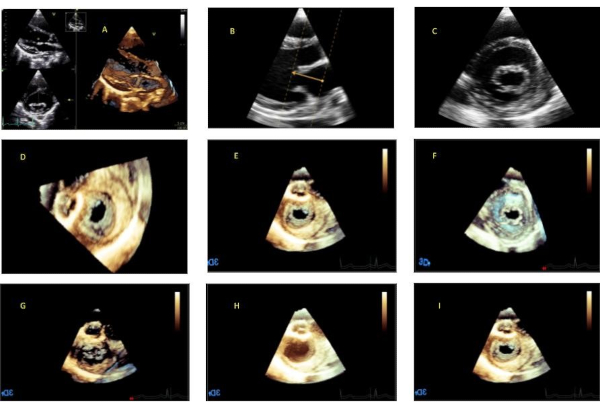
그림 3. 후처리 워크플로우. (A) 다중 평면 디스플레이로 시작합니다. (B) 퀵 크롭 기능을 활성화하고 승모판 고리 위의 좌심방 내 첫 번째 지점을 배치합니다. 승모판막을 가로질러 커서를 드래그하고 승모판 고리에 수직으로 크롭 라인을 정렬합니다. 좌심실 내에 두 번째 점을 배치하여 재건 깊이를 설정합니다. (C) 짧은 축에서 승모판막을 보여주는 직교 2D 평면. (D) 좌심방 투시에서 승모판막의 정면 모습을 보여주는 3D 재구성. (E) z축을 중심으로 이미지를 회전하여 앞쪽(이미지 상단의 대동맥)을 배치합니다. (F) 이미지를 y축을 중심으로 180도 뒤집어 심실 관점에서 승모판막 앙 페이스를 시각화합니다. (G) 게인 설정이 너무 낮습니다. (H) 게인 설정이 너무 높습니다. (I) 게인 설정이 최적화되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4. 승모판 하부 판막 장치 워크플로우. 승모판 하부 판막 장치 워크플로우. 낮은 흉골 주위 이미징 창에서 승모판막의 3D 볼륨 획득을 사용하여 빠른 자르기 도구를 활성화합니다. 첫 번째 커서(curser)를 좌심실(A)의 중앙에 배치하고, 자르기 선을 후방 벽(posterior wall)(B) 쪽으로 드래그한 다음 두 번째 커서(posterior)를 좌심실(C)로 설정합니다. 오른쪽의 3D 렌더링 보기는 후-내측 승모판 부착물(D)과 전방-외측 승모판 부착물(E)을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
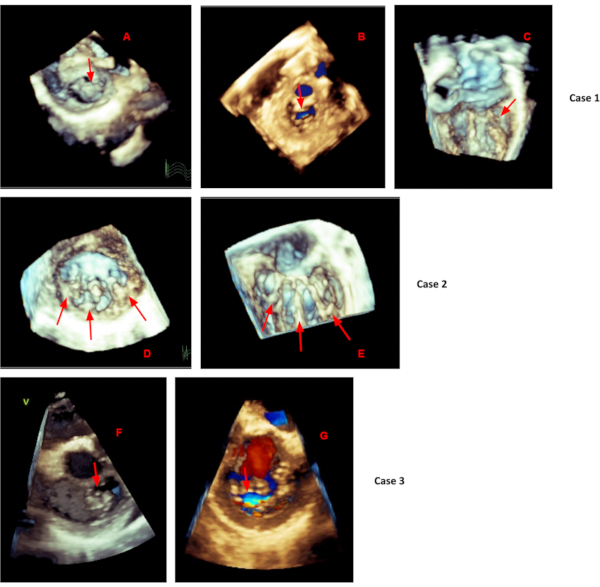
그림 5. 승모판 3D 케이스. 승모판 3D 케이스. 사례 1: 낮은 흉골 주위 장축 이미징 창에서 획득한 ECG 게이트 데이터 세트에서 잘라낸 중심 승모판 역류(B)가 있는 승모판 전방 첨판 탈출증(A)을 보여줍니다. (C) 움직임을 제한하는 짧은 후방 전단지 척삭을 보여주는 정점 2 챔버 뷰에서 실시간 3D 획득. 사례 2: 승모판 맥락막 부착물(E)이 있는 3개의 좌심실 유두근(D)을 보여주며, 낮은 흉골 주위 장축 이미징 창에서 획득한 ECG 게이트 데이터 세트에서 잘라냈습니다. A3 및 P3 가리비(F)의 탈출과 해당 승모판 역류(G)를 보여주는 사례 3은 낮은 흉골 주위 장축 이미징 창에서 획득한 ECG 게이트 데이터 세트에서 잘라냈습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
작업자/초음파 검사자에게 3D 심초음파는 종종 몇 가지 문제에 직면합니다. 첫째, 본질적으로 소아 심장초음파검사 중 환자 크기, 심박수 및 협력도에 상당한 차이가 있습니다. 이러한 매개변수는 3D 특정 프로토콜을 갖기 어렵게 만들어 3D 수집 운영자를 의존하게 만듭니다. 초음파 검사자에 대한 교육은 주로 2D 이미징에 초점을 맞추는 경우가 많아 3D 이미지 획득 및 해석에 대한 지식의 격차가 발생합니다. 또한 2D 이미징과 비교할 때 3D 시간 해상도가 감소하고 일부 어린이의 경우 ECG 게이트(하위 볼륨) 획득을 사용하여 볼륨 속도를 높일 수 없기 때문에 이 방식은 어려움을 겪고 있습니다. 심박수가 높은 어린이의 경우, 승모판 첨판의 실시간 움직임을 감상하기 위해서는 높은 시간 해상도를 유지하는 것이 중요합니다. 어린이의 3D 이미징과 관련된 또 다른 과제는 최적의 공간 해상도를 위해 고주파 소아 프로브에 접근하는 것입니다. 현재의 성인용 3D 프로브는 주파수 대역폭이 넓지만 설치 공간과 낮은 주파수는 종종 어린 아이들에게 적합하지 않습니다.
2D 및 3D 평가에 하나의 초음파 프로브를 사용하면 어린이의 3D 평가 프로세스에 상당한 효율성을 더할 수 있습니다. 새로운 3D 초음파 프로브는 뛰어난 2D 이미지, 컬러 도플러 및 3D 볼륨 품질을 제공합니다. 검사 중 어느 시점에서든 3D 볼륨을 빠르게 캡처할 수 있는 능력은 어린이에게 특히 중요합니다. 둘째, 작업자의 경우 지속적인 교육을 통해 우수한 품질의 3D 획득을 구성하는 것이 무엇인지 이해하는 것이 중요합니다. 또한 소아의 3D 평가를 최적화하기 위해 이식 전에 작업자는 평가 프로세스를 안내하기 위해 환자에게 어떤 3D 정보가 중요한지 결정해야 합니다. 심장 전문의와 외과 의사는 후처리 소프트웨어에 직접 액세스할 수 있으므로 수술 계획에 도움이 되는 3D 재구성을 생성할 수 있습니다.
3D 데이터 세트의 품질은 2D 이미지의 품질에 따라 크게 달라집니다. 따라서 승모판막의 2D 이미지를 최적화하기 위해 신중한 고려를 해야 합니다. 각 개별 환자(흉골주위 또는 정점)에 사용할 수 있는 가장 최적의 2D 창에서 시작하면 최상의 3D 이미지(14)를 얻을 수 있습니다. 그러나 가능한 경우, 흉골 주위 장축 창에서 승모판막의 3D TTE가 대부분의 이상을 가장 잘 보여줄 것입니다15. 프로토콜에 명시된 바와 같이, 프로브를 낮은 흉골 주위 장축 창으로 조금만 움직이면 첨판 탈락이 줄어들어 결과적으로 승모판막의 3D 이미지가 더 좋아집니다. 2D 이미지 품질이 기술적으로 어려운 경우 3D 획득이 임상적으로 유용한 데이터를 생성하지 못한다는 점에 유의할 가치가 있습니다.
본질적으로 2D 심장초음파를 통한 승모판 평가에는 여러 이미지와 기하학적 규칙이 필요합니다. 대신, 3D 심장초음파검사는 한 번의 체적 획득으로 승모판막의 2D 절편과 해부학적으로 정확한 3D 재구성을 제공합니다. 일반적으로 심장초음파에 의한 승모판막은 음향 품질이 우수한 이미지이므로 이 판막은 3D 평가에 매우 적합합니다. 또한 3D 이미징은 획득 방법과 후처리 기술의 개선으로 더 이상 시간이 많이 걸리지 않습니다. 프로토콜에서 언급했듯이 좌심방의 관점에서 승모판막의 정면 보기(외과 의사의 관점)는 외과의가 쉽게 해석할 수 있습니다. 수술 전에 3D 심장초음파를 추가하면 수술실에서 외과의와 함께 즉시 검토할 수 있습니다. 이는 심장 전문의와 외과 의사가 명확한 메커니즘에 합의하여 수술 계획을 개선할 수 있는 기회를 제공합니다. 특히 선천성 심장 질환의 경우, 주변 구조와 관련된 승모판막의 기능을 시각화할 수 있는 능력은 3D 심장초음파검사의 강력한 장점이다16. 승모판막의 3D 평가의 필요성은 승모판 자체에만 국한되지 않습니다. 이 진단 방식은 심장 자기 공명(CMR)과 더 잘 상관관계가 있는 좌심실(LV) 볼륨17 및 좌심방(LA) 볼륨18 을 보다 정확하고 재현 가능한 것으로 나타났습니다. LV 및 LA 용적을 정확하게 평가하는 것은 혈역학적 중요성을 결정하는 데 사용되기 때문에 승모판 수술 계획에 중요합니다.
현재 3D 심초음파, 특히 소아 선천성 심장 질환에서 3D 심초음파에는 많은 한계가 남아 있습니다. 선천성 승모판 질환에 3D 이미징을 적용하려면 높은 수준의 해부학적 이해와 3D 이미징 숙련도가 모두 필요합니다. 더욱이 현재의 기술로 인해 어린이들은 숨을 참는 것과 협력할 수 없다는 점과 몸집이 작다는 점에서 3D 심장초음파검사에 상당한 어려움을 겪고 있습니다. 또한 실시간 3D 이미징과 어린이의 심박수가 높기 때문에 시간 해상도 문제가 남아 있습니다. 실시간 3D 심초음파검사 기술의 지속적인 개선으로 소아 심장학에서 그 중요성이 더욱 강조될 것입니다.
공개
이해 상충 없음
감사의 말
없음.
자료
| Name | Company | Catalog Number | Comments |
| 4Vc-D probe | General Electric | Ultraspound probe (GE) | |
| 6Vc-D probe | General Electric | Ultraspound probe (GE) | |
| Epiq 7C | Philips | Ultrasound system | |
| Vivid E95 | General Electric | Ultrasound system | |
| X5-1 | Philips | Ultraspound probe (Philips) | |
| X7-2 | Philips | Ultraspound probe (Philips) |
참고문헌
- Perloff, J. K., Roberts, W. C. The mitral valve apparatus. Functional anatomy of mitral regurgitation. Circulation. 46, 227-239 (1972).
- Ho, S. Y. Anatomy of the mitral valve. Heart. , 5-10 (2002).
- Sousa Uva, M., et al. Surgery for congenital mitral valve disease in the first year of life. The Journal of Thoracic and Cardiovascular Surgery. 109 (1), 164-176 (1995).
- Honjo, O., Mertens, L., Van Arsdell, G. S. Atrioventricular Valve Repair in Patients With Single-ventricle Physiology: Mechanisms, Techniques of Repair, and Clinical Outcomes. Pediatric Cardiac Surgery Annual. 14, 75-84 (2011).
- Banerjee, A., Kohl, T., Silverman, N. H. Echocardiographic evaluation of congenital mitral valve anomalies in children. American Journal of Cardiology. 76, 1284-1291 (1995).
- Lang, R. M., Tsang, W., Weinert, L., Mor-Avi, V., Chandra, S. Valvular Heart Disease: The Value of 3-Dimensional Echocardiography. Journal of the American College of Cardiology. 58 (19), 1933-1944 (2011).
- Gripari, P., et al. Transthoracic echocardiography in patients undergoing mitral valve repair: comparison of new transthoracic 3D techniques to 2D transoesophageal echocardiography in the localization of mitral valve prolapse. The International Journal of Cardiovascular imaging. 34, 1099-1107 (2018).
- Pepi, M., et al. Head-to-Head Comparison of Two- and Three-Dimensional Transthoracic and Transesophageal Echocardiography in the Localization of Mitral Valve Prolapse. Journal of the American College of Cardiology. 48 (12), 2524-2530 (2006).
- Tamborini, G., et al. Pre-operative transthoracic real-time three-dimensional echocardiography in patients undergoing mitral valve repair: accuracy in cases with simple vs. complex prolapse lesions. European Journal of Echocardiography. 11, 778-785 (2010).
- Lang, R. M., Addetia, K., Narang, A., Mor-Avi, V. 3-Dimensional Echocardiography: Latest Developments and Future Directions. JACC: Cardiovascular Imaging. 11 (12), 1854-1878 (2018).
- Simpson, J. M. Real-time three-dimensional echocardiography of congenital heart disease using a high frequency paediatric matrix transducer. European Journal of Echocardiography. 9, 222-224 (2008).
- Lang, R. M., et al. EAE/ASE Recommendations for Image Acquisition and Display Using Three-Dimensional Echocardiography. Journal of the American Society of Echocardiography. 25, 3-46 (2012).
- Surkova, E., et al. Current Clinical Applications of Three-Dimensional Echocardiography: When the Technique Makes the Difference. Current Cardiology Reports. 18, 109 (2016).
- Kutty, S., Colen, T., Smallhorn, M., J, F. Three-dimensional echocardiography in the assessment of congenital mitral valve disease. Journal of the American Society of Echocardiography. 27, 142-154 (2014).
- Simpson, J., et al. Three-dimensional echocardiography in congenital heart disease: an expert consensus document from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. European Heart Journal - Cardiovascular Imaging. 17, 1071-1097 (2016).
- Sugeng, L., et al. Use of real-time 3-dimensional transthoracic echocardiography in the evaluation of mitral valve disease. Journal of the American Society of Echocardiography. 19, 413-421 (2006).
- Badano, L. P., et al. Current clinical applications of transthoracic three-dimensional echocardiography. Journal of Cardiovascular Ultrasound. 20 (1), 1-22 (2012).
- Mor-Avi, V., et al. Real-time 3D echocardiographic quantification of left atrial volume: multicenter study for validation with CMR. JACC Cardiovascular Imaging. 5, 769-777 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유