Method Article
非遺伝的光刺激によるCa2+ 伝播を研究するための心臓微小生理学的システム
* これらの著者は同等に貢献しました
要約
光を使って心臓の細胞や組織を制御することで、非接触で刺激を受けることができるため、細胞の自然な状態や機能を保つことができるため、基礎研究や治療への応用に有用なアプローチとなっています。
要約
in vitro 心臓微生理学的モデルは、科学研究、医薬品開発、医療応用において高い信頼性を発揮します。科学界では広く受け入れられていますが、これらのシステムは非侵襲的な刺激技術がないため、寿命にはまだ限界があります。フォトトランスデューサーは、効率的な刺激方法を提供し、刺激プロセスにおける侵襲性を最小限に抑えながら、高い時間的および空間的分解能を備えたワイヤレスアプローチを提供します。この論文では、 in vitro 心臓微生理学的モデルの活性を刺激および検出するための完全光学的方法を紹介します。具体的には、3Dバイオリアクター懸濁培養で作製したヒト人工多能性幹細胞由来心筋細胞(hiPSC-CM)を播種することにより、人工的な層流異方性組織を作製しました。刺激には両親媒性アゾベンゼン誘導体である光変換器(Ziapin2)を使用し、システムの応答を監視するためにCa2+ 色素(X-Rhod 1)を使用しました。この結果は、Ziapin2が、組織の完全性、生存率、または挙動を損なうことなく、採用されたシステムにおけるCa2+ 応答を光調節できることを示しています。さらに、光ベースの刺激アプローチは、現在のゴールドスタンダードである電気刺激と比較して同様の解像度を提供することを示しました。全体として、このプロトコルは、心臓研究におけるZiapin2および材料ベースの光刺激の応用に有望な展望を開きます。
概要
生きた細胞や組織を刺激するための光の使用は、生物医学研究における重要なゲームチェンジャーとして浮上しており、正確な時間的および空間的分解能1,2,3,4,5,6を備えたタッチレス刺激機能を提供します。細胞を光に感受性にするために使用される主要な技術の1つは、光感受性イオンチャネルまたはポンプ7,8を発現するように細胞を遺伝子改変することを含む光遺伝学である。このアプローチは、生体組織内の細胞の調節において印象的な効果を示しています。しかし、ウイルス遺伝子導入に依存しているため、研究や臨床応用での広範な採用が妨げられています。
この制限を克服するために、有機材料および無機材料は、非遺伝的な材料ベースの光媒介刺激技術を開発するための光感受性トランスデューサとして使用されてきた9,10。有機ナノ構造光トランスデューサー11,12,13,14,15は、ニューロン、心筋細胞、骨格筋細胞など、さまざまなアプリケーションにわたって細胞応答を誘発することにおいて、最近顕著な成功を収めています。
ここでは、アゾベンゼン誘導体であるZiapin216,17,18を、人工層状心臓組織におけるCa2+の増殖を調査するために提案します。分子の両親媒性構造は、細胞原形質膜の正確な標的化を可能にし、一方、アゾベンゼンコアは光誘起異性化を可能にし、その立体配座変化をもたらす16,17,18。心細胞では、このトランスからシスへの異性化は、細胞膜の厚さを変化させ、活動電位を生成する一連の効果を誘発し、それが次に興奮収縮プロセス19,20,21を引き起こす。
さらに、心臓組織22の異方性成長のための工学的プラットフォームの製造プロセスを説明し、その活性を光学的にトリガーおよびモニタリングするために使用される実験セットアップを詳述し、特に組織23,24内のCa2+ダイナミクスを獲得することに焦点を当てる。最後に、取得した信号を、参照標準と考えられている電気刺激によって得られた信号と比較します。全体として、このプロトコルは、特に人工組織の文脈で、心臓細胞の挙動の理解を深めるための新しい光応答型トランスデューサーの応用を強調しています。
プロトコル
使用したヒト多能性幹細胞 (hiPSC) 培養液は、CAGrtTA::TetO-Cas9をAAVS1遺伝子座に導入して作製した、ドキシサイクリン (Dox) 誘導性CRISPR/Cas9系を持つ野生型ヒト男性iPS細胞株です (Addgene: #73500)。この研究は、Boston Children's Hospital Institutional Review Boardによって承認されたプロトコルに従って実施されました。インフォームドコンセントは、研究に参加する前に患者から得られました。hiPSC由来心筋細胞(hiPSC-CM)の作製は、前述の通りに誘導された25,26。このプロトコルについては、次のセクションで簡単に説明します。
1. ヒト人工多能性幹細胞由来心筋細胞の作製と作製
- T75フラスコで培養したhiPSCをPBSで1回洗浄します。キレート剤Verseneと10〜15分間インキュベートして細胞を剥離し、10μM ROCK阻害剤Y-27632を添加したE8培地100 mL中の5,000万IPSC/容器の密度で非イオン性界面活性剤の1%溶液で前処理したバイオリアクター容器に播種します。
- 次のバイオリアクターパラメータを設定します:攪拌60 rpm、温度37°C、pH 7、および3標準L / hでのオーバーレイガス(O2 およびCO2)。
- 培養で1日後、胚様体(EB)の直径が100〜300μmに達したことを確認し、7μMのCHIR99021を含む塩基性RPMI培地(RPMI 1640培地にB27マイナスインスリンを添加したRPMI 1640培地)で細胞を24時間処理し、その後、さらに24時間培地をRPMIに変更します。5 μM IWR-1-endo を含む塩基性 RPMI 培地をさらに 48 時間追加して、心臓系譜への分化プロセスを開始します。48 時間後、メディアを基本 RPMI に戻します。
- 分化の7日目に、1:1,000(v / v)ヒトインスリンを添加した基本的なRPMI培地で細胞を培養します。酸素消費量が30%を超える場合は、2日ごとまたは毎日50%の媒体交換でメディアをリフレッシュしてください。
- 15日目に、HBSS、コラゲナーゼII(200ユニット/ mL)、HEPES(10 mM)、ROCK阻害剤Y-27632(10 μM)、 およびN-ベンジル-p-トルエンスルホンアミド(BTS、30 μM)を含むコラゲナーゼII溶液を使用して、バイオリアクター細胞を3時間酵素的に解離します。これを行うには、まず、分化したhiPSC-CM EBs 2xを予熱したHBSSで洗浄し、Collagenase II溶液(200 μlのEBs / 12 mlのCollagenase II溶液)で37°C、5% CO2 で、完全なEB解離から単一細胞が現れるまでインキュベートします。
- 同量のブロッキングバッファー(RPMI-1640、B27およびDNase IIを含まない、RPMI-1640のmLあたり6 μLのDNase II)をシングルセル懸濁液に添加して、解離反応を停止します。分化したhiPSC−CMをカウントし、遠心分離(200 × g、5分)し、細胞をイソプロパノール中で-80°Cで24時間凍結し、播種が行われるまで液体窒素タンクに移すことで、ダウンストリームアプリケーションの準備をします。
2. 工学的層状組織作製
- 厚さ1mmの傷や紫外線に強い透明なアクリルシートに、白と青の2層の実験用テープを接着します。CO2レーザー彫刻機を使用して、アクリルシートを円形(直径20 mm、12 MWに適合)にカットし、チップパターン(3 x 7.5 mmの正方形、チップごとに3つ)を、ベクターグラフィックスソフトウェア(CorelDrawなど)で設計したテープにカットします。アクリル切断パラメータ:100パワー、20スピード、1,000PPI。テープカットパラメータ:8つのパワー、6つのスピード、および1,000PPI。ピンセットを使用して最も内側の線の内側のテープの2つの層をはがし、チップを純粋な漂白剤に30〜1時間浸して切断による太い線と暗い斑点を取り除き、鋭い線を残し、ビーカーでチップを一晩または少なくとも3時間脱イオン(DI)水で洗い流します。
注:2時間以上漂白剤を塗ると、側壁の接着剤がエッチングされ、ゼラチンが適切に付着するのを防ぎます。 - チップを10分間超音波処理し、ライン溝の特徴(25μmの隆起幅、4μmの溝幅、および5μmの溝の深さ)を有するポリジメチルシロキサン(PDMS、Sylgard 184)スタンプをきれいな70%エタノールで30分間超音波処理します。チップとスタンプをフードの下のきれいな場所に移し、空気の流れで1~2時間乾燥させます。
- ブタの皮から採取したゼラチン1g(ゲル強度~175gブルーム、タイプA)を50mLチューブに秤量します。5 mLのリン酸緩衝生理食塩水(PBS)を加え、ゼラチンがすぐに溶解するように十分に混合します。チューブを65°Cのウォーターバスに30分間入れて、溶解プロセスを完了します。同様に、微生物トランスグルタミナーゼ(MTG)1 gを別の50 mLチューブに秤量します。PBS12.5 mLを加え、十分に混合し、チューブを37°Cのウォーターバスに30分間入れて、MTGが完全に溶解することを確認します。
- ゼラチンチューブを15分間超音波処理し、使用前に65°Cの水浴に戻します。キャップを少し緩めた状態でMTGチューブをデシケーターに入れ、バキュームをゆっくりとオンにします。真空下でMTG溶液から気泡が除去されるのを観察します。脱気後、MTGチューブを37°Cのウォーターバスに戻します。
注意: プロセスを監視し、激しい沸騰を避けるために真空度を調整します。 - グリッドシートをきれいなパラフィルムで覆い、チップをグリッドに置き、スタンプを近くに置いて使用できるようにします。5 mLのゼラチン溶液に5 mLのMTGを加え、泡を避けるために慎重にピペッティングします。次に、ゼラチンをチップにすばやくピペットで固定し、チップ領域を覆うのに十分な量(各約0.5mL)を使用します。次に、ラインパターンのPDMS22 (ライン幅25μm、高さ5μm、間隔4μm)スタンプを上に置き、200gの重りを適用して、ゼラチンが組織の縦軸と平行にパターン化されていることを確認します。すべてのチップが成形されたら、環境の乱れを避けるためにガラス瓶で覆い、一晩で架橋します。
注:混合溶液ゼラチン-MTGを5分以内に使用してください。そうしないと、ゼラチンの架橋状態が高くなるため、ターゲットパターンが変化します。 - チップとPDMSスタンプサンドイッチをPBSで満たされた新しいP150皿に移し、ゼラチンを30分から1時間水和させて、PDMSスタンプとチップの分離を促進します。チップの周りの余分な成形されていないゼラチンを取り除き、きれいなチップをPBSで満たされた新しいP150ディッシュに移します。PDMSスタンプを70%エタノールで保存します。
- チップをエタノールに10分間ボンネットの下に浸して滅菌します。
注:エタノールで10分を超えないようにしてください、長時間の曝露はゼラチンを変形させる可能性があります。 - チップをPBSに移し、10分間浸し、3回すすぎます。培養培地中で20 μg/mLのフィブロネクチンと1:100に希釈した基底膜マトリックスを混合して、コーティング溶液を調製します(ウェルあたり約0.5 mL)。インキュベーター内でチップを37°Cおよび5%CO2 で2時間、または4°Cで一晩コーティングします。
- Y-27632 (10 μM) を含むRPMI培地で細胞 (8 × 105 hiPSC-CMsper cm 2) を解凍して播種し、24時間後にY-27632を含まないRPMIと交換します。
- 細胞播種から3日後、ピンセットで白いテープをはがします。
3. 光変換器の合成と応用
注:Ziapin2は、以前に発表された手順16,18に従って合成され、培養培地中のhiPSC−CMに直接投与された。
- 25 μMのZiapin2を細胞培養物に加え、37°Cおよび5%CO2 で7分間インキュベートします。
- 余分な分子をやさしく洗い流し、新鮮な培養培地ですすいでください。
4. 生存率アッセイ
注:Alamar Blueは、細胞に浸透し、細胞の生存率を監視するための酸化還元インジケーターとして機能するレサズリンベースのアッセイです。レサズリンは生理学的緩衝液に溶解し、培養中の細胞に直接添加される深い青色の溶液が得られます。活発な代謝を持つ生細胞は、レサズリンをピンク色の蛍光性であるレソフリンに還元します。
- 培養培地中の20 μg/mLフィブロネクチンと1:100に希釈した基底膜マトリックスでコーティングした96ウェルプレート内のプレート細胞。振とうして混合し、ウェル容量の10%に相当する量でアラマーブルーを各ウェルに無菌で加えます。
- Alamar Blueで培養物を4時間インキュベートします。
- 前述のように、光変換器とビヒクル(DMSO)で細胞を治療します。光ファイバー(シアン、470nm)を介して光刺激(1Hzパルス光を1分間)に加え、Ziapin2の内在化と光曝露がhiPSC-CMの生存率に及ぼす影響を評価します。
- プレートリーダーで励起560 nm、蛍光590 nmで蛍光を読み取ります。
5. 人工心臓組織層流異方性の評価
注:このプロトコルは、免疫染色、共焦点顕微鏡法、および核分析27を使用して、工学的層状心臓組織の異方性を評価するための体系的なアプローチを概説しています。
- 基材をPBSで数回洗浄した後、0.05%(v/v)Triton X-100を含む4%(v/v)パラホルムアルデヒドをPBSに10分間固定します。
- サンプルを5%(w / v)ウシ血清アルブミン(BSA)とPBSで30分間インキュベートすることにより、非特異的結合をブロックします。
- サンプルをHoechst(1:500)と室温で1時間インキュベートします。
- 顕微鏡スライドに埋込む前に、退色防止剤を使用してPBSで洗浄してください。スライドを一晩乾燥させ、イメージングするまで4°Cで保存します。
- スピニングディスク共焦点顕微鏡を20倍の倍率で使用してサンプルを画像化します。FiJiプラグインであるOrientationJ Measure28を使用して、セルの向きを決定します。
6. 光学マッピング記録
注:光学マッピングは、ゼラチン成形組織チップ上に播種したhiPSC-CM上で5日間の培養後に行いました。
- このプロトコルに従うには、光学マッピング装置が、高速度カメラを備えた改造タンデムレンズ顕微鏡と励起光源である200mW水銀ランプで構成されていることを確認してください。指定されたCa2+ イメージングカメラの前にダイクロイックミラーを配置して、調製物が励起光にさらされていることを確認し、サンプルから放出される蛍光を収集します。
- 2 μM X-Rhod 1を培養培地に添加してサンプルをインキュベートし、37°Cで30分間インキュベートします。
注:色素の光退色を避けるために、画像取得中にのみサンプルを光にさらしてください。 - セクション3で前述したように、光トラスデューサーをインキュベートします。
- 新鮮な培養培地で洗浄し、チップをB27マイナスインスリンを添加したフェノールレッドフリーRPMI 1640培地に移します。
- ティッシュチップを温度制御された皿に入れ、生理学的温度(37°C)で記録を開始し、2.5フレーム/秒のフレームレートで画像を取得します。
- 光ペーシングの場合、LED光源(465/25 nm)を使用して組織の一端に光学点刺激を適用し、Ziapin2刺激を可能にします。組織から1mm離れた場所に配置された時間的に調整された光ファイバーを介して、0.5Hzまたは1Hzの周波数で組織のペースを調整します。電気ペーシングの場合は、長方形組織の最も遠位端の中央に配置されたバイポーラプラチナ電極を使用して点刺激を適用します。この配置により、Ca2+ 波の伝播は、長方形の短辺に対応する組織の幅の中点から発生するようになります。刺激は、0.5 Hzの周波数、振幅10 V、パルス幅100 msで適用する必要があります。
- 録音後、3 x 3 ピクセル サイズの空間フィルターを適用して、信号対雑音比を改善します。
- 各パルスの各ピクセルでのCa2+ 波伝導速度を決定し、x方向とy方向の両方に沿った変化率を計算します。これを行うには、これらの方向のCa2+ 信号強度の空間勾配を測定し、それを信号の伝搬の時間遅延に関連付けます。これらの指向性変化率を組み合わせることで、波が細胞フィールドを横切って両方の次元でどれだけ速く伝わるかを定量化します。
7. データのエクスポートと取り扱い
- 参照されたソフトウェアでデータを抽出して分析します。
- 3 x 3 ピクセルの空間フィルターを適用して、信号対雑音比を改善します。
- Ca2+ トランジェント(CaT)トレースを、手動で選択した特定の関心領域(ROI)の平均として抽出します。
- 50 x 50ピクセル(≈ 25 mm2)の中央関心領域(ROI)でCaTパラメータを測定します。
- CaT ごとに、CaT 振幅、立ち上がり時間 (tピーク)、最大減衰勾配の時間 (Max Decay Slope)、および過渡減衰が 90% になるまでの時間 (Decay Time90) を解析します。
8. 統計分析
- 正規性検定などの適切な統計的検定を使用して分布の正規性を評価し、パラメトリックな方法とノンパラメトリックな方法のどちらを適用すべきかを判断します。
- 連続データまたはカテゴリデータについて、スチューデントのt検定またはマン・ホイットニーのU検定を使用して、2つの条件間の統計的有意性をそれぞれ評価します。2つ以上のグループを比較する場合は、データの仮定に応じて一元配置分散分析またはKruskal-Wallis検定を使用し、その後に適切な事後検定を使用して有意なペアワイズ差を特定します。
結果
レーザーパターニング、ゼラチン成形、および細胞播種技術の組み合わせを使用して、人工層状心臓組織を作製するための多段階プロセスが開発され、実装されました。もともとはMcCainら22 とLeeら24によって確立されたこの技術は、彼らのプロトコルに従って、人工的な層状微小組織を構築するために再実装されました。このプロセスでは、構造誘導のための精密なレーザーベースのパターニング、足場材料としてのゼラチン、生体模倣組織環境を作り出すための制御された細胞播種が統合されています。(図1)。
紙基板の成膜には、厚さ1mmのアクリル基板に白と青の2層のラボ用ラベリングテープを接着することで、後続のステップのための堅牢なベースを提供し、製造プロセス中の正確な視覚化と操作を可能にしました(図1A)。レーザーパターニングを採用して、基板上に目的のチップ形状を実現し、最適化されたパラメータにより、アクリルベースを損傷することなく正確なアブレーションを確保しました(図1B)。テープ層を選択的に除去すると、基板の特定の領域が露出し、さらに処理することができます。次に、ブタの皮から調製し、微生物トランスグルタミナーゼと架橋したゼラチン溶液をパターン化されたアクリル表面に堆積させて、細胞接着に適した生体適合性層を作製しました(図1C)。このゼラチン層は、ライングルーブパターンを特徴とするPDMSスタンプを使用して成形され、組織の縦軸との位置合わせを確保し、一晩で架橋して安定したパターン化された基板を作製しました(図1Dおよび補足図S1)。
ヒト誘導多能性幹細胞由来心筋細胞(hiPSC-CM)を、約8 × 105 細胞/cm2 の密度でプレコート基質上に播種しました(図1E)。培養条件は、細胞増殖をサポートするために、毎日の培地リフレッシュで最適化されました。3日後、白いテープ層を剥がしてパターン化されたゼラチン表面を露出させ(図1F)、細胞を特定の基質領域に正確に閉じ込め、所望の幾何学的形状を持つバイオエンジニアリングされた層状組織の開発を促進しました。その後、バイオエンジニアリング組織における hiPSC-CM の生存率とアライメントを評価しました。
Ziapin2の内在化とそれに続く光曝露が細胞生存率に与える影響を、AlamarBlue Assayを用いて評価しました。 図2A で報告された結果は、Ziapin2を25 μMの濃度で内在化し、続いて470 nmの光刺激を加えた場合、細胞生存率に悪影響を及ぼさなかったことを示しており、この光トランスデューサーアプローチと生細胞との適合性が確認されています。
バイオエンジニアリングされた層状組織内の異方性は、意図したとおりに達成され、蛍光イメージングでは、マイクロモールドゼラチン基質のパターン化された溝に沿って有意な細胞整列が示されました(図2B)。蛍光画像から明らかな細胞配向は、FiJiプラグインOrientationJ28を使用して定量的に評価されました。配向は、ヘキスト蛍光画像を処理して評価し、平均角度をθ平均 = 13.39±2.67°に等しくしました。角度は、パターン方向に正規化された向きを示し、組織内の高度な異方性を示します。測定された角度分布と標準偏差の低い測定値は、組織構造における強い指向性選好を示唆しています(図2C)。これは、協調収縮や電気伝導などの適切な機能的パフォーマンスに必要な自然な構造を模倣するために重要な異方性心臓組織の形成を実証しました。
培養に5日間浸した後、ゼラチン成形組織チップ上に播種したZiapin2をロードしたhiPSC-CMに対して光学マッピングを行いました(図3)。光学マッピングは、高速度カメラと正確な光刺激によって促進され、人工心臓組織内のCa2+ ダイナミクスの明確で詳細なイメージングを提供しました。Ziapin2の刺激は、LED光源を使用して効果的に達成され、組織サンプルは0.5Hz(図4A)と1Hz(図4B)の両方の周波数でペーシングによく反応しました。
これらの周波数での光刺激は、組織全体にわたってCa2+ 波を伝播する誘導し、縦方向の伝導速度を計算し、両方の刺激周波数で組織全体に電気信号が均一に伝播することを示し、その結果、4.5 ± 0.5 cm / sに等しくなりました(図4A、B)。
最後に、私たちの方法論を電気刺激のゴールドスタンダードリファレンスと比較しました。図5に示すように、Ca2+過渡現象(CaT)の詳細な解析により、CaT振幅(図5A)、立ち上がり時間(図5B)、最大減衰勾配(図5C)、減衰時間(図5D)などの主要なパラメータが、2つの刺激手がかり間で類似していることが明らかになりました。全体として、光学マッピングアプローチは、バイオエンジニアリングされた層状心臓組織の生理学的特性に関する高解像度データを提供し、光刺激によるZiapin2の挙動の調節における有効性を実証しました。

図1:層状心臓組織調製のスケッチ。(A)アクリル基材に2本の紙テープを堆積させます。(B)レーザーアブレーションによる両方の紙層のパターニング。(C)パターン化された基質へのゼラチンの沈着。(D)ラインパターンPDMSスタンプによるゼラチン層の成形および焼結。(E)調製した基質上の細胞播種。(F)必要な形状を達成する最初の紙層の除去。略語:PDMS = ポリジメチルシロキサン。 この図の拡大版を表示するには、ここをクリックしてください。

図2:バイオエンジニアリングされた層状心臓組織における細胞生存率とアラインメント。 (A)Alamar Blue Assayで測定したhiPSC-CMの生存率に対するZiapin2の内在化と光曝露の影響。暗闇でのCtrlの細胞生存率は100%に設定しました。データは、各条件ごとに平均 (SEM) n = 16 の平均±標準誤差として表されます。(B)マイクロモールドゼラチン上の異方性バイオエンジニアリング層流組織。異方性hiPSC組織の蛍光画像。スケールバー = 100 μm。細胞をHoechst(青)で染色します。(C)ゼラチン基質上に播種した細胞の平均配向(パターン方向に正規化)(N = 45 ROIは4つの異なるサンプルから得られ、分布の平均角度、θ平均 = 13.39°±2.67°)。略語:hiPSC-CM =ヒト誘導多能性幹細胞由来心筋細胞;ROI = 関心領域。 この図の拡大版を表示するには、ここをクリックしてください。
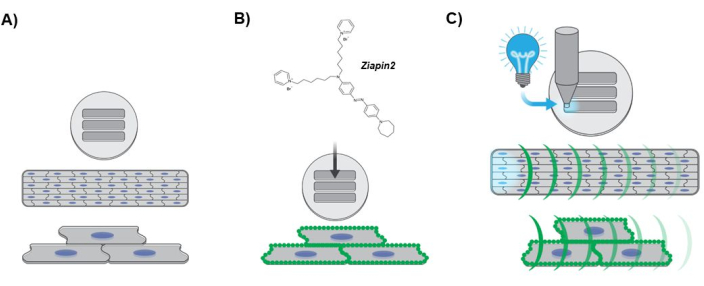
図3:実験プロトコルを示す図。 (A)異方性心臓組織形成。hiPSC-CMsの核は青色で示されています。(B)人工層状組織への光変換器の内在化。サルコレンマに沿った緑色の点は、Ziapin2膜の分割を示しています。(C)光刺激プロトコルおよびCa2+ ダイナミクス光学マッピング。シアン色の光は、LED光源を使用して組織の一端に適用される光学点刺激を示します。緑色の曲率は、人工的な層状組織に沿ったCa2+ 波の伝播を表しています。略語:hiPSC-CMs = ヒト誘導多能性幹細胞由来心筋細胞;LED = 発光ダイオード。 この図の拡大版を表示するには、ここをクリックしてください。

図4:光でトリガーされたCa2+波の代表的な記録。(A)0.5 Hzおよび(B)1 Hzでの光刺激組織のCa2+波面伝搬、等時線マップ、およびCa2+信号トレースを表す時間経過。代表的なトレースでは、各Ca2+過渡現象が光励起を表す前のシアン色の陰影領域をトレースします。この図の拡大版を表示するには、ここをクリックしてください。
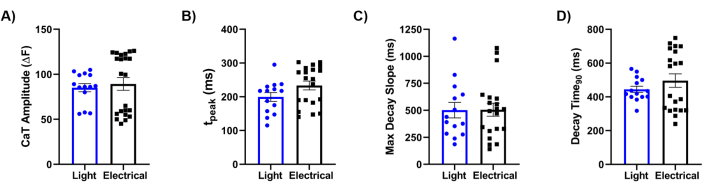
図5:電気刺激と光刺激の比較。 0.5 HzでhiPSC-CMを播種したチップに記録された光誘起および電気的に誘発されるCa2+ 過渡(CaT)パラメータの定量化。分析されたCaTの特徴は、(A)CaT振幅;(B)立ち上がり時間(tピーク)。(C)最大減衰勾配(最大減衰勾配)の時間。(D)90%の過渡減衰までの時間(減衰時間90)。ペア測定は、各条件について37°Cで実施しました。光刺激N = 5チップ、n = 14組織;電気刺激 N = 8チップ、n = 22組織。データは、平均±標準誤差の平均として表されます。略語:CaT = Ca2+ トランジェント;hiPSC-CMs = ヒト人工多能性幹細胞由来心筋細胞。 この図の拡大版を表示するには、ここをクリックしてください。
補足図S1:PDMSおよびゼラチン基質上のマイクロパターニング評価。 (A)PDMSスタンプ上に実現されたパターンの光学画像。スケールバー=100μm. (B) マイクロモールドゼラチン基板の光学画像;スケールバー=100μm.(C)PDMSスタンプ(黒線)とマイクロモールドゼラチンフィルム(赤線)のパターンプロファイル。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このアプローチは、心臓研究を前進させるための堅牢なプラットフォームを提供し、心臓組織の複雑なダイナミクスに関する洞察を提供し、新しい治療戦略につながる可能性のある長期的な in vitro 心臓機構研究の新たな可能性を開きます。この方法論を成功させるためには、人間の心臓の 生体内 条件を忠実に模倣した微生理学的環境を再現することが重要です。したがって、適切な電気伝導と収縮機能に不可欠な心臓構造の自然な異方性を再現するために、組織の設計と整列に細心の注意を払う必要があります。チップパターンの精密なレーザーカット、漂白剤処理のタイミング、ゼラチン溶液の粘度制御など、均一な組織型を作るためには重要な要素が必要です。さらに、フィブロネクチンとGelTrex(低成長因子の基底膜マトリックス)でチップを正確にコーティングすることは、細胞の付着を成功させ、その後の組織形成に不可欠です。
さらに、フォトアクチュエーター(すなわち、Ziapin216,18)のインキュベーション時間と濃度は、適切な内部化を確保するために慎重に制御する必要があります。余分な分子を徹底的に洗浄することは、非特異的な影響を防ぐために不可欠です。分子が細胞に有害な影響を与えるかどうかを評価するために、生存率アッセイを行うことを常に推奨します。フォトアクチュエータの内在化が不十分な場合は、インキュベーション時間を延長するか、より高い濃度を使用することを検討してください。
機能実験では、光ファイバーの正確な位置決めや刺激周波数のキャリブレーションなど、光学マッピング装置の適切なセットアップが、高品質のデータを取得するために重要です。録音で高いノイズレベルが示された場合は、空間フィルターサイズを調整するか、光学設定にミスアライメントがないか確認してください。
このアプローチ手法には、いくつかの重要な利点があります。整列したiPSC-CMの開発と応用は、天然の心臓組織特性の複製における顕著な改善を表しています。細胞のアライメントにより、研究者は、適切な電気的および機械的機能を維持するために不可欠な天然の心臓組織の異方性構造を厳密に模倣することができます。これにより、心筋細胞は in vivo の状態によく似た方法で相互作用し、それによって天然の心臓をより代表する生理学的挙動を示すようになります。
電解質への配線と電極の存在を必要とする電気刺激とは異なり、光ベースの変調は、特定の領域の電気的特性を制御するための非侵襲的で正確な方法を提供します。光の強度、波長、タイミングを調整する機能により、隣接する領域を混乱させることなく、的を絞った介入が容易になります。さらに、光感受性チャネルまたはタンパク質を発現するために細胞の遺伝子改変を必要とする光遺伝学とは対照的に、ウイルス遺伝子の伝達を必要としない。これらの側面は、遺伝子組み換えが実現不可能または望ましくないアプリケーションにとって重要です。さらに、材料の光刺激能力は、細胞または手順の特異性を解きほぐし、この刺激アプローチを異なる細胞タイプに容易に移行できるようにします。
心臓組織の動的かつリアルタイムの制御も、この方法論の利点です。光を利用することで、電気的特性をリアルタイムで調節することができ、さまざまな刺激が心機能にどのように影響するかを調べるための強力なツールとなります。Ziapin2との統合により、光を電気信号に直接変換することができ、hiPSC-CMの活動電位とリズムを正確に制御することができます。
このアプローチは、研究アプリケーションを前進させ、特に心不整脈やその他の電気的障害に対する正確な疾患モデルを作成するための基礎を築くことにも有望であり、研究者が制御された環境でさまざまな刺激や薬物に対する細胞応答を研究できるようにします。さらに、薬物スクリーニングと毒性試験のための堅牢なプラットフォームを提供し、従来の動物モデルと比較して、より人間に関連するコンテキストを提供します。
この点に関して、この技術は動物モデルへの依存を減らし、3R(Replacement, Reduction, and Refinement)の原則に沿っているため、倫理的な配慮にも対処します。ヒトの心臓反応について、より倫理的で潜在的に予測可能なモデルを提供することで、より人道的な研究実践への移行をサポートします。
このメソッドのスケーラビリティとカスタマイズ性により、その有用性がさらに向上します。研究者は、細胞の種類、アライメント、光トランスデューサーの配置などの要素を調整しながら、特定の研究ニーズに合わせて組織構築物を調整できます。さらに、この方法論は、大規模な実験やハイスループット研究に拡張できる可能性があるため、基礎研究と前臨床アプリケーションの両方に対応する汎用性の高いツールになります。
最後に、個別化医療の可能性は大きいです。個々の患者から hiPSC-CM を導き出すことで、研究者は患者固有の心臓組織モデルを作成でき、薬物や介入に対する個別の反応の研究が可能になります。これにより、心臓病学におけるオーダーメイドの治療アプローチへの道が開かれ、治療法開発の新たな道が開かれます。
開示事項
CB、GL、FLは「PHOTOCHROMIC COMPOUNDS」特許No.の発明者です。EP 3802491(2020年2月7日)。
謝辞
著者らは、 図1 と 図3のイラストを提供してくださったMichael Rosnach氏と、hiPSCの供給を提供してくださったWilliam T. Pu教授に感謝します。この研究は、NCATS Tissue Chips Consortium (UH3 TR003279) から KKP、イタリア大学研究省 PRIN 2022 プロジェクト (ID 2022-NAZ-0595) から FL、PRIN 2020 プロジェクト (ID 2020XBFEMS) から CB と GL、Fondo Italiano per la Scienza プロジェクト (ID FIS00001244) から GL の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| alamarBlue Cell Viability Reagent | Thermo Fisher Scientific | DAL1025 | Cell Viability Assay |
| B-27 Supplement, minus insulin | Thermo Fisher Scientific | A1895601 | For cell culture |
| Bovine Serum Albumin | Sigma-Aldrich | A9056-50G | For cell staining |
| BrainVision Analyzer software | Brain Products | https://www.brainproducts.com/downloads/analyzer/ | Data export and handling |
| BTS | Sigma | 203895-5MG | |
| CHIR99021 | Stem Cell Technologies | 72054 | |
| Clear Scratch- and UV-Resistant Acrylic Sheet, 12" x 12" x 0.01 inch | McMaster Carr | 4076N11 | Tissue chip fabrication |
| Collagenase Type II | Worthington | CLS-2 / LS004176 | |
| DNase II | VWR | 89346-540 | |
| Essential 8 Medium | Thermo Fisher Scientific | A1517001 | For cell culture |
| Fibronectin | VWR | 47743-654 | Coating |
| Gelatin from porcine skin gel strength 175 Type A | Sigma-Aldrich | G2625-100G | Tissue chip fabrication |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413302 | Coating |
| HBSS | Thermo Fisher | 14175-095 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15630080 | |
| Hoechst 33342 | Life technologies | H1399 | For cell staining |
| Insulin solution human | Sigma Aldrich | I9278-5ML | |
| IWR-1-endo | Stem Cell Technologies | 72564 | |
| Paraformadehyde 16% Aqueous Solution (PFA) | VWR | 100503-917 | For cell staining |
| PBS, sterile, 500 mL | Thermo Fisher Scientific | 10010049 | Tissue chip fabrication |
| phosphate buffered saline | Thermo Fisher Scientific | 10010049 | |
| Pluronic F-127 (20% Solution in DMSO) | Thermo Fisher Scientific | P3000MP | Non-ionic surfactant |
| ROCK inhibitor Y-27632 | Stem Cell Technologies | 72304 | |
| RPMI 1640 Medium, GlutaMAX Supplement | Thermo Fisher Scientific | 61870127 | For cell culture |
| RPMI 1640 Medium, no phenol red | Thermo Fisher Scientific | 11835030 | Optical mapping |
| Versene Solution | Thermo Fisher Scientific | 15040066 | chelating agent |
| VWR General-Purpose Laboratory Labeling Tape | VWR | 89098-058 | Tissue chip fabrication |
| X-Rhod-1 AM | Thermo Fisher Scientific | X14210 | Optical mapping |
参考文献
- Di Maria, F., Lodola, F., Zucchetti, E., Benfenati, F., Lanzani, G. The evolution of artificial light actuators in living systems: from planar to nanostructured interfaces. Chem Soc Rev. 47 (13), 4757-4780 (2018).
- Manfredi, G., et al. The physics of plasma membrane photostimulation. APL Mater. 9 (3), 030901 (2021).
- Bareket-Keren, L., Hanein, Y. Novel interfaces for light directed neuronal stimulation: advances and challenges. Int J Nanomed. 9 Suppl 1 (Suppl 1), 65-83 (2014).
- Ford, S. M., Watanabe, M., Jenkins, M. W. A review of optical pacing with infrared light. J. Neural Eng. 15 (1), 011001 (2018).
- Antognazza, M. R., et al. Shedding light on living cells. Adv Mater. 27 (46), 7662-7669 (2015).
- Zhang, J., Wang, J., Tian, H. Taking orders from light: progress in photochromic bio-materials. Mater Horiz. 1 (2), 169-184 (2014).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Ambrosi, C. M., Entcheva, E. Optogenetics' promise: pacing and cardioversion by light. Future Cardiol. 10 (1), 1-4 (2014).
- Hopkins, J., et al. Photoactive organic substrates for cell stimulation: Progress and perspectives. Adv Mater Technol. 4 (5), 1800744 (2019).
- Vurro, V., Venturino, I., Lanzani, G. A perspective on the use of light as a driving element for bio-hybrid actuation. Appl Phys Lett. 120 (8), 080502 (2022).
- Bruno, G., et al. All-optical and label-free stimulation of action potentials in neurons and cardiomyocytes by plasmonic porous metamaterials. Adv Sci. 8 (21), 2100627 (2021).
- Ronchi, C., et al. Nongenetic optical modulation of pluripotent stem cells derived cardiomyocytes function in the red spectral range. Adv Sci. 11 (3), 2304303 (2023).
- Li, P., et al. Monolithic silicon for high spatiotemporal translational photostimulation. Nature. 626 (8001), 990-998 (2024).
- Jiang, Y., et al. Nongenetic optical neuromodulation with silicon-based materials. Nat Protoc. 14 (5), 1339-1376 (2019).
- Rotenberg, M. Y., et al. Living myofibroblast-silicon composites for probing electrical coupling in cardiac systems. Proc Natl Acad Sci USA. 116 (45), 22531-22539 (2019).
- DiFrancesco, M. L., et al. Neuronal firing modulation by a membrane-targeted photoswitch. Nat Nanotechnol. 15 (4), 296-306 (2020).
- Paternò, G. M., et al. Membrane environment enables ultrafast isomerization of amphiphilic azobenzene. Adv Sci. 7 (8), 1903241 (2020).
- Vurro, V., et al. Molecular design of amphiphilic plasma membrane-targeted azobenzenes for nongenetic optical stimulation. Front Mater. 7, 631567 (2021).
- Vurro, V., et al. Optical modulation of excitation-contraction coupling in human-induced pluripotent stem cell-derived cardiomyocytes. iScience. 26 (3), 106121 (2023).
- Vurro, V., et al. Light-triggered cardiac microphysiological model. APL Bioeng. 7 (2), 026108 (2023).
- Florindi, C., et al. Role of stretch-activated channels in light-generated action potentials mediated by an intramembrane molecular photoswitch. J. Transl. Med. 22 (1), 1068 (2024).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35 (21), 5462-5471 (2014).
- Park, S. -. J., et al. Insights into the pathogenesis of catecholaminergic polymorphic ventricular tachycardia from engineered human heart tissue. Circulation. 140 (5), 390-404 (2019).
- Lee, K. Y., et al. An autonomously swimming biohybrid fish designed with human cardiac biophysics. Science. 375 (6581), 639-647 (2022).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nat Protoc. 8 (1), 162-175 (2013).
- Prondzynski, M., et al. Efficient and reproducible generation of human iPSC-derived cardiomyocytes and cardiac organoids in stirred suspension systems. Nat Commun. 15 (1), 5929 (2024).
- Pasqualini, F. S., Sheehy, S. P., Agarwal, A., Aratyn-Schaus, Y., Parker, K. K. Structural phenotyping of stem cell-derived cardiomyocytes. Stem Cell Rep. 4 (3), 340-347 (2015).
- Fonck, E., et al. Effect of aging on elastin functionality in human cerebral arteries. Stroke. 40 (7), 2552-2556 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved