Method Article
疼痛管理における緑色発光ダイオードの役割を評価するための光ニューロモデュレーション技術の最適化
* これらの著者は同等に貢献しました
要約
疼痛研究の最近の進展は、非薬理学的治療として緑色発光ダイオード(GLED)を使用した光神経調節の可能性を強調しています。GLEDは痛みの経路を調節し、効果的な痛みの緩和を提供します。この記事は、GLED 曝露プロトコルを標準化および改良し、研究間の一貫性を向上させ、この治療法の臨床応用を前進させることを目的としています。
要約
広範な研究と多数の鎮痛標的の特定にもかかわらず、疼痛に対して利用可能な薬理学的治療の範囲は依然として限られています。しかし、潜在的なパラダイムシフトは、優れた安全性、有効性、忍容性を備えた非薬理学的疼痛治療の新たな波をもたらす可能性があります。有望な研究分野の 1 つは、緑色発光ダイオード (GLED、525 nm) を使用した光神経調節であり、急性および慢性疾患の両方で痛みを緩和する可能性が示されており、この治療法の有効性を調査する多数の前臨床および臨床研究につながっています。これらの研究プロジェクトは、GLEDへの曝露が、網膜のMコーン活性化後の脳および脊髄の内因性オピオイド系の活性をどのように強化するかを実証しています。この知見は、GLEDが下行する疼痛経路を調節することにより、疼痛を緩和する可能性があることを示唆している。GLEDの魅力的な効果に照らして、光ニューロモデュレーション研究の急増は、前臨床試験および臨床試験における明確に定義され標準化された曝露プロトコルの一貫性を確立することの重要性を強調しています。前臨床試験では、12時間の光相中に100ルクスで8時間の光を含むプロトコルを使用して、最低2日間の曝露後に有益な効果が観察されています。.臨床試験では、曝露プロトコルは調査中の特定の病状に合わせて調整されます。15分間の曝露は、急性術後疼痛の調節に有利であることが証明されています。慢性疼痛の調節のために、患者は自宅でGLEDを10週間にわたって1日1〜2時間使用するように指示されます。この記事では、光神経調節の利点を評価するさまざまな研究における再現性と一貫性を向上させるための前臨床および臨床プロトコルについて詳しく説明します。これらの標準化されたプロトコルを確立することにより、この作業は、GLED 光線療法の臨床応用を、疼痛に対する実行可能な非薬理学的治療として進めることを目的としています。
概要
薬理学的治療、特にオピオイドは、急性および慢性の疼痛状態の管理に引き続き大きく依存しています1。疼痛管理の有効性は、オピオイド使用に関連する副作用の頻度と重症度によって大きく影響を受ける可能性があります2。このため、オピオイド治療を受けている患者のかなりの部分が、疼痛管理を成功させていません3。したがって、疼痛専門医と患者コミュニティは、従来の鎮痛剤に関連する副作用を回避する非薬理学的治療をますます求めています。光ニューロモデュレーションは、痛みを管理するための有望な解決策および安全な治療法として浮上しています。
光神経調節(PNM)は、発光ダイオード(LED)を使用して生物学的プロセスを調節する非侵襲的手法です4。光線療法は、数千年前に日光、またはヘリオセラピーを使用して皮膚の状態を治療するために確立されました5。その後、光が生体組織に影響を与えるという概念が広がり、光神経調節という用語が開発されました。PNM研究は現在、世界中で拡大しており、疼痛管理6、7、8、9、アルツハイマー病患者の睡眠の質の改善10、うつ病のコントロール11など、さまざまな臨床応用でその有効性が示されています。
疼痛管理のための光神経調節のメカニズムと治療の可能性を調査することを目的とした前臨床研究と臨床試験にますます重点が置かれています。これらのアプローチの中で、525 nmの波長刺激を使用した緑色発光ダイオード療法(GLED)は、片頭痛、線維筋痛症、術後の痛みなど、さまざまな種類の痛みを軽減する有望な有効性を示しています12,13,14,15,16。臨床試験では、グリーンライト療法が、活動性片頭痛発作中の頭痛痛と羞明強度の両方を低下させることにより、複数の研究12,17,18で片頭痛に苦しむ患者に一貫して利益をもたらすことが示されており19、片頭痛エピソードの頻度と持続時間12を減少させます.前臨床試験では、神経障害性疼痛の神経損傷モデルにおいて、GLEDへの曝露が熱的および機械的過敏症を逆転させる可能性があることも示されました20。さらに、前臨床試験では、GLEDが痛みの知覚と感覚閾値に影響を与えるメカニズムが調査されています13、21、22、23、24。これらの研究は、M錐体の関与とそれに続く腹側外側膝状核(vLGN)の調節を強調しており、これにより背側縫線核(DRN)に投射するエンケファリン作動性ニューロンの活性が増加します22。さらなる研究はまた、下行性疼痛調節の主要な調節因子である吻側腹内側髄質(RVM)21の重要な役割を強調しています。まとめると、これらの知見は、GLEDが下行疼痛経路20,25に作用する視覚回路を調節することにより、疼痛知覚を変化させることを示唆している。しかし、臨床応用への応用を促進するためには、さらなる研究が必要です。
この記事では、GLEDベースのPNMを実装するための包括的な方法論を詳しく説明し、実験的および臨床使用のための再現性のあるフレームワークを提供することを目指しています。GLED曝露の設計と操作について説明し、標準化されたアプリケーションプロトコルの概要を説明し、有効性と再現性を確保するための主要な考慮事項について説明します。さらに、上行および下降疼痛経路の両方の活動を評価するための詳細なプロトコルを提供し、GLED 誘発性鎮痛の調節におけるそれらの役割についてより深い調査を可能にします。このアプローチを共有することで、非薬理学的疼痛管理の研究を進め、利用しやすく、効果的で、より安全な治療法の開発に貢献することを目指しています。
プロトコル
すべての動物実験手順は、アリゾナ大学の動物施設管理および使用委員会によって承認され、国立衛生研究所の実験動物の使用に関するガイドラインに準拠しています。病原体を含まない成体のSprague Dawleyラット(試験時の体重:275-330 g)を、12時間の明暗サイクルで温度制御された部屋の標準的なビバリウムラットケージ(ケージあたり3匹)に収容し、餌と水へのアドリブアクセスを許可されました。すべての行動実験は、治療条件を知らされていない実験者によって行われました。すべての人間の手順は、プロトコル番号 (STUDY00000370) の下でアリゾナ大学治験審査委員会 (IRB) から承認されました。この研究は、NCT05295225歳未満の ClinicalTrials.gov に登録されています。
1.動物における光曝露プロトコル
- 光の露出を最適化し、動物の飼育を準備する
- 次の特性を持つ可視スペクトル発光ダイオード(LED)フレックスストリップを取得します:(i)緑色LED(材料表)、波長525nm、電力8W、電圧120V、ビーム角120°。(ii)白色LED(Table of Materials)、電力9.6 W、電圧120 V、ビーム角120°。
- 分光計で光スペクトルの精度を確認します(この研究では、アリゾナ大学のBIO5研究所のBiomedical Device Prototyping Serviceを使用しました)。
注:緑色のLEDは、中心波長が525 ± 10 nm(最も明るい発光点)、全幅半最大値(FWHM)が40 nm未満、レコード強度ドロップ(光強度が最大値の50%に低下する)が500 ± 5 nmおよび530 ± 5 nm21である必要があります。白色LED FWHMは、90nmを超える必要があります。白色光の複数の光源を使用できます。実験者は、525nmの波長の低強度と、複数の波長21をカバーするスペクトルの広いスパンを確保する必要があります。 - ルクスメーター(Table of Materials)を使用して、光の強度を測定し、最適化します。必要に応じてLEDを黒いテープ(材料の表)で覆い、目的の強度を取得します。
注:強度が異なると感覚閾値にさまざまな影響を与える可能性があるため、光の強度を測定して検証することが重要です(図1)。強度が正確でない場合は、目的の強度に達するまで、一部のLEDを覆うか覆いを外します。 - LEDストリップを暗い部屋(材料の表)のワイヤーシェルフの上端に固定して、各シェルフに専用の光露光源が装備されていることを確認します。LEDストリップにタイマー(材料の表)を配置して、午前8時から午後6時までケージを露出させます。
- 透明な静的ケージをシェルフに取り付けます。光の干渉を最小限に抑えながら露出を最適化するために、すべての側面に暗いシート(材料の表)で棚を完全に囲みます。
- ルクスメーターを使用して、一部のLED(各ケージの中心で100ルクス)を覆ったり覆ったりすることで、ケージ内の光強度の最終的な最適化を行います(補足図1)。
- ベースラインの感覚行動の取得と曝露の開始
- 到着したら、ラットが動物施設に1週間順応するのを待ちます。この順応期間の後、ラットを実験者の取り扱いに少なくとも7日間慣れさせます。
- 動物を治療条件に基づいて 3 つの実験グループに分類します: (1) 緑色光曝露 (GLED) と外科的介入の組み合わせ、(2) 白色光曝露 (WLED) と外科的介入の組み合わせ、および (3) 偽手術による WLED 対照群。
- 試験の1時間前に、実験者が好ましくは存在する試験エリアと同じ部屋で、金網(材料の表)上の透明なプレキシガラスの箱にラットを順応させます。
- 術前の閾値を評価するには、ディクソンの上下法を使用して、左後肢のフォンフレイフィラメント26 (材料表)を使用して足の離脱閾値を測定し、4.31フィラメント(19.6 mN)から始めて、ベースラインの足の離脱閾値を確立します。
注:機械的感度は、引き出ししきい値を決定することにより、「アップアンドダウン」方法を使用して評価する必要があります。動物が4.31フィラメント(19.6 mN)に反応しない場合は、太い4.56フィラメント(39.2 mN)を使用します(反応は、影響を受けた足の離脱、震え、または舐めとして視覚的に記録されます)。動物が4.31フィラメントに反応する場合は、細い4.08(9.8 mN)フィラメントを使用してください。- 各フィラメントを後足の足底面に垂直に塗布し、動物を吊り下げられた金網ケージに配置します。
- フィラメントの圧力を、前のフィラメントサイズに基づいて増減します。
- 動物がその後の反応が肯定的または否定的であったかどうかに応じて、徐々に太くなるフィラメントまたは細いフィラメントを引き続き使用します。
- 否定的な回答と肯定的な回答の両方を 、補足表1に示すデータシートに記録してください。
注意: 各フィラメントは、一度に1つずつ順番に塗布する必要があります。最初の肯定的な反応の後、同じ足を異なるフィラメントでさらに4回テストします。すべての動物で信頼性の高い結果を得るために、実験者はフィラメントをフットパッドに適用しないようにする必要があります。
- ハーグリーブス試験を使用して熱感度ベースラインを測定するために、試験エリアと同じ部屋で試験する前に、ラットをハーグリーブス装置(材料の表)の透明なプレキシガラスボックスに1時間順応させます。
注:ハーグリーブステストでは、ラットが数秒間静止している必要があります。最初の1時間の慣れ期間後もラットが過度に活動的である場合は、必要に応じて順応時間を延長します。ラットが落ち着いて静止しているが、眠りに落ちないように十分に警戒していることを確認してください。ハーグリーブステスト(資料表)を実施する前に、赤外光の強度を設定して、痛みの感受性を測定するためのベースラインを確立することが重要です。目標は、離脱潜伏期間をベースラインで平均約 20 秒にすることであり、これにより、痛覚過多/減痛症などの疼痛反応の変化を検出するのに十分な感度が得られます。足が引き抜かれると、モーション検出器が刺激とタイマーの両方を停止します。組織の損傷を防ぐために、最大カットオフ値 33.5 秒が適用されます。 - 術前の行動閾値を評価するには、赤外線レーザーを動物の左後足の中央の下に置きます(赤外線エミッターのガイドラインを使用)。
- 熱刺激を開始して、動物が熱に反応して足を引っ込めるのにかかる時間(離脱潜時)を測定します。
注:平均引き出し遅延が20秒に近くない場合は、強度を調整し、目的の平均が決定されるまでテストを繰り返します。その後、実験の残りの部分で強度が一定に保たれます。この研究では、刺激強度30(50W)を使用しました。テストを繰り返す必要がある場合は、同じ動物でテストを繰り返す前に5分間隔を空けてください。 - 引き出しレイテンシーは 、補足表2のデータシートに記録します。
注:熱刺激の温度に影響を与えないように、試験中は尿をきれいにしてください。
- 熱刺激を開始して、動物が熱に反応して足を引っ込めるのにかかる時間(離脱潜時)を測定します。
- ベースラインの感覚行動の獲得に続いて、動物を静的ケージに収容して光を浴び、手術前の4日間(1日8時間、午前6時から午後2時まで)食物と水に継続的にアクセスします。
- 疼痛モデルの誘導と感覚閾値の術後評価
- 曝露が 4 日目の午後 2 時に終了した後、左後肢のブレナン モデルに従って切開手術を行い、術後疼痛27,28 を誘発します。
- 5日目も曝露を続けます。曝露が5日目の午後2時に終了した後、前述のようにフォンフレイテストとハーグリーブステストを実施して、手術後1日で熱的および機械的過敏症を評価します。.
- 6日目も曝露を続けます。曝露が6日目の午後2時に終了した後、前述のようにフォンフレイテストとハーグリーブステストを実施して、手術の2日後に熱的および機械的過敏症を評価します。.
注:動物が施設の動物管理および使用委員会によって確立されたエンドポイント基準に達した場合は、研究から動物を除外してください。 - 行動試験を完了した後、施設動物管理および使用委員会によって概説されたプロトコルに従って、動物に安楽死を行います。
- 動物データ解析
- 回答の機械的離脱パターンをAllodynia Software(National Instruments, LabView 2015)に入力して、機械的な感覚閾値を評価する29。
注:ソフトウェアは、Chaplanら30で詳述されているように、ノンパラメトリックディクソン法を使用しています。 - 離脱待ち時間をスプレッドシートで報告し、その後の熱性異痛症の統計分析に役立てることができます。
- 平均感度 (しきい値または遅延) を時間の関数として表示するプロットを生成します。
- 回答の機械的離脱パターンをAllodynia Software(National Instruments, LabView 2015)に入力して、機械的な感覚閾値を評価する29。
2. ヒトにおける光曝露プロトコル
- 被験者評価のための露出室の設置
- 露光室の準備から始め、潜在的な干渉を排除するために外部光源が完全にないことを確認します。
注意: この手順は、LEDライトの影響を分離するために不可欠です。 - LEDライトを被験者の椅子から3〜6フィートの距離に配置します。
注:この範囲は、一貫した光強度と効果的な曝露を確保するための以前の臨床試験に基づいています。 - 2 m の LED ストリップを取り付け、ルクスメーターを使用して 90 〜 100 ルクスの必要な光強度範囲を確保します (材料の表 と 補足図 2)。
- ライトストリップの位置を変更したり、一部のLEDを覆ったりして、光の強度を最適化し、被験者が座っている主要な領域で90〜100ルクスを受け取るようにします。
- 露光室の準備から始め、潜在的な干渉を排除するために外部光源が完全にないことを確認します。
- 機械的な時間的総和評価をテストするための習熟手順
- 評価を行う前に、手洗いを徹底し、手袋を着用して、適切な手指衛生を確保してください。
- 機械的感度を評価する前に、校正されたフォンフレイフィラメント(6.65 mN、300 gの力に相当)を洗浄および消毒して、無菌性を確保します。
- 今後の評価のために僧帽筋を露出させる許可を要求します。
- フォンフレイフィラメントは、フィラメントが曲がるまで僧帽筋の非利き側に適用されることを患者に伝えます。
- 患者に自分の痛みを 0 から 10 のスケールで評価するように指示します。ここで、0 は痛みがないことを表し、10 はオペレーターが「今すぐ」と言った直後に想像できる最悪の痛みを表します。
注:オペレーターが「今」と言ったときに、患者が迅速かつ正確な応答を提供することを確認してください。 - フィラメントを非支配的な僧帽筋の3つの異なるポイント(1インチ間隔)に3回適用し、各適用の間に5秒の間隔を空けます。
- フォン・フレイ・フィラメントが1秒に1回、同じ場所に10回適用されることを被験者に伝え、被験者に最後の塗布の痛みを評価してもらいます。
注意: 10のアプリケーションすべてで、僧帽筋の同じ場所を使用します。 - 非支配的な僧帽筋にフィラメントを 10 回適用して時間的合計効果を測定し、被験者に刺激の終わりの痛みを評価するように依頼します。
- 機械的な時間的総和の試験
- 慣れ手順の後、3分間の休憩を取り、フォンフレイフィラメントが僧帽筋の利き側に適用されることを患者に伝えます。
- 校正されたフォンフレイフィラメントを清掃して消毒します。
- オペレーターが「今」と言った直後に、患者に痛みを0から10のスケールで評価するように指示します。
- フィラメントを支配的な僧帽筋の3つの異なるポイント(1インチ間隔)に3回適用し、各適用の間に5秒の間隔を空けます。患者の反応をレコードシートに記録します(補足表3)。
- フォン・フレイ・フィラメントが1秒に1回、同じ場所に10回適用されることを被験者に伝え、被験者に最後の塗布の痛みを評価してもらいます。
- ドミナント僧帽筋にフィラメントを10回適用することにより、時間的合計効果を測定します。被験者の回答をレコードシートに記録します(補足表3)。
- この処理を3分間隔で2回繰り返し、被験者の回答をレコードシートに記録します(補足表3)。
- 条件付疼痛調節評価のための習熟ステップ
- 12°Cの冷水浴を準備します(補足図3)。
注意: 温度計(材料の表)を使用して、テストの前に温度を確認してください。テスト期間中の温度を調整するために、必要に応じて追加の氷を用意してください。 - アルゴメーターを清掃し、消毒します。
- CPM(Table of Materials)の評価にはMedocソフトウェアを使用してください。
- AlgoMed オプションを選択します (補足図 4)。ホーム画面で、Algometer Deviceを見つけてクリックし、アクティブにします。
- リストから正しい患者を選択し、テストプログラムを選択します。
- デバイスを適用するサイトを選択します。この習熟ステップでは、ボディダイアグラムから非ドミナントの僧帽筋を選択します(補足図5)。
注: [テストに移動]をクリックすると、テスト画面に移動します。圧力を加える前に、ソフトウェアでは、デバイスがまだ圧力をかけていない事前テストを実行する必要があります。この事前テストは、新しいテストが開始されるたびに完了する必要があります。 - テストを開始し、5 秒のタイムアウト。
- デバイスは加えられる圧力の量を測定し、僧帽筋の非利き側に圧力を加えるために使用されることを患者に伝えます。患者が痛みを感じ始めたらすぐに「やめて」と言ってもらいます。
- [開始] をクリックします。システムは、デバイスの適用を開始する前に 5 秒の待機を課します。
- 30 kPa/s の速度で力を増加させて、僧帽筋にアルゴメーターを適用します (補足図 6)。
- 患者の反応をレコードシートに記録します(補足表3)。
注:この研究では、適用される最大圧力は650kPaです。この研究は、痛みの耐性を評価するのではなく、痛みの発症を具体的に評価します。 - 評価には氷水浴を使用することを参加者に伝えます。
- 温度計(材料表)を使用して水温を約12°Cに確認してください。 タイマーを10秒に設定します。
- 利き手を手首まで水に浸すように参加者に指示し、手がリラックスし、指が広がるようにします。
- オペレーターが10秒の終わりまでに「今」と言ったとき、参加者に0から10のスケールで痛みを評価するように依頼します。
- 10 秒の終わりに疼痛評価を求め、患者の反応をレコード シートに記録します (補足表 3)。
- 12°Cの冷水浴を準備します(補足図3)。
- 条件付疼痛調節のテスト
- 温度計(材料表)で水温を確認してください。
- アルゴメーターを清掃し、消毒します。
- 3 分間の休憩の後、次の評価のために支配的な僧帽筋を露出する許可を要求することにより、条件付疼痛調節 (CPM) の評価を開始します。
- 患者が痛みを感じ始めたらすぐに「やめて」と言ってもらいます。ソフトウェアの[開始]をクリックします。
- 30 kPa/sの速度で力を増やして僧帽筋にアルゴメーターを適用し、患者の反応を記録シートに記録します(補足表3)。
- 優勢な僧帽筋の異なる部位で、それぞれ3分の間隔を空けて、さらに2回アプリケーションを繰り返します。
- 被験者からの皮膚油の蓄積による滑りを防ぐために、各アプリケーションの前にアルゴメーターが十分に洗浄および消毒されていることを確認してください。
- 患者の反応をレコードシートに記録します(補足表3)。5分待ってから、条件刺激テストに移ります。
- [開始] をクリックします。システムは、デバイスの適用を開始する前に 5 秒の待機を課します。
- アルゴメーターを清掃し、消毒します。
- 利き手ではない手を手首まで氷水浴に浸すように患者に指示します。.
- 30 kPa/sの速度で力を増やして僧帽筋にアルゴメーターを適用し、患者の反応を記録シートに記録します(補足表3)。
- 僧帽筋の異なる部位でさらに2回、それぞれ5分の間隔を空けて繰り返します。
注:初期スクリーニング後に以前に発見されていない病状が特定された場合、特にその状態が研究を妨げる可能性がある場合は、研究を中止してください。 - ベースラインの曝露前値を取得した後、患者に割り当てられた光条件に患者を曝露し始めます。
- 光源を直接見つめないようにボランティアに指示します。
注意: 代わりに、自宅の周囲光源の場合と同様に、光が周辺視野に入るようにする必要があります(補足図7)。 - 被験者をLEDライトに1.5時間さらします。
注:長時間の光治療の場合、被験者は自宅で最大10週間自己投与します。線維筋痛症影響調査票(FIQ)、HIT-6(頭痛影響テスト)、PSQI(ピッツバーグ睡眠品質指数)、EQ-5D-5L(全体的な健康状態を評価するため)などの調査と、痛みに関する質問票を使用して、治療の効果を経時的に監視することができます。 - 曝露中は、読み書きなど、追加の光源を必要としない活動に参加するようにボランティアに奨励します。
注意: 4〜100ルクスの強度で十分な照明が得られます。 - プロトコルを完全に遵守するために、曝露期間中は睡眠を控えてください。
- 光曝露療法の後、ベースラインで完了したすべての測定を繰り返します。
- 人によるデータ分析
- 機械的な時間的合計の場合は、3 つのベースライン測定値の平均と 3 つの反復刺激の平均を計算します。
- 反復刺激後の平均痛み評価をベースラインの平均痛み評価で割り、その結果に 100 を掛けてパーセンテージで表すことにより、機械的な時間的合計パーセンテージを計算します。
注:100%を超えるパーセンテージは、刺激を繰り返すと痛みの知覚が増加したことを示し、時間的合計の存在を示唆しています。 - 機械的に調整された疼痛調節 (CPM) の場合、無条件刺激 (冷風呂なし) 中に得られた最後の 2 つのベースライン疼痛閾値 (kPa) の平均を計算します。
- コンディショニング刺激中の最後の 2 つの痛みの閾値 (kPa) の平均を計算します。
- CPM を計算するには、次の式を使用します。
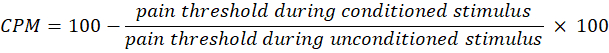
注: CPM 値 0 は痛みの知覚に変化がないことを示し、負の値は条件付け刺激中の痛みの感覚抑制を示し、正の値は条件付け刺激中の痛みの促進を示します。 - 光曝露前後の時間的合計と CPM の両方の変化を評価して、治療がそれぞれ上行および下降疼痛経路の活動にどのように影響するかを評価します。
結果
グリーンライトへの曝露は、線量依存的に足の離脱遅延を増加させます
図1A は、さまざまな強度(4、50、100、および200ルクス)での緑色発光ダイオード(GLED)への曝露が、ナイーブラットモデルの7日間の曝露期間にわたって足の離脱遅延を有意に増加させたことを示しており、GLEDの抗侵害受容効果を示しています。光曝露前のベースライン待ち時間は、グループ間で同等でした。1日目から、GLED処理群は白色発光ダイオード(WLED)対照群と比較して離脱待ち時間が徐々に増加し始め、その差は4日目までに統計的に有意になりました(p < 0.04)。離脱潜伏時間の増加はGLED曝露の強度と正の相関があり、最高強度(200ルクス)は最大の抗侵害受容効果をもたらし、一方、低強度(4ルクス)は依然として顕著な効果を示したが、対照群と比較して有意ではなかった。
GLEDの抗侵害受容効果は強度依存性である
図1Bの曲線下面積(AUC)分析は、GLED曝露が強度依存性の抗侵害受容反応を誘発することをさらに確認しています。7日間の足の離脱遅延のAUC分析は、最も高いGLED強度(200ルクス)がWLED対照群(p = 0.0015)と比較して有意に強い抗侵害受容反応を誘発したことを示しています。GLEDの中間強度(100ルクスと50ルクス)もAUCの有意な増加をもたらしました(それぞれp = 0.0068とp = 0.0472)一方で、最も低い強度(4ルクス)はWLEDと比較して統計的有意性に達しませんでした(p = 0.7033)。これらの結果は、明確な用量反応関係を示しており、GLED強度が高いほど鎮痛効果が大きくなります。
緑色光曝露はラットの術後過敏症を緩和する
100ルクスでのGLEDへの曝露は、足の手術誘発性疼痛モデルにおける機械的過敏を逆転させた。手術前、ベースラインの足の離脱閾値はグループ間で一貫していました。しかし、手術後、ラットは足の離脱閾値の顕著な減少を示し、機械的過敏症の増加を示しました。この過敏症は、手術前の4日間、100ルクスで毎日緑色LEDを8時間曝露した後、効果的に逆転しました(図2A、B)。熱過敏症も評価され、手術後の足の離脱潜伏の大幅な減少が示されました。機械的評価と同様に、過敏症は 8 時間の毎日の GLED 曝露で逆転しました (図 2C、D)。これらの知見は、急性術後疼痛モデルにおける抗侵害受容的介入としてのGLED曝露の有効性を実証している。
ヒト被験者における時間的総和と条件付疼痛調節
健康な被験者では、機械的時間的合計 (TS) を使用して上行性疼痛経路の活動を評価し、機械的条件付け疼痛調節 (CPM) を使用して下行性疼痛経路の活動を評価しました。被験者は、時間的合計中に機械的感度の有意な増加を示しました(図3A)。反復刺激に反応した機械的感受性の増加率は著しく上昇し、痛みの中枢性促進が強化されたことを示しました(p = 0.0039)。この知見は、反復的な侵害受容入力に対する感度の高まりを反映しており、時間的総和の増加と一致しています。CPMテストの結果は、非条件刺激フェーズと比較して、条件付け刺激フェーズ中の機械的感度の有意な低下を示しています(図3B)。被験者は機械的感受性の大幅な低下を示し、平均37.32%の減少を示しました(p = 0.0039)。これは、条件刺激中の痛みの知覚の抑制によって証明されるように、下行する痛み抑制経路の効果的な活性化を示唆しています。これらの評価は、ヒトの緑色光曝露によって引き起こされる疼痛調節の根本的なメカニズムを明らかにするための有望な可能性を提供します。
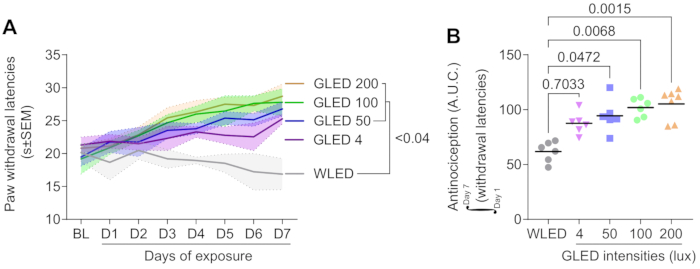
図 1.光強度はラットの熱侵害防止受容に影響を与えます。 雄ラットを緑色LED光(λ=525nm)または白色LED(8時間/日、100ルクス)に連続して7日間ばく露し、ハーグリーブス試験を用いて熱感受性を毎日評価した。4つの強度の緑色LED(GLED)を評価しました(4、50、100、および200ルクス)。(A)熱感度は、光曝露(BL)前および曝露7日間にわたって測定されました。7日目に、50〜200ルクスのGLEDは熱感覚閾値を増加させます(二元配置ANOVAとそれに続くテューキーの事後検定、n = 6-7、0.192 < p < 0.392)。(B)曲線下面積分析(1〜7日目)を実施して、7日間の光強度の全体的な影響を評価しました。抗侵害受容効果の振幅は、光の強度とともに増加します(Kruskal-WallisとDunnの事後テスト、n = 6-7)。データは平均±SEMとして示されています。 この図の拡大版を表示するには、ここをクリックしてください。

図 2.GLED 曝露は、急性術後疼痛のラットモデルで観察された熱痛覚過敏と機械的異痛症を逆転させます。 雄ラットを、切開手術の4日前(赤い三角形、Sx)と手術の2日後に、緑色LED光(λ=525nm、GLED)または白色LED(8時間/日、100ルクス、WLED)にばく露した。機械的異痛症と熱痛覚過敏は、それぞれフォン・フレイ・フィラメントとハーグリーブス・テストを使用して評価されました。(A)機械的過敏症は、手術前と手術後2日で評価されました。ラットは、手術後に足の離脱閾値の有意な減少を示しました。この過敏症は、毎日のGLED曝露の8時間によって逆転しました(双方向ANOVAとそれに続くテューキーの事後検定、n = 12-14)。(B) パネル A の曲線下面積分析 (1 日目から 2 日目まで) GLED への曝露により、機械的過敏症の減衰が示されました (Kruskal Wallis に続いて Dunn の事後テスト)。(C) 熱過敏症は、手術前と手術後 2 日で評価されました。GLED曝露は、WLED条件と比較して、足の手術で観察された足の離脱潜伏を増加させました(二元配置ANOVAとそれに続くテューキーの事後検定、n = 14-15)。(D)パネルCの曲線下面積分析(1日目から2日目まで)GLEDと手術を受けなかった対照動物、および手術を受けたがWLEDに曝露された動物との間に有意差は観察されませんでした(Kruskal WallisとDunnの事後試験)。データは平均±SEMとして示されています。 この図の拡大版を表示するには、ここをクリックしてください。
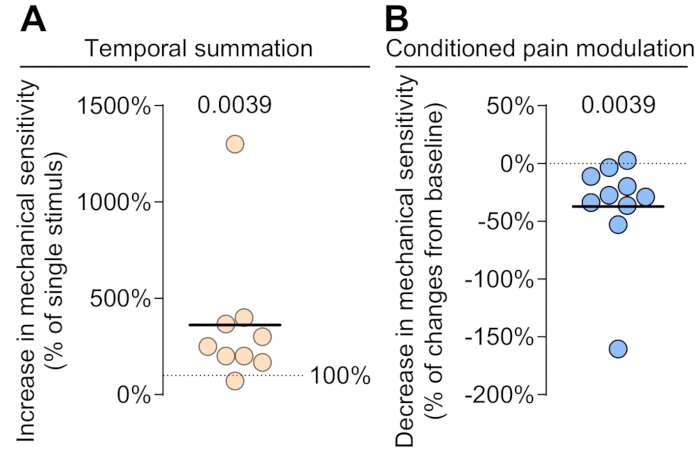
図 3.健康な被験者で観察された機械的な時間的合計と条件付き疼痛調節。 時間的合計 (TS) と条件的疼痛調節 (CPM) を人間で測定して、それぞれ上行疼痛経路と下降疼痛経路の活動を評価できます。(A)各被験者の機械的TS、初期刺激のパーセンテージとして表される。10回の刺激のシーケンスは、単一の刺激と比較して痛みの知覚を大幅に増加させます(Wilcoxon符号付きランク付け検定、n = 9)。(B)機械的CPM、別の有害な刺激(条件刺激として12°C冷水浴が使用されました)中に刺激が適用されたときの痛みの閾値の低下を示します。被験者は、CPM中に疼痛感受性の低下を示しました(Wilcoxon符号付きランク付け検定、n = 10)。 この図の拡大版を表示するには、ここをクリックしてください。
補足 図1:動物の飼育と光への曝露のセットアップ。 この画像は、光曝露実験中のラットの最適化されたハウジング設定を示しています。このセットアップには、各ケージの上に配置された固定光源が含まれており、一貫した露出を確保します。外部光源やケージ間の光の干渉を最小限に抑えるために、棚は四方を暗いシートで完全に囲まれており、制御された環境を作り出しています。この配置により、動物にとって正確で途切れることのない光の曝露が保証され、GLED曝露の影響を正確に評価することができます。この図をダウンロードするには、ここをクリックしてください。
補足 図2:ヒト被験者の被ばくに対するGLEDセットアップ。 この画像は、人体の被写体への露出に使用される 2 メートルの緑色 LED (GLED) ストリップの取り付けを示しています。LEDストリップは、ルクスメーターを使用して測定および検証される90〜100ルクスの一貫した光強度範囲を確認するためにテストされています。この制御された環境は、臨床試験で人間の被験者に対する緑色光の影響を評価するために最適化されています。 この図をダウンロードするには、ここをクリックしてください。
補足 図3:コンディショニングペインモジュレーション(CPM)テスト用の冷水浴。 この画像は、12°Cに維持された冷水浴を特徴とする、条件付疼痛調節(CPM)評価のセットアップを示しています。 温度は、精度を確保するために、各テストの前に温度計を使用して慎重に検証されます。試験中に必要に応じて水温を調整および維持するために、追加の氷が手元に保管されています。 この図をダウンロードするには、ここをクリックしてください。
補足 図4:Medocの高度な医療システムソフトウェアのスクリーンショット。 この画像は、Medoc の高度な医療システムソフトウェアのスクリーンショットを示しています。ホーム画面には、対応するアイコンをクリックすることでアクティブになるアルゴメーターデバイスの選択が表示されます。 この図をダウンロードするには、ここをクリックしてください。
補足 図5:Medoc advanced medical systemsソフトウェアのスクリーンショット(テスト場所の選択)。 この画像は、Medocの高度な医療システムソフトウェアインターフェースをキャプチャし、特にテスト場所の選択に使用されるボディダイアグラムを強調しています。この選択プロセスは、条件付疼痛調節(CPM)評価中に正確な疼痛評価を確保するために重要であり、指定された筋肉領域の痛みの閾値の的を絞った測定を可能にします。 この図をダウンロードするには、ここをクリックしてください。
補足 図6:僧帽筋にアルゴメーターを適用する際のインターフェース。 この画像は、Algometer Deviceが僧帽筋に適用されている間、Medocの高度な医療システムソフトウェアインターフェースを示しています。インターフェースは、力が毎秒30キロパスカルの速度で増加するとリアルタイムのデータを表示し、加えられる力が650キロパスカルを超えないようにします。 この図をダウンロードするには、ここをクリックしてください。
補足 図7:GLED曝露と試験室。 この画像は、緑色発光ダイオード(GLED)の露光と試験室のセットアップを示しています。座席の配置は、参加者が快適で注意力を発揮できるように設計されており、光に完全にさらされながら眠りに落ちるリスクを最小限に抑えます。 この図をダウンロードするには、ここをクリックしてください。
補足表1:フォン・フレイ試験のデータ収集シート。 この表により、実験者はフォン・フレイ・フィラメントを使用した場合の応答のパターンを記入することができます。 この表をダウンロードするには、ここをクリックしてください。
補足表2:ハーグリーブステストのデータ収集シート。 このテーブルにより、実験者はハーグリーブステスト中に観察された応答パターンを記録し、文書化することができます。 この表をダウンロードするには、ここをクリックしてください。
補足表3:時間的合計および条件付け疼痛調節(CPM)中の被験者の反応を記録するためのデータ収集シート。 この表は、実験者が時間的合計と条件付けられた疼痛調節の評価中に観察された疼痛反応を文書化するための構造化された形式を提供します。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
最近の研究では、緑色光(GLED)鎮痛13,21,22,23,24の根底にあるメカニズムが調査されています。ただし、臨床診療への応用を強化するには、方法論のさらなる標準化が必要です。前臨床モデルで観察された用量依存的な抗侵害受容効果は、治療結果を最大化するために曝露パラメータを最適化することの重要性を強調しています。ただし、げっ歯類モデルで観察されたこれらの影響は、臨床現場で確認する必要があります。GLEDのヒトへの影響を研究するために、時間的総和(TS)と条件的疼痛調節(CPM)を評価することで、研究者はそれぞれ上行疼痛経路と下降疼痛経路の活動を分析できます。CPMは、反刺激の現象に基づいており、そこでは、体の一部に加えられた有害な刺激が、下行抑制システム31を活性化することによって、別の部分の痛みを抑制することができる。TSは、上昇する疼痛促進経路32を評価するために、頻繁に同じ強度で投与される一連の有害な刺激の適用に続く疼痛知覚の増加を指す。この研究のユニークな強みは、前臨床プロトコルと臨床プロトコルの統合にあり、実験室での研究と患者ケアの間のギャップを埋める包括的なフレームワークを提供します。この作業では、動物モデルとヒトモデルの両方で標準化された方法論を採用することで、GLED光線療法の効果を評価する際の一貫性と比較可能性を確保しています。前臨床モデルを含めることで、上行および下降する疼痛経路の調節など、GLED誘発性鎮痛の根底にあるメカニズムの制御された調査が可能になります。これらの知見は、時間的総和(TS)と条件的疼痛調節(CPM)の評価が患者の疼痛調節に関する貴重なメカニズムの洞察を提供するヒト研究に直接変換できます。
光神経調節(PNM)の有望な利点に基づいて、いくつかの研究は、GLED誘発性鎮痛の根底にあるメカニズムの特徴付けに焦点を当てています。前臨床モデルでは、動物は通常、1日あたり8時間100ルクスのGLEDに曝露されました13,20,21,33。しかし、過敏症の逆転は疼痛モデルによって異なり、異なる曝露時間が必要でした。例えば、HIV誘発性ニューロパチーのモデルでは、機械的過敏症は曝露の3日後に逆転したが、熱痛覚過敏の回復には5日を要した13。同様に、炎症性疼痛モデルにおける熱痛覚過敏は、曝露の2日後に逆転した22。これらの結果は、最適な抗侵害受容効果を達成するための用量と期間の重要性を示す私たちの調査結果と一致しています。特に、ここで説明する研究は、GLED 強度と鎮痛剤との関係を強調することにより、この以前の研究を拡張し、強度が高いほどより強い効果を誘発します。これは、慢性狭窄損傷を受けた動物で特に顕著であり、3日後に改善を示したが、強度の増加(200ルクス)と1日の曝露時間の短縮(4時間)が行われた23。部分的な坐骨神経結紮モデルでは、2時間の曝露のわずか1日後に利益が観察され、GLED療法が短い曝露時間でも効果的であることを示唆しています24。これらの慢性疼痛モデルとは対照的に、変形性膝関節症モデルは、機械的過敏症を逆転させるために1日8時間で12日間の曝露を必要とした36。最後に、術後疼痛に関する1つの研究では、GLED曝露期間と抗侵害受容との間に正の相関関係が示され、曝露日数が鎮痛効果に有意な影響を与えたことが示された21。これらの知見は、曝露時間を特定の病理に合わせて調整することの重要性を強調しており、異なる感覚障害間でのPNM効果の一貫した比較を可能にするための標準化されたプロトコルの必要性を強調しています。
ヒトでは、GLED療法は、片頭痛、線維筋痛症、術後の痛みなどの症状で鎮痛効果を示しています17,34,35,36。慢性疾患に関する臨床試験では、長期の曝露が必要であることが示唆されており、患者は通常、毎日2週間の曝露(1日あたり1〜2時間)後に痛みの緩和を報告しています。逆に、緑色光フィルターメガネの使用などの短期間の曝露では、歯科手術後わずか15分以内に鎮痛効果が示されました36。これは、急性疼痛状態におけるGLEDの急速な有効性と、慢性疼痛管理における持続的な利益を強調している文献結果と一致しています。また、この研究は、TS評価とCPM評価を統合して、上行および下降する疼痛経路の活動を調査するという点で、以前の研究とは異なります。これらの標準化された評価により、GLEDが痛みの知覚をどのように調節するかについてのメカニズム的な理解を提供することができますが、これは以前の臨床研究ではしばしば欠けていた特徴です。前臨床研究では下行性疼痛経路の関与が指摘されていますが、前臨床と臨床の両方の環境でこれらの知見を確認するには、さらなる研究が必要です。臨床試験はCPM評価に頼ることができるが、前臨床試験では、侵害受容の下降制御を下行性疼痛抑制の行動的読み出しとして分析することもできる37,38,39,40。疼痛経路活動の一貫した標準化された測定は、GLED 誘発性鎮痛の根本的なメカニズムを解明するために不可欠です。
このプロトコルには、いくつかの重要なステップがあります。まず、正確な光露光設定は、動物と人間の被験者の両方にとって非常に重要です。光強度の変動は感覚閾値や鎮痛効果に大きな影響を与える可能性があるため、実験を開始する前にGLED曝露強度が適切に最適化され、ルクスメーターを使用して検証されていることを確認することが重要です。さらに、GLED波長が治療効果の指定された範囲内に収まるように、分光計を使用して光スペクトルを検証する必要があります。外部光源を排除して露光領域を分離することは、光の干渉がないことを確認し、すべての被写体で均一な露出を維持するために重要です。さらに、治療は間接的な視覚曝露に依存しているため、光源を必要としない活動に従事させることにより、曝露時間中に被験者を目覚めさせ続けることが最も重要です。TSおよびCPMテストでは、信頼性の高い測定を確保するために、フォンフレイフィラメント(すでに曲がったものの使用は避けてください)やアルゴメーターなどのデバイスの適切なキャリブレーションとサニタイズが不可欠です。テスト中の環境ノイズを最小限に抑えることで、注意散漫に対処することが重要です。さらに、動物被験者の慎重な取り扱いと順応は、ストレスとばらつきを減らし、結果の再現性を高めるのに役立ちます。同様に、無菌または不慣れな実験室環境は威圧的でストレスの多い可能性があり、感覚処理を変化させ、痛みの評価の精度に影響を与える可能性があるため、人間の参加者にとって快適で快適な環境を作り出すことが重要です。落ち着きのある協力的な雰囲気を確保することで、参加者は安心し、結果の信頼性を向上させることができます。被験者に、最初の習熟段階と2番目のテスト段階の違いを明確に説明し、それに焦点を当てる必要があります。最後に、評価間で疼痛評価尺度の一貫性を維持することが不可欠である。同じ研究内でCPMの1〜100のスケールとTSの1〜10のスケールなど、異なるスケールを使用すると、参加者を混乱させ、評価が不正確または信頼性が低下する可能性があります。標準化されたアプローチにより、参加者の明確さと研究間での結果の比較可能性が保証されます。
以前の研究方法には、特に曝露セッション中に毎日 2 時間所定の位置に留まらなければならない臨床被験者に必要な時間コミットメントに関して、一定の制限があります。この制約は、代替の曝露方法をさらに調査する必要性を強調しています。被験者を特定時間や場所に限定することなくGLED療法を提供するポータブルデバイスを開発することで、参加者のコンプライアンスを向上させるだけでなく、より大規模な研究も促進できる可能性があります。このようなイノベーションにより、グリーンライト療法の長期的な有効性と安全性について、より包括的な調査が可能になります。
要約すると、このレポートで概説されている詳細なプロトコルは、GLEDが疼痛感受性に及ぼす影響を調査するためのフレームワークを提供します。GLED誘発性鎮痛薬を検証し、この治療法をより広範な臨床応用に最適化するためには、継続的な研究と臨床試験が重要です。
開示事項
イブラヒム博士は、アリゾナ大学に対してルクソン・セラピューティクス社に対する外部からの関心を明らかにしました。この利益から生じる利益相反は、アリゾナ大学の方針に従ってアリゾナ大学によって管理されています。他のすべての著者には、報告すべき利益相反はありません。原稿の著者は、報酬、払い戻し、または謝礼を他の方法で受け取っていません。著者らは、この研究に関連するベンダーや製薬会社と提携していません。これらの研究、原稿、または要約はいずれも以前に発表されておらず、他のジャーナルによる出版が検討されていません。
謝辞
この研究は、アリゾナ大学疼痛依存症総合センター(M.M.I.、L.F.M.)、アリゾナ大学麻酔科(L.F.M.)、アリゾナ大学ツーソン医科大学の医学者トレーニングプログラム(MSTP)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 24 h Mechanical mini timer for LED strips | bn-link | BND-60/U47 | https://www.bn-link.com/products/bn-link-indoor-24-hour-mechanical-outlet-timer-3-prong-2-pack?variant=42704897245237¤cy= USD&utm_medium=product_sync& utm_source=google&utm_content= sag_organic& utm_campaign= sag_organic&gad_source=1& gclid=Cj0KCQjwurS3BhCGARI sADdUH50dy8sYj4Ku2ZmM14-3Yp3iajSY 4TgRze8UvSuyhq81-h 1E6GChOXgaAhwYEALw_wcB |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-GR | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips Green Strip Lighting for all exposure rooms 120V AC, 60Hz |
| AC 5050 SMD LED Tape Rope Strip Lighting | LED Supply Co | LS-AC50-WH | https://www.ledsupply.com/led-strips/ac-power-5050-led-strips White Strip Lighting for all exposure rooms 120V AC, 60Hz |
| Allodynia Software | National Instruments, LabView 2015 | https://www.ni.com/en-us/shop/product/labview.html | |
| Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid | Amazon Basics Store | Amazon.com: Amazon Basics Lightweight Super Soft Easy Care Microfiber 4-Piece Bed Sheet Set with 14-Inch Deep Pockets, Queen, Black, Solid : Amazon Basics: Home & Kitchen | |
| Computerized Pressure Pain Algometer | Medoc advanced medical systems | ID 00186 | https://www.medoc-web.com/algomed |
| Digital Lux Meter | Edmund Optics | 52270 | https://www.edmundoptics.com/ |
| Elevated metal mesh stand for Von Frey | Bioseb | BIO-STD2-EVF | https://www.bioseb.com/en/pain-mechanical-allodynia_hyperalgesia/1689-elevated-metal_mesh-stand-30-cm-height-to-fit-up_to-2-pvf-cages.html |
| Fisherbrand Thermometers | Fischer Scientific | 13-201-577 | https://www.fishersci.com/shop/products/fisherbrand-10-30-ground-joint-thermometers-6/13201927 |
| Medline Autoclavable Plastic Washbasins | Truway Health | 42141606 | https://truwayhealth.com/medline-autoclavable-plastic-washbasins/?cmp_id=21122060336&adg_id= &kwd=&device=c& gad_source=1&gclid= CjwKCAjw0aS3BhA3EiwAKaD2ZTHY8_ 7W__ gXC7Wf3Kv3jJa6KQrNI-4JrdYqKM9IO v8moeW6ylEpzRoCnZ8QAvD_BwE |
| Modular holder cages for rats and mice | Bioseb | BIO-PVF | https://bioseb.com/en/pain-mechanical-allodynia-hyperalgesia/1206-modular-holder-cages-for-rats-and-mice.html |
| Plantar Test for Thermal Stimulation - Hargreaves Apparatus | Ugo Basile | 37570 | https://ugobasile.com/products/categories/pain-and-inflammation/plantar-test-for-thermal-stimulation includes semi-transparent glass panel and individual animal enclosures for 6 rats/12 mice |
| Scotch 700 Electrical Tape, 3/4 in. x 66 ft. x 0.007 in. | 3M | https://www.3m.com/3M/en_US/p/d/cbgnawus1596/ | |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-99 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| Touch Test Sensory Evaluators (von Frey Filaments) | North Coast Medical and Rehabilitation Products | NC12775-20 | https://www.ncmedical.com/products/touch-test-sensory-evaluators_1278.html |
| TRINITY EcoStorage 5-Tier , 48 x 24 x 72, Commercial Wire Shelving | Trinity | 952471 | https://trinityii.com/ecostorage-5-tier-48x24x72-wire-shelving-nsf-with-wheels-chrome/ |
参考文献
- Alorfi, N. M. Pharmacological methods of Narrative review of medication used. Int J Gen Med. 16, 3247-3256 (2023).
- Cherny, N., et al. Strategies to manage the adverse effects of oral morphine: an evidence-based report. J Clin Oncol. 19 (9), 2542-2554 (2001).
- Hanks, G. W., et al. Morphine in cancer pain: modes of administration. Expert Working Group of the European Association for Palliative Care. BMJ. 312 (7034), 823-826 (1996).
- de Freitas, L. F., Hamblin, M. R. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 22 (3), 7000417 (2016).
- Pathak, M. A., Fitzpatrick, T. B. The evolution of photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J Photochem Photobiol B. 14 (1), 3-22 (1992).
- Kemper, K. J. ."Let there be light." Research on phototherapy, light therapy, and photobiomodulation for healing - Alternative therapy becomes mainstream. Complement Ther Med. 41, A1-A6 (2018).
- Olesen, J., et al. Headache Classification Committee of the International Headache Society(IHS), The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 38 (1), 1-211 (2018).
- Santiago, R., Gomes, S., Ozsarfati, J., Zitney, M. Photobiomodulation for modulation of neuropathic pain and improvement of scar tissue. Scars Burn Heal. 8, 20595131221134052 (2022).
- González-Muñoz, A., et al. Efficacy of photobiomodulation therapy in the treatment of pain and inflammation: A literature review. Healthcare (Basel). 11 (7), 938 (2023).
- Figueiro, M. G., et al. Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer's disease and related dementia living in long-term care facilities. Clin Interv Aging. 9, 1527-1537 (2014).
- Eastman, C. I., Young, M. A., Fogg, L. F., Liu, L., Meaden, P. M. Bright light treatment of winter depression: A placebo-controlled trial. Arch Gen Psychiatry. 55 (10), 883-889 (1998).
- Martin, L. F., et al. Evaluation of green light exposure on headache frequency and quality of life in migraine patients: A preliminary one-way cross-over clinical trial. Cephalalgia. 41 (2), 135-147 (2021).
- Martin, L. F., et al. light antinociceptive and reversal of thermal and mechanical hypersensitivity effects rely on endogenous opioid system stimulation. J Pain. 22 (12), 1646-1656 (2021).
- Nelli, A., Wright, M. C., Gulur, P. Green light-based analgesia - novel non-pharmacological approach to fibromyalgia pain: A pilot study. Pain Physician. 26 (4), 403-410 (2023).
- Martin, L., et al. light exposure improves pain and quality of life in fibromyalgia patients: A preliminary one-way crossover clinical trial. Pain Med. 22 (1), 118-130 (2021).
- Qaiser, H., Uzair, M., Arshad, M., Zafar, A., Bashir, S. Evaluating the potential of green light exposure on nociception-A mini review. CNS Neurol Disord Drug Targets. 23 (6), 675-679 (2024).
- Lipton, R. B., et al. Narrow band green light effects on headache, photophobia, sleep, and anxiety among migraine patients: an open-label study conducted online using daily headache diary. Front Neurol. 14, 1282236 (2023).
- Posternack, C., Kupchak, P., Capriolo, A. I., Katz, B. J. Targeting the intrinsically photosensitive retinal ganglion cell to reduce headache pain and light sensitivity in migraine: A randomized double-blind trial. J Clin Neurosci. 113, 22-31 (2023).
- Noseda, R., et al. Migraine photophobia originating in cone-driven retinal pathways. Brain. 139 (7), 1971-1986 (2016).
- Ibrahim, M. M., et al. Long-lasting antinociceptive effects of green light in acute and chronic pain in rats. Pain. 158 (2), 347-360 (2017).
- Martin, L. F., et al. light exposure elicits anti-inflammation, endogenous opioid release and dampens synaptic potentiation to relieve post-surgical pain. J Pain. 24 (3), 509-529 (2023).
- Tang, Y. L., et al. Green light analgesia in mice is mediated by visual activation of enkephalinergic neurons in the ventrolateral geniculate nucleus. Sci Transl Med. 14 (674), eabq6474 (2022).
- Cao, P., et al. light induces antinociception via visual-somatosensory circuits. Cell Rep. 42 (4), 112290 (2023).
- Wu, X. Q., et al. Glutamatergic and GABAergic neurons in the vLGN mediate the nociceptive effects of green and red light on neuropathic pain. Neurobiol Dis. 183, 106164 (2023).
- Sprenger, C., Eichler, I. C., Eichler, L., Zöllner, C., Büchel, C. Altered signaling in the descending pain-modulatory system after short-term infusion of the µ-opioid agonist remifentanil. J Neurosci. 38 (10), 2454-2470 (2018).
- Zahn, P. K., Brennan, T. J. Primary and secondary hyperalgesia in a rat model for human postoperative pain. Anesthesiology. 90 (3), 863-872 (1999).
- Brennan, T. J., Zahn, P. K., Pogatzki-Zahn, E. M. Mechanisms of incisional pain. Anesthesiol Clin North Am. 23 (1), 1-20 (2005).
- Martin, L., et al. Conotoxin contulakin-G engages a neurotensin receptor 2/R-type calcium channel (Cav2.3) pathway to mediate spinal antinociception. Pain. 163 (9), 1751-1762 (2022).
- Korah, H. E., et al. Partial sciatic nerve ligation: A mouse model of chronic neuropathic pain to study the antinociceptive effect of novel therapies. J VIs Exp. (188), e64555 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53 (1), 55-63 (1994).
- Lockwood, S., Dickenson, A. H. What goes up must come down: insights from studies on descending controls acting on spinal pain processing. J Neural Transm (Vienna). 127 (4), 541-549 (2020).
- Staud, R., Robinson, M. E., Price, D. D. Temporal summation of second pain and its maintenance are useful for characterizing widespread central sensitization of fibromyalgia patients. J Pain. 8 (11), 893-901 (2007).
- Ventura, L., et al. light exposure reduces primary hyperalgesia and proinflammatory cytokines in a rodent model of knee osteoarthritis: Shedding light on sex differences. Biomedicines. 12 (9), 2005 (2024).
- Cheng, K., Martin, L. F., Slepian, M. J., Patwardhan, A. M., Ibrahim, M. M. Mechanisms and pathways of pain photobiomodulation: A narrative review. J Pain. 22 (7), 763-777 (2021).
- Cheng, K., Martin, L. F., Calligaro, H., Patwardhan, A., Ibrahim, M. M. Case report: Green light exposure relieves chronic headache pain in a colorblind patient. Clin Med Insights Case Rep. 15, 11795476221125164 (2022).
- Takemura, Y., et al. Effects of green color exposure on stress, anxiety, and pain during peripheral intravenous cannulation in dental patients requiring sedation. Int J Environ Res Public Health. 18 (11), 5939 (2021).
- Berkley, K. J., Hubscher, C. H. Are there separate central nervous system pathways for touch and pain. Nat Med. 1 (8), 766-773 (1995).
- Bannister, K., Kucharczyk, M. W., Graven-Nielsen, T., Porreca, F. Introducing descending control of nociception: a measure of diffuse noxious inhibitory controls in conscious animals. Pain. 162 (7), 1957-1959 (2021).
- Millan, M. J. Descending control of pain. Prog Neurobiol. 66 (6), 355-474 (2002).
- Ossipov, M. H., Morimura, K., Porreca, F. Descending pain modulation and chronification of pain. Curr Opin Support Palliat Care. 8 (2), 143-151 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved