Method Article
体外式膜型人工肺が凝固系に及ぼす影響
* これらの著者は同等に貢献しました
要約
ヒツジにおける長期覚醒体外式膜型人工肺(ECMO)モデルを確立するためのプロトコルを提示します。ECMOモデル中の凝固システムの管理と評価には、特別な注意が払われています。
要約
この研究は、ヒツジモデルの凝固系に対する長期覚醒体外式膜型人工肺(ECMO)の影響を調査することを目的としています。この研究には、各グループに5頭の羊を含む合計10頭の健康な羊が含まれていました。静脈動脈ECMO(V-A ECMO)群では、右頸動脈と右外頸静脈にカニューレ挿入を行った。静脈静脈ECMO(V-V ECMO)グループでは、デュアルルーメンカテーテルを使用して右外頸静脈に挿入しました。ECMOを開始した後、羊は麻酔から回復し、7日間起きていました。目標活性化凝固時間(ACT)の目標は220〜250秒に設定されました。どちらのグループでも、実際のACTは約250秒変動し、ヘパリンの用量は徐々に増加し、実験の終わりにはほぼ60IU / kg / minに達しました。さらに、活性化された部分トロンボプラスチン時間(APTT)とトロンビン時間(TT)の値は、同じ用量のヘパリンを投与されたにもかかわらず、V-A ECMOグループでV-V ECMOグループと比較して有意に高かった。.臨床検査の結果は正常かつ妥当な範囲内で変動しましたが、研究の終わりに腎臓の梗塞病巣が両方のグループで観察されました。
概要
体外式膜型人工肺(ECMO)は、重症患者に心肺サポートを提供する救命介入として機能します。これは、静脈動脈ECMO(V-A ECMO)と静脈静脈ECMO(V-V ECMO)の2つの主要な形態に分類されます1,2。V-A ECMOは循環不全を経験している患者に採用されていますが、V-V ECMOは呼吸不全であるが重度の心血管機能障害がない患者に好まれます3,4。
血栓症と出血は、ECMO患者によく見られる合併症です5。ECMO回路は血液を人工表面にさらし、複雑な凝固反応を開始します6。これらのプロセスは、内皮の損傷や微小循環障害を引き起こし、その後の重要な臓器の機能不全を引き起こす可能性があります7,8。したがって、ECMO患者にとって効果的な全身抗凝固療法の管理が重要であると考えられています。それにもかかわらず、さまざまなECMO関連の臨床現場で抗凝固戦略を導くための証拠は依然として不足しています。
安定したECMO動物モデルを確立することで、ECMOが体に与える影響についての洞察を得ることができ、ECMO管理戦略の最適化、ECMO関連合併症の軽減、臨床診療における患者の転帰の改善に大きく貢献することができます。ヒツジやブタなどの大型動物は、その生理学的パラメータがヒトのものと非常によく似ているため、ECMOモデルを確立するための主要な選択肢である9,10。しかし、従来の大型動物ECMOモデルはメンテナンス時間が24時間未満であったため、ECMOが凝固系に与える影響を包括的に評価することは困難であった11。したがって、ECMOの病態生理学的メカニズムを徹底的に探求するために、長期的なECMO大型動物モデルを確立する必要があります。長期の大動物モデルを利用して、ECMOが凝固系に及ぼす影響を調べることで、臨床診療のためのより強固なエビデンスを得ることができます。
この研究は、健康なヒツジにおける長期 (7 日間) 覚醒 V-A および V-V ECMO モデルを確立することを目的としています。モデル全体の確立と評価の中心的な焦点は、抗凝固療法の管理です。
プロトコル
この実験プロトコルは、福和病院の動物施設管理および使用委員会(番号0101-2-20-HX(X))から承認を受けました。すべての手順は、国立衛生研究所の実験動物の使用とケアに関するガイドに概説されているガイドラインに準拠しています。実験は、福偉病院の動物実験センターである北京心臓血管インプラント材料の前臨床研究評価の北京重点研究所で行われました(登録番号。CNAS LA0009)。本研究では、福井病院動物実験センターで必要な検疫基準を満たした健康なヒツジが利用されました。さらに、この研究は、Animal Research: Reporting of In Vivo Experimentsガイドラインに従っています。体重範囲が50〜65 kg、年齢が12〜24か月のオスのスモールテールハンヒツジ( 材料表を参照)は、手術前の少なくとも1週間、食物と水に自由にアクセスできる特定の病原体のない環境で飼育されました。ヒツジは無作為に 2 つのグループに割り当てられ、それぞれが 5 人で構成されていました: 静脈動脈 ECMO (V-A ECMO) グループと静脈静脈 ECMO (V-V ECMO) グループ。健康なヒツジの選択は、ECMOサポートが生物に及ぼす影響を正確に評価する必要性によって正当化されました。この試験で使用された機器と試薬は、 材料表に記載されています。
1.動物の調理
- 外科的処置の前に、健康な成羊を48時間絶食させ、12時間水分を奪います。
- 手術前に、手術器具とECMOパラメータを滅菌します。手術チームのすべてのメンバーに、手術用キャップ、使い捨てフェイスマスク、清潔な手術服、靴カバー、滅菌手術服、滅菌手袋など、個人用保護具を確実に提供します。
- プロポフォール注射(5 mg / kg)を耳介静脈から投与します。.前述のように、血圧計カフを大腿部に固定し、4つの手足すべてに心電図リードを配置します。血圧カフとECGリード線をECGおよび非侵襲的血圧測定12用の医療モニターに接続します。
- シングルルーメンの気管内チューブを気管に挿入し、ボリュームコントロールモードでチューブを人工呼吸器に接続します。パラメータを次のように設定します:一回換気量:8-10 mL / kg、呼吸数:12-20 / min、吸気酸素(FiO2)の初期画分:60%。
- 麻酔維持のために、静脈内麻酔(プロポフォール、8-10 mg / kg / h)と吸入麻酔(イソフルラン2%-3%)の組み合わせを投与します。術中鎮痛のために間欠的なフルルビプロフェン(1〜2 mg / kg)を静脈内投与します。.
- 羊を手術台に置き、柔軟な布ベルトで手足を固定します。左頸動脈と頸静脈を分離し、シングルルーメン中心静脈カテーテル(18 Fr)とトリプルルーメン中心静脈カテーテル(7 Fr)をそれぞれ挿入します。左頸動脈の18Gカテーテルをメディカルモニターに接続し、血行動態をモニタリングします。左頸静脈にある7Frトリプルルーメン中心静脈カテーテルを輸液ポンプとメディカルモニターに接続し、静脈内輸液投与、薬物注射、中心静脈圧モニタリングを同時に行うことができます。三方活栓を使用してすべての接続を行います。三方活栓を介して静脈血または動脈血サンプル を 採取します。
注:カテーテル挿入後、カテーテルと血管を2-0外科用縫合糸で結紮します。 - 右頸静脈と静脈を露出させます。右頸静脈を通るヘパリン(120 IU / kg)のボーラスで全身性抗凝固療法を達成します。.
注:カニューレ挿入の目標活性化凝固時間(ACT)は250秒を超えています。
2.カニューレ挿入
- V-A ECMO回路の確立:動脈カテーテル(18 Fr)を右頸動脈から10〜15 cmの深さまで挿入し、静脈カテーテル(24 Fr)を右外頸静脈から右心房に挿入します。
- V-V ECMO回路の確立:右外頸静脈を露出させ、右外頸静脈からデュアルルーメンカテーテル(23 Fr)を挿入します。
注:この手順では、羊の血圧と心拍数をベースライン値の±20%以内に維持します。動脈二酸化炭素(PaCO2)の分圧を35〜40mmHgに保ちます。呼気終末二酸化炭素(EtCO2)の分圧が35〜45 mmHgの間にあることを確認します。羊の血圧と心拍数の変動に遭遇した場合は、麻酔の深さを調整します。これが効果がないことが判明した場合、または緊急時に、血管作用薬の使用を検討してください。人工呼吸器のパラメータを調整し、主に一回換気量と呼吸数に焦点を当てて、PaCO2とEtCO2を正常値内に維持します。 - V-V ECMOでは、カテーテルの先端を右心房(RA)に通し、下大静脈(IVC)内に配置します。デュアルルーメンカテーテルの流出ポートを三尖弁に向けます(超音波アシストで位置を確認します)。
注:カテーテル挿入後、カテーテルと血管を2-0外科用縫合糸で結紮します。4-0外科用縫合糸を使用して皮膚切開を閉じます。
3. ECMOの開始
- 製造元の指示に従って、すべてのECMOデバイスを接続します( 資料の表を参照)。漏れがないことを確認してください。
注:接続中は無菌原則に従ってください。 - プライミング溶液は、生理食塩水(1000mL)と2000IUのヘパリンで構成されています。ECMO回路にプライミング溶液を手動で注入し、回路内に気泡がないことを確認した後、プライミング用の遠心ポンプを始動します(1000-1500 rpm)。
- プライミングが完了したら、遠心ポンプをオフにしてください。流入カテーテルを遠心ポンプの入口に接続し、流出カテーテルを酸素供給器の出口に接続します。三方活栓を使用してすべての接続を行います。三方活栓を介して接続部で空気を排出します。酸素源をECMOシステムに接続し、正しい酸素の流れを確保します。次に、ECMOラン用の遠心ポンプを始動します。ポンプ速度を3000rpmで初期ポンプ流量を2.0L / minに設定します。
- ECMO回路チューブラインを羊の首に半周して、ずれやねじれを防ぎます。
4. 術後管理とモニタリング
- 手術終了後、羊をメタボリックケージに移し、羊を適切に拘束します。
注意: カニューレのずれやねじれを防ぐことに特に重点を置いて、羊の頭と肩を固定します。麻酔の深さを徐々に減らします。防護服(滅菌服、手袋、マスク、帽子)を着用して、術後看護チームのメンバーの個人保護を確保します。 - 安定した呼吸と血液ガス分析の結果を確保する場合は、気管内チューブを取り外してください。
- 手術後最初の 24 時間で、フルルビプロフェン (1-2 mg/kg) とデクスメデトミジン (0.2-0.3 μg/kg·h) を静脈内投与して、鎮静と痛みの緩和を図ります。
注:最初の24時間後、術後の痛みにより羊に興奮と血圧の変動がある場合は、鎮静薬と鎮痛薬を検討してください。 - モニタリングケージ内では、羊が一定の範囲内で自由に動き回り、適切な量の飼料と水に無制限にアクセスできることを確認します。
- 基本的なバイタルサイン(心拍数と動脈血圧)とECMO油圧パラメータ(ポンプ流量、ポンプ速度、ポンプ前圧力、ポンプ後圧力、酸素供給後圧力)を継続的にリアルタイムでチェックします。
注:ECMO管理の目標パラメータを設定します(ポンプ流量:2.0-2.5 L / min、ポンプ速度:3000-3500 rpm、酸素流量:1.0-1.5 L / min、FiO2は50%-80%)。血液ガスの結果に応じて、上記のパラメータを調整します。 - 6時間ごとに血液ガスとACTを測定し、血球数、血液化学、凝固検査を毎日監視します。凝固指標に基づいて抗凝固戦略を調整します。
注:目標ACT目標:220-250秒。 - 中心静脈圧(CVP)を5〜12 cm H2O.に維持するために、体液バランスに基づいて静脈内注入を調整します。感染予防のために、セフロキシムナトリウム(1.5 g、iv、b.i.d.)を毎日投与します。毎日切開消毒を行い、感染や出血の兆候がないか注意深く監視してください。
5.安楽死
- 7日間の実験期間の後、ECMO回路を取り外します。
- プロポフォール (100 mg/kg) による鎮静下での安楽死のために塩化カリウム (100 mg/kg) の静脈内注射を投与します。
注:安楽死後、主要な臓器(心臓、腎臓、肺、肝臓、脳、腸)が収集され、梗塞、出血、または明白な損傷の存在について視覚的に確認されました。すべての臓器損傷は詳細に記録されました。次いで、臓器を小片に切断し、4%ホルムアルデヒドに固定し、パラフィンを包埋し、ヘマトキシリン−エオシン(HE)染色のために4μm切片に分割した13。光学顕微鏡下でHE切片の組織学的検査を、少なくとも2人の病理医が独立して実施します。
結果
実験全体を通じて、各グループに5頭ずつ、合計10頭のヒツジが評価されました(表1)。ECMOの開始後、すべての羊が麻酔から回復し、7日間起きていました。両群ともECMO流量は1.8L/minを超えました。V-V ECMOグループでは1.8 L/min前後で流量が変動し、V-A ECMOグループでは2.3 L/minから1.8 L/minの範囲でした(図1A)。各羊のバイタルサインは安定していました。血中乳酸濃度は、両群とも覚醒後60時間から180時間の間に1mmol/Lを下回った(図1B)。7日間を通じて、ACTレベルは約220〜250秒を維持することを目指し、実際のACTは約250秒変動し(図1C)、ヘパリンの用量は徐々に増加し、実験終了時にはほぼ60IU / kg /分に達しました(図1D)。
両群のプロトロンビン時間(PT)は15秒から32秒の範囲であった(図2A)。V-V ECMOグループの活性化部分トロンボプラスチン時間(APTT)とトロンビン時間(TT)は、実験全体の特定の時点でV-A ECMOグループのものよりも低かった(APTTの統計的に有意な差)(図2B、C)。各グループの国際正規化比率は、約1.5で変動しました(図2D)。フィブリノーゲン、フィブリン分解産物、Dダイマー、および血小板は、2つのグループ間で同様に変動し、正常範囲内に留まりました(図3)。
両群のクレアチニンと血中尿素窒素の血中濃度は、実験全体を通じて正常範囲内にとどまり、両グループ間に統計的な差はありませんでした(図4)。さらに、両群の体液バランスは0付近で最小の変動を示し、両群のCVP測定値は研究全体を通じて正常範囲内にとどまっていることが観察されました(図5)。実験の終わりに、実験室の結果が正常かつ妥当な範囲内で変動したにもかかわらず、両群のヒツジは腎臓に梗塞病巣を示しました(図6 および 表1)。
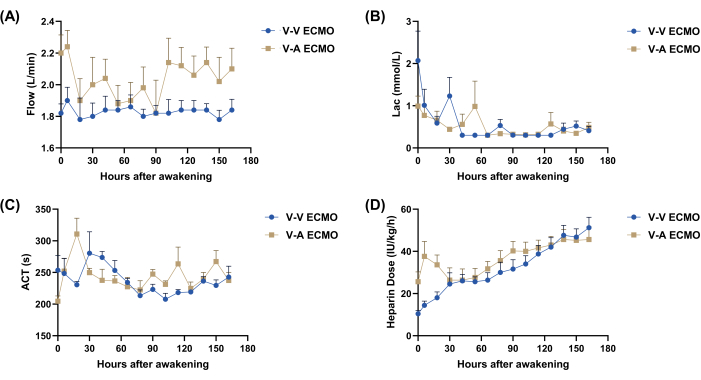
図1:基本的なパラメータ監視。 (A)ECMOフロー。(B)ラック。(C)行為 (D)ヘパリン投与量。ラック、乳酸;ACT、活性化凝固時間;V-V ECMO、静脈体外膜型人工肺;V-A ECMO、静脈動脈体外式膜酸素化。値:平均±SEMこの 図の拡大版を表示するには、ここをクリックしてください。

図2:凝固機能の結果 (A) PT. (B) APTT.(C)TTです。(D)インドルピー。PT、プロトロンビン時間;APTT、活性化部分トロンボプラスチン時間;TT、トロンビン時間;INR、国際正規化比率。V-V ECMO、静脈体外膜型人工肺;V-A ECMO、静脈動脈体外式膜酸素化。対応のない t検定 を実行して、各時点で2つのグループを比較しました。値:SEM±平均。*P < 0.05; P > 0.05 は表示されません。 この図の拡大版を表示するには、ここをクリックしてください。

図3:両群のフィブリノーゲン、フィブリン分解産物、D-ダイマー、および血小板数。(B)FDP。(c)Dダイマー。(D)PLT。FIB、フィブリノーゲン;FDP、フィブリン分解生成物;PLT、血小板数;V-V ECMO、静脈体外膜型人工肺;V-A ECMO、静脈動脈体外式膜酸素化。対応のないt検定を実行して、各時点で2つのグループを比較しました。値:SEM±平均。P > 0.05 は表示されませんでした。この図の拡大版を表示するには、ここをクリックしてください。

図4:腎機能モニタリング (A)クレアチニン。(B)パン。V-V ECMO、静脈体外膜型人工肺;V-A ECMO、静脈動脈体外式膜酸素化;BUN、血中尿素窒素。対応のない t検定 を実行して、各時点で2つのグループを比較しました。値:SEM±平均。 P > 0.05 は表示されませんでした。 この図の拡大版を表示するには、ここをクリックしてください。
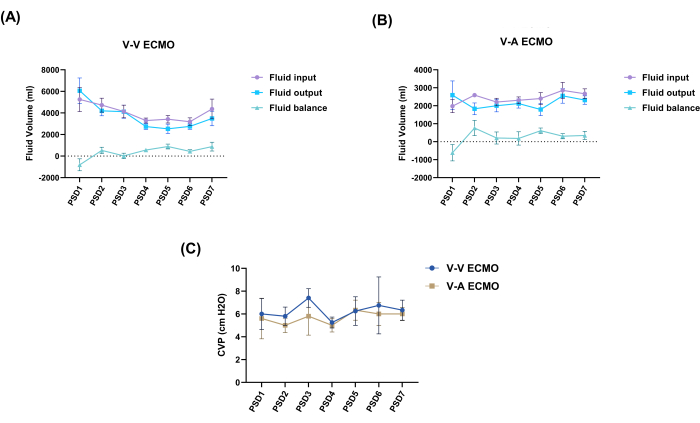
図5:フルードバランスとCVP値の動的変化 (A)V-V ECMOグループの日々のフルードバランスの変化。(B)V-A ECMOグループの日々の体液バランスの変化。(C)CVPモニタリング。対応のない t検定 を実施して、各時点での2つのグループのCVPを比較しました。値:SEM±平均。 P > 0.05 は表示されませんでした。CVP、中心静脈圧;V-V ECMO、静脈体外膜型人工肺;V-A ECMO、静脈動脈体外式膜酸素化;PSD、手術後の日。 この図の拡大版を表示するには、ここをクリックしてください。

図6:両群における腎臓の解剖学的構造とヘマトキシリン-エオシン染色。 スケールバー:400μm;インセット:100μm。V-V ECMO、静脈体外膜型人工肺;V-A ECMO、静脈動脈体外式膜酸素化。 この図の拡大版を表示するには、ここをクリックしてください。
| 羊の数 | 性 | 重量(kg) | 腎臓病理学的結果* |
| VA1の | 男性 | 58 | 何一つ |
| VA2の | 男性 | 54 | 何一つ |
| VA3の | 男性 | 55 | 限局性小梗塞 |
| VA4の | 男性 | 56 | 限局性小梗塞 |
| VA5の | 男性 | 57 | 限局性小梗塞 |
| VV1 | 男性 | 56 | 何一つ |
| VV2の | 男性 | 60 | 何一つ |
| VV3の | 男性 | 63 | 何一つ |
| VV4の | 男性 | 59 | 何一つ |
| VV5の | 男性 | 60 | 限局性小梗塞 |
| *腎病理診断は、客観的な評価を得るために、2人の独立した病理医によって行われました。 | |||
表1:2つのグループの腎臓病理学的結果。
ディスカッション
この研究では、ヒツジのV-VおよびV-A ECMOの堅牢で長期の生存モデルを確立するための手順を概説します。生き残ったすべての動物は安定したバイタルサインを示し、重度の出血や凝固イベントは発生しませんでした。ECMOの流れと酸素化性能は安定しており、大きな病理学的損傷は観察されませんでした。この研究は、抗凝固療法に関する詳細な情報を提供します。
抗凝固療法は、ECMO周術期ケアにおいて重要な役割を果たします。当初、以前の研究に基づいて、目標ACTは180-220秒14,15,16,17に設定されました。しかし、実験前の段階では、酸素供給器でのフィブリン沈着と血栓症が観察され(材料表参照)、ヒツジにはより高い抗凝固レベルが必要であることが示された。重大な出血の兆候がなく、血小板数が比較的安定しているにもかかわらず、目標ACTは220〜250秒に調整されました。抗凝固ターゲットのこの調整は、ヒツジと人間の血液学的違いを浮き彫りにしています。この調整により、酸素供給器内のフィブリン沈着と血栓形成が減少し、安定した酸素供給器の性能が得られました。
実験全体を通じて、ヒツジの血小板数には傾向が観察され、最初の減少とその後の増加が特徴でした。驚くべきことに、全血輸血や血小板輸血を受けなくても、血小板数は回復し、7日目までに ベースラインレベルを超えました。持続ヘパリン注入を受けた健康なヒツジにおける血小板数の最初の減少は、ヘパリン誘発性血小板減少症に起因する可能性がある18。その後の増加は、ヒツジの凝固系と造血系内の代償メカニズムによって解明できます。
さらに、健康なヒツジに同用量のヘパリンを投与した場合、APTTおよびTT値は、V-V ECMOと比較してV-A ECMOで著しく高かった。この観察結果は、V-A ECMOがヘパリン抗凝固療法後の凝固パラメータに対してより応答性が高いことを示唆しています。以前のコホート研究では、V-A ECMOサポートを受けている患者は、同様のAPTTレベルを達成するために、V-V ECMOサポートを受けている患者と比較して、より少ない用量のヘパリンが必要であることが指摘されました。さらに、V-A ECMO患者は凝固因子の消費量の増加を示しました19。これらの知見は、これら 2 つの ECMO モダリティ間の凝固管理において明確な考慮事項が必要であることを総合的に示しています。
ほとんどすべての臨床検査結果は正常で妥当な範囲内で変動していましたが、実験の終了時に両群の腎臓に梗塞病巣が特定されました。このことは、重要な臓器の灌流と凝固が依然としてECMO管理の焦点であることを強調しており、臓器の状態を評価するために臨床検査だけでは当てにできないことを強調しています。
このモデルの管理中、ヘパリンの用量は徐々に増加し、長期的なECMO管理のための動的な抗凝固療法を示しています。ただし、正常な羊に採用されているECMO抗凝固戦略は、重症患者の臨床シナリオに直接適用できない場合があります。重篤な疾患の複雑さとその炎症反応は、特にCOVID-19患者で観察されるような後天性凝固亢進および過炎症の場合、患者の止血をさらに混乱させる可能性があります7,20。多様な臨床状況におけるECMOの抗凝固戦略は、依然として重要な臨床的考慮事項です。術前のベースライン凝固状態が異なる患者や、さまざまな臨床状況を経験している患者(V-VモデルおよびV-Aモデル)に対するECMO抗凝固療法戦略を調査するためには、今後の詳細な臨床試験が必要である。
この研究では、いくつかの制限が残っていました。まず、偽のグループは含まれていませんでした。第二に、血液消費を最小限に抑えるために、炎症マーカーの動的モニタリングは行われませんでした。また、本研究ではECMOに関連する疾患動物モデルが確立されておらず、本論文で述べるECMO術後管理は臨床診療とは異なる可能性があります。
結論として、抗凝固管理のための目標ACT値が220〜250秒の長期覚醒羊ECMOモデルは、実現可能で安定していることが示されています。凝固機能を綿密に監視するだけでなく、重要な臓器の灌流機能は、ECMO管理の焦点であり続けています。疾患動物のECMOモデルにおける適切な抗凝固管理戦略を掘り下げるためには、将来のさらなる実験が必要です。
開示事項
著者は何も開示していません。
謝辞
何一つ。
資料
| Name | Company | Catalog Number | Comments |
| ACT analyzer | Hemochron, USA | Jr Signature | |
| Anaesthesia machine | Drager, Germany | Primus | |
| Arterial catheter | Edwards Lifescience, USA | 18-Fr | Provide return access into an artery for VA-EMCO |
| Blood chemistry analyzer | IDEXX Laboratories, USA | Catalyst One | |
| Blood gas analyzer | Abbott, USA | Abbott i-STAT1 | |
| Centrifugal pump | Jiangsu STMed Technologies, China | STM CP-24 I | |
| Centrifugal pump drive and console | Jiangsu STMed Technologies, China | OASSIST STM001 | |
| Coagulation test analyzer | Beijing Succeeder Technology, China | SF-8050 | |
| Complete blood count analyzer | Siemens Healthcare, Germany | ADVIA 2120i | |
| Dual-channel micro-injection pump | Zhejiang Smith Medical Instrument, China | WZS-50F6 | |
| Dual-lumen catheter | MAQUET Avalon Elite, Germany | 23-Fr | Provide return and drainage accesses into the right external jugular vein for VV-ECMO |
| Flurbiprofen | Beijing Tide Pharmaceutical Co., Ltd., China | 5ml: 50mg | |
| GraphPad software | GraphPad Software, USA | GraphPad Prism v9.0 | Statistical analysis |
| Heparin | Shanghai Shangyao No.1 Biochemical Pharmaceutical Co., Ltd., China | 2ml: 12500IU | |
| High-frequency electrosurgical | COVIDIEN, USA | Force F | |
| Multi-parameter medical monitor | Philips, Netherlands | MP60 | |
| Oxygenator kit | Medos, Germany | Hilite 7000LT | |
| Oxygenator kit | Maquet, Germany | BE-PLS 2050 | |
| Propofol | Xi’an Libang Pharmaceutical Co. Ltd, China | 20ml: 0.2g | |
| Single-lumen central venous catheter | TuoRen, China | 18Fr | Insert in left carotid artery for hemodynamic monitoring and blood sampling. |
| Small Tail Han sheep | Jinyutongfeng Commercial and Trade Co. Ltd, China | weight: 50-65 kg, age: 12-24 months | |
| Triple-lumen central venous catheter | TuoRen, China | 7Fr | Insert in left jugular vein for intravenous fluid administration, drug injection, and blood sampling. |
| Ultrasound machine | GE, USA | E9 | |
| Venous catheter | Edwards Lifescience, USA | 24-Fr | Provide the drainage access into a vein for VA-ECMO |
| Ventilator | Drager, Germany | Savina |
参考文献
- Descamps, R., et al. Anti-Xa activity and hemorrhagic events under extracorporeal membrane oxygenation (ECMO): A multicenter cohort study. Crit Care. 25 (1), 127 (2021).
- Keller, S. P. Contemporary approaches in the use of extracorporeal membrane oxygenation to support patients waiting for lung transplantation. Ann Cardiothorac Surg. 9 (1), 29-41 (2020).
- Smith, M., et al. Duration of veno-arterial extracorporeal life support (VA ECMO) and outcome: An analysis of the Extracorporeal Life Support Organization (ELSO) registry. Crit Care. 21 (1), 45 (2017).
- Yang, L., et al. Risk factors for bloodstream infection (BSI) in patients with severe acute respiratory distress syndrome (ARDS) supported by veno-venous extracorporeal membrane oxygenation (VV-ECMO). BMC Pulm Med. 22 (1), 370 (2022).
- Arachchillage, D. J., et al. Impact of major bleeding and thrombosis on 180-day survival in patients with severe COVID-19 supported with veno-venous extracorporeal membrane oxygenation in the United Kingdom: A multicentre observational study. Br J Haematol. 196 (3), 566-576 (2022).
- King, C. S., Roy, A., Ryan, L., Singh, R. Cardiac support: Emphasis on venoarterial ECMO. Crit Care Clin. 33 (4), 777-794 (2017).
- Rajsic, S., et al. Anticoagulation Strategies during extracorporeal membrane oxygenation: A narrative review. J Clin Med. 11 (17), 5147 (2022).
- Rajsic, S., et al. The Role of Excessive anticoagulation and missing hyperinflammation in ECMO-associated bleeding. J Clin Med. 11 (9), 2314 (2022).
- Djordjevic, I., et al. Fluid management in veno-arterial extracorporeal membrane oxygenation therapy-analysis of an experimental pig model. J Clin Med. 12 (16), 5330 (2023).
- Passmore, M. R., et al. Evidence of altered haemostasis in an ovine model of venovenous extracorporeal membrane oxygenation support. Crit Care. 21 (1), 191 (2017).
- Heinsar, S., et al. Heart failure supported by veno-arterial extracorporeal membrane oxygenation (ECMO): a systematic review of pre-clinical models. Intensive Care Med Exp. 8 (1), 16 (2020).
- MohanKumar, S. M., et al. Effects of prenatal bisphenol-A exposure and postnatal overfeeding on cardiovascular function in female sheep. J Dev Orig Health Dis. 8 (1), 65-74 (2017).
- Zou, Z., et al. Naturally-occurring spinosyn A and its derivatives function as argininosuccinate synthase activator and tumor inhibitor. Nat Commun. 12 (1), 2263 (2021).
- Cianchi, G., Lazzeri, C., Bonizzoli, M., Batacchi, S., Peris, A. Echo-guided insertion of a dual-lumen cannula for venovenous extracorporeal membrane oxygenation. ASAIO J. 65 (4), 414-416 (2019).
- Conway, R. G., et al. Evaluation of an autoregulatory ECMO system for total respiratory support in an acute ovine model. Artif Organs. 44 (5), 478-487 (2020).
- McDonald, C. I., et al. The impact of acute lung injury, ECMO and transfusion on oxidative stress and plasma selenium levels in an ovine model. J Trace Elem Med Biol. 30, 4-10 (2015).
- Zhou, X., et al. Long-term support with an ambulatory percutaneous paracorporeal artificial lung. J Heart Lung Transplant. 31 (6), 648-654 (2012).
- Brodard, J., et al. COVID-19 patients often show high-titer non-platelet-activating anti-PF4/heparin IgG antibodies. J Thromb Haemost. 19 (5), 1294-1298 (2021).
- Cartwright, B., et al. Hemostasis, coagulation and thrombin in venoarterial and venovenous extracorporeal membrane oxygenation: the HECTIC study. Sci Rep. 11 (1), 7975 (2021).
- Lim, M. S., McRae, S. COVID-19 and immunothrombosis: Pathophysiology and therapeutic implications. Crit Rev Oncol Hematol. 168, 103529 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved