Method Article
アフリカツマカ卵母細胞におけるヒトの匂いに対するネッタイシマカの匂い受容体の異種発現と機能解析
要約
Xenopus卵子発現システムと組み合わせた2電極電圧クランプを使用して、ヒトの臭気に応答する蚊のORを機能的に特徴付けるプロトコルが提示され、ヒトの臭気への曝露に対する蚊のORの応答を探索するための強力な新しい技術を提供します。
要約
ネ ッタイシマカ (Linnaeus)は、黄熱病、デング熱、ジカ熱など、多くの重要なヒト疾患の媒介者であり、他の温血動物よりもヒトの宿主を強く好み、血液の食事をすることを示しています。嗅覚の手がかりは、蚊が環境を探索し、血液の食事を得るために人間の宿主を探すときに重要な役割を果たし、したがって人間の病気を伝染させます。嗅覚ニューロンで発現する匂い受容体(OR)は、蚊媒介生物とヒトの匂いとの相互作用に関与していることが知られています。 Ae. aegyptiの嗅覚生理機能についてより深い洞察を得て、分子レベルでのヒトとの相互作用を調査するために、 Xenopus Oocytesの異種発現の最適化されたプロトコルを使用して、ヒトの匂いに応答する Ae. aegypti の匂い受容体を機能的に解析しました。3つの実験例が提示されます:1)4〜6日齢の Ae. aegypti 触角からのORおよび匂い受容体共受容体(Orco)のcRNAのクローニングと合成。2) Xenopus 卵子におけるORおよびOrcoのマイクロインジェクションと発現。3)2電極電圧クランプで蚊ORs/Orcoを発現する Xenopus 卵子からの全細胞電流記録。これらの最適化された手順は、研究者が ネッタイシマカ のヒトの匂いの受容を調査し、分子レベルでの宿主探索活性を支配する根本的なメカニズムを明らかにするための新しい方法を提供します。
概要
黄熱病の蚊Ae.aegyptiは、黄熱病、デング熱、ジカ熱など、多くの致命的な病気を媒介し、甚大な苦痛と人命の損失を引き起こす可能性があります。蚊は、CO2、皮膚の臭い、体温などの複数の手がかりを利用して、宿主1を見つけます。ヒトと他の温血動物の両方がCO2を産生し、体温が類似していることを考えると、雌のAe. aegyptiは主に皮膚の匂いを宿主識別に依存している可能性が高いと考えられる2。しかし、これは複雑な状況を作り出し、ある初期の研究では、ヒトの皮膚放出物から300以上の化合物を分離しました3。さらなる行動アッセイにより、これらの化合物の多くがAe. aegypti 4,5,6,7の行動応答を誘発することが示されているが、これらの化合物が蚊によってどのように検出されるかは正確にはほとんど不明のままである。私たちのグループによる最近の研究では、Ae. aegyptiの宿主探索活動に関与している可能性のあるいくつかのヒトの匂い物質が特定されましたが、それらの役割はまださらなる行動アッセイによって確認されていません8。これらの必須のヒトの匂い物質が、Ae. aegyptiの末梢感覚系でどのように解読されるのかは、まだ確立されていません。
昆虫は、嗅覚付属器の化学感覚感覚を通じて匂い物質を検出します。各センシラの内部では、匂い受容体(OR)、イオントロピック受容体(IR)、味覚受容体(GR)などの異なる嗅覚受容体が嗅覚ニューロン9の膜上に発現している。これらのORは、昆虫が遭遇する多くの匂い物質、特に食物、宿主および交尾相手に関連する匂いを感知する役割を担っている10,11,12,13。Xenopus発現システムと2電極電圧クランプを組み合わせて、ハマダラカのORの機能を脱オルファン化することに焦点を当てた以前の研究では、ハマダラカのORは、ヒトの放射物の主要な成分である芳香族化合物に特異的に調整されていることがわかっています14。最近のゲノム研究では、Ae. aegypti15で最大117のOR遺伝子が同定されました。したがって、ヒトの匂いや産卵刺激などの生物学的または生態学的に重要な匂い物質に応答して、これらのネッタイシマカの機能を体系的に処理する方法は、Ae. aegyptiの化生態学または神経行動学をさらに理解しようとする人々にとって有用な情報を提供するでしょう。
2電極電圧クランプ(TEVC)技術は、もともと1990年代半ばに膜イオンチャネルの機能を調べるために開発されました16,17。それ以来、TEVCは、14、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32の昆虫種からのORを調査するために使用されてきました、33,34。ORのこの機能的検討は、昆虫の重要な生態学的質問に答えるのに大きく貢献しました:1)昆虫はどのようにして食料源を見つけますか?2)彼らは交尾相手から放出される揮発性の性フェロモンにどのように引き付けられますか?3)彼らはどのようにして彼らの子孫のための完璧な産卵場所を見つけますか?4)植物由来または合成で、噛む虫から人間を効率的に保護できる化合物はありますか?これらの疑問に対する答えは、蚊などの重要な病気の媒介者を制御するために重要です。
ヒト胚性腎臓細胞株293(HEK293)、ショウジョウバエの空ニューロン系、亜鉛フィンガーヌクレアーゼ、転写活性化因子様エフェクターヌクレアーゼ、およびCRISPR/Cas9遺伝子編集系に基づくものを含む他の多くのアプローチも、手術室機能研究で使用されています12,20,35,36,37.しかし、これらの技術はすべて経験豊富な分子生物学者のスキルを必要とし、複数の潜在的に交絡因子を含んでいます。TEVC/卵子発現は、匂いを誘発する受容体電流とイオンコンダクタンスを直接測定することができ、cRNAからの受容体発現に必要なスピーディーなセットアップ時間という利点もあります。したがって、この研究では、TEVCを使用して、生物学的関連性の可能性のあるいくつかの匂い物質に対する1つのAe.aegyptiOR55(AaegOR55)の応答を調べ、AaegOR55•AaegOrcoで発現した卵子がヒトの匂い物質ベンズアルデヒドに対して用量依存的な応答を示したことを明らかにしました。
プロトコル
この手順のプロトコルである実験動物の世話と使用は、承認および監視されています(オーバーン大学の施設用動物の世話と使用委員会:承認されたプロトコル#2016-2987)。
注:カスタム遺伝子合成は、蚊OR遺伝子のクローニングに代わる有力な方法です。
1. 蚊と嗅覚の付属肢(触角)コレクション
- Ae. aegypti蚊(USDA、ARS、Mosquito and Fly Research UnitのJames Becnel博士から入手)を25±2°C、日長12:12(L:D)h(午前8時点灯)に維持します。
- CO2 を使用して、血液供給なしで ~800 匹の 4-6 日齢の雌の蚊に麻酔をかけます。蚊の触角(嗅組織)を顕微鏡(40倍)でハサミで切断し、ドライアイスに置いた1.5mLの遠心チューブに集めます。
注意: 収集したアンテナは、-80°Cの冷凍庫に保管することも、すぐに使用することもできます。
2. Ae. aegyptiの触角からのORクローニング
- 市販のトータルRNAキットを使用して、メーカーのプロトコルに従ってアンテナからトータルRNAを抽出します。
- 市販のDNAフリーキットを使用して全RNAを消化し、メーカーのプロトコルに従ってDNaseおよびその他のイオンを除去します。
- Oligo d(T)20-primed SuperScript IV First-Strand Synthesis System13,30を使用して、1.5 μgのDNAフリーRNAからcDNAを合成します。
- VectorBase(https://www.vectorbase.org/)で利用可能な配列と酵素切断部位の特別な要件に従って 、OR 遺伝子のPCRプライマーを設計します。ほとんどの真核生物において翻訳を開始するコザック配列(GCCACC)を、各フォワードプライマー30の切断部位と開始コドンとの間に追加する。
- 制限エンドヌクレアーゼ部位を含む遺伝子特異的プライマーと、製造元のプロトコールに従ってKozak配列を含むPCRにより 、OR 遺伝子のコード配列をクローニングします。
- 1%アガロースゲルでPCR産物を検出し、市販のゲル抽出キットを使用して、メーカーのプロトコールに従って精製します。
- 制限酵素による消化後、PCR産物をpT7Tsベクターにクローニングすることにより、メーカーのプロトコールに従って組換えプラスミドの構築を行います。
- サンガーシーケンシングによりリコンビナントプラスミドを検証し、VectorBaseデータベースを用いて確認します。
3. cRNA合成
- 構築したプラスミドを特異的な制限酵素で直鎖化します。
注:プラスミドDNAは、転写する遺伝子の下流の制限酵素で直鎖化する必要があります。 - 直鎖状プラスミドを使用して、前述の説明13,30に従って市販のT7キットでcRNAを合成します。
- ORとOrcoのcRNA(1:1)を遠心チューブでプレミックスし、混合したcRNAを各PCRチューブごとに2 μLの容量(250 ng/μL/各)に分注します。分注したcRNAは、使用前に-80°Cで保存してください。
4.Xenopus卵子コレクション
注:この手順は、Schneider et al.38の指示に従っています。
- Xenopus laevisを1 Lの超精製水と1 gのエチルm-アミノ安息香酸メタンスルホン酸塩で20〜30分間麻酔します(図1A)。指を使ってカエルのつま先をつまみます。反応がない場合、カエルは十分に麻酔され、手術の準備ができています。麻酔をかけたカエルを氷床に移します。
- 手術
- カエルの腹側領域を10%ポビドンヨード溶液でこすり、きれいなコットンボールで溶液を拭きます。この手順を 2 回繰り返します。
- 使い捨てメスで小さな腹部切開(10-15 mm、 図1B)を行います。皮膚、筋膜 - 筋肉層を別々に浸透させます。切開部は腹部の下部、正中線の外側にあります。
注意: 内臓を傷つけないでください。 - 鉗子で卵巣葉の一部をつかみ、外側に優しく引っ張ります。卵巣を持ち上げ、ハサミで体壁の高さで切り取ります。十分な卵巣材料が得られるまで数回繰り返します(~200個の卵子、 図1C)。卵巣材料を洗浄バッファー(96 mM NaCl、2 mM KCl、5 mM MgCl2•6H2O、5 mM HEPESナトリウム塩、10 μg/mLゲンタマイシン、pH 7.6)に移します。
- 手術の傷(筋肉と皮膚の両方)を吸収性の縫合糸で閉じます。これは通常、10〜14日で分解して自然に脱落します。
- 各手術後、カエルを1Lの回収液(缶詰と酸洗い塩3.4g、インスタント海塩2gを含む)に入れて目を覚ますまで置き、その後、カエルの施設に戻します。
注:各カエルに対して最大4回の手術を行うことができます。各カエルの操作間隔は2か月以上である必要があります。
- 酵素脱落消化と卵子培養
- 卵子(~200個の卵子、 図1C)を細かく分けます。
- 10 mLの洗浄バッファー(セクション4.2.3)と2 mg/mLコラゲナーゼBを周囲温度で40〜60分間、すべての卵子を消化溶液に移し、濾胞細胞層を除去します。顕微鏡でサンプルを検査して、卵子の80%が完全に脱落しているかどうかを判断します。そうでない場合は、ほとんどの卵子の準備が整うまで10分ごとにチェックしてください。
- 卵子を1x Ringer's solution(96 mM NaCl、2 mM KCl、5 mM MgCl2.6H 2O、5 mM HEPESナトリウム塩、pH 7.6)、洗浄緩衝液(セクション4.2.3)、変性Barth生理食塩水(78 mM NaCl、1 mM KCl、0.33 mM Ca(NO3)2・4H2O、0.41 mM CaCl2・2H2O、 0.82 mM MgSO4·7H2O、2.4 mM NaHCO3、10 mM HEPESナトリウム塩、1.8 mMピルビン酸ナトリウム、10 μg/mLゲンタマイシン、10 μg/mLストレプトマイシン、pH 7.6)順番に(各バッファーにつき5回、毎回10 mLを使用)。卵子をバッファーで広範囲にすすぎ、未熟で質の悪い卵子を取り除きます。
- デュモンの分類に従って、ステージV-VIで卵子を採取します。ステージV-VIの健康状態の良い良質な卵子を、白と黒の分裂がはっきりしていて、視覚的に明らかな損傷がない(図1D)を、改変バルト生理食塩水を含む100 mm x 15 mmのシャーレに移します(セクション4.3.3)。質の悪い卵子を捨てます(図1E)。マイクロインジェクションの前に、消化した卵子を昆虫成長チャンバー内の18°Cで約24時間維持します。
5. Xenopus OocytesにおけるcRNAマイクロインジェクションと匂い受容体(OR)およびOR共受容体(Orco)の発現
- 100 mm x 15 mmのペトリ皿に金属マトリックスを入れ、マトリックスが水没するまで変性バルト生理食塩水(セクション4.3.3)を追加します。マトリックス上の卵子を移し、サイズに合わない卵子を捨てます。卵子を植物の極が上側になるように配置します(図1F)。
- マイクロパイププーラー(熱= 525、プル= 50、速度= 50、時間= 250)を使用して各サンプルに対して新しいガラスキャピラリー(外径1.0 mm x 内径0.5 mm x 長さ= 100 mm)を引っ張り、マイクロピペットベベラーで25°の角度で研ぎます。キャピラリーチューブをナノリットルインジェクターに取り付けます。
- 注入する前に、ORとOrcoのプレミックスcRNA(セクション3.3)のチューブを1本冷凍庫から取り出し、完全に溶解するまで氷の上に置きます。ナノリットルインジェクターの Fill ボタンを押して、キャピラリーチューブにOR/Orco混合物を充填します。
- 各卵子のプレミックスcRNAを10 ng(5 ng OR + 5 ng Orco; ~20 nL)をナノリットルのインジェクターでRNAseフリーステーションに注入します。(図1F)。
注:注入する前に、 EMPTYボタンを押して混合物をほとんど排出せず、毛細管が詰まっていないことを確認します。cRNAが卵子に完全に入るまで約5秒待ちます。 - 注射後、卵子を改変Barth生理食塩水を入れた滅菌24ウェル細胞培養プレートに18°Cで3〜7日間保存してから、全細胞記録を行います。
6. 2電極電圧クランプ方式による全セル電流記録(図2)
- 2電極電圧クランプ記録の前に、個々の臭気化合物をジメチルスルホキシド(DMSO)に溶解して、一連のストック溶液(100μg/μL)を得ます。これらのストック溶液を1x ND96バッファー(91 mM NaCl、2 mM KCl、1.8 mM CaCl2·2H2O、2 mM MgCl2·6H2O、5 mM HEPESナトリウム塩、pH 7.6)で1000倍に希釈して、一連の作業溶液(0.1 μg/μL)を得ます。
- 金属シールド、顕微鏡、光源、廃棄物ポンプなど、TMC防振テーブル上のすべてが慎重に接地されていることを確認し、全細胞信号記録に対する外部電気ノイズの影響を軽減します。
- マイクロパイププーラー(熱=525、引っ張り=50、速度=50、時間=250)を使用してガラスキャピラリー(外径1.20mm×内径0.94mm、長さ=750mm)を引っ張って微小電極を作製します。キャピラリーに3 M KClを充填し、Ag/AgClワイヤーを10%塩素系漂白剤で2〜5分間塩素化します(淡い灰色のAg/AgClワイヤーは塩素化する必要があります)。
- Oocyte Clamp と Digidata Digitizer のスイッチを入れて、マシンの電源を入れます (図 3A)。ソフトウェア(Clampex 10.3など)を開き、[ 記録 ]ボタンをクリックします。1x ND96バッファー(セクション6.1)のスイッチと廃棄物バッファーのポンプをオンにします。
- 流動バッファに微小電極を挿入し、 Vm Electrode Test ボタンと Ve Electrode Test ボタンを押して微小電極の抵抗を確認することにより、事前テストを実施します。Vm は 40 mV <、Ve は 40 μA <する必要があります。プレテスト後、1x ND96バッファー(セクション6.1)の流れと廃棄物ポンプのスイッチを切ります。
- 各卵子を1x ND96バッファー(セクション6.1)で満たされた灌流チャンバー(図2)に置き、植物柱をガラスキャタピラが上に向けて卵子を穏やかに配置します。電極をゆっくりと卵子に挿入します(図3B)。Vm パラメータを 0 に調整し、次に Ve パラメータを 0 に調整します。Clamp ボタンを OFF から FAST に変更します。ゲインボタンを~-80mVに調整します。
- Ve の値は一定であるはずです。そうでない場合は、2つの微小電極のうち少なくとも1つに漏れがあります。これが発生した場合は、故障したコンポーネントを新しいキャピラリーと交換してください。
- 注入した卵子からの全細胞電流を、卵子クランプで~-80 mVの保持電位で記録します(図2)。
- データの取得と解析を実行します。
- 1x ND96バッファー(セクション6.1)の流れを再開し、廃棄物ポンプをオンにします。
- 灌流システムによる臭気溶液の塗布:1x ND96バッファー(セクション6.1)のスイッチを切り、臭気溶液を10秒間流します。次に、ピーク値を記録します。試験臭気物質に対するORの応答を得るには、ピーク値からベースライン値を差し引きます。
- 臭気溶液の流れを止め、1x ND96バッファー(セクション6.1)に切り替えます。以前の臭気刺激から現在のトレースが回復するまで、バッファーを使用して卵子を洗浄します。その後、卵子は別の臭気溶液による刺激の準備が整います。一般に、1つの卵子を使用して20〜30の化学刺激を検出できます。
注:濃度依存の応答をテストするときは、常に最低濃度を最初に適用してから、高濃度に移動する必要があります。
結果
最近、Single sensillum Recording(SSR)技術を用いて、Ae. aegyptiの宿主探索行動8に重要であると考えられるヒトの匂い物質を特定しました。しかし、Ae. aegyptiの末梢感覚系で人間の匂い物質を感知するプロセスを推進する分子メカニズムは不明のままです。ORは、ほとんどの昆虫10,11,12において、匂い物質リガンドの検出において重要な役割を果たしている。その機能を果たすためには、各ORをOrcoと共発現させて、ヘテロマーリガンド依存性イオンチャネルを形成する必要があります(図4)。特定のリガンドに結合すると、細胞膜上に発現するヘテロマーイオンチャネルが活性化されて開き、Ca2+などの陽イオンが細胞に流入する20,35(図4)。これにより、セルに挿入された電極を記録することによって検出できる内向きの電流30,34が生成されます。これらの記録電極は、卵子の電圧クランプ用に設計されたアンプに接続され、取得した電気信号はデジタイザを使用して処理され、コンピューターに記録されます。灌流されたリガンドに対するORの応答は、ピーク値からベースライン値を差し引くことによって計算できます。
本研究では、TEVCを用いてAe. aegypti産のAaegOR55•AaegOrcoの機能を調べました。健康な卵母細胞をステージV-VIでXenopus frogから採取し、Collagenase Bで消化した後、それぞれにAaegOR55、AaegOrco、またはプレミックスされたAaegOR55•AaegOrcoのcRNA10 ngを注入しました(1:1)。その結果、生細胞、AaegOR55のみを注入した細胞、AaegORCOのみを注入した細胞は、2つの植物由来化合物(コントロールリガンドとして使用されるα-テルピネンとシトロネラール)またはヒトの匂い物質(ベンズアルデヒド)のいずれに対しても反応を示さなかったことがわかりました(図5)。しかし、AaegOR55とAaegOrcoの両方を注入した卵母細胞は、ヒトの匂い物質であるベンズアルデヒドに対して用量依存的な反応を示し(図5)、AaegOR55がAe. aegyptiのベンズアルデヒドの分子標的の少なくとも1つであることを示唆しています。これは、ORとオルコが機能チャネル14,20,30,34,35を形成するために共発現する必要があるという観察結果とも一致している。高濃度のベンズアルデヒドを浴びたAaegOR55•AaegOrcoを発現する卵子は、より強い応答を誘発し(図5)、これはより多くのヘテロマーイオンチャネルが活性化されることを示しています。
組み合わせたAaegOR55•AaegOrcoは、2つの植物性化合物に対して応答を示さず(図5)、各OR/Orco複合体12の特徴的な調整特性を示唆しています。一方、オルコはORに依存しない限られた数の化合物に応答することが報告されています。例えば、多くのPterygota昆虫種(蚊のAnopheles gambiae、Culex quinquefasciatus、ショウジョウバエのDrosophila melanogaster、タバコのつぼみHeliothis virescens、インドの跳躍アリHarpegnathos saltator、および寄生性のイチジクのスズメバチApocrypta bakeriを含む)のオルコは、アゴニストVUAA1 34,40,41によって活性化することができる.進化研究からの証拠は、昆虫オルコが最初に翼のないザイゲントマシルバーフィッシュで進化し、複雑なORs/オルコが翼のあるプテリゴタ昆虫で進化したことを示唆しています42。

図1: Xenopus laevis からの卵子の単離と、 Xenopus卵子への匂い受容体(OR)およびOR共受容体(Orco)のマイクロインジェクションに関与するプロセスを示す概略図。A. Xenopus laevis; B. 無菌手術; C. ステージV-VIで良質で採取された卵母細胞。 D. 2 mg/mLコラゲナーゼBによる消化後の卵母細胞; E. 研究に使用できなかった質の悪い卵子。 F. Xenopus 卵子細胞のマトリックス上の配列と、ガラス毛細血管を用いた Xenopus 卵子へのORおよびOrcoのマイクロインジェクション。 この図の拡大版を表示するには、ここをクリックしてください。
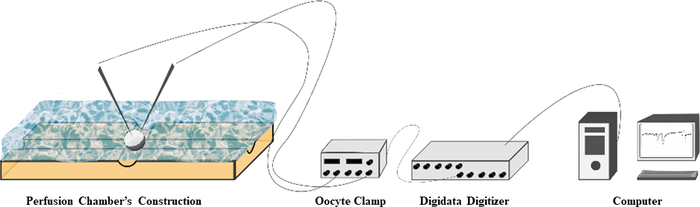
図2:図は、2電極電圧クランプシステムによる全細胞電流記録の灌流チャンバー、配線、および接続を示しています。この図の拡大版を表示するには、ここをクリックしてください。

図3:2電極電圧クランプのセットアップ。 卵子クランプシステム、Digidataデジタイザー、モニター イ.TMC除振テーブルに設置された顕微鏡、灌流チャンバー、微小電極、磁気スタンド、マイクロマニピュレーター。灌流システムはテーブルの左側に吊り下げられています。卵子に2つの微小電極を挿入します。この図の拡大版を表示するには、ここをクリックしてください。
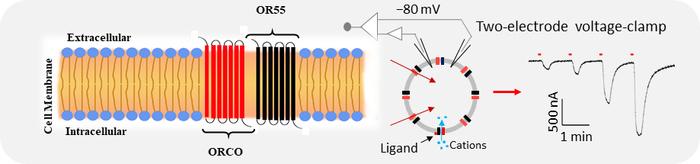
図4: Xenopus卵子におけるOR(AaegOR55など)とOrcoの全細胞電流記録を図に示します。 各トレースの上にある赤いバーは、10秒間の覚醒剤の適用を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
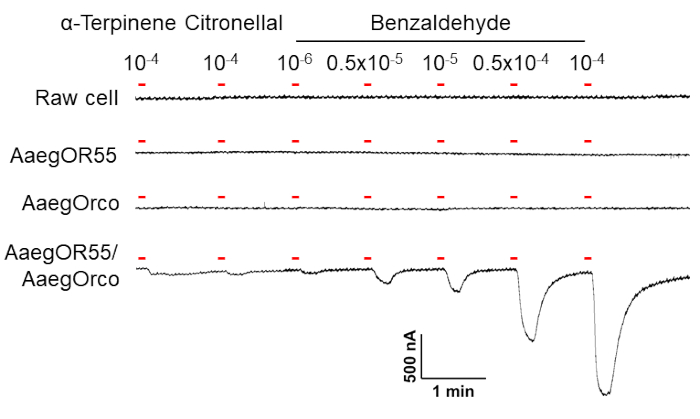
図5:ヒトの匂い物質に対する Xenopus 卵子の応答。Xenopus 卵子に脱イオン蒸留水(生細胞)、AaegOR55単独、AaegOrco単独、またはAaegOR55 / AaegOrcoを注入します。α-テルピネンとシトロネラールはどちらも10-4 V / Vの濃度でテストされています。ベンズアルデヒドは、示されているように、連続濃度でテストされます。各トレースの上にある赤いバーは、10秒間の覚醒剤の適用を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
TEVCは、膜受容体の機能を調べるために広く使用されている古典的な手法です。詳細なプロトコルは、ここで提示された手順とかなり類似性を共有する43 すでに公開されているが、ここで提案された方法は、いくつかの重要な変更を導入している。例えば、ここでは、ORおよびOrcoの両方のcRNAを、合成直後に少量のサンプルに予混合して分注し、注入43の直前にパラフィルム上で別々に混合するのではなく、使用まで−80°Cで保存する。さらに、卵子を採取した後、筋肉と皮膚の両方の傷を閉じるために吸収性縫合糸を使用することを選択しますが、これは縫合糸がカエルに吸収され、後で除去する必要がないため、筋肉を閉じるのに特に役立ちます。さらに、各カエルから採取される卵巣の量は、各実験のニーズに応じて柔軟です。Nakagawa and Touhara(2013)のプロトコルでは、卵巣の3分の1を切除する必要があると具体的に述べられていますが、これは通常、かなりの無駄をもたらします。私たちの経験では、卵巣の5分の1は1回の実験に十分であるべきだと示唆しています。
昆虫のORは、匂いの感覚に関与する嗅覚受容体の3つのクラスのうちの1つであり、TEVC技術14、18、19、21、22、23、24、25、26、27、28、29、30を使用して、さまざまな化合物に対して広範囲にテストされています、31、32、33、34。ORの機能研究では、昆虫が食料源、交配パートナー、産卵場所を特定するために使用する化合物など、生態学的に重要な化合物を常に優先する必要があります。ヒトの皮膚から300種類以上の化合物が単離されており3、蚊の宿主探索行動の分子基盤を明らかにする取り組みの一環として、TEVCを用いて ネッタイシマカ のORを機能的に特徴付けるために使用されるような化学パネルの有用な参考資料となっています。
卵子におけるORの発現を成功させることは、TEVCを用いてその機能を調べる際に不可欠です。An. gambiae と Cimex lectularius の以前の研究で示されたように、An. gambiae の 72 の OR のうち 37 と C. lectularius の 47 の OR のうち 15 が Xenopus 卵母細胞で首尾よく発現しています14,30。Xenopus卵子におけるORの発現には、いくつかの要因が影響を及ぼす可能性があります。たとえば、卵母細胞の品質はカエルごとに異なる場合があります。本研究では、アフリカツメガエルから卵子を採取しましたが、品質保証付きの卵子を直接購入することは可能です(例:Nasco)。そのため、消化開始から40分後に卵子の品質を慎重にチェックし、~80%が完全に脱卵するまで10分ごとに卵子の品質をチェックし続けました。最後に、一部のOR遺伝子は他の遺伝子よりもゆっくりと発現する可能性があることに留意することが重要です。したがって、18°Cで3日間のインキュベーション後、24時間ごとに発現をチェックし、不良卵子を除去し、バッファーを新鮮な改変Barth生理食塩水で毎日交換する必要があります。
ORの機能は、他の実験方法を使用して調べることができます。例えば、HEK293細胞株は、昆虫または機能研究で使用される別のin vitro発現系である35。今回の研究で使用したXenopus卵子発現系とは異なり、発現のためには標的OR遺伝子をHEK293細胞にトランスフェクションする必要があり、その後、イオン電流をパッチクランプ技術で記録します。ショウジョウバエの空のニューロンシステムは、ニューロン環境2,11,12における昆虫のOR機能を調査するために使用できる別のin vivo発現システムであり、一方、空のニューロンシステムは、ショウジョウバエの内因性OR遺伝子44を欠く突然変異触角ニューロンである。その後、他の昆虫種由来の外因性OR遺伝子をトランスジェニック法を用いて変異型触角ニューロンに組み入れ、SSRを用いて機能的に研究することができます。TEVCと比較すると、これら2つの方法はより複雑で、長いトレーニングプロセスを完了した経験豊富なオペレーターが必要です。ショウジョウバエの空のニューロンシステムは、安定したトランスジェニックUASラインを確立するために特に労力と時間がかかります。
最近の研究では、クライオ電子顕微鏡を利用して、寄生性のイチジクバチ A.bakeri41のオルコの構造を特定しました。昆虫OR•Orcoヘテロ四量体のクライオ電子顕微鏡構造に特に焦点を当てた将来の研究は、他の未定義のOR•OrcoヘテロテトラマーのEM構造を予測し、コンピューターモデリングを介して数千の候補化合物の中から特定のORのリガンドを比較的短時間でスクリーニングするのに役立つ可能性があります。その後、予測されたリガンドまたはORの機能は、TEVCを使用して確認することができます。
開示事項
何一つ。
謝辞
このプロジェクトは、アラバマ農業試験場(AAES)のMultistate/Hatch Grants ALA08-045、ALA015-1-10026、ALA015-1-16009からN.L.への賞を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 24-well cell culture plate | CytoOne | CC7682-7524 | Used for oocyte culture |
| African clawed frog | Nasco | LM00535 | Used to harvest Xenopus oocytes |
| Ag/AgCl wire electrode | Warner Instruments | 64-1282 | Used for microelectrodes |
| Clampex 10.3 | Axon | N.A. | Used for signal recording |
| Clampfit 10.3 | Axon Instruments Inc. | N.A. | Used for data analysis |
| Collagenase B | Sigma | 11088815001 | Used for oocyte digestion |
| Digidata Digitizer | Axon CNS | Digidata 1440A | Used for data acquisition |
| E.Z.N.A. Plasmid DNA Mini kit | Omega | D6942-01 | Used for plasmid preparation |
| Ethyl-M-aminobenzoate methanesulfonate salt | Sigma | 886-86-2 | Used for anesthetizing frogs |
| Glass capillary | FHC | 30-30-1 | Used for microinjection |
| Glass capillary | Warner Instruments | 64-0801 | Used for preparing microelectrodes |
| GyroMini Nutating Mixer | Labnet | S0500 | Used for oocyte digestion |
| Insect Growth Chambers | Caron Products | model 6025 | Used for oocyte incubation |
| Leica Microscope | Leica | S6 D | Used for cutting mosquito antennae |
| Light Source | Schott | A20500 | Providing light sources for observation |
| Magnetic stand | Narishige | GJ-1 | Used to hold the reference electrode |
| Micromanipulator | Leica | 115378 | Used for minor movement of electrode |
| Micropipe puller | Sutter | model P-97 | Used to pull capillaries |
| Micropipette beveler | Sutter | model BV-10 | Used to sharpen capillaries |
| mMESSAGE mMACHINE T7 kit | Invitrogen | AM1344 | Used for synthesizing cRNA |
| Nanoject II Auto-Nanoliter Injector | Drummond | 3-000-204 | Used for microinjection |
| Oligo d(T)20-primed SuperScript IV First-Strand Synthesis System | Invitrogen | 18091050 | Used for synthesizing cDNA |
| Olympus Microscope | Olympus | SZ61 | Used for microinjection |
| One Shot TOP10 Chemically Competent E. coli cells | Invitrogen | C404003 | Used for transformation |
| Oocyte clamp amplifier | Warner Instruments | model OC-725C | Used for TEVC recording |
| QIAquick gel extraction kit | Qiagen | 28704 | Used for gel purification |
| TMC Vibration Isolation Table | TMC | 63-500 | Used for isolating the vibration from the equipment |
| TURBO DNA-free kit | Invitrogen | AM1907 | Used to remove DNase and other ions in RNA |
参考文献
- Cardé, R. T. Multi-cue integration: how female mosquitoes locate a human host. Current Biology. 25 (18), 793-795 (2015).
- McBride, C. S., et al. Evolution of mosquito preference for humans linked to an odorant receptor. Nature. 515 (7526), 222-227 (2014).
- Bernier, U. R., Kline, D. L., Barnard, D. R., Schreck, C. E., Yost, R. A. Analysis of human skin emanations by gas chromatography/mass spectrometry. 2. Identification of volatile compounds that are candidate attractants for the yellow fever mosquito (Aedes aegypti). Analytical Chemistry. 72 (4), 747-756 (2000).
- Bernier, U. R., Kline, D. L., Schreck, C. E., Yost, R. A., Barnard, D. R. Chemical analysis of human skin emanations: comparison of volatiles from humans that differ in attraction of Aedes aegypti (Diptera: Culicidae). Journal of the American Mosquito Control Association. 18 (3), 186-195 (2002).
- Bernier, U. R., et al. Synergistic attraction of Aedes aegypti (L.) to binary blends of L-lactic acid and acetone, dichloromethane, or dimethyl disulfide. Journal of Medical Entomology. 40 (5), 653-656 (2003).
- Bernier, U. R., Kline, D. L., Allan, S. A., Barnard, D. R. Laboratory studies of Aedes aegypti attraction to ketones, sulfides, and primary chloroalkanes tested alone and in combination with L-lactic acid. Journal of the American Mosquito Control Association. 31 (1), 63-70 (2015).
- Okumu, F. O., et al. Development and field evaluation of a synthetic mosquito lure that is more attractive than humans. PloS one. 5 (1), 8951 (2010).
- Chen, Z., Liu, F., Liu, N. Human odour coding in the yellow fever mosquito, Aedes aegypti. Scientific Reports. 9 (1), 1-12 (2019).
- Hansson, B. S., Stensmyr, M. C. Evolution of insect olfaction. Neuron. 72 (5), 698-711 (2011).
- Nakagawa, T., Sakurai, T., Nishioka, T., Touhara, K. Insect sex-pheromone signals mediated by specific combinations of olfactory receptors. Science. 307 (5715), 1638-1642 (2005).
- Hallem, E. A., Carlson, J. R. Coding of odors by a receptor repertoire. Cell. 125 (1), 143-160 (2006).
- Carey, A. F., Wang, G., Su, C. Y., Zwiebel, L. J., Carlson, J. R. Odorant reception in the malaria mosquito Anopheles gambiae. Nature. 464 (7285), 66-71 (2010).
- Liu, F., Xiong, C., Liu, N. Chemoreception to aggregation pheromones in the common bed bug, Cimex lectularius. Insect Biochemistry and Molecular Biology. 82, 62-73 (2017).
- Wang, G., Carey, A. F., Carlson, J. R., Zwiebel, L. J. Molecular basis of odor coding in the malaria vector mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences. 107 (9), 4418-4423 (2010).
- Matthews, B. J., et al. Improved reference genome of Aedes aegypti informs arbovirus vector control. Nature. 563 (7732), 501-507 (2018).
- Costa, A. C., Patrick, J. W., Dani, J. A. Improved technique for studying ion channels expressed in Xenopus oocytes, including fast superfusion. Biophysical Journal. 67 (1), 395-401 (1994).
- Schreibmayer, W., Lester, H. A., Dascal, N. Voltage clamping of Xenopus laevis oocytes utilizing agarose-cushion electrodes. Pflügers Archiv. 426 (5), 453-458 (1994).
- Lu, T., et al. Odor coding in the maxillary palp of the malaria vector mosquito Anopheles gambiae. Current Biology. 17 (18), 1533-1544 (2007).
- Ditzen, M., Pellegrino, M., Vosshall, L. B. Insect odorant receptors are molecular targets of the insect repellent DEET. Science. 319 (5871), 1838-1842 (2008).
- Sato, K., et al. Insect olfactory receptors are heteromeric ligand-gated ion channels. Nature. 452 (7190), 1002-1006 (2008).
- Xia, Y., et al. The molecular and cellular basis of olfactory-driven behavior in Anopheles gambiae larvae. Proceedings of the National Academy of Sciences. 105 (17), 6433-6438 (2008).
- Bohbot, J. D., Dickens, J. C. Characterization of an enantioselective odorant receptor in the yellow fever mosquito Aedes aegypti. PLoS One. 4 (9), 7032 (2009).
- Bohbot, J. D., Dickens, J. C. Insect repellents: modulators of mosquito odorant receptor activity. PLoS One. 5 (8), 12138 (2010).
- Bohbot, J. D., Dickens, J. C. Odorant receptor modulation: ternary paradigm for mode of action of insect repellents. Neuropharmacology. 62 (5-6), 2086-2095 (2012).
- Hughes, D. T., Pelletier, J., Luetje, C. W., Leal, W. S. Odorant receptor from the southern house mosquito narrowly tuned to the oviposition attractant skatole. Journal of Chemical Ecology. 36 (8), 797-800 (2010).
- Pelletier, J., Hughes, D. T., Luetje, C. W., Leal, W. S. An odorant receptor from the southern house mosquito Culex pipiens quinquefasciatus sensitive to oviposition attractants. PloS one. 5 (4), 10090 (2010).
- Bohbot, J. D., et al. Multiple activities of insect repellents on odorant receptors in mosquitoes. Medical and Veterinary Entomology. 25 (4), 436-444 (2011).
- Bohbot, J. D., et al. Conservation of indole responsive odorant receptors in mosquitoes reveals an ancient olfactory trait. Chemical Senses. 36 (2), 149-160 (2011).
- Leal, W. S., Choo, Y. M., Xu, P., da Silva, C. S., Ueira-Vieira, C. Differential expression of olfactory genes in the southern house mosquito and insights into unique odorant receptor gene isoforms. Proceedings of the National Academy of Sciences. 110 (46), 18704-18709 (2013).
- Liu, F., Chen, Z., Liu, N. Molecular basis of olfactory chemoreception in the common bed bug, Cimex lectularius. Scientific Reports. 7, 45531 (2017).
- Choo, Y. M., et al. Reverse chemical ecology approach for the identification of an oviposition attractant for Culex quinquefasciatus. Proceedings of the National Academy of Sciences. 115 (4), 714-719 (2018).
- Ruel, D. M., Yakir, E., Bohbot, J. D. Supersensitive odorant receptor underscores pleiotropic roles of indoles in mosquito ecology. Frontiers in Cellular Neuroscience. 12, 533 (2019).
- Xu, P., Choo, Y. M., De La Rosa, A., Leal, W. S. Mosquito odorant receptor for DEET and methyl jasmonate. Proceedings of the National Academy of Sciences. 111 (46), 16592-16597 (2014).
- Xu, P., et al. Odorant inhibition in mosquito olfaction. iScience. 19, 25-38 (2019).
- Wicher, D., et al. Drosophila odorant receptors are both ligand-gated and cyclic-nucleotide-activated cation channels. Nature. 452 (7190), 1007-1011 (2008).
- DeGennaro, M., et al. orco mutant mosquitoes lose strong preference for humans and are not repelled by volatile DEET. Nature. 498 (7455), 487-491 (2013).
- Koutroumpa, F. A., et al. Heritable genome editing with CRISPR/Cas9 induces anosmia in a crop pest moth. Scientific Reports. 6, 29620 (2016).
- Schneider, P. N., Hulstrand, A. M., Houston, D. W. Fertilization of Xenopus oocytes using the Host Transfer Method. Journal of Visualized Experiments. (45), e1864 (2010).
- Missbach, C., et al. Evolution of insect olfactory receptors. ELife. 3, 02115 (2014).
- Jones, P. L., Pask, G. M., Rinker, D. C., Zwiebel, L. J. Functional agonism of insect odorant receptor ion channels. Proceedings of the National Academy of Sciences. 108 (21), 8821-8825 (2011).
- Butterwick, J. A., et al. Cryo-EM structure of the insect olfactory receptor Orco. Nature. 560 (7719), 447-452 (2018).
- Missbach, C., et al. Evolution of insect olfactory receptors. ELife. 3, 02115 (2014).
- Nakagawa, T., Touhara, K. Functional assays for insect olfactory receptors in Xenopus oocytes. Pheromone signaling. , 107-119 (2013).
- Dobritsa, A. A., Van Naters, W., Warr, C. G., Steinbrecht, R. A., Carlson, J. R. Integrating the molecular and cellular basis of odor coding in the Drosophila antenna. Neuron. 37 (5), 827-841 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved