Distillazione frazionata
Panoramica
Fonte: Laboratorio del Dr. Nicholas Leadbeater — Università del Connecticut
La distillazione è forse la tecnica di laboratorio più comune impiegata dai chimici per la purificazione dei liquidi organici. I composti in una miscela con diversi punti di ebollizione si separano in singoli componenti quando la miscela viene accuratamente distillata. I due principali tipi di distillazione sono la "distillazione semplice" e la "distillazione frazionata", ed entrambi sono ampiamente utilizzati nei laboratori di chimica organica.
La distillazione semplice viene utilizzata quando il liquido è (a) relativamente puro (contenente non più del 10% di contaminanti liquidi), (b) ha un componente non volatile, come un contaminante solido, o (c) è miscelato con un altro liquido con un punto di ebollizione che differisce di almeno 25 °C. La distillazione frazionata viene utilizzata quando si separano miscele di liquidi i cui punti di ebollizione sono più simili (separati da meno di 25 °C).
Questo video descriverà in dettaglio la distillazione frazionata di una miscela di due solventi organici comuni, cicloesano e toluene.
Principi
Per separare due o più liquidi mediante semplice distillazione, vengono prima riscaldati in un pallone. Il liquido più volatile (il liquido con il punto di ebollizione più basso) in genere evapora per primo e il vapore passerà in una colonna di condensazione, dove può tornare in un liquido (condensare) sulle pareti di vetro freddo e quindi gocciolare in un recipiente di raccolta (Figura 1).
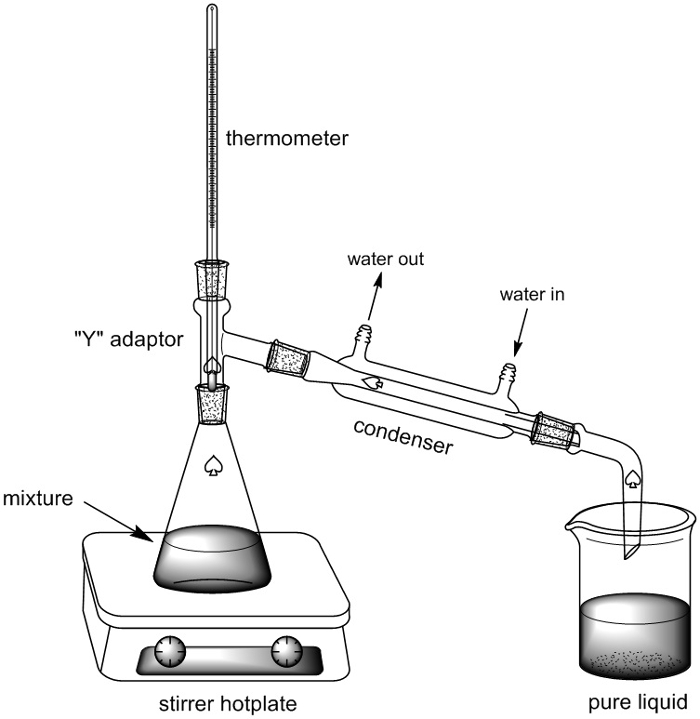
Figura 1. Apparecchi per la distillazione semplice.
Nella distillazione frazionata, una miscela di liquidi viene bollita e i vapori risultanti viaggiano su un tubo di vetro chiamato "colonna di frazionamento" e separati. La colonna di frazionamento è posta tra il pallone contenente la miscela e l'adattatore "Y" ed è solitamente riempita con perle di vetro o di plastica, il che migliora la separazione tra i liquidi da distillare. La distillazione frazionata porta a una separazione migliore rispetto alla semplice distillazione perché le perle di vetro nella colonna di frazionamento forniscono "piastre teoriche" su cui i vapori possono condensare, reevaporate e quindi ricondensere, essenzialmente distillando la miscela più e più volte. Una piastra teorica equivale a un ciclo di vaporizzazione-condensazione, che equivale a una semplice distillazione. I liquidi più volatili si sposteranno gradualmente verso la parte superiore della colonna di frazionamento, mentre i liquidi bollenti più bassi rimarranno verso il basso, dando una migliore separazione tra i liquidi. Il vapore alla fine raggiunge il condensatore, dove viene raffreddato e poi gocciola nel recipiente di raccolta.
Una curva di composizione del punto di ebollizione (Figura 2) può essere utilizzata per prevedere il numero di piastre teoriche necessarie per ottenere la separazione desiderata. I dati per la curva si ottengono prendendo miscele di composizione variabile, riscaldandole al punto di ebollizione, registrando la temperatura e analizzando la composizione del vapore sopra ogni miscela. La curva inferiore rappresenta la composizione liquida e la curva superiore rappresenta la composizione del vapore. Nel caso di questo esperimento, la miscela di partenza era il 50% di cicloesano e il 50% di toluene. Partendo dall'asse X nel punto 50:50, disegnando una linea dritta fino alla curva del liquido, poi una linea orizzontale diritta fino alla curva di vapore e poi di nuovo giù fino all'asse X, si può vedere che durante la semplice distillazione di una miscela di cicloesano al 50%: 50% di toluene, la prima goccia di distillato sarebbe composta da circa l'80% di cicloesano e il 20% di toluene.
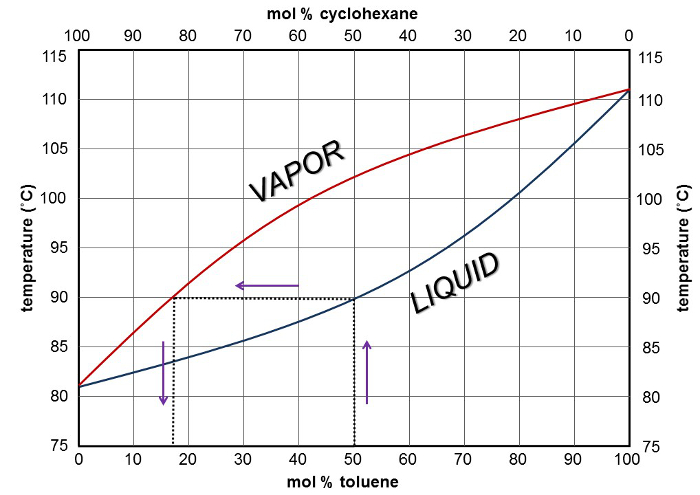
Figura 2. Curva punto di ebollizione-composizione per cicloesano e toluene che mostra una semplice distillazione.
La distillazione frazionata è fondamentalmente un numero di semplici distillazioni eseguite in sequenza, il numero è determinato dal numero di piastre teoriche. È possibile utilizzare la curva di composizione del punto di ebollizione per determinare il numero di piastre teoriche necessarie per ottenere un certo grado di separazione (Figura 3). Partendo da una miscela che è il 50% di cicloesano e il 50% di toluene, una colonna di frazionamento con un'efficienza pari a due piastre teoriche si tradurrebbe in un distillato che è al 95% cicloesano puro. Una terza piastra teorica risulterebbe in distillato che è circa il 99% di cicloesano puro. Tuttavia, in pratica, la situazione non è così semplice. Man mano che la distillazione procede e la miscela nel pallone di distillazione diventa sempre più arricchita di toluene - essenzialmente, risultando in una nuova miscela di partenza che si trova più a destra sulla curva di composizione del liquido. Per ottenere cicloesano puro, sono necessarie più piastre teoriche, ma l'efficienza della colonna di frazionamento è fissa, e quindi si raggiunge un punto in cui non può più fornire il grado di separazione richiesto, con conseguente distillato che contiene più tracce contaminanti di toluene.
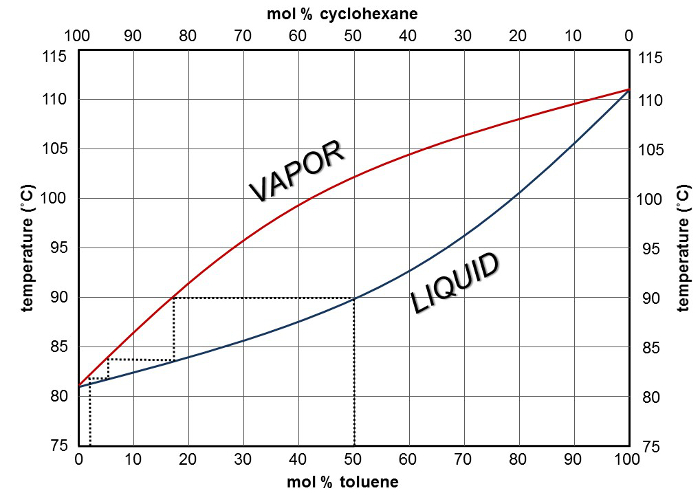
Figura 3. Curva punto di ebollizione-composizione per cicloesano e toluene che mostra tre piastre teoriche.
Una curva di distillazione, che traccia la temperatura rispetto al volume del distillato, è mostrata nella Figura 4. La distillazione avviene inizialmente a circa 82 °C, il punto di ebollizione del cicloesano. La temperatura relativamente stabile mostra che il materiale quasi puro sta distillando durante questo periodo. La temperatura sale quindi e raggiunge un altro plateau intorno ai 110 °C, il punto di ebollizione del toluene. Tra i due plateau la temperatura sale gradualmente, non istantaneamente. Ricordiamo che man mano che la distillazione procede e il cicloesano viene rimosso, sono necessarie piastre più teoriche per ottenere la purezza desiderata. Ad un certo punto la colonna di frazionamento è al suo numero massimo di piastre e non può più separare efficacemente la miscela, il che significa che ci sarà distillato contenente sia il cicloesano che il toluene. Una volta distillato tutto il cicloesano, tuttavia, il toluene puro inizia a distillare come evidenziato dal secondo plateau di temperatura. Per ottenere la distillazione ottimale, la velocità di distillazione deve essere costante e relativamente lenta.

Figura 4. Curva di distillazione frazionata per cicloesano e toluene.
Procedura
1. Installazione di un apparecchio di distillazione frazionata
| Apparecchi di distillazione frazionata | Quantità |
| Supporti per storte (supporti ad anello) | 2 |
| Martinetto a vite | 1 |
| Morsetti | 4 |
| Morsetti Keck | 4 |
| Barra di agitazione magnetica | 1 |
| Colonna di frazionamento | 1 |
| Adattatore "Y" | 1 |
| Adattatore per termometro e termometro | 1 |
| Pallone a fondo tondo da 100 mL | 1 |
| Condensatore con tubi di ingresso e uscita acqua | 1 |
| Adattatore di raccolta | 1 |
| Cilindri graduati da 25 mL | 3 |
| Mantello riscaldante | 1 |
| Mescolare la piastra | 1 |
Tabella 1. Componenti dell'apparato di distillazione frazionata.
Nota: tutti gli articoli in vetro, ad eccezione dei cilindri graduati, devono avere giunti in vetro sdenato
- Raccogliere tutte le attrezzature necessarie per assemblare l'apparato di distillazione frazionata (Tabella 1) e metterle in una cappa aspirante.
- Posizionare il mantello riscaldante e mescolare la piastra ai piedi del supporto di storta, seduto sopra un martinetto a vite.
- Utilizzando il martinetto a vite, elevare il mantello riscaldante ad un'altezza di 20 cm.
- Attaccare un morsetto sul supporto di storta. Fissare il pallone a fondo tondo al supporto di storta usando il morsetto in modo che il pallone si trovi rannicchiatamente nel mantello riscaldante.
- Rimuovere il martinetto a vite e il mantello riscaldante, mettendoli da parte per dopo.
- Aggiungere una barra magnetica al pallone a fondo tondo.
- Aggiungere una colonna di frazionamento nella parte superiore del pallone a fondo tondo, fissandolo al supporto di storta con un morsetto.
- Aggiungere un adattatore a "Y" nella parte superiore della colonna di frazionamento, fissandolo al supporto di storta con un morsetto e alla colonna di frazionamento con una clip Keck.
- Aggiungere una colonna di condensazione al braccio inclinato verso il basso dell'adattatore a "Y", fissandolo con una clip Keck. Per una maggiore stabilità, il condensatore può essere fissato con un morsetto a un secondo supporto di storta.
- Collegare il tubo dalla fonte d'acqua alla connessione inferiore sul condensatore e collegare il tubo di ritorno dell'acqua alla connessione superiore sul condensatore. Assicurarsi che il tubo sia saldamente montato sul condensatore (considerare l'utilizzo di filo di rame per mantenere il tubo in posizione).
- Collegare un adattatore di raccolta all'estremità aperta del condensatore e fissare il collegamento con una clip Keck.
- Avere a disposizione tre cilindri graduati da 25 ml per la raccolta del distillato.

Figura 5. Apparecchi per distillazione frazionata.
2. Preparazione per la distillazione
- Rimuovere il pallone a fondo tondo dal gruppo abbassandolo alla base del supporto di storta.
- Posizionare un imbuto a stelo nella parte superiore del matraccio a fondo tondo e aggiungere il liquido da distillare. Non riempire il pallone più della metà pieno.
- Dopo aver riempito il pallone, rimuovere l'imbuto.
- Sollevare nuovamente il pallone e rimettere il pallone nella sua posizione originale sul supporto di storta.
- Utilizzando l'adattatore per termometro, posizionare il termometro nella porta aperta rimanente sull'adattatore a "Y". Il termometro dovrebbe essere aggiunto per ultimo, in quanto è più suscettibile alla rottura.
- Posizionare la lampadina del termometro in modo che si trova appena sotto il braccio laterale dell'adattatore a "Y". Ciò garantisce una lettura accurata della temperatura del vapore.
- Sostituire il mantello riscaldante e il martinetto a vite nella loro posizione originale, avvolgendo avvolgendo il pallone a fondo tondo.
- Posizionare un cilindro graduato sotto l'adattatore del condensatore, pronto per raccogliere il distillato.
3. Esecuzione della distillazione
- Aumentare gradualmente la temperatura del mantello riscaldante fino a quando il liquido nel pallone a fondo tondo inizia a bollire.
- Non appena inizia l'ebollizione, tenere la temperatura per 2 minuti.
- Si noti l'anello di condensa che sale lentamente sulla colonna di frazionamento. L'aumento dovrebbe essere graduale, il che garantisce una corretta separazione dei componenti della miscela attraverso le piastre teoriche. Se l'anello di condensa smette di salire, aumentare leggermente la temperatura. Dovrebbero essere necessari almeno 5 minuti prima che l'anello raggiunga la parte superiore della colonna.
- Una volta che le prime gocce di liquido iniziano a cadere nel condensatore, la temperatura dovrebbe rimanere quasi costante. Registrare la temperatura man mano che ogni 2 mL di distillato si raccoglie nel cilindro graduato.
- Regolare il calore di conseguenza per consentire 1-2 gocce/s dal condensatore al cilindro graduato.
- Ogni volta che il cilindro graduato raggiunge i 4 ml, sostituirlo rapidamente con uno vuoto.
- Versare il distillato in un flaconcino pulito ed etichettato per la custodia.
- Se la distillazione avviene molto lentamente, avvolgere la colonna con un foglio di alluminio o lana di vetro per proteggerla dalle correnti d'aria fredde.
- Quando la temperatura inizia a scendere in modo significativo, quasi tutto il cicloesano è stato distillato. Aumentare la temperatura fino a quando il toluene inizia a bollire e distillare. Ancora una volta, registrare la temperatura man mano che ogni 2 ml di distillato si raccoglie.
- Prima che l'intero contenuto del pallone evapori, interrompere il riscaldamento del pallone. È importante assicurarsi che il pallone non si asciughi, il che potrebbe causarne la rottura.
- Rimuovere il mantello riscaldante abbassando il martinetto a vite alla base del supporto di storta
- Analizzare il contenuto delle fiale di distillato per confermare la purezza utilizzando una tecnica scelta, come la spettroscopia NMR 1H.
Risultati
Distillazione frazionata di una miscela cicloesano-toluene
La purezza del distillato può essere valutata con una serie di tecniche. Uno dei migliori è la spettroscopia NMR. Lo spettro 1H-NMR della miscela iniziale prima della distillazione è mostrato nella Figura 6. I segnali sia per il toluene che per il cicloesano sono chiaramente visibili. 1 Gli spettri HNMR dei distillati di cicloesano puro e toluene puro sono mostrati rispettivamente nelle figure 7 e 8. In ogni caso non si vedono contaminanti dell'altro componente, mostrando l'efficacia della distillazione.
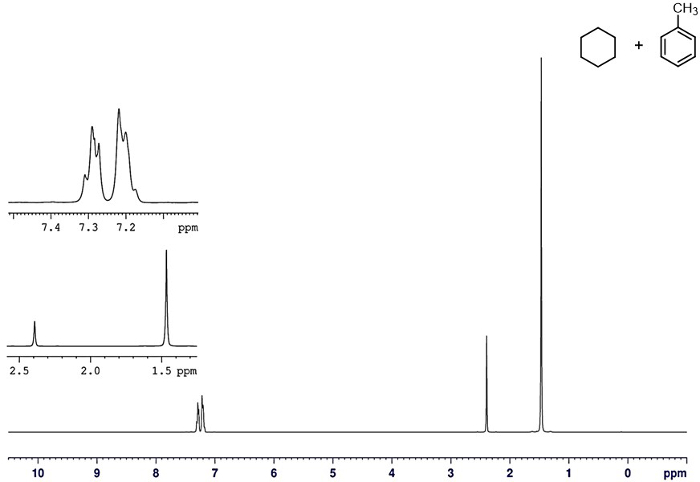
Figura 6. 1 H-NMR di una miscela di cicloesano e toluene prima della distillazione.
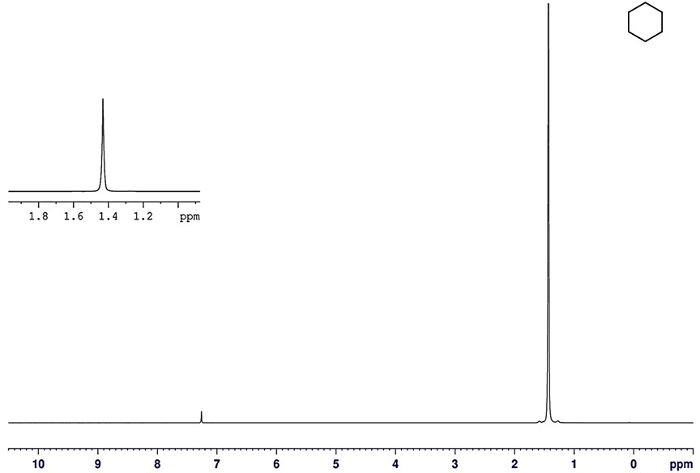
Figura 7. 1 H-NMR del distillato di cicloesano puro.
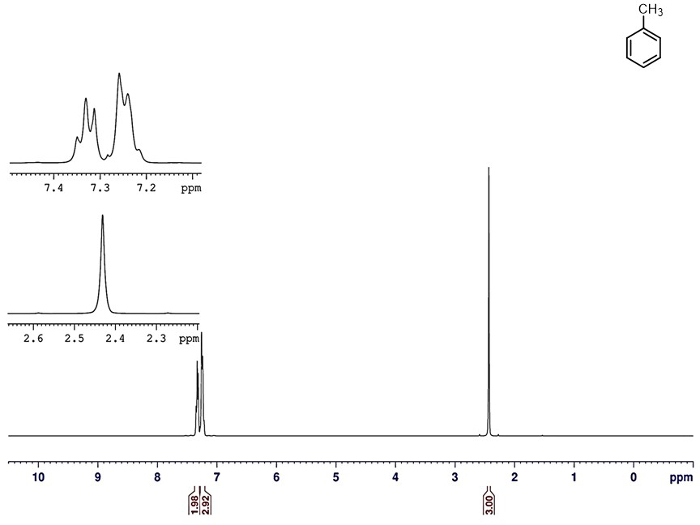
Figura 8. 1 H-NMR del distillato di toluene puro.
Applicazione e Riepilogo
La distillazione rappresenta circa il 95 % di tutti gli attuali processi di separazione industriale. La principale differenza tra le distillazioni eseguite su scala di laboratorio e quelle eseguite industrialmente è che le prime sono solitamente eseguite in modo batch-wise, mentre le ultime sono spesso eseguite continuamente. Nella distillazione continua, la miscela di partenza, i vapori e il distillato vengono mantenuti a una composizione costante reintegrando accuratamente il materiale fissante e rimuovendo le frazioni sia dal vapore che dal liquido nel sistema. L'applicazione industriale più utilizzata della distillazione continua e frazionata è nelle raffinerie di petrolio e negli impianti di trattamento del gas naturale. A temperature inferiori a 36 °C, il gas naturale si separa dal petrolio. Altre sostanze, tra cui l'etere di petrolio e la nafta, si separano prima che il petrolio raggiunga l'intervallo 69-74 ° C, a quel punto la benzina si separa.
La distillazione trova applicazione anche nell'industria alimentare. Viene utilizzato per produrre un'ampia varietà di bevande alcoliche, ad esempio whisky, rum e brandy. Quando i materiali da frutto e vegetali fermentano, viene prodotta una soluzione diluita di etanolo. Distillare il materiale fermentato purifica e concentra l'etanolo. Una varietà di altri componenti, come esteri profumati e altri tipi di alcol, vengono anche raccolti durante il processo di distillazione, che spiega il sapore unico dello spirito finito.
Vai a...
Video da questa raccolta:

Now Playing
Distillazione frazionata
Organic Chemistry
334.5K Visualizzazioni

Introduzione alla catalisi
Organic Chemistry
34.5K Visualizzazioni

Assemblaggio di un sistema a riflusso per reazioni chimiche riscaldate
Organic Chemistry
167.5K Visualizzazioni

Esecuzione di reazioni al di sotto della temperatura ambiente
Organic Chemistry
70.7K Visualizzazioni

Trasferimento di solventi tramite linea Schlenk
Organic Chemistry
41.6K Visualizzazioni

Degasaggio di liquidi con ciclo freeze-pump-thaw
Organic Chemistry
56.1K Visualizzazioni

Preparazione di reagenti anidri e relativa strumentazione
Organic Chemistry
79.4K Visualizzazioni

Purificazione di composti tramite ricristallizzazione
Organic Chemistry
708.7K Visualizzazioni

Separazione di miscele tramite precipitazione
Organic Chemistry
157.8K Visualizzazioni

Estrazione solido-liquido (lisciviazione)
Organic Chemistry
237.8K Visualizzazioni

Rimozione dei solventi con evaporatore rotante
Organic Chemistry
212.9K Visualizzazioni

Preparazione di cristalli per l'analisi mediante diffrazione dei raggi X
Organic Chemistry
32.4K Visualizzazioni

Performing 1D Thin Layer Chromatography
Organic Chemistry
289.8K Visualizzazioni

Cromatografia su colonna
Organic Chemistry
360.2K Visualizzazioni

Spettroscopia a risonanza magnetica nucleare (NMR)
Organic Chemistry
247.9K Visualizzazioni