Paddlewheel a quadruplo legame metallo-metallo
Panoramica
Fonte: Corey Burns, Tamara M. Powers, Dipartimento di Chimica, Texas A & M University
I complessi di ruote a pale sono una classe di composti composta da due ioni metallici (1°,2°o 3° fila metalli di transizione) tenuti in prossimità da quattro ligandi ponte (più comunemente formamidinati o carbossilati) (Figura 1). Variando l'identità dello ione metallico e del ligando ponte si accede a grandi famiglie di complessi di ruote a pale. La struttura dei complessi di ruote a pale consente l'incollaggio metallo-metallo, che svolge un ruolo vitale nella struttura e nella reattività di questi complessi. A causa della diversità delle strutture elettroniche disponibili per i complessi di ruote a pale - e delle corrispondenti differenze nell'incollaggio M-M visualizzate da queste strutture - i complessi di ruote a pale hanno trovato applicazione in diverse aree, come nella catalisi omogenea e come elementi costitutivi per strutture metallo-organiche (MOF). Comprendere la struttura elettronica dei legami M-M nei complessi di ruote a pale è fondamentale per comprendere le loro strutture e quindi per l'applicazione di questi complessi nella chimica di coordinazione e nella catalisi.

Figura 1. Struttura generale dei complessi di ruote a pale, dove M può essere un metallo di transizione 1°,2 °o 3° fila.
Quando due metalli di transizione sono tenuti in prossimità, gli orbitali dsi sovrappongono, il che può provocare la formazione di legami M-M. Gli orbitali d sovrappostipossono formare tre tipi di legami - σ, π e δ - a seconda della simmetria degli orbitali coinvolti. Se assegniamo l'asse z molecolare come complanare con il legame M-M, un legame σ è formato dalla sovrapposizione degli orbitali dz2 e i legami π sono formati dalla sovrapposizione degli orbitali dxz e dyz. δ legami sono generati dalla sovrapposizione di d-orbitaliche hanno due nodi planari (dxy e dx2–y2). Di conseguenza, tutti e quattro i lobi dell'orbitale dsi sovrappongono e il corrispondente legame δ ha due nodi planari (Figura 2). In teoria, con l'aggiunta di legami δ, i complessi della ruota a pale sono in grado di supportare legami quintupli o cinque legami tra atomi di metallo. 1 Nella maggior parte dei complessi, il dx2–y2 forma forti legami metallo-ligando e non contribuisce in modo significativo al legame M-M. Pertanto, i legami quadrupli sono l'ordine massimo di legame in molti complessi.
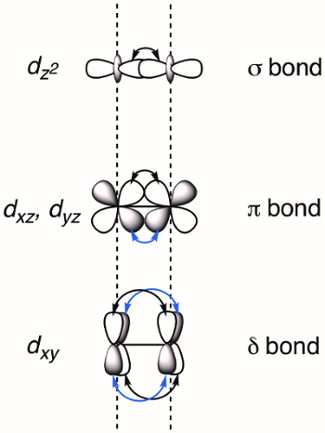
Figura 2. Rappresentazione visiva di σ, π e δ MO di legame risultanti dalla combinazione lineare di orbitali dmetallici. Gli orbitali atomici dz2 hanno la migliore sovrapposizione spaziale, seguiti dagli orbitali dxz e dyz. Gli orbitali atomici dxy hanno la minor quantità di sovrapposizione spaziale.
In questo video, sintetizzaremo il complesso di ruota a pale di dimolybdenumMo 2(ArNC(H)NAr)4, dove Ar = p-(MeO) C6H4, che presenta un legame quadruplo. Caratterizzeremo il composto mediante spettroscopia NMR e utilizzeremo la cristallografia a raggi X per studiare il legame M-M.
Principi
Iniziamo costruendo un diagramma MO del legame M-M all'interno del complesso generale di dimolybdenum Mo2(ArNC(H)NAr)4. In primo luogo, dobbiamo definire i nostri assi. Assumendo la massima simmetria disponibile,Mo 2(ArNC(H)NAr)4 è nel gruppo di punti D4h (Figura 3). L'asse z è per definizione assegnato all'asse con la più alta simmetria rotazionale (asse primario), che in questo caso è un asse di rotazione C4 che si trova lungo il legame Mo-Mo. Per convenzione, gli assi x e y si trovano lungo i legami M-L; nel nostro caso specifico, questo significa che gli assi x e y sono collineari con i vettori Mo-N. Secondo le nostre assegnazioni degli assi, l'orbitale dx2–y2 su ciascun atomo di Mo è coinvolto nel legame metallo-ligando. Ciò lascia gli orbitali dxy, dxz, dyze dz2 per il legame M-M.
Il diagramma MO che descrive il legame M-M in Mo2(ArNC(H)NAr)4 è mostrato in Figura 4. La combinazione lineare dell'orbitale dz2 su ciascun atomo M si traduce in σ e σ* MO. Gli orbitali dxz e dyz formano π e π* MO. Infine, la combinazione lineare degli orbitali atomici dxy dà origine alla δ e δ* MO. Il legame δ presenta la minima quantità di sovrapposizione spaziale tra gli orbitali atomici e, di conseguenza, l'energia relativa degli orbitali di legame è σ < π < δ (Figura 2). Ciò corrisponde alle forze di legame, in cui un legame σ è più forte di un legame π, che è più forte di un legame δ. Riempiamo gli MO corrispondenti con il numero totale di d e- per entrambi i centri Mo, che è 8 (Mo2+, d4). Questo porta ad un ordine di legame di 4, che è coerente con un legame quadruplo.
In questo video, useremo la cristallografia a raggi X per osservare la lunghezza del legame Mo-Mo nel complessoMo 2(ArNC(H)NAr)4. Con la distanza del legame Mo-Mo dalla struttura dello stato solido, possiamo trovare il rapporto di shortness formale (FSR), che è il valore normalizzato del legame M-M. L'FSR è calcolato per un legame A-B usando l'equazione 1, che è semplicemente il rapporto tra la distanza di legame osservata allo stato solido (DA-B) e la somma dei raggi atomici (  e ) dei
e ) dei  singoli atomi.
singoli atomi.
 (1)
(1)
Il valore FSR è normalizzato per il raggio atomico e quindi fornisce un modo rapido e conveniente per confrontare le distanze di legame M-M, non solo tra diversi tipi di metallo, ma anche per legare distanze tra atomi non metallici.
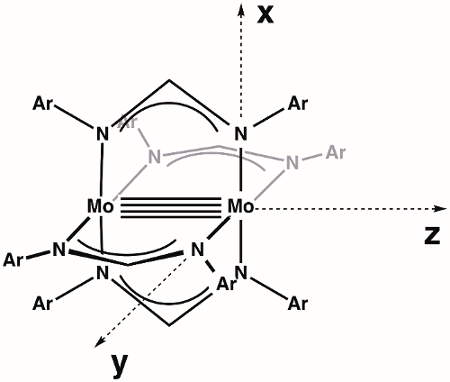
Figura 3. Assi definiti per la molecola Mo2(ArNC(H)NAr)4, assumendo la massima simmetria (D4h).

Figura 4. Diagramma MO del legame M-M in Mo2(ArNC(H)NAr)4.
Procedura
1. Sintesi del ligando ArN(H)C(H)NAr, dove Ar = p-(MeO)C6H4 (Figura 5)2
- Unire 6,0 g (0,050 mol) di p-anisidina e 4,2 mL (0,025 mol) di trietilortoformio in un matraccio a fondo tondo da 100 mL con una barra magnetica.
- Attaccare una testa di distillazione al pallone di reazione.
- Mescolando, riscaldare la reazione in bagno d'olio al reflusso (120 °C). Una volta raggiunto il reflusso, l'etanolo sottoprodotto dovrebbe iniziare a distillarsi dalla reazione. Raccogliere l'etanolo in un becher posto all'estremità della testa di distillazione.
- Riscaldare la reazione fino a quando la distillazione dell'etanolo cessa (almeno 1,5 ore).
- Togliere il matraccio dal bagno d'olio e lasciare raffreddare la miscela di reazione a temperatura ambiente. Dovrebbe formarsi un precipitato. Se il prodotto non precipita, posizionare il pallone in un bagno di ghiaccio e graffiare il fondo del pallone con una spatola per favorire la cristallizzazione.
- Ricristallizzare il prodotto da una quantità minima di toluene bollente (per una procedura più dettagliata, si prega di rivedere il video "Purifying Compounds by Recrystallization" nella serie Essentials of Organic Chemistry).
- Raccogliere il prodotto per filtrazione attraverso un imbuto fritto e lavare con 10 ml di esani.
- Isolare il prodotto bianco e lasciarlo asciugare all'aria.
- Raccogliere una NMR di 1H del solido utilizzando CDCl3.

Figura 5. Sintesi di ArN(H)C(H)NAr, dove Ar = p-MeOC6H4.
2. Configurazione della linea Schlenk
NOTA: Per una procedura più dettagliata, consultare il video "Schlenk Lines Transfer of Solvent" nella serie Essentials of Organic Chemistry. La sicurezza della linea Schlenk deve essere rivista prima di condurre questo esperimento. La vetreria deve essere ispezionata per le crepe delle stelle prima dell'uso. Prestare attenzione per assicurarsi che O2 non sia condensato nella trappola della linea di Schlenk se si utilizza N2liquido . A temperatura N2 liquida, O2 condensa ed è esplosivo in presenza di solventi organici. Se si sospetta che O2 sia stato condensato o che si osservi un liquido blu nella trappola fredda, lasciare la trappola fredda sotto vuoto dinamico. NON rimuovere la trappola N2 liquida o spegnere la pompa per vuoto. Nel tempo il liquido O2 sublima nella pompa; è sicuro rimuovere latrappola N 2 liquida solo una volta che tutto l'O2 è sublimare.
- Chiudere la valvola di rilascio della pressione.
- Accendere il gas N2 e la pompa per vuoto.
- Quando il vuoto della linea Schlenk raggiunge la sua pressione minima, preparare la trappola fredda con N2 liquido o ghiaccio secco/acetone.
- Assemblare la trappola fredda.
3. Sintesi di Mo2(ArNC(H)NAr)4 (Figura 6)2
ATTENZIONE: La fonte di molibdeno utilizzata nella sintesi di Mo2(ArNC(H)NAr)4 è Mo(CO)6, che è altamente tossico e può essere fatale se inalato, assorbito attraverso la pelle o ingerito. Il CO viene generato durante la reazione. Pertanto, la sintesi deve essere condotta in una cappa ben ventilata.
- Utilizzare tecniche standard di linea Schlenk per la sintesi diMo 2(ArNC(H)NAr)4 (vedere il video "Synthesis of a Ti(III) Metallocene Using Schlenk line Technique").
- Aggiungere 0,34 g (1,3 mmol) di Mo(CO)6 e 1,0 g (3,9 mmol) di ArN(H)C(H)NAr in un matraccio Schlenk da 100 mL e preparare il matraccio Schlenk per il trasferimento del solvente con cannula.
- Aggiungere 20 mL di o-diclorobenzene degassato al matraccio schlenk mediante trasferimento di cannula.
- Montare il pallone Schlenk con un condensatore collegato alla linea del gas N2.
- Reflusso la reazione per 2 ore (180 °C) in un bagno di olio di silicone.
NOTA: Mo(CO)6 è volatile e si condensa sui lati del pallone Schlenk durante la reazione. Per ottenere rese più elevate, sciogliere periodicamente qualsiasi Mo(CO)6 sublimentato estraendo il matraccio dal bagno d'olio e facendo roteare delicatamente il solvente nel pallone. - Togliere il matraccio Schlenk dal bagno d'olio e lasciare raffreddare la miscela a temperatura ambiente.
- Filtrare la soluzione marrone attraverso un imbuto fritto e lavare il precipitato giallo con 10 ml di esani, seguito da 5 ml di acetone di grado reagente. Il Mo2(ArNC(H)NAr)4 si decompone lentamente in soluzione quando O2 è presente. Pertanto, la filtrazione deve essere eseguita prontamente una volta rimossa la reazione da N2.
- Raccogliere il giallo solido Mo2(ArNC(H)NAr)4 e lasciarlo asciugare all'aria.
- Utilizzando CDCl3 misurare lo spettro NMR 1H del prodotto.

Figura 6. Sintesi di Mo2(ArNC(H)NAr)4, dove Ar = p-MeOC6H4.
4. Crescita a cristallo singolo
NOTA: Mo2(ArNC(H)NAr)4 si ossida lentamente in soluzione. Il solvente di cristallizzazione deve essere degassato prima dell'uso, ma non sono necessarie rigorose condizioni di cancellazione dell'aria per ottenere cristalli di qualità a raggi X per la diffrazione a raggi X a cristallo singolo.
- Degas 10 mL di diclorometano (CH2Cl2) facendo gorgogliare il gas N2 attraverso la soluzione per 10 minuti (vedere il video "Sintesi di un metallocene Ti(III) utilizzando la tecnica della linea Schlenk" per una procedura più dettagliata sullo spurgo dei liquidi).
- Fare una soluzione satura diMo 2(ArNC(H)NAr)4 sciogliendo 20 mg del solido in 2 ml di CH2Cl2degassato .
- Crea un tappo Celite per pipetta inserendo un piccolo pezzo di Kimwipe in una pipetta. Aggiungere una piccola quantità di Celite alla pipetta.
- Filtrare la soluzione CH2Cl2 attraverso il tappo Celite della pipetta in un piccolo flaconcino da 5 ml. Aiuta a spingere la soluzione attraverso il Celite usando una lampadina a pipetta.
- Utilizzando una pinzetta, inserire il flaconcino da 5 mL in un flaconcino a scintillazione da 10 mL.
- Nel flaconcino di scintillazione esterno, aggiungere 2 ml di esani.
- Tappare saldamente il flaconcino di scintillazione e posizionarlo su uno scaffale dove sarà indisturbato.
- Consentire almeno 24 ore per la crescita di singoli cristalli (vedere il video "Cristallografia a raggi X" nella serie Essentials of Organic Chemistry per una procedura più dettagliata su come coltivare singoli cristalli).
- Raccogliere i dati a raggi X a cristallo singolo sul campione (vedere il video "Diffrazione a raggi X a cristallo singolo e polvere" per una procedura più dettagliata su come raccogliere i dati a raggi X).
Risultati
Ligando ArN(H)C(H)NAr
Resa: 3,25 g (53%). 1 H NMR (cloroformio-d, 500 MHz, δ, ppm): 8,06 (s, 1H, NHC-HN), 6,99 (d, 4H, aromatico C-H, J = 8,7 Hz), 6,86 (d, 4H, aromatico C-H, J = 9,0 Hz), 3,80 (s, 6H, -OCH3).
Complesso MoMo 2(ArNC(H)NAr)4
Resa: 450 mg (57%). 1 H NMR (cloroformio-d, 500 MHz, δ, ppm): 8.38 (s, 4H, NHC-HN), 6.51 (d, 16H, aromatico C-H, J = 8.8 Hz), 6.16 (d, 16H, aromatico C-H, J = 8.8 Hz), 3.71 (s, 24H, -OCH3).
Tabella 1. Dati del cristallo e parametri delle celle unitarie
| Formula empirica | C60H70Mo2N8O8 |
| Peso della formula (g/mol) | 1223.12 |
| Temperatura (K) | 296.15 |
| Sistema a cristalli | triclino |
| Gruppo spaziale | P-1 |
| a (Å) | 10.1446(4) |
| b (Å) | 10.3351(4) |
| c (Å) | 13.9623(6) |
| α (°) | 80.151(2) |
| β (°) | 75.251(2) |
| γ (°) | 82.226(2) |
| Volume (Å3) | 1388.3(1) |
Lo spettro NMR 1H diMo 2(ArNC(H)NAr)4 presenta due segnali nella regione aromatica, che è coerente con la 4-foldsymmetry. La struttura a stato solido (Figura 7) è coerente con il gruppo di punti D4 e presenta un legame Mo-Mo corto (2.0925(3) Å). I raggi atomici di Mo sono 1,45 Å. Pertanto, usando l'equazione 1, il valore FSR per il legame M-M inMo 2(ArNC(H)NAr)4 è 0,72. Questo valore è inferiore a quello osservato per il complesso Mo-Mo quadruplicato legato Mo(hpp)4 (hpp = 1,3,4,6,7,8-esaidro-2 H-pirimido[1,2-a]pirimidinato), che ha un valore FSR di 0,797, ed è coerente con la presenza di un legame quadruplo M-M3.
Figura 7. Struttura a stato solido per Mo2(ArNC(H)NAr)4 con gli ellissoidi termici impostati al livello di probabilità del 50%. Gli atomi di idrogeno sono omessi per chiarezza (Mo navy, N blu, C grigio).
Applicazione e Riepilogo
In questo video, abbiamo imparato a conoscere l'incollaggio M-M. Abbiamo sintetizzato un complesso di molibdeno dinucleare caratterizzato da un legame quadruplo. Le obbligazioni quadruple sono costituite da tre diversi tipi di obbligazioni, tra cui obbligazioni σ, π e δ. Abbiamo raccolto dati di diffrazione a raggi X a cristallo singolo e osservato una breve lunghezza del legame Mo-Mo coerente con un composto quadruplicato.
I complessi di ruote a pale, come il complesso Mo2 preparato qui, mostrano una vasta gamma di proprietà e quindi trovano applicazione in diverse aree della chimica. Ad esempio, i legami M-M svolgono un ruolo importante nella catalisi: il complesso della ruota a pale di dirodio Rh2(OAc)4 è un noto catalizzatore per la funzionalizzazione del legame C-H tramite reazioni di trasferimento di carbene e nitrene (Figura 8). In una tipica reazione di trasferimento del carbene, Rh2(OAc)4 reagisce con un composto diazo per generare un intermedio di carbene Rh2. Il successivo inserimento del carbene in un legame C-H genera il prodotto della funzionalizzazione C-H e rigenera il catalizzatore Rh2(OAc)4. L'eccezionale reattività dei catalizzatori Rh2 in queste reazioni è stata attribuita all'interazione Rh-Rh attraverso il legame M-M. Il legame Rh-Rh nell'intermedio risultante agisce come un serbatoio di elettroni; mentre un metallo funge da sito di legame per il substrato, il secondo centro metallico trasporta la densità elettronica da e verso il centro metallico attivo durante l'attivazione del substrato. Il diagramma di scissione d-orbitaledel complesso intermedio (nucleo Rh-Rh legato al carbenoide) mostra che gli orbitali ddi frontiera non sono leganti rispetto al centro Rh attivo ( Figura9a). La densità elettronica sia nel σ che π MO non leganti è centrata sul carbonio carbenoide nucleofilo e sul centro Rh "spettatore", che non è direttamente legato all'unità carbenoide (Figura 9b)4.
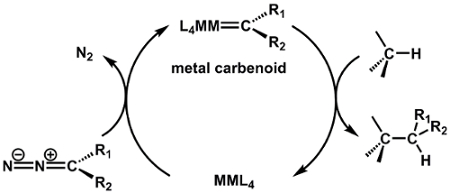
Figura 8. Funzionalizzazione del legame C-H tramite un intermedio metallo-carbenoide.

Figura 9. (a) d-diagramma di scissione orbitale MO del nucleo Rh-Rh in complessi di ruote a pale legate a un substrato carbenoide. Si noti che vengono mostrati solo gli orbitali coinvolti nel legame del substrato. b)Le σ risultanti e π le MO non leganti sono piene di elettroni. La densità elettronica in questi MO è centrata sul carbonio carbenoide e sul centro Rh "spettatore".
I complessi di paddlewheel sono stati utilizzati anche come elementi costitutivi nei MOF. I MOF sono polimeri di coordinazione porosi costituiti da complessi metallici collegati tra loro da ligandi organici. Le sovrastrutture monodimensionali, bidimensionali o tridimensionali risultanti possono essere utilizzate in una varietà di applicazioni che vanno dall'assorbimento di gas (compresa la separazione e la purificazione) alla catalisi.
Vai a...
Video da questa raccolta:

Now Playing
Paddlewheel a quadruplo legame metallo-metallo
Inorganic Chemistry
15.3K Visualizzazioni

Sintesi di un Ti(III) metallocene utilizzando la tecnica della linea Schlenk
Inorganic Chemistry
31.6K Visualizzazioni

Scatola a guanti (Glove Box) e sensori di impurezze
Inorganic Chemistry
18.7K Visualizzazioni

Purificazione del ferrocene per sublimazione
Inorganic Chemistry
54.7K Visualizzazioni

Il metodo di Evans
Inorganic Chemistry
68.7K Visualizzazioni

Diffrazione a raggi X su cristallo singolo e su polveri
Inorganic Chemistry
105.1K Visualizzazioni

Spettroscopia di risonanza paramagnetica elettronica (EPR)
Inorganic Chemistry
25.6K Visualizzazioni

Spettroscopia Mössbauer
Inorganic Chemistry
22.0K Visualizzazioni

Interazione acido-base di Lewis in Ph3P-BH3
Inorganic Chemistry
39.0K Visualizzazioni

Struttura del ferrocene
Inorganic Chemistry
79.7K Visualizzazioni

Applicazione della teoria dei gruppi nella spettroscopia infrarossa
Inorganic Chemistry
45.8K Visualizzazioni

Teoria degli orbitali molecolari
Inorganic Chemistry
35.5K Visualizzazioni

Celle di Grätzel (Dye-sensitized Solar Cells)
Inorganic Chemistry
16.0K Visualizzazioni

Sintesi di un complesso di cobalto (II) legato ad ossigeno
Inorganic Chemistry
51.7K Visualizzazioni

Inizio fotochimico di una reazione di polimerizzazione radicalica
Inorganic Chemistry
17.1K Visualizzazioni