Method Article
שיטה פשוטה ויעילה לבדיקת חומרים אימונומודולטוריים ליצירת תאים דנדריטיים טולרוגניים ממונוציטים CD14+ אנושיים
In This Article
Summary
אנו מתארים הליך להערכת היכולת של חומרים פרמקולוגיים לייצר תאים דנדריטיים טולרוגניים מתאים דנדריטיים נאיביים שמקורם במונוציטים במבחנה ולאמת את עוצמתם על ידי יצירת תאי T רגולטוריים אוטולוגיים.
Abstract
תאים דנדריטיים טולרוגניים (tolDCs) הם תת-קבוצה של תאים דנדריטיים (DCs) הידועים כמשפיעים על תאי T נאיביים לעבר פנוטיפ תאי T רגולטוריים (Treg). TolDCs נחקרים כיום כטיפולים לאוטואימוניות והשתלה, הן כטיפול תאי והן כשיטה לגרימת tolDCs מ-DCs אנדוגניים. עם זאת, עד כה, מספר התרופות הידועות לגרימת tolDCs מ-DCs נאיביים הוא קטן יחסית ועוצמתם ליצור Tregs in vivo לא הייתה עקבית, במיוחד טיפולים הגורמים ל-tolDCs מ-DCs אנדוגניים. זה מספק הזדמנות לחקור תרכובות חדשות ליצירת סובלנות.
כאן אנו מתארים שיטה לבדיקת תרכובות אימונומודולטוריות חדשות על DCs שמקורם במונוציטים (moDCs) במבחנה ומאמתים את הפונקציונליות שלהם ליצירת Tregs אוטולוגיים. ראשית, אנו משיגים PBMCs ומבודדים מונוציטים CD14+ ותאי CD3+ T באמצעות ערכות הפרדה מגנטיות זמינות מסחרית. לאחר מכן, אנו מבדילים מונוציטים ל-moDCs, מטפלים בהם עם אימונומודולטור מבוסס, כגון רפמיצין, דקסמתזון, IL-10 או ויטמין D3, למשך 24 שעות ובודקים את השינוי שלהם בסמנים טולרוגניים כאימות של הפרוטוקול. לבסוף, אנו מתרבתים במשותף את ה-tolDCs המושרים עם תאי T אוטולוגיים בנוכחות גירוי אנטי-CD3/CD28 וצופים בשינויים באוכלוסיות Treg ובהתפשטות תאי T. אנו צופים שימוש בפרוטוקול זה כדי להעריך את יעילותם של סוכנים אימונומודולטוריים חדשים לתכנת מחדש DCs שכבר מובחנים לקראת tolDC.
Introduction
תאים דנדריטיים (DCs) הם מתווכים קריטיים בין חסינות מולדת לנרכשת. DCs, השוכנים בעיקר בריריות, בעור וברקמת הלימפה, הם התאים המציגים אנטיגן (APCs) העיקריים1. DCs קולטים חלבונים זרים ומעבדים ומציגים אותם על חלבוני תאימות היסטולוגית עיקרית (MHC) לתאי T נאיביים. DCs מבטאים באופן ספציפי חלבוני MHC Class II, כגון אנטיגן לויקוציטים אנושיים-DR-DR (HLA-DR) בבני אדם. מצב ההפעלה של ה-DCs עם חשיפה לאנטיגן הוא קריטי לתגובת תאי T במורד הזרם2. DCs לא בשלים מבטאים קולטנים שונים לזיהוי דפוסים (PRRs) המזהים סוגים של מולקולות הנקראות דפוסים מולקולריים הקשורים לפתוגן (PAMPs), כגון מרכיב דופן החיידקים, ליפופוליסכריד (LPS)3. עם גירוי PRR, DCs הופכים ל-DCs בוגרים ומווסתים חלבונים חשובים של תאי T, כגון CD80, CD86 ו-CD40, ומפרישים ציטוקינים פרו-דלקתיים כגון גורם נמק גידול-אלפא (TNFα), מה שמקל על התמיינות תאי T נאיביים לתאי T קונבנציונליים או מסייעים2. להיפך, אם הבשלת DC נקטעת או אם DCs מתפתחים בסביבה טולרוגנית, DCs יכולים ליצור מצב DC טולרוגני (tolDCs)4. TolDCs מפחיתים את הקולטנים הקלאסיים של תאי T ובמקום זאת מווסתים קולטני סבילות כגון ליגנד מוות תאי מתוכנת 1 (PD-L1) ומנחת לימפוציטים B ו-T (BTLA) ומייצרים ציטוקינים מדכאים כגון אינטרלוקין 10 (IL-10) וגורם גדילה טרנספורמטיבי בטא (TGF-β)4. זו אינה רשימה מקיפה של סמני סובלנות, ולמעשה, יש הסכמה מוגבלת לגבי אילו סמני tolDC מתאימים להגדרת מצב tolDC5. בהתחשב בכך, אנו מציעים יצירת תאי T רגולטוריים (Treg) כסמן פונקציונלי שיש להשתמש בו כדי להשוות את היעילות של חומרי אינדוקציה שונים של tolDC.
בנוסף למצבי הפעלה של tolDC/DC בשלים, ניתן לסווג DCs גם על סמך השושלת או מיקום הרקמה שלהם, כאשר כל תת-קבוצה מציגה פונקציונליות שונה במקצת. בעוד שחלוקת ה-tolDC/DC הבוגרת היא פחות סופית וקיימת יותר כרצף, לחלוקות שושלת יש סמנים מוגדרים היטב הן בבני אדם והן בעכברים. מבשרי DC נוצרים במח העצם, אך ישנם שני תת-סוגים עיקריים של DCs המבוססים על השושלת שלהם: 1) תאים דנדריטיים פלסמציטואידים (pDCs), הנובעים משושלות לימפואידיות ו-2) תאים דנדריטיים קונבנציונליים (cDCs), הנובעים משושלות מיאלואידיות. בבני אדם, pDCs מבשילים באיברי לימפה, מבטאים CD303 ומגיבים מאוד בזיהומים נגיפיים6. CD11c המבטאים cDCs, בינתיים, מבשילים ברקמות היקפיות וקיימים בשני תת-סוגים נפרדים, CD1c+ cDC1s ו-CD141+ cDC2, שכל אחד מהם מייצר תגובות תאי T מובחנות7. יתר על כן, כל ה-cDCs יכולים להתקיים בתת-מצבים תושבים ברקמה (CD103-) או נודדים (CD103+)8. לבסוף, בתנאים מסוימים, ניתן להשרות תאים משושלות מונוציטים (CD14+) לעבר פנוטיפ תא דנדריטי והם מזוהים כ-CD14-, CD141+, CD1c+ 9. תאים אלה, הידועים כ-DCs שמקורם במונוציטים (moDCs), הם הנפוצים ביותר לניתוח ex vivo בבני אדם שכן מונוציטים מהווים כ-10-30% מהתאים החד-גרעיניים של הדם ההיקפי האנושי (PBMCs), בעוד ש-pDCs מהווים רק 1-3%10. זה הופך את ה-moDCs לבחירה אטרקטיבית, אך ידוע גם ש-moDCs הם דלקתיים יותר מאשר cDCs טיפוסיים המבודדים מרקמה ראשונית9.
ישנן כיום שתי קטגוריות רחבות של מאמצים להשתמש ב-tolDCs כדי ליצור סבילות קלינית. ראשית, tolDCs נוצרים ממונוציטים לשימוש כטיפול תאי. בפרדיגמה זו, מודולטורים מובחנים בדרך כלל באמצעות IL-4/GM-CSF במקביל לאימונומודולטורים כגון ויטמין D3, רפמיצין (ראפה), IL-10, דקסמתזון, או שילובים של11,12 אלה. tolDCs אלה נחקרו כטיפולים תאיים אוטולוגיים עבור אוטואימוניות והשתלות13. השימוש הנוסף ב-tolDCs הוא לתכנת מחדש DCs אנדוגניים לקראת tolDCs באמצעות תרופות חופשיות או ננו-נשאים כדי לספק גם אימונומודולטור וגם אנטיגן מעניין 14,15,16. עם זאת, אינדוקציה של DCs שכבר מובחנים היא מאתגרת יותר, בשל התפתחותם של פנוטיפים מטבוליים חזקים של DCs המנוגדים בדרך כלל למטבוליזם של tolDC17,18. זהו רף גבוה עבור רוב האימונומודולטורים הפרמקולוגיים; מסיבה זו, רוב מחקרי התכנות מחדש האנדוגניים של DC מדווחים על דיכוי DC יעיל ולעתים קרובות אינדוקציה מסוימת של Treg, אך חסרים הצלחה קלינית, לעתים קרובות בגלל חוסר התמדה של תאי T 15,19,20. זה מדגיש את הצורך באסטרטגיות לזיהוי סוכני אינדוקציה פוטנציאליים של tolDC מ-DCs קיימים.
כאן, אנו מציגים שיטה להערכה חוץ גופית של חומרים אימונומודולטוריים כנגד moDCs מובחנים עם מדד הקצה של אינדוקציה Treg אוטולוגית. פרוטוקול זה נועד להעריך את יעילותם של תרופות אימונומודולטוריות לתכנת מחדש את ה-moDC האנושי שכבר התמיין לקראת עמידות. יתר על כן, פרוטוקול זה מאמת את הפונקציונליות של tolDCs מתוכנתים מחדש כדי ליצור Tregs כנגד תאי T אוטולוגיים המבודדים מאותה דגימת PBMC. זאת בניגוד לפרוטוקולים אחרים הגורמים לסבילות במהלך התמיינות ו/או מאתגרים tolDCs עם תאי T מתורמים אלוגניים21. בפרוטוקול זה, אנו משתמשים בחומר הסובלני הנפוץ ראפה כדוגמה, אך גם מדגימים את היעילות המוגבלת של moDCs שטופלו בראפה ליצירת Tregs. בתוצאות המייצגות שלנו, אנו מראים גם את היעילות של טיפולים אימונומודולטוריים נפוצים אחרים כגון IL-10, דקסמתזון וויטמין D3. אנו צופים שפרוטוקול זה ישמש לסינון סוכני השראת tolDC יעילים יותר כנגד moDCs22 שכבר הוקמו.
Protocol
כל דגימות התאים החד-גרעיניים של הדם ההיקפי האנושי (PBMC) התקבלו מליבת האימונולוגיה האנושית של אוניברסיטת פנסילבניה מתורמים לא מזוהים באישור מראש של מועצת הביקורת המוסדית של אוניברסיטת פנסילבניה (IRB) בהסכמת המטופל.
אופציונלי: בעוד שבשיטה זו, השתמשנו ב-PBMCs מבודדים טריים שהתקבלו ממעבדה אקדמית, ניתן לבודד PBMCs מדם מלא או ממוצרי דם מועשרים בלויקפרזיס. אנו ממליצים להשתמש בשיטת צנטריפוגת שיפוע צפיפות, מכיוון שמדובר בשיטה מבוססת ואמינה המתוארת במקום אחר23.
1. בידוד מונוציטים/תאי T והתמיינות moDC
- בידוד מונוציטים ותאי T מ-PBMCs - יום 1
- השג 200 מיליון PBMCs אנושיים מתורם בריא. שמור את התאים בצינור של 15 מ"ל והעביר אותם על קרח.
- Aliquot 50 מ"ל של מאגר הפרדה (מסופק בערכות הפרדה זמינות מסחרית) בצינור חרוטי.
הערה: ניתן להחליף את מאגר ההפרדה גם ב-DPBS עם 2% סרום בקר עוברי (FBS) וחומצה אתילנדיאמינטטראצטית (EDTA) של 1 מ"מ. - הסר את צינור ה-PBMC מהקרח ומלא אותו במאגר הפרדה. צנטריפוגה בחום של 300 x גרם למשך 5 דקות.
- שאפו את הסופרנטנט באמצעות פיפטה סרולוגית של 10 מ"ל. השעו מחדש את כדור התא ב-4 מ"ל של מדיום מומלץ באמצעות פיפטה סרולוגית.
- חלקו את המתלה לשני צינורות שונים של 15 מ"ל, והוסיפו 2 מ"ל לצינור (5 × 107 תאים/מ"ל לצינור). סמנו שפופרת אחת "T" ואת השנייה "מונוציטים".
- אחזר את ערכת בידוד המונוציטים האנושיים ופעל לפי פרוטוקול היצרן כדי לבודד מונוציטים מהצינור המסומן במונוציטים.
- אחזר את ערכת בידוד תאי T אנושיים ופעל לפי פרוטוקול היצרן עבור הצינור השני לבידוד תאי T.
- ציפוי מונוציטים להתמיינות והקפאה של תאי T-יום 1
- מחממים מראש 50 מ"ל של מדיום תרבית moDC (טבלה 1) בטמפרטורה של 37 מעלות צלזיוס למשך 10 דקות לפחות.
- צנטריפוגה צינורות 15 מ"ל עם מונוציטים מועשרים וצינור 15 מ"ל עם תאי T משלב 1.1 ב-250 × גרם למשך 5 דקות.
- שאפו את הסופרנטנט. השעו מחדש מונוציטים ב-1 מ"ל של מדיום תרבית moDC ותאי T במדיום תרבית תאי T (טבלה 1) על ידי פיפטינג למעלה ולמטה. ודא שהגלולה מפוזרת כהלכה.
- ספור את התאים באמצעות מונה תאים אוטומטי או המציטומטר ידני באמצעות צביעת טריפן בלו.
הערה: עבור הנתונים המייצגים, בודדו 10 מיליון תאי T ו-3 מיליון מונוציטים. - קח את הצינור עם מונוציטים והוסף 9 מ"ל של מדיום תרבות moDC חם למתלה לנפח סופי של 10 מ"ל. לאחר מכן, הוסף 100 מיקרוליטר כל אחד מ-10 מיקרוגרם/מ"ל GM-CSF ו-10 מיקרוגרם/מ"ל IL-4 לריכוז סופי של 100 ננוגרם/מ"ל של GM-CSF ו-IL-4 במדיה. מעבירים את התרחיף לצלחת פטרי ומסמנים כ-"moDC" (יום 1) ודוגרים ב-37 מעלות צלזיוס עם 5% CO2.
- קח את צינור תאי T וערבב 1 מ"ל של מדיום הקפאת תאי T (טבלה 1) עם 1 מ"ל של תרחיף תאי T. מחלקים לשני קריוביאלים של 2 מ"ל (1 מ"ל/בקבוקון); לאטום היטב (ריכוז סופי של 5 מיליון תאים לבקבוקון). הנח את הקריוביאלים בתא הקפאה עם צינורות איזון בבארות שאינן בשימוש. אחסן את החדר בטמפרטורה של -80 מעלות צלזיוס למשך הלילה, ולאחר מכן העבר את הקריוביאלים לקריוטנק.
- ביום הרביעי, רענן את המדיום בתוספת של 5 מ"ל של מדיום תרבית moDC טרי והוסף 100 מיקרוליטר כל אחד ממלאי GM-CSF ו-IL-4. modcs מובחנים יהיו מוכנים ביום השביעי.
2. הוספת תרופות אימונומודולטוריות ליצירת moDCs טולרוגניים
- הגדר את לוחית ה-moDC.
- ביום השביעי, שלפו את ה-moDCs המובחנים מהאינקובטור והעבירו את תרחיף תאי ה-moDC לתוך צינור של 50 מ"ל.
- צנטריפוגה המתלה ב -250 × גרם למשך 5 דקות. שאפו את הסופרנטנט והשעו מחדש את גלולת התא ב-1 מ"ל של מצע תרבית moDC חם על ידי פיפטינג למעלה ולמטה. ספרו את התאים עם המציטומטר ודללו את התאים לריכוז של 3 × 105 תאים/מ"ל במדיום תרבית moDC חם המכיל 100 ננוגרם/מ"ל GM-CSF ו-IL-4.
- הוסף 3 × 104 תאים / באר ב -100 מיקרוליטר למספר הבארות הרצוי בצלחת תרבית רקמות תחתונה שטוחה של 96 בארות.
הערה: לקבלת תוצאות מייצגות, השתמשנו בסך הכל ב-48 בארות (ארבעה תנאים שנעשו בשלושה מוכנים לארבעה ניתוחים שונים בסעיפים 3 ו-4), אך ניתן להתאים זאת לעד 60 בארות. מלאו את כל הבארות הנותרות ב-100 מיקרוליטר / באר PBS כדי למנוע ייבוש, במיוחד בארות חיצוניות. אנו ממליצים להכין צלחות שונות לכל שיטת ניתוח. - הוסף 1 מיקרוליטר/באר של תרופות אימונומודולטוריות לבארות הרצויות (כאן 10 ננוגרם/מ"ל ראפה). דגרו את הצלחת למשך הלילה ב-37 מעלות צלזיוס עם 5%CO2.
הערה: אם כולל גירוי חיסוני ביום 8, הכינו בארות לתרופה האימונומודולטורית עם ובלי גירוי חיסוני. השימוש בגירוי חיסוני למודקים בוגרים הוא אופציונלי.
- להפשיר מחדש תאי T.
- ביום 8, הוציאו שני קריוביאלים מהקריוטנק והפשירו את הקריוביאלים באמבט חרוזים חם או באמבט מים ב-37 מעלות צלזיוס עד שהתכולה מתחילה להימס (תוך <3 דקות).
- כאשר התוכן מתחיל להימס, העבירו את הבקבוקונים למכסה המנוע של תרבית תאים והזרימו 1 מ"ל של מדיה חמה לתרבית תאי T לתוך הבקבוקון כדי להפשיר במהירות. העבירו את כל תכולת הבקבוקון לצינור של 50 מ"ל. שטפו את הקריוביאלים עם 1 מ"ל של מדיום תרבית תאי T כדי להבטיח שכל התאים מועברים לתוך הצינור.
- מלאו את המתלה בתמיסת מכתים זרימה (טבלה 1) עד 15 מ"ל. צנטריפוגה בחום של 200 × גרם למשך 10 דקות ושואבים את הסופרנטנט. לאחר מכן, השעו מחדש את הגלולה ב-5 מ"ל של תמיסת צביעת זרימה וצנטריפוגה שוב.
- שאפו את הסופרנטנט והשעו מחדש את התאים ב-1 מ"ל של מדיום תרבית תאי T חם. ספרו את התאים באמצעות המציטומטר.
הערה: הכדאיות צריכה להיות >70% בשלב זה; אם נותרו כמויות גדולות של תאים מתים, העבירו לצינור טרי, הוסיפו 10 מ"ל של תמיסת כתמי תאים, צנטריפוגה ב-200 × גרם למשך 5 דקות, השעו מחדש ב-1 מ"ל של מדיה של תאי T וספרו מחדש. - הוסף 9 מ"ל של מדיום תרבית תאי T חם כדי ליצור נפח סופי של 10 מ"ל. מעבירים את המתלה לצלחת פטרי. תייגו אותו כ"תאי T מופשרים" ודגרו למשך הלילה בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2 כדי לתת לתאים לנוח.
- שטפו את צלחת ה-moDC והוסיפו את הממריץ החיסוני אם תרצו.
- ביום 8 יש לצנטריפוגה את צלחת ה-moDC (מהיום השביעי) ב-300 × גרם למשך 5 דקות.
- שאפו את הסופרנטנט, שטפו עם HBSS חם, חזרו על הצנטריפוגה, שאפו שוב והשעו מחדש את התאים במדיום תרבית moDC חם המכיל GM-CSF ו-IL-4 (100 מיקרוליטר לבאר).
הערה: היזהר לא להפריע לתאים. הטה את הצלחת במהלך השאיפה. כ -10 מיקרוליטר יכולים להישאר בבאר. - אם אתה משתמש בגירוי חיסוני, הוסף 1 מיקרוליטר / באר של LPS מלאי פי 100 (או חומר חיסוני אחר) לבארות הרצויות. דגרו את הצלחת למשך הלילה ב-37 מעלות צלזיוס עם 5%CO2.
3. ניתוח זרימה עבור moDC (אימות + סובלנות)
- ניתוח זרימה לאימות moDC
- ביום השמיני, הכינו קוקטיילים של נוגדנים לפאנל האימות, המכוונים לסמנים הבאים: HLA-DR, CD14, לקטין מסוג C ספציפי לתאים דנדריטיים (DC-SIGN), CD1c ו-CD40 כמתואר בטבלה 2. יש לדלל את כל הנוגדנים בתמיסת כתמי זרימה.
הערה: הפאנל תוכנן עבור ציטומטר זרימת לייזר אדום/כחול בעל 7 ערוצים. - אחזר את לוחית ה-moDC מהחממה. צנטריפוגה את הצלחת בחום של 300 × גרם למשך 5 דקות. הסר את הסופרנטנטים. אופציונלי: שמור את הסופרנטנטים לניתוח ELISA עבור ציטוקינים IL-10 ו-TNFα באמצעות ערכות זמינות מסחרית בהתאם להוראות היצרן.
- הוסף 200 מיקרוליטר/באר של תמיסת צביעת זרימה. צנטריפוגה את הצלחת בחום של 300 × גרם למשך 5 דקות.
- שאפו את הסופרנטנט והוסיפו 50 מיקרוליטר לבאר של נוגדן מעכב קושר קולטן Fc מדולל 1:200 בתמיסת צביעת זרימה כדי לחסום קשירה לא ספציפית. דגירה בטמפרטורת החדר (RT) למשך 30 דקות.
- הוסף 50 מיקרוליטר לבאר מקוקטייל הנוגדנים המוכן של לוח האימות .
- הכן בקרות פיצוי בצלחת או בצינורות של 1.5 מ"ל על ידי ערבוב של 50 מיקרוליטר של חרוזי פיצוי עם 50 מיקרוליטר מכל נוגדן מדולל. דגרו את הצלחת בטמפרטורה של 4 מעלות צלזיוס למשך שעה.
הערה: חרוזי פיצוי משמשים כאן במקום תאים לפיצוי עקב ביטוי נמוך פוטנציאלי של סמנים ב-moDCs. - יש לשטוף על ידי צנטריפוגה בחום של 300 × גרם למשך 5 דקות, להסיר את הסופרנטנט ולהשעות מחדש ב-200 מיקרוליטר של תמיסת צביעת זרימה. בצע שתי כביסות.
- לאחר הכביסה הסופית, צנטריפוגה שוב והשעיה מחדש של התאים ב-110 מיקרוליטר לבאר של תמיסת צביעת זרימה. הדגימות מוכנות כעת לניתוח ציטומטריית זרימה.
- ביום השמיני, הכינו קוקטיילים של נוגדנים לפאנל האימות, המכוונים לסמנים הבאים: HLA-DR, CD14, לקטין מסוג C ספציפי לתאים דנדריטיים (DC-SIGN), CD1c ו-CD40 כמתואר בטבלה 2. יש לדלל את כל הנוגדנים בתמיסת כתמי זרימה.
- ניתוח זרימה עבור moDC טולרוגני (לוח סובלנות)
- בדומה לשלב 3.1 ביום 8, הכינו קוקטיילים של נוגדנים לפאנל הסובלנות, המכוונים לסמנים הבאים: CD86, PD-L1, DC-SIGN, CD1c, BTLA ו-CD40 (טבלה 2).
- חזור על שלבים 3.1.2-3.1.8, והחלף את קוקטייל הנוגדנים בקוקטייל לוח הסובלנות .
4. ניתוח זרימה של תאי T
- שלב תאי T עם moDCs טולרוגניים מטופלים.
- ביום התשיעי, הוציאו את צלחת הפטרי של תאי T שהופשרו מחדש מהאינקובטור והעבירו את כל תאי ה-T לתוך צינור של 50 מ"ל. מלאו בתמיסת מכתים זרימה.
- אופציונלי: אם מבצעים ניתוח התפשטות תאי T, חלקו תאי T לשני צינורות.
- בעזרת הצינור הראשון, יש לסובב בחום של 250 × גרם למשך 5 דקות ולהוציא את הסופרנטנט. צבעו את הצינור הזה בצבע התפשטות תאים בהתאם להוראות היצרן.
הערה: השתמשנו ב-Fixable Viability Dye eFluor 670, הדורש שלב דגירה של 30 דקות, ואחריו שני שלבי כביסה. אנו ממליצים להשתמש בצינורות חרוטיים של 50 מ"ל כדי למנוע אובדן תאים ולהשתמש ב-HBSS עם 10% HIFBS לשטיפה לאחר הצביעה. - השתמש בצינור השני המכיל תאי T לא מוכתמים לניתוח Treg. באופן דומה יש לסובב בטמפרטורה של 250 × גרם למשך 5 דקות, להסיר את הסופרנטנט, להשהות מחדש במצע תרבית תאים חם ולשמור באינקובטור במהלך תהליך הצביעה. אם אין צורך בהתרבות תאי T, סובב את כל תאי ה-T והחלף אותם במדיה חמה של תרבית תאי T.
- בעזרת הצינור הראשון, יש לסובב בחום של 250 × גרם למשך 5 דקות ולהוציא את הסופרנטנט. צבעו את הצינור הזה בצבע התפשטות תאים בהתאם להוראות היצרן.
- ספור את התאים וקבל לפחות 4 מיליון (לניתוח Treg בלבד) או 8 מיליון (לניתוח התפשטות Treg ו-T).
- אחזר את צלחת ה-moDC מהחממה עם הבארות הנותרות, צנטריפוגה ב-300 × גרם למשך 5 דקות, ואפיין את הסופרנטנטים. הוסף 200 μL/באר תאי T ב-1.6 ×-105 תאים/באר. הוסף תאי T לא מוכתמים עבור לוחות ניתוח Treg ותאי T מוכתמים עבור לוחות התפשטות תאי T.
הערה: זה ישמור על יחס תא T ל-moDC של 5:1, מכיוון ש-3 ×104 moDC הראשוניים בדרך כלל מתרחבים מעט. - הוסף 25 מיקרוליטר/מ"ל של קוקטייל נוגדנים נגד CD3/CD28 לכל הקבוצות למעט בארות בקרה שליליות כדי לעורר תאי T. דגרו על הצלחת למשך 72 שעות בטמפרטורה של 37 מעלות צלזיוס עם 5%CO2 עד היום ה-12.
הערה: הקפד להשתמש בתאי T מוכתמים לניתוח התפשטות ולא מוכתמים לניתוח Treg.
- ניתוח זרימת Treg
- צביעת סמן פני השטח
- ביום ה-12, הכינו קוקטיילים של נוגדנים לפאנל Treg (טבלה 2).
- העבר את כל מתלי התאים מלוח התרבית של 96 בארות לצלחת תחתונה V עם תמיסת צביעת זרימה. שמור את הסופרנטנטים לניתוח ציטוקינים.
- שטפו את התאים פי 2 על ידי צנטריפוגה (200 × גרם למשך 5 דקות ואחריה 200 מיקרוליטר של תמיסת כתמי זרימה). הקצו כמה תאים לבקרות פיצוי. הניחו אחד בצד לצביעה של FOXP3 ולבקרות לא מוכתמות.
הערה: אנו מציעים לסרוק 10 מיקרוליטר מכל הדגימות לפני הסיבוב הסופי בשלב 4.2.1.3 כדי לקבל בקרות פיצוי נחוצות. זה מספק מדגם מייצג של כל הביטוי ברמת פני השטח של כל סמן בתאים. - לאחר הכביסה השנייה, צנטריפוגה ב-200 x גרם למשך 5 דקות בטמפרטורת החדר ושואבים, ואז מוסיפים נוגדן מעכב קושר קולטן Fc של 50 מיקרוליטר/באר (מדולל 1:200 בתמיסת צביעת זרימה). דוגרים בטמפרטורת החדר למשך 10 דקות.
- הוסף 50 מיקרוליטר/באר מקוקטייל הנוגדנים המוכן של Treg Panel .
- לבקרות פיצוי, ערבבו 50 מיקרוליטר של תאי פיצוי לא מוכתמים עם 50 מיקרוליטר מכל נוגדן מוכתם.
- דגרו את בקרות הצלחת והפיצוי ב-4 מעלות צלזיוס למשך שעה. שטפו את הצלחת פעם אחת עם תמיסת כתמי זרימה וצנטריפוגה בחום של 300 × גרם למשך 5 דקות.
- כתם עם צבע Live/Dead Near-IR מדולל ב-HBSS (1:1,000) ב-200 מיקרוליטר לבאר. דגירה בטמפרטורה של 4 מעלות צלזיוס למשך 30 דקות.
- שטפו את הצלחת פעם אחת עם תמיסת מכתים זרימה (200 מיקרוליטר/באר) בחום של 300 × גרם למשך 5 דקות.
- מכתים עם FoxP3 על פי הוראות היצרן, מה שידרוש דגירה למשך הלילה. סקירה קצרה של פרוטוקול הצביעה FoxP3 מתוארת להלן .
- הכן את פתרון העבודה לקיבוע/חדירות של FoxP3 בהתאם להוראות היצרן. מערבבים חלק אחד של תרכיז קיבוע/חדירות FoxP3 עם 3 חלקים של מדלל קיבוע/חדירות FoxP3. הכן 200 מיקרוליטר מתמיסת העבודה לכל דגימה.
- דגירה של כל הדגימות ב-200 מיקרוליטר / באר של תמיסת הקיבוע / חדירות העובדת. השאירו בטמפרטורה של 4 מעלות צלזיוס למשך שעה.
- הכן מאגר פרמביליזציה 1x: מערבבים חלק אחד של מאגר פרמביליזציה 10x (מתקבל מערכה מסחרית) עם 9 חלקים של מים מזוקקים.
- שטפו את הצלחת פעמיים עם מאגר חדירה 1x (200 מיקרוליטר/באר) ב-300 × גרם למשך 5 דקות.
- צביעה עם נוגדן FoxP3 (PE-Cy5.5, דילול 1:300 במאגר חדירה 1x): הוסף 100 מיקרוליטר/באר של נוגדן FoxP3 המדולל ודגירה בטמפרטורה של 4 מעלות צלזיוס למשך הלילה.
- שטפו את הצלחת פעמיים עם מאגר חדירה 1x (200 מיקרוליטר/באר) ב-300 × גרם למשך 5 דקות.
- השעו מחדש את התאים ב-110 מיקרוליטר לבאר של תמיסת צביעת זרימה.
- בצע ניתוח ציטומטריית זרימה.
- צביעת סמן פני השטח
- ניתוח התפשטות תאי T
- הכינו קוקטיילים של נוגדנים לפאנל התפשטות T (טבלה 2).
- העבר את כל מתלי התאים מלוח התרבית של 96 בארות לצלחת תחתונה V עם תמיסת צביעת זרימה. שמור על סופרנטנטים לניתוח ציטוקינים.
- שטפו את התאים פי 2 על ידי צנטריפוגה (200 × גרם למשך 5 דקות ואחריה 200 מיקרוליטר של תמיסת כתמי זרימה). הקצו כמה תאים לבקרות פיצוי. הניחו אחד בצד לצביעה של FOXP3 ולבקרות לא מוכתמות.
הערה: אנו מציעים לסרוק 10 מיקרוליטר מכל הדגימות לפני הסיבוב הסופי בשלב 4.3.3 כדי להשיג את בקרות הפיצוי הדרושות. זה מספק מדגם מייצג של כל הביטוי ברמת פני השטח של כל סמן בתאים. - לאחר הכביסה השנייה, צנטריפוגה (200 × גרם למשך 5 דקות בטמפרטורת החדר) ושואבים, ואז מוסיפים נוגדן מעכב קושר קולטן Fc של 50 מיקרוליטר/באר (מדולל 1:200 בתמיסת צביעת זרימה). דוגרים בטמפרטורת החדר למשך 10 דקות.
- הוסף 50 מיקרוליטר/באר מקוקטייל הנוגדנים המוכן של T Proliferation Panel .
- לבקרות פיצוי, ערבבו 50 מיקרוליטר של תאי פיצוי לא מוכתמים עם 50 מיקרוליטר מכל נוגדן מוכתם.
- דגרו את בקרות הצלחת והפיצוי ב-4 מעלות צלזיוס למשך שעה. שטפו את הצלחת פעם אחת עם תמיסת כתמי זרימה וצנטריפוגה בחום של 300 × גרם למשך 5 דקות.
- כתם עם צבע Live/Dead Near-IR מדולל ב-HBSS (1:1,000) ב-200 מיקרוליטר לבאר. דגירה בטמפרטורה של 4 מעלות צלזיוס למשך 30 דקות.
- שטפו את הצלחת פעם אחת עם תמיסת מכתים זרימה (200 מיקרוליטר/באר) בחום של 300 × גרם למשך 5 דקות.
- בצע ניתוח ציטומטריית זרימה.
תוצאות
תיארנו פרוטוקול ל-PBMCs אנושיים, לבודד גם תאי CD3+ T וגם מונוציטים CD14+ באמצעות ערכות הפרדה מגנטיות זמינות מסחרית, להבדיל מונוציטים ל-CD14-, HLA-DR+, CD141+, CD1c+ moDCs באמצעות GM-CSF ו-IL-4, לטפל בהם במשך 24 שעות, ולבצע תרבית משותפת עם תאי T אוטולוגיים עם גירוי אנטי-CD3/CD28 למשך 72 שעות. סכמת ניסוי מוצגת באיור 1.
בידוד מונוציטים/תאי T והתמיינות moDC
עבור התוצאות המייצגות הראשוניות שלנו, 200 מיליון PBMCs אנושיים נרכשו מאוניברסיטת פנסילבניה Human Immunology Core (HIC) מתורם בריא אחד ועובדו כמתואר בסעיפים 1 ו-2 בפרוטוקול. הדם נלקח ביום הראשון ובודד באמצעות פיצול פיקול סטנדרטי במתקן CHIC. השתמשנו ב-100 מיליון PBMCs לבידוד תאי T ומונוציטים, כל אחד עם תפוקות של 10 מיליון תאי T ו-3 מיליון מונוציטים, בהתאמה. מונוציטים ו-moDCs לאחר התמיינות GM-CSF/IL-4 ביום 7 נותחו באמצעות ציטומטריית זרימה. צפינו בשתי קבוצות נפרדות במונוציטים הלא מובחנים, CD14+ קלאסי, מונוציטים HLA-DR (>45%), ואוכלוסייה קטנה של תאי CD14-, HLA-DR+ שביטאו כמויות מינימליות של CD1c וללא CD141. לעומת זאת, ביום השביעי של ההתמיינות, ראינו את רוב התאים שהיו CD14-, HLA-DR+, CD141+, CD1c+, מה שמצביע על moDCs (איור 2). השגנו כ-4 מיליון moDCs מתוך 3 מיליון המונוציטים הראשונים.
ניתוח זרימה עבור moDC (אימות + סובלנות)
ביום השביעי, מודגרים עם ראפה למשך 24 שעות, נשטפו, הודגרו עם LPS למשך 24 שעות, ולאחר מכן נותחו על ידי ציטומטריית זרימה ביום 9 באמצעות שלב פרוטוקול 3. קבוצות הטיפול כללו: 1) ללא טיפול + ללא טיפול (UT), 2) ללא טיפול + 0.1 מיקרוגרם/מ"ל LPS (LPS), 3) 10 ננוגרם/מ"ל ראפה + ללא טיפול (ראפה), או 4) 10 ננוגרם/מ"ל ראפה+ 0.1 מיקרוגרם/מ"ל LPS (LPS + ראפה). טיפול בראפה, הן עם LPS והן בלעדיו, הפחית את אוכלוסיות CD1c+, DC-SIGN+ מ-UT, אם כי האחוזים נותרו >50% (איור 3A). MoDCs ביום 9 נותחו גם לביטוי של סמני התבגרות DC, CD86 ו-CD40. ראינו עלייה ניכרת ב-CD86 כאשר moDCs טופלו ב-LPS, שנמנעה כאשר moDCs טופלו מראש בראפה (איור 3B). כאשר האות נורמל לבקרות UT, ראינו ירידה משמעותית הן ב-CD40 והן ב-CD86 בקבוצות הטיפול בראפה וללא עלייה באות עם קבוצות LPS + rapa (איור 3C,D). אותו דפוס נצפה עבור סמנים טולרוגניים, PD-L1 ו-BTLA, כאשר טיפול בראפה מפחית את האות ומונע עלייה בתגובה לגירוי LPS (איור 3E,F). זה מצביע על כך שטיפול בראפה מנע את הבשלת LPS אך בו זמנית הגביל את הביטוי של סמנים טולרוגניים.
ניתוח זרימה עבור Treg
לאחר מכן ניתחנו תאי T אוטולוגיים לאחר תרבית משותפת עם moDCs וגירוי עם גירוי CD3/CD28 ביום 12 ביחס של 1:5 תאי moDC:T באמצעות פרוטוקול שלב 4.2. זיהינו אוכלוסיות Treg לפי CD4+, CD25+, FoxP3+ (איור 4)24. הדגימות כללו תאי T ללא גירוי (בקרה שלילית), תאי T עם גירוי CD3/CD28 אך ללא moDCs, ותאי T עם גירוי CD3/CD28 ותרבית משותפת עם ארבע קבוצות ה-moDC מהפסקה הקודמת. ראינו אוכלוסיית Treg ברורה ועלייה ניכרת ב-Treg כאשר moDCs נוספו לתרבות המשותפת. עם זאת, לא היה הבדל משמעותי בתדירות ה-Treg בין ארבעת ה-moDC, בניגוד לכמה דיווחי ספרות המדגימים ייצור מוגבר של Treg מ-tolDCs שטופלו בראפה (איור 5A)25.
ניתוח זרימה של התפשטות תאי T
ניתחנו גם את המדגם המייצג שלנו לשגשוג תאי T באמצעות פרוטוקול שלב 4.3. תרביות משותפות של תאי T-moDC עוררו באופן דומה כמו בניתוח Treg ולאחר מכן נותחו על ידי זרימה לצבע התפשטות תאים של תאי CD4+ או CD8+ T (איור 5B). ראינו כי ל-moDCs שטופלו ב-rapa יש ירידה מתונה בשגשוג תאי T הן בתאי CD4+ והן ב-CD8+ בהשוואה ל-moDCs שטופלו ב-LPS ו-moDCs לא מטופלים בגירוי CD3/CD28.
ניתוח דגימות חולים ואימונומודולטורים נוספים:
התוצאות המייצגות שלנו מצביעות על כך ש-moDCs שטופלו ב-rapa מפחיתים סמנים של בשלות DC כגון CD86 ו-CD40 ומפחיתים את התפשטות תאי T לגירוי CD3/CD28 לא ספציפי. עם זאת, ל-moDCs שטופלו ב-Rapa יש השפעה מועטה על סמנים חיוביים של עמידות, כגון PD-L1 או BTLA ואינם מגדילים את אוכלוסיות ה-Treg עם גירוי CD3/CD28. כדי לחקור אם תוצאות דומות של תאי T ייצפו עם חולים ואימונומודולטורים אחרים, חזרנו על ניסוי התרבות המשותפת האוטולוגית מדגימות אנושיות נוספות (בסך הכל 4 או 5 בהתאם לניתוח). בדקנו עוד 1 מיקרומטר דקסמתזון (Dex), 10 ננוגרם/מ"ל IL-10 (IL-10), 1 מיקרוגרם/מ"ל ליפופוליסכריד (LPS), או 1 ננומטר ויטמין D3 (VD3) בנוסף ל-10 ננוגרם/מ"ל ראפה כאימונומודולטורים שניתנו בשלב 2.1.4 אך השמיטו גירוי חיסוני. כללנו גם דגימה שקיבלה Dex בשלב 2.1.4 וטופלה ב-0.1 מיקרוגרם/מ"ל LPS בשלב 2.3.3 ביום 8 (Dex + LPS). תחילה בדקנו סופרנטנטים מ-moDC (ללא תוספת תאי T) 24 שעות או 72 שעות אחרי שלב 2.3.3 ביום 8 עבור ציטוקין הסבילות הנפוץ IL-10 והציטוקין הדלקתי TNFα (איור 6A-D). ראינו כי moDCs שטופלו בראפה לא העלו את IL-10 באף דגימות לאחר 24 שעות או 72 שעות, אך דגימות שטופלו ב-IL-10 הגדילו משמעותית את ייצור ה-IL-10 לאחר 24 שעות, גם לאחר שני שלבי שטיפה להסרת IL-10 שנוספו באופן אקסוגני. (איור 6A). ראינו גם ש-moDCs שטופלו ב-Dex אכן הגדילו משמעותית את ייצור ה-IL-10 אך רק לאחר מנוחה של 72 שעות (איור 6B). עוד ראינו שאף אימונומודולטור לא יצר TNFα בעצמו, אך הטיפול המקדים ב-Dex הפחית את הייצור הממוצע של TNFα לאחר טיפול ב-LPS לאחר 24 שעות, אם כי תוצאה זו לא הייתה משמעותית (איור 6C). הנתונים מראים עוד כי בעוד שביטוי ה-moDC של PD-L1 אינו מוגבר על ידי אף אימונומודולטור לאחר 24 שעות, עליות משמעותיות ב-PD-L1+ moDCs נצפו בקבוצות שטופלו ב-Dex + LPS ו-Rapa לאחר 72 שעות (איור 6E,F). כמו המדגם המייצג היחיד שלנו, אנו רואים גם דיכוי של ביטוי CD86 מכל הקבוצות שטופלו באימונומודולטור הן ב-24 שעות והן ב-72 שעות (איור 6G,H). אלה מאשרים כי אימונומודולטורים יכולים להגדיל סמנים טולרוגניים עבור moDCs, אם כי ההשפעה מתעכבת.
ניתחנו עוד את תגובות תאי T לאחר תרבית משותפת ביום ה-12. ראינו כי moDCs שטופלו באימונומודולטור לא הגדילו את התפשטות תאי CD4+ T ביחס לבקרות moDC לא מטופלות בדומה לדוחות אחרים שפורסמו26 (איור 6I). מעניין שלא ראינו עלייה משמעותית באוכלוסיות Treg עבור כל moDCs שטופלו באימונומודולטור במדגם הגדול יותר (איור 6J). אנו מאמינים שחוסר משמעות זה נובע משונות גבוהה בין דגימות חולים; שתיים מדגימות המטופלים (1 ו-2) לא הראו עלייה ב-Tregs לטיפול כלשהו, בעוד שהשתיים האחרות (3 ו-4) הראו עלייה כמעט בכל הטיפולים האימונומודולטוריים (איור 6J). זה מדגיש את הצורך לבצע ניתוח של אימונומודולטורים עם דגימות מטופלים מרובות ומצביע על כך שהתפשטות Treg באמצעות moDCs שטופלו באימונומודולטור משתנה מאוד בין חולים.
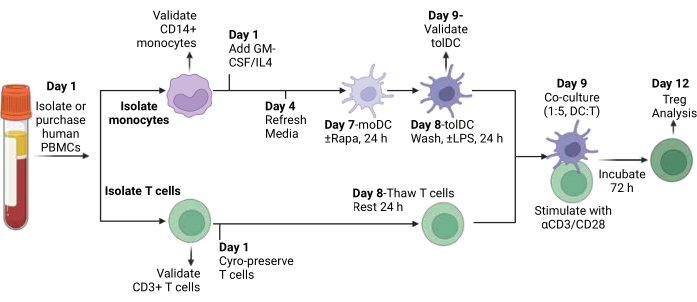
איור 1: סכמת סקירה ניסויית. מונוציטים ותאי T מבודדים מ-PBMCs, מונוציטים מתמיינים ל-moDCs, מאותגרים עם חומרים אימונומודולטוריים ליצירת tolDCs, ועוברים תרבית משותפת עם תאי T. קיצורים: PBMCs = תאים חד-גרעיניים בדם היקפי; moDCs = תאים דנדריטיים שמקורם במונוציטים; tolDCs = תאים דנדריטיים טולרוגניים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: אסטרטגיית שער מייצגת לזיהוי מונוציטים CD14+ , HLA-DR ו- CD14- , HLA-DR+ , CD1c+ , DC-SIGN+ moDCs. הדגימות נותחו ביום השביעי. קיצורים: moDC = תא דנדריטי שמקורו במונוציטים; HLA-DR = אנטיגן לויקוציטים אנושיים-DR; DC-SIGN = לקטין מסוג C ספציפי לתא דנדריטי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
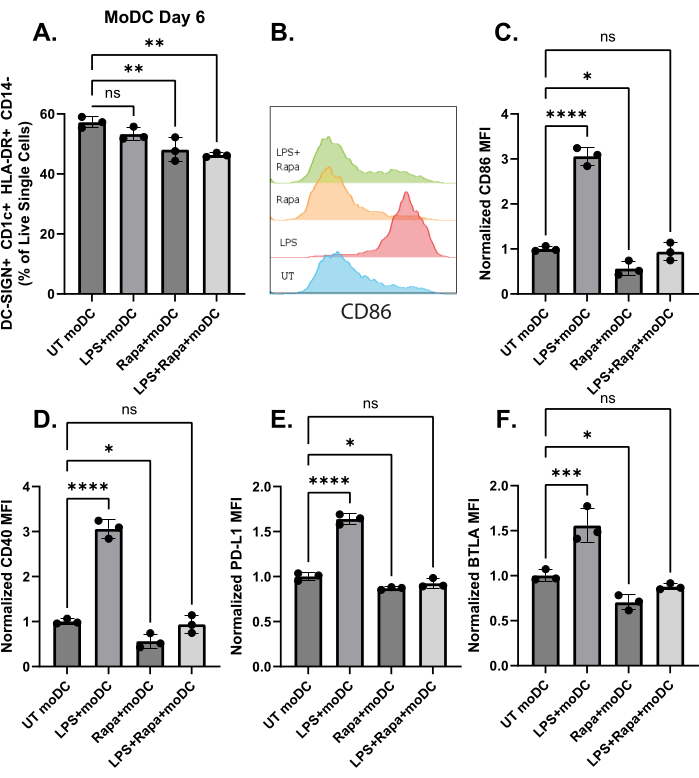
איור 3: ניתוח ציטומטריית זרימה של moDCs לאחר טיפול ראפה ו/או LPS. ביום השישי, 105 moDCs הודגרו עם אימונומודולטורים למשך 24 שעות, ולאחר מכן נשטפו והודגרו עם או בלי 0.1 מיקרוגרם/מ"ל LPS למשך 24 שעות. ביום התשיעי, moDCs נשטפו ונותחו על ידי ציטומטריית זרימה. (A) זיהוי של מונוציטים CD14+, HLA-DR ו-CD14-, HLA-DR+, CD1c+, DC-SIGN+. (B) היסטוגרמות מייצגות של אות moDC CD86 לאחר הטיפול; עוצמת הקרינה הממוצעת עבור (C) CD86, (D) CD40, (E) PD-L1 ו-(F) BTLA. הדגימות היו בשלישיות טכניות (N = 3) מאותו PBMCs של מטופלים. המשמעות נקבעה על ידי ANOVA חד כיווני בהשוואה לקבוצת UT. *פ < 0.05, **פ < 0.01, ***פ < 1 × 10-3, ****פ < 1 × 10-4. קיצורים: PBMCs = תאים חד-גרעיניים בדם היקפי; moDCs = תאים דנדריטיים שמקורם במונוציטים; HLA-DR = אנטיגן לויקוציטים אנושיים-DR; ראפה = רפמיצין; LPS = ליפופוליסכריד; MFI = עוצמת הקרינה הממוצעת; BTLA = מנחת לימפוציטים B ו-T; PD-L1 = ליגנד מוות תאי מתוכנת 1; UT = לא מטופל; LPS moDC= moDCs שטופלו ב-0.1 מיקרוגרם/מ"ל LPS ביום 8; ראפה moDC = moDCs שטופלו ב-10 ננוגרם/מ"ל ראפה ביום 7 ואז נשטפו ביום 8; ראפה + LPS moDCs = moDCs שטופלו ב-10 ננוגרם/מ"ל ראפה ביום 7 ולאחר מכן נשטפו וטופלו ב-0.1 מיקרוגרם/מ"ל LPS ביום 8. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: אסטרטגיית שער מייצגת לזיהוי Tregs CD4+, CD25+, FoxP3+ . הדגימה נותחה מתאי T מופשרים ביום ה-12. קיצורים: SSC-A = אזור שיא פיזור צדדי; FSC-A = אזור שיא פיזור קדימה; Tregs = תאי T רגולטוריים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
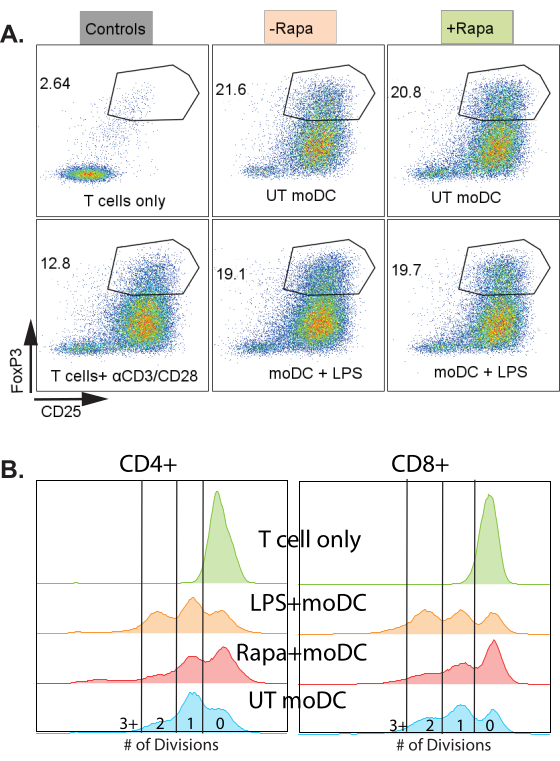
איור 5: ניתוח תאי T מייצג של תרבית משותפת של תאי moDC-T ביום ה-12. (A) עלילות זרימה מייצגות CD25 לעומת FoxP3 של תאי T חיים, יחידים, CD4+ לזיהוי Tregs. העמודה השמאלית מכילה פקדים: תאי T בלבד (למעלה) ותאי T מגורים CD3/CD28 (למטה). העמודה האמצעית: moDCs ללא טיפול בראפה, העמודה הימנית: moDcs עם טיפול בראפה. עבור עמודות אמצעיות וימניות, השורה העליונה היא דוגמאות ללא LPS והתחתונה היא עם טיפול LPS. (ב) שער מייצג לשגשוג תאי T. תאי T CD4+ (משמאל) או CD8+ (מימין) תוכננו כנגד כתם התפשטות. פסגות מסומנות עבור חלוקות תאים 0, 1, 2 או 3. היסטוגרמות מסומנות עם סוג הטיפול ב-moDC. קיצורים: rapa = rapamycin; LPS = ליפופוליסכריד; moDCs = תאים דנדריטיים שמקורם במונוציטים; תאי T בלבד = תאי T ללא moDCs ללא טיפול CD3/CD28; UT = לא מטופל; LPS moDC = moDCs שטופלו ב-0.1 מיקרוגרם/מ"ל LPS ביום 8; ראפה moDC = moDCs שטופלו ב-10 ננוגרם/מ"ל ראפה ביום 7 ולאחר מכן נשטפו ביום 8. שימו לב שטיפול בראפה מגדיל את הכמויות היחסיות של תאים עם 0 חלוקות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: ניתוח של דגימות מרובות של תאי moDC/T עם איממודולטורים נוספים. MoDCs טופלו ב-1 מיקרומטר דקסמתזון, 10 ננוגרם/מ"ל IL-10, 1 מיקרוגרם/מ"ל ליפופוליסכריד או 1 ננומטר ויטמין D3 בנוסף ל-10 ננוגרם/מ"ל ראפה כאימונומודולטורים שניתנו בשלב 2.1.4 אך השמיטו גירוי חיסוני. כללנו גם דגימה שקיבלה Dex בשלב 2.1.4 וטופלה ב-0.1 מיקרוגרם/מ"ל LPS בשלב 2.3.3 ביום 8 (Dex + LPS). (א,-ד) ניתוח ציטוקינים של moDCs. סופרנטנטים נבדקו ל-IL-10 (A) 24 שעות או (B) 72 שעות לאחר שלב 2.3.3 או נבדקו ל-TNFα עבור C) 24 שעות או (D) 72 שעות לאחר שלב 2.3.3 באמצעות ערכות ELISA מסחריות. N = 5. (א-ה) ניתוח סמני משטח moDC. באופן דומה, moDCs נותחו באמצעות ציטומטריית זרימה עבור PD-L1 ב-(E) 24 שעות או (F) 72 שעות או עבור CD86 ב- (G) 24 שעות או (H) 72 שעות. (I) ניתוח התפשטות תאי T. תאי CD4+ T ביום ה-12 נותחו לשגשוג תאי T וחושב מספר חלוקות התאים לכל 100 תאי T. הדגימות הודגרו ביחס של 1:5 moDC:T תאים, N = 4. (ה) ניתוח טרג. MoDCs שהובחנו מחמישה מטופלים שונים נותחו באופן דומה כמו באיור 5. משמאל, לא מטופלים; מימין, moDCs שטופלו ב-10 ננוגרם/מ"ל ראפה. כל קו צבעוני מייצג דגימת מטופל אחרת. המשמעות נקבעה על ידי ANOVA חד כיוונית. *p < 0.05, **p < 0.01.קיצורים: rapa = rapamycin; LPS = ליפופוליסכריד; TNFα = גורם נמק גידול-אלפא; moDCs = תאים דנדריטיים שמקורם במונוציטים; UT = לא מטופל; LPS moDC = moDCs שטופלו ב-0.1 מיקרוגרם/מ"ל LPS; ראפה moDC = moDCs שטופלו ב-10 ננוגרם/מ"ל ראפה, Dex = moDCs שטופלו ב-1 מיקרומטר דקסמתזון, IL-10 = moDCs שטופלו ב-10 ננוגרם/מ"ל IL-10, VD3= moDCs שטופלו ב-1 ננומטר ויטמין D3, Dex + LPS= moDCs שטופלו ב-1 מיקרומטר דקסמתזון ביום 7 ולאחר מכן 0.1 מיקרוגרם/מ"ל LPS ביום 8. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מדיום תרבות moDC | תמיסת מכתים זרימה | מדיום תרבית תאי T | מדיום הקפאת תא T | |
| בסיס מדיה | RPMI 1640 | HBSS | RPMI 1640 | מדיה של תרבית תאי T |
| רכיב 1 | 10% FBS (HI-FBS) | 1% BSA w/v | 10% FBS (HI-FBS) | 10% DMSO |
| רכיב 2 | 1x פניצילין-סטרפטומיצין | 0.1 מ"מ EDTA | 1x פניצילין-סטרפטומיצין | לא ישים |
| רכיב 3 | לא ישים | לא ישים | 1 מ"מ HEPES | לא ישים |
| רכיב 4 | לא ישים | לא ישים | 1 x חומצות אמינו לא חיוניות | לא ישים |
| רכיב 5 | לא ישים | לא ישים | 50 מיקרומטר β-מרקפטואתנול | לא ישים |
טבלה 1: תיאור של ריאגנטים לתרבית תאים
| החלונית ' | נוגדן | פלואורופור | דילול | ערוץ |
| אימות | HLA-DR | אלקסה פלואור488 | 1:500 | כחול 1 |
| תקליטור 14 | PE | 1:500 | כחול 2 | |
| סימן DC | Percp-CY5.5 | 1:500 | כחול 3 | |
| CD1c | PE-CY7 | 1:500 | כחול 4 | |
| תקליטור 40 | נגמ"ש | 1:500 | אדום 1 | |
| סובלנות | CD86 | פיטק | 1:500 | כחול 1 |
| PD-L1 | PE | 1:5000 | כחול 2 | |
| סימן DC | Percp-CY5.5 | 1:500 | כחול 3 | |
| CD1c | PE-CY7 | 1:500 | כחול 4 | |
| BTLA | נגמ"ש | 1:250 | אדום 1 | |
| תקליטור 40 | APC אפלואור 780 | 1:500 | אדום 3 | |
| טרג | תקליטור 4 | אלקסה פלואור488 | 1:500 | כחול 1 |
| תקליטור 8 | PE-CY7 | 1:500 | כחול 4 | |
| CD25 | נגמ"ש | 1:500 | אדום 1 | |
| התפשטות T | תקליטור 4 | אלקסה פלואור488 | 1:500 | כחול 1 |
| תקליטור 69 | PE | 1:500 | כחול 2 | |
| תקליטור 8 | PE-CY7 | 1:500 | כחול 4 | |
| *כל הנוגדנים מדוללים בתמיסת כתמי זרימה | ||||
טבלה 2: תיאור לוחות נוגדנים לזרימה ציטומטרית
Discussion
כאן אנו מתארים שיטה אמינה ורב-תכליתית להערכת הפונקציונליות של חומרים אימונומודולטוריים כדי לגרום ל-tolDCs מ-moDCs ולאמת את הפונקציונליות שלהם ליצירת Tregs מתאי T אוטוגניים ex vivo. ישנם מספר שלבים קריטיים בפרוטוקול זה. ראשית, מונוציטים הם תאים רגישים לשמצה ויש להשיגם מ-PBMCs טריים שלא הוקפאו בעבר לקבלת התוצאות הטובות ביותר. יש לבודד מונוציטים בהקדם האפשרי ולהניח אותם בקוקטייל ההבחנה. בדרך כלל, תפוקת מונוציטים ירודה או שיעורים גבוהים של מוות מונוציטים ב-24 השעות הראשונות נובעים ממחזורי הקפאה/הפשרה או תקופות ממושכות בין בידוד PBMCs למונוציטים. שנית, ציטוקינים המשמשים להתמיינות של moDCs ומדיה של תרבית תאי T חייבים להיות ממקור איכותי. בדרך כלל, בידול לקוי של moDCs נובע מאיכות ירודה או ריכוזים שגויים של ציטוקינים. שלישית, אנו ממליצים להקפיא תאי T בין היום הראשון ליום השביעי ולא לשמור אותם בתרבית כדי לשמר את הפנוטיפ הנאיבי והלא מגורה שלהם. רביעית, אם עשוי להועיל לאפשר ל-moDCs שטופלו לנוח עד 72 שעות כדי לאפשר עלייה בסמנים טולרוגניים כגון PD-L1 ו-IL-10 כפי שניתן לראות באיור 6. לבסוף, כפי שניתן לראות בנתונים שלנו, קיימת שונות רחבה של המטופלים ביכולת הייצור של Treg, ולכן יש להפעיל כל בקרה עם כל דגימת מטופל כדי להסיק מסקנות. אנו ממליצים לבדוק דגימות מרובות של מטופלים.
בתוצאות המייצגות שלנו, בחרנו בעיצוב ניסוי מגביל למדי להדגמת סובלנות עם סרגל גבוה. בחרנו בריכוז נמוך למדי של ראפה (10 ננוגרם/מ"ל), שהודגר רק עם moDCs שכבר התמיינו במשך 24 שעות ולאחר מכן הודגר ביחס תאי moDC:T של 1:5 למשך 72 שעות עם גירוי לא ספציפי CD3/CD28. פרוטוקול זה הוא רב תכליתי מכיוון שניתן לשנות בקלות כל אחד מהתנאים הבאים: ריכוז אימונומודולטור, זמן הדגירה של האימונומודולטור, האם הדגירה מתרחשת במקביל להתמיינות moDC או בנפרד, יחס תרבית משותפת של תאי MoDC: T, זמן דגירה של תרבית משותפת וגירוי משותף של תאי T. כל הגורמים הללו יכולים לשנות את הקלות שבה טיפול ב-MoDC גורם ליצירת Treg. ראוי לציין את השימוש בגירוי CD3/CD28 לא ספציפי כדי לגרום לשגשוג תאי T. ניתן להחליף זאת בקלות באנטיגן מעניין - אנטיגן בקרה כגון מאגרי פפטידים CEFT עם דגימות חולים בריאות או אוטואנטיגנים כמו אינסולין עם דגימות חולי סוכרת מסוג 127,28. זה יספק נתוני סובלנות ספציפיים לאנטיגן, שככל הנראה יהיו שונים מסובלנות לא ספציפית בתיווך Treg.
למרות שהוא רב-תכליתי, לפרוטוקול הזה יש כמה מגבלות. כלומר, הוא מוגבל רק לכמה סמני tolDC, CD86, CD40, PD-L1 ו-BTLA. אלה סמנים מקובלים ומגבלה של מספר הערוצים הזמינים בציטומטר הזרימה במעבדה שלנו. ניתן לבחור גם סמנים אחרים כגון ILT-3 ו-ILT-4 או אחרים25. פרוטוקול זה גם אינו מעריך סוגים אחרים של תת-קבוצות של תאי T מדכאים, כגון תאי T רגולטוריים מסוג 1 (Tr1), שיכולים להדגים פנוטיפים מגינים חזקים in vivo29. עם זאת, אנו טוענים כי פרוטוקול זה מעריך את הפונקציונליות של DCs ליצירת Tregs קלאסיים של FoxP3+ CD25+ , המספיק לסינון ראשוני של תרכובות אימונומודולטוריות חדשות ולהערכת היכולת הטולרוגנית של DC.
היבט מעניין נוסף של הערכת ה-MoDC האנושית הוא השונות של המטופל ותגובת ה-IL-10, PD-L1, BLTA המוגבלת, והכי חשוב, תגובת Treg לאימונומודולטורים המוצגת בתוצאות המייצגות שלנו, במיוחד לראפה. הספרות מראה תוצאות סותרות. תוצאות דומות למאמר זה נצפו הן בעכברים שטופלו בראפה והן ב-DCs אנושיים, והראו ירידה בסמנים של בשלות DC (CD80/CD86/CD40) ומניעת שחרור IL-2 מתאי T כאשר לא מגורים באופן ספציפי, אך ללא מוות של תאי T או יצירת Treg26,30. עם זאת, מחקרים אחרים הן בבני אדם והן בעכברים מראים כי DCs שטופלו ב-ex vivo rapa מראים רמות גבוהות של Tregדור 25. ראפה הוא מטרה מכניסטית של מעכב רפמיצין (mTOR), חלבון קינאז במסלול האיתות PI3K/AKT/mTOR בעל מספר פונקציות תאיות חיוניות כגון צמיחת תאים, שגשוג והישרדות31. ראפה משמשת לעתים קרובות כתרופה נגד דחייה להשתלה ויש לה תועלת קלינית מבוססת במניעת תגובות חיסוניות. עם זאת, במיוחד לשימוש בו כחומר אינדוקציה של tolDC, לראפה יכולה להיות יעילות משתנה ממטופל למטופל.
זה מדגיש את הצורך הן לחקור בקפדנות סוכני אינדוקציה של tolDC נגד אוכלוסיות חולים רחבות יותר והן לזהות תרכובות אימונומודולטוריות חדשות. מספר עצום של מחקרים קליניים על tolDCs אנושיים משתמשים בראפה, IL-10, דקסמתזון או ויטמין D3 כאימונומודולטורים32. זה משאיר מרחב כימי רחב שלא נחקר. אנו מציגים בדיקה זו ככלי חקירה להערכת פוטנציאל האינדוקציה של tolDC של אימונומודולטורים חדשים ולהעריך את הפוטנציאל שלהם לייצר tolDCs מ-DCs אנדוגניים. פרוטוקול זה הוא פשוט, רב-תכליתי, דורש רק ציטומטר זרימה, וניתן להתאים אותו לפונקציונליות של תפוקה גבוהה.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
ברצוננו להודות לליבת האימונולוגיה האנושית של אוניברסיטת פנסילבניה (HIC) על אספקת PBMCs אנושיים טריים מתורמים. ה-HIC נתמך בחלקו על ידי NIH P30 AI045008 ו-P30 CA016520.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1-10 µL Filtered Pipet tips | VWR | 76322-158 | General Cell Culture |
| 1.5 mL Centrifuge Tube | VWR | 77508-358 | General Cell Culture |
| 10 mL Serological Pipets | VWR | 414004-267 | General Cell Culture |
| 100-1000 µL Filtered Pipet tips | VWR | 76322-164 | General Cell Culture |
| 15 mL Conical Tube | VWR | 77508-212 | General Cell Culture |
| 20-200 µL Filtered Pipet tips | VWR | 76322-160 | General Cell Culture |
| 2-Mercaptoethanol | MP Biomedical | 194834 | T Cell Culture |
| 50 mL Conical Tube | VWR | 21008-736 | General Cell Culture |
| 60 x 15 mm Dish, Nunclon Delta | Thermo Fischer | 150326 | General Cell Culture |
| 96 Well Conical (V) Bottom Plate, Non-Treated Surface | Thermo Fischer | 277143 | General Cell Culture |
| 96 well Flat Bottom Plate | Thermo Fischer | 161093 | General Cell Culture |
| APC/Cyanine7 anti-human CD272 (BTLA) Antibody | Biolegend | 344518 | Flow Cytometry |
| Attune NxT (Red/Blue Laser, 7 Channel) | Thermo Fischer | A24863 | Flow Cytometry |
| BSA | Thermo Fischer | 15260-037 | General Cell Culture |
| CD14 Monoclonal Antibody (61D3), PE | Thermo Fischer | 12-0149-42 | Flow Cytometry |
| CD1c Monoclonal Antibody (L161), PE-Cyanine7 | Thermo Fischer | 25-0015-42 | Flow Cytometry |
| CD209 (DC-SIGN) Monoclonal Antibody (eB-h209), PerCP-Cyanine5.5 | Thermo Fischer | 45-2099-42 | Flow Cytometry |
| CD25 Monoclonal Antibody (CD25-4E3), APC | Thermo Fischer | 17-0257-42 | Flow Cytometry |
| CD274 (PD-L1, B7-H1) Monoclonal Antibody (MIH1), PE | Thermo Fischer | 12-5983-42 | Flow Cytometry |
| CD4 Monoclonal Antibody (RPA-T4), Alexa Fluor 488 | Thermo Fischer | 53-0049-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC | Thermo Fischer | 17-0409-42 | Flow Cytometry |
| CD40 Monoclonal Antibody (5C3), APC-eFluor 780 | Thermo Fischer | 47-0409-42 | Flow Cytometry |
| CD69 Monoclonal Antibody (FN50), PE | Thermo Fischer | MA1-10276 | Flow Cytometry |
| CD86 Monoclonal Antibody (BU63), FITC | Thermo Fischer | MHCD8601 | Flow Cytometry |
| CD8a Monoclonal Antibody (RPA-T8), PE-Cyanine7 | Thermo Fischer | 25-0088-42 | Flow Cytometry |
| Conical Bottom (V-well) 96 Well Plate | Thermo Fischer | 2605 | Flow Cytometry |
| Cryogenic Vials, 2 mL | Thermo Fischer | 430488 | T Cell Culture |
| Dimethylsulfoxide (DMSO), Sequencing Grade | Thermo Fischer | 20688 | General Cell Culture |
| DPBS | Thermo Fischer | 14200166 | General Cell Culture |
| EasySep Human Monocyte Isolation Kit | Stem Cell Technologies | 19359 | Cell Separation |
| EasySep Human T Cell Isolation Kit | Stem Cell Technologies | 17951 | Cell Separation |
| EasySep Magnet | Stem Cell Technologies | 18000 | Cell Separation |
| EDTA | Thermo Fischer | AIM9260G | General Cell Culture |
| Falcon Round-Bottom Polystyrene Tubes, 5 mL | Stem Cell Technologies | 38025 | Cell Separation |
| Fc Receptor Binding Inhibitor Polyclonal Antibody | Thermo Fischer | 14-9161-73 | Flow Cytometry |
| Fetal Bovine Serum | Thermo Fischer | A5670701 | General Cell Culture |
| Fixable Viability Dye eFluor 780 | Thermo Fischer | 65-0865-18 | Flow Cytometry |
| Foxp3 / Transcription Factor Staining Buffer Set | Thermo Fischer | 00-5523-00 | Flow Cytometry |
| FOXP3 Monoclonal Antibody (PCH101), PE-Cyanine5.5 | Thermo Fischer | 35-4776-42 | Flow Cytometry |
| HBSS | Thermo Fischer | 14170-112 | General Cell Culture |
| Heat Inactivated Fetal Bovine Serum | Thermo Fischer | A5670801 | General Cell Culture |
| HEPES (1 M) | Thermo Fischer | 15630106 | moDC Cell Culture |
| HLA-DR Monoclonal Antibody (L243), Alexa Fluor 488 | Thermo Fischer | A51009 | Flow Cytometry |
| Human CD3/CD28/CD2 T Cell Activator | StemCell Technologies | 10970 | T Cell Culture |
| Human GM-CSF Recombinant Protein | Thermo Fischer | 300-03 | moDC Cell Culture |
| Human IL-10 ELISA Kit, High Sensitivity | Thermo Fischer | BMS215-2HS | ELISA |
| Human IL-4, Animal-Free Recombinant Protein | Thermo Fischer | AF-200-04 | moDC Cell Culture |
| Human PBMC (Freshly Isolated) | UPenn HIC | N/A | Cells |
| Human TNF alpha ELISA Kit | Thermo Fischer | BMS223-4 | ELISA |
| Light Microscope (DMi1) | Lucia | 391240 | General Cell Culture |
| Lipopolysaccaride (LPS) | Invivogen | tlrl-eblps | moDC Cell Culture |
| LIVE/DEAD Fixable Near-IR Dead Cell Stain Kit | Thermo Fischer | L34975 | Flow Cytometry |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fischer | 11140050 | T Cell Culture |
| Penicillin-Streptomycin (100x) | Thermo Fischer | 15140122 | General Cell Culture |
| Pipette Controller | VWR | 77575-370 | General Cell Culture |
| Rapamycin, 98+% | Thermo Fischer | J62473.MF | moDC Cell Culture |
| RPMI 1640 with Glutamax | Thermo Fischer | 61870-036 | General Cell Culture |
| Separation Buffer | Stem Cell Technologies | 20144 | Cell Separation |
| T Cell Stimulation Cocktail (500x) | Thermo Fischer | 00-4970-93 | T Cell Culture |
| UltraComp eBead Plus Compensation Beads | Thermo Fischer | 01-3333-41 | Flow Cytometry |
| Variable Pipette Set | Fischer Scientific | 05-403-152 | General Cell Culture |
References
- Banchereau, J., et al. Immunobiology of dendritic cells. Annu Rev Immunol. 18 (1), 767-811 (2000).
- Blander, J. M., Medzhitov, R. Toll-dependent selection of microbial antigens for presentation by dendritic cells. Nature. 440 (7085), 808-812 (2006).
- Anderson, A. E., et al. LPS activation is required for migratory activity and antigen presentation by tolerogenic dendritic cells. J Leukoc Bio. 85 (2), 243-250 (2009).
- Iberg, C. A., Hawiger, D. Natural and induced tolerogenic dendritic cells. J Immunol. 204 (4), 733-744 (2020).
- Ness, S., Lin, S., Gordon, J. R. Regulatory dendritic cells, T cell tolerance, and dendritic cell therapy for immunologic disease. Front Immunol. 12, 633436 (2021).
- Ali, S., et al. Sources of type I interferons in infectious immunity: Plasmacytoid dendritic cells not always in the driver's seat. Front Immunol. 10, 778 (2019).
- Fossum, E., et al. Targeting antigens to different receptors on conventional type 1 dendritic cells impacts the immune response. J Immunol. 205 (3), 661-673 (2020).
- Kedl, R. M., et al. Migratory dendritic cells acquire and present lymphatic endothelial cell-archived antigens during lymph node contraction. Nat Comm. 8 (1), 2034 (2017).
- Chow, K. V., Sutherland, R. M., Zhan, Y., Lew, A. M. Heterogeneity, functional specialization and differentiation of monocyte-derived dendritic cells. Immun Cell Biol. 95 (3), 244-251 (2017).
- Johnson, R. K., Overlee, B. L., Sagen, J. A., Howe, C. L. Peripheral blood mononuclear cell phenotype and function are maintained after overnight shipping of whole blood. Sci Rep. 12 (1), 19920 (2022).
- Boks, M. A., et al. IL-10-generated tolerogenic dendritic cells are optimal for functional regulatory T cell induction - A comparative study of human clinical-applicable DC. Clinl Immunol. 142 (3), 332-342 (2012).
- Navarro-Barriuso, J., et al. Vitamin D3-induced tolerogenic dendritic cells modulate the transcriptomic profile of T CD4+ cells towards a functional hyporesponsiveness. Front Immunol. 11, 599623 (2021).
- Moorman, C. D., Sohn, S. J., Phee, H. Emerging therapeutics for immune tolerance: Tolerogenic vaccines T cell therapy, and IL-2 therapy. Front Immunol. 12, 657768 (2021).
- Kenison, J. E., et al. Tolerogenic nanoparticles suppress central nervous system inflammation. Proc Natl Acad Sci USA. 117 (50), 32017-32028 (2020).
- Neshat, S. Y., et al. Improvement of islet engrafts via Treg induction using immunomodulating polymeric tolerogenic microparticles. ACS Biomater Sci Eng. 9 (6), 3522-3534 (2023).
- Deak, P., Knight, R., Esser-Kahn, A. Robust tolerogenic dendritic cells via push/pull pairing of toll-like-receptor agonists and immunomodulators reduces EAE. Biomaterials. 286, 121571 (2022).
- Møller, S. H., Wang, L., Ho, P. -. C. Metabolic programming in dendritic cells tailors immune responses and homeostasis. Cell Mol Immunoly. 19 (3), 370-383 (2022).
- Adamik, J., et al. Distinct metabolic states guide maturation of inflammatory and tolerogenic dendritic cells. Nat Comm. 13 (1), 5184 (2022).
- Hals, I. K., et al. Investigating optimal β-cell-preserving treatment in latent autoimmune diabetes in adults: Results from a 21-month randomized trial. Diabetes Obes Metab. 21 (10), 2219-2227 (2019).
- Gammon, J. M., et al. Engineering the lymph node environment promotes antigen-specific efficacy in type 1 diabetes and islet transplantation. Nat Comm. 14 (1), 681 (2023).
- Sim, W. J., Malinarich, F., Fairhurst, A. -. M., Connolly, J. E. Generation of immature, mature and tolerogenic dendritic cells with differing metabolic phenotypes. J Vis Exp. (112), e54128 (2016).
- Jia, S., Kim, J., Esser-Kahn, A. P., Deak, P. High-throughput screening identification of novel immunomodulatory combinations for the generation of tolerogenic dendritic cells. Front Med. 10, 1298424 (2024).
- Dinh, B., et al. Isolation and cryopreservation of highly viable human peripheral blood mononuclear cells from whole blood: A guide for beginners. J Vis Exp. (212), e66794 (2024).
- Akkaya, B., et al. Regulatory T cells mediate specific suppression by depleting peptide-MHC class II from dendritic cells. Nat Immunol. 20 (2), 218-231 (2019).
- Stallone, G., et al. mTOR inhibitors effects on regulatory T cells and on dendritic cells. J Trans Med. 14 (1), 152 (2016).
- Dahlqvist, G., et al. Modulatory effect of rapamycin and tacrolimus on monocyte-derived dendritic cells phenotype and function. Immunobiology. 226 (1), 152031 (2021).
- Cimen Bozkus, C., Blazquez, A. B., Enokida, T., Bhardwaj, N. A T-cell-based immunogenicity protocol for evaluating human antigen-specific responses. STAR Protoc. 2 (3), 100758 (2021).
- Nakayama, M., Michels, A. W. Determining antigen specificity of human islet infiltrating T cells in type 1 diabetes. Front Immunol. 10, 365 (2019).
- Gregori, S., et al. Differentiation of type 1 T regulatory cells (Tr1) by tolerogenic DC-10 requires the IL-10-dependent ILT4/HLA-G pathway. Blood. 116 (6), 935-944 (2010).
- Taner, T., Hackstein, H., Wang, Z., Morelli, A. E., Thomson, A. W. Rapamycin-treated, alloantigen-pulsed host dendritic cells induce Ag-specific T cell regulation and prolong graft survival. Am J Transpl. 5 (2), 228-236 (2005).
- Baroja-Mazo, A., Revilla-Nuin, B., Ramírez, P., Pons, J. A. Immunosuppressive potency of mechanistic target of rapamycin inhibitors in solid-organ transplantation. World J Transplant. 6 (1), 183-192 (2016).
- Phillips, B. E., Garciafigueroa, Y., Trucco, M., Giannoukakis, N. Clinical tolerogenic dendritic cells: Exploring therapeutic impact on human autoimmune disease. Front Immunol. 8, 1279 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved